251 / Kedokteran Hewan
! " # $$%&%'()$* +,! -. ! "
# $$%'%%&/$0
1
Halaman pengesahan ……….. i
Daftar isi ……….. ii
Ringkasan ……… iii
Bab I. Pendahuluan ………. 1
Bab II. Tinjauan Pustaka ……….. 3
Bab III. Metode Penelitian ……… 6
Rencana Penelitian Tahun I ………. 8
Rencana Penelitian Tahun II ……… 10
Bab 4. Biaya dan Jadwal Penelitian ………... 13
4.1. Anggaran Penelitian ………. 13
4.2. Jadwal Penelitian ……….. 14
Daftar Pustaka ………. 14
Lampiran 1 Rincian Anggaran ……… 16
Lampiran 2 Ketersediaan sarana dan prasarana penelitian ………... 14
Lampiran 3 Susunan organisasi tim peneliti dan pembagian tugas ……. 14
Lampiran 4 Format Biodata Ketua dan Anggota peneliti ……….. 15
(CPV) adalah penyakit virus yang sangat infeksius dan fatal pada anjing. Infeksi CPV ditandai dengan demam, muntah, diare berdarah, leukopenia dan limfopenia. Morbiditas dapat mencapai 100% dan kematian mencapai 90% pada anak anjing yang tidak divaksinasi. Vaksinasi terbukti efektif dan metode paling ideal untuk mengendalikan infeksi CPV. Namun adanya maternal antibodi dan perbedaan strain virus dalam vaksin dengan virus yang menginfeksi anjing di lapangan menyebabkan kegagalan vaksinasi. Hingga saat ini belum ada terapi yang efektif untuk mengobati infeksi CPV pada anjing.
Beberapa penelitian membuktikan antibodi yang diisolasi dari kuning telur ayam (IgY) efektif untuk pencegahan dan pengobatan penyakit infeksius pada manusia dan hewan. IgY memiliki keunggulan tidak mengaktivasi sistem komplemen pada mamalia, sehingga aman diaplikasikan secara intravena. Pengobatan IgY secara intravena diduga dapat memutus rantai infeksi CPV di darah. Netralisasi IgY mencegah virus merusak organ limfoid dan saluran pencernaan sehingga kematian anjing dapat dicegah. Adanya berbagai keunggulan dan kemudahan produksi IgY dari kuning telur ayam dapat menjadi modalitas baru untuk terapi infeksi CPV pada anjing.
Pada anjing sehat jumlah dan morfologi leukosit relatif stabil. Perubahan jumlah dan morfologi leukosit memberikan informasi klinis tentang adanya suatu penyakit. Perubahan nilai leukosit berguna untuk menentukan respon dan keberhasilan suatu pengobatan dan menduga kesembuhan hewan. . .4 ! 5. 6 ! untuk isolasi, pemurnian dan karakterisasi IgY anti CPV, membuktikan efektivitas terapi IgY mencegah kematian anjing berdasarkan indikator perbaikan profil leukosit anjing dan isolasi virus parvo lokal Bali untuk uji tantang sehingga didapatkan isolat baru yang patogen. Isolat ini nantinya dapat digunakan sebagai bibit vaksin yang homolog dengan virus yang menginfeksi anjing di lapangan. Imunoterapi IgY secara intravena dilakukan pada kelompok anjing setelah ditantang dengan CPV patogenik secara oral. . .4 !
! #produksi IgY di ayam dengan cara imunisasi ayam menggunakan CPV , pemurnian IgY dengan , karakterisasi IgY dengan SDS;PAGE dan spesifisitas IgY diuji dengan HI dan serum netralisasi
(SN) Penentuan (PD50) IgY di . . .4 !
! : isolasi, propagasi virus parvo lokal Bali di , karakterisasi virus dengan uji HI dan serum netralisasi. Penentuan dosis virus untuk uji tantang dengan uji HA dan dan uji tantang virus secara invivo di anjing.
! !,. . ! !,! : differensial leukosit dihitung dengan pewarnaan Giemsa, titer antibodi IgY dalam serum dengan uji HI dan Elisa dan titer virus dalam feses anjing dengan uji HA. ! 4 7. .4 ! ! !78! dapat membuktikan perbaikan profil leukosit dapat dijadikan indikator efektivitas terapi IgY sehingga dokter hewan dapat menduga kesembuhan anjing, diperoleh virus parvo isolat lokal sebagai kandidat vaksin. Hasil penelitian ini sangat bermakna di dunia kedokteran hewan karena akan mengurangi biaya dan waktu perawatan anjing yang sangat mahal. Isolat lokal yang dihasilkan sangat tepat digunakan sebagai bibit vaksin yang sesuai dengan virus yang menginfeksi anjing di lapangan. ! . ! 4 7. .4 ! yaitu: Data efektivitas terapi IgY dan isolate lokal Bali dapat dipublikasi di jurnal nasional dan internasional dan dihasilkan satu buku ajar yang dapat digunakan oleh mahasiswa dan dokter hewan.
Infeksi (CPV) adalah penyakit infeksius yang sangat fatal pada anjing. Penyakit ini ditemukan di seluruh dunia karena virus parvo dapat bertahan dalam kondisi lingkungan yang ekstrem dan resisten terhadap berbagai desinfektan (Goddard dan Leisewitz 2010). Secara alami CPV dapat menginfeksi anjing domestik, anjing hutan, kucing, beruang dan serigala (Nandi
2010). Gejala klinis infeksi CPV pada anjing adalah demam, muntah, diare berdarah, dehidrasi, leukopenia dan limfopenia (Decaro 2006). Penyakit CPV sangat merugikan pemilik dan anjing. Mortalitas pada anak anjing umur 6 minggu sampai 6 bulan mencapai 100% (Godsall . 2010). Vaksinasi pada anak anjing telah dilakukan untuk mencegah infeksi CPV. Namun adanya maternal antibodi di dalam tubuh anjing mengganggu respon pembentukan antibodi sehingga terjadi kegagalan vaksinasi (Prittie 2004). Ketika titer antibodi maternal turun, anak anjing sangat peka terhadap infeksi CPV. Kegagalan vaksinasi menyebabkan anjing mengalami infeksi subklinis. Anjing yang terinfeksi CPV secara subklinis mengekskresikan virus infektif melalui fesesnya, sedangkan anjing tersebut tidak menunjukkan gejala klinis sakit. Hal inilah yang menyebabkan penyakit parvovirus pada anjing bersifat endemis di Indonesia (Sendow & Syafriati 2004).
Penularan CPV pada anjing terjadi melalui mulut dan hidung (Prittie .2004). Lingkungan yang terkontaminasi dapat menularkan virus parvo pada anjing baik secara langsung dan tidak langsung. Virus parvo yang tertelan mula; mula terkonsentrasi di jaringan limfoid orofaring, limfonodus mesenterika dan timus. Virus melakukan replikasi, selanjutnya dikeluarkan ke pembuluh darah sehingga terjadi viremia. Virus disebarkan ke jaringan limfoid, timus dan limfonodus di seluruh tubuh. Infeksi CPV pada anjing bersifat sistemik karena distribusi virus melalui viremia dan virus dapat diisolasi hampir di semua organ tubuh seperti paru;paru, limpa, hati, ginjal dan jantung (Duffy . 2010).
basal epitel usus halus. Selanjutnya sel kripte yang matang menuju ujung;ujung vili usus dan melakukan fungsinya untuk absorbsi nutrisi. Infeksi CPV akan merusak sel;sel kripte usus di bagian basal sehingga tidak berfungsi dan anjing mengalami diare. Kerusakan epitel usus menjadi penyebab ditariknya netrofil yang ada di peredaran darah menuju jaringan yang mengalami peradangan. Infeksi CPV pada organ timus terjadi meluas di daerah germinal dan kortek. Pada daerah kortek timus akan terjadi limfositolisis yang cepat. Ketidakseimbangan antara produksi netrofil dan limfosit dengan kebutuhan tubuh untuk melawan infeksi virus menyebabkan anjing mengalami neutropenia dan limfopenia.
Tingginya laju mitosis sel;sel limfoid dan epitel saluran pencernaan berperan memperparah gejala klinis akibat infeksi CPV. Laju mitosis sel limfoid yang tinggi berhubungan langsung dengan kecepatan replikasi virus dan keparahan kerusakan organ (Ling 2012). Durasi neutropenia dan limfopenia yang lama akan meningkatkan resiko kematian anjing akibat sepsis (Duffy . 2010). Pengobatan yang cepat dan tepat untuk memperpendek waktu neutropenia sangat dibutuhkan untuk mencegah kematian anjing. Pada anjing sehat jumlah dan morfologi leukosit relatif stabil. Perubahan respon leukosit memberikan informasi klinis adanya suatu penyakit. Perubahan nilai leukosit tidak menjadi ciri khas suatu penyakit, tetapi dapat digunakan untuk diagnosa pembanding berbagai penyakit, menentukan respon dan keberhasilan suatu pengobatan dan menduga prognosis suatu penyakit (Goddard dan Leisewitz 2010).
Tujuan khusus penelitian ini adalah untuk membuktikan bahwa perbaikan profil leukosit, titer antibodi dalam serum dan titer antigen di feses dapat digunakan sebagai indikator efektivitas terapi IgY dalam mencegah kematian anjing akibat infeksi CPV. Dapat diisolasi virus parvo isolate local yang nantinya dapat digunakan sebagai kandidat vaksin yang homolog dengan isolate lapang.
9 :
Hingga saat ini belum ada terapi yang efektif dapat menyembuhkan anjing dari infeksi . Terapi yang biasa dilakukan hanya untuk menekan gejala klinis tetapi tidak dapat mencegah kematian anjing. Biaya terapi yang dikeluarkan pemilik anjing sangat mahal sehingga pemilik hewan cenderung membiarkan anjingnya mati daripada mengobati. Hal ini dirasa sangat merugikan ketika harga anjing yang dimiliki mencapai jutaan rupiah.
Provinsi Bali memiliki plasma nutfah yang sangat berharga yaitu anjing kintamani. Dari informasi dokter hewan di daerah Sukawana, populasi anjing kintamani menurun drastis akibat penyakit rabies dan pemusnahan massal. Dinformasikan pula bahwa anjing kintamani banyak yang terinfeksi canine parvovirus sehingga sangat perlu dilakukan pencegahan dan terapi anjing ,baik melaui vaksinasi dan terapi. Anjing kintamani sebagai plasma nutfah Bali yang sudah diakui sebagai anjing trah asli Asia dan hanya ada di Bali sangat perlu dijaga kesehatan dan kelestariannya.
. !,!! 7. .4 ! ini adalah terapi infeksi CPV dengan IgY secara intravena memberi peluang sembuh pada anjing. Efektivitas terapi dapat diketahui melalui indikator perbaikan profil leukosit darah anjing, titer antibodi dan titer virus di feses. Isolat virus lokal yang berhasil diisolasi dapat digunakan sebagai bibit virus dalam vaksin sehingga homolog dengan virus parvo yang menginfeksi anjing di lapangan.
berkhasiat akibat kuman yang resisten, ketiadaan obat yang efektif untuk sebagian besar penyakit virus, atau akibat patogenesis agen yang berkembang dengan sangat cepat dan menginfeksi organ vital (Dubie . 2014).
Imunisasi pasif buatan dengan pemberian antibodi untuk pencegahan dan pengobatan penyakit infeksius telah dilakukan sejak jaman dahulu (Carlander
2000). Pengobatan dengan antibodi pasif disebut juga serum terapi karena antibodi yang digunakan berasal dari serum manusia atau hewan yang sudah dikebalkan (Baxter 2007). Produksi antibodi pasif memerlukan biaya yang sangat mahal karena memerlukan donor yang banyak dan proses isolasi yang sulit (Goddard 2006). Kendala produksi dan biaya menyebabkan pemanfaatan antibodi sangat terbatas. Pengobatan dengan antibodi pasif mulai ditinggalkan sejak ditemukannya antibiotik. Namun penggunaan antibiotik yang tidak terkendali menyebabkan sebagian besar kuman menjadi resisten, sehingga pengobatan menjadi tidak efektif (Carlander 2000).
Antibodi pasif kembali menjadi pilihan untuk pengobatan infeksi virus, gangguan inflamasi dan tumor (Michael . 2010).Pengobatan dengan antibodi menjadi pilihan karena memiliki spesifisitas yang tinggi pada agen target, dapat digunakan dalam dosis tinggi dan tidak bersifat toksik (Casadevall 1999). Masalah utama dalam imunoterapi adalah dan hilangnya daya; guna pada pemberian berulang dalam waktu yang lama. Walau demikian, potensi antibodi sebagai bahan biologik yang efektifitasnya tidak tergantikan oleh bahan kimia apapun, perlu dimanfaatkan dengan menemukan bahan atau cara yang dapat menekan dampak jangka panjang. Ketersediaan antibodi pasif sangat dibutuhkan untuk pencegahan dan pengobatan berbagai penyakit.
Penggunaan IgY untuk imunoterapi juga bukan hal baru. IgY ayam terbukti efektif untuk pencegahan dan pengobatan berbagai penyakit (Kovacs
2005). Antibodi ini efektif mencegah infeksi saluran pencernaan yang disebabkan oleh caries gigi yang disebabkan oleh
,inaktivasi urease dari (Al;Adwani . 2013) dan infeksi pada anjing. (Nguyen 2006). Secara in vitro, IgY anti terbukti efektif mencegah terjadinya pada sel lestari (Suartini 2015).
IgY memiliki keunggulan dibandingkan IgG yaitu tidak mengaktivasi sistem komplemen pada mamalia (Carlander 2002) sehingga memungkinkan aplikasinya secara intravena. Pada mencit IgY terbukti tidak menimbulkan reaksi anafilaktik dan serum sikness ketika diaplikasikan secara intravena mencegah terjadinya (Menaatchisundaram 2010).
Tropisme CPV adalah pada jaringan yang sel;selnya sedang aktif membelah seperti epitel kripta usus halus, limfoid orofaring, limfoglandula mesenterika dan sumsum tulang belakang (Meunier 1985). Replikasi virus yang terjadi di seluruh jaringan limfoid dan saluran pencernaan menyebabkan lonjakan jumlah virus yang diekskresikan melalui feses. Anjing akan mengalami imunosupresif dan diare berdarah akibat kerusakan se;sel limfoid dan epithel saluran pencernaan.
Secara klinis infeksi CPV ditandai dengan leukopenia dan limfopenia (Prittie . 2004). Infeksi CPV pada jaringan limfoid dan sumsum tulang menyebabkan cadangan leukosit dan limfosit berkurang. Kerusakan epitel usus halus menyebabkan migrasi netrofil di sumsum tulang dan darah menuju tempat terjadinya infeksi. Ketidakseimbangan jumlah netrofil yang dihasilkan di sumsum tulang dan migrasi netrofil menuju jaringan yang terinfeksi menyebabkan neutropenia.
paling parah. Netropenia terjadi akibat ditariknya netrofil menuju daerah infeksi di saluran pencernaan. Pada infeksi parvovirus lekopenia terjadi pada hari 5;8 pasca infeksi.
Anjing yang terinfeksi CPV memiliki total sel darah putih di bawah 2.0 x 109/l (normalnya: 6.0;15.0 x 109/l). Total sel darah putih antara 0.5;0.2 x 109/l terutama terjadi pada puncak infeksi. Leukopenia yang terjadi pada infeksi CPV sebanding dengan keparahan gejala klinis yang ditimbulkannya. Mekanisme terjadinya neutropenia pada infeksi CPV sebagai berikut: (1) invasi virus pada sel; sel hematopoietik dan pusat proliferasi netrofil di sumsum tulang memicu terjadinya neutropenia 5;8 hari pasca infeksi. (2) turunnya jumlah cadangan netrofil di sumsum tulang akibat jaringan yang mengalami radang membutuhkan banyak netrofil. Hal ini sering dijumpai pada kasus septikemia dan infeksi bakteri saluran pencernaan. (3) perpindahan netrofil dari sirkulasi menuju ujung;ujung pembuluh darah sebagai respon adanya endotoksemia dan migrasi netrofil ke jaringan. (4) granulopoiesis yang tidak efektif akibat meningkatnya fagositosis netrofil oleh makrofag di sumsum tulang. Pengobatan pendukung pada infeksi CPV akan meningkatkan jumlah leukosit pada hari 1;6 pasca infeksi ditandai peningkatan jumlah leukosit yang drastis (Goddard dan Leisewitz 2006).
Jumlah dan morfologi leukosit pada individu sehat relatif stabil. Perubahannya yang drastis pada individu sakit dapat digunakan untuk diagnosa secara klinis. Walaupun respon leukosit pada individu sakit bukan penciri utama suatu penyakit namun perubahan keseimbangannya dapat memberikan informasi klinis, sebagai diagnosa banding dan untuk mengetahui respon indivudu terhadap suatu pengobatan (Goddard dan Leisewitz 2006).
!5.4 % ! !7! 7. .4 ! 7! ! !
No Tahapan
Penelitian Penjelasan Indikator capaian
1 Preparasi
Produksi IgY spesifik dilakukan dengan cara imunisasi ayam dengan
dosis 213 HA secara intramuskuler dan koleksi IgY dari serum dan telur yang dihasilkan
Mendapatkan IgY dalam jumlah besar dan titer tinggi. presipitasi dengan ammonium sulfat, dialisis, kromatografi filtrasi gel. Tujuan untuk memastikan bahwa IgY yang terbentuk spesifik terhadan PAGE, penentuan kandungan protein dengan metode Nano Drop, Uji spesifisitas menggunakan Teknik HI dan AGPT
Uji kemampuan netralisasi IgY secara in vivo pada anak anjing dengan uji haemaglutinasi inhibisi dan uji ELISA
Diketahui kemampuan netralisasi IgY secara in vitro ,juga diketahui titer optimal IgY untuk aplikasi pencegahan dan
imunoterapi intravena 7 Produksi
massal IgY pada telur
Dilakukan dengan cara imunisasi ayam dengan parvovirus intramuskuler dan koleksi IgY dari telur yang dihasilkan
Produksi IgY secara massal sehingga diperoleh
No Tahapan Penelitian Penjelasan Indikator capaian
1 Isolasi virus parvo isolat lokal, propagasi dan identifikasi virus
Dilakukan dengan menanam virus pada biakan lestari FK, identifikasi dengan uji HA/HI dan serum netralisasi
Diperoleh virus parvo dengan patogenitas dan titer yang tinggi untuk uji tantang.
2 Uji tantang pada 16 ekor anjing
Dilakukan dengan cekok virus dan terapi dengan IgY anti CPV
Diketahui efektivitas terapi IgY
3 Deteksi titer IgY di serum dan titer CPV di feses
Dilakukan dengan uji HA/HI dan ELISA
.,7! ! -!8 . .4 !
Penelitian akan dilakukan di Laboratorium Bioteknologi Balai Besar Veteriner Denpasar, Bali. Hewan dipelihara di kandang hewan coba Balai Besar Veteriner Denpasar, Bali. Uji Serum Netralisasi, HA/HI dan isolasi virus di laboratorium Virologi Balai Besar Penelitian Veteriner, Bogor. Pembuatan preparat ulas darah dilakukan di Balai Besar Veteriner Denpasar, Bali dan penghitungan profil leukosit dan limfosit dilakukan di Laboratorium Fisiologi FKH;IPB Bogor.
! ! ! 4! 7. .4 ! ! !
Bahan yang digunakan dalam penelitian ini adalah: sepuluh ekor ayam petelur galur Isabrown umur 20 minggu, antigen parvovirus diperoleh dari
Bbalitvet;Bogor, dan ! . Virus berasal dari
isolat lapang yang diinaktivasi dengan formaldehid. Isolat parvovirus diperbanyak dalam kultur sel FK, diberi medium " #
# (DMEM) yang mengandung 2% $ (FBS). Bahan kimia untuk isolasi, karakterisasi kuning telur, % (Promega) untuk pemurnian antibodi. Bahan untuk elektroforesis SDS;PAGE. Bahan kimia untuk AGPT. Bahan untuk uji HA/HI dan bahan untuk uji serum netralisasi.
. !4! !
Kandang, perlengkapan kandang ayam, Sentrifus dingin, mikrotiter, spuite disposable needle, eppendorf, fintip, Elisa reader, plate Elisa, spectrophotometer.
& incubator CO2, alat elektroforesis SDS;PAGE, tabung
dialysis, kertas saring, seperangkat glasswares, tabung reaksi serta raknya, tabung erlemeyer dan corong gelas.
. ;! ! 7. .4 ! ! <'$%(=
. + . . .4 !
Produksi serum hiperimun dilakukan pada ayam. Ayam diimunisasi dengan virus parvo dosis 213 HA unit/ml serta ! secara intra muskular pada otot pektoral. Pada minggu ke;2 dan ke;4 dilakukan imunisasi ulang menggunakan virus dan dosis yang sama dan ! Serum diambil setiap minggu kemudian digabung. Penentuan titer IgY dalam serum dan aktivitas hambatan hemaglutinasi diukur dengan metode HI standar. Jika titer antibodi dalam serum sudah cukup tinggi, selanjutnya dilakukan koleksi telur. Panen telur dimulai 4 minggu setelah vaksinasi dan dikoleksi selama 6 bulan. Deteksi titer IgY murni dalam kuning telur dilakukan dengan metode ' (
) & (AGPT). Pemurnian IgY kuning telur ayam dilakukan
menggunakan (( ) (Promega). Pola pita protein
IgY diidentifikasi dengan elektroforesis SDS;PAGE. Konsentrasi IgY ditentukan dengan spektrofotometer Nanodrop ND;1000 dengan absorbansi panjang gelombang 280 nm. Penentuan titer virus parvo (TCID50) dilakukan dengan
membiakkan virus parvo pengenceran 10;1 sampai 10;8 HA unit di dalam biakan sel FK yang memiliki konsentrasi 2 x 105/ml. Biakan tersebut diinkubasi pada suhu 37ºC dengan tekanan CO2 5% selanjutnya diamati 5;7 hari. Hasil tersebut
digunakan sebagai dasar penentuan dosis uji tantang. Kemampuan IgY anti CPV dalam menetralisasi virus parvo (PD50) diuji menggunakan teknik Serum
Netralisasi prosedur beta (Swayne dan Suarez 1998).
! !,. . ! !,!
Parameter yang diamati adalah konsentrasi IgY anti CPV dalam serum dan kuning telur ayam, titer virus parvo yang dapat menginfeksi sel
sebanyak 50% (TCID50) dan pengenceran tertinggi IgY anti CPV yang mampu
menetralisasi virus sebanyak 50% (PD50).
! ;! ! . ;+5!! ! !4 ! ! !
. ;! ! 7. .4 ! ! <'$%&=
Penelitian tahun kedua diutamakan untuk isolasi virus parvo isolat lokal (Bali) agar diperoleh virus yang sangat pathogen sehingga memudahkan dalam membedakan gejala klinis antara anjing sakit dan yang sembuh, mengetahui efektivitas terapi IgY berdasarkan perbaikan profil leukosit dan titer antibodi di serum dan titer virus di feses
. + . 7. .4 ! .>! . ;+5!!
Hewan yang digunakan adalah 16 ekor anak anjing umur antara 3;5 bulan Anjing dipisahkan menjadi empat kelompok, masing;masing terdiri dari empat ekor anjing. Anjing ditempatkan pada kandang terpisah, di ruangan yang terisolasi. Kelompok 1 (kelompok sehat) adalah kontrol negatif yaitu anjing yang tidak diberi perlakuan, kelompok 2 (kelompok sakit) adalah kontrol positif yaitu anjing yang dicekok virus parvo dosis 100 TCID50 sebanyak 1ml, kelompok 3
(kelompok sembuh) adalah anjing yang dicekok virus parvo 100 TCID50 dan di
terapi IgY anti;CPV dosis 10000 PD50 dan kelompok 4 (kelompok plasebo)
adalah anjing yang disuntik IgY anti CPV dosis 10.000 PD50.
! ! ! 4!
Pada penelitian ini digunakan bahan dan alat untuk pembuatan preparat ulas darah yaitu sampel darah yang akan diperiksa, alkohol 70%, objek glass, metil alkohol absolut, pewarna Giemsa 10%, aquades dan
1 8 6 ! !
+4! +4! 4+8!4 !4
!,7.4
6 . +4+
Sampel serum dari anjing yang diambil fesesnya diuji menggunakan uji Hemaglutinasi Inhibisi (HI) terhadap virus parvo, untuk mengetahui ada atau tidaknya antibodi pada serum yang diperoleh. Referens virus dan antibodi diperoleh dari Balitvet;Bogor. Uji serologi yang digunakan dalam penelitian ini berdasarkan metode Sendow dan Syafriati (2004).
+4! 1
Feses, kerokan usus digunakan untuk keperluan isolasi virus. Isolasi dilakukan dengan membuat 20% suspense organ dalam PBS steril, selanjutnya dicair;bekukan sebanyak tiga kali, lalu disentrifus dengan kecepatan 1000 x g selama 10 menit. Supernatan difilter menggunakan milipore filter ukuran 450 nm, sebelum diinokulasikan pada biakan jaringan (FK) yang telah membentuk 50% jaringan selapis, dalam media pemelihara yang terdiri dari DMEM berantibiotik dan 1% $ Biakan jaringan tersebut diinkubasikan pada suhu 37°C selama enam hari dan diamati setiap hari ada tidaknya (CPE). Apabila CPE tampak maka suspense tersebut mengandung isolate virus. Apabila CPE tidak tampak, pasase buta dilakukan sebanyak tiga kali sebelum inoculum tersebut dinyatakan negative mengandung isolate virus. Inokulum yang akan dipasase lebih lanjut, dibeku;cairkan sebanyak tiga kali, kemudian disentrifus dengan kecepatan 1000 x g. Supernatan yang diperoleh digunakan sebagai inoculum untuk pasase selanjutnya.
+7! ! +4! . ? 7! ! 5 !8! 6! ! < =
. @ 8! +4! . ?
Isolat yang telah diperbanyak dalam biakan jaringan FK dicair;bekukan sebanyak tiga kali, lalu disentrifus dengan kecepatan 1000 x g selama 15 menit. Supernatan digunakan dalam uji HA untuk mengetahui ada tidaknya daya aglutinasi virus terhadap sel darah merah babi. Aglutinasi menunjukkan bahwa isolate virus tersebut mempunyai daya aglutinasi dan dilanjutkan dengan identifikasi isolate dengan menggunakan uji HI terhadap referens antisera CPV.
. + . ! ! ;! ! . .4 !
Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok. Enambelas ekor anjing dibagi menjadi empat kelompok percobaan. Masing; masing kelompok terdiri dari empat ekor anjing (Gambar 1). Pengobatan dilakukan saat anjing sudah menunjukkan gejala klinis infeksi CPV. Feses dikoleksi menggunakan * steril, dilakukan setiap hari sampai akhir observasi. Sebelum dan selama perlakuan dilakukan pengambilan sampel darah dan feses untuk deteksi titer antibodi dan antigen di feses anjing. Gejala klinis tidak mau makan, demam, muntah, diare dan diare berdarah diamati mulai hari pertama perlakuan. Temperatur tubuh anjing diukur melalui suhu rektal. Masing; masing kelompok anjing diambil darahnya untuk dibuat preparat ulas darah. Darah diambil mulai hari pertama sampai hari ketujuh penelitian. Darah digunakan untuk preparat ulas darah, dengan tujuan untuk mengetahui persentase leukosit. Pewarnaan preparat ulas darah dilakukan dengan larutan pewarna Giemsa 10% dan nilai leukosit dinyatakan dalam persen (Sodikoff CH 1995).
!4 ! !
' + (ANOVA), dilanjutkan dengan Uji Duncan dengan selang kepercayaan 95% (α=0.05). Analisis keseluruhan menggunakan perangkat lunak SAS 9.1 for Microsoft Windows (Mattjik dan Sumertajaya 2006).
! !,. . ! !,!
Parameter yang diamati adalah gejala klinis, titer antibodi (IgY) di serum, dan titer ekskresi virus di feses anjing. Prosentase monosit, limfosit, neutrofil segmen, neutrofil batang, neutrofil total dan eosinofil dari masing;masing kelompok perlakuan yang menunjukkan klinis sehat, sakit, sembuh dan plasebo.
! ! !4 7. .4 ! !
1
-. . .4 ! ! ! 8. ,4! < 7=
! !
Pelaksana (Honor dan Upah) 15.200.000,; 15.200.000,; 30.400.000,; Peralatan dan Bahan Habis
Pakai 29.100.000,; 20.630.000,; 49.730.000,;
Analisa Laboratorium ; 1.440.000,; 1.440.000,;
Perjalanan (Transport,
pemantauan seminar) 10.000.000,; 6.000.000,; 16.000.000,; Pengeluaran lain;lain
(pembuatan laporan dan publikasi)
7.500.000,; 7.000.000,; 14.500.000,;
+ !4 ! ! (% 0$$ $$$"2 3$ '&$ $$$"2 %%' $&$ $$$"2
16 ekor anjing dibagi menjadi 4 group masing 4 ekor anjing
Group 1 Kontrol Negatif
Group 3 Pengobatan (cekok CPV 100 TCID50 + Terapi
IgY 10000 PD50
Group 4 Plasebo Injeksi IgY 10000 PD50
;Gejala Klinis ; Serum ; feses ; ulas darah
Luaran :
1. Protektivitas IgY ditentukan berdasarkan kesembuhan anjing dan titer antibody di serum 2. Efektivitas IgY dalam menekan ekskresi virus di feses (titer virus di feses)
! >!4 . .4 !
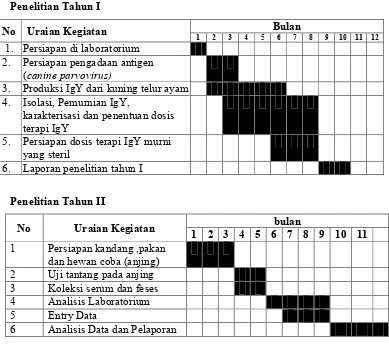
Tabel 1. Jadwal Kegiatan Penelitian . .4 ! !
+ ! ! . ! ! 4!
% ' / * 3 ( & 0 ) %$ %% %'
1. Persiapan di laboratorium 2. Persiapan pengadaan antigen
( ,
3. Produksi IgY dari kuning telur ayam 4. Isolasi, Pemurnian IgY,
karakterisasi dan penentuan dosis terapi IgY
5. Persiapan dosis terapi IgY murni yang steril
6. Laporan penelitian tahun I
. .4 ! !
+ ! ! . ! ! 5 4!
% ' / * 3 ( & 0 ) %$ %%
1 Persiapan kandang ,pakan dan hewan coba (anjing) 2 Uji tantang pada anjing 3 Koleksi serum dan feses 4 Analisis Laboratorium 5 Entry Data
6 Analisis Data dan Pelaporan
Al;Adwani SR, Crespo R, Shah DH (2013). Production and evaluation of chicken egg;yolk;derived antibodies against Campylobacter jejuni colonization; ssociatedproteins. Foodborne Pathogens Dis., 10: 624;631
Baxter, D. (2007).Active and passive immunity, vaccine types, excipents and licensing. Occup. Med. (Lond). 57:552;556.
Carlander V. 2002. ' - . ' / . Fakulty of Medicine ACTA Universitatis Upsaliensis, UPPSALA. Swedia. Pp. 53.
Decaro N, Martella V, Desario C, Bellaciccio AL, Camero M, Manna L, d’Alojo D, Buonavaglia C. 2006. First detection of type 2c in pups with haemorrhagic enteritis in Spain. 0 + # 53:468;472.
Duffy A, Dow S, Ogilvie G, Rao S, Hackett T . 2010. Hematologic improvement in dogs with parvovirus infection treated with recombinant canine granulocyte;colony stimulating factor. 0 ) & . 33: 352– 356
Goddard A, Leisewitz AL, Christopher MM, Duncan NM, Becker PL. 2006. Prognostic usefulness of blood leukocyte changes in
enteritis . 0 + - # . 22:309;316.
Goddard A, Leisewitz AL. 2010. . + 1 '
' ) . 40: 1041;1053.
Godsall SA, Cleqq SR, Stavisky JH, Radford AD, Pinchbeck G. 2010.
Epidemiology of and in dogs presented
with severe diarrhoea to PDSA Pet Aid hospital. + 2 . 7: (6) 196;201. Grindstaff JL, Brodie III, ED, Ellen DK (2003). Immune function across
generations: Integrating mechanism and evolutionary process in maternal antibody transmission. Proc. Biol. Sci.,270:2309–2319.
Ling, M. Jacqueline M. Norris, Mark Kelman, Michael P. Ward. (2012). Risk factor for death from canine parvoviral; related disease in Australia. Veterinary Microbiology. 158: 280;290.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Ed ke;3. Bogor. IPB Press.
Meenatchisundaram S, Michael A. 2010. Comparison of four different purification methods for isolation of anti antivenom antibodies from immunized chicken egg yolk. - 0 $ . 8(1): 50;55.
Michael A, Meenatchisudaram S, Parameswari G, Subbraj T, Selvaku R, amalingam S (2010). Chicken egg yolk antibodies (IgY) as an alternative to mammalian antibodies. Indian J. Sci. Technol., 3: 468;474.
Nguyen VS, Umeda K, Yokoyama H, Tohya Y, Kodama Y. 2006. Passive protection of dogs against clinical disease due to ;2 by specific antibody from chicken egg yolk. !
70: 62.
Prittie J. 2004. enteritis: A review of diagnosis. Management, and prevention. 0 +
14(3):167;176.
Sendow I, Syafriati T. 2004. Seroepidemiologi infeksi pada
anjing. 0 - & +
!,7 ! %
perlengkapannya 1 set 1.000.000,; 1.000.000,;
4. Adjuvant complete dan
incomplete 4 vial 200.000,; 800.000,;
5. Spuite disposible syring 3 box 150.000,; 450.000,; 6. Kapas, alcohol, cotton bud 1 set 300.000,; 300.000,;
7. Kertas saring 100 lembar 3000,; 300.000,;
8. Botol sampel 150 buah 3000,; 450.000,; 9. Tabung ependorf 4 box 300.000,; 1.200.000,; 10 Kit EGGstract Purification 1 paket 8.000.000,; 8.000.000,;
11 ELISA Kit 1 Paket 3.000.000,; 3.000.000,; 17. Millipore Sartorius 1 Box 1000.000,; 1.000.000,;
18. Fintips 200 ul 2 Box 350.000,; 700.000,;
19. Fintips 1000 ul 2 Box 450.000,; 900.000,;
% / ! ! 8 . 6!4! !
1. Dokumentasi hasil Dokumentasi 1.500.000,;
2. Pengolahan data dan
penulisan laporan Pembuatan laporan 1.000.000,; 3. Penggandaan laporan Penggandaan laporan 500.000,; 4. Publikasi ilmiah Publikasi ilmiah 1.000.000,;
5 Seminar Nasional Biaya Seminar 3.000.000,;
' ' ! ! 8 ! ! !5 !8!
+ ! ! 1+4 ,. ! ! ! ! < 7= ! ! < 7 =
1. Hewan coba anjing 16 ekor 200.000,; 3.200.000,;
2. Pakan anjing 5 zak 350.000,; 1.750.000,;
3. Kandang anjing dan
perlengkapannya 4 set 1.500.000,; 6.000.000,;
4. Spuite disposable syring 2 box 150.000,; 300.000,; 5. Kapas, alcohol, cotton bud 1 set 380.000,; 380.000,; 6. NaCl fisiologis(infus) 2 dus 200.000,; 400.000,; 7. Botol sampel 150 buah 3000,; 450.000,; 8. Tabung ependorf 3 box 300,000,; 900,000,;
9 Methanol absolut 1 Botol 500.000,; 500.000,;
10. Biakan sel lestari 2 flask 500.000,; 1.000.000,; 11. Serum referent positif
(BBalitvet) 1 Vial 1000.000,; 1.000.000,;
12. Viral adjusting diluent 2 Botol 750.000,; 1.500.000,;
13. Sarung tangan 4 Boks 50.000,; 200.000,; 2. Differensial leukosit 32 sampel 10.000.; 320.000,;
' 3 ! ! 8 . .4 ! ! 4! 24!
+ ! ! .7. 4 ! ! ! < 7 =
1. Dokumentasi hasil Dokumentasi 1.500.000,;
2. Pengolahan data dan
penulisan laporan Pembuatan laporan 1.000.000,; 3. Penggandaan laporan Penggandaan laporan 500.000,; 4. Publikasi ilmiah
internasional Publikasi ilmiah 4.000.000,;
5 + !4 &$$$ $$$"2
+ !4 ! ! ! <' % A' 'A' /A' *A' 3= 3$ '&$ $$$"2
,4! .4 ! ! ! 7. .4 ! 8 ! A #
!,7 ! '
. . . !! ! ! ! ! 7 ! ! ! ! 7. .4 ! Peralatan utama :
!,! 7. !4! ! +8! . !! .,!,7 ! !
Refrigerator ;200C Lab. Biomedik FKH;Unud
Menyimpan darah dan serum
Bagus Sentrifus Lab. Biomedik
FKH;Unud
Memisahkan serum Bagus Sentrifus ;4°C Lab. Bioteknologi
BBvet;Bali
Pemurnian IgY dari kuning telur
bagus Inkubator Lab. Virologi
FKH;Unud
Memanaskan serum Bagus Cermin reflektor Lab. Bioteknologi
BBvet;Bali
Membaca hasil uji HA/HI
Bagus Elisa reader Lab. Bioteknologi
BBvet;Bali
Membaca hasil uji Elisa
Bagus Spektrofotometer Lab. Bioteknologi
BBvet;Bali
Laminar flow Lab. Virologi Balitvet;Bogor
Incubator CO2 Lab. Virologi Balitvet;Bogor
!,7 ! /
Biokimia 25 ;Optimasi semua komponen
;uji tantang virus di anjing
25 ;Sampling darah anjing ;pemisahan serum
25 ;sentrifugasi serum, kuning telur
!,7 ! * Format Biodata ketua dan anggota tim peneliti BIODATA KETUA PENELITI 1.1 Nama Lengkap (dengan
gelar)
: Dr.drh. I Gusti Ayu Agung Suartini, MSi. (P)
1.2 Jabatan fungsional : Lektor
1.3 NIP/NIDN : 196912171999032001/0017126904
1.4 Tempat dan tanggal lahir : Denpasar, 17 Desember 1969 1.5 Alamat Rumah : Cemara Giri Graha Blok VIII/53,
Dalung, Kuta Utara, Badung 1.6 Nomor Telp/Fax : ;
1.7 Nomor HP : 081 282 797 188
1.8 Alamat Kantor : Laboratorium Biokimia, FKH Universitas Udayana, Kampus Unud Denpasar, Bali
1.9 Alamat e;mail : [email protected] 1.10 Lulusan yang telah
dihasilkan
: S;1 = 15 orang ; S;2 = ; orang ; S;3 = ; orang
1.11 Mata Kuliah yang diampu : Biokimia Veteriner 1 (S1) Biokimia Veteriner 2 (S1) Kimia Biofisika (S1) Teknik Laboratorium (S2) >! ! . 8!
2.1 Program S;1 S;2 S;3
2.2 Nama PT Unud IPB IPB
2.3 Bidang Ilmu Kedokteran Hewan
: <5 8! 8 7 " . " ,! 7 . ! =
3 ! 4 ,
No .
Tahun Judul Penelitian Pendanaan
Sumber* Jml (Rp) 2013;
2014
Farmakokinetik dan efektivitas penggunaan antibody spesifik dari kuning telur ayam (igy) untuk terapi
infeksi pada anjing
Produksi, Isolasi dan Karakterisasi IgY anti CPV dan Uji Aktivitas Netralisasi secara Invitro
Ketua/Mandiri 5.000.000,;
2013; 2014
Protektivitas Imunoglobulin Y anti untuk Pengobatan Infeksi Virus Parvo pada Anjing
Ketua/mandiri 5.000.000,;
& / )"# %5 2 $
) ) ! 2')-"
3 !
4 ,
No. Tahun Judul Pengabdian Kepada Masyarakat
No Tahun Judul Artikel Ilmiah Volume/
Nomor Nama Jurnal 1 2014 Intravenous Administration of
Chicken Immunoglobulin Has a Curative Effect in Experimental Infection of Canine Parvovirus
Vol.13 (5): therapy Canine parvovirus infection in dogs (Review artikel)
; Wartazoa
(in Press) 3 2015 Farmakokinetik Imunoflobulin Y
anti Canine parvovirus di dalam tubuh anjing
Vol. 16 No. 1, 1015
No. Tahun Judul Artikel Ilmiah Tema Seminar Penyeleng gara Tempat
; ; ; ; ; ;
3 !
No. Tahun Judul Buku Jumlah Halaman Penerbit
; ; ; ; ;
Semua data yang saya isikan dan tercantum dalam biodata ini adalah benar dan dapat dipertanggungjawabkan secara hukum. Apabila di kemudian hari ternyata dijumpai ketidak;sesuaian dengan kenyataan, saya sanggup menerima risikonya.
Demikian biodata ini saya buat dengan sebenarnya untuk memenuhi salah satu persyaratan dalam pengajuan Hibah Penelitian Skim: 5! 4!
+ !,
Denpasar, 20 April 2015
( ! " =
. !
1. Nama Lengkap (dengan gelar) Dr.drh. Ni Nym. Werdi Susari, M.Si P 2. Pangkat/Golongan Penata/IIIc
3. Jabatan Lektor
4. NIP/NIK/No.Identitas lainnya 19731112 200112 2 001
5. NIDN 0012117308
6. Tempat dan Tanggal Lahir Mataram, 12 Nopember 1973 7. Alamat Rumah Jl. Ir.Ida Bagus Oka No 15, Dps 8. Nomor Telepon/Faks /HP 0361;226345/081337505673 9. Alamat Kantor Jl. PB Sudirman Denpasar 10. Nomor Telepon/Faks 0361;223791
11. Alamat e;mail [email protected] 12. Lulusan yang telah dihasilkan
13. Mata Kuliah yg diampu Anatomi Veteriner I Anatomi Veteriner II Anatomi Topografi
Embriologi Veteriner, Genetika Veteriner >! ! . 8!
Program S;1 S;2 S;3
Nama Perguruan Tinggi
Universitas Udayana Universitas Udayana Universitas Udayana
Bidang Ilmu Kedokteran Hewan Bioteknologi pertanian Ilmu Kedokteran
: . !4!,! . .4 ! !4!, 3 ! . !8 1 2009 Genetic diversity of gembrong goat
based on DNA Microsatellite markers (Global Veterinaria 9 (1): 113;116, 2012).
. !4!,! . !5 ! 8.7! ! ! ! !8! !4!, 3 ! . !8
No Tahun Judul Pengabdian Kepada Masyarakat
Pendanaan Sumber *) Jml (Rp.) 1. 2014 Pelayanan Kesehatan dan vasektomi pada
Monyet Ekor panjang di Uluwatu, Desa Pecatu, Kecamatan Kuta Selatan, Kabupaten Badung
2. 2014 Pemeriksaan Kesehatan Hewan dan daging Qurban dalam rangka Hari Idul Adha 1435 H di Kota Denpasar
3.
based on DNA Microsatellite markers.
Vol. 9 (1) : 113;
No Nama Pertemuan ilmiah/
Seminar Judul Artikel Ilmiah
Waktu dan Tempat 1. Seminar nasional aplikasi
teknologi Molekuler dalam peningkatan produktivitas dan kesehatan hewan
Keragaman Genetik sapi putih taro Berdasarkan marka D;Loop DNA mitokondria Genetik
. !4!,! . 4 ! 8 !4!, 3 ! . !8
No. Judul Buku Tahun Jumlah halaman Penerbit
1. 2. 3
. ! !! ! . ! ! !4!, %$ ! . !8 < !
7.,. ! " ! + ! ! ! 4! !=
No. Jenis penghargaan Institusi pemberi penghargaan Tahun 1.
2. 3
Denpasar, 20 April 2015
Yang bertanda tangan di bawah ini kami :
1. Nama Lengkap : Dr.drh.I Gst Ayu Agung Suartini, M.Si NIP/NIDN : 1969121719990320010 / 0017126904
Fakultas/P.S. : Kedokteran Hewan
Status dalam Penelitian : Ketua
Dengan ini menyatakan bahwa proposal penelitian saya dengan judul :
, + . !7 ! !4 .4 8 . 8! 8! +@ 4 . 8+
6 ! . @.8 , yang diusulkan dalam skim
Penelitian Hibah Bersaing tahun anggaran 2016 bersifat original dan belum pernah dibiayai oleh lembaga/sumber dana lain. Bilamana dikemudian hari ditemukan ketidaksesuaian dengan pernyataan ini, maka saya bersedia dituntut dan diproses sesuai dengan ketentuan yang berlaku dan mengembalikan seluruh biaya penelitian yang sudah diterima ke kas Negara.
Demikian surat pernyataan ini dibuat dengan sesungguhnya dan dengan sebenar;benarnya.
Denpasar, 28 April 2015
Mengetahui Yang menyatakan
Kepala lembaga Penelitian