MAKALAH GENETIKA MOLEKULER DNA MUTASI DAN PERBAIKANNYA
OLEH: ELSA ROHMAH
1410422044
JURUSAN BIOLOGI
FAKULTAS ILMU PENGETAHUAN ALAM DAN MATEMATIKA UNIVERSITAS ANDALAS
BAB I PENDAHULUAN
1.1 Latar Belakang
Kelangsungan hidup jangka panjang dari spesies menuntut kestabilan genetik. Menjaga ke stabilan genetik tidak hanya membutuhkan mekanisme yang sangat akurat untuk mereplikasi DNA tetapi juga membutuhkan mekanisme untuk memperbaiki DNA. Sebagian besar perubahan spontan DNA bersifat sementara karena akan segera dikoreksi dengan proses kolektif yang disebut perbaikan DNA. Hanya jarang sekali proses perbaikan DNA sel gagal dan memungkinkan perubahan permanen dalam DNA. Perubahan seperti ini disebut mutasi (Albert, 2003).
Mutasi adalah perubahan pada materi genetik suatu makhluk yang terjadi secara tiba-tiba, acak, dan merupakan dasar bagi sumber variasi organisme hidup yang bersifat terwariskan (heritable). Mutasi juga dapat diartikan sebagai perubahan struktural atau komposisi genom suatu jasad yang dapat terjadi karena faktor luar (mutagen) atau karena kesalahan replikasi. Peristiwa terjadinya mutasi disebut mutagenesis. Makhluk hidup yang mengalami mutasi disebut mutan dan faktor penyebab mutasi disebut mutagen (mutagenic agent). Perubahan urutan nukleotida yang menyebabkan protein yang dihasilkan tidak dapat berfungsi baik dalam sel dan sel tidak mampu mentolerir inaktifnya protein tersebut, maka akan menyebabkan kematian (lethal mutation) (Warianto, 2011).
Selama perjalanan seluruh hidupnya, DNA menghadapi berbagai macam
1.2 Rumusan Masalah
Adapun rumusan masalah dalam makalah ini yaitu : 1. Apa saja macam-macam DNA mutasi?
2. Bagaimana mekanisme perbaikan terhadap DNA mutasi? 1.3 Tujuan
Adapun tujuan dari makalah ini yaitu :
1. Mengetahui macam-macam DNA mutasi.
BAB II ISI
A. DNA Mutasi 1. Pointmutation
Mutasi titik (point mutation) merupakan perubahan kimiawi pada satu atau beberapa pasangan basa dalam satu gen tunggal. Mutasi gen adalah mutasi yang terjadi dalam lingkup gen. Peristiwa yang terjadi pada mutasi gen adalah perubahan urutan-urutan DNA. Mutasi gen pada dasarnya merupakan mutasi titik (Warianto, 2011).
Mutasi titik terdiri dari perubahan tunggal dalam urutan nukleotida. Asam amino yang sama memiliki kodon yang sama. Ketika perubahan dasar menghasilkan asam amino baru, protein baru. Protein baru dapat mengubah morfologi atau fisiologi organisme dan hasilnya kebaruan fenotip atau dapat mematikan (Tamarin, 2017).
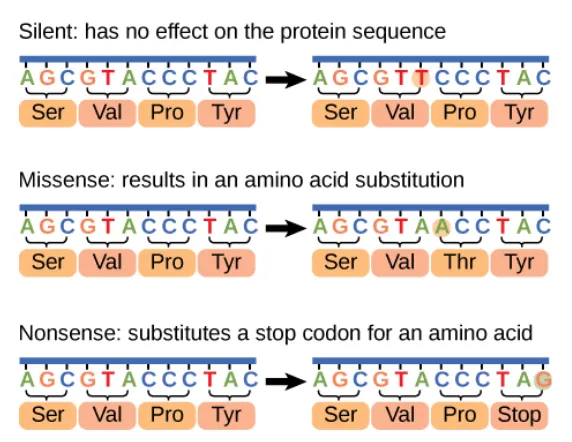
Macam-mavcam muatsi gen (point mutation): Mutasi salah arti (missens mutation)
Perubahan suatu kode genetik (umumnya pada posisi 1 dan 2 pada kodon) sehingga menyebabkan asam amino terkait (pada polipeptida) berubah. Perubahan pada asam amino dapat menghasilkan fenotip mutan apabila asam amino yang berubah merupakan asam amino esensial bagi protein tersebut. Jenis mutasi ini dapat disebabkan oleh peristiwa transisi dan tranversi (Warianto, 2011).
Mutasi diam (silent mutation)
Mutasi tanpa arti (nonsense mutation)
Perubahan kodon asam amino tertentu menjadi kodon stop. Hampir semua mutasi tanpa arti mengarah pada inaktifnya suatu protein sehingga menghasilkan fenotip mutan. Mutasi ini dapat terjadi baik oleh tranversi, transisi, delesi, maupun insersi (Warianto, 2011).
Gambar 1. Mutasi silent, mutasi missense dan muatsi nonsense. Sumber: https://www.google.co.id
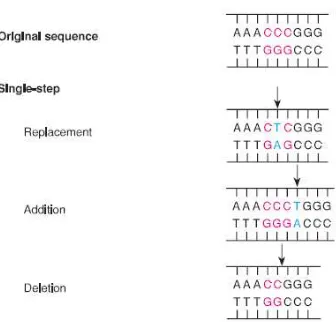
Frameshift mutation
Gambar 2. Mutasi titik Replacement, Addition dan Deletion. Sumber: (Tamarin, 2017).
Sebuah mutasi frameshift menyebabkan dua masalah:
- Pertama, semua kodon dari frameshift yang berbeda memungkinkan akan menghasilkan protein tidak berguna.
- Kedua informasi stop-sinyal akan salah membaca. Salah satu kodon baru mungkin kodon nonsense, yang menyebabkan terjemahan untuk berhenti sebelum waktunya (Tamarin, 2017).
-2. SpontaneousMutagenesis
Watson dan Crick awalnya mengatakan bahwa mutasi bisa terjadi secara spontan selama replikasi DNA jika kesalahan pasangan terjadi. Jika dasar dari DNA menjalani pergeseran proton menjadi salah satu bentuk tautomerik selama proses replikasi, perubahan pasangan dari basa akan terjadi. Biasanya, adenin dan sitosin berada di bentuk amino (NH2). Mereka pergeseran tautomerik yang ke bentuk
Gambar 3. Pergeseran tautomerik adenin dan sitosin yaitu bentuk imino; guanin dan timin yaitu bentuk enol.
Sumber: (Tamarin, 2017).
Tabel 1. Pasangan basa baru pada tautomerik berikut pergeseran dari basa DNA.
Basa Normal Tautomerik
A T C
T A G
G C T
C G A
Selama replikasi DNA, pergeseran tautomerik baik dasar masuk (substrat
Gambar 4. Template Transisi dan substrate transisi tautomerik adenin Sumber: (Tamarin, 2017).
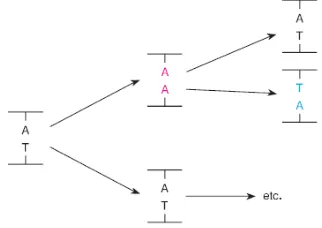
Dalam contoh pada gambar 4, penggantian salah satu pasangan basa memelihara hubungan purin-pirimidin yang sama: AT digantikan oleh GC dan GC oleh AT. Dalam kedua contoh, kombinasi purin-pirimidin diganti dengan kombinasi purin-pirimidin. (Atau, lebih khusus, purin yang menggantikan purin lain: guanin menggantikan adenin dalam contoh pertama dan adenin menggantikan guanin di kedua.) mutasi ini disebut sebagai transisi mutasi: purin (atau pirimidin) menggantikan lain purin (atau pirimidin) melalui keadaan transisi melibatkan pergeseran tautomerik. Ketika purin yang menggantikan pirimidin atau sebaliknya, itu disebut sebagai transversi sebuah mutasi. Transversi mungkin timbul dengan kombinasi dua peristiwa, sebuah tautomerik dan rotasi dasar. Sebagai contoh, sebuah pasangan basa AT dapat dikonversi ke TA pasangan basa
(transversi a) oleh AA pasangan menengah (Tamarin, 2017).
Gambar 5. Transversi pasangan basa AT dapat dikonversi ke TA pasangan basa (transversi a) oleh AA pasangan menengah.
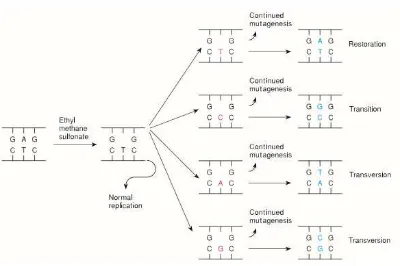
3. Chemical Mutagenesis
Muller menunjukkan bahwa sinar X dapat menyebabkan mutasi. Kimia tertentu dan suhu juga dapat menyebabkan mutasi. Menentukan modus tindakan berbagai mutagen kimia telah memberikan wawasan ke dalam proses mutasi serta proses karsinogenesis. Selain itu, mengetahui bagaimana mutagen kimia tindakan telah memungkinkan para ahli genetika untuk mengetahui sejumlah besar mutasi tertentu Sumber: (Tamarin, 2017).
Transisi
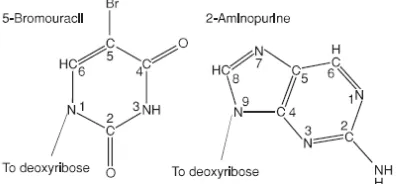
Transisi secara rutin diproduksi oleh analog dasar. Dua dari analog dasar
yang paling banyak digunakan adalah pirimidin analog 5-bromouracil (5BU) dan purin analog 2-aminopurine. Itu mekanisme mutagenik dari dua serupa Sumber: (Tamarin, 2017).
Gambar 6. Struktur basa analog 5-bromouracil dan 2-aminopurine Sumber: (Tamarin, 2017).
5-bromouracil dimasukkan ke dalam DNA di tempat timin; ia bertindak seperti timin dalam replikasi DNA dan, karena tidak mengubah ikatan hidrogen, harus mendorong tidak ada mutasi. Namun, tampaknya bahwa bromin atom menyebabkan 5-bromouracil untuk tautomerize lebih mudah dari timin tidak. Jadi, 5-bromouracil pergi dari bentuk keto ke bentuk enol lebih mudah daripada timin. Transisi sering terjadi ketika enol yang bentuk pasangan 5-bromouracil dengan guanin (Tamarin, 2017).
2-aminopurine adalah mutagenik berdasarkan fakta bahwa itu bisa, seperti adenin, bentuk dua ikatan hidrogen dengan timin. Ketika dalam keadaan yang
itu menggantikan adenin, dan pada kali lain guanin. Mempromosikan mutasi transisi (Tamarin, 2017).
Gambar 7. (a) Adenin berpasangan dengan timin dalam keadaan normal (b) adenin berpasangan dengan sitosin dalam keadaan mutasi Sumber: (Tamarin, 2017).
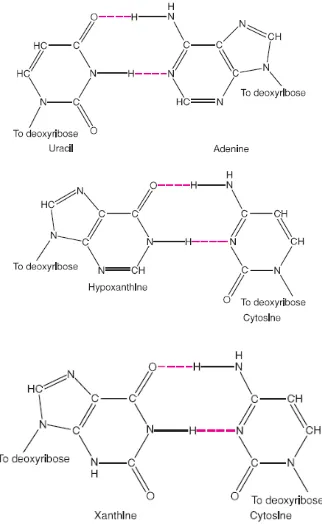
Nitrous acid (HNO2) juga mudah menghasilkan transisi dengan mengganti gugus amino pada nukleotida dengan kelompok keto (-NH2 ke OEO). Hasilnya adalah sitosin yang diubah menjadi urasil, adenin diubah menjadi hipoksantin, dan guanin diubah menjadi xanthine. Hasil transisi mutasi dari dua perubahan. pasang urasil dengan adenin bukannya guanin, sehingga mengarah ke UA pasangan basa di tempat pasangan basa CG; hipoksantin (H) berpasangan dengan sitosin, bukan
Gambar. 8 Nitrous acid mengubah sitosin menjadi ursil, adenin menjadi
hypoxantin dan guanin menjadi xantin Sumber: (Tamarin, 2017).
Seperti asam nitrat, panas juga dapat deaminate sitosin ke membentuk urasil dan dengan demikian membawa transisi (CG untuk TA). Rupanya, panas juga dapat membawa transversi oleh mekanisme yang tidak diketahui.
Transversi
Gambar 9. Treatment DNA dengan agen alkilasi, yang menghilangkan purin-adenin
Sumber: (Tamarin, 2017).
Tempat di mana hal ini terjadi disebut sebagai AP
(Apurinic-apyrimidinic). Jika tempat AP tidak diperbaiki, salah satu dari empat basa DNA dapat dimasukkan ke dalam untai baru yang berlawanan kesenjangan. Jika timin
ditempatkan di untai baru terbentuk, maka pasangan basa dipulihkan; penyisipan sitosin maka akan terjadi transisi mutasi; penyisipan baik adenin atau guanin hasil akan terjadi mutasi transversi. Tentu saja, gap masih ada, dan itu terus menghasilkan mutasi baru setiap generasi sampai diperbaiki. Selama DNA replikasi di E. coli, polimerase cenderung menempatkan adenin lebih sering daripada menempatkan basa lain (Tamarin, 2017).
B. DNA Repair
Radiasi, mutagen kimia, panas, kesalahan enzimatik, dan peluruhan spontan terus merusak DNA. Misalnya, diperkirakan bahwa beberapa ribu basa DNA hilang setiap hari di setiap sel mamalia karena busuk spontan. Beberapa jenis kerusakan DNA mengganggu replikasi DNA dan transkripsi. Hal ini menjadi tantangan evolusi yang panjang untuk meminimalkan mutasi. Banyak enzim, bertindak sendiri atau dengan enzim lain, dalam sistem perbaikan DNA (Tamarin, 2017).
Perbaikan DNA umumnya ditempatkan dalam empat kategori besar: damage
reversal, excision repair, untai ganda perbaikan istirahat dan perbaikan postreplicative. Enzim yang langkah-langkah perbaikan proses telah dilestarikan
homolog dalam ragi, buah fl ies, dan manusia. Namun, sistem eukariotik hampir selalu lebih kompleks (Tamarin, 2017).
1. Damage reversal
Photoreactivation
Garis utama perbaikan dimer-dimer pirimidin dikenal sebagai fotoreaktivasi, memerlukan enzim fotoreaktivasi, yang telah ditemukan pada bakteri dan eukariota (termasuk manusia). Enzim-enzim ini mengubah dimer timin (disingkat TT) menjadi monomer timin (TT) dan oleh sebab itu mengeliminasi luka dari benang induk. Enzim-enzim itu disebut demikian karena meskipun enzim-enzim itu dapat berasosiasi dengan dimer ditempat gelap, enzim-enzim itu harus menyerap foton
cahaya yang terlihat sebelum dapat menimbulkan monomerasi (Goodenough, 1998).
Gambar 10. Dimer timin (timin yang berdekatan) tepapar UV Sumber: https://www.ncbi.nlm.nih.gov/books/NBK26879
2. Excision Repair
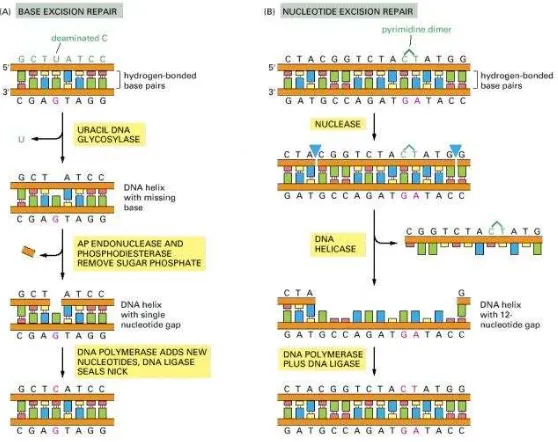
Base Excision Repair
- Terjadi pemisahan total dalam eksisi sel prokariot dan eukariot untuk membuang sejumlah nukleotida yang disebabkan distorsi duble helik - Enzim glikosilase mengawali repair dengan mengenal adanya
- Perubahan basa purin/pirimidin dibuang oleh endonuklease, dan celah diperbesar oleh fosfodiesterase, kemudian diisi dengan DNA polimerase. Strand ditutup /diletakan dengan DNA ligase (Kirkpatrick, 1997 dalam Yani, 2010).
Gambar 11. Mekanisme Base Excision Repair dan Nukleotida Excision Repair
Sumber: https://www.ncbi.nlm.nih.gov/books/NBK26879
Nukleotida Excision Repair
- Mekanisme repair berupa pemotongan bagian strand DNA yang mengandung “bulky lesion” pada nukleotida atau pirimidin dimer. - Proses dimulai oleh enzim endonuklease, dengan membuat incisi pada
backbone strand di 2 sisi lesi.
- Oligonukleotida yang rusak ditahan dalam dupleks dengan ikatan
hidrogen pada basa dari strand lainnya. Selama replikasi DNA dipisahkan oleh DNA helikase.
- Setelah dipotong dan dibuang, maka celah diisi oleh DNA polimerase - Dan strand yang direpair diletakan dengan DNA ligase (Kirkpatrick,
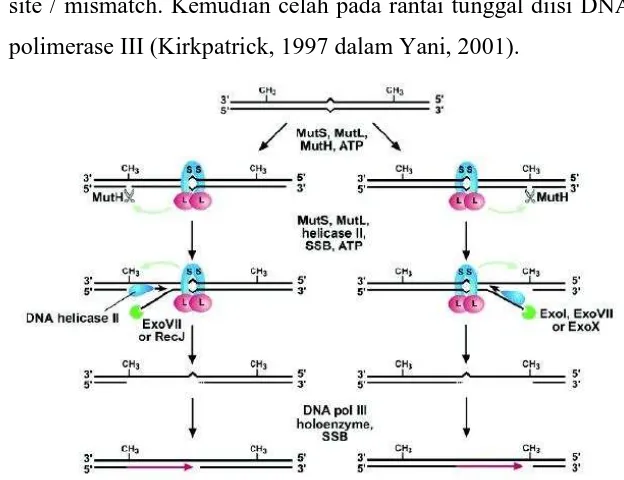
Mismatch Repair
- Pasangan basa mismatch menyebabkan distorsi dalam bentuk double heliks yang timbul karena adanya kesalahan replikasi. Pada E. coli basa mismatch direpair oleh enzim:
Mut S : mengenali lesi dan mengawali penyusunan kompleks repair
Mut L : memotong pada sekuen GATC pada rantai unmethylated
Mut H : memindahkan bagian DNA yang mengandung GATC site / mismatch. Kemudian celah pada rantai tunggal diisi DNA polimerase III (Kirkpatrick, 1997 dalam Yani, 2001).
Gambar 12. Mekanisme Mismacth Repair. Sumber: https://www.google.co.id
3. Double-Strand Break Repair
kromatit atau kromosom homolog. Metode yang disebut homology directed recombination (Tamarin, 2017).
Pada akhirnya nonhomolog bergabung, protein yang disebut Ku, heterodimer dari Ku70 dan Ku80, mengikat rusak ujung kromosom. Kemudian merekrut protein kinase (PKCS); interaksi mereka dan interaksi dengan protein lain distabilkan oleh protein perancah disebut XRCC4 (untuk X-ray lintas komplementasi kelompok 4). Kompleks mengarahkan pengutan dari ujung yang rusak oleh DNA ligase IV. Tidak ada informasi urutan tertentu digunakan, dan jika lebih dari dua ujung yang rusak hadir, lampiran yang tidak benar dapat berlangsung (misalnya, translokasi). Metode kedua
homology directed recombination melibatkan kedua sepotong DNA homolog dengan bagian yang rusak (Tamarin, 2017).
Gambar 13. Mekanisme homology directed recombination dan non -homology directed recombination.
Sumber: https://www.google.co.id
4. Postreplicative Repair
lainnya. Sekelompok enzim, satu-spesifikasi dengan lokus recA memiliki kepentingan pusat, perbaikan kesenjangan. Sejak perbaikan berlangsung di celah yang dibuat oleh kegagalan replikasi DNA, proses ini disebut perbaikan postreplicative. The recA locus awalnya ditemukan dan dinamai dalam proses rekombinasi. Bahkan, perbaikan postreplicative kadang-kadang disebut perbaikan rekombinasi, dan banyak enzim dengan rekombinasi (Tamarin, 2017).
Protein RecA
Protein RecA memiliki dua sifat. Pertama, lapisan single-strand
DNA menyebabkan single-strand DNA untuk menyerang double-strand DNA. Single-strand DNA mencoba untuk membentuk pasangan basa komplementer dengan untai antiparalel dari double-strand DNA, sementara menggusur untai lain dari mekanisme helix. RecA terus bergerak single-strand DNA sepanjang DNA untai ganda sampai daerah homologi ditemukan. Sifat kedua dari protein RecA adalah jika dirangsang oleh adanya single-strand DNA, hal itu menyebabkan penekanan autocatalysis lain, disebut Lexa, dan dengan demikian memulai beberapa urutan reaksi (Tamarin, 2017).
Protein RecA bertanggung jawab untuk mengisi kesenjangan postreplicative di DNA baru direplikasi dengan untai dari rusak duplex anak. Proses Gap-mengisi kemudian menyelesaikan kedua untai. Garpu replikasi dengan celah di untai keturunan di wilayah dimer timin. Protein RecA bertanggung jawab untuk untai tunggal yang rusak menyerang aktivitas duplex anak .Endonuclease kemudian membebaskan double helix yang berisi dimer timin. DNA polimerase I dan ligase DNA kembali baik heliks anak untuk utuh. Timin dimer masih ada, tapi sekarang duplex utuh, dan siklus sel lain adalah tersedia untuk photoreactivation atau
Gambar 14. Mekanisme The RecA Protein. Sumber: (Tamarin, 2017).
SOS Response
Perbaikan Postreplicative merupakan bagian dari reaksi sel disebut SOS
Protein RecA adalah protease dan salah satu sasarannya adalah Lexa. Sekali sintesis Protein RecA mulai, taraf Lexa menurun dengan cepat dan gen-gen yang khas SOS dibolehkan mengekspresi bebas. Gen-gen ini memerintahkan sederetan enzim yang menimbulkan perbaikan DNA brcendrungan salah yang tidak tercetak itu, menjadi ciri tanggapan SOS. Dalam waktu 4 jam seteh isyarat kerusakan dibuang, taraf protein RecA menurun, taraf Lexa meningkat dan fundsi SOS kembali pada keadaan tertahan (Goodenough, 1998).
BAB III PENUTUP
1.1Kesimpulan
Adapun kesimpulan dari makalah ini yaitu: a. DNA mutasi
DNA mutasi terdiri dari : - point mutation
o Mutasi salah arti (missens mutation) o Mutasi diam (silent mutation)
o Mutasi tanpa arti (nonsense mutation) o Frameshift mutation
- spontaneous mutagenesis
o Pergeseran tautomerik adenin dan sitosin yaitu bentuk imino
o Pergeseran tautomerik guanin dan timin yaitu bentuk enol. - chemical mutagenesis
o Transisi oleh agen pirimidin analog 5-bromouracil (5BU), purin analog 2-aminopurine, Nitrous acid (HNO2) mengganti gugus amino pada nukleotida dengan kelompok keto (-NH2 ke OEO)
o Transversi oleh agen Etil metana sulfonat (CH3SO3CH2CH3) dan etil etana sulfonat (CH3CH2SO3CH2CH3)
b. DNA repair
Perbaikan DNA umumnya ditempatkan dalam empat kategori besar:
1. Damage reversal - Photoreactivation
2. Excision Repair
- Mismacth Repair
3. Double-Strand Break Repair
DAFTAR PUSTAKA
Albert. 2003. Molecular Biology of the Cell. file:///H|/albert/paginas/dna_repair.htm (2 of 17) [29/05/2003 04:54:40 a.m.]
Kirkpatrick DT, Petes TD. 1997. Repair of DNA loops involves DNA-,ismatch and nucleotide-excision repair proteins. Nature (387); 929-30.
Goodenough, U. 1998. Gnetika Edisi Ketiga Jilid 1. Erlangga. Jakarta.
Tamarin. 2017. Biosci cell micro. Diakses dari http://www.mhhe.com/biosci/cellmicro/tamarin7/information/tam7ch12.pdf. Diakses pada tanggal 6 februari 2017.
Tatiah. 2017. DNA Mutation. Diakses dari
http://faculty.ksu.edu.sa/tatiah/Genetic%20lectures/6-%20DNA%20Mutation.pdf. Diakses pada tanggal 6 februari 2017.
Yani C. R, Elza I.A. 2001. Studi Molekuler pada Instabilitas Genetik: Mekanisme Kerusakan DNA dan Proses Perbaikannya. Jurnal Kedokteran Gigi. Universitas Indonesia: Jakarta.
Warianto, C. 2011. Mutasi. Diakses dari http://skp.unair.ac.id/repository/Guru-Indonesia/Mutasi_ChaidarWarianto_17.pdf. Diakses pada tanggal 6 februari 2017.
https://www.ncbi.nlm.nih.gov/books/NBK26879/ Diakses pada tanggal 6 februari 2017.