LAPORAN PRAKTIKUM ANALISIS INSTRUMEN
ELUSIDASI STRUKTUR SENYAWA ORGANIK BERDASARKAN METODE SPEKTROSKOPI (MASSA, IR, HNMR, DAN CNMR)
OLEH:
NAMA : SHARNILA
STAMBUK : 15020140107
KELOMPOK : III (TIGA)
KELAS : C4
ASISTEN : NASRUL HAQ, S.FARM
FAKULTAS FARMASI
UNIVERSITAS MUSLIM INDONESIA MAKASSAR
Dalam dunia farmasi, terdapat berbagai macam metode dan alat-alat yang digunakan guna keperluan aspek kefarmasian. Alat-alat yang digunakan antara lain contohnya yaitu alat-alat instrumen. Alat-alat instrumen berfungsi untuk menghitung kadar suatu senyawa dalam sediaan, baik itu kadar dalam jumlah besar maupun dalam jumlah kecil.
Analisis instumen dikenal sebagai analisis fisika-kimia, sebab instrumen yang digunakan dalam penentun sampel didasarkan pada sifat-sifat fisika-kimia dari molekul atau atom dalam sampel yang dianalisis. Analisis kualitatif bertujuan untuk mengetahui keberadaan suatu unsur atau senyawa kimia, baik organik maupun inorganik, sedangkan analisis kuantitatif bertujuan untuk mengetahui jumlah suatu unsur atau senyawa dalam suatu cuplikan.
Elusidasi struktur molekul senyawa organik merupakan tahapan terpenting dari penggunaan analisis spektroskopi modern. Dalam elusidasi struktur molekul untuk menentukan struktur senyawa. Adapun metode yang digunakan yaitu spektroskopi dimana metode ini merupakan metode yang paling tepat dalam menentukan rumus molekul atau elusidasi struktur senyawa-senyawa organik.
Adapun penentuan rumus molekul terdapat 2 cara yaitu menggunakan cara klasik melalui analisis elementer dan melalui metode modern yang melihat dari nilai M+nya kemudian dibandingkan dengan tabel J.H Beynon. Metode klasik akan memberikan data tentang jenis unsure dan perbandingan mol atom-atom unsure penyusun molekul. Namun dalam penggunaan analisis elementer terdapat kelemahan yang di miliki yaitu analisis elementer hanya dapat mengidentifikasi sebatas unsur karbon, hidrogen dan oksigen saja. Sedangkan penentuan berat molekul suatu senyawa yang di peroleh dari M+ spektrum dari spektroskopi massa, dengan mudah menyusun rumus molekul suatu senyawa, sehingga lebih tearah untuk menetapkan struktur molekul suatu senyawa berdasarkan metode
Melihat pentingnya metode-metode diatas dalam menentukan rumus struktur molekul suatu sampel maka praktikum ini dilakukan agar mahasiswa mampu menganalisis ion untuk memberikan informasi tentang berat molekul senyawa dan struktur kimianya.
1.2 Maksud Praktikum
Adapun maksud percobaan ini yaitu untuk memahami elusidasi struktur senyawa organic berdasarkan metode spektroskopi (massa, IR, HNMR dan CNMR
1.3 Tujuan Percobaan
Adapun tujuan percobaan yaitu untuk menentukan dan melakukan elusidasi struktur senyawa organik berdasarkan metode spektroskopik (massa, IR, HNMR dan CNMR).
BAB 2 TINJAUAN PUSTAKA 2.1 Teori Umum
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari spektrometer dengan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorbsi. Jadi spektrometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai ungsi dari
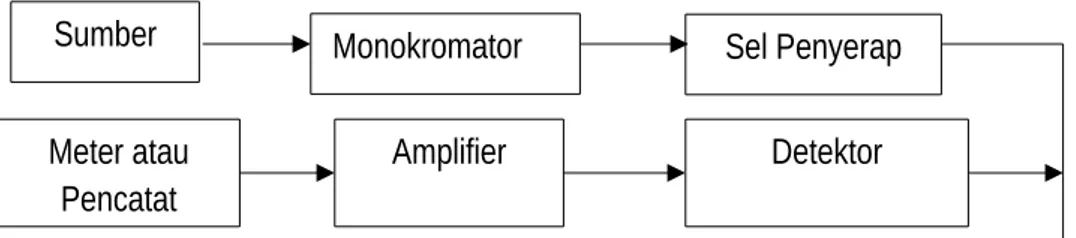
panjang gelombang. Sedangkan pada spektrofotometer, panjang gelombang yang benar-benar diseleksi dapat diperoleh dengan bantuan alat pengurai cahaya seperti prisma. Suatu spektrofotometer tersusun dari sumber spektrum tampak yang kontinue, minokromator, sel pengabsorbsi untuk larutan sampel atau blanko dan suatu alat untuk mengukur perbedaan absorbsi antara sampel dan blanko ataupun pembanding (Khopkar,2008).
Diagram sederhana dari spektrofotometer (Ditjen POM, 1979) :
Prinsip kerja spektrofotometer mula-mula zat yang akan diukur diidentifikasi, berupa atom atau molekul. Radiasi dari sumber infra merah dipecah oleh pencacah sinar menjadi dua bagian yang sama dengan arah yang saling tegak lurus. Setelah itu, kedua radiasi tersebut dipantulkan kembali ke dua cermin sehingga bertemu kembali di pencacah sinar untuk berinteraksi. Sebagian sinar diarahkan ke sampel lalu ke detektor sedangkan sebagian lagi dibalikkan ke sumber gerak. Maju mundur cermin akan menyebabkan sinar yang menuju detektor berfluktuasi tetapi terkendali (Cahyono, 2008).
Spektroskopi inframerah merupakan teknik yang sangat berguna untuk pengidentifikasian senyawa- senyawa yang tidak di kenal, misalnya produkk dari suatu sintesis atau metabolit kemih dari seekor hewan percobaan, terutama ketika di gunakan bersama-sama dengan teknik elusidasi stuktur lainnya, seperti resonansi magnetic nuklir dan spektrometri massa (Cairns, 2008).
Spektrometer massa adalah suatu instrument yang dapat menyeleksi molekul-molekul gas bermuatan berdasarkan massa dan
Sel Penyerap Monokromator Sumber Meter atau Pencatat Amplifier Detektor
beratnya. Teknik ini tidak dapat dilakukan dengan spektroskopi, akan tetapi nama spektroskopi dipilih disebabkan persamaannya dengan pencatat fotografi dan spectrum garis optic. Umumnya spectrum massa diperoleh dengan mengubah senyawa suatu sampel menjadi ion-ion yang bergerak cepat yang dipisahkan berdasarkan perbandingan massa terhadap muatan (m/e). proses ionisasi menghasilkan partikel-partikel bermuatan positif, dimana massa yang terdistribusi adalah spesifik terhadap senyawa induk. Selain untuk penentuan struktur molekul, spectrum massa dipakai untuk penentuan analisis kuantitatif. Biasanya sampel ditembaki dengan berkas electron yang menghasilkan suatu ion molekul atau fragmen ionic.Fragmen-fragmen bermuatan ini dapat dipisahkan menurut massanya (Asis, 2010).
Merupakan suatu instrumen yang menghasilkan berkas ion dari suatu zat uji, memilah ion tersebut menjadi spektum yang sesuai dengan perbandingan massa terhadap muatan dan merekam kelimpahan relatif tiap jenis ion yang ada. Umumnya hanya ion positif yang dipelajari karena ion negatif yang dihasilkan dari sumber tumbukan umumnya sedikit. Garis besar tentang apa yang terjadi dalam alat spektrometer massa. Atom dapat dibelokkan dalam sebuah medan magnet (dengan anggapan atom tersebut diubah menjadi ion terlebih dahulu) (Khopkar, 2008).
Dalam suatu spectrometer NMR, radio frekuensi dibuat tetap pada 60 MHz, sedangkan Ho diubah – ubah dalam suatu range kecil, dan frekuensi absorpsi direkam untuk berbagai harga Ho. Jadi spectrum NMR ialah grafik dari banyaknya enegi yang diserap (I, intensitas) versus kuat medan magnet (Supratman,2007).
Dalam spektro 1HNMR, suatu medan magnet luar berupa tapalkuda permanen atau suatu electromagnet. Kuat medan magnet luar dilambangkan (Ho) akan bergasing / berputar pada momen magnet nuklirnya (inti), terinduksi, apabila senyawa sampel mengandung atom – atom hidrogen ditempatkan dalam medan magnet luar tersebut, maka
inti hidrogen/ proton dapat bersikap paralel atau anti paralel atau anti paralel terhadap arah medan magnet luar ( tergantung bentuk ikatan atom hydrogen dengan atom unsure lain dalam molekul senyawa). Dalam keadaan paralel ataupun anti paralel suatu poton / atom hydrogen senyawa dikenal radiasi gelombang frekuensi gelombang radio yang cocok, maka momen magnet inti hydrogen/proton menyerap radiasi tersebut dan terjadi pembalikkan arah(flip) dan menyebabkan poton bepindah arah dari keadaan paralel menjadi anti paralel atau dikatakan proton mengalami peristiwa resonansi yang dikenal sebagai resonansi magnetic inti (NMR) (Supratman, 2007).
Rumus molekul yang telah diketahui dapat digunakan untuk menghitung nilai DBE dan memperkirakan kemungkinan bentuk struktur unknown tersebut sehingga sudah terbayang bentuk struktur molekul yang akan dituju. Terdapat banyak metode penentuan persentase bobot dari unsur-unsur dalam suatu senyawaan, bergantung macamnya senyawa dan unsur penyusunnya. Dua metode klasik ialah analisis pengendapan dan analisis pembakaran, adapun metode analisis pembakaran masih digunakan secara meluas (Khopkar, 2008).
Jika suatu zat mengandung karbon, hidrogen, dan oksigen, setelah dilakukan penimbangan, dapat dibakar dalam suatu tabung tertutup dalam suatu aliran oksigen untuk menghasilkan karbondioksida dan air (Khopkar, 2008).
Produk pembakaran tersebut dikeluarkan dari tabung dengan aliran oksigen ke dalam dua bahan penyerap, yaitu penyerap uap air oleh magnesium perkolat dan penyerap gas karbon dioksida oleh natrium hidroksida menghasilkan natrium karbonat. Adapun pertambahan berat penyerap masing-masing merupakan bobot air dan karbon dioksida. Hasil oksidasi sempurna senyawa tersebut diukur kemudian dengan dasar stokiometri dapat dihitung unsur-unsur penyusunnya (Khopkar, 2008).
Penentuan nilai DBE menurut Dudley H. William and lan Fleming dalam buku “Spectroscopic methods in organic chemistry”, adapun rumus molekul yang telah diketahui dapat digunakan untuk memperkirakan berapa banyak ikatan rangkap atau sistem lingkar yang mungkin ada sesuai rumus molekul yang telah diketahui tersebut dengan menggunakan persamaan (2008).
CaHbOc DBE = (2a+22)−b
Apabila terdapat atom Cl, Br, I pada formula molekul maka perlakuan sebagai atom monovalen H, dan jika terdapat atom trivalen (N, P, dll) maka digunakan rumus sebagai berikut (Khopkar, 2008):
CaHbOcNd DBE = (2a+2)−(2 b−d)
Bila diperoleh nilai DBE = 0 berarti tidak ada ikatan rangkap atau cincin
1 berarti terdapat satu ikatan rangkap dua atau satu cincin (bukan aromatis).
2 berarti ada dua ikatan rangkap dua atau satu ikatan rangkap dua dan satu cincin atau satu ikatan rangkap tiga, dst.
2.2 Uraian Bahan
1. Alkohol ( Ditjen POM, 1979 : 65) Nama Resmi : AETHANOLUM Nama Lain : Etanol, Alkohol RM/BM : C2H6O
Pemerian : Cairan tak berwarna, jernih mudah menguap dan mudah bergerak; bau khas; rasa panas; mudah terbakar dan memberikan nyala biru yang tidak berasap.
Eter P
Penyimpanan : Dalam wadah tertutup rapat, terhindar dari cahaya, di tempat sejuk jauh dari nyala api
Kegunaan : Sebagai zat tambahan, juga dapat membunuh kuman 2. Eter (Ditjen POM, 1979 : 66)
Nama resmi : AETHER ASTHETICUS Nama lain : Eter anastesi, efoksierana RM/BM : C4H10O/ 74,12
Pemerian : Cairan transparan, tidak berwarna, bau khas; rasa manis dan membakar. Sagat mudah menguap; sangat mudah terbakar
Kelarutan : Larut dalam 10 bagian air; dapat bercampur dengan etanol (95%) P, dengan kloroform P, dengan minyak lemak dan dengan minyak atsiri
Penyimpanan : Dalam wadah kering tertutup rapat, terlindung dari cahaya; di tempat sejuk.
Kegunaan : Anastesi Umum
3. Kloroform (Ditjen POM, 1979: 151) Nama resmi : CHLOROFROM Nama lain : Kloroform RM/BM : CHCl3 / 119,38
Pemerian : Cairan, mudah menguap , tidak berwarna; bau khas; rasa manis dan membakar
Kelarutan : Larut dalam lebih kurang 200 bagian air, mudah larut dalam etanol mutlak P, dalam eter P, dalam sebagian besar pelarut organic, dalam minyak atsiri dan dalam minyak lemak
Penyimpanan : Dalam wadah tertutup baik tersumbat kaca, terlindung dari cahaya
BAB 3 METODE KERJA 3.1 Alat Praktikum
Adapun alat yang di gunakan dalam praktikum ini adalah instrument CHNS, spektroskopi IR, spektroskopi massa.
3.2 Bahan Praktikum
Adapun bahan yang digunakan dalam praktikum ini adalah senyawa yang mengandung rumus molekul C4H8O.
3.3. Cara Kerja
a) Alat konvensional
Di timbang zat yang mengandung karbon, hydrogen, dan oksigen, lalu zat dapat di bakar dalam suatu tabung tertutup dalam suatu aliran oksigen untuk menghilangkan karbon di oksida dan air. b) Instrumen CHNS
Ditimbang zat yang mengandung karbon, hydrogen, nitrogen, sulfur dan oksigen senyawa organic. Produk pembakaran di pisahkan oleh kolom kromatografi dalam bentuk NO2, CO2,SO2, H2O yang kemudian di deteksi dengan bantuan detector konduktivitas termal (TCD, Thermal Conductivity Detector) memberikan sinyal keluaran sebandng dengan persentase masing-masing komponen campuran.
BAB 4 HASIL DAN PEMBAHASAN 4.1 Hasil
a. Spektrum massa C4H8O
b. Spektrum IR dari senyawa C4H8O
c. Interpretasi data HNMR dari senyawa C4H8O
e. Spektrum HNMR C2H6O
f. Spektrum IR C9H10O
Elusidasi struktur molekul senyawa organik merupakan tahapan terpenting dari penggunaan analisis spektroskopi modern. Dalam elusidasi struktur molekul untuk menentukan struktur senyawa. Adapun metode yang digunakan yaitu spektroskopi dimana metode ini merupakan metode yang paling tepat dalam menentukan rumus molekul atau elusidasi struktur senyawa-senyawa organik.
Spektroskopi adalah ilmu yang mempelajari materi dan atributnya berdasarkan cahaya, suara atau partikel yang dipancarkan, diserap atau dipantulkan oleh materi tersebut. Spektroskopi juga dapat didefinisikan sebagai ilmu yang mempelajari interaksi antara cahaya dan materi. Dalam catatan sejarah, spektroskopi mengacu kepada cabang ilmu dimana "cahaya tampak" digunakan dalam teori-teori struktur materi serta analisa kualitatif dan kuantitatif. Dalam masa modern, definisi spektroskopi berkembang seiring teknik-teknik baru yang dikembangkan untuk memanfaatkan tidak hanya cahaya tampak, tetapi juga bentuk lain dari radiasi elektromagnetik dan non-elektromagnetik seperti gelombang mikro, gelombang radio, elektron, fonon, gelombang suara, sinar x dan lain sebagainya.
Pada praktikum kali ini, data yang di gunakan untuk menentukan sturktur senyawa dan rumus molekul yang ada pada suatu sampel yaitu dilakukan pemeriksaan pendahuluan seperti pada gambar d yang menunjukkan suatu data adanya puncak kuat yang terdapat pada daerah kisaran 1050 cm-1 yang menandakan adanya C-O dan puncak melebar pada kisaran 3300 -3400 cm-1 yang di yakinkan dengan adanya OH. Hal ini menandakan rumus molekul senyawa kemungkinan alcohol atau fenol. Diperoleh nilai DBE nya yaitu 0 yang menandakan tidak ada ikatan rangkap yang terdapat pada suatu sampel atau rumus molekulnya.
Berdasarkan nilai yang diperoleh dari spectrum IR,dapat di simpulkan bahwa senyawa dengan rumus molekul C4H8O adalah suatu alcohol. Selanjutnya dilakukan analisis pada spectrum HNMR dari senyawa C2H6O yaitu terdapat tiga peak, yang menandakan adanya
tiga gugus yang tidak equivalen satu dengan yang lainnya. Pada gesekan kimia ± 1 ppm terdapat tiga peak yang mengandung 3 proton (H) menyerap di atas medan biasanya gugus alkana (CH3).
BAB 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan data yang diberikan sebagaimana data DBE = 0 menunjukkan bahwa struktur molekul C2H6O tidak memilki ikatan rangkap dan data IR menyimpulkan bahwa senyawa yang tidak di ketahui merupakan alcohol, sehingga struktur molekul senyawa dengan rumus C2H6O adalah
CH3 CH2 OH 5.2 Saran
Sebaiknya laboratorium melengkapi instrument yang ada pada materi praktikum agar praktikan lebih mudah untuk melakukan praktikum
DAFTAR PUSTAKA
Anonim., 2016, Penuntun Praktikum Analisis Instrumen , Universitas Muslim Indonesia: Makassar.
Azis, B., 2010, Spektroskopi Resnonansi Magnetik Inti (NMR), Universitas Hasanuddin: Makassar.
Cahyono, M., 2008, Spektroskopi Elusidasi Struktur Molekul Organik, Graha Ilmu : Yogyakarta.
Cairns, 2008, Intisari Kimia Farmasi, EGC: Jakarta.
Dirjen POM, 1979, Farmakope Indonesia Edisi II, Departemen Kesehatan Republik Indonesia: Jakarta.
Supratman, U., 2010, Elusidasi Struktur Senyawa Organik (Metode Spektroskopi untuk Penentuan Struktur Senyawa Organik), Widya Pajajaran: Bandung.
LAMPIRAN Hasil Diskusi
1. Contoh analisis elementer untuk penentuan rumus molekul senyawa. Bila suatu senyawa organik hanya tersusun dari atom C, H dan O beratnya 36 mg di oskidasi sempurna sehingga di peroleh 88 mg gas CO2 dan 36 mg H2O. bagaimana rumus molekul senyawa tersebut jika spectrum massa dengan puncak ion molekul (M+) 72 sma. Adapun reaksi yang terjadi adalah
CHO + O2 CO2 + H2O
36 mg 88 mg 36 mg
mg= 4mg. Adapun bobot atom yang terdapat dalam senyawa adalah 36 mg – (24+4)mg = 8 mg, sehingga perbandingan mol atom C, H, dan O dalam molekl senyawa adalah 24/12:4/1 :8/16 atau 2: 4: 0,5. Karena massa relative senyawa tersebut sudah di ketahui dari spectrum massanya (M+) 72 sma.
Maka rumus molekul senyawa dapat di hitung sebagai berikut: (C2H4O0,5)n = 72
(12x2 + 1x4 + 16x0,5)n = 72 (24 + 4 + 8)n = 72
36 n = 72 N = 2
Rumus molekul senyawa adalah C4H8O 2. Perhitungan nilai DBE
Diberikan senyawa dengan rumus molekul C10H14N2, perkiraan banyaknya ikatan rangkap dan atau seistem lingkar yang mungkin terdapat pada struktur senyawa tersebut?
CaHbOcNd DBE=(2qa+2)−(2 b−d)
C10H14N2 DBE=(2X10+2)2–(14−2) = 5
Struktur molekul senyawa dengan rumus molekul C10H14N2 sudah diketahui dan telah di lakukan analisis data spektroskopi IR dan NMR terhadap senyawa tersebut, maka dapat di pastikan bahwa senyawa tersebut memiliki satu cincin romatik/ heterosiklik, DBE= 4 dan satu cincin (bukan aromatis), DBE =1 ini sesuai dengan nilai DBE senyawa= 5 sebagaimana di ketahui senyawa tersebut adalah nikotin. 3. Tentukan nilai DBE senyawa C4H8O dan perkirakan ikatan rangkap
atau system lingkar kemungkinan terdapat pada rumus molekul senyawa tersebut?
Jawab :
C4H8O DBE=(2x4+2)2 –8 = 1
a. Kemungkinan senyawa tersebut mempunyai 1 ikatan rangkap C=C atau C=O atau mempunyai 1 ikatan siklis (bukan aromatis), atau lain-lainnya.
b. Untuk memastikan struktur molekul senyawa C4H8O tersebut maka di perlukan selain data bobot massa telah di ketahui sebelumnya dari data spektroskopi massa, juga data spectrum IR dan HNMR yang akan di bahas selanjutnya.
4. Serapan inframerah karakteristik dari senyawa haloalkana
Haloalkana, absorpsi uluran ikatan CX suatu haloalkana jatuh pada daerah sidikjari spectrum IR, yakni 500-1430 cm-1 (7-20µm),
5. Serapan inframerah dari senyawa di-propil Eter
Alcohol dan amina menunjukkan absorpsi uluran OH atau NH yang jelas pada 300-3700 cm-1 (2,7-3,3µm), dikiri absorpsi CH. Bila terdapat dua hydrogen pada suatu nitrogen amina (-NH2), absorpsi NH Nampak sebagai peak kembar. Jika terdapat hanya satu H pada N itu, maka terlihat suatu satu peak. Tentu saja bila terdapat serapan dalam daerah ini. Gugus O dan N dalam bentuk C-O dan C-N di temukan di daerah sidik jari pada daerah 900-1300 cm -1 (8-11 µm) namun tidak selalu mudah di identifikasi karena banyak peak dari gugus lain.
Eter mempunyai suatu pita uluran C-O yang terletak dalam daerah sidik jari pada 1050-1260 cm -1 (7,9-9,5µm). karenaoksigen bersifat elektronegatif, uluran akan menyebabkan perubahan besar dalam momen ikatan; oleh karena itu, serapan C-O biasanya kuat. 6. Spectrum IR dari senyawa C4H8O seperti gambar di bawah ini:
Tentukan puncak-puncak sebagai signal adanya gugus fungsi : Analisis data puncak puncak spectrum IR adalah sebagia berikut : a. Adanya puncak kuat pada daerah 1722 cm-1 menunjukkan
terdapat gugus karbonil C=O. hal ini menandakan rumus molekul senyawa kemungkinan keton atau aldehida. Karena senyawa unknown hanya memiliki satu atom oksigen, maka tidak mungkin karboksilat atau ester.
b. Terdapat pita pada daerah 2900-3000 cm-1 di identifikasi sebagai gugus C-H alifatik (absorpsi untuk uluran CH aromatic, lemah berada di dekat 3030 cm-1 (3,3µm), tepat di sebelah kiri absorpsi CH alifatik), juga karena rumus molekul senyawa memiliki atom C sebanyak 4 serta harga DBEnya adalah 1
c. Pita CH pada aldehida mempunyai spectra IR yang sangat mirip dengan spectra keton, bedanya, aldehida mempunyai H terikat pada karbon karbonil. Ikatan C-H istimewa ini menunjukan pita uluran karakteristik (tepat dikanan pita CH alifatik) pada 2820-2900 cm-1 (3,45-3,55µm) dan 2700 -2780 cm-1 (3,60-3,70µm). kedua peak CH ini runcing, tetapi lemah dan peak pada 2900cm-1 (3,45µm) dapat tersembunyi oleh absorpsi yang bertumpang tindih dari ikatan CH lain.
d. Berdasarkan interpretasi spectrum IR dapat di simpulkan bahwa senyawa dengan rumus molekul C4H8O adalah suatu keton alifatik. 7. Analisis data peak spectrum HNMR pada senyawa C4H8O
Analisis data peak
a. Terdapat tiga peak, menandakan adanya tiga gugus yang tidak equivalen satu dengan lainnya
b. Pada gesekan kimia 1,058 ppm terdapat peak yang mengandung 3 proton (H) menyerap di atas medan biasanya gugus alkana (CH3) dengan polan pemisahan/ terbelah menjadi tiga/ triplet menandakan adanya proton (H) tetangga yang tak ekuivalen dengannya, memiliki proton (H) sebanyak N=2 (gugus CH2) sesuai aturan N+1 = 3. Demikian pula pada gesekan kimia 2, 319 terdapat peak mengandung 3 proton (H) menyerap di atas medan dengan pola pemisahan singlet, menandakan bahwa gugus alkana (CH3) yang tidak memiliki atom proton (H) tetangga yang tak ekivalen dengannya.
c. Pada gesekan kimia 2,449 ppm terdapat peak mengandung 2 proton (H) juga menyerap di atas medan (gugus alkana, CH2) dengan pola pemisahan kuartet/ terbelah empat, menandakan bahwa gugus ini memiliki atom proton (H) tetangga tak ekivalen sebanyak N=3 (gugus CH3) sebagaimana aturan N+1=4
Kesimpulan
1. Sebagaimana data DBE= 1 menunjukkan bahwa struktur molekul C4H8O memiliki satu ikatan rangkap berasal dari gugus karbonil (C=O)
2. Data IR menyimpulkan bahwa senyawa unknown meruoakan keton alifatik, sehingga struktur molekul senyawa dnegan rumus C4H8O adalah
CH3 CH3 C CH3
ǁ