(Thunnus sp) DAN CAKALANG (Katsuwonus pelamis)
SKRIPSI Oleh: DEFRIZAL
C34060519
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
DEFRIZAL. C34060519. KARAKTERISASI GEN hdc PENGKODE ENZIM HISTIDIN DEKARBOKSILASE PADA ISOLAT BAKTERI IKAN TUNA (Thunnus sp) DAN CAKALANG (Katsuwonus pelamis). Dibimbing oleh PIPIH SUPTIJAH dan ASADATUN ABDULLAH
Indonesia merupakan salah satu produsen ikan tuna di dunia. Laporan Rapid Alert System for Food and Feed (RASFF) Uni Eropa pada tahun 2007 mencatat terdapat 22 kasus impor tuna Indonesia yang mengandung histamin melebihi batas keamanan pangan. Food and Drugs Adminsitration Amerika serikat (US-FDA) melaporkan terdapat 7 kasus pada tahun 2007 dan 13 kasus pada tahun 2008 tentang penolakan tuna Indonesia akibat kadar histamin yang melebihi ambang batas keamanan pangan. Ikan-ikan golongan scombridae seperti tuna dan cakalang secara alami memiliki kandungan histidin dalam jumlah yang tinggi yang dapat diubah menjadi histamin oleh bakteri pembentuk histamin yang memiliki enzim histidin dekarboksilase.
Untuk dapat mengembangkan metode yang dapat mendeteksi adanya histamin secara dini dan akurat, maka perlu dilakukan isolasi gen pengkode enzim histidin dekarboksilase dengan metode berbasis PCR-sequencing. Adapun tujuan dari penelitian ini adalah mendapatkan isolat bakteri dari ikan tuna dan cakalang; mendapatkan gen pengkode enzim histidin dakarboksilase dari isolat bakteri ikan tuna dan cakalang dan karakterisasi gen pengkode enzim histidin dekarboksilase dari isolat bakteri ikan tuna dan cakalang.
Metode yang digunakan dalam penelitian ini adalah isolasi bakteri dari ikan tuna dan cakalang, ekstraksi DNA dengan menggunakan metode CTAB dan PCR-sequencing. Prosedur kerja pada penelitian ini meliputi; isolasi dan karakterisasi isolat bakteri; esktraksi dan purifikasi DNA; amplifikasi DNA target; karakterisasi DNA dengan elektroforesis gel agarosa serta PCR- sequencing. Total isolat dari kedua jenis sampel berjumlah 22 isolat dengan karakteristik isolat secara umum: bentuk permukaan cembung dan datar; bentuk tepian licin; bentuk koloni tidak beraturan dan bulat dengan warna merah, kuning, putih dan oranye. Karakterisasi gram menunjukkan bahwa terdapat 18 isolat gram negatif dan 4 isolat gram positif. Gen pengkode enzim histidin dekarboksilase (hdc) berhasil diisolasi dari isolat bakteri ikan Be 3 dengan panjang basa yang telah sesuai dengan literatur yaitu 534 bp. Hasil Basic Local Asignment Search Tool (BLAST) terhadap DNA bakteri target menunjukkan gen hdc dari bakteri Morganella morganii FJ4965.1 berdasarkan data yang diperoleh dari National Center for Biotechnology Information (NCBI).
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEFRIZAL C34060519
PROGRAM STUDI TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
CAKALANG (Katsuwonus pelamis) Nama Mahasiswa : Defrizal
NIM : C34060519
Menyetujui:
Pembimbing I Pembimbing II
Dra. Pipih Suptijah, MBA Asadatun Abdullah, S.Pi, M.Si, M.S.M NIP. 195310201985031002 NIP. 198304052005012001
Mengetahui:
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP: 195805111985031002
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Karakterisasi Gen hdc Pengkode Enzim Histidin Dekarboksilase pada Isolat Bakteri Ikan Tuna (Thunnus sp) dan Cakalang (Katsuwonus pelamis)” adalah hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi.
Bogor, Juli 2010
Defrizal C34060519
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan dan melimpahkan rahmat dan hidayahNya sehingga penulis dapat menyelesaikan penulisan skripsi ini dengan baik. Selawat berserta salam penulis sanjungkan kepada nabi Muhammad SAW, keluarga berserta sahabatnya yang telah membimbing umat ini menuju jalan kebenaran hingga akhir jaman.
Skripsi ini merupakan tulisan yang disusun berdasarkan hasil penelitian yang penulis lakukan dengan judul “Karakterisasi Gen hdc Pengkode Enzim Histidin Dekarboksilase pada Isolat Bakteri Ikan Tuna (Thunnus sp) dan Cakalang (Katsuwonus pelamis)”. Skripsi ini ditulis sebagai syarat untuk memperoleh gelar Sarjana Perikanan (S.Pi) pada Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Kesempatan kali ini, penulis mengucapkan terima kasih yang sedalam-dalamnya kepada:
1. Dra. Pipih Suptijah, MBA selaku dosen pembimbing I yang telah memberikan waktu, arahan dan bimbingannya selama penelitian dan penulisan skripsi
2. Asadatun Abdullah, S.Pi, M.S.M, M.Si selaku dosen pembimbing II, atas segala bimbingan, masukan dan pengarahan yang luar biasa kepada penulis sehingga skripsi yang inovatif ini dapat terwujudkan
3. Dr. Tati Nurhayati, S.Pi, M.Si selaku dosen penguji atas saran dan masukan kepada penulis
4. Dr. Ir. Ruddy Suwandi, MS, M.Phill, selaku Ketua Departemen Teknologi Hasil Perairan, Fakulltas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
5. Semua dosen yang telah ikhlas memberikan ilmu sebagai bekal penelitian bagi penulis
6. Ayah (Amirudin) dan ama (Nurlaili) serta kakak-kakak dan adik tercinta (Hery, Isnadi, Andriani, Detty A, Rudi A dan Lani A), atas semua dukungan dan kasih sayang yang diberikan baik moril maupun materil serta doa yang selalu mengalir tanpa henti kepada penulis
8. Tema-teman ‘team histamin’ Roji dan Roma yang telah bekerjasama menjalankan penelitian ini dengan baik.
9. Teman-teman terbaik di THP 43 2006-2010: Wahyu, Supri, Yayan, Dwi, Idmar, Uuk, Nico, Wati, Ferry, Nanda, Nanang, Dina, Cubby, Buddy, Ely, Minal, Nurwati, Fau, Uty, Reza, Lely, Efga, Aul, Pipit, Hilda dan semuanya yang tidak bisa penulis sebutkan satu per satu. Terima kasih atas dukungan, semangat, kerjasama, persahabatan dan kenangan yang kita jalani bersama.
10.Teman-teman THP 42, 44 dan 45 atas bantuan dan semangatnya kepada penulis
Penulis menyadari bahwa tidak ada yang sempurna di dunia ini, begitu pun juga dengan penulisan skripsi ini. Penulis mengharapkan kritik dan saran yang membangun demi perbaikan ke depannya. Penulis berharap skripsi ini dapat memberikan manfaat kepada siapa pun yang menggunakannya.
Bogor, Juli 2010
September 1987. Penulis merupakan anak ke enam dari enam bersaudara dari pasangan bapak Amirudin dan ibu Nurlaili. Selama ini penulis telah menempuh jalur pendidikan formal dari SDN 13 Saribu Labiah dan lulus pada tahun 2000, SLTPN 2 Lintau Buo, lulus pada tahun 2003 dan SMAN 1 Lintau Buo, lulus pada tahun 2006.
Pada tahun 2006 penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan mengambil Program Studi Teknologi Hasil Perairan dengan Supporting Course. Selama menjadi mahasiswa, penulis pernah aktif dalam Himpunan Profesi Mahasiswa Teknologi Hasil Perairan (HIMASILKAN) sebagai staf divisi Pengembangan Sumberdaya Manusia (2007), Asisten mata kuliah Ikhtiologi (2008), Asisten mata kuliah Teknologi Pengolahan Hasil Perikanan (TPHP) (2010), kepanitian baik internal maupun eksternal (2006-2009) serta pengajar bimbingan belajar dan prívate Briliant Student (2009 sampai sekarang).
Penulis telah melaksanakan penelitian dengan judul” Karakterisasi Gen Hdc Pengkode Enzim Histidin Dekarboksilase pada Isolat Bakteri Ikan Tuna (Thunnus sp) dan Cakalang (Katsuwonus pelamis)”. Sebagai salah satu syarat untuk menyelesaikan tugas akhir atau skripsi dan memperoleh gelar sarjana pada Program Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN ... x 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2.TINJAUAN PUSTAKA ... 3
2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus sp) ... 3
2.2 Deskripsi dan Klasifikasi Ikan Cakalang (Katsuwonus pelamis) ... 4
2.3 Histamin ... 6
2.3.1 Histamin pada ikan. ... 6
(1) Histamin yang terbentuk selama autolisis ... . 7
(2) Histamin yang terbentuk karena aktivitas bakteri ... ... 8
2.3.2 Reaksi fisiologis histamin ... . 10
2.4 Deoxysiribonucleic Acid (DNA) ... 10
2.5 Metode Isolasi Bakteri ... 13
2.6 Polymerase Chain Reaction (PCR) ... 15
2.7 Analisis Produk PCR (Elektroforesis) ... 16
2.8 DNA Sequencing ... 17
3. METODOLOGI ... 19
3.1 Waktu dan Tempat ... 19
3.2 Alat dan Bahan ... 19
3.3 Prosedur Kerja ... 21
3.3.1 Isolasi dan pengujian isolat bakteri ... 21
3.3.2 Ekstraksi dan purifikasi DNA ... 24
3.3.3 Amplifikasi DNA target ... 24
3.3.4 Visualisasi DNA dengan elektroforesi gel agarosa ... 27
3.3.5 DNA sequencing ... 28
4. HASIL DAN PEMBAHASAN .. ... 29
4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang ... 29
4.1.1 Morfologi isolat bakteri ... ... 29
4.4 DNA Sequencing .. ... 37
5. KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
No. Halaman 1. Jenis-jenis dan spesifikasi bakteri pembentuk histamin
yang terdapat pada ikan laut ... 9
2. Tingkat bahaya histamin per 100g daging ikan ... 10
3. Jumlah bahan yang digunakan untuk amplifikasi DNA bakteri ... 25
4. Karakteristik isolat bakteri ikan tuna dan cakalang ... 29
5. Hasil pewarnaan gram isolat bakteri ikan tuna dan cakalang ... 31
No Halaman
1. Morfologi ikan cakalang (Katsuwonus pelamis) ... 5
2. Struktur kimia histamin ... 6
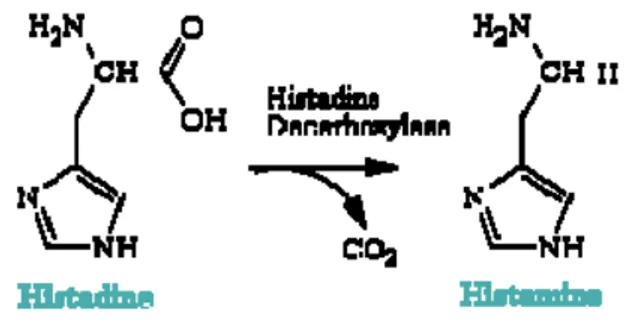
3. Proses dekarboksilase histidin menjadi histamin ... 7
4. Struktur kimia basa purin dan pirimidin ... 12
5. Struktur molekul DNA ... 13
6. Mekanisme reaksi PCR ... 16
7. Ikan tuna albacore (Thunnus allalunga) ... 20
8. Ikan madidihang (Thunnus albacore) ... 20
9. Ikan tuna mata besar (Thunnus obesus) ... 20
10. Ikan tuna sirip biru (Thunnus maccoyii) ... 20
11. Proses isolasi bakteri ... 22
12. Proses pewarnaan gram isolat bakteri ... 25
13. Proses ekstraksi dan purifikasi DNA isolat bakteri ... 26
14. Proses amplifikasi DNA dengan menggunakan alat thermocycler ... 27
15. Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari bakteri ikan tuna dan cakalang ... 32
16. Elektroforegram produk PCR dengan menggunakan primer histidin dekarboksilase (Hdc) ... ... 35
17. Elektroforegram produk PCR dengan menggunakan primer 106 dan 107 .. ... 36
No. Halaman 1. Alat-alat yang digunakan dalam penelitian ... 42 2. Cara pembuatan larutan ... 43 3. Perhitungan konsentrasi DNA genom sampel ... 44
1. PENDAHULUAN
1.1 Latar belakang
Indonesia merupakan salah satu produsen utama ikan tuna di dunia. Data ekspor Indonesia pada tahun 2008 menunjukkan nilai ekspor ikan tuna mencapai 337,89 juta dolar AS (DKP 2008). Nilai ekspor ini terus mengalami peningkatan secara signifikan setiap tahun rata-rata 20,17%. Industri tuna Indonesia masih memiliki permasalahan yakni adanya ancaman penolakan oleh negara importir yang berhubungan dengan masalah keamanan pangan, terutama tingginya kadar histamin. Laporan Rapid Alert System for Food and Feed (RASFF) Uni Eropa pada tahun 2007 mencatat terdapat 22 kasus impor tuna Indonesia yang mengandung histamin melebihi batas keamanan pangan (EC 2007). Food and Drugs Administration Amerika Serikat (US-FDA) melaporkan terdapat 7 kasus pada tahun 2007 dan 13 kasus pada tahun 2008 tentang kasus penolakan tuna Indonesia akibat kadar histamin yang melebihi ambang batas keamanan pangan (FDA 2009).
Keracunan yang disebabkan oleh histamin, yang dikenal dengan scombroid poisoning seringkali terjadi setelah mengkonsumsi ikan laut yang banyak mengandung histidin bebas yang merupakan prekursor histamin (Mangunwardoyo et al. 2007). Beberapa jenis ikan terutama dari famili scombridae seperti tuna dan cakalang mempunyai kandungan histidin bebas yang tinggi pada dagingnya sehingga berpotensi menghasilkan histamin.
Histamin tersebut terbentuk karena adanya kesalahan selama proses penanganan dan pengolahan. Oleh karena itu, jika pada saat penangkapan tidak ditangani dengan tepat maka histidin yang terkandung pada ikan jenis scombroid tersebut dapat diubah menjadi senyawa toksik yang disebut dengan histamin. Dalam jumlah tertentu histamin dapat menyebabkan reaksi keracunan bagi yang mengkonsumsinya yang ditunjukkan dalam beberapa gejala klinis seperti kemerahan di sekitar leher dan wajah, badan terasa panas, gatal-gatal, diare dan sakit kepala (Dalgaard 2008). Jika histamin telah terbentuk dalam tubuh ikan, maka keberadaannya tidak akan dapat dihilangkan dengan proses pengolahan apapun. Oleh karena itu, penanganan yang tepat semenjak ikan ditangkap hingga
sampai ke tangan konsumen merupakan langkah yang kritis untuk mencegah terbentuknya histamin.
Histamin terbentuk sebagai akibat adanya aktivitas bakteri yang mampu memproduksi enzim histidin dekarboksilase. Bakteri yang dapat memproduksi enzim histidin dekarboksilase sehingga berpotensi menghasilkan histamin antara lain Enterobacteriaceae, Clostridium, Morganella, Lactobacillus, Vibrio, Pseudomonas dan Photobacterium (Arisman 2009).
Bakteri pembentuk histamin sulit dideteksi secara langsung, karena jumlahnya sedikit dibandingkan bakteri lain pada ikan segar. Selama ini metode yang digunakan untuk mendeteksi histamin adalah medium diferensial Niven (Mangunwardoyo et al. 2007). Untuk dapat mengembangkan metode secara dini dan akurat pendeteksi adanya bakteri yang mampu menghasilkan histamin secara enzimatis, maka perlu dilakukan isolasi gen pengkode enzim histidin dekarboksilase. Pengembangan metode cepat deteksi histamin ini selanjutnya dapat dijadikan sebagai standar pembanding (marka molekuler) dan sebagai langkah awal perancangan kit histamin. Oleh karena itu, dibutuhkan suatu usaha untuk mengisolasi gen hdc pengkode enzim histidin dekarboksilase dari bakteri endogenous Indonesia, yaitu dari spesies ikan tuna dan cakalang.
1.2 Tujuan
Tujuan penelitian ini adalah untuk mendapatkan isolat bakteri dari daging ikan tuna dan cakalang; mendapatkan gen pengkode enzim histidin dekarboksilase dari isolat bakteri ikan tuna dan cakalang; dan mengkarakterisasi gen pengkode enzim histidin dekarboksilase pada isolat bakteri ikan tuna dan cakalang.
2. TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Ikan Tuna (Thunnus sp)
Tuna digunakan sebagai nama group dari beberapa jenis ikan yang terdiri dari jenis tuna besar (Thunnus spp, seperti yellowfin tuna, bigeye tuna, southern bluefin tuna, dan albacore) dan jenis ikan mirip tuna (tuna-like species) yaitu marlins, sailfish, dan swordfish. Skipjack tuna sering digolongkan sebagai “cakalang”, sedangkan “tongkol” umumnya digunakan untuk jenis eastern little tuna (Euthynnus spp), frigate and bullet tuna (Auxis spp) dan longtail tuna (Thunnus tonggol). Potensi pelagis besar (termasuk tuna) secara nasional mencapai 1.165.360 ton. Sumberdaya tersebut sangat berpotensi untuk dikembangkan di masa mendatang bagi kepentingan pembangunan perikanan nasional (DKP 2005).
Klasifikasi ikan tuna menurut Saanin (1984) adalah sebagai berikut:
Filum : Chordata Subfilum : Vertebrata Kelas : Teleostei Subkelas : Actinopterygi Ordo : Perciformes Subordo : Scombridae Genus : Thunnus
Spesies : Thunnus albacores Thunnus allalunga
Thunnus maccoyii
Thunnus obesus Thunnus tonggol
Menurut Tampubolon (1983) ikan tuna meliputi13 jenis yang terdiri dari 7 jenis tuna besar dan 6 jenis tuna kecil (small tuna).
1. Albacore (Thunnus allalunga) biasanya hidup di laut lepas dan berada di bawah thermoklin (lapisan air yang perbedaan suhunya mencolok).
Panjang ikan bisa mencapai 137 cm, namun yang umum antara 40–100 cm. Pemakan segala macam organisme, khususnya ikan,
cumi-cumi dan udang. Terdapat di perairan barat Sumatera, selatan Jawa dan selatan Sumbawa.
2. Madidihang atau yellowfin (Thunnus albacore) hidup di laut lepas dan dekat dengan permukaan. Panjang maksimum mencapai 195 cm tetapi umumnya antara 50–150 cm. Pemakan ikan, cumi-cumi dan udang. Banyak terdapat di parairan selatan Makasar, utara Sulawesi, Laut Banda, dan utara Irian Jaya.
3. Tuna mata besar atau bigeye tuna (Thunnus obesus) hidup di perairan laut lepas mulai dari permukaan sampai kedalaman 250 cm. Panjang ikan tuna mata besar bisa mencapai 236 cm, namun yang umum antara 60–180 cm. ikan ini pemakan cumi-cumi dan udang. Banyak terdapat di perairan barat Sumatera, Laut Banda, utara Sulawesi dan utara Irian Jaya.
4. Tuna sirip biru atau southern bluefin tuna (Thunnus maccoyii) hidup di perairan lepas pantai di bawah thermoklin. Panjang maksimum 222 cm tetapi kebanyakan antara 40–180 cm. Pemakan binatang berkulit lunak seperti cumi-cumi, udang serta bebagai jenis ikan mackerel. Daerah penyebarannya meliputi Samudera Hindia.
Migrasi jenis ikan tuna di perairan Indonesia merupakan bagian dari jalur migrasi tuna dunia, karena wilayah Indonesia terletak pada lintasan perbatasan perairan antara Samudera Hindia dan Samudera Pasifik. Migrasi kelompok tuna yang melintasi wilayah perairan pantai dan teritorial terjadi karena perairan tersebut berhubungan langsung dengan perairan kedua samudera tersebut. Beberapa wilayah perairan pantai dan teritorial memiliki sumberdaya perikanan tuna yang besar. Kelompok tuna merupakan jenis kelompok ikan pelagis besar, yang secara komersial dibagi atas kelompok tuna besar dan tuna kecil. Tuna besar terdiri dari jenis ikan tuna mata besar (Thunnus obesus), madidihang (Thunnus albacores), albacore (Thunnus allalunga), dan tuna sirip biru selatan (Thunnus maccoyii) dan tuna abu-abu (Thunnus tonggol), sedangkan yang termasuk tuna kecil adalah cakalang (Katsuwonus pelamis) (DKP 2003).
2.2 Deskripsi dan Klasifikasi Ikan Cakalang (Katsuwonus pelamis)
Cakalang termasuk ikan perenang cepat dan mempunyai sifat yang rakus. Ikan jenis ini sering bergerombol dan hampir bersamaan melakukan ruaya di
sekitar pulau dan jarak jauh. Gerombolan ikan cakalang dapat mencapai 300 ton, cakalang dapat hidup pada kisaran suhu 9–130C, tetapi lebih menyukai suhu antara 26–280C. Oleh karena itu, cakalang banyak ditemukan di daerah khatulistiwa sepanjang tahun. Ukuran ikan cakalang maksimum dapat mencapai 108 cm dengan berat 32,5–45,5 kg, sedangkan ukuran yang umum tertangkap adalah 40–80 cm dengan berat 8–10 kg (Collete dan Nauen 1983).
Klasifikasi ikan cakalang menurut Saanin (1984) adalah sebagai berikut: Subfilum : Vertebrata Kelas : Pisces Subkelas : Dercomorphi Ordo : Percomorphi Subordo : Scombroidea Divisi : Perciformes Subdivisi : Scombroid Family : Scombridae Genus : Katsuwonus
Spesies : Katsuwonus pelamis
Ciri-ciri ikan cakalang yaitu bentuk tubuh fusiform, memanjang dan agak bulat, tapis insang (gill rakers) berjumlah 53-63 pada helai insang pertama. Ikan cakalang mempunyai dua sirip punggung terpisah. Pada sirip punggung yang pertama terdapat 14-16 jari-jari keras, jari-jari lemah pada sirip punggung kedua diikuti oleh 7-8 finlet. Badan tidak bersisik kecuali pada barut badan (corselets) dan lateral line terdapat sisik kecil. Bagian punggung berwarna biru kehitaman (gelap), sisi bawah dan perut keperakan dengan 4-6 buah ban (garis-garis) warna yang membujur. Morfologi ikan cakalang dapat dilihat pada Gambar 1.
Gambar 1: Ikan cakalang (Katsuwonus pelamis) Sumber: Anonim (2007)
2.3 Histamin
Histamin merupakan komponen amin biogenik yaitu bahan aktif yang diproduksi secara biologis melalui proses dekarboksilasi dari asam amino bebas serta terdapat pada berbagai bahan pangan, seperti ikan, daging merah, keju dan makanan fermentasi (Keer et al. 2002). Indriati et al. (2006) menyatakan bahwa histamin merupakan salah satu senyawa biogenik amin yang dianggap sebagai penyebab utama keracunan makanan yang berasal dari ikan, terutama dari kelompok scombroid. Histamin merupakan komponen yang kecil, mempunyai berat molekul rendah yang terdiri dari cincin imidazol dan sisi rantai etilamin. Histamin juga merupakan komponen yang tidak larut air. Histamin merupakan salah satu amin biogenik yang mempunyai pengaruh terhadap fisiologis manusia. Struktur kimia histamin dapat dilihat pada Gambar 2.
Gambar 2. Struktur kimia histamin Sumber: Keer et al. (2002)
2.3.1 Histamin pada ikan
Histamin merupakan indikator utama keracunan scombrotoxin. Scombrotoxin adalah toksin yang dihasilkan terutama oleh ikan-ikan famili scombridae, seperti tuna, cakalang, tongkol, marlin, mackerel, dan jenisnya (Lehane dan Olley 2000).
Ikan-ikan golongan scombridae biasanya memiliki kandungan histidin dengan level tinggi yang akan diubah menjadi histamin oleh bakteri pembentuk histamin yang memiliki enzim histidin dekarboksilase jika kondisi penyimpanan tidak dapat mengontrol pertumbuhan bakteri (McLauchlin et al. 2005). Ada dua macam histidin pada daging ikan, yaitu histidin bebas yang akan diubah menjadi histamin dan histidin yang terikat oleh protein. Faktor-faktor yang mempengaruhi
perombakan histidin menjadi histamin adalah faktor waktu, temperatur, jenis dan banyaknya mikroflora bakteri yang terdapat pada tubuh ikan.
Satuan kadar histamin dalam daging ikan dapat dinyatakan dalam mg/100g atau ppm (mg/1000g). Kandungan histidin bebas pada jaringan ikan tuna lebih tinggi dibandingkan dengan spesies ikan lainnya sehingga meningkatkan potensi peningkatan kadar histamin, khususnya untuk penyimpanan dan penanganan yang salah (Keer et al. 2002).
Proses dekarboksilase histidin menjadi histamin dapat terjadi melalui dua cara yaitu autolisis dan aktivitas bakteri. Proses dekarboksilase histidin menjadi histamin dapat dilihat pada Gambar 3.
Gambar 3. Proses dekarboksilase histidin menjadi histamin Sumber: Keer et al (2002)
(1) Histamin yang terbentuk selama autolisis
Pembentukan histamin dalam tubuh ikan dapat terjadi akibat adanya enzim yang terdapat secara alami dalam jaringan ikan, pembentukan berlangsung selama proses autolisis. Jumlah histamin yang dihasilkan melalui aktivitas enzim selama proses autolisis sangat rendah bila dibandingkan dengan histamin yang dihasilkan oleh aktivitas bakteri selama proses pembusukan berlangsung. Pada kondisi optimum jumlah maksimum histamin yang dapat diproduksi melalui proses autolisis tidak dapat melebihi 10–15 mg/100 gram daging ikan. Pembentukan histamin berbeda untuk setiap spesies ikan, hal ini tergantung pada kandungan histidin, tipe dan banyaknya bakteri yang menunjang pertumbuhan dan reaksi mikroba serta dipengaruhi oleh pH lingkungan (Kimata 1961).
(2) Histamin yang terbentuk karena aktivitas bakteri
Setelah ikan mati, sistem pertahanan tubuhnya tidak bisa lagi melindungi dari serangan bakteri, dan bakteri pembentuk histamin mulai tumbuh dan memproduksi enzim dekarboksilase yang akan menyerang histidin dan asam amino bebas lainnya menjadi histamin yang mempunyai karakter lebih bersifat alkali. Histamin umumnya dibentuk pada temperatur tinggi (>20 0C). Pendinginan dan pembekuan yang cepat, segera setelah ikan mati merupakan tindakan yang sangat penting dalam upaya mencegah pembentukan scombrotoxin (histamin). Histamin tidak akan terbentuk bila ikan selalu disimpan dibawah suhu 5 0C. Pembekuan yang terlalu lama (24 minggu) diduga akan menginaktifkan bakteri pembentuk enzim dekarboksilase dan diduga pula dapat mengurangi pembentukan histamin. Penelitian lebih lanjut menyebutkan bahwa kenaikan pembentukan histamin dapat terus berjalan walaupun dalam keadaan penyimpanan beku (Taylor dan Alasalvar 2002).
Selama proses kemunduran mutu, bakteri memproduksi enzim dekarboksilase yang akan mengubah histidin bebas dan asam amino lain pada daging ikan menjadi histamin dan amin biogenik lain seperti putresin (dari ornitin), kadaverin (dari lisin), serta spermidin dan spermin (dari arginin) (Lehane dan Olley 2000).
Bakteri pembentuk histamin secara alami terdapat pada otot, insang dan isi perut ikan. Kemungkinan besar insang dan isi perut merupakan sumber bakteri ini karena jaringan otot ikan segar biasanya bebas dari mikroorganisme. Bakteri ini akan menyebar ke seluruh bagian tubuh selama proses penanganan. Penyebaran bakteri biasanya terjadi pada saat proses pembuangan insang (gilling) dan penyiangan (gutting) (Sumner et al. 2004). Banyak penelitian menyebutkan bahwa bakteri pembentuk histamin adalah bakteri termofilik, tetapi bakteri
pembentuk histamin dapat tumbuh pada ikan sardin pada temperatur <5 0C ( Shahidi dan Botta 1994 diacu dalam Arisman 2009).
Berbagai jenis bakteri yang mampu menghasilkan enzim histidin dekaroksilase (Hdc) termasuk bakteri Enterobacteriaceae dan Bacillaceae (Staruszkiewicz 2002 dalam Allen 2004). Umumnya genus Bacillus, Citrobacter, Clostridium, Escherichia, Klebsiella, Lactobacillus,Pediacoccus, Photobacterium,
Proteus, Pseudomonas, Salmonella, Shigella dan Streptococcus menunjukkan aktvitas dekarboksilase asam amino (Kanki et al. 2002 diacu dalam Allen 2004).
Bakteri pembentuk histamin dapat tumbuh pada kisaran suhu yang luas. Pertumbuhan bakteri pembentuk histamin berlangsung lebih cepat pada temperatur yang tinggi (21,1 0C) dari pada temperatur rendah (7,2 0C) (FDA 2001). Laporan mengenai suhu optimum dan batas suhu terendah untuk pembentukan histamin sangat bervariasi. Huhu optimum pembentukan histamin adalah pada suhu 25 0C (Kim et al. 1991 diacu dalam Keer et al. 2002). Penyimpanan pada suhu 25 0C selama 24 jam dapat meningkatkan kandungan histamin hingga 120 mg/100 g (Yoghuci et al. 1990 diacu dalam Dwiyitno et al. 2004). Menurut Fletcher et al. (1996) pembentukan histamin pada suhu 0–5 0C sangat kecil bahkan dapat diabaikan. Hasil penelitian Price et al. (1991) juga menunjukkan bahwa pembentukan histamin akan terhambat pada suhu 0 0C atau lebih rendah. Oleh karena itu, Food And DrugAdministration (FDA) menetapkan batas kritis suhu untuk pertumbuhan histamin pada tubuh ikan yaitu 4,4 0C (FDA 2001).
Perbedaan dari jenis bakteri pembentuk histamin pada ikan golongan scombroid disebabkan oleh spesies ikan, prosedur penanganan dan temperatur. Karakteristik mikroflora yang ada dapat dipengaruhi oleh kebiasaan makan, lokasi geografis, musim, temperatur air, dan lain-lain (Lopez -Sabater et al. 1996). Jenis-jenis bakteri pembentuk histamin yang terdapat pada ikan laut dan spesifikasinya dapat dilihat pada Tabel 1.
Tabel 1. Jenis-jenis dan spesifikasi bakteri pembentuk histamin yang terdapat pada ikan laut
Bakteri Spesifikasi Hafnia sp Klebsiella sp Escherichia coli Clostridium sp Lactobacillus sp Enterobacter spp Proteus sp
Gram negatif, fakultatif anaerobik (Hafnia alvei) Gram negatif, fakultatif anaerobik (Klebsiella pneumonia)
Gram negatif, Fakultatif anaerobik
Gram positif, anaerobik (Clostridium perfringens) Gram positif, fakultatif anaerobik (Lactobacillus 30a) Gram negatif, fakultatif anaerobik (Enterobacter aerogenes)
Gram negatif, fakultatif anaerobik (Proteus morganii)
2.3.2 Reaksi fisiologis histamin
Keracunan histamin disebabkan oleh konsumsi ikan yang mengandung histamin dengan level yang tinggi (Bremer et al. 2003). Gejala keracunan histamin meliputi sakit kepala, kejang, mual, wajah dan leher kemerah-merahan, tubuh gatal-gatal, mulut dan kerongkongan terasa terbakar, bibir membengkak, badan lemas dan muntah-muntah (Eitenmiller et al. 1982). Gejala keracunan histamin dapat terjadi sangat cepat, sekitar 30 menit setelah mengkonsumsi ikan yang mengandung histamin tinggi. Kemudian gejala agak menurun antara 3 hingga 24 jam setelah konsumsi, tetapi mungkin juga hingga beberapa hari (Bremer et al. 2003).
Histamin pada ikan yang busuk dapat menimbulkan keracunan jika terdapat sekitar 100 mg dalam 100g sampel daging ikan yang diuji (Kimata 1961). Food And Drug Administration (FDA) menetapkan bahwa untuk ikan tuna, mahi-mahi dan ikan sejenis, 5 mg histamin/100 g daging ikan merupakan level yang harus diwaspadai sebagai indikator terjadinya dekomposisi, sedangkan 50 mg histamin/100g daging ikan merupakan level yang membahayakan atau dapat menimbulkan keracunan. Oleh karena itu, jika ditemukan ikan dengan kandungan 5 mg histamin/100 g daging ikan pada satu unit, maka kemungkinan pada unit yang lain, level histamin dapat mencapai lebih dari 50 mg/100 g (FDA 2002). Tingkat bahaya histamin per 100 g daging ikan dapat dilihat pada Tabel 2.
Tabel 2. Tingkat bahaya histamin per 100 g daging ikan
Kadar histamin per 100 g Tingkatan bahaya
< 5 mg 5-20 mg 20-100 mg > 100 mg Aman dikonsumsi Kemungkinan toksik Berpeluang toksik Toksik
Sumber:Shalaby (1996) diacu dalam Sumner et al. (2004)
2.4 Deoxyribonucleic Acid (DNA)
Asam deoksiribonukleat, lebih dikenal dengan DNA adalah sejenis asam nukleat yang tergolong biomolekul utama penyusun setiap organisme. Di dalam sel, DNA umumnya terletak di dalam inti sel. Secara garis besar, peran DNA di dalam sebuah sel adalah sebagai materi genetik. Artinya, DNA menyimpan cetak
biru bagi segala aktivitas sel. Ini berlaku umum bagi setiap organisme. Diantara perkecualian yang menonjol adalah beberapa jenis virus (Gregory et al. 2006).
Asam deoksiribonukleat (DNA) merupakan persenyawaan kimia yang paling penting pada mahkluk hidup, yang membawa keterangan genetik dari sel khususnya atau dari mahkluk dalam keseluruhannya dari satu generasi ke generasi berikutnya. Molekul DNA pertama kali diisolasi oleh F. Miescher (1869) dari sel spermatozoa dan dari nukleus sel-sel darah merah burung (Suryo 2008).
Banyaknya DNA biasanya diukur dengan pikogram, yaitu suatu mikrounit dari berat. Satu pikogram (1 pg) adalah sama dengan 10-12 gram. Ukuran molekul DNA berbeda-beda dari satu spesies ke spesies lainnya. Pada mitokondria, molekul DNA mempunyai ukuran 5µm, pada virus lebih panjang, sedangkan molekul DNA tunggal pada sel bakteri berukuran 1,4 mm (Suryo 2008).
DNA merupakan susunan kimia makromolekul yang kompleks dan terdiri dari tiga macam molekul yaitu:
1. Gula pentosa, yang dikenal sebagai deoksiribosa 2. Asam fosfat
3. Basa nitrogen, yang dapat dibedakan atas dua tipe dasar a. Pirimidin, basa ini dibedakan atas sitosin (C) dan timin (T) b. Purin, basa ini dibedakan atas adenin (A) dan guanin (G)
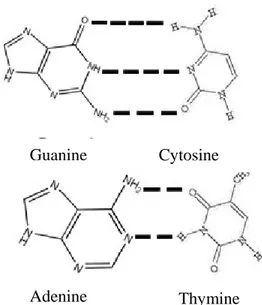
Pirimidin (sitosin dan timin) dan purin (adenin dan guanin) membentuk rangkain kimiawi dengan deoksiribosa. Atom C 1’ dari gula deoksiribosa akan berhubungan dengan atom nitrogen pada sisi 1 dari pirimidin atau pada posisi 9 dari purin. Molekul seperti ini disebut nukleosida atau deoksiribosa dan mereka ini dapat berlaku sebagai prekursor elementer untuk sintesa DNA. Akan tetapi sebelum suatu nukleosida dapat menjadi bagian dari suatu molekul DNA, mereka harus bergabung dengan gugus fosfat untuk membentuk suatu nukleotida atau deoksiribosanukleotida (Suryo 2008). Struktur kimia basa purin (adenin dan guanin) dan pirimidin (sitosin) dapat dilihat pada Gambar 4.
Gambar 4. Struktur kimia basa purin dan pirimidin Sumber: Keer et al. (2002)
Telah diketahui bahwa DNA adalah bahan genetik yang memberi informasi genetik dari sel ke sel dan dari satu generasi ke generasi berikutnya. Sesungguhnya informasi genetik itu letaknya di dalam molekul DNA. Tulang punggung fosfat-deoksiribosa selalu sama untuk berbagai segmen dari molekul DNA. Tetapi basa nitrogennya berbeda. Hal ini yang menyebabkan informasi genetik tergantung dari urutan basa nitrogen yang menyusun segmen molekul DNA (Suryo 2008). Struktur molekul DNA dapat dilihat pada Gambar 5.
Gambar 5. Struktur molekul DNA Sumber: Doherty (2007)
Guanine Cytosine
2.5 Metode isolasi bakteri
Bakteri merupakan organisme prokariot yang paling luas penyebarannya di alam. Bakteri tersusun atas dinding sel dan inti sel. Di sebelah luar dinding sel terdapat selubung atau kapsul. Di dalam sel bakteri terdapat membran dalam dan organel membran seperti kloroplas dan mitokondria. Semua jenis bakteri memiliki beragam bentuk dan tipe sel. Terdapat tiga bentuk dasar bakteri, yaitu batang (bacillus), bulat (coccus), dan spiral (spiral). Beberapa jenis bakteri tertentu menunjukkan adanya penataan sel seperti berpasangan, gerombol, rantai atau filamen. Bakteri yang biasa diteliti di laboratorium berukuran antara 0,5-2 µm dan panjang 1-5 µm (Irianto 2007).
Berdasarkan perbedaan komposisi dan dinding sel, bakteri dibedakan menjadi bakteri gram positif dan gram negatif. Bakteri gram positif mempunyai struktur dinding sel yang tebal (15-80 µm) dan berlapis tunggal, dengan kompisisi dinding sel terdiri dari lipid, peptidoglikan dan asam tekoat. Kandungan lipid pada gram positif relatif rendah (1-4%), peptidoglikan sebagai lapisan tunggal memiliki jumlah lebih dari 50% berat kering sel bakteri. Bakteri gram positif rentan terhadap penisilin, namun lebih resisten gangguan fisik. Persyaratan nutriennya relatif lebih rumit pada banyak spesies (Pelczar dan Chan 2006).
Untuk dapat mencirikan dan mengidentifikasi suatu spesies bakteri, maka spesies tersebut harus dapat dipisahkan dari organisme lain yang selanjutnya ditumbuhkan menjadi biakan murni. Biakan murni adalah biakan yang sel-selnya berasal dari pembelahan satu sel tunggal. Semua metode mikrobiologis yang digunakan untuk menelaah dan mengidentifikasi mikroorganisme termasuk penelaahan ciri-ciri kultural, morfologis dan fisiologis memerlukan suatu populasi yang terdiri dari satu macam mikroorganisme saja (Hadioetomo 1993).
Sesungguhnya ada beberapa metode untuk memperoleh biakan murni dari suatu biakan campuran. Dua diantaranya yang paling sering digunakan adalah teknik cawan gores dan cawan tuang. Kedua metode ini berdasarkan pada prinsip yang sama yaitu mengencerkan organisme sedemikian sehingga dapat dipisahkan dari organisme lainnya, dengan anggapan bahwa setiap koloni terpisah yang tampak pada cawan petri setelah inkubasi berasal dari satu sel tunggal (Hadioetomo 1993).
Mikroorganisme dibiakkan pada bahan nutrien yang disebut medium. Banyak jenis medium yang tersedia, namun pemakainnya bergantung pada banyak faktor salah satunya adalah jenis mikroorganisme yang akan ditumbuhkan. Bahan yang diinokulasikan pada medium disebut inokulum. Setelah menginokulasikan mikroorganisme pada medium agar dengan metode cawan gores dan cawan tuang, maka sel-sel bakteri akan terpisah dengan sendirinya. Setelah inkubasi, sel-sel bakteri memperbanyak diri sedemikian cepatnya sehingga dalam jangka waktu 18–24 jam terbentuk massa sel yang dapat dilihat dan dinamakan koloni. Setiap koloni yang berlainan dapat mewakili jenis organisme yang berbeda-beda. Setiap koloni merupakan biakan murni satu macam mikroorganisme (Pelczar dan Chan 2006).
Semua bentuk kehidupan dari mikroorganisme sampai kepada manusia, mempunyai persamaan dalam hal persyaratan nutrisi dalam bentuk zat-zat kimiawi yang diperlukan untuk pertumbuhan. Tipe nutrisi yang dibutuhkan oleh bakteri diantaranya adalah energi, karbon, nitrogen, belerang, unsur logam, vitamin dan air. Selain menyediakan nutrien yang sesuai untuk kultivasi bakteri, juga diperlukan kondisi fisik yang memungkinkan pertumbuhan optimum. Bakteri tidak hanya bervariasi dalam persyaratan nutrisinya, tetapi juga menunjukkan respon yang berbeda-beda terhadap kondisi fisik di dalam lingkungannya. Untuk keberhasilan kultivasi berbagai tipe bakteri, dibutuhkan suatu kombinasi nutrien serta lingkungan fisik yang sesuai seperti suhu dan derajat keasaman (pH) (Pelczar dan Chan 2006).
Semua proses pertumbuhan bergantung pada reaksi kimiawi. Karena laju reaksi-reaksi ini dipengaruhi oleh suhu, maka pola pertumbuhan bakteri sangat dipengaruhi oleh suhu. Suhu juga mempengaruhi laju pertumbuhan dan jumlah total pertumbuhan organisme. Keragaman suhu dapat juga mengubah proses-proses metabolik tertentu serta morfologi sel. Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas dasar ini maka bakteri dapat diklasifikasikan sebagai: psikrofil yang tumbuh pada suhu 00-300C; mesofil yang tumbuh pada 250-400C; dan termofil yang tumbuh pada suhu di atas 400C. Respon pertumbuhan bakteri terhadap suhu bergantung pada jenis bakterinya. Suhu inkubasi yang memungkinkan pertumbuhan tercepat selama periode waktu yang singkat
(12 sampai 24 jam) dikenal sebagai suhu pertumbuhan optimum (Pelczar dan Chan 2006).
Derajat keasaman (pH) optimum pertumbuhan bagi kebanyakan bakteri terletak antara 6.5 sampai 7.5. Namun, beberapa spesies dapat tumbuh dalam keadaan sangat asam atau sangat alkalin. Bagi kebanyakan spesies, nilai pH minimum dan maksimum adalah 4 dan 9 (Pelczar dan Chan 2006).
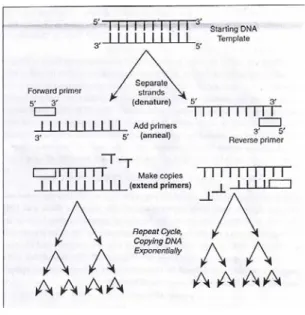
2.6 Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) adalah metode untuk memperbanyak sekuen spesifik dari nukleotida (Singleton dan Sainbury 2006). Proses enzimatik tersebut terjadi secara in vitro melalui penggunaan sepasang primer oligonukleotida yang menghibridisasi pita berlawanan dan mengapit DNA target. Potongan yang diperbanyak akan ditentukan oleh primer tersebut, dan merupakan sekuen dari DNA target yang diapit oleh kedua primer. Proses PCR juga menggunakan enzim DNA polymerase yang stabil terhadap suhu (thermostable DNA polymerase) untuk perbanyakan fragmen DNA secara eksponensial dari cetakan (template) yang lebih panjang. Taq polymerase adalah salah satu DNA polymerase yang stabil suhu dan semula diisolasi dari bakteri Thermophilus aquaticus. Bakteri tersebut berkembang di mata air panas pada suhu yang mendekati titik didih air, sehingga semua enzim pada organisme ini telah berevolusi untuk toleran terhadap suhu tinggi. Reaksi sintesis pada PCR diulang beberapa kali (siklus). Produk dari siklus sintesis sebelumnya bertindak sebagai cetakan untuk berikutnya, mengakibatkan perbanyakan eksponensial terhadap daerah target DNA (Dale dan Schantz 2002).
Empat komponen utama pada proses PCR adalah: (1) DNA cetakan (template), yaitu fragmen (potongan) DNA yang akan dilipatgandakan; (2) pasangan primer oligonukleotida, yang akan melewati sintesis rantai DNA; (3) deoksiribonukleotida trifosfat (dNTP), terdiri atas dATP, dCTP, dGTP, dTTP; dan (4) enzim DNA polymerase, sebagai katalis reaksi sintesis DNA. Komponen lainnya yang juga penting adalah MgCl2 dan senyawa buffer. Setiap siklus sintesis
terdiri dari tiga tahapan yaitu denaturasi, annealing (penempelan atau hibridisasi primer pada DNA cetakan) dan ekstensi/elongasi (perpanjangan atausintesis untai komplemen dari DNA target). Masing-masing tahapan tersebut akan ditentukan
oleh suhu dan lama waktu yang dibutuhkan (Dale dan Schantz 2002). Mekanisme reaksi PCR dapat dilihat pada Gambar 6.
Gambar 6. Mekanisme reaksi PCR Sumber: Keer et al. (2002)
2.7 Analisis Produk PCR (Elektroforesis)
Elektroforesis adalah proses migrasi dari fragmen DNA di dalam gel yang direndam dalam larutan penyangga. Fragmen DNA yang lebih kecil berat molekulnya akan berjalan lebih cepat dari DNA yang lebih besar. Perjalanan molekul DNA di dalam gel mengikuti arus listrik dari kutub negatif menuju kutub positif. Semakin besar tegangan arus listrik, perjalanan molekul DNA semakin cepat, demikian pula sebaliknya (Sulandari dan Zein 2003).
Ada bermacam-macam zat kimia yang digunakan sebagai gel di dalam proses elektroforesis. Penggunaan jenis gel disesuaikan dengan tujuan yang akan dicapai. Jenis gel yang biasa digunakan adalah elektroforesis gel agarosa dengan visualisasi menggunakan ethidium bromida dan elektroforesis gel poliakrilamida dengan visualisasi menggunakan silver staining. Kedua cara elektroforesis ini banyak digunakan dalam visualisasi produk PCR (Sulandari dan Zein 2003).
Teknik ini sederhana, cepat terbentuk dan mampu memisahkan campuran potongan DNA sesuai dengan ukurannya secara akurat bila dibandingkan dengan densitas gradien sentrifugasi. Selanjutnya, lokasi DNA dalam gel tersebut dapat diidentifikasi secara langsung dengan pewarna berfluoresen. Untuk mendeteksi
potongan-potongan DNA berupa pita DNA pada gel agarosa digunakan pewarna yang mengandung fluoresen dengan konsentrasi rendah, seperti intercalating agent ethidium bromida (EtBr). Hanya sedikit DNA ± 1ng dapat dideteksi secara langsung dengan cara gel diletakkan pada media UV-transilluminator (Fatchiyah 2006).
Rentang ukuran yang efektif dari gel ditentukan oleh komposisinya. Gel agarosa dapat digunakan untuk memisahkan molekul asam nukleat yang memiliki perbedaan beberapa ratus pasang basa. Sedangkan untuk molekul-molekul lebih kecil yang ukurannya sama, hingga hanya berbeda beberapa puluh pasang basa, dapat digunakan gel polyacrylamide (Dale dan Schantz 2002).
Elektroforesis gel agarosa dapat digunakan untuk menganalisis komposisi dan kualitas dari sampel asam nukleat. Secara khusus, hal ini sangat membantu untuk menentukan ukuran fragmen DNA dari pendekatan restriksi (restriction digest) untuk produk reaksi PCR. Untuk tujuan ini diperlukan kalibrasi terhadap gel dengan menjalankan (running) penanda (marker) standar yang mengandung fragmen dari ukuran DNA yang diketahui (Dale dan Schantz 2002).
Pewarna seperti ethidium bromida biasanya digunakan untuk mendeteksi maupun mengkuantitasi asam nukleat. Ethidium bromida memiliki struktur cincin datar yang mampu menumpuk (stack) diantara basa-basa dalam asam nukleat; hal ini dikenal sebagai intercalation. Selanjutnya, pewarna dapat dideteksi melalui pendarannya (fluorosence), pada daerah spektrum merah-oranye ketika dipaparkan pada iradiasi UV. Hal ini merupakan metode yang paling luas digunakan untuk pewarnaan gel elektroforesis dan juga dapat digunakan untuk menduga jumlah DNA (atau RNA) dalam sampel dengan membandingkan intensitas dari peredaran sampel yang telah diketahui konsentrasinya dan dimuatkan pada gel yang sama (Dale dan Schantz 2002).
2.8 DNA Sequencing
Satu dari terobosan utama dalam genetika molekuler adalah perkembangan metode mensekuens potongan DNA secara cepat. Pada dasarnya ada dua metode yang telah dikembangkan, yaitu metode Maxam-Gilbert dan metode Sanger. Metode Sanger lebih sering digunakan karena lebih mudah, praktis dan efisien. Metode Sanger menggunakan pendekatan sintesis molekul DNA baru dan
pemberhentian sintesis tersebut pada basa tertentu. Untuk mensintesis molekul DNA, diperlukan dNTPs (Deoxynucleoside Triphosphates) sebagai bahan utamanya, sedangkan untuk menghentikan proses sintesis diperlukan ddNTP (Dideeoxynucleoside Triphosphates). Hasil akhir dari reaksi tersebut adalah sejumlah potongan DNA yang panjangnya bervariasi tetapi semuanya berakhir dengan nukleotida A (jika dNTP dicampur dengan dATP), berakhir dengan nukleotida C (jika dNTP dicampur dengan dCTP), berakhir dengan nukleotida G (jika dNTP dicampur dengan dGTP), berakhir dengan nukleotida T (jika dNTP dicampur dengan dTTP) (Sulandari dan Zein 2003).
3. METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2010 di Laboratorium Mikrobiologi, Biokimia dan Bioteknologi Hasil Perairan Departemen Teknologi Hasil Perairan, Laboratorium Genetika Ikan Fakultas Perikanan dan Ilmu Kelautan dan Laboratorium Penyakit Hewan dan Laboratorium Kultur Jaringan Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan antara lain inkubator, autoklaf, erlenmeyer, pipet 10 ml, pipet mikro, bulb, tabung reaksi, cawan petri, gelas ukur, pemanas bunsen, jarum ose, gelas piala, kompor listrik, alat sterilisasi (autoklaf), mikroskop, gelas objek, aluminium foil, kapas, shaker, sentrifuse, vortex, thermocycler dan elektroforesis. Gambar alat yang digunakan dapat dilihat pada Lampiran 1.
Bahan utama yang digunakan adalah ikan laut jenis tuna (Bluefin, Albacore, Bigeye dan Yellowfin) dan cakalang (Katsuwonus pelamis). Morfologi ikan tuna dapat dilihat pada gambar 7; 8; 9 dan 10. Masing-masing daging ikan diambil sebanyak 10 gram untuk dijadikan sampel. Bahan-bahan yang digunakan pada penelitian ini adalah media agar TSA (Tryptic Soy Agar), larutan garam fisiologis, aquades, media agar NB (Nutrient Broth), bahan untuk uji pewarnaan gram (Kristal violet, lugol iodine, safranin, etil alkohol dan akuades), TE, lisozim, agarosa, akuabidestilata, SDS10%, NaCl 5M, CTAB 10%, kloroform, isopropanol, etanol 70%, TBE, aquabides free nuclease, mix DNA, primer Hdc-Forward dan Hdc-Reverse, primer 106-107 (Takahashi et al. 2003), tisu, etidium bromida, DNA (marker DNA) dan ethidium bromida. Cara pembuatan larutan dapat dilihat pada Lampiran 2.
Gambar 7. Ikan tuna albacore (Thunnus allalunga) Sumber: Koleksi pribadi (2009)
Gambar 8. Ikan madidihang (Thunnus albacore) Sumber: Koleksi pribadi (2009)
Gambar 9: Ikan tuna mata besar (Thunnus obesus) Sumber: Koleksi pribadi (2009)
Gambar 10: Ikan tuna sirip biru (Thunnus maccoyii) Sumber: Koleksi pribadi (2009)
3.3 Prosedur Kerja
Prosedur kerja pada penelitian ini terdiri atas beberapa tahap, yaitu isolasi bakteri; ekstraksi dan purifikasi DNA bakteri; amplifikasi DNA bakteri target; visualisasi DNA dengan elektroforesis gel agarosa dan DNA-Sequencing.
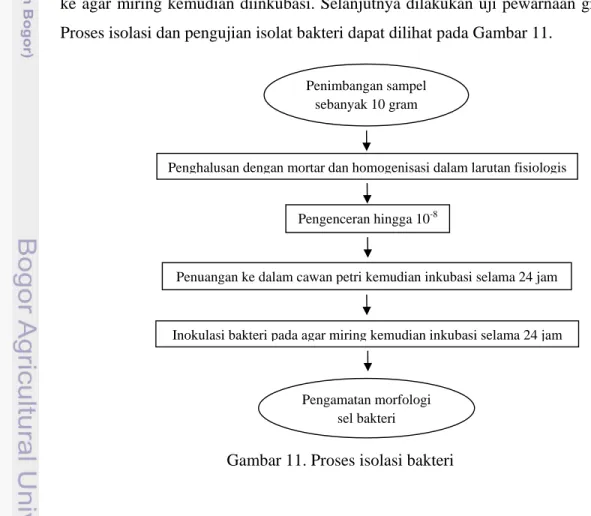
3.3.1Isolasi dan karakterisasi isolat bakteri
Isolasi bakteri terdiri dari 3 tahap yaitu: 1). Persiapan media dan persiapan sampel, 2). Pengenceran dan 3). Penuangan ke dalam cawan.
(1) Isolasi bakteri
(a). Persiapan media (Trypticase Soy Agar) dan persiapan sampel
Untuk menstimulir pertumbuhan bakteri, medium yang digunakan harus mengandung komponen-komponen yang yang dibutuhkan oleh bakteri tersebut misalnya unsur karbon dan nitrogen. Sebanyak 10 gram sampel masing-masing diambil dari daging ikan tuna dan cakalang, kemudian dihaluskan dengan cara menggeruskan menggunakan mortar yang steril sampai halus. Sampel yang sudah dihaluskan dimasukkan ke dalam erlenmeyer yang sudah berisi larutan fisiologis sebanyak 9 ml. Langkah selanjutnya dilakukan pengenceran.
(b). Pengenceran
Sampel daging dengan berat masing-masing 10 gram yang sudah dihaluskan dimasukkan ke dalam erlenmeyer dan ditambahkan larutan fisiologis sebanyak 9 ml. Sampel yang sudah diencerkan di pipet sebanyak 1 ml untuk dimasukkan ke dalam tabung reaksi yang sudah berisi garam fisiologi 9 ml sehingga menjadi pengenceran 10-2 kemudian dihomogenkan. Selanjutnya sampel dipipet sebanyak 1 ml dari pengenceran 10-2 untuk dimasukkan ke dalam tabung reaksi yang berisi garam fisiologi 9 ml sehingga menjadi pengenceran 10-3 kemudian dihomogenkan. Demikian selanjutnya, dengan cara yang sama dibuat hingga pengenceran 10-8. Tujuan dari pengenceran ini adalah untuk menurunkan jumlah bakteri sehingga pada pengenceran akhir akan didapatkan isolat murni dengan jumlah koloni yang sedikit. Pada saat melakukan pengenceran semua alat dan lingkungan harus dalam keadaan steril agar tidak terkontaminasi oleh mikroorganisme lainnya.
(c). Penuangan ke dalam cawan
Penuangan larutan sampel ke dalam cawan petri dilakukan dengan tujuan untuk menumbuhkan koloni bakteri dari sampel ikan tuna dan cakalang. Langkah dalam melakukan penuangan sampel yang sudah diencerkan ke dalam cawan yaitu, sampel dari pengenceran 10-4-10-8 sebanyak 1 ml dituangkan ke dalam cawan petri yang sudah berisi Trypticase Soy Agar (TSA) beku sementara itu sekelilingnya dipanaskan menggunakan bunsen agar tidak terkontaminasi. Pengenceran 10-1-10-3 tidak dituangkan ke dalam cawan petri karena dianggap jumlah mikroba pada pengenceran tersebut masih tinggi atau tidak dapat dihitung (TBUD). Selanjutnya dilakukan inkubasi selama 24 jam.
(2) Karakterisasi isolat bakteri
Setelah dilakukan inkubasi selama 24 jam, koloni bakteri yang memiliki bentuk, warna dan ukuran dominan kemudian diisolasi untuk mendapatkan isolat murni bakteri. Untuk menyatakan isolat tersebut sudah murni dilakukan uji pewarnaan gram. Koloni-koloni yang telah terpisah tunggal diinokulasi kembali ke agar miring kemudian diinkubasi. Selanjutnya dilakukan uji pewarnaan gram. Proses isolasi dan pengujian isolat bakteri dapat dilihat pada Gambar 11.
Gambar 11. Proses isolasi bakteri Penimbangan sampel
sebanyak 10 gram
Pengamatan morfologi sel bakteri
Penghalusan dengan mortar dan homogenisasi dalam larutan fisiologis
Inokulasi bakteri pada agar miring kemudian inkubasi selama 24 jam Pengenceran hingga 10-8
(a) Morfologi koloni
Pengamatan morfologi koloni dilakukan untuk mengetahui bentuk koloni dari atas, bantuk tepi, bentuk elevasi dan warna koloni secara visual.
(b) Morfologi sel
Pengamatan morfologi sel meliputi bentuk sel dan pewarnaan gram. Hasil preparat bakteri yang telah dibuat kemudian diamati bentuk selnya secara mikroskopik sehingga dapat diketahui bentuknya (kokus, batang atau spiral).
Pewarnaan gram ini bertujuan untuk menentukan karakteristik mikroskopik setiap galur bakteri seperti bentuknya. Proses pewarnaan gram menggunakan empat jenis larutan, yaitu zat warna basa (Kristal violet), mordant (lugol), pencuci zat warna (alkohol), dan zat warna lain (safranin).
Tahap-tahap pewarnaan gram adalah sebagai berikut: mula-mula kaca objek dibersihkan dengan kapas yang telah diberi alkohol. Selanjutnya diberi kode (label) sesuai jenis sampel yang digunakan. Biakan bakteri pada agar miring diambil menggunakan jarum ose steril dan dipindahkan di bagian tengah kaca objek yang sebelumnya telah ditetesi larutan garam fisiologis steril. Kemudian preparat tersebut dikeringkan dengan cara fiksasi di atas bunsen. Kemudian ditetesi dengan larutan kristal violet dan dibiarkan selama 1 menit. Selanjutnya dibilas dengan akuades dengan cara memegang kaca objek pada posisi miring dan dikeringkan. Preparat tersebut selanjutnya ditetesi dengan lugol dan dibiarkan selama 1 menit lalu dibilas dengan akuades. Kemudian preparat ditetesi larutan pemucat warna yaitu alkohol 95%, selanjutnya dicuci dengan akuades dan dikeringkan. Preparat ditetesi larutan safranin selama 2 menit lalu dibilas dengan alkohol dan dikeringkan dengan menggunakan kertas tissu secara perlahan-lahan.
Kemudian diamati bentuk selnya menggunakan mikroskop dengan pembesaran 100x10. Sebelumnya preparat ditetesi dengan minyak imersi. Bakteri dinyatakan bersifat gram negatif apabila warna selnya merah dan dinyatakan gram posistif apabila warna selnya ungu. Proses pewarnaan gram bakteri dapat dilihat pada Gambar 12.
3.3.2 Ekstraksi dan purifikasi DNA isolat bakteri
Ekstraksi DNA bakteri target menggunakan metode CTAB 10% (Sambrook et al. 2001). Purifikasi DNA bakteri menggunakan beberapa bahan kimia seperti SDS, lisozim, NaCl, kloroform dan etanol. Sel bakteri dikultivasikan ke media Nutrient Broth (NB) cair 50 ml. Proses inkubasi dilakukan pada suhu ruang dan digoyang (shaker) selama 24 jam. Kultur hasil inkubasi kemudian disentrifugasi untuk memisahkan antara pelet sel bakteri dan supernatannya. Supernatan yang dihasilkan dibuang. Pelet kemudian diresuspensi dengan penambahan 500 µl buffer TE dan 40 µl lisozim dan diinkubasi 37 0C selama 1 jam. Kemudian ditambahkan 100 µl SDS 10%, 100 µl NaCl 5M, 80 µl CTAB 10% dan diinkubasi pada suhu 68 0C selama 10 menit.
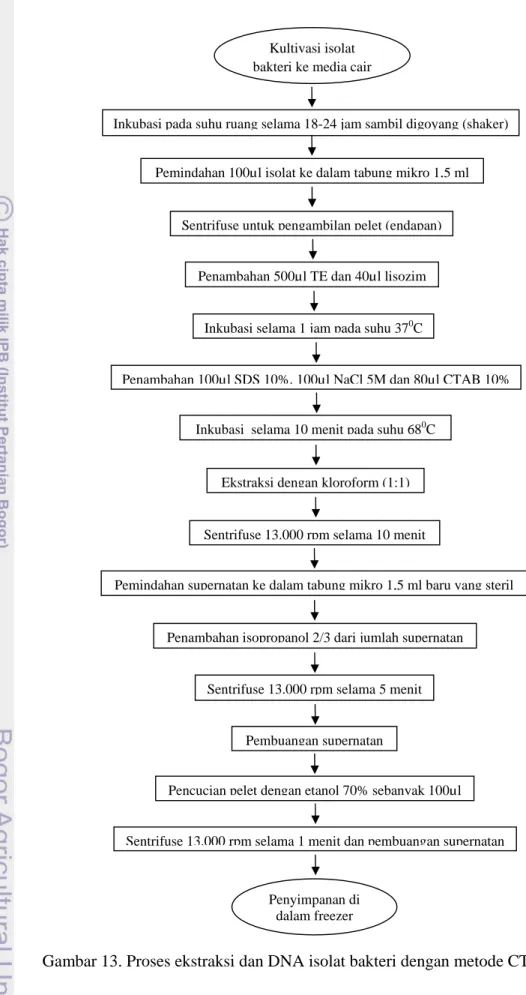
Suspensi yang telah diinkubasi diekstrak dengan menggunakan kloroform (1:1) kemudian tabung dibolak-balik beberapa kali dan selanjutnya disentrifuse 13.000 rpm selama 10 menit. Supernatan yang terbentuk dipindahkan ke tabung mikro 1,5 ml baru yang steril. Selanjutnya ditambahkan isopropanol dengan volume 2/3 dari jumlah supernatan. Suspensi tersebut kemudian disentrifuse selama 5 menit 13.000 rpm. Supernatan yang dihasilkan dibuang dan dilakukan pencucian dengan etanol 70% 100 µl. Kemudian suspensi disentrifuse 13.000 rpm selama 1 menit, supernatan dibuang dan pelet yang telah merupakan kromosom bakteri diinkubasi selama 24 jam di dalam freezer. Proses ekstraksi dan purifikasi DNA isolat bakteri dapat dilihat pada Gambar 13.
3.3.3 Amplifikasi DNA bakteri target
Tahapan yang kedua dari proses identifikasi adalah melakukan PCR dengan menggunakan dua jenis primer spesifik dengan gen target yaitu hdc (histidin dekarboksilase) pada panjang basa 709 bp dengan urutan basa primer
forwardnya adalah 5’-TCHATYARY AACTGYGGT GACTGGRG-3’ dan urutan
basa primer reversenya 5’-CCCACAKCATBARWGGDGTRTGRCC-3’.
Sedangkan panjang basa DNA target dari primer 106-107 adalah 534 bp. Urutan basa primer 106 adalah 5’AAYTCNTTYGAYTTYGARAARGARG 3’ dan primer 107 adalah 5’-ATNGGNGANCCDATCATYTTRTGNCC-3’ (Takahashi et al. 2003). Berikut ini adalah tabel jumlah bahan yang digunakan untuk
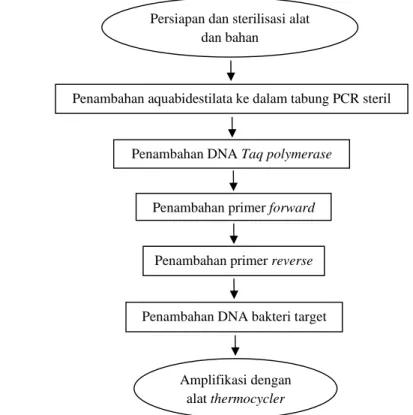
masing-masing primer dalam reaksi PCR dan diagram alir proses amplifikasi PCR dengan menggunakan alat thermocycler yang disajikan pada Gambar 14.
Tabel 3. Jumlah bahan yang digunakan untuk amplifikasi DNA bakteri
Bahan Jumlah (µl)
Aquabidestilata free nucleic DNA Taq polymerase Primer forward Primer reverse DNA bakteri 8,5 12,5 1 1 2 Total 25
Gambar 12. Proses pewarnaan gram isolat bakteri Persiapan alat dan bahan
Pengamatan
Penambahan dengan larutan Kristal violet
Penambahan dengan larutan safranin Penambahan dengan larutan lugol
Pembilasan dengan aquades
Penambahan dengan alkohol 95%
Pemindahan 1 ose bakteri ke kaca objek dan kemudian difiksasi
Pembilasan dengan alkohol dan pengeringan dengan kertas tissu Pembilasan dengan aquades
Gambar 13. Proses ekstraksi dan DNA isolat bakteri dengan metode CTAB 10% Kultivasi isolat
bakteri ke media cair
Inkubasi pada suhu ruang selama 18-24 jam sambil digoyang (shaker)
Penyimpanan di dalam freezer
Penambahan 100µl SDS 10%, 100µl NaCl 5M dan 80µl CTAB 10% Inkubasi selama 1 jam pada suhu 370C
Inkubasi selama 10 menit pada suhu 680C Pemindahan 100µl isolat ke dalam tabung mikro 1,5 ml
Pencucian pelet dengan etanol 70% sebanyak 100µl Pembuangan supernatan
Sentrifuse untuk pengambilan pelet (endapan)
Penambahan 500µl TE dan 40µl lisozim
Ekstraksi dengan kloroform (1:1)
Sentrifuse 13.000 rpm selama 5 menit
Pemindahan supernatan ke dalam tabung mikro 1,5 ml baru yang steril
Sentrifuse 13.000 rpm selama 1 menit dan pembuangan supernatan Sentrifuse 13.000 rpm selama 10 menit
Gambar 14. Proses amplifikasi DNA dengan menggunakan alat thermocycler
3.3.4 Visualisasi DNA dengan elektroforesis gel agarosa
Proses visualisasi DNA hasil ekstraksi dengan menggunakan agarosa 2%. Sebanyak 2g agarosa dimasukkan ke dalam erlenmeyer, selanjutnya dilarutkan dengan 100 ml TBE 1x yang telah diukur dengan gelas ukur dan diaduk merata. Gel agarosa tersebut dimasukkan ke dalam microwave selama 5-7 menit sampai semua agarosa terlarut. Setelah agak dingin, gel agarosa dimasukkan ke dalam cetakan. Setelah benar-benar dingin agarosa diangkat dari cetakan. Agar yang sudah mengeras dipindahkan dari bak pencetak ke dalam elektroforesis yang sudah berisi larutan buffer TBE 1x hingga terendam.
Elektroforesis dihubungkan ke power supply yang diatur pada tegangan 400 volt dan dijalankan selama 1 jam untuk melajukan partikel DNA sampai dicapai resolusi yang diinginkan. Pengamatan terhadap hasil elektroforesis dilakukan dengan menggunakan sinar UV. Hasil positif ditunjukkan dengan adanya pita berpendar pada saat penyinaran. Proses visualisasi ini bertujuan untuk mengetahui adanya keberadaan dari gen target penghasil histamin dari
Persiapan dan sterilisasi alat dan bahan
Penambahan aquabidestilata ke dalam tabung PCR steril
Amplifikasi dengan alat thermocycler Penambahan DNA bakteri target
Penambahan primer reverse Penambahan DNA Taq polymerase
bakteri yang telah diisolasi sebelumnya. Keberadaan dari gen target tersebut ditandai oleh pita yang berwarna terang pada agarosa.
Proses elektroforesis akan menganalisis dan memisahkan DNA berdasarkan berat atau panjang DNA. Molekul DNA bergerak dari elektroda negatif menuju elektroda positif. Kecepatan pergerakan DNA berdasarkan berat dan panjang DNA. DNA yang berukuran kecil akan lebih cepat bergerak, sedangkan DNA dengan berat molekul lebih besar akan semakin sulit melewati pori atau rongga agar .
3.3.5 DNA-Sequencing
Metode ini dilakukan untuk mengetahui urutan basa nitrogen dari gen bakteri yang mampu memproduksi enzim histidin dekarboksilase (hdc) yang telah diisolasi pada awal penelitian. Proses sequencing terhadap DNA bakteri pengkode enzim histidin dekarboksilase dilakukan pada suatu lembaga penelitian biologi molekuler “Macrogen Inc” yang berlokasi di Korea. Hasil sequencing dicocokkan dengan bank data National Center for Biotechnolgy Information (NCBI).
4. HASIL DAN PEMBAHASAN
4.1 Karakteristik isolat bakteri dari ikan tuna dan cakalang 4.1.1 Morfologi isolat bakteri
Secara alamiah, mikroba terdapat dalam bentuk campuran dari berbagai jenis. Untuk mempelajari sifat-sifat pertumbuhan, morfologi dan sifat fisiologis mikroba, maka masing-masing mikroba tersebut harus dipisahkan satu dengan yang lainnya, sehingga terbentuk kultur murni yaitu suatu biakan yang terdiri dari sel-sel satu spesies atau satu galur mikroba (Pelczar dan Chan 2006).
Tahap isolasi pada cawan petri bertujuan untuk mendapatkan isolat bakteri yang diinginkan. Setelah dilakukan proses isolasi bakteri dari ikan tuna serta ikan cakalang, selanjutnya dilakukan inkubasi selama 24 jam untuk menumbuhkan bakteri yang telah diisolasi sebelumnya. Tabel 4 menunjukkan karakteristik hasil isolasi bakteri dari kelima jenis ikan tersebut.
Tabel 4. Karakterisasi isolat bakteri ikan tuna dan cakalang
Jenis ikan Kode Bentuk
permukaan
Bentuk tepian
Bentuk koloni Warna
Bluefin tuna Bf 1 Bf 2 Bf 3 Bf 4 Bf 5 Cembung Cembung Cembung Cembung Cembung Licin Licin Licin Licin Licin Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Merah Kuning Merah Putih Krem Albacore Alb 1 Alb 2 Alb 3 Alb 4 Alb 5 Alb 6 Alb 7 Datar Datar Cembung Cembung Cembung Datar Cembung Licin Licin Licin Licin Licin Licin Licin Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Bulat Tidak beraturan Kuning Oranye Merah Merah Kuning Hitam Krem Bigeye tuna Be 1 Be 2 Be 3 Be 4 Cembung Cembung Cembung Cembung Licin Licin Licin Licin Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Krem Krem Krem Krem Yellowfin tuna Yf 1 Yf 2 Yf 3 Yf 4 Cembung Cembung Cembung Cembung Licin Licin Licin Licin Tidak beraturan Tidak beraturan Tidak beraturan Tidak beraturan Merah Merah Kuning Krem Cakalang Ck 1 Ck 2 Cembung Cembung Licin Licin Bulat Bulat Putih Putih
Koloni bakteri yang terpisah (koloni tunggal) dari daging ikan tuna dan cakalang digunakan pada tahap penelitian selanjutnya yaitu pewarnaan gram dan karakterisasi gen hdc pengkode enzim histidin dekarboksilase yang berpotensi menghasilkan histamin .
Berdasarkan Tabel 4, morfologi koloni dari bakteri yang diisolasi dari daging ikan tuna dan cakalang memiliki bentuk permukaan sama, yaitu cembung kecuali pada sampel Alb 1, 2 dan 6 yang memiliki bentuk permukaan datar. Koloni bakteri yang diisolasi bentuk tepiannya licin, bentuk elevasi koloninya bulat dan tidak beraturan. Koloni bakteri yang diperoleh memiliki warna koloni merah, kuning, putih, krem, oranye dan hitam.
Isolasi bakteri dilakukan sebanyak dua kali pengisolasian sampai dihasilkan isolat yang murni. Setiap isolat murni yang diperoleh dikultur pada agar miring. Tahap selanjutnya adalah pengamatan morfologi sel yang meliputi pewarnaan gram.
4.1.2 Karakterisasi isolat bakteri
Setelah didapatkan isolat murni dari bakteri yang diisolasi pada tahap sebelumnya, maka tahap selanjutnya adalah proses pewarnaan gram yang bertujuan untuk mengetahui bentuk sel secara mikroskopik. Dalam proses ini olesan bakteri yang terfiksasi diberi berbagai macam larutan seperti ungu kristal (UK), larutan yodium (lugol), alkohol dan pewarna tandingan, yaitu safranin. Bakteri yang tergolong kedalam gram positif akan mempertahankan zat pewarna ungu kristal sehingga tetap berwarna ungu ketika dilihat secara mikroskopik. Sedangkan bakteri yang tergolong kedalam gram negatif kehilangan zat pewarna ungu kristal ketika dicuci dengan alkohol sehingga terlihat berwarna merah setelah ditambahkan pewarna safranin. Tabel 5 menunjukkam hasil pewarnaan gram terhadap bakteri yang diisolasi dari ikan bluefin tuna, albacore, bigeye tuna dan yellowfin tuna serta ikan cakalang.
Tabel 5. Hasil pewarnaan gram bakteri dari isolat ikan tuna dan cakalang
Jenis ikan Kode Warna Bentuk Gram
Bluefin tuna Bf 1 Bf 2 Bf 3 Bf 4 BF 5 Merah Merah Merah Merah Merah Bulat Bulat Batang Batang Batang Negatif Negatif Negatif Negatif Negatif Albacore Alb 1 Alb 2 Alb 3 Alb 4 Alb 5 Alb 6 Alb 7 Merah Ungu Merah Merah Merah Merah Merah Bulat Bulat Batang Batang Batang Batang Batang Negatif Positif Negatif Negatif Negatif Negatif Negatif Bigeye tuna Be 1 Be 2 Be 3 Be 4 Ungu Merah Merah Merah Koma Koma Batang Bulat Positif Negatif Negatif Negatif Yellowfin tuna Yf 2 Yf 2 YF 3 Yf 4 Ungu Merah Merah Ungu Bulat Bulat Bulat Bulat Positif Negatif Negatif Positif Cakalang Ck 1 Ck 2 Merah Merah Batang Koma Negatif Negatif
Berdasarkan Tabel 5 dapat diketahui bahwa isolat bakteri yang diperoleh didominasi oleh bakteri gram negatif, yaitu sebanyak 18 isolat. Bakteri gram positif diperoleh sebanyak 4 isolat, yaitu Alb 2; Be 1; Yf 1 dan Yf 4. Bakteri gram negatif mengandung lipid dan peptidoglikan yang lebih tipis dibandingkan bakteri gram positif. Faktor inilah yang menyebabkan terjadinya perbedaan warna dari kedua jenis bakteri tersebut. Penambahan ungu kristal (UK) dan lugol (Yodium) saat pewarnaan gram berlangsung menyebabkan terbentuknya kompleks UK-Y di dalam sel-sel bakteri sehingga sel tetap berwarna ungu (Pelczar dan Chan 2006).
Bentuk koloni yang diperoleh adalah bulat, batang dan koma (spiral). Berikut ini adalah Gambar hasil pewarnaan gram terhadap isolat bakteri yang diperoleh dari sampel yang digunakan yaitu dari empat jenis ikan tuna (kode: Bf, Alb, Be dan Yf ) dan cakalang (Ck).
Bf 1 Bf 2 Bf 3 Bf 4 Bf 5
Gambar 15.1 : Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari isolat bakteri ikan bluefin tuna
Alb 1 Alb 2 Alb 3 Alb 4 Alb 5 Alb 6 Alb 7
Gambar 15.2: Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari isolat bakteri ikan albacore
Be 1 Be 2 Be 3 Be 4
Gambar 15.3: Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari isolat bakteri ikan bigeye tuna
Yf 1 Yf 2 Yf 3 Yf 4
Gambar 15.4: Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari isolat bakteri ikan yellowfin tuna
Ck 1 Ck 2
Gambar 15.5: Bentuk sel bakteri secara mikroskopik hasil pewarnaan gram dari isolat bakteri ikan cakalang
4.2 Ekstrak DNA Bakteri
Setiap nukleotida disusun oleh basa nitrogen, gula deoksiribosa dan pospat. Deoxyribonucleic Acid (DNA) menyusun gen yang menjadi unit fundamental informasi genetik. Informasi genetik yang terkandung dalam suatu organisme termasuk bakteri dapat diketahui dengan melakukan ekstraksi DNA. Ekstrak DNA bakteri yang diperoleh akan menentukan protein suatu bakteri melalui susunan basa nitrogennya (Yuwono 2006).
Ekstrak DNA diperoleh dari bakteri yang diisolasi dari daging ikan tuna dan cakalang. Isolat bakteri yang diperoleh berjumlah 22 isolat yang berasal dari empat jenis ikan tuna (Bluefin tuna, Albacore, Bigeye tuna dan Yellowfin tuna) serta cakalang. Masing-masing karakteristik dan bentuk sel secara mikroskopik dapat dilihat pada Tabel 4 dan 5. Ekstraksi DNA bakteri dilakukan dengan menggunakan metode Cetyl-trimethyl-amonium bromide (CTAB) 10% dengan menambahkan SDS, lysozim dan EDTA. Cetyl-Trimethyl-Amonium Bromide (CTAB) bertindak sebagai deterjen yang dapat melarutkan membran bakteri sehingga dapat membantu proses ekstraksi DNA bakteri target. Penambahan Sodium Dodesil Sulfat (SDS) menyebabkan protein yang menyusun tubuh bakteri akan mengalami denaturasi. Ekstrak DNA bakteri yang diperoleh diharapkan bersih dari berbagai pengotor seperti protein dan lemak karena akan mempengaruhi kemurnian dari ekstrak DNA bakteri yang diperoleh.
Kualitas dan kuantitas DNA dapat diketahui melalui alat yang disebut dengan spektrofotometer. Kemurnian DNA ditentukan oleh tingkat kontaminasi protein dalam larutan (Sulandari dan Zein 2003). Penentuan tingkat kemurnian DNA perlu dilakukan sebelum proses amplifikasi dengan metode PCR, sehingga sampel yang diamplifikasi secara enzimatik berdasarkan metode PCR tersebut
telah mengandung DNA pada konsentrasi tertentu. Konsentrasi DNA sampel diukur dengan 2 kali ulangan menggunakan spektrofotometer. Hasil pengukuran tingkat kemurnian DNA sampel dapat dillihat pada Tabel 6.
Tabel 6. Konsentrasi DNA sampel yang diukur menggunakan spektrofotometer Kode sampel Rasio Konsentrasi
DNA (µg/ml) Bf 1 Bf 2 Bf 3 Bf 4 Bf 5 2,156 2,016 2,288 1,843 1,678 200 3765 10 3935 15 Alb 1 Alb 2 Alb 3 Alb 4 Alb 5 Alb 6 Alb 7 1,705 1,136 2,005 2,035 1,782 1,944 2,274 0 0 2065 115 445 2510 250 Be 1 Be 2 Be 3 Be 4 1,799 2,217 2,004 2,235 0 125 680 445 Yf 1 Yf 2 Yf 3 Yf 4 1,805 1,752 2,007 2,054 0 0 0 2175 Ck 1 Ck 2 1,825 2,602 235 70
Berdasarkan Tabel 6 bahwa sampel yang memiliki tingkat kemurnian yang DNA yang tinggi adalah Bf 2 dan 4; Alb 3,4 dan 6; Be 3; Yf 4 dan Ck 1. Hal ini dibuktikan dengan nilai rasio masing-masing sampel berkisar antara 1,8-2,0 serta konsentrasi DNA yang cukup tinggi. Hal ini sesuai dengan pernyataan Muladno (2002) bahwa molekul DNA dikatakan murni apabila rasio antara nilai OD260 dan
OD280 berkisar antara 1,8-2,0. Sampel yang memiliki nilai rasio lebih kecil dari
1,8 atau lebih besar dari 2,0 belum memiliki tingkat kemurnian yang tinggi. Hal tersebut disebabkan oleh rendahnya konsentrasi DNA bakteri yang diperoleh pada saat ekstraksi. Selain itu dapat disebabkan oleh proses ekstraksi DNA bakteri yang belum murni karena masih dikontaminasi oleh berbagai pengotor seperti RNA dan
protein. Perhitungan konsentrasi DNA genom sampel dapat dilihat pada Lampiran 3.
Sampel yang diperoleh dengan tingkat kemurnian DNA yang tinggi selanjutnya diamplifikasi untuk melipatgandakan basa nukleotidanya melalui reaksi enzimatik dengan metode PCR.
4.3 Amplifikasi fragmen DNA bakteri melalui metode PCR
Reaksi Polimerase Berantai atau dikenal sebagai PCR merupakan suatu proses sintesis enzimatik untuk mengamplifikasi nukleotida secara in vitro (Fatchiyah 2006). Metode PCR merupakan salah satu teknik yang digunakan secara luas dalam biologi molekuler (Yuwono 2006). Metode PCR dapat meningkatkan jumlah urutan DNA ribuan bahkan jutaan kali dari jumlah semula. Dengan demikian, pada tahap akhir proses PCR diperoleh jumlah fragmen (potongan) DNA sebanyak 2n dari jumlah semula dimana n adalah jumlah reaksi dalam proses PCR.
Hasil elektroforegram sampel Bf 4 dan Be 3(Gambar 16) menunjukkan pita yang telah sesuai dengan panjang get target yaitu 709 bp (Takahashi et al. 2003).
Gambar 16. Elektroforegram produk PCR dengan menggunakan primer Histidin dekarboksilase (Hdc)
Keterangan:
1. Bf 1 5. Alb 3 9. Yf 1 13. Alb 1 17. Bf 5
2. Bf 4 6. Alb 4 10. Be 4 14. Alb 2 18. Alb 7
3. Bf 3 7. Alb 5 11. Yf 2 15. Be 1 19. K. negatif 4. Be 3 8. Alb 6 12. Yf 3 16. Be 2 20. Marker 1000 bp 700 bp 600 bp 500 bp 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
1000 bp 500 bp Sementara sebanyak 20 sampel dari 22 total sampel tidak menunjukkan
adanya pita yang menandakan adanya DNA bakteri target yang terlihat pada saat visualisasi dibawah sinar UV. Hal ini menunjukkan bahwa sampel tersebut tidak memiliki gen hdc sebagai pengkode enzim histidin dekarboksilase.
Gambar 17. 1: Elektroforegram produk PCR dengan menggunakan primer 106 dan 107 Keterangan: 1. Bf 1 5. Bf 5 9. Yf 3 13. Alb 3 17. Marker 2. Bf 2 6.Be 1 10. Ck 1 14. Alb 4 3. Bf 3 7. Yf 4 11. Ck 2 15. Alb 6 4. Bf 4 8. Yf 2 12. Alb 1 16. K. Negatif
Gambar 17. 2: Elektroforegram produk PCR dengan menggunakan primer 106 dan 107 Keterangan: 1. Bf 1 6. Alb 3 11. Yf 2 16. K.negatif 2. Bf 2 7. Bf 4 12. Yf 3 17. Marker 3. Bf 3 8. Bf 5 13. Yf 4 4. Alb 1 9. Be 3 14. Be 1 5. Alb 2 10. Yf 1 15. Be 2 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 1000 bp 500 bp