Jurnal Biologi Sumatera, Januari 2006, hlm. 1 – 2 Vol. 1, No. 1
ISSN 1907-5537
1
ang terdapat pada pasien-pasien mikosis kulit.
BAHAN DAN METODE
idia menunj
Infeksi sekunder oleh bakteri pada saat serangan jamur terjadi karena kekebalan tubuh
menurun akibat infeksi yang sedang terjadi. Bakteri ini berasal dari flora normal tubuh atau berasal dari lingkungan. Pada tinea pedis menunjukkan bahwa pemeriksaan lebih lanjut ditemukan peningkatan jumlah bakteri Gram negatif yaitu Staphylococcus aureus dan S. epidermidis (Rippon 1988; Mainiadi 2002). Penelitian ini bertujuan mengidentifikasi jenis dan jumlah bakteri y
IDENTIFIKASI JENIS DAN JUMLAH BAKTERI PADA PASIEN
MIKOSIS KULIT
Kiki Nurtjahja1), Dwi Suryanto1), dan Lavarina Winda2)
1
Departemen Biologi, FMIPA, Universitas Sumatera Utara, Jalan Bioteknologi No. 1, Padang Bulan, Medan 20155
2
Fakultas Biologi, Universitas Medan Area, Jalan Kolam No. 1, Medan 20223
Abstract
The occurrence of bacteria on superficial mycosis (tinea) has been studied. The aim of the study is to observe the presence of bacterial species as secondary infection on superficial primary mycosis. Thirty samples of patients mycosis were investigated by scrapping method at head skin (tinea capitis), body (tinea corporis), feet (tinea pedis), nail (tinea manus), and upper tight (tinea cruris). By adding potassium hydroxide (KOH) 10%, each sample was tested microscopically to examine the presence of parasitic fungi. The positive samples were diluted to 10-2 in sterile distilled water. The samples were cultured in solidified nutrient agar (NA) media for 37oC, 24 h. The number of bacteria colonies were calculated, the colonies were determined by Gram stainning.
Most patients were infected by tinea tinea corporis, tinea pedis, tinea cruris, tinea manus, and tinea capitis, respectively. Five species bacteria were found, the highest number of bacteria was
Staphylococcus aureus, which was found in all tinea. The second number was Streptococcus faecalis, Enterobacter aerogenes, Escherichia coli, and Proteus vulgaris, respectively.
Keywords: tinea, scrapping, mycosis
PENDAHULUAN
Infeksi jamur pada kulit atau mikosis banyak diderita penduduk khususnya yang tinggal di daerah tropis. Iklim panas dan lembab merupakan salah satu penyebab tingginya insiden tersebut. Selain itu mikosis pada kulit dipredisposisi oleh higiene yang kurang sehat, adanya sumber penularan, pemakaian antibiotika, dan penyakit kronis (Adiguna 2001).
Mikosis kulit atau disebut juga dengan “ring worm” atau dalam istilah klinis disebut dengan tinea disebabkan oleh 3 genus jamur yaitu
Microsporum, Tricophyton dan Epidermophyton
(Rippon 1988; Chung & Bennett 1992 dan Morello et al 1994). Jamur-jamur ini menyerang permukaan tubuh yang terkeratinisasi seperti kulit pada tubuh, kulit yang berambut seperti pada kepala, dan kuku. Namun jamur ini tidak menginfeksi ke jaringan kulit yang lebih dalam. Tergantung pada bagian tubuh yang diserang, dikenal tinea pada kulit kepala (tinea kapitis), permukaan badan (tinea korporis), lipat paha (tinea kruris), dagu dan leher (tinea barbae), jari-jari tangan (tinea manus), kaki (tinea pedis) dan pada kuku (tinea ungium).
Pemeriksaan Mikroskopis. Sampel untuk diagnosis diperoleh dari kerokan (scrapping) dan usapan lesi kulit/rambut dari 30 pasien yang sebelumnya diduga terinfeksi jamur. Bagian yang terinfeksi dibersihkan dengan alkohol 70%. Hasil kerokan kemudian diletakkan pada gelas objek steril selanjutnya ditambahkan 1-2 tetes KOH 10%. Sediaan dibiarkan pada temperatur kamar selama 2-5 menit, dilayangkan beberapa kali di atas api kecil dan dilihat di bawah mikroskop. Adanya hifa atau kon
ukkan infeksi disebabkan oleh jamur. Kultur Bakteri. Bila pemeriksaan positif (ditandai adanya hifa atau konidia pada hasil
NURTJAHJA ET AL. J. Biologi Sumatera 2
perti triple sugar iron agar (TSI), sulfur indole m y agar (SIM), dan simon ci
tinea k
adap 30 sampel penderita dermatofitosis (tinea) dapat dilihat pada Tabel 1
Ta an diju
30 pas atof is (tine
Dermatofitosis Jumlah Jenis
Infeksi positif oleh jamur dikerok dengan skalpel, hasil kerokan diencerkan dengan akuades hingga 10-2. Hasil pengenceran dikultur pada media nutrient agar, diinkubasi 37oC, 24 jam. Jumlah koloni yang tumbuh dihitung. Jenis bakteri diidentifikasi dengan pewarnaan Gram. Bakteri teridentifikasi Gram + atau bentuk kokus dikultur kembali dengan media MSA (Mannitol Salt Agar) dan diuji dengan uji katalase. Bakteri Gram – dan bentuk batang dikultur dengan media reaksi biokimia se
otilit trate agar.
HASIL DAN PEMBAHASAN
Pemeriksaan Mikroskopis. Seluruh sampel menunjukkan uji positif adanya hifa spora jamur. Sebagian besar sampel pasien menderita
orporis diikuti berturut-turut oleh tinea pedis, tinea kruris, tinea manus, dan tinea kapitis.
Kultur Bakteri. Dari hasil kultur dijumpai 5 spesies bakteri. Spesies bakteri yang paling sering dijumpai pada setiap tinea adalah
Staphylococcus aureus diikuti dengan
Enterobacter aerogenes dan Staphylococcus faecalis. Bakteri Escherichia coli dan Proteus vulgaris hanya dijumpai pada tinea pedis. S. aureus paling banyak dijumpai pada tinea korporis, tinea pedis, tinea kruris. Hasil pengamatan pemeriksaan mikroskopis dan kultur bakteri terh
Permukaan kulit manusia tidak steril. Pada kulit banyak terakumulasi sisa-sisa metabolisme tubuh sehingga mikroorganisme dapat tumbuh pada permukaan kulit (Wiryadi, 2002). Mikroorganisme tersebut secara alami berada pada permukaan kulit dan dalam kondisi normal tidak menimbulkan penyakit, mikroorganisme demikian disebut sebagai flora normal tubuh manusia. Namun beberapa faktor predisposisi seperti higiene yang kurang, menurunnya daya tahan tubuh, penyakit kronis atau terjadi luka pada kulit maka flora normal tersebut dapat menimbulkan infeksi. Di antara flora normal yang paling sering dijumpai pada permukaan kulit adalah bakteri dan jamur. Kedua jenis mikroorganisme ini dapat menyebabkan penyakit kulit. Pada keadaan kulit yang mengalami luka maka akan terjadi infeksi sekunder oleh jamur dan bakteri. Bakteri dapat menginfeksi epidermis atau jaringan yang lebih dalam, infeksinya dapat bervariasi sesuai dengan bakteri penyebabnya, bagian tubuh yang terinfeksi dan keadaan imunologik penderita. Di antara bakteri yang sering menyebabkan infeksi sekunder pada kulit adalah dari genus
Staphylococcus, Streptococcus, dan bakteri Gram- (Rippon, 1988). Di antara bakteri tersebut.
Staphylococcus aureus adalah sangat patogen pada kulit.
DAFTAR PUSTAKA
Adiguna, M.S. 2001. Epidemiologi Dermatomikosis di Indonesia dalam Dermatomikosis Superfisial. Jakarta: FKUI.
Kwon-Chung KJ, Bennet JE. 1992. Medical Mycology. Philadelphia: Lea & Febiger. Mainiadi. 2002. Infeksi Sekunder pada
Dermatofitosis di Poliklinik Penyakit Kulit dan Kelamin. Medan: RSUP H. Adam Malik.
Rippon JW. 1988. Medical Mycology. 3rd edition. Philadelphia: WB Saunders Co. Wiryadi BE. 2002. Mikrobiologi Kulit dalam
Jurnal Biologi Sumatera, Januari 2006, hlm. 3 – 7 Vol. 1, No. 1 ISSN 1907-5537
3
azin HCl pada kelinci
plasma
orbsi maksimum 700-720 nm (Nagaraja, 2000).
Klorpromazin HCl dalam darah yang disimpan pada temperatur 4°C tidak mengalami peruraian, sedangkan penyimpanan pada
temperatur 37°C klorpromazin HCl dalam darah yang tidak diawetkan akan terurai sebesar 50% (Batziris, 1997). Menurut Simanjuntak dan Bangun (2004), kalsium dan vitamin B1 dapat
mempengaruhi absorbsi klorprom
PENGUJIAN DEGRADASI KLORPROMAZIN HCl DALAM PLASMA
SECARA
IN VITRO
M.T. Simanjuntak
Departemen Farmasi, FMIPA, Universitas Sumatera Utara, Jalan Bioteknologi No. 1, Kampus USU Medan
Abstract
The degradation test of chlorpromazin hydrochloride in condensation of buffer solution attempt animal plasma and by in vitro. The degradation test of chlorpromazin hydrochloride was conducted in condensation of buffer solution done at pH 4.0; 6.0; 7.0; 8.0; and 11.5, while in plasma was done with addition of enzyme inhibitor of NaF with different concentration. Test of degradation of chlorpromazin hydrochloride also done at temperature 30°C, 37°C and 50°C in condensation of buffer solution pH 7.0. The experimental data was analyzed by analysis of variance (ANOVA) and Least Significant Difference (LSD).
Total chlorpromazin hydrochloride in plasma was measured by using spectrophotometer at 710 nm with addition of ferri chloride solution, potassium ferri cyanide solution and acetic acid with aquabidest as the solvent. The result of research indicated that the degradation of chlorpromazin hydrochloride was influenced by pH, temperature, and enzyme activity.
PENDAHULUAN
Psikotropik ialah obat yang bekerja pada atau mempengaruhi fungsi psikis, kelakuan, atau pengalaman (World Health Organization, 1966). Klorpromazin hidroklorida (CPZ) merupakan derivat dari fenotiazin yang terdiri dari senyawa dimetilaminopropil.
Klorpromazin HCl adalah turunan fenotiazin dengan pKa=9,3 (Foye, 1996). Pertama kali dikembangkan pada tahun 1950 untuk digunakan sebagai pengobatan anestesi (Mayer, 1990). Klorpromazin HCl digunakan sebagai antiemetikum, sedativum, analgetikum. Efek samping yang ditimbulkan dari klorpromazin HCl berupa lesu, mengantuk, pusing, sakit kepala, konstipasi, jantung berdebar, mulut kering, dan tenggorokan (Shannon, 2000). Dalam perdagangan klorpromazin HCl terdapat dalam bentuk sediaan tablet, sirup, dan injeksi. Sediaan oral klorpromazin yang sering digunakan adalah tablet antara lain tablet Largactil®, Promagtil®.
Klorpromazin HCl secara kimia merupakan senyawa yang kurang stabil. Bentuk garamnya di bawah pengaruh cahaya dan oksigen akan berwarna gelap, di mana perubahan oksidatif dipercepat dengan adanya ion logam (Mayer, 1990).
bila diberikan secara oral.
Monitoring obat dilakukan dengan mengukur konsentrasi obat dalam darah dengan maksud untuk memastikan bahwa obat berada dalam indeks terapetik. Salah satu kriteria obat yang harus dimonitor dalam tubuh adalah obat-obat yang mempunyai indeks terapi yang sempit. Klorpromazin HCl mengalami metabolisme sangat luas dan indeks terapi yang sempit sehingga konsentrasi dan peruraian obat dalam
perlu dipantau (Wilson & Gisvold, 1982). Berbagai metode penetapan kadar fenotiazin dan turunannya dapat dilakukan secara spektrofotometri, spektrofluorometri, konduktometri, fluoroimmunoassay, Kromatografi Cair Kinerja Tinggi, Kromatografi Cair-Gas, adsorpsi voltametri, dan titrasi. Metode spektrofotometri yang dilakukan adalah berdasarkan reaksi oksidasi klorpromazin HCl dengan Fe (III) dan membentuk khelat dengan ferisianida dalam asam asetat yang menghasilkan warna biru prusia dan abs
SIMANJUNTAK J. Biologi Sumatera 4
HCl dalam larutan air dan plasma hewan ercobaan secara in vitro, dan mempergunakan kelinci
trium hidroks a
aret, efendor
h mixer, termos es, batang pengaduk, neraca analitik
n HCl dalam plasma tanpa a
i pada panjang gelombang maksim
pH 7,0 diinkubasi selama
rpm, supernatant (bagian etanol) dipisah
tau dengan penambahan enzim inhibitor NaF dengan variasi waktu reaksi: 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam.
Penentuan Laju Peruraian Klorpromazin HCl dalam Larutan Buffer. Untuk menentukan laju peruraian klorpromazin HCl sesuai dengan rancangan uji tahap I adalah dengan memakai variasi larutan buffer pada pH 4,0; pH 6,0; pH 7,0; pH 8,0; pH 11,5 dengan cara sebagai berikut: dipipet ke dalam tabung reaksi 15 ml 1 ml larutan buffer dan kemudian diinkubasi di dalam penangas air pada suhu 37°C selama 5 menit dipipet 100 μl larutan klorpromazin HCl ke dalam larutan buffer yang telah diinkubasi di atas. Lalu reaksi dihentikan
pada waktu yang bervariasi dari 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam dengan mempergunakan “stop solution” berupa larutan buffer yang telah didinginkan dalam campuran es dan garam sebanyak 5 ml. Konsentrasi dari klorpromazin HCl ditentukan dengan metode spektrofotometr
p
sebagai model hewan percobaan. BAHAN DAN METODE
Bahan. Bahan yang digunakan dalam penelitian ini adalah aqua bidestilata, aquadestilata, klorpromazin HCl, na
ida, k lium dihidrogen fosfat, ferri klorida, kalium ferri sianida, asam asetat glasial, NaF, garam dapur, es, etanol, asam fosfat.
Alat. Alat yang digunakan dalam penelitian adalah tabung reaksi, gelas ukur, gelas beaker, baskom plastik, termometer, pH meter,
waterbath, alumunium foil, rak tabung, mikro pipet 100 μl, labu taker, maat pipet, bola k
f, kertas perkamen, stopwatch, centrifuge,
touc
, spektrofotometri visibel, pipet tetes. Subjek Uji. Kelinci Jantan berat 1,5 – 2 kg.
Rancangan Percobaan Uji In Vitro. Pada percobaan in vitro yang digunakan dalam percobaan ini adalah larutan buffer dengan pH yang ditentukan dan plasma dari hewan percobaan yaitu kelinci dengan berat badan 2,0 kg. Rancangan percobaan ini dibagi menjadi 4 tahap rancangan uji. Pada tahap I, pengujian laju peruraian klorpromazin HCl dalam larutan buffer pH 4,0; 6,0; 7,0; 8,0; 11,5 pada temperatur 37°C dengan variasi waktu reaksi: 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam. Tahap II, pengujian laju peruraian klorpromazin HCl larutan buffer pH 7,0 pada temperatur 30°C, 37°C, 50°C, dengan variasi waktu reaksi: 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam. Tahap III, pengujian laju peruraian klorpromazin HCl dalam plasma kelinci dengan variasi waktu reaksi: 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam. Tahap IV, pengujian laju peruraian klorpromazi
um. Untuk menentukan konsentrasi dari klorpromazin HCl dalam berbagai pH yang lainnya dilakukan dengan prosedur yang sama seperti di atas.
Penentuan Laju Peruraian Larutan Klorpromazin HCl pH 7,0 pada Temperatur 30°C; 37°C; 50°C. Untuk menentukan laju peruraian larutan klorpromazin HCl pH 7,0 pada temperatur 30°C; 37°C; 50°C dilakukan dengan cara sebagai berikut: Ke dalam tabung reaksi 15 ml dipipet 1 ml larutan buffer
5 menit pada temperatur yang diinginkan (30°C; 37°C; 50°C), kemudian dipipet 100 µl larutan klorpromazin HCl ke dalam larutan buffer yang telah diinkubasi di atas.
Pengujian Laju Peruraian Klorpromazin HCl dalam Plasma Kelinci. Untuk menentukan laju peruraian larutan klorpromazin HCl dalam plasma kelinci dilakukan dengan cara sebagai berikut: ke dalam tabung reaksi 15 ml dipipet 1 ml larutan plasma, diinkubasi selama 5 menit pada temperatur 37°C. Kemudian dipipet 100 μl larutan klorpromazin HCl ke dalam larutan buffer yang telah diinkubasi di atas. Lalu reaksi dihentikan pada waktu yang bervariasi dari 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam dengan mempergunakan 4 ml larutan etanol 96%, dicampur dengan bantuan pengaduk sentuh dan disentrifugas selama 10 menit, 3000
dan dimasukkan ke dalam tabung. Konsentrasi dari klorpromazin HCl ditentukan secara spektrofotometri pada panjang gelombang maksimum.
Vol. 1, 2006 J. Biologi Sumatera 5
akai bantuan pengaduk sentuh dan disentrifugasi selama 10 menit, 3000 rpm, pisahkan supernatan (bagian etanol) dan dimasukkan ke dalam tabung.
al ini juga
p=0,5) erdasarkan konsentrasi, diperoleh harga
(Sudja kkan bahwa laju
pe azin rut
menunjukkan perbedaan y ifikan.
Tabel. Harga kobs dan t promazin HCl
da larutan dapar
-1
) mg/ml; 25 mg/ml; 12,5 mg/ml). Lalu reaksi dihentikan pada waktu yang bervariasi dari 1 jam; 2 jam; 4 jam; 6 jam; 9 jam; 12 jam dengan penambahan 4 ml larutan etanol 96%. Dicampur sampai homogen mem
Selanjutnya ditentukan secara spektrofotometri pada panjang gelombang maksimum.
HASIL DAN PEMBAHASAN
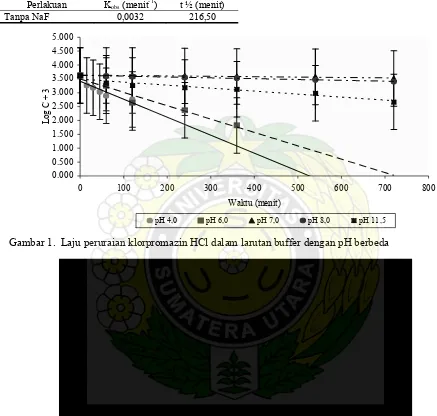
Pengaruh pH terhadap Laju Peruraian Klorpromazin HCl. Dari Gambar 1 terlihat bahwa klorpromazin HCl mengikuti reaksi orde satu dan lebih stabil pada pH 7,0. H
dapat dilihat pada Tabel 1, di mana pada pH 7,0 harga Kobs paling kecil dan harga t ½ paling besar. Jadi, tingkatan laju peruraian klorpromazin HCl dalam larutan buffer adalah pH=4,0>pH=11,5>pH=6,0>pH= 8,0>pH=7,0.
Dari hasil uji statistik laju peruraian larutan klorpromazin HCl menggunakan Anova dan LSD dengan taraf kepercayaan (
b
Fhitung=5,971 berarti lebih besar dari Ftabel=3,49
na, 1992). Hal ini menunju
ruraian klorprom HCl dalam la an buffer ang sign
Keterangan: kobs=konstanta laju laju peruraian t½ (menit)=waktu paruh obat
Pengaruh Temperatur. Pada Gambar 2 terlihat bahwa laju peruraian klorpromazin HCl mengikuti reaksi orde satu dan akan meningkat dengan semakin tinggi temperatur. Laju peruraian klorpromazin HCl juga dapat ditentukan dengan menghitung harga energi aktivasi. Energi aktivasi (Ea) adalah energi minimu
a, 1993). Dengan ncian bahwa perbedaan signifikan terhadap laju
temperatu , temperatur 37°C
ed peru
temperatur 30°C denga idak m n perbedaan yang signifi
HCl te
Temper
m yang diperlukan agar suatu zat terurai. Semakin tinggi harga Ea dari suatu zat maka laju peruraiannya akan semakin kecil. Dengan peningkatan temperatur Energi aktivasi diperoleh sebesar 4305,98 kkal/mol.
Hasil uji statistik dari pengaruh temperatur terhadap laju peruraian klorpromazin
HCl dalam larutan buffer pH=,0 (Tabel 2) menggunakan Anova dan LSD dengan taraf kepercayaan (p=0,5) diperoleh harga Fhitung=6,825 yang berarti lebih besar dari
Ftabel=3,55 (Sudjana, 1992). Hal ini menunjukkan
bahwa laju peruraian klorpromazin HCl dalam larutan berbagai temperatur yang diuji berbeda secara signifikan (Sudjan
ri
peruraian klorpromazin HCl adalah antara r 30°C dengan 50°C
dengan 50°C, s angkan laju raian pada n 37°C t enunjukka kan.
abel 2. H azin
T arga kobs dan t½ klorprom
mperatur berbeda
atur (°C) Kobs (menit-1) t ½ (menit)
30 0,00022 3165,625
37 0,00024 2887,500
50 0,00049 1414,286
Keterangan: kobs=konstanta laju laju peruraian t ½ (menit)=waktu paruh obat
Laju Peruraian Klorpromazin HCl dalam Plasma Kelinci dengan atau Tanpa Penambahan NaF. Dari Gambar 3 dan Tabel 3 dapat dilihat bahwa laju peruraian klorpromazin HCl mengikuti orde satu dan dipengaruhi oleh konsentrasi NaF (12,5 mg; 25 mg; 50 mg), semakin besar konsentrasi NaF yang ditambahkan laju peruraian klorpromazin HCl semakin menurun, bila dibandingkan dengan tanpa p
peruraian klorpromazin HCl dalam lasma mungkin dipengaruhi oleh kerja suatu
rprom
terjadi m. Enzim
enambahan NaF. Dari hasil percobaan diperoleh bahwa laju peruraian klorpromazin HCl dalam plasma dengan penambahan NaF dengan konsentrasi 50 mg/ml memiliki profil yang hampir sama dengan laju peruraian pada larutan buffer pH 7,0.
Dengan uji statistik menggunakan Anova terlihat bahwa laju peruraian klorpromazin dalam plasma dibandingkan dengan laju peruraian dalam plasma dengan penambahan NaF dan laju peruraian pada larutan buffer pH=7,0 menunjukkan bahwa terdapat perbedaan yang signifikan di mana Fhitung=5,575, lebih besar dari
Ftabel=3,33. Sedangkan laju peruraian
klorpromazin HCl dalam plasma dengan penambahan NaF tidak menunjukkan perbedaan yang signifikan dengan laju peruraian pada larutan buffer pH 7,0. Hasil analisis menunjukkan bahwa laju
p
enzim. Hal ini disebabkan karena laju peruraian azin HCl yang lebih besar dalam plasma
SIMANJUNTAK J. Biologi Sumatera 6
men reaks da
kobs dan tan klor n
n
Perlakuan Kobs (menit-1) t ½ (menit)
ingkatkan i spontan pa temperatur fisiologis.
Tabel 3. Harga t½ laru promazi u denga HCl d
Total NaF 12,5 mg 0,0009 770,00
Total NaF 25 mg 0007 990,00
Total NaF 50 mg 0 0016 4331,25 0,
,0
Keterangan: kobs=konstant laju laju peruraian t½ (menit)=waktu paruh obat
a alam p pa ata
Na
lasma tan F pada temperatur 37°C
Tanpa NaF 0,0032 216,50
0.000 0.500 1.000 1.500 2.000 2.500 3.000 3.500 4.000 4.500 5.000
800
L
og C
+
3
0 100 200 300 400 500 600 700 Waktu (menit)
pH 4,0 pH 6,0 pH 7,0 pH 8,0 pH 11,5
ar 1. Laju peruraian klorpromazin HCl dalam larutan buffer dengan pH berbeda Gamb
3,350 3,400 3,450 3,500 3,550 3,600 3,650 3,700
L o g C + 3
0 100 200 300 400 500 600 700 800
Waktu (menit)
Suhu kamar (30 C) Suhu 37 C Suhu 50 C
Gamb eratur yang
berbeda
Vol. 1, 2006 J. Biologi Sumatera 7
0
00 400
Waktu 0.5
1 1.5 2
Lo
2.5 3 3.5
g C
+
3
4 4.5
0 2 600 800
it) (men
pH 7,0 Plasma Plasma + NaF 12,5 mg
Plasma + NaF 25 mg Plasma NaF 50 mg
Gamb arutan klorprom
Disam
1. B M.Sc. Phil.
U 2. Pr
ya 3. Sa un
i. Surabaya: Anief
nsel HC. 1989. Pengantar Bentuk Sediaan
Basav hotometric
Determination of some Biologically Important Phenothiazines using Potassium Dichromat, Iron (II) and 1, 10-phenantroline. Indian Journal of Chemical Technology 11: 639-642.
Batziris H. 1997. Postmortem Artefacts Associated with Physychotropic Drugs. Monash University.
Departemen Kesehatan RI. 1995. Farmakope Indonesia. Edisi IV. Jakarta.
Martin A., Swarbrick J., Cammarata A. 1990. Farmasi Fisik. Penerjemah: Yoshita. Edisi ketiga. Jakarta: Universitas Indonesia. Mayer K. 1990. Senyawa Obat. Edisi kedua.
Penerjemah: Wattimena, dkk. Yogyakarta: Gadjah Mada University Press.
hahib
Shann
Takata
azine Induced Orthostatic Hypotension. Japan: Department of Pharmacology, Faculty of Pharmaceutical Science.
Tanu I. 1994. Farmakologi dan Terapi. Edisi IV. Jakarta: Bagian Farmakologi, Fakultas Kedokteran Universitas Indonesia.
Simanjuntak MT., Bangun H., Juniaton K. 2004. Pemeriksaan Absorbsi Intestinal Klorpromazin HCl dengan Pemberian Peroral pada Kelinci Percobaan. Medan: Jurusan Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
Tokumura T, Horie T. 1997. Kinetics of Nikkomycin Z Degradation in Aqueous Solution and in Plasma. Biol Pharm Bull
20:557-580.
ar 3. Profil laju peruraian l azin HCl dalam plasma tanpa atau dengan ,0
penambahan NaF dan larutan buffer pH 7 UCAPAN TERIMA KASIH
paikan kepada:
apak Drs. Harry Agusnar,
selaku Kepala Lembaga penelitian FMIPA SU atas bantuan fasilitas yang diberikan.
of. DR. Hakim Bangun, Apt. atas diskusi ng diberikan.
udara Ronald Sidabutar atas bantuan teknis tuk penelitian ini.
DAFTAR PUSTAKA
S
Aiache JM, Devissaquet J, Guyot-Herman AM. 1993. Farmasetika Biofarmas
Universitas Airlangga Press.
M. 1993. Farmasetika. Yogyakarta: Universitas Gadjah Mada Press.
A
Farmasi. Edisi keempat. Jakarta: Universitas Indonesia Press.
aiah K. 2004. Indirect Spectrop
Nagaraja P. Dinesh ND, Gowda NMM, Ranggappa KS. 2000. A Simple Spectrophotometric Determination of Some Phenothiazine Drugs in Pharmacetical samples. Analytical Sciences. pp. 16, 1127-1130.
Atkins PW. 1993. Kimia Fisika. Edisi keempat. Jakarta: Penerbit Erlangga.
Roth S, Seeman P. 1972. Biochemistry Biophysiology.
H. 1992. Pemahaman Seluk Beluk Biokimia dan Penerapan Enzim Bandung: PT Citra Aditya Bakti.
on MT. 2000. Drug Guide. New Orleans: Division Nursing Our Lady of Holy Cross College.
Sudjanah. 1993. Pengantar Statistik. Yogyakarta: Gadjah Mada University Press.