PERTUMBUHAN ANGGREK PHALAENOPSIS
AMABILIS PADA PERLAKUAN CHITOSAN DAN ASAM
SALISILAT
ERNA SULISTIANA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pertumbuhan anggrek Phalaenopsis amabilis pada perlakuan chitosan dan asam salisilat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013 Erna Sulistiana NIM A24090025
ABSTRAK
ERNA SULISTIANA. Pertumbuhan Anggrek Phalaenopsis amabilis pada Perlakuan Chitosan dan Asam Salisilat. Dibimbing oleh DEWI SUKMA.
Pertumbuhan vegetatif tanaman anggrek Phalaenopsis dipengaruhi oleh kondisi lingkungan seperti cahaya, suhu, dan kelembaban. Bahan organik tertentu berpengaruh terhadap pertumbuhan, perkembangan dan ketahanan tanaman terhadap hama dan penyakit, diantaranya chitosan dan asam salisilat. Penelitian ini dilaksanakan untuk menguji pemberian bahan organik chitosan dan asam salisilat terhadap pertumbuhan anggrek Phalaenopsis amabilis. Percobaan ini menggunakan Rancangan Acak Lengkap (RAL). dengan faktor tunggal yaitu perlakuan bahan organik. Terdapat enam perlakuan yaitu, chitosan 3 ppm, chitosan 6 ppm, asam salisilat 5 ppm, asam salisilat 10 ppm serta chitosan 3 ppm + asam salisilat 5 ppm. Setiap perlakuan diulang lima kali dengan setiap ulangan berupa 1 botol yang berisi 3 planlet. Bahan organik dicampur kedalam media MS ½ kemudian planlet di pindahkan kedalam media tersebut, selanjutnya disimpan di laboratorium kultur jaringan selama empat minggu. Planlet kemudian diaklimatisasi kedalam media tanam spaghnum moss dan disimpan di greenhouse. Perlakuan dilanjutkan dengan menyemprotkan bahan organik ke tanaman dua minggu sekali. Hasil penelitian menunjukkan perlakuan terbaik pemberian bahan organik untuk pertumbuhan vegetatif anggrek Phalaenopsis amabilis adalah bahan organik chitosan dengan konsentrasi 3 ppm. Hal ini ditunjukkan oleh perlakuan chitosan 3 ppm yang nyata meningkatkan peubah persentase tumbuh dan peubah panjang daun termuda.
Kata kunci : bahan organik, planlet, in vitro, aklimatisasi, persentase tumbuh, panjang daun
ABSTRACT
ERNA SULISTIANA. Growth of Phalaenopsis amabilis Orchid on Chitosan and Salicylic Acid Treatment. Supervised by DEWI SUKMA
Phalaenopsis orchid plant vegetative growth is influenced by environmental condition such as light, temperature, and humidity. Certain organic material affected on the growth, development and plant resistance to pests and diseases, including chitosan and salicylic acid. The objective of this research was to test the application of organic compound chitosan and salicylic acid on the growth of Phalaenopsis amabilis. This research was arranged in a randomized completely design with organic compound as a single factor. There were six treatment, 3 ppm chitosan, chitosan 6 ppm, 5 ppm salicylic acid, salicylic acid 10 ppm and 3 ppm chitosan + 5 ppm salicylic acid. Each treatment was repeated five times with 3 plantlets per bottle. Organic compound were mixed in ½ MS in vitro medium and planlets were transfered to the treatment medium and cultured in the tissue culture laboratory for four weeks. Planlets subsequently were acclimatizated to spaghnum
ii
moss medium in greenhouse. Treatment were continued by spraying of organic compound to planlets every two weeks. The results of the experiment showed that the best treatment of organic compound, was chitosan 3 ppm. This is showed by length of youngest leaf and percentage growth of plant on treatment of chitosan 3 ppm.
Keywords : acclimatization, leaf length, organic compound, percentage of growth, planlet
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
PERTUMBUHAN ANGGREK Phalaenopsis amabilis PADA
PERLAKUAN CHITOSAN DAN ASAM SALISILAT
ERNA SULISTIANA
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi: Pertumbuhan Anggrek Phalaenopsis amabilis pada Perlakuan Chitosan dan Asam Salisilat
Nama :Erna Sulistiana NIM : A24090025
Disetujui oleh
Dr Dewi Sukma SP MSi Pembimbing
Diketahui oleh
Dr Agus Purwito MSc Agr Ketua Departemen
PRAKATA
Puji syukur ke hadirat Tuhan Yang Maha Kuasa atas terselesaikannya usulan penelitian Pertumbuhan Anggrek Phalaenopsis amabilis pada Perlakuan Chitosan dan Asam Salisilat yang dilakukan selama lima bulan yaitu sejak bulan Januari sampai Mei 2013 di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor serta Nursery Alam Sinar Sari, Dramaga, Bogor.
Penulis mengucapkan terimakasih kepada Ibu Dr Dewi Sukma SP, MSi selaku pembimbing, Ibu Dr Ir Eny Widajati, MS selaku pembimbing akademik, serta kepada Ibu Prof Dr Ir Sandra Arifin Aziz, MS dan Bapak Dr Ir Eko Sulistyono, MSi selaku penguji pada ujian akhir saya. Ucapan terimakasih juga disampaikan untuk kedua Orangtua yang telah memberikan doa serta dukungan untuk penulis. Penulis berharap semoga penelitian ini dapat bermanfaat untuk semua kalangan dan dapat digunakan sebaik-baiknya.
Bogor, September 2013 Erna Sulistiana
DAFTAR ISI
DAFTAR TABEL x DAFTAR GAMBAR x DAFTAR LAMPIRAN xi PENDAHULUAN 1 Latar belakang 1 Tujuan 2 Hipotesis 2 TINJAUAN PUSTAKA 2 Botani Anggrek 2 Syarat tumbuh 3 Pemupukan 4 Bahan Organik 4 Chitosan 5 Asam Salisilat 6 Hardening 6 METODE 7 Bahan 7 Alat 7Lokasi dan Waktu Penelitian 7
Prosedur Analisis Data 7
Pelaksanaan Penelitian 8
HASIL DAN PEMBAHASAN 11
Keadaan Umum di Laboratorium Kultur Jaringan 11
Bobot Planlet 12
Jumlah Daun 13
Jumlah Akar 13
Keadaan Umum Tahap Aklimatisasi 15
Persentase Tumbuh Tanaman 15
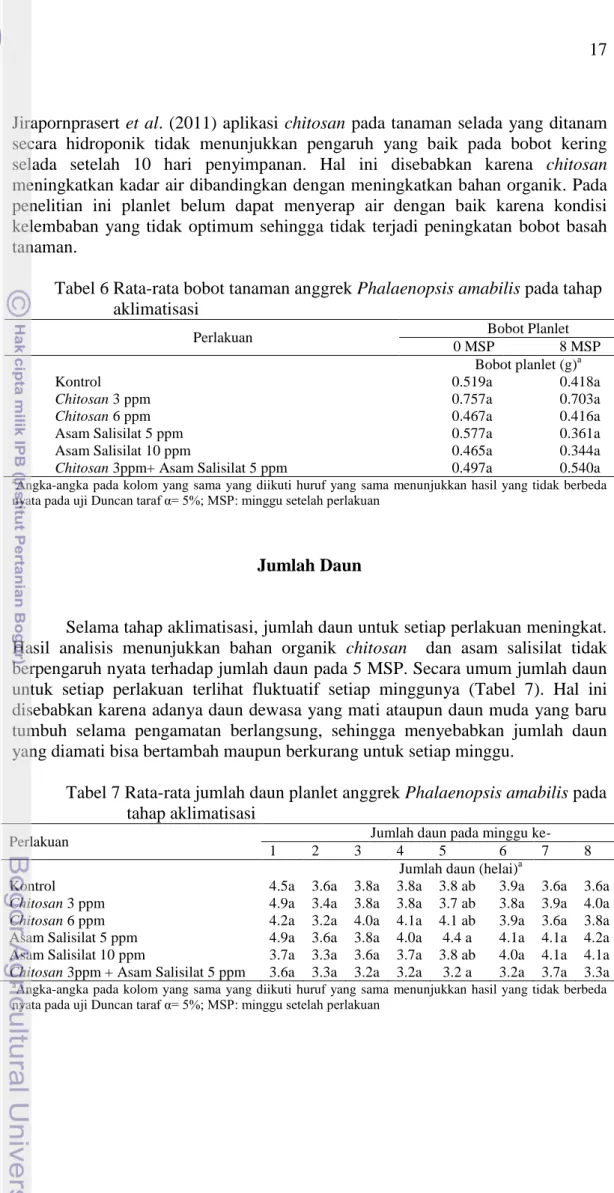
Bobot Tanaman 16
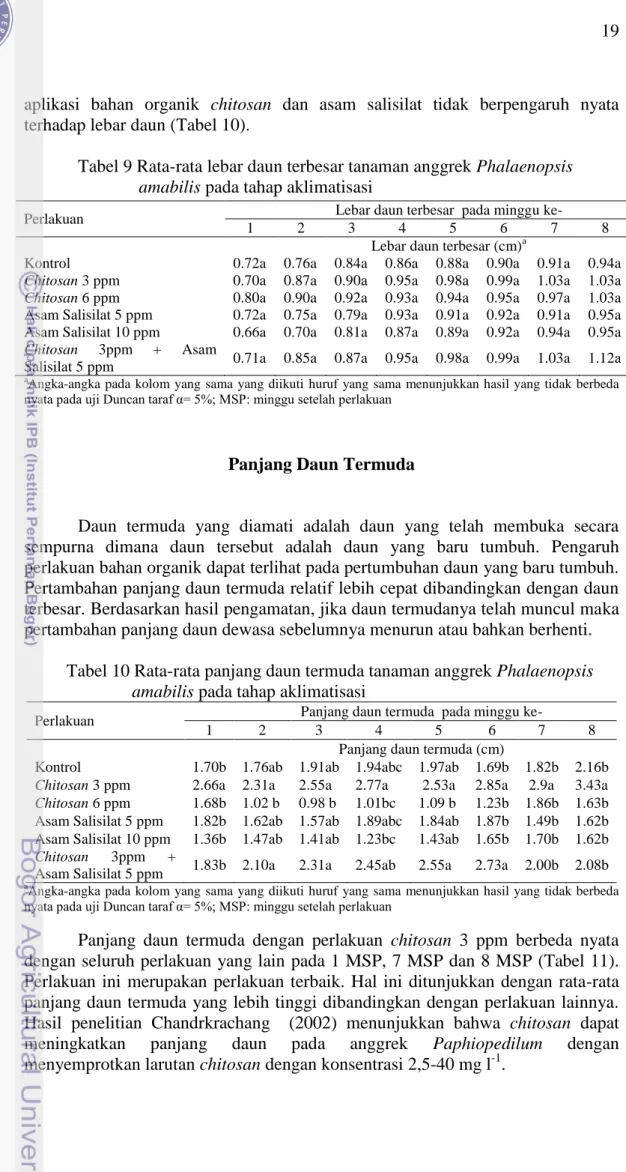
Jumlah Daun 17
Panjang Daun Terbesar 18
Lebar Daun Terbesar 18
ii
Lebar Daun Termuda 20
Jumlah Klorofil 20
SIMPULAN DAN SARAN 21
Simpulan 21
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 26
DAFTAR TABEL
1. Rata-rata bobot planlet anggrek Phalaenopsis amabilis di laboratorium
kultur jaringan 12
2. Rata-rata jumlah daun planlet anggrek Phalaenopsis amabilis pada
perlakuan bahan organik in vitro 13
3. Rata-rata jumlah akar planlet anggrek Phalaenopsis amabilis pada
perlakuan bahan organik in vitro 14
4. Rata-rata jumlah planlet anggrek Phalaenopsis amabilis dengan ujung akar hijau dan putih pada perlakuan bahan organik in vitro (4 MSP) 14 5. Rata-rata persentase tumbuh planlet anggrek Phalaenopsis amabilis
pada tahap aklimatisasi 16
6. Rata-rata bobot tanaman anggrek Phalaenopsis amabilis pada tahap
aklimatisasi 17
7. Rata-rata jumlah daun planlet anggrek Phalaenopsis amabilis pada
tahap aklimatisasi 17
8. Rata-rata panjang daun terbesar tanaman anggrek Phalaenopsis
amabilis pada tahap aklimatisasi 18
9. Rata-rata lebar daun terbesar tanaman anggrek Phalaenopsis amabilis
pada tahap aklimatisasi 19
10.Rata-rata panjang daun termuda tanaman anggrek Phalaenopsis
amabilis pada tahap aklimatisasi 19
11.Rata-rata lebar daun termuda tanaman anggrek Phalaenopsis amabilis
pada tahap aklimatisasi 20
12.Rata-rata jumlah klorofil tanaman anggrek Phalaenopsis amabilis 8
MSP pada tahap aklimatisasi 21
DAFTAR GAMBAR
1. Anggrek Phalaenopsis amabilis 3
2. Tahap aklimatisasi: Spaghnum moss dan planlet direndam dalam bakterisida dan fungisida (a), planlet ditanam dalam media (b), planlet disimpan dengan tingkat naungan 65% (c), planlet disemprot dengan bahan organik chitosan dan asam salisilat 10 3. Keragaan planlet tanpa perlakuan bahan organik (a), perlakuan
chitosan 3 ppm (b), perlakuan chitosan 6 ppm (c), perlakuan asam salisilat 5 ppm (d), perlakuan asam salisilat 10 ppm (e), perlakuan chitosan 3 ppm + asam salisilat 5 ppm (f) pada media in vitro 12 4. Kondisi akar di media kultur in vitro (a), planlet dengan ujung akar
iv
5. Planlet dengan kondisi segar (a), gejala serangan penyakit pada anggrek Phalaenopsis amabilis ujung daun yang mengalami busuk basah Erwinia sp.(b), ujung daun yang mengalami sun burn (c). 16 6. Representasi daun terbesar pada tanaman yang diamati panjang dan
lebarnya 18
7. Representasi daun termuda pada tanaman yang diamati panjang dan
lebarnya 20
DAFTAR LAMPIRAN
1. Rekapitulasi sidik ragam bobot planlet, jumlah daun, jumlah akar, panjang dan lebar daun terbesar, panjang dan lebar daun termuda
serta jumlah klorofil 26
PENDAHULUAN
Latar belakang
Anggrek merupakan tanaman hias yang bernilai estetika tinggi dan memiliki arti penting dalam perdagangan bunga. Selain karena bunganya yang indah dengan warna yang menarik, anggrek dapat dijadikan sebagai tanaman pot maupun tanaman bunga potong (Muhit 2010). Produksi tanaman anggrek di Indonesia saat ini adalah 14,050,445 tangkai dengan produktivitas 7.68 tangkai per m2. Angka ini menunjukkan bahwa anggrek berada pada posisi ke-tiga setelah krisan dan mawar (Badan Pusat Statistik 2012). Anggrek memiliki sifat yang berbeda dengan tanaman lain, perbedaan ini tampak dari bentuk, ukuran dan warna bunga serta cara pertumbuhannya. Salah satu jenis anggrek yang cukup populer adalah kelompok anggrek dari genus Phalaenopsis dengan salah satu spesies yang paling populer adalah anggrek bulan atau Phalaenopsis amabilis (Iswanto 2001). Indonesia merupakan negara tropis yang memiliki berbagai jenis spesies anggrek Phalaenopsis, di antaranya Phalaenopsis bellina, Phalaenopsis modesta dan Phalaenopsis amabilis. Spesies – spesies asli tersebut perlu untuk dilindungi sehingga dapat dimanfaatkan dalam pengembangan varietas baru anggrek (Noer 2012).
Sebagai komoditas bisnis, anggrek Phalaenopsis amabilis ini pernah menduduki rangking atas dalam perdagangan tanaman anggrek, karena harganya yang relatif terjangkau namun memiliki sosok bunga yang sangat indah dan bahkan bunganya tahan sampai kisaran hampir 6 bulan (Virnanto 2010). Widiastoety et al. (2010) menyatakan bahwa kendala pengembangan anggrek di Indonesia antara lain terbatasnya bibit unggul, teknologi yang digunakan masih sederhana, dan kurangnya dukungan kebijakan pemerintah.
Pertumbuhan vegetatif tanaman anggrek Phalaenopsis dipengaruhi oleh kondisi lingkungan seperti cahaya, suhu, dan kelembaban serta faktor lain seperti jenis media dan konsentrasi larutan pupuk yang di berikan sangat menentukan produktivitas tanaman. Pemupukan yang tepat dan intensif serta penggunaan media tumbuh yang cocok akan menentukan pertumbuhan vegetatif tanaman anggrek (Santi dan Kusumo 1992). Aplikasi pemupukan yang tepat untuk tanaman anggrek pada fase pertumbuhannya sangat diperlukan untuk mendukung pertumbuhan dan perkembangan anggrek (Noer 2012).
Disamping pupuk, beberapa bahan organik tertentu berpengaruh terhadap pertumbuhan, perkembangan dan ketahanan tanaman terhadap hama dan penyakit, diantaranya chitosan dan asam salisilat. Chitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin (Wahyono et al. 2009). Chitosan merupakan salah satu polimer alam yang paling umum yang dapat diperoleh dari berbagai spesies, terutama dari eksoskeletons dari krustasea. Chitosan juga ditemukan dalam kutikula dari serangga serta dalam dinding sel jamur dan beberapa alga (Sanford dan Hutchings 1987; Sandford 1989; EPA 1995). Pengaruh chitosan telah diteliti pada beberapa jenis tanaman. Hasil penelitian telah menunjukkan bahwa chitosan
2
dapat meningkatkan ukuran akar dan tunas pada tanaman lobak ( Raphanus sativus L.) (Tsugita et al. 1993.). Hasil penelitian telah menunjukkan bahwa chitosan dapat meningkatkan pertumbuhan anggrek Paphiopedilum bellatulum x Paph. Angthong di kultur jaringan (Kliangkeaw et al. 2003). Hasil penelitian Chandrkrachang et al. (2002) juga menunjukkan chitosan dapat meningkatkan pertumbuhan tanaman anggrek Dendrobium muda dengan konsentrasi chitosan sebesar 10 mg l-1. Namun demikian perlakuan chitosan pada bibit anggrek Phalaenopsis amabilis setelah aklimatisasi dengan konsentrasi 10 ppm menyebabkan kematian (Noer 2012)
Bahan organik lain yang belum banyak diteliti pengaruhnya terhadap pertumbuhan dan perkembangan tanaman khususnya anggrek adalah asam salisilat. Asam salisilat (SA) termasuk dalam kelompok senyawa fenolik yang banyak berperan dalam respon tanaman terhadap penyakit dan juga mempengaruhi pertumbuhan dan perkembangan tanaman. Pengaruh asam salisilat terhadap pertumbuhan tanaman tergantung pada spesies tanaman, fase perkembangan dan konsentrasi asam salisilat tersebut pada tanaman (Rivas et al. 2011). Pengaruh asam salisilat telah diteliti pada beberapa jenis tanaman yaitu kedelai, gandum, dan jagung. Asam salisilat yang diaplikasikan pada tanaman kedelai menunjukkan peningkatan pertumbuhan akar (Gutie´rrez-Coronado i 1998).
Tujuan
Menguji pemberian bahan organik chitosan dan asam salisilat terhadap pertumbuhan anggrek Phalaenopsis amabilis.
Hipotesis
Terdapat perlakuan bahan organik (chitosan, asam salisilat) atau kombinasi keduanya yang dapat meningkatkan pertumbuhan anggrek Phalaenopsis amabilis.
TINJAUAN PUSTAKA
Botani Anggrek
Secara taksonomi, anggrek adalah kelompok tanaman yang unik. Anggrek terdiri dari 800 genus dan lebih dari 25,000 spesies. Bunga anggrek memiliki ukuran, bentuk dan warna yang sangat bervariasi. Beberapa diantaranya tumbuh pada tanaman lain, diantara bebatuan, diatas tanah, serta ada pula tanaman anggrek yang mampu menjalar. Jenis anggrek yang saat ini banyak ditemukan
bukanlah jenis anggrek liar yang tumbuh di alam, melainkan jenis anggrek hybrid yaitu anggrek hasil persilangan oleh manusia (Orchids Society 1998).
Anggrek secara taksonomi diklasifikasikan: Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Asparagales Family : Orchidaceae
Marga :Phalaenopsis, Dendrobium, Bulbophyllum, Vanda, Cattleya, Cymbidium, Nephelaphyllum
Gambar 1 Anggrek Phalaenopsis amabilis
Salah satu jenis anggrek yang sangat terkenal di Asia adalah jenis anggrek Phalaenopsis. Anggrek ini termasuk kedalam anggrek epifit. Anggrek ini memiliki daun yang sukulen, dapat tumbuh dengan baik pada lingkungan dengan kelembaban yang tinggi karena secara alami, tanaman anggrek hidup di tanaman lain dengan kondisi akar yang menggantung diudara sehingga mampu menyerap air dari lingkungannya (Stewart 2000). Anggrek Phalaenopsis merupakan anggrek dengan tipe pertumbuhan monopodial, yaitu pola pertumbuhan ujung batang yang terus tumbuh vertikal ke atas (Iswanto 2001)
Phalaenopsis memiliki spesies yang cukup banyak dengan bunga yang indah. Spesies bunga tersebut yaitu Phal. amabilis, Phal. lueddemanniana, Phal. pulchara, Phal. schilleriana, Phal. stuartiana, Phal. violacea. Selain jenis-jenis tersebut, terdapat pula jenis tanaman hibrida yang diperoleh dari spesies tersebut atau dari spesies yang lain. Jenis tanaman ini tumbuh lebih cepat pada lingkungan yang hangat. (Stewart 2000).
Syarat tumbuh
Ketinggian tempat merupakan salah satu faktor yang mempengaruhi keberhasilan pertumbuhan anggrek. Ketinggian tempat untuk setiap jenis anggrek tidak sama, beberapa jenis anggrek dapat tumbuh baik di dataran tinggi, tetapi jenis yang lain dapat tumbuh subur di datran rendah, akan tetapi terdapat pula
4
anggrek yang dapat tumbuh subur di dataran rendah sampai medium. Phalaenopsis merupakan jenis anggrek yang dapat tumbuh baik di dataran tinggi. Berdasarkan ketinggian tempat, kebutuhan suhu untuk setiap jenis anggrek juga berbeda. Suhu yang dibutuhkan anggrek Phalaenopsis pada fase vegetatif berbeda dengan suhu pada fase generatifnya. Pada fase vegetatif, Phalaenopsis membutuhkan suhu 280C, sedangkan pada fase generatifnya, Phalaenopsis membutuhkan suhu untuk induksi pembungaannya sebesar 260C (Lopez et al. 2007).
Anggrek adalah jenis tanaman yang menyukai keadaan yang lembab, berkisar antara 60-85%. Untuk menjaga kelembaban agar tetap stabil, dapat dilakukan dengan melakukan penyiraman dengan menggunakan sprayer. Sama seperti halnya ketinggian tempat, setiap jenis anggrek juga membutuhkan intensitas cahaya matahari yang berbeda-beda. Phalaenopsis membutuhkan 1,500 foot candle (300µmol m2s-1) untuk fase vegetatifnya dan 1,000-1,500 foot candle ( 200-300 µmol m2s-1) untuk fase generatifnya (Lopez 2007).
Pemupukan
Pemupukan adalah kegiatan dalam menyediakan mineral yang dibutuhkan oleh tanaman agar proses fotosintesis lebih efisien (Frowine 2005). Penggunaan pupuk dalam budidaya tanaman anggrek sangat penting untuk karena dapat menentukan tingkat pertumbuhan tanaman. Pupuk dapat dibagi menjadi dua jenis, yaitu pupuk organik dan non organik. Pupuk organik dapat diperoleh langsung dari alam, misalnya pupuk kandang, pupuk hijau, pupuk kompos dan pupuk guano sedangkan pupuk non organik adalah pupuk buatan pabrik dengan berbagai macam merk dagang (Noer 2012)
Pada kondisi alaminya di alam, anggrek mampu menyerap nutrisi dari lingkungannya. Pupuk yang biasa digunakan dalam pemupukan anggrek adalah pupuk organik yang terdiri dari karbon yang dihasilkan oleh manusia atau hewan. Pupuk anorganik yang digunakan tersusun atas tiga komponen utama yaitu nitrogen, fosfor dan potassium. Unsur hara mikro yang lain yaitu Zn, Br, dan Mb. Pupuk dengan kandungan N yang tinggi akan merangsang pertumbuhan dengan cepat, sedangkan pupuk yang mengandung banyak P dan K akan merangsang pembungaan. Perbandingan ketiga komponen (N:P:K) tersebut secara umum adalah 21:21:21 (Orchids Society 1998).
Bahan Organik
Pupuk organik adalah pupuk yang sebagian besar atau seluruhnya terdiri atas bahan organik yang berasal dari tanaman dan atau hewan yang telah melalui proses rekayasa, dapat berbentuk padat atau cair yang digunakan mensuplai bahan organik untuk memperbaiki sifat fisik, kimia, dan biologi tanah (Suriadikarta et al. 2006). Pupuk organik bersifat bulky dengan kandungan hara makro dan mikro rendah sehingga perlu diberikan dalam jumlah banyak. Bahan organik juga dapat
mengurangi unsur hara yang bersifat racun bagi tanaman. Komposisi hara pupuk organik bergantung pada sumber bahan pupuk, yaitu dari pertanian dan nonpertanian. Dari pertanian dapat berupa sisa panen dan kotoran ternak, sedangkan dari non pertanian antara lain adalah sampah organik kota dan limbah industri (Balai Penelitian Tanah 2005).
Bahan organik sangat bermanfaat bagi peningkatan produksi pertanian baik kualitas maupun kuantitas, mengurangi pencemaran lingkungan. Sumber bahan untuk pupuk organik sangat beranekaragam, dengan karakteristik fisik dan kandungan kimia atau hara yang sangat beragam sehingga pengaruh dari penggunaan pupuk organik terhadap lahan dan tanaman dapat bervariasi. Pupuk organik atau bahan organik tanah merupakan sumber nitrogen tanah yang utama, selain itu peranannya cukup besar terhadap perbaikan sifat fisika, kimia biologi tanah serta lingkungan. Pupuk organik yang ditambahkan ke dalam tanah akan mengalami beberapa kali fase perombakan oleh mikroorganisme tanah untuk menjadi humus atau bahan organik tanah (Suriadikarta et al. 2006). Agar aplikasi pupuk organik lebih hemat dan penggunaan tenaga kerja lebih murah, salah satu alternatifnya adalah dengan meningkatkan kandungan haranya, terutama hara makro seperti nitrogen, kalium, dan fosfor (Balai Pengkajian Teknologi Pertanian Bali 2008).
Bahan dasar pupuk organik yang berasal dari sisa tanaman umumnya sedikit mengandung bahan berbahaya. Bahan/pupuk organik dapat berperan sebagai “pengikat” butiran primer menjadi butir sekunder tanah dalam pembentukan agregat yang mantap. Keadaan ini besar pengaruhnya pada porositas, penyimpanan dan penyediaan air, aerasi tanah, dan suhu tanah. Pupuk organik/bahan organik memiliki fungsi kimia yang penting seperti penyediaan hara makro (N, P, K, Ca, Mg, dan S) dan mikro seperti Zn, Cu, Mo, Co, B, Mn, dan Fe, meskipun jumlahnya relatif sedikit (Suriadikarta et al. 2006).
Chitosan
Chitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Chitosan dapat dijumpai secara alamiah di beberapa organisme seperti pada karapas udang, cangkang rajungan, jamur, dan serangga. Chitosan larut dalam pelarut organik, HCl encer, HNO3 encer, H3PO4 0.5%, dan CH3COOH 1%, tetapi tidak larut dalam basa kuat dan H2SO4. Dalam kondisi asam berair, gugus amino (-NH2) chitosan akan menangkap H+ dari lingkungannya, sehingga gugus aminonya terprotonasi menjadi –NH3+ inilah yang menyebabkan chitosan bertindak sebagai garam, sehingga dapat larut dalam air, analog dengan pelarutan garam dapur dalam air (Wahyono et al. 2009).
Sifat polikationik chitosan menjadi dasar pemanfaatan chitosan dalam berbagai bidang. Chitosan dapat dimanfaatkan dalam bidang pertanian karena sifatnya yang biodegradable. Chitosan diserap oleh akar setelah diuraikan oleh bakteri di dalam tanah. Tanaman yang diberi aplikasi chitosan memiliki ketahanan yang baik terhadap serangan jamur. Penggunaan chitosan dalam bidang pertanian walaupun tanpa penggunaan pupuk kimia mampu meningkatkan
6
populasi mikroba dalam jumlah yang besar serta mempercepat proses transformasi nutrien dari senyawa organik menjadi senyawa anorganik sehingga lebih mudah diserap oleh akar tanaman (Boonlertnirun et al. 2005).
Asam Salisilat
Asam salisilat (SA) termasuk dalam kelompok senyawa fenolik yang banyak berperan dalam respon tanaman terhadap penyakit dan juga mempengaruhi pertumbuhan dan perkembangan tanaman. Asam salisilat yang paling banyak disintesis oleh tanaman adalah glucosylated dan methylated (Gutie ´rrez-Coronado et al. 1998). Asam salisilat merupakan hormon pada tanaman yang berfungsi sebagai ketahanan pada tanaman, serta responsif terhadap stress lingkungan. Asam salisilat berkontribusi dalam pertumbuhan dan perkembangan tanaman (Rivas et al. 2011).
Menurut Rivas et al. (2011), pengaruh asam salisilat terhadap pertumbuhan tanaman tergantung pada spesies tanaman, fase perkembangan dan konsentrasi asam salisilat tersebut pada tanaman. Pengaruh asam salisilat juga terlihat pada tahap pembungaan pada tanaman. Pada saat pembungaan kandungan asam salisilat pada beberapa tanaman meningkat dalam daun-daun tanaman yang melakukan inisiasi pembungaan (Yalpani et al. 1993; Abreu et al. 2009).
Hardening
Proses hardening diawali saat planlet masih berada pada kultur in vitro. Tahap ini melibatkan transfer planlet dari kondisi aseptik ke greenhouse dan akhirnya ke lokasi terakhir (lingkungan). Planlet berkembang dalam botol kultur dalam kondisi aseptik, pada medium yang mengandung gula dan nutrisi untuk memungkinkan pertumbuhan heterotrofik dalam suasana kelembaban yang relatif tinggi dan tingkat cahaya yang rendah, hal tersebut berpengaruh terhadap planlet yang tidak dapat bertahan pada kondisi lingkungan saat langsung ditempatkan di greenhouse atau lapangan (Sujatha 2011).
Tahap hardening merupakan tahap yang penting sebelum transplantasi tanaman ke tanah. Planlet yang langsung dipindahkan dari media kultur jaringan ke lapangan tidak memungkinkan karena akan menyebabkan tingkat kematian yang tinggi karena sebelumnya planlet berada pada kondisi heterotrofik dimana nutrisi yang dibutuhkan dapat dikontrol. Tahap hardening perlu dilakukan dalam rangka meningkatkan persentase kelangsungan hidup planlet saat di tanam di lapang (Kaur et al. 2011).
Proses hardening dilakukan dengan tujuan untuk meningkatkan kondisi planlet sebelum di aklimatisasi. Tahap aklimatisasi merupakan tahapan paling kritis dan sulit pada proses regenerasi tanaman secara in vitro (Pardal et al. 2005). Beberapa sifat yang kurang menguntungkan yang dimiliki tanaman hasil regenerasi melalui kultur jaringan adalah lapisan kutikula kurang berkembang, jaringan pembuluh akar dan batang kurang sempurna, stomata tidak berfungsi, berkurangnya sel-sel palisade daun, dan lignifikasi batang (Gunawan 1988).
Keadaan tersebut menyebabkan bibit kultur rentan terhadap hama, penyakit, dan udara luar sehingga menyulitkan aklimatisasinya (Slamet 2012).
METODE
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Januari – Mei 2013. Penelitian ini dilakukan di dua tempat yaitu di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor dan di Nursery Alam Sinar Sari, Dramaga, Bogor untuk tahap aklimatisasi.
Bahan
Bahan tanaman yang digunakan adalah planlet anggrek Phalaenopsis amabilis dalam kultur in vitro berumur sekitar 1 tahun setelah penyemaian benih. Media untuk planlet adalah media Murashige dan Skoog (MS) sedangkan pupuk untuk pemeliharaan tanaman menggunakan pupuk organik merk Multitonik. Bahan untuk perlakuan yang digunakan adalah bahan organik chitosan, dan asam salisilat. Bahan lain digunakan yaitu pot tanah liat berdiameter 15 cm, Spaghnum Moss untuk aklimatisasi planlet, fungisida, dan bakterisida,
Alat
Alat-alat yang digunakan yaitu timbangan analitik, hand sprayer, laminar air flow cabinet, autoclave, meteran, alat-alat penanaman di laboratorium kultur jaringan serta alat–alat yang digunakan untuk pemeliharaan di lapang dan alat tulis.
Prosedur Analisis Data
Percobaan ini disusun menggunakan Rancangan Acak Lengkap (RAL). dengan faktor tunggal yaitu perlakuan bahan organik. Terdapat enam perlakuan, setiap perlakuan diulang lima kali (5 botol) dengan 3 planlet per botol. Setiap satuan percobaan menggunakan 15 planlet anggrek Phalaenopsis amabilis sehingga jumlah planlet yang digunakan yaitu 90 planlet. Perlakuan yang diuji adalah sebagai berikut:
P1 : (kontrol), planlet ditanam dalam media MS1/2,
P2 : planlet ditanam dalam media MS1/2 + Chitosan 3 ppm P3 : planlet ditanam dalam media MS1/2 + Chitosan 6 ppm
8
P4 : planlet ditanam dalam media MS1/2 + Asam Salisilat 5 ppm P5 : planlet ditanam dalam media MS1/2 + Asam Salisilat 10 ppm
P6 :planlet ditanam dalam media MS1/2 + Chitosan 3 ppm + Asam Salisilat5 ppm Data yang diperoleh dianalisis dengan sidik ragam uji sidik ragam pada α: 5%. Apabila hasil analisis sidik ragam menunjukkan bahwa perlakuan berpengaruh nyata maka dilanjutkan dengan uji Duncan Multiple Range Test (DMRT). Model linier yang digunakan dalam penelitian ini adalah sebagai berikut:
Yijk = + αi + ij
Keterangan:
Yijk = Respon pengamatan bahan organik taraf ke-i, dan ulangan ke-j,
µ = rataan umum
αi = pengaruh perlakuan bahan organik taraf ke-i,
ij = pengaruh galat percobaan perlakuan bahan organik taraf ke-i, ulangan
ke- j
Pelaksanaan Penelitian
a. Penanaman planlet di kultur jaringan 1. Sterilisasi alat
Sterilisasi alat dilakukan dengan mencuci alat-alat yang akan digunakan hingga bersih. Alat-alat yang digunakan tersebut antara yaitu pinset, gunting, scalpel, cawan petri serta botol kultur berukuran 300 ml. Selanjutnya alat tersebut disterilisasi menggunakan autoklaf pada suhu 121oC dan tekanan 17.5 psi (pounds per square inch) selama 60 menit. Alat yang telah disterilisasi kemudian disimpan di dalam oven penyimpanan agar tidak mengalami kontaminasi.
2. Pembuatan media kultur dan persiapan botol kultur
Pembuatan media dilakukan dengan mempersiapkan media kultur in vitro dengan penambahan bahan organik (chitosan dan asam salisilat) sesuai dengan konsentrasi yang diberikan dan jumlah ulangan. Pembuatan larutan chitosan dilakukan dengan melarutkan chitosan bentuk lembar tipis dalam asam asetat untuk membantu kelarutan chitosan sesuai dengan kebutuhan perlakuan. Pembuatan larutan asam salisilat dilakukan dengan melarutkan asam salisilat dengan bantuan KOH kemudian dibuat konsentrasi 5 dan 10 ppm.
Media yang digunakan adalah media MS ½. Semua bahan media dicampur dalam labu takar dan ditera hingga 1 liter menggunakan aquades. Setelah itu, dilakukan pengukuran pH hingga 5.8-6.0. Pengaturan pH dilakukan dengan penambahan HCl 1N atau KOH 1N. Formula tersebut kemudian ditambahkan agar-agar sebagai pemadat media sebanyak 7 g.l-1, dididihkan lalu dimasukkan ke dalam botol kultur steril. Selanjutnya botol media ditutup dengan plastik hingga rapat dan disterilisasi dalam autoklaf pada tekanan 17.5 psi dan suhu 121o C selama 10 menit.
3. Penanaman planlet
Planlet anggrek Phalaenopsis amabilis yang digunakan berasal dari penyemaian benih anggrek Phalaenopsis amabilis yang berumur satu tahun. Penanaman planlet pada seluruh media dilakukan di dalam laminar air flow cabinet. Alat-alat, bahan atau tangan harus disterilisasi terlebih dahulu dengan menyemprotkan alkohol 70% ketika menanam. Planlet dikeluarkan dari botol dan diletakkan pada cawan petri steril kemudian ditanam dalam media kultur jaringan yang sebelumnya telah dipersiapkan. Planlet anggrek Phalaenopsis amabilis ditanam dalam media dengan jumlah 3 buah planlet untuk masing-masing botol. Planlet kemudian disimpan di laboratorium kultur jaringan selama empat minggu. Planlet yang digunakan sebelumnya telah ditimbang bobot awal, jumlah daun, jumlah akar dan kondisi awal planlet.
b. Aklimatisasi
1. Persiapan tanaman dan media aklimatisasi
Planlet yang akan diaklimatisasi dikeluarkan dari botol dengan memasukkan air ke dalam botol dan dikeluarkan satu per satu dengan pinset lalu dicuci bersih dengan air mengalir untuk menghilangkan media agar-agar yang melekat. Planlet selanjutnya direndam dalam larutan fungisida dan bakterisida dengan konsentrasi 1g l-1selama 10-15 menit.
Media tanam spaghnum moss juga direndam dalam larutan fungisida dan bakterisida selama 10-15 menit. Pot yang digunakan adalah pot tanah liat yang berdiameter 15 cm. pot tanah liat tersebut diisi oleh arang hingga seperempatnya lalu diisi kembali oleh spaghnum moss hingga penuh.
2. Penanaman
Penanaman dilakukan dengan menanam tiga buah planlet untuk setiap pot, akar planlet diusahakan agar tertutup oleh media. Setiap perlakuan diberi tanda untuk memudahkan pengamatan. Tempat penyimpanan yang digunakan sebagai menyimpan anggrek menggunakan paranet dengan tingkat naungan 65%.
3. Penyemprotan oleh bahan organik
Pembuatan larutan chitosan dilakukan dengan melarutkan chitosan bentuk lembar tipis dalam asam asetat untuk membantu kelarutan dan dibuat larutan stok chitosan dengan konsentrasi pemberian chitosan yaitu 3 dan 6 ppm tanaman-1 sesuai dengan kebutuhan perlakuan. Pembuatan larutan asam salisilat dilakukan dengan melarutkan asam salisilat dengan KOH dan dibuat stok asam salisilat dengan konsentrasi 5 dan 10 ppm.
Penyemprotan chitosan dilakukan secara bergantian dengan asam salisilat setiap 2 minggu sekali setelah aklimatisasi. Pemberian chitosan diberikan dengan cara menyemprotkan ke seluruh daun dan media tanam, dengan volume semprot sekitar 20 ml tanaman-1, menggunakan hand sprayer. Pemberian asam salisilat diberikan seperti halnya pemberian pupuk chitosan dengan volume semprot yang sama. Pemeliharaan tanaman meliputi penyiraman yang dilakukan setiap hari serta pemberian pupuk organik Multitonik satu minggu sekali. Tanaman kemudian diletakkan didalam rak yang telah ditutupi oleh paranet selama penelitian berlangsung.
10
(a) (b)
(c) (d)
Gambar 2 Tahap aklimatisasi: Spaghnum moss dan planlet direndam dalam bakterisida dan fungisida (a), planlet ditanam dalam media (b), planlet disimpan dengan tingkat naungan 65% (c), planlet disemprot dengan bahan organik chitosan dan asam salisilat
Pengamatan Penelitian
Pengamatan yang dilakukan yaitu pengamatan awal sebelum perlakuan dan selama perlakuan di laboratorium kultur jaringan selama empat minggu serta pengamatan saat aklimatisasi dan pasca aklimatisasi selama delapan minggu. Peubah yang diamati pada awal sebelum perlakuan antara lain bobot planlet, jumlah daun dan jumlah akar. Peubah yang diamati selama perlakuan di laboratorium kultur jaringan antara lain jumlah daun, akar yang baru tumbuh, warna planlet dan gejala visual lainnya. Peubah yang diamati saat aklimatisasi yaitu bobot planlet, jumlah daun, jumlah akar, warna ujung akar, panjang dan lebar daun terbesar, panjang dan lebar daun termuda serta gejala visual lainnya. Pengamatan pasca aklimatisasi yang dilakukan satu minggu yaitu bobot planlet, jumlah daun, jumlah akar, warna ujung akar, panjang dan lebar daun terbesar, panjang dan lebar daun termuda serta gejala visual lainnya. Selain itu pengamatan pada 8 MSP juga dilakukan terhadap peubah jumlah klorofil.
Uji klorofil anggrek Phalaenopsis amabilis dilakukan dengan metode Sims and Gamon. Tahap pertama uji klorofil tersebut adalah mengambil masing-masing 3 sample untuk setiap perlakuan, sehingga jumlah sample yang diperoleh adalah 18 sample. Masing-masing sample ditimbang dengan bobot minimum 0.016 g dan maksimum 0.025 g. Setiap sample lalu dimasukkan ke dalam plastik klip dan diberi label sesuai perlakuan. Sample masing-masing digerus dan mencampurnya dengan aceton sebanyak 1 ml (diukur dengan mikro pipet). Sample yang telah digerus kemudian dimasukkan kedalam microtube, lalu ditera hingga volumenya mencapai 2 ml tiap tabung. Tahap berikutnya adalah mensentrifuse sample selama lebih kurang 10 detik dengan tujuan untuk memisahkan cairan dan endapan tiap
sample. Selanjutnya, cairan sample sebanyak 1 ml dimasukkan ke dalam tabung reaksi dan ditambahkan aceton kembali sebanyak 3 ml. Tiap sample kemudian dikocok agar cairan didalamnya tercampur rata. Tahap terakhir adalah menganalisis jumlah klorofil untuk masing-masing sample.
HASIL DAN PEMBAHASAN
Keadaan Umum di Laboratorium Kultur Jaringan
Planlet anggrek Phalaenopsis amabilis sebelum diaklimatisasi telah
diberikan perlakuan bahan organik sebelumnya di media kultur jaringan selama empat minggu. Tujuan ditambahkannya bahan organik ke media MS ½ adalah untuk menguatkan planlet anggrek Phalaenopsis amabilis sebelum dilakukannya aklimatisasi. Proses penguatan planlet ini disebut dengan proses hardening.
Hardening pada planlet Phalaenopsis amabilis harus dilakukan untuk meningkatkan ketahanan planlet sebelum diaklimatisasi. Planlet anggrek Phalaenopsis amabilis yang digunakan memiliki bobot antara 0.2-0.4 g, dengan jumlah daun 2 hingga 7 helai dan jumlah akar 1 hingga 6 buah setelah empat minggu melalui proses hardening.
Keadaan planlet selama perlakuan tidak menunjukkan adanya gejala keracunan. Berdasarkan hasil pengamatan, jumlah planlet pada perlakuan dengan bahan organik chitosan lebih banyak planlet yang terkontaminasi dibandingkan dengan planlet tanpa perlakuan bahan organik dan planlet dengan perlakuan asam salisilat. Terdapat lima botol planlet yang terkontaminasi pada perlakuan dengan chitosan sejak 2 MSP, yaitu satu botol pada perlakuan chitosan 3 ppm, dua botol pada 6 ppm dan dua botol pada perlakuan chitosan 3 ppm ditambah asam salisilat 5 ppm. Pada perlakuan dengan asam salisilat terdapat dua botol yang terkontaminasi yaitu pada perlakuan asam salisilat 5 ppm dan 10 ppm pada 4 MSP. Hasil penelitian Lakani (2012), menunjukkan pemberian asam salisilat pada media kultur jaringan anggrek menyebabkan pertumbuhan anggrek lebih baik. Pemberian asam salisilat menjadikan plantlet tumbuh lebih baik sehingga mampu bertahan hidup walaupun media tumbuhnya terkontaminasi cendawan.
Berdasarkan hasil rekapitulasi sidik ragam terhadap peubah yang diamati (Lampiran 1), penambahan bahan organik pada media kultur jaringan menunjukkan pengaruh yang tidak berbeda nyata pada peubah bobot planlet dan jumlah akar, sedangkan pada peubah jumlah daun menunjukkan pengaruh yang nyata. Pengamatan yang dilakukan setelah planlet di aklimatisasi menunjukkan aplikasi bahan organik pengaruh nyata pada peubah panjang daun termuda pada 1 hingga 5 MSP serta pada 8 MSP dan pengaruh yang sangat nyata pada 6 dan 7 MSP, sedangkan pada peubah bobot planlet, jumlah daun, panjang dan lebar daun terbesar, lebar daun termuda dan jumlah klorofil menunjukkan hasil yang tidak berpengaruh nyata pada awal hingga akhir pengamatan.
12
Bobot Planlet
Bobot planlet awal diamati saat planlet akan dipindahkan kedalam media
MS ½ yang telah dicampur bahan organik. Bobot planlet kemudian diamati kembali setelah empat minggu. Hasil analisis statistik menunjukkan bahwa perlakuan bahan organik yaitu chitosan dan asam salisilat tidak berpengaruh nyata terhadap bobot planlet Phalaenopsis amabilis pada 4 MSP (Tabel 1).
Tabel 1 Rata-rata bobot planlet anggrek Phalaenopsis amabilis pada perlakuan bahan organik in vitro
Perlakuan Bobot Planlet
0 MSP 4 MSP
Bobot planlet (g)a
Kontrol 0.191 0.519a
Chitosan 3 ppm 0.458 0.757a
Chitosan 6 ppm 0.268 0.467a
Asam Salisilat 5 ppm 0.296 0.577a
Asam Salisilat 10 ppm 0.354 0.465a
Chitosan 3ppm+ Asam Salisilat 5 ppm 0.276 0.497a
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan.
(a) (b) (c)
(a) (b) (c)
Gambar 3 Keragaan planlet tanpa perlakuan bahan organik (a), perlakuan chitosan 3 ppm (b), perlakuan chitosan 6 ppm (c), perlakuan asam salisilat 5 ppm (d), perlakuan asam salisilat 10 ppm (e), perlakuan chitosan 3 ppm + asam salisilat 5 ppm (f) pada media in vitro
Jumlah Daun
Jumlah daun yang dihitung adalah daun yang telah membuka sempurna.
Jumlah daun pada planlet anggrek Phalaenopsis amabilis yang digunakan berkisar 2-7 helai pada awal pengamatan. Selama pengamatan berlangsung seluruh perlakuan menunjukkan pertambahan jumlah daun kecuali untuk perlakuan chitosan 3 ppm + asam salisilat 5 ppm. Jumlah daun pada perlakuan tersebut pada 1 MSP dan 4 MSP adalah sama. Jumlah daun planlet dengan perlakuan chitosan 3 ppm berbeda nyata dengan perlakuan chitosan 6 ppm, asam salisilat 5 ppm dan 10 ppm pada 1 MSP menunjukkan kondisi bahan tanam yang relatif beragam (Tabel 2) dengan jumlah daun 4.3 helai. Pengamatan pada 4 MSP menunjukkan pemberian bahan organik tidak berpengaruh nyata terhadap jumlah daun untuk setiap perlakuan.
Tabel 2 Rata-rata jumlah daun planlet anggrek Phalaenopsis amabilis pada perlakuan bahan organik in vitro
aAngka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak
berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Jumlah Akar
Hasil analisis statistik terhadap jumlah akar planlet menunjukkan bahwa jumlah akar pada perlakuan asam salisilat berbeda nyata dibandingkan dengan perlakuan tanpa bahan organik dan perlakuan chitosan 3 ppm pada 1 MSP (Tabel 3). Jumlah akar yang dimiliki oleh planlet dengan perlakuan asam salisilat 5 ppm adalah paling sedikit dibandingkan dengan perlakuan bahan organik yang lain. Pada 4 MSP jumlah akar dan warna ujung akar tidak berbeda nyata antar perlakuan.
Perlakuan Jumlah Daun
1 MSP 4 MSP Jumlah daun (helai)a
Kontrol 3.5ab 3.9a
Chitosan 3 ppm 4.3a 4.9a
Chitosan 6 ppm 3.0b 4.2a
Asam Salisilat 5 ppm 3.4b 4.9a
Asam Salisilat 10 ppm 2.8b 3.7a
14
Tabel 3 Rata-rata jumlah akar planlet anggrek Phalaenopsis amabilis pada perlakuan bahan organik in vitro
Perlakuan Jumlah Akar
1 MSP 4 MSP
Kontrol 3.6a 3.7a
Chitosan 3 ppm 3.5a 4.4a
Chitosan 6 ppm 2.7ab 2.7a
Asam Salisilat 5 ppm 2.2b 3.4a
Asam Salisilat 10 ppm 2.8ab 3.2a
Chitosan 3ppm+ Asam Salisilat 5 ppm 2.9ab 4.6a
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Tabel 4 Rata-rata jumlah planlet anggrek Phalaenopsis amabilis dengan ujung akar hijau dan putih pada perlakuan bahan organik in vitro (4 MSP)
Perlakuan Jumlah Planlet
Putih Hijau Jumlah akar a
Kontrol 0.4a 2.4a
Chitosan 3 ppm 1.5a 1.5a
Chitosan 6 ppm 2.0a 1.0a
Asam Salisilat 5 ppm 1.3a 1.7a
Asam Salisilat 10 ppm 1.2a 1.7a
Chitosan 3ppm+ Asam Salisilat 5 ppm 1.0a 2.4a
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
(a) (b) (c)
Gambar 4 Kondisi akar di media kultur in vitro (a), planlet dengan ujung akar putih (b), planlet dengan ujung akar hijau (c).
Sebagian planlet Phalaenopsis amabilis pada 4 MSP memiliki akar yang hijau dengan ujung akar putih (Tabel 4). Planlet dengan ujung akar putih menunjukkan bahwa planlet tersebut telah siap untuk diaklimatisasi. Namun demikian, terdapat pula planlet yang ujung akarnya masih berwarna hijau. Hasil analisis statistik menunjukkan pemberian bahan organik tidak berpengaruh nyata terhadap warna ujung akar. Planlet dengan ujung akar hijau pada umumnya memiliki ukuran yang lebih kecil. Kondisi planlet seperti ini menunjukkan bahwa planlet belum cukup kuat untuk diaklimatisasi.
Keadaan Umum Tahap Aklimatisasi
Pertumbuhan planlet setelah aklimatisasi secara visual kurang baik. Hal tersebut kemungkinan karena kondisi media spaghnum moss yang kurang lembab. Penyiraman dilakukan dua kali sehari namun volume penyiraman belum cukup terkontrol sehingga media masih mengalami kekeringan yang menyebabkan tidak terjaganya kesegaran planlet.
Pertumbuhan vegetatif anggrek Phalaenopsis amabilis dipengaruhi oleh penyerapan hara yang dilakukan oleh kemampuan tanaman menyerap hara yang kemudian ditranslokasikan ke seluruh bagian tanaman. Persentase tumbuh planlet planlet pada tahap aklimatisasi (8 MSP) sebesar 78.3% dari seluruh planlet yang di aklimatisasi (69 planlet). Beberapa planlet yang mati terutama disebabkan planlet layu oleh penyakit seperti busuk basah Erwinia sp. Tanaman yang terserang oleh busuk basah Erwinia sp. ditunjukkan oleh adanya bercak yang basah pada daun (Gambar 5). Bercak tersebut kemudian akan menjalar ke seluruh bagian tanaman dan menyebabkan tanaman tersebut mati. Selain penyakit yang disebabkan oleh busuk basah, daun pada tanaman anggrek Phalaenopsis amabilis ini juga mengalami kekeringan pada ujung daun (sun burn) (Gambar 5). Kondisi tanaman yang tidak sehat juga bisa dipengaruhi oleh cuaca atau iklim di sekitar lingkungan hidup tanaman. Wiyono (2007) menyatakan, perkembangan penyakit sangat dipengaruhi oleh faktor iklim mikro disekitar tanaman. Berdasarkan pernyataan tersebut dapat dikatakan bahwa perubahan cuaca atau iklim akan mempengaruhi pertumbuhan tanaman dan ketahanan tanaman terhadap penyakit.
.
Persentase Tumbuh Tanaman
Persentase tumbuh tanaman merupakan persentase jumlah tanaman yang hidup selama perlakuan berlangsung. Berdasarkan hasil analisis statistik pada 6 dan 7 MSP, persentase tumbuh planlet paling tinggi adalah pada perlakuan kontrol dan chitosan 3 ppm yang berbeda nyata dengan persentase tumbuh pada perlakuan chitosan 3 + asam salisilat 5 ppm, namun tak berbeda nyata dengan perlakuan lainnya.
Sebagian planlet Phalaenopsis amabilis pada 4 MSP memiliki akar yang hijau dengan ujung akar putih (Tabel 4). Planlet dengan ujung akar putih menunjukkan bahwa planlet tersebut telah siap untuk diaklimatisasi. Namun demikian, terdapat pula planlet yang ujung akarnya masih berwarna hijau. Hasil analisis statistik menunjukkan pemberian bahan organik tidak berpengaruh nyata terhadap warna ujung akar. Planlet dengan ujung akar hijau pada umumnya memiliki ukuran yang lebih kecil. Kondisi planlet seperti ini menunjukkan bahwa planlet belum cukup kuat untuk diaklimatisasi.
16
Tabel 5 Rata-rata persentase tumbuh planlet anggrek Phalaenopsis amabilis pada tahap aklimatisasi
Perlakuan Persentase tumbuh pada minggu ke-
1 2 3 4 5 6 7 8
Persentase tumbuh (%)a
Kontrol 100a 100a 100a 100a 100a 100a 100a 93a
Chitosan 3 ppm 100a 100a 100a 100a 100a 100a 100a 92a
Chitosan 6 ppm 100a 100a 100a 100a 100a 89ab 89ab 78a
Asam Salisilat 5 ppm 100a 89a 89a 89a 89a 89ab 89ab 89a
Asam Salisilat 10 ppm 100a 100a 100a 92a 92a 83ab 83ab 83a
Chitosan 3ppm + Asam Salisilat
5 ppm 100a 78a 67a 67a 67a 56b 56b 56a
aAngka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
(a) (b) (c)
Gambar 5 Planlet dengan kondisi segar (a), gejala serangan penyakit pada anggrek Phalaenopsis amabilis ujung daun yang mengalami busuk basah Erwinia sp.(b), ujung daun yang mengalami sun burn (c). Penurunan persentase tumbuh planlet selama perlakuan pada tahap aklimatisasi disebabkan oleh serangan penyakit. Penyakit yang menyerang antara lain busuk basah Erwinia sp. serta kering pada ujung daun kemudian merambat hingga pangkal daun. (Gambar 5).
Persentase tumbuh tanaman juga dipengaruhi oleh kondisi akar tanaman anggrek Phalaenopsis amabilis yang mengalami kerusakan. Kerusakan tersebut kemungkinan disebabkan oleh kurangnya kelembaban media dan udara sehingga akar menjadi kering yang ditunjukkan oleh akar yang mengerut dan kering. Kerusakan akar tersebut menyebabkan terganggunya proses penyerapan hara oleh akar. Hal ini sesuai dengan pernyataan Gunadi (1977), yang menyatakan bahwa salah satu fungsi akar anggrek adalah menyerap air dan unsur hara. Akar yang rusak tidak mampu menyerap air dan unsur hara dengan baik, sehingga mengganggu pertumbuhan tanaman anggrek. Hal ini menyebabkan persentase tumbuh tanaman anggrek menurun di setiap minggu.
Bobot Tanaman
Hasil analisis statistik menunjukkan bahwa perlakuan bahan organik yaitu
chitosan dan asam salisilat tidak berpengaruh nyata terhadap bobot tanaman Phalaenopsis amabilis pada 4 MSP (Tabel 6). Menurut hasil penelitian
Jirapornprasert et al. (2011) aplikasi chitosan pada tanaman selada yang ditanam secara hidroponik tidak menunjukkan pengaruh yang baik pada bobot kering selada setelah 10 hari penyimpanan. Hal ini disebabkan karena chitosan meningkatkan kadar air dibandingkan dengan meningkatkan bahan organik. Pada penelitian ini planlet belum dapat menyerap air dengan baik karena kondisi kelembaban yang tidak optimum sehingga tidak terjadi peningkatan bobot basah tanaman.
Tabel 6 Rata-rata bobot tanaman anggrek Phalaenopsis amabilis pada tahap aklimatisasi
Perlakuan Bobot Planlet
0 MSP 8 MSP
Bobot planlet (g)a
Kontrol 0.519a 0.418a
Chitosan 3 ppm 0.757a 0.703a
Chitosan 6 ppm 0.467a 0.416a
Asam Salisilat 5 ppm 0.577a 0.361a
Asam Salisilat 10 ppm 0.465a 0.344a
Chitosan 3ppm+ Asam Salisilat 5 ppm 0.497a 0.540a
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Jumlah Daun
Selama tahap aklimatisasi, jumlah daun untuk setiap perlakuan meningkat. Hasil analisis menunjukkan bahan organik chitosan dan asam salisilat tidak berpengaruh nyata terhadap jumlah daun pada 5 MSP. Secara umum jumlah daun untuk setiap perlakuan terlihat fluktuatif setiap minggunya (Tabel 7). Hal ini disebabkan karena adanya daun dewasa yang mati ataupun daun muda yang baru tumbuh selama pengamatan berlangsung, sehingga menyebabkan jumlah daun yang diamati bisa bertambah maupun berkurang untuk setiap minggu.
Tabel 7 Rata-rata jumlah daun planlet anggrek Phalaenopsis amabilis pada tahap aklimatisasi
Perlakuan Jumlah daun pada minggu ke-
1 2 3 4 5 6 7 8
Jumlah daun (helai)a
Kontrol 4.5a 3.6a 3.8a 3.8a 3.8 ab 3.9a 3.6a 3.6a
Chitosan 3 ppm 4.9a 3.4a 3.8a 3.8a 3.7 ab 3.8a 3.9a 4.0a
Chitosan 6 ppm 4.2a 3.2a 4.0a 4.1a 4.1 ab 3.9a 3.6a 3.8a
Asam Salisilat 5 ppm 4.9a 3.6a 3.8a 4.0a 4.4 a 4.1a 4.1a 4.2a
Asam Salisilat 10 ppm 3.7a 3.3a 3.6a 3.7a 3.8 ab 4.0a 4.1a 4.1a
Chitosan 3ppm + Asam Salisilat 5 ppm 3.6a 3.3a 3.2a 3.2a 3.2 a 3.2a 3.7a 3.3a
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
18
Panjang Daun Terbesar
Daun yang diukur adalah daun dewasa yang telah membuka secara sempurna dengan ukuran yang paling besar diantara daun lainnya. Hasil analisis statistik menunjukkan bahwa perlakuan bahan organik chitosan 3 ppm berbeda nyata terhadap pertambahan panjang daun terbesar dibandingkan dengan perlakuan bahan organik asam salisilat 10 ppm mulai dari 2 MSP hingga 8 MSP (Tabel 9). Hal ini sesuai dengan hasil penelitian Wanichpongpan et al. (2000) yang menunjukkan bahwa aplikasi chitosan dapat meningkatkan jumlah daun serta meningkatkan panjang dan lebar daun gerbera. Pertambahan jumlah daun terendah ditunjukkan oleh perlakuan bahan organik asam salisilat 5 ppm dan berbeda nyata dengan perlakuan chitosan 3 ppm.
Tabel 8 Rata-rata panjang daun terbesar tanaman anggrek Phalaenopsis amabilis pada tahap aklimatisasi
aAngka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji
Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Gambar 6 Representasi daun terbesar pada tanaman yang diamati panjang dan lebarnya
Lebar Daun Terbesar
Secara umum, lebar daun tanaman anggrek Phalaenopsis amabilis pada penelitian ini menunjukkan pertambahan setiap minggunya. Daun yang diukur lebarnya adalah daun dewasa yang telah membuka sempurna dengan ukuran daun yang paling besar diantara daun lainnya. Hasil uji statistik menunjukkan bahwa Perlakuan Panjang daun terbesar pada minggu ke-
1 2 3 4 5 6 7 8
Panjang daun terbesar (cm)
Kontrol 2.11a 2.21ab 2.37ab 2.38ab 2.40ab 2.43ab 2.56ab 2.63ab Chitosan 3 ppm 2.79a 3.15a 3.25a 3.32a 3.47a 3.52a 3.62a 3.61a Chitosan 6 ppm 2.02a 2.23ab 2.29ab 2.30ab 2.37ab 2.35ab 2.37ab 2.57ab Asam Salisilat 5 ppm 2.40a 2.43ab 2.43ab 2.50ab 2.43ab 2.43ab 2.43ab 2.50ab Asam Salisilat 10
ppm 1.81a 1.86b 1.90b 1.95b 1.97b 1.98b 1.97b 2.09b Chitosan 3ppm +
aplikasi bahan organik chitosan dan asam salisilat tidak berpengaruh nyata terhadap lebar daun (Tabel 10).
Tabel 9 Rata-rata lebar daun terbesar tanaman anggrek Phalaenopsis amabilis pada tahap aklimatisasi
a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Panjang Daun Termuda
Daun termuda yang diamati adalah daun yang telah membuka secara
sempurna dimana daun tersebut adalah daun yang baru tumbuh. Pengaruh perlakuan bahan organik dapat terlihat pada pertumbuhan daun yang baru tumbuh. Pertambahan panjang daun termuda relatif lebih cepat dibandingkan dengan daun terbesar. Berdasarkan hasil pengamatan, jika daun termudanya telah muncul maka pertambahan panjang daun dewasa sebelumnya menurun atau bahkan berhenti.
Tabel 10 Rata-rata panjang daun termuda tanaman anggrek Phalaenopsis amabilis pada tahap aklimatisasi
Perlakuan Panjang daun termuda pada minggu ke-
1 2 3 4 5 6 7 8
Panjang daun termuda (cm)
Kontrol 1.70b 1.76ab 1.91ab 1.94abc 1.97ab 1.69b 1.82b 2.16b
Chitosan 3 ppm 2.66a 2.31a 2.55a 2.77a 2.53a 2.85a 2.9a 3.43a
Chitosan 6 ppm 1.68b 1.02 b 0.98 b 1.01bc 1.09 b 1.23b 1.86b 1.63b Asam Salisilat 5 ppm 1.82b 1.62ab 1.57ab 1.89abc 1.84ab 1.87b 1.49b 1.62b Asam Salisilat 10 ppm 1.36b 1.47ab 1.41ab 1.23bc 1.43ab 1.65b 1.70b 1.62b
Chitosan 3ppm +
Asam Salisilat 5 ppm 1.83b 2.10a 2.31a 2.45ab 2.55a 2.73a 2.00b 2.08b
aAngka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Panjang daun termuda dengan perlakuan chitosan 3 ppm berbeda nyata dengan seluruh perlakuan yang lain pada 1 MSP, 7 MSP dan 8 MSP (Tabel 11). Perlakuan ini merupakan perlakuan terbaik. Hal ini ditunjukkan dengan rata-rata panjang daun termuda yang lebih tinggi dibandingkan dengan perlakuan lainnya. Hasil penelitian Chandrkrachang (2002) menunjukkan bahwa chitosan dapat meningkatkan panjang daun pada anggrek Paphiopedilum dengan menyemprotkan larutan chitosan dengan konsentrasi 2,5-40 mg l-1.
Perlakuan Lebar daun terbesar pada minggu ke-
1 2 3 4 5 6 7 8
Lebar daun terbesar (cm)a
Kontrol 0.72a 0.76a 0.84a 0.86a 0.88a 0.90a 0.91a 0.94a
Chitosan 3 ppm 0.70a 0.87a 0.90a 0.95a 0.98a 0.99a 1.03a 1.03a
Chitosan 6 ppm 0.80a 0.90a 0.92a 0.93a 0.94a 0.95a 0.97a 1.03a
Asam Salisilat 5 ppm 0.72a 0.75a 0.79a 0.93a 0.91a 0.92a 0.91a 0.95a
Asam Salisilat 10 ppm 0.66a 0.70a 0.81a 0.87a 0.89a 0.92a 0.94a 0.95a
Chitosan 3ppm + Asam
20
Pengamatan pada 2 MSP, 3 MSP dan 5 MSP menunjukkan perlakuan chitosan 6 ppm berbeda nyata dengan perlakuan chitosan 3 ppm dan perlakuan chitosan 3 ppm ditambah dengan asam salisilat 5 ppm. Perlakuan chitosan 3 ppm dan asam salisilat 10 ppm berbeda nyata dengan perlakuan chitosan 6 ppm pada 4 MSP.
Gambar 7 Representasi daun termuda pada tanaman yang diamati panjang dan lebarnya
Lebar Daun Termuda
Perlakuan bahan organik tidak berpengaruh nyata terhadap lebar daun
termuda pada 2 MSP hingga 8 MSP berbeda dengan peubah panjang daun termuda yang berbeda nyata pada perlakuan chitosan 3 ppm. Panjang daun termuda pada perlakuan asam salisilat 10 ppm berbeda nyata dibandingkan dengan perlakuan chitosan 3 ppm dan perlakuan chitosan 3 ppm ditambah dengan asam salisilat 5 ppm pada 1 MSP (Tabel 12) sedangkan pada pengamatan selanjutnya berbeda nyata.
Tabel 11 Rata-rata lebar daun termuda tanaman anggrek Phalaenopsis amabilis pada tahap aklimatisasi
Perlakuan Lebar daun termuda pada minggu ke-
1 2 3 4 5 6 7 8
Lebar daun termuda (cm)a
Kontrol 0.80ab 0.88a 0.85a 0.79a 0.79a 0.73a 0.76a 0.84a Chitosan 3 ppm 0.95 a 0.90a 0.98a 0.61a 1.05a 1.05a 1.07a 1.17a Chitosan 6 ppm 0.79ab 0.58a 0.60a 0.95a 0.64a 0.70a 0.76a 0.83a Asam Salisilat 5 ppm 0.74ab 0.70a 0.73a 0.78a 0.82a 0.83a 0.77a 0.77a Asam Salisilat 10 ppm 0.58 b 0.76a 0.69a 0.81a 0.91a 1.02a 1.14a 1.00a Chitosan 3ppm + Asam
Salisilat 5 ppm 0.85 a 0.91a 0.93a 0.95a 0.96a 0.98a 0.88a 0.88a
aAngka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji
Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Jumlah Klorofil
Warna daun erat kaitannya dengan kandungan klorofil yang dimiliki oleh tanaman. Daun tanaman yang hijau normal memiliki kandungan klorofil
lebih tinggi dibandingkan dengan albino, kuning atau hijau muda. Klorofil adalah salah satu pigmen yang sangat penting yang digunakan tumbuhan untuk menyerap cahaya dalam proses fotosintesis (Bakti 2009). Klorofil terdapat di dalam kloroplas, dimana pada bagian tertentu kloroplas terdapat tumpukan tilakoid yang disebut grana (Salisbury & Ross 1995).
Tabel 12 Rata-rata jumlah klorofil tanaman anggrek Phalaenopsis amabilis 8 MSP pada tahap aklimatisasi
Perlakuan Klorofil a (mg g-1)a Klorofil b (mg g1)a Total Klorofil (mg g-1)a Rasio Klorofil a/b (mg g1)a Kontrol 0.513 0.262 0.418 1.958 Chitosan 3 ppm 0.342 0.175 0.703 1.954 Chitosan 6 ppm 0.430 0.282 0.416 1.525 Asam Salisilat 5 ppm 0.385 0.208 0.361 1.850 Asam Salisilat 10 ppm 0.343 0.189 0.344 1.814 Chitosan 3ppm + Asam Salisilat 5 ppm 0.363 0.175 0.540 2.074 a
Angka-angka pada kolom yang sama yang diikuti huruf yang sama menunjukkan hasil yang tidak berbeda nyata pada uji Duncan taraf α= 5%; MSP: minggu setelah perlakuan
Uji klorofil anggrek Phalaenopsis amabilis pada penelitian ini dilakukan dengan metode Sims and Gamon. Hasil analisis statistik pada 8 MSP menunjukkan aplikasi bahan organik tidak berpengaruh nyata terhadap jumlah kandungan klorofil a, klorofil b, rasio klorofil a dan klorofil b dan total klorofil anggrek Phalaenopsis amabilis (Tabel 13). Klorofil merupakan faktor yang penting dalam proses fotosintesis. Jumlah klorofil berkaitan erat dengan hasil yang diperoleh dari proses yang melibatkan cahaya tersebut. Hasil pengamatan menunjukkan total klorofil tertinggi terdapat pada perlakuan bahan organik chitosan 3 ppm. Total klorofil yang tinggi menunjukkan energi yang dihasilkan dari proses fotosintesis tersebut juga tinggi. Energi ini akan digunakan oleh tanaman untuk pertumbuhannya. Pada percobaan ini tanaman dengan perlakuan bahan organik chitosan 3 ppm menunjukkan pertumbuhan yang terbaik dibandingkan dengan perlakuan lainnya sesuai dengan total klorofil yang dimiliki oleh tanaman tersebut.
SIMPULAN DAN SARAN
Simpulan
Penambahan bahan organik chitosan dan asam salisilat berpengaruh nyata terhadap pertumbuhan anggrek Phalaenopsis amabilis. Perlakuan terbaik pemberian bahan organik untuk pertumbuhan vegetatif anggrek Phalaenopsis amabilis adalah bahan organik chitosan dengan konsentrasi 3 ppm. Hal ini ditunjukkan oleh perlakuan chitosan 3 ppm yang nyata mempengaruhi persentase
22
tumbuh planlet anggrek Phalaenopsis amabilis pada tahap aklimatisasi dan peubah panjang daun termuda.
Saran
Aklimatisasi sebaiknya dilakukan secara individual, masing-masing tanaman ditanam dalam satu pot. Kondisi media selama pemeliharaan salah satunya penyiraman. sebaiknya dilakukan secara intensif. Volume penyiraman harus terkontrol agar kondisi media stabil sehingga tanaman tidak kekeringan.
DAFTAR PUSTAKA
Abreu ME, Munne ´ -Bosch S. 2009. Salicylic acid deficiency in NahG transgenic lines and sid2 mutants increases seed yield in the annual plant Arabidopsis thaliana. J Experiment Bot. 60, 1261–1271.
Badan Pusat Statistik. 2012. Produksi Bunga Potong di Indonesia. http://www.bps.go.id [2012 November 16].
Balai Pengkajian Teknologi Pertanian Bali, 2008. Membuat pupuk cair bermutu dari limbah kambing. Warta Penelitian dan Pengembangan Pertanian Indonesia
Balai Penelitian Tanah. 2005. Pupuk Organik Tingkatkan Produksi Pertanian. Warta Penelitian dan Pengembangan Pertanian Indonesia.
Bakti PLW. 2009. Analisis kandungan klorofil dan laju fotosintesis tebu transgenik ps-ipb 1 yang ditanam di kebun percobaan PG Djatiroto, Jawa Timur [skripsi]. Bogor (ID) Institut Pertanian Bogor.
Boonlertnirun S, Sarobol E, Sooksathan. 2005. Studies on chitosan concentration and frequency of foliar application on rice yield potential c.v Suphunburi 1. 31st Congress on Science and Technology of Thailand. Suranaree University of Technology Thailand.
Chandrkrachang, S. 2002. The applications of chitin in agriculture in Thailand. Advances in Chitin Science 5, 458-462 In Uthairatanakij, A., Jaime A. Teixeira da Silva., and Obsuwan, K. 2007. Chitosan for Improving Orchid Production and Quality. Orchid Science and Biotechnol.
Chandrkrachang S, Sompongchaikul P, Teuntai S .2003. Effect of chitosan applying in multicuture crop plantation. National Chitin-Chitosan Conference July 17-18, 2003, Chulalongkorn University, Bangkok, Thailand.
Direktorat Budidaya dan Pasca Panen Florikultura. 2011. Buku Pintar, Series Tanaman Anggrek. Jakarta (ID): Direktorat Budidaya dan Pasca Panen Florikultura, Direktorat Florikultura, Kementrian Pertanian.
EPA .1995. Poly-D-glucosamine (chitosan); exemption from the requirement of a tolerance U.S. Environmental Protection Agency, Final Rule. Federal Re-gister 60, 19523-19524. In Uthairatanakij, A., Jaime A. Teixeira da Silva., and Obsuwan, K. 2007. Chitosan for Improving Orchid Production and Quality. Orchid Science and Biotechnol.
Frowine SA. 2005. Orchids for Dummies. Indianapolis, Indiana. Wiley Publishing, Inc.
Gunadi T. 1977. Mengenali Anggrek. Bandung (ID). PAI Cabang Bandung. Gunawan, L.W. 1988. Teknik Kultur Jaringan Tanaman. Pusat Antaruniversitas
Bioteknologi. Bogor (ID). Institut Pertanian Bogor
Gutie´rrez-Coronado MA, Trejo-Lo´pez C, Larque´-Saavedra A.1998. Effects of salicylic acid on the growth of roots and shoots in soybean. Plant Physiol and Biochemist 36, 563–565.
Iswanto H. 2001. Anggrek Phalaenopsis. Jakarta (ID). Agromedia Pustaka.
Iswanto H. 2005. Merawat dan Membungakan Anggrek Phalaenopsis. Jakarta (ID). Agromedia Pustaka.
Jirapornprasert T , Seraypheap K, Boon-long P, Pichyangkura R. and Chadchawan S. 2011. Effect of Types and Concentrations of Chitosan on Growth of „Frillice Iceberg‟ Lettuce Cultivated byHydroponic Method .Agricultural Sci. J. 42(2): 29-32
Kaur H, Anand M, Goyal D. Optimization of potting mixture for hardening of in vitro raised plants of Tylophora indica to ensure high survival percentage. Int. J. Med. Arom. Plants. 1: 2, pp.83-88
Kliangkeaw C, Chandrkrachang S, Sawajsila P .2003. A study on the influences of chitosan upon the transplanting and growth of Paphiopedilum bellatulum x Paph. x angthong derived from tissue culture. National Chitin-Chitosan Conference July 17-18, 2003, Chulalongkorn University, Bangkok, Thailand.
Lakani I. 2012. Identifikasi dan karakterisasi beberapa virus yang menginfeksi tanaman anggrek di Jawa serta induksi ketahanan sistemik tanaman anggrek dengan asam salisilat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lopez R, Runkle E, Wang YT, Blanchard, and Hsu T. 2007. Growing the Best Phalaenopsis Part 3: Temperature and Light Requirements, Height, Insect and DiseaseControl [Internet]. [Waktu dan tempat pertemuan tidak diketahui]. [diunduh 2012 Jul 5]. Tersedia pada: http://www.hrt.msu.edu/faculty/Runkle/Orchid/Articles/Growing_the_Best _Phalaenopsis_Part_3.pdf.
Muhit A. 2010. Teknik penggunaan beberapa jenis media tanam alternatif dan zat pengatur tumbuh pada Anggrek Bulan. Bul. Teknik Pertanian. 15: 60-62. Noer IR 2012. Pengaruh Pupuk Organik Guano dan Chitosan terhadap
pertumbuhan dan Perkembangan Anggrek Phalaenopsis spp [skripsi] Bogor (ID): Institut Pertanian Bogor.
Orchid Society of South East Asia. 1998. Orchid Growing In The Tropics. Malaysia.
Pardal SJ, Wattimena GA, Aswidinoor H, Herman M. 2005. Transformasi genetik kedelai dengan gen proteinase inhibitor II menggunakan teknik penembakan partikel. J. AgroBiogen 1(2): 53−61.
Rivas, M -San Vicente Plasencia, J. 2011. Salicylic acid beyond defence: its role in plant growth and development. J Experiment Bot, Vol. 62, No. 10, pp. 3321–3338.