PROFIL INTERLEUKIN 4 (IL-4) DAN INTERFERON GAMMA (IFN γ) Mus musculus Balb-C PASCA INJEKSI KELENJAR SALIVA Anopheles maculatus (Diptera: Culicidae) SEBAGAI MODEL Transmission Blocking Vaccine (TBV) MELAWAN MALARIA
SKRIPSI
oleh Ika Agus Rini NIM 081810401005
JURUSAN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS JEMBER
ii
PERSEMBAHAN
Skripsi ini saya persembahkan untuk:
1. bapak saya Ngadianto dan ibu saya Sunarti, atas segala dukungan dan do’a yang terus terpanjat pada setiap sujudnya;
2. adik saya Ferry Dwi Dewantoro yang selalu mendukung setiap langkahku; 3. guru-guru sejak Sekolah Dasar (SD) sampai perguruan tinggi, atas bimbingan
dan dukungannya;
4. Almamater Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember.
iii MOTTO
“...contoh itu Kami buat untuk manusia dan tidak ada yang mengerti kecuali orang-orang berilmu.”
(Surat Al-Ankabut, ayat 43)i
“Orang berilmu dan beradap tidak akan diam di kampung halaman. Tinggalkanlah negerimu dan merantaulah ke negeri orang. Merantaulah, kau akan dapatkan pengganti dari kerabat dan kawan.
Berlelah-lelahlah, manisnya hidup terasa setelah lelah berjuang.” (Imam Safi’i)ii
iYayasan Penyelenggara Penterjemah/Pentafsir Alqur’an.1971. Al Qur’an dan Terjemehan. Sausi Arabia
iv
PERNYATAAN
Saya yang bertanda tangan di bawah ini: nama : Ika Agus Rini
NIM : 081810401005
menyatakan dengan sesungguhnya bahwa karya ilmiah saya yang berjudul “Profil Interleukin 4 (IL-4) dan Interferon Gamma (IFN γ) Mus Musculus Balb-C Pasca Injeksi Kelenjar Saliva Anopheles maculatus (Diptera: Culicidae) sebagai Model Transmission Blocking Vaccine (TBV) Melawan Malaria” adalah benar-benar hasil karya sendiri, kecuali kutipan yang sudah saya sebutkan sumbernya, belum pernah diajukan pada institusi mana pun, dan bukan karya jiplakan. Penelitian ini merupakan bagian dari proyek penelitian berjudul “Karakterisasi Molekuler Komponen Immonomodulator Salivary Gland Vektor sebagai Target kandidat dalam Penegmbangan TBV melawan Malaria” dan dibiayai program Hibah Strategis Nasional, DIPA Universitas Jember atas nama Dr. rer. nat. Kartika Senjarini. Saya bertanggung jawab atas keabsahan dan kebenaran isinya sesuai dengan sikap ilmiah yang harus dijunjung tinggi.
Demikian pernyataan ini saya buat dengan sebenarnya, tanpa ada tekanan dan paksaan dari pihak mana pun serta bersedia mendapat sanksi akademik jika ternyata dikemudian hari pernyataan ini tidak benar.
Jember, 21 Desember 2012 Yang menyatakan,
Ika Agus Rini NIM 081810401005
v SKRIPSI
PROFIL INTERLEUKIN 4 (IL-4) DAN INTERFERON GAMMA (IFN γ) Mus musculus Balb-C PASCA INJEKSI KELENJAR SALIVA Anopheles maculatus (Diptera: Culicidae) SEBAGAI MODEL Transmission Blocking Vaccine (TBV) MELAWAN MALARIA
Oleh
Ika Agus Rini NIM 081810401005
Pembimbing :
Dosen Pembimbing Utama : Dr. rer. nat. Kartika Senjarini S.Si., M.Si Dosen Pembimbing Anggota : Sri Mumpuni WW S.Pd., M.Si
vi
PENGESAHAN
Skripsi berjudul “Profil Interleukin 4 (IL-4) dan Interferon Gamma (IFN γ) Mus Musculus Balb-C Pasca Injeksi Kelenjar Saliva Anopheles maculatus (Diptera: Culicidae) sebagai Model Transmission Blocking Vaccine (TBV) Melawan Malaria” telah diuji dan disahkan pada :
hari, tanggal :
tempat : Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas jember
Tim Penguji : Ketua,
Dr. rer. nat. Kartika Senjarini NIP 197509132000032001
Sekretaris,
Sri Mumpuni WW S.Pd., M.Si NIP 197105101999032002 Anggota I,
Dr. Hidayat Teguh Wiyono M.Pd NIP 195805281988021002
Anggota II,
Drs. Rudju Winarsa M.Kes NIP 196008161989021001 Mengesahkan
Dekan,
Prof. Drs. Kusno DEA., Ph.D NIP 196101081986021001
vii RINGKASAN
Profil Interleukin 4 (IL-4) dan Interferon Gamma (IFN γ) Mus Musculus Balb-C Pasca Injeksi Kelenjar Saliva Anopheles maculatus (Diptera: Culicidae) sebagai Model Transmission Blocking Vaccine (TBV) Melawan Malaria; Ika Agus Rini; 081810401005; 2012; 40 halaman; Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember.
Saat ini malaria merupakan salah satu masalah besar bagi kesehatan masyarakat dunia terutama negara tropis serta sub tropis. Penyakit ini disebabkan oleh protozoa yaitu Plasmodium yang dibawa oleh nyamuk Anopheles betina. An. maculatus merupakan vektor utama malaria di Pulau Jawa dan Sumatera. Berbagai upaya telah dilakukan untuk memberantas malaria, mulai dari pemberantasan vektor menggunakan insektisida maupun pemberantasan parasit dengan obat anti malaria. Akan tetapi upaya tersebut masih belum efektif karena menimbulkan resistensi. Akhir-akhir ini telah berkembang pendekatan baru dalam upaya pengembangan TBV yaitu dengan memanfaatkan komponen saliva vektor arthropoda sebagai kandidat target TBV berbasis vektor. Beberapa penelitian terdahulu menyatakan bahwa kelenjar saliva mengandung senyawa protein (immunomodulator) yang dapat menekan respon imun inang. Berdasarkan fakta tersebut peningkatan proses transmisi patogen dapat dikendalikan dengan melakukan vaksinasi terhadap anti dari senyawa aktif tersebut. Oleh karena itu pengembangan vaksin berbasis saliva vektor yang dimungkinkan dapat memutus transmisi parasit dan meningkatkan sistem imun sangat penting sebagai strategi untuk mengatasi malaria. Dalam penelitian ini akan diamati aktivitas kelenjar saliva An. maculatus dalam memodulasi respon imun hewan coba dengan melihat profil imun IL-4 dan IFN γ. Tujuan penelitian ini untuk mempelajari potensi saliva sebagai kandidat target potensial untuk pembuatan TBV dan untuk mengetahui profil IL-4 dan IFN γ Mus musculus Balb-C pasca injeksi dengan kelenjar saliva An. maculatus yang akan digunakan sebagai model Transmission Blocking Vaccine (TBV) untuk melawan malaria.
viii
Metode yang digunakan dalam penelitian ini antara lain: 1) rearing nyamuk An. maculatus,2) preparasi sampel kelenjar saliva, 3) persiapan hewan coba, 4) optimasi dosis anestesi, 5) pembuatan vaksin model dengan kelenjar saliva An. maculatus, 6) injeksi vaksin model kelenjar saliva An. maculatus dan pengambilan darah melalui ekor Mus musculus, 7) pengukuran kadar IL-4 dan IFN γ menggunakan metode ELISA.
Hasil yang didapatkan dari penelitian ini adalah ekstrak kelenjar saliva An. maculatus terbukti mampu memodulasi respon imun inang dalam penelitian ini. Hal ini ditunjukkan dengan perubahan kadar sitokin IL-4 dan IFN γ pada kelompok yang divaksinasi jika dibandingkan dengan kelompok yang tidak divaksinasi dengan vaksin model ekstrak kelenjar saliva tersebut. Faktor immunomodulator yang berperan pada penurunan kadar IL-4 dimungkinkan bersifat soluble sedangkan pada kenaikan kadar IFN γ dimungkinkan bersifat insoluble. Oleh karena itu, pengembangan vaksin berbasis ekstrak kelenjar saliva An. maculatus harus melibatkan kedua fraksi kelenjar saliva tersebut.
ix PRAKATA
Puji Syukur kehadirat Allah S.W.T yang telah memberikan limpahan rahmat, nikmat serta hidayahNya sehingga penulis dapat menyusun dan menyelesaikan skripsi yang berjudul “Profil Interleukin 4 (IL-4) dan Interferon Gamma (IFN γ) Mus
Musculus Balb-C Pasca Injeksi Kelenjar Saliva Anopheles maculatus (Diptera: Culicidae) sebagai Model Transmission Blocking Vaccine (TBV) Melawan Malaria”. Skripsi ini disusun untuk memenuhi salah satu prasyarat dalam menyelesaikan pendidikan strata satu (S1) Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Jember.
Penyusunan skripsi ini tidak lepas dari bimbingan, bantuan, dan dukungan dari berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih kepada:
1. Dr. rer. nat. Kartika Senjarini S.Si., M.Si dan Sri Mumpuni WW S.Pd., M.Si selaku dosen pembimbing, yang dengan penuh kesabaran telah meluangkan waktu, pikiran, saran serta motivasi dalam penulisan skripsi ini;
2. Dr. Hidayat Teguh Wiyono M.Pd dan Drs. Rudju Winarsa M.Kes selaku dosen penguji yang telah memberi banyak kritik dan saran yang sangat membangun dalam penyusunan skripsi ini;
3. Prof. Drs. Sudarmadji, MA, Ph.D, selaku dosen pembimbing akademik dan dr. Yunita Armiyati M.Kes yang telah banyak memberikan bimbingan dan motivasi selama berada pada masa perkuliahan sampai dengan terselesaikannya skripsi ini;
4. bapak dan ibu dosen serta seluruh staf di lingkungan FMIPA Universitas Jember, atas segala ketulusan dan keikhlasannya dalam membantu penulis selama masa perkuliahan;
5. bapak, ibu dan adik serta keluarga besar di Kaliasem yang telah memberikan semangat dan doa serta segala dukungan kepada penulis demi terselesaikannya skripsi ini;
x
6. rekan kerja seperjuangan Imam Hanafy, Zahira Rajab, Syubbanul Wathon, Dewi Eka, Madaniyah, Arif Setiawan, Pak Ali, Pak Adrial, teman-teman FK (Dani, Dini, Harmas) teman-teman Mikrobiologi (Niar, Mbak Zizah, Lutfi) teman-teman Sugar Group (Edia, Hiday, Rinda) terimakasih atas kerjasama dan dukungan serta bantuannya selama ini;
7. kakak-kakak seperjuangan Riskha, Esti, Dina dan adik-adik seperjuangan Moh. Mirza dan Rofi’atul serta teman-teman seperjuangan Wisnu, Rasit, Adifa, May, Rudi, Duy, Icha, Lia, Nur Indah, yang selalu memberikan dukungan dan semangatnya;
8. staf B2V2RP dan teknisi Laboratorium Biomedik UB, yang telah meluangkan waktu dan tenaganya dalam penyediaan sampel dan lancarnya proses penelitian;
9. teman-teman Yayasan As-Sa’adah, Ika Revi, Mbak Ucok, Mbak Moo, Mbak Zahro yang senantiasa memberi motivasi dan semangat disaat letih dalam pengerjaan skripsi ini;
10. teman-teman Biologi angkatan 2008 yang tergabung dalam “Omfalomesenterika”, atas motivasi, dukungan serta bantuan dalam pengerjaan skripsi ini dan teman-teman BEM kepengurusan 2012-2013 serta Himabio “Bakteriophage” yang selalu memberi dukungan di sela kesibukannya;
11. serta semua pihak yang tidak dapat disebutkan satu persatu.
Penulis juga menerima segala kritik dan saran dari semua pihak demi kesempurnaan skripsi ini. Akhirnya penulis berharap semoga skripsi ini dapat bermanfaat.
Jember, Desember 2012 Penulis
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSEMBAHAN ... ii
HALAMAN MOTTO ... iii
HALAMAN PERNYATAAN ... iv HALAMAN PEMBIMBINGAN ... v HALAMAN PENGESAHAN ... vi RINGKASAN ... vii PRAKATA ... ix DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB 1. PENDAHULUAN ... 1.1 Latar Belakang ... 1.2 Rumusan Masalah ... 1.3 Batasan Masalah ... 1.4 Tujuan Penelitian ... 1.5 Manfaat Penelitian ... 1 1 3 3 4 4 BAB 2. TINJAUAN PUSTAKAN ... 2.1 Malaria dan Penatalaksanaan ... 2.2 Parasit Malaria dan Transmisinya ke Manusia ... 2.3 Imunologi Malaria ... 2.4 An. maculatus sebagai Salah Satu Vektor Penting di Indonesia ... 2.5 Kelenjar Saliva Vektor Malaria sebagai Kandidat target Potensial untuk Pembuatan TBV Malaria ... 5 5 6 8 9 13 BAB 3. METODE PENELITIAN ... 16
xii
3.1 Tempat dan Waktu Penelitian ... 3.2 Alat dan Bahan ... 3.3 Cara Kerja ... 3.3.1 Rearing nyamuk An. Maculatus ... 3.3.2 Preparasi sampel kelenjar saliva ... 3.3.3 Persiapan hewan coba ... 3.3.4 Optimasi dosis anestesi ... 3.3.5 Pembuatan vaksin model dengan kelenjar saliva
An. maculatus ... 3.3.6 Injeksi vaksin model kelenjar saliva An. maculatus dan
pengambilan darah melalui ekor Mus musculus ... 3.3.7 Pengukuran kadar IL-4 dan IFN γ ...
16 16 17 17 17 18 18 19 19 20 BAB 4. HASIL DAN PEMBAHASAN ...
4.1 Hasil ... 4.1.1 Identifikasi nyamuk An. maculatus ... 4.1.2 Kelenjar Saliva An. maculatus ... 4.1.3 Kadar IL 4 dan IFN γ Individu ... 4.1.4 Kadar IL 4 dan IFN γ Populasi ... 4.2 Pembahasan ... 22 22 22 23 24 26 28 BAB 5. KESIMPULAN DAN SARAN ...
5.1 Kesimpulan ... 5.2 Saran ... 33 33 33 DAFTAR PUSTAKA ... 34 LAMPIRAN-LAMPIRAN
A. TABEL UJI ELISA ... B. KURVA STANDART ELISA ...
41 41 43
xiii
DAFTAR GAMBAR
Halaman
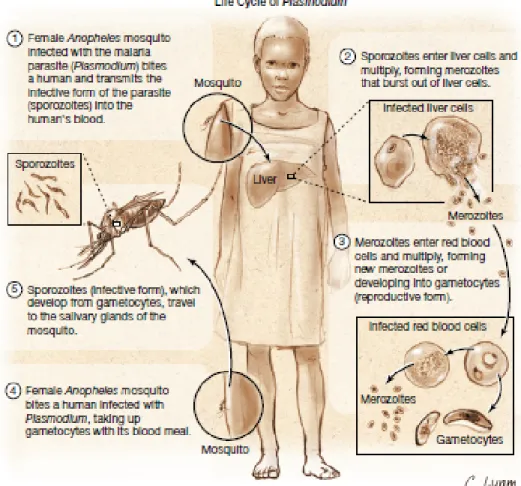
Gambar 2.1 Siklus Hidup Plasmodium ... 8
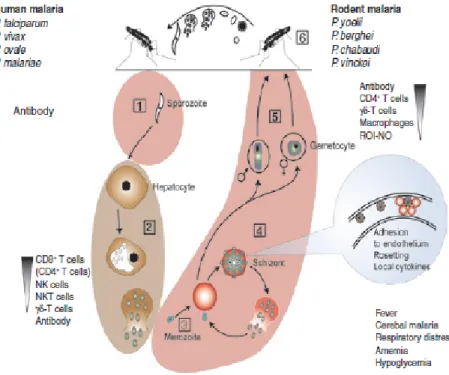
Gambar 2.2 Respon Imun terhadap Infeksi Malaria ... 10
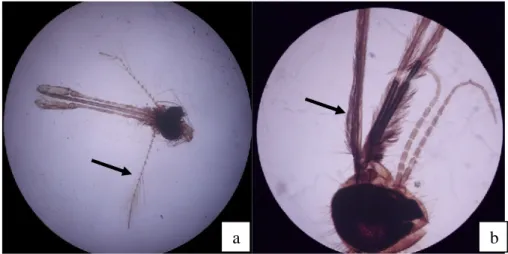
Gambar 4.2 Morfologi antena nyamuk jantan dan betina ... 22
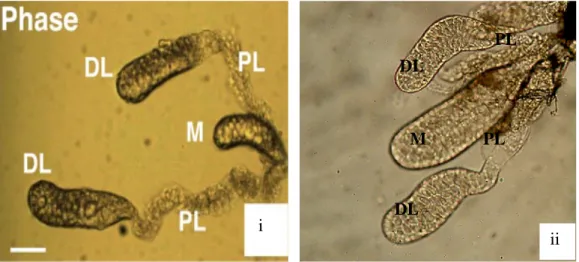
Gambar 4.3 Morfologi kelenjar saliva An. maculatus ... 23
Gambar 4.4 Kadar IL-4 dari masing-masing kelompok ... 24
Gambar 4.5 Kadar IFN γ dari masing-masing kelompok ... 25
Gambar 4.6 Kadar IL-4 populasi dari masing-masing kelompok ... 26
xiv
DAFTAR LAMPIRAN
Halaman A. Kadar IL4 dan IFN γ ... 41 B. Kurva standart ELISA ... 43
1
BAB 1. PENDAHULUAN
1.1 Latar Belakang
Saat ini malaria merupakan salah satu masalah besar bagi kesehatan masyarakat dunia terutama negara tropis serta sub tropis. Indonesia merupakan daerah endemis malaria, walaupun telah dilakukan upaya pemberantasan, namun hingga saat ini angka kematian masih cukup tinggi. Indonesia merupakan salah satu negara yang masih berisiko terhadap malaria. Pada tahun 2007 di Indonesia terdapat 396 Kabupaten endemis dari 495 Kabupaten yang ada, dengan perkiraan sekitar 45% penduduk berdomisili di daerah yang berisiko tertular malaria (Kemenkes, 2009). Penyakit ini disebabkan oleh protozoa yaitu Plasmodium yang dibawa oleh nyamuk Anopheles betina (Zein, 2006). Jumlah spesies Anopheles di Indonesia mencapai 80 spesies, 24 diantaranya merupakan vektor malaria. Salah satu dari vektor malaria tersebut adalah Anopheles maculatus (Dale, 2005). An. maculatus merupakan vektor utama malaria di Pulau Jawa dan Sumatera (Harmendo, 2008).
Berbagai upaya telah dilakukan untuk memberantas malaria. Salah satunya adalah pengendalian vektor dengan pemberantasan menggunakan insektisida. Salah satu insektidisa yang paling sering digunakan adalah Dichloro-Diphenyl-Trichloroethane (DDT). Akan tetapi penggunaan DDT ini justru menimbulkan beberapa resistensi pada vektor (WHO, 2006; Raghavendra, 2011). Oleh karena itu upaya pemberantasan vektor ini masih belum efektif dalam pemberantasan malaria. Selain itu pada dekade terakhir ini diketahui adanya resistensi parasit terhadap obat antimalaria yaitu klorokuin dan sulfadoksin-pirimetamin (Dachlan, 2004). Di Indonesia, resistensi terhadap klorokuin ditemukan pertama kali di daerah Kalimantan Timur pada tahun 1974, dan pada tahun 1996 kasus-kasus malaria yang resisten klorokuin ditemukan di seluruh
2
provinsi Indonesia (Acang, 2002; Laihad, 2000). Berbagai penelitian terus dilakukan dalam rangka mengatasi resistensi parasit malaria terhadap obat antimalaria, salah satunya dengan mengkombinasikan beberapa obat antimalaria (WHO, 2000). Beberapa terapi kombinasi telah dilaporkan dalam usaha mengatasi malaria dengan resistensi obat, tetapi sampai saat ini belum ada yang efektif dan aman (Zein, 2006). Meskipun implementasi teknologi pengendalian malaria seperti insektisida kelambu dan kemoterapi bisa mengurangi angka kematian secara substansial, namun malaria masih menjadi re-emerging desease (Moorthy et. al, 2004). Oleh karena itu, pencegahan dengan pengembangan vaksin malaria merupakan alternatif yang harus dikembangkan untuk pemberantasan malaria. Karena kompleksitas dari siklus hidup parasit, dengan dua inang yaitu manusia dan nyamuk maka vaksin yang efektif harusnya dapat menggabungkan seluruh siklus hidup parasit tersebut yaitu pre-eritrositik, eritrositik dan vaksin penghambat transmisi. Vaksin pre-eritrositik merupakan vaksin yang dapat mencegah invansi sporozoit ke dalam sel hati atau jika telah terjadi invansi maka akan memblok pembentukan merozoit di hati. Vaksin eritrositik adalah vaksin yang mencegah merozoit menginfeksi hepatosit dan invansi eritrosit yang sehat, sedangkan vaksin transmisi adalah vaksin yang menghambat transmisi yang didasarkan pada ekspresi antigen di permukaan gamet atau pada midgut nyamuk (Chattopadhyay & Kumar, 2009). Sementara itu vaksin penghambat transmisi (TBV) akan memberikan keuntungan dengan menginduksi produksi antibodi pada host vertebrata sehingga menghambat perkembangan parasit dalam midgut nyamuk. (Lavazec et. al, 2007).
Akhir-akhir ini telah berkembang pendekatan baru dalam upaya pengembangan TBV yaitu dengan memanfaatkan komponen saliva vektor arthropoda sebagai kandidat target TBV berbasis vektor (Titus et al., 2006). Saliva nyamuk mengandung komponen-komponen yang dapat mempengaruhi homeostasis antara lain vasodilator, inhibitor koagulasi darah, immunomodulator dan agregasi platelet (Eric et al, 2007; Lavazec et al, 2007). Fungsi dari faktor
3
vasodilator yaitu dapat memperlebar pembuluh darah saat vektor menggigit hospes atau inang, sehingga dapat memudahkan vektor untuk menghisap darah. Faktor imunomodulator berfungsi untuk mempermudah vektor mentransmisikan patogen ke dalam tubuh inang dengan cara memodulasi respon imun inang. Berdasarkan fakta tersebut peningkatan proses transmisi patogen dapat dikendalikan dengan melakukan vaksinasi terhadap anti dari senyawa aktif tersebut (Titus et al., 2006). Hal ini dibuktikan oleh Donovan et al. (2007) yang menunjukkan bahwa paparan nyamuk yang berulang-ulang dapat merubah respon imun inang dari T helper 2 (Th2) ke arah T helper 1 (Th1). Pergeseran respon imun tersebut ditandai dengan peningkatan kadar IFN γ dan menurunnya kadar IL-4. IFN γ berperan untuk mengaktifkan makrofag yang akan memproduksi Nitrat Oksida (NO) sehingga dapat membunuh parasit malaria.
Oleh karena itu pengembangan vaksin berbasis saliva vektor yang dimungkinkan dapat memutus transmisi parasit dan meningkatkan sistem imun sangat penting sebagai strategi untuk mengatasi malaria. Dalam penelitian ini akan diamati aktivitas kelenjar saliva An. maculatus dalam memodulasi respon imun hewan coba dengan melihat profil imun IL-4 dan IFN γ.
1.2 Rumusan Masalah
Bagaimana profil IL-4 dan IFN γ pra dan pasca injeksi kelenjar saliva An. maculatus pada hewan coba Mus musculus Balb-C?
1.3 Batasan penelitian
a. Penelitian ini menggunakan kelenjar saliva salah satu vektor utama malaria Anopheles maculatus;
b. Respon imun yang diamati meliputi pengamatan profil IL-4 dan IFN γ dari hewan coba Mus musculus Balb-C secara kuantitatif.
4
1.4 Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mempelajari potensi saliva sebagai kandidat target potensial untuk pembuatan TBV. Secara khusus tujuan penelitian ini adalah untuk mengetahui profil IL-4 dan IFN γ Mus musculus Balb-C pasca injeksi dengan kelenjar saliva An. maculatus yang akan digunakan sebagai model Transmission Blocking Vaccine (TBV) untuk melawan malaria.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi kepada masyarakat tentang potensi kelenjar saliva sebagai model pengembangan vaksin malaria.
5
BAB 2. TINJAUAN PUSTAKA
2.1 Malaria dan Penatalaksanaan
Malaria merupakan salah satu penyakit tropis yang paling penting, sebagian besar daerah beriklim tropis terserang penyakit menular ini, akan tetapi penyakit ini juga dapat terjadi di iklim daerah lain (WHO, 2011). Malaria masih menjadi masalah kesehatan masyarakat di dunia. Penyakit ini mempengaruhi tingginya angka kematian ibu hamil, bayi dan balita. Setiap tahun lebih dari 500 juta penduduk dunia terinfeksi malaria dan lebih dari satu juta orang meninggal dunia, lebih dari 80% adalah anak-anak yang berusia kurang dari 5 tahun. Kasus terbanyak terdapat di Afrika dan beberapa negara Asia termasuk Indonesia, Amerika Latin, Timur Tengah dan beberapa bagian negara Eropa. Kini penyakit malaria banyak dijumpai di Meksiko, sebagian Karibia, Amerika Tengah dan Selatan, Afrika Sub-Sahara, India, Asia Selatan, Asia Tenggara, Cina dan pulau-pulau Pasifik Selatan. Penyakit infeksi ini yang disebabkan oleh parasit Plasmodium berukuran mikroskopis yang hidup dan berkembangbiak dalam sel darah merah manusia. Penyakit ini secara alami ditularkan oleh gigitan nyamuk Anopheles betina. (Parmet et al, 2007; Depkes, 2010; Harijanto, 2010; WHO, 2011). Plasmodium memiliki taksonomi sebagai berikut :
Filum : Apicomplexa
Klas : Sporozoa
Sub klas : Cocidiidae Ordo : Eucoccidiidae Sub ordo : Haemosporidiidae Familia : Plasmodiidae
6
Pencegahan penyakit malaria dapat dilakukan dalam berbagai cara seperti pengendalian nyamuk pembawa malaria dengan penggunaan kelambu dan penyemprotan insektisida serta vaksinasi. Penggunaan insektisida, mendapat ancaman dari berbagai pihak karena bahan-bahan kimia yang terkandung di dalamnya dapat merusak lingkungan (Chattopadhyay & Kumar, 2009).
Secara global World Health Organization telah menetapkan pengobatan malaria dengan memakai obat ACT (Artemisin base Combination Therapy). Pada ACT golongan artemisin (ART) telah terpilih sebagai obat utama karena efektif dalam mengatasi Plasmodium yang resisten dengan pengobatan. Artemisin juga bekerja membunuh Plasmodium dalam semua stadium termasuk gametosit dan efektif terhadap semua spesies Plasmodium. Obat ACT yang saat ini tersedia di Indonesia adalah Artesdiaquine yang merupakan kombinasi dari Artesunate dan Amodiaquin (Harijanto, 2010).
2.2 Parasit Malaria dan Transmisinya ke Manusia
Parasit malaria yang berupa spesies Plasmodium terdiri dari 4 spesies yang telah ditemukan pada manusia, yaitu Plasmodium vivax, Plasmodium falciparum, Plasmodium ovale dan Plasmodium malarie (Harijanto, 2010). Parasit tersebut memiliki siklus hidup yang komplek yang meliputi dua inang yaitu manusia dan nyamuk. Siklus hidup Plasmodium membutuhkan dua hospes yaitu vertebra (manusia) dan avertebrata (nyamuk Anopheles). Siklus hidupnya dimulai secara aseksual pada tubuh vertebrata serta siklus seksualnya pada tubuh nyamuk. Secara aseksual Plasmodium melalui 3 stadium yaitu eksoeritrositik skizogoni, stadium eritrositik skizogoni dan sporogoni yang menghasilkan bentuk invasif merozoit dan sporozoit (Rinidar, 2010).
Siklus aseksual di dalam inang vertebrata dikenal sebagai skizogoni, sedangkan siklus seksual yang membentuk sporozoit di dalam nyamuk dikenal sebagai sporogoni. Sporozoit yang aktif dapat ditularkan ke dalam tubuh manusia melalui ludah nyamuk ketika menghisap darah manusia, setelah itu sporozoit tersebut
7
akan menempati jaringan parenkim hati dan tumbuh sebagai skizon. Pada tahap ini disebut dengan stadium ekso-eritrositik atau stadium pra-eritrositik. Sebagian dari sporozoit tidak tumbuh dan tetap tidur (dormant) yang disebut hipnozoit. Sel hati yang mengandung parasit kemudian akan pecah dan membentuk merozoit. Merosoit tersebut akan masuk ke dalam eritrosit sehingga disebut stadium eritrositik, kenampakan pada eritrosit seperti kromatin kecil yang dikelilingi oleh sedikit sitoplasma yang memiliki bentuk cincin yang dikenal sebagai trofozoit. Trofozoit membentuk skizon muda dan setelah matang membelah menjadi merozoit. Setelah proses pembelahan, eritrosit akan hancur, merozoit, pigmen, dan sisa-sisa sel akan keluar dan berada di dalam plasma. Parasit akan difagositosis oleh RES (Retikulo Endotelial Sistem), akan tetapi Plasmodium yang dapat melarikan diri akan masuk kembali ke dalam eritrosit untuk mengulangi stadium skozogoni. Beberapa merozoit tidak membentuk skizon tetapi memulai tahap gametogoni yaitu dengan membentuk mikro dan makrogametosit yang merupakan stadium seksual (Harijanto, 2010).
Nyamuk Anopheles betina yang menghisap darah individu yang terinfeksi malaria, maka gametosit jantan dan betina akan menuju ke dalam usus nyamuk. Perubahan molekuler dan seluler pada gametosit membantu parasit untuk cepat menyesuaikan ke vektor serangga dari inang manusia dan kemudian untuk memulai siklus sporogoni. Gamet jantan dan betina dalam usus nyamuk akan membentuk zigot yang kemudian berkembang menjadi ookinete yang aktif bergerak masuk ke dalam dinding midgut nyamuk untuk berkembang menjadi ookista. Pertumbuhan dan pembelahannya masing-masing menghasilkan ribuan ookista bentuk haploid aktif yang disebut sporozoit. Setelah fase sporogoni dari 8-15 hari, sporozoit pecah kemudian masuk ke dalam rongga tubuh nyamuk, dan menuju kelenjar ludah nyamuk. Ketika nyamuk terinfeksi dengan sporozoit tersebut menghisap darah, sporozoit bisa berpindah dari kelenjar ludah ke dalam aliran darah manusia yang menyebabkan infeksi malaria di inang manusia. (Mury et al, 2005; Widoyono, 2008).
8
2.3 Immunologi Malaria
Infeksi malaria dapat menimbulkan respon imun inang baik respon imun tubuh secara alami maupun adaptif yang dipengaruhi oleh faktor lingkungan. Kekebalan yang diperoleh bersifat spesifik pada setiapm spesies (Perlmann et al., 2002). Menurut Bruce et al., (1980) mendefinisikan respon imun terhadap malaria sebagai suatu keadaan resistensi terhadap infeksi yang diakibatkan oleh semua proses yang melibatkan penghancuran Plasmodia atau dengan membatasi perbanyakannya. Titus et al., pada tahun 2006 melaporkan bahwa air liur kutu memberikan respon kekebalan inang menuju respon tipe 2 (Th2) ditandai oleh produksi IFN γ dan IL-12
9
yang rendah, namun produksi IL-4 dan IL-10 tinggi. Berdasarkan jenis sitokin yang dihasilkan, limfosit T helper dibagi menjadi Th1 yang menghasilkan sitokin proinflamasi TNF-α dan TNF-β yang sekarang disebut limfotoksin, IFN γ, IL-1, IL-6, IL-8, IL-12, berfungsi mengaktifkan imunitas seluler dan non spesifik. Selain itu ada Th2 yang menghasilkan sitokin anti inflamasi yaitu IL-4 dan IL-10 yang mengaktifkan imunitas humoral (Harijanto, 2010).
Mekanisme respon imun manusia terhadap infeksi malaria dapat melalui beberapa tahapan yang komplek. Pada awal infeksi, manusia akan membentuk antibodi yang akan menetralisir sporozoit dan memblokir invasi parasit ke hepatosit sehingga menghambat fase pre-eritrositik, selain pembentukan antibodi dalam tubuh inang antigen pada parasit akan menginduksi IFN-γ, limfosit T sitotoksik (CD8+), sel T (CD4+), dan Natural Killer (NK) untuk membunuh parasit intrahepatik yang lolos pada fase pre-eritrositik. Ketika parasit akan memasuki fase eritrositik maka antibodi pada tubuh akan mengaglutinasi merozoit sehingga menghambat invasi sel darah merah sehingga mencegah fase eritrositik. Antibodi sel darah merah akan menuju ke permukaan sel darah merah yang terinfeksi untuk fagositosis dan memblokir adhesi sel darah merah yang terinfeksi, selain itu TNF dan IFN-γ mengaktifkan makrofag untuk memfagosit dan membunuh sel darah merah yang terinfeksi merozoit. Antibodi yang melekat pada toksin malaria glycosylphosphatidylinositol (GPI) akan menetralisir toksin parasit tersebut dan mencegah induksi inflamasi berlebihan kemudian dapat mencegah penyerapan dan pematangan gametosit. Antibodi dan komplemen akan terikut ketika nyamuk menghisap darah dan dapat memediasi untuk melisiskan gametosit, mencegah pembuahan dan perkembangan lebih lanjut dari parasit dalam tubuh nyamuk (Langhorne, 2008).
2.4 An. maculatus sebagai Salah Satu Vektor Malaria Penting di Indonesia Vektor adalah organisme yang secara aktif memindahkan mikroorganisme penyebab penyakit dari penderita kepada orang lain yang sehat. Salah satunya adalah arthropoda, yaitu hewan yang mempunyai tubuh bersegmen-segmen. Hewan ini
10
memiliki tonjolan tubuh (appendagis) yang berpasangan seperti antena, kaki dan sayap sehingga tubuhnya simetris (CDC, 2004; Soedarto, 2008).
Gambar 2.2 Respon Imun terhadap Infeksi Malaria (Sumber: Langhorne, 2008)
Malaria pada manusia hanya dapat ditularkan oleh nyamuk Anopheles betina. Dari lebih 400 spesies Anopheles di dunia, hanya sekitar 67 spesies terbukti mengandung sporozoit dan dapat menularkan malaria. Di Indonesia telah ditemukan 22 spesies Anopheles yang menjadi vektor malaria, diantaranya; Anopheles aconitus, Anopheles maculatus, Anopheles barbirostris, Anopheles sundaicus, Anopheles balabacensis dan lain sebagainya (Wigati, 2010), sedangkan yang berpotensi sebagai vektor penting di Jawa adalah spesies Anopheles seperti An. aconitus, An. maculatus, dan An. sundaicus karena hadir sepanjang tahun (Stoops et al, 2009).
11
Untuk melangsungkan kehidupannya nyamuk Anopheles memiliki beberapa syarat yang harus ada yaitu tempat perindukan vektor (breeding places), tempat untuk mendapatkan makanan atau darah (feeding places), dan tempat untuk beristirahat (reesting places). Nyamuk Anopheles betina yang telah kawin, akan beristirahat 1-2 hari kemudian baru mencari makan kembali (Rinidar, 2010). Tempat yang paling banyak dikunjungi nyamuk malaria untuk berkembang biak adalah tempat dengan air jernih yang tidak mengalir. Nyamuk betina umumnya bersifat zoofilik dan juga bersifat eksofilik, yaitu puncak keaktifan menghisap darah mulai senja hingga menjelang tengah malam, meskipun aktivitasnya dapat terus berlangsung hingga pagi hari dan cenderung bersifat eksofagik, yaitu hampir selalu menghisap darah di luar rumah (Sumatri & Djoko, 2005).
Siklus hidup nyamuk pada umumnya mengalami metamorfosis sempurna (holometabola) yaitu stadium telur, larva, pupa dan dewasa serta menyelesaikan daur hidupnya selama 7-14 hari. Tahapan ini dibagi ke dalam 2 (dua) perbedaan habitatnya yaitu lingkungan air (aquatic) dan di daratan (terrestrial). Sebagian besar nyamuk mencari pasangannya tidak lama setelah muncul dari pupa. Setelah kawin, sperma disalurkan dari jantan ke betina melalui spermathecanya. Sperma ini dalam spermatheca, biasanya berfungsi untuk membuahi semua telur selama hidupnya, dengan demikian hanya ada satu kali perkawinan dan inseminasi untuk setiap betina. Dengan beberapa pengecualian, nyamuk betina harus menghisap darah inang dan meminum darah untuk mendapatkan nutrisi yang dibutuhkan untuk pengembangan telur dalam ovarium (Foster & Walker, 2002).
Larva nyamuk memakan ragi, bakteri, protozoa dan berbagai mikro-organisme, dan juga pada tanaman yang membusuk dan bahan hewani yang ditemukan di dalam air, seperti spesies Anopheles yang surface feeders. Ada empat instar larva dan di negara-negara tropis. Perkembangan larva tersebut adalah waktu dari menetas telur hingga proses menjadi pupa, bisa dalam waktu 5-7 hari, tapi banyak spesies membutuhkan sekitar 7-14 hari. Di daerah beriklim secara periodik
12
stadium larva dapat berlangsung beberapa minggu atau bulan, dan beberapa spesies melewati musim dingin sebagai larva (Foster & Walker 2002; Cross, 2004).
Nyamuk jantan dan betina memakan nektar dan buah-buahan yang telah busuk. Tapi nyamuk betina juga harus menghisap darah hewan untuk menyediakan protein untuk telur mereka. Nyamuk dewasa bertahan antara satu minggu dan satu bulan. Betina bertelur dengan jumlah 70-100 buah di permukaan air pada malam hari. Dalam suhu tropis telur menetas setelah 2-3 hari. Larva terletak tepat di bawah permukaan air dan memakan ganggang, setelah 7-14 hari berubah menjadi pupa. Pupa Anopheles berbentuk koma dan merupakan tahap paling aktif dari siklus hidup Anopheles. Setelah dua sampai empat hari dalam pupa bermetamorfosis menjadi nyamuk dewasa. Nyamuk dewasa muncul ketika malam hari dan mampu terbang dalam beberapa menit. Nyamuk biasanya kawin saat terbang. Jantan tertarik kepada betina dengan cara memukul sayapnya, dan memiliki antena yang bertindak sebagai reseptor suara. Setelah kawin, betina mencari makanan berupa darah dan mencari tempat peristirahatan (resting places). Ketika makan darah telah dicerna, ovarium berkembang dan telur matang diletakkan di malam hari (Cross, 2004).
An. maculatus merupakan spesies penting dalam perbukitan terbukti daerah, di daerah pegunungan membabat hutan dan dalam bukit berhutan seperti di Jawa Tengah. Tempat perkembangbiakan meliputi genangan air diterangi matahari di lereng gunung dan sepanjang aliran tepi sungai, selokan, sawah, atau dekat dengan daerah perbukitan. Keberadaannya juga terkait dengan mata air rembesan, kolam renang dan air tergenang yang dibentuk dari jejak kaki ternak (Ndoen, et al., 2010). Habitat An. maculatus adalah pada suhu air antara 24,10 0C – 24.150C, pH berkisar antara 7.13 -7.2, tingkat kekeruhan sebesar 5.11 -5.30 NTU dan angka kepadatan plankton minimal rata-rata 500/liter. Larva nyamuk An. maculatus dapat tumbuh dan berkembang dengan baik pada perairan terbuka baik mengalir maupun tidak mengalir, mata air yang langsung kena sinar matahari dan dengan dasar berupa batu atau tanah (Santoso, 2004, Harmendo, 2008).
13
An. maculatus adalah spesies zoofilik dan menunjukkan aktivitas menghisap darah menjelang malam, memuncak antara pukul 18.00 sampai 21.00. Meskipun An. maculatus memiliki distribusi terluas dari semua spesies dari kelompok itu, akan tetapi vektor ini menjadi vektor dominan pada wilayah berbukit di wilayah India timur, Thailand bagian selatan, semenanjung Malaysia dan Jawa Tengah bagian selatan (Sinka et al, 2011). Spesies ini juga ditemukan dengan puncak kepadatannya antara bulan Februari dan Juni. Aktivitas menghisap darahnya pada spesies ini juga bervariasi menurut musim (Saeung, 2012).
2.5 Kelenjar Saliva Vektor Malaria sebagai Kandidat Target Potensial untuk Pembuatan TBV Malaria
Ketika vektor artropoda menghisap darah vertebrata, vektor artropoda juga melapaskan kelenjar salivanya. Kelenjar saliva mengandung sebagian besar zat yang fungsinya meliputi kemampuan untuk menghambat hemostasis, vasokonstriksi dan pengembangan peradangan dan respon imun (Titus et al, 2006). Jika kelenjar saliva dapat meningkatkan transmisi patogen terhadap tubuh inang, mungkin ia juga dapat digunakan untuk mengontrol penularan patogen dengan melakukan vaksinasi terhadap inang untuk melawan molekul dalam kelenjar saliva yang berpotensi untuk infeksi. Sehingga menghalangi efek meningkatkan infeksi dan dengan demikian dapat mencegah patogen dari pembentukan infeksi pada inang. Kemungkinan ini untuk beberapa alasan yang paling penting untuk mempelajari efek imunomodulator dari kelenjar saliva artropoda karena menawarkan metode baru untuk mengendalikan berbagai macam penyakit yang ditularkan oleh artropoda. Sebuah vaksin berbasis saliva vektor tidak hanya akan melindungi terhadap patogen yang diketahui dapat ditularkan melalui vektor, tetapi juga mampu memotong transmisinya (Titus et al, 2006).
Konsep tentang TBV untuk melawan malaria berasal dari penelitian pada tahun 1958 yang menunjukkan bahwa imunitas yang menghambat transmisi dapat diinduksi
14
pada ayam yang telah divaksinasi dengan campuran stadium seksual dan aseksual Plasmodium gallineceum (Chattopadhyay & Kumar, 2009). Seperti halnya juga konsep TBV menurut Carter tahun 2001 yang menyebutkan bahwa TBV terhadap malaria dimaksudkan untuk menginduksi imunitas terhadap tahapan parasit yang terdapat pada tubuh nyamuk sehingga individu yang diimunisasi dengan TBV tidak dapat mentransmisikan penyakit malaria. Seperti infeksi malaria yang ditularkan terutama dalam jarak beberapa ratus meter dari sumber manusia, TBV yang digunakan dalam suatu komunitas akan melindungi lingkungan terdekat dari individu-individu yang divaksinasi. TBV untuk dua spesies utama malaria pada manusia yaitu P. falciparum dan P. vivax, sedang dalam pengembangan. Kandidat konstruksi TBV untuk kedua spesies Plasmodium tersebut telah berhasil diujikan pada hewan dan pengujian sedang berlangsung dengan materi tingkat klinis pada manusia.
Pengembangan TBV bertujuan untuk memblokir transmisi malaria dari nyamuk ke manusia dengan mencegah parasit malaria dari berkembang di nyamuk. Sementara vaksin tersebut tidak akan secara langsung melindungi individu dari pengembangan diimunisasi malaria klinis, mereka akan mengurangi kemungkinan bahwa individu-individu lain dalam masyarakat mendapatkan malaria dengan mencegah penyebaran infeksi oleh nyamuk (Malaria Vaccine Initiative, 2011). Penelitian tentang pengaruh kelenjar saliva vektor sudah banyak dilakukan. Salah satunya penelitian Gomes et al. pada tahun 2008 yang menyatakan bahwa kelenjar saliva vektor berpengaruh pada hewan coba. Hewan coba yang diimunisasi dengan kelenjar saliva sand flies dapat bertahan dengan derajat parasit yang rendah dan mengalami peningkatan kadar IFN γ/ TGF β serta membentuk proteksi terhadap inang. Oleh sebab itu hasil penelitian ini memperkuat konsep menggunakan komponen kelenjar saliva Artropoda dapat dikembangkan sebagai vaksin. Pengembangan tersebut merupakan salah satu strategi terhadap vector borne diseases.
Penelitian yang dilakukan oleh Donovan et al., (2007) menunjukkan bahwa jaringan lokal dan lingkungan sistemik pada inang yang diimunisasi dengan
15
menggunakan komponen saliva nyamuk Anopheles bisa meningkatkan imunitas terhadap infeksi malaria pada inangnya. Selain itu, peningkatan Th1 yang ditunjukkan dengan adanya peningkatan IFN-γ, IL-12, iNOS dan penurunan kadar IL-4 membuktikan bahwa terjadi pergeseran respon imun dari Th2 ke arah Th1. Pergeseran respon imun tersebut dimungkinkan lebih efektif untuk melawan malaria. Oleh karena itu, studi mengenai saliva nyamuk Anopheles merupakan strategi yang tepat untuk dikembangkan dalam pembuatan Transmission Blocking Vaccine berbasis kelenjar saliva. Penelitian lain tentang kelenjar saliva vektor dilakukan di Amerika Serikat pada penyakit yang disebabkan oleh vektor Ixodes scapularismenyatakan bahwa pengaruh vaksinasi dengan protein spesifik saliva Ixodes scapularis pada transmisi Borrelia burgdorferi dalam mencit untuk penyakit Lyme memiliki kemampuan untuk mengurangi beban spirochete pada mencit dibandingkan dengan mencit kontrol (Ullmann & Moore, 2011). Perkembangan vaksin berbasis saliva vektor yang paling maju adalah pada Leishmaniasis. Kemajuan tersebut ditandai dengan ditemukannya protein pada saliva yaitu SP15 dengan berat molekul 15kD dari Plasmodium papatasi yang dapat memberikan proteksi hewan coba terhadap infeksi Leshmania. Hasil tersebut menjadi suatu tantangan dalam pengembangan vaksin yang bersifat universal dan dapat mengontrol transmisi patogen spesifik oleh beberapa spesies vektor, termasuk malaria (Fontaine, 2011)
16
BAB 3. METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Mikrobiologi dan Biologi Dasar, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Jember serta Laboratorium Biomedik Fakultas Kedokteran Universitas Brawijaya. Waktu pelaksanaan dimulai pada bulan Maret sampai dengan bulan September 2012.
3.2 Alat dan bahan
Alat yang diperlukan dalam penelitian ini adalah eppendoft ukuran 1,5 ml, botol schott, gelas ukur, gelas beker, magnetic stirrer, pH meter, autoclave, aluminium foil, isolasi penunjuk sterilitas, wadah air, mikropipet dan mikrotip 1 set (ukuran 0,5-10µL, 10-100µL, dan 100-1000µL), multichannel pipet Slide, jarum diseksi, ice bag dan ice pack, laminar air flow, gelas selai, api Bunsen, falcon, insulin dissposible syringe 1 cc, kapas, water sonication, steroform, mikropistil, microscope stereo, mikroskop Olympus, mikroskop stereo, cover glass, vortex, kompor, Mikro Zentrifugen, lemari es (-200C, dan 40C), Cryotube, toples tertutup, gunting bedah, pinset, kandang kasa, pappercup, kasa, dudukan eppendoft, ELISA reader.
Bahan-bahan yang digunakan dalam penelitian ini adalah larutan Phospat Buffer Saline (PBS), HCl, NaOH, aquades, 1500 pasang kelenjar saliva An. maculatus, alkohol 70%, ethanol, ajuvan aluminium hidroksida, air es 40 C, Chloroform, Quantikine® ELISA Mouse IFN γ dan IL-4 Immunoassay.
17
3.3 Cara kerja
3.3.1 Rearing nyamuk An. Maculatus
Rearing nyamuk Anopheles dilakukan skala laboratorium di Laboratorium Zoologi Jurusan Biologi Fakultas MIPA dan Balai Besar Penelitian dan Pengembangan Vektor dan Reservoir Penyakit (B2P2VRP) di Salatiga. Rearing dimulai dari stadium larva yang diperoleh dari hasil landing collection di daerah sekitar Kulon Progo. Sebelum proses rearing dimulai maka dipersiapkan terlebih dahulu kandang nyamuk dewasa dan makanan nyamuk yaitu darah hewan dan sukrosa 5%. Proses rearing diawali dengan pemeliharaan nyamuk dewasa. Nyamuk dewasa dipelihara dalam skala laboratorium serta diberi makan sukrosa 5%. Setelah nyamuk dewasa bertelur maka telur dipindahkan ke tray yang telah diisi cukup air. Kemudian setelah telur menetas sekitar 1-2 hari maka larva dipindahkan ke tray yang lain sampai akhirnya menjadi pupa. Larva-larva yang telah berubah menjadi pupa dipindahkan lagi ke tempat pupa dan dimasukkan ke dalam kandang nyamuk dewasa supaya ketika menetas akan mendapatkan asupan nutrisi yang cukup yaitu darah hewan bagi nyamuk Anopheles betina dan sukrosa 5% bagi nyamuk Anopheles jantan.
3.3.2 Preparasi sampel kelenjar saliva
An. maculatus yang digunakan merupakan hasil rearing dari laboratorium Balai Besar Penelitian dan Pengembangan Vektor dan Reservoir Penyakit (B2P2VRP) di Salatiga. Sebelum diisolasi kelenjar salivanya, nyamuk betina dewasa dimatikan terlebih dahulu menggunakan klorofom. Diseksi kelenjar saliva dari nyamuk betina yang dilakukan dengan metode Bruce-Chwatt, 1980: langkah pertama meletakkan nyamuk di bawah mikroskop stereo pada sisi kanan slide. Kemudian jarum diseksi ditangan kiri menekan dengan lembut pada bagian toraks dan jarum diseksi ditangan kanan menarik bagian kepala dengan perlahan-lahan, setelah kelenjar saliva yang melekat pada bagian kepala (bentuk seperti sosis, berupa badan refraktil) dipotong dan dipindah ke dalam larutan
18
PBS. Kelenjar saliva yang telah diisolasi disimpan pada suhu -20⁰C sampai diperlukan.
3.3.3 Persiapan hewan coba
Langkah awal yang dilakukan untuk persiapan hewan coba adalah menyiapkan kandang dalam keadaan bersih kemudian dimasukkan sekam secukupnya. Selain itu disiapkan juga tempat makan dan tempat minum serta dicek setiap hari. Mus musculus Balb-C yang dipelihara berumur sekitar 2-3 bulan. Sebelum hewan coba diberi perlakuan maka hewan coba diaklimatisasi terlebih dahulu selama 2 minggu. Hewan coba yang akan digunakan dibagi menjadi 3 kelompok yaitu kelompok kontrol, kelompok supernatan dan kelompok pellet.
3.3.4 Optimasi dosis anestesi
Optimasi dosis anestesi dilakukan untuk menemukan dosis anestesi yang tepat. Dengan dosis yang tepat hewan coba tidak akan mati karena over dosis atau dosis tidak berfungsi karena terlalu rendah. Langkah pertama yang dilakukan adalah membuat stock solution dengan konsentrasi 100 mg/ml. 40 µl Xylazine diencerkan dengan 60 µl larutan PBS kemudian ditambahkan dengan ketamin sebanyak 1 ml, sehingga volume total stock solution adalah 1,1 ml. Dari stock solution yang sudah tersedia dibuat beberapa konsentrasi larutan yaitu pengenceran P1, P2, P3 dan P4. untuk formulasi masing-masing perlakuan adalah sebagai berikut;
P1: 25µl stock solution + 75µl PBS P2: 25µl stock solution + 225 µl PBS P3: 50µl stock solution + 250 µl PBS P4: 25µl stock solution + 275 µl PBS
19
3.3.5 Pembuatan vaksin model dengan kelenjar saliva An. maculatus
Langkah pertama memberi perlakuan freeze and thaw pada sampel kelenjar saliva nyamuk Anopheles yang disimpan di -200C. Sampel kelenjar saliva nyamuk Anopheles dimasukkan air mendidih selam 5 menit. Setelah proses freeze and thaw sampel dihomogenisasi dengan menggunakan mikropistil kemudian diamati dengan mikroskop stereo apabila sudah terlihat jernih maka sampel telah homogen. Kemudian sampel dihomogenisasi dengan water sonicator selama 30 menit. Sampel kelenjar saliva nyamuk An. maculatus yang telah homogen kemudian disentrifuse dengan kecepatan 10.000 rpm dalam suhu 40C selama 15 menit. Sehingga didapatkan pellet (SG-1) sebagai vaksin I dan supernatan (SG-2) sebagai vaksin II. Pellet dan supernatan yang diperoleh dipisahkan ke dalam eppendoft yang berbeda yang keduanya dipakai untuk vaksinasi. Kontrol dibuat dengan PBS yang diinjeksikan pada kelompok kontrol. Proses ini dilanjutkan dengan penambahan ajuvan gel aluminium hidroksida (alhydrogel,Sigma) dalam jumlah yang sama pada ketiga vaksin tersebut dan disimpan dalam suhu ruangan selama 2 jam atau dalam suhu 4ºC overnight.
3.3.6 Injeksi vaksin model kelenjar saliva An. maculatus dan pengambilan darah melalui ekor Mus musculus
Vaksinasi dengan menggunakan vaksin kelenjar saliva yaitu pellet (SG-1) dan supernatan (SG-2). Vaksinasi pada masing-masing kelompok mencit Balb-C dilakukan selama 3 kali dengan interval waktu 2 minggu. Vaksin disuntikkan secara subkutan pada bagian femur (paha) mencit dengan volume 100 µl. Setiap satu minggu setelah proses vaksinasi tersebut, dilakukan pengambilan darah melalui ekor pada setiap kelompok vaksin untuk uji serologis. Pengambilan darah melalui ekor Mus musculus dilakukan dengan terlebih dahulu membiusnya dengan campuran ketamin dan xilazine (1:3) setelah pingsan dan tenang, dipotong sedikit ujung ekor dan diurut sampai keluar darahnya.
20
Darah yang keluar disedot dengan pipa kapiler lalu dimasukkan dalam eppendoft samapi mencapai volume ± 100 µl. Kemudian diinkubasi pada suhu 280C selama 30 menit. Kemudian disentrifuge 10.000 rpm selama 10 menit sehingga didapatkan plasma (bagian supernatan) lalu disimpan di -200C sampai diuji. Pengambilan darah dilakukan 4 kali pengambilan yaitu sebelum injeksi vaksin model, pasca injeksi vaksin model, pasca booster I, dan pasca booster II.
3.3.7 Pengukuran kadar IL-4 dan IFN γ
Pengukuran kadar IL-4 dan IFN γ menggunakan metode ELISA di Laboratorium Biomedik Fakultas Kedokteran Universitas Brawijaya. Sampel yang digunakan dalam tes serologi ini adalah sampel serum darah mencit BALB/C yang diambil dari masing-masing kelompok (kontrol, pelet dan supernatan). Aktivitas sitokin yang diamaati adalah IL-4 dan IFN γ. IL-4 diamati dengan Quantikine® ELISA IL-4 Immunoassay catalog number M400B dan IFN-γ diukur menggunakan Quantikine® ELISA Mouse IFN γ catalog number MIF00. Semuanya dilakukan di dalam Microwell Plates yang berjumlah 96 sumuran. Prosedur pengujian dilakukan sesuai dengan katalog Quantikine® ELISA. Sebelum dilakukan analisis maka semua reagent yang diperlukan disiapkan dalam suhu ruang dan memformulasi semua reagent yang diperlukan. Setelah itu menambahkan 50 µl Assay Diluent pada masing-masing sumuran. Lalu langkah berikutnya adalah menambahkan 50 µl Standart, kontrol dan sampel pada masing-masing sumuran dan dijentikkan dengan lembut. Inkubasi pada suhu ruang selama 2 jam. Setelah inkubasi selesai maka dicuci dengan washing buffer sebanyak 5 kali. Kemudian ditambahkan 100 µl Conjugate pada masing-masing sumuran dan diinkubasi selama 2 jam. Lalu dilakukan proses pencucian lagi seperti langkah sebelumnya sebanyak 5 kali. Setelah itu ditambahkan 100 µl substrate solution pada masing-masing sumuran dan diinkubasi selama 30 menit. Penambahan reagen yang terakhir yaitu 100 µl Stop
21
Solution pada masing-masing sumuran dan dibaca dengan ELISA reader dengan panjang gelombang 450 nm dan 540 nm.
22
BAB 4. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Hasil Identifikasi nyamuk An. maculatus
An. maculatus yang diperoleh pada penelitian ini berasal dari koleksi rearing skala laboratorium di Balai Besar Penelitian dan Pengembangan Vektor dan Reservoir Penyakit (B2P2VRP) di Salatiga, Jawa Tengah. Kelenjar saliva yang digunakan dalam penelitian adalah kelenjar saliva dari nyamuk An. maculatus betina karena hanya nyamuk betina yang menghisap darah vertebrata dan manusia untuk pematangan sel telurnya (Harijanto, 2009). Oleh karena itu yang berpotensi untuk mentransmisikan patogen adalah nyamuk betina. Perbedaan morfologi nyamuk jantan dan betina dapat dilihat pada gambar 4.1.
Gambar 4.2. Morfologi antena nyamuk jantan dan betina. a antena nyamuk jantan
dengan antena berambut tebal; b. antena nyamuk betina dengan rambut jarang.
23
4.1.2 Kelenjar Saliva An. maculatus
Kelenjar saliva diperoleh dari hasil isolasi nyamuk betina steril An. maculatus menggunakan metode microdissection (Bruce-Cwatt, 1980). Kelenjar saliva yang mengandung plasmodium akan mempengaruhi hasil penelitian, karena yang akan diamati adalah pengaruh kelenjar saliva. Hasil isolasi kelenjar saliva didapatkan 1500 pasang kelanjar saliva yang disimpan dalam larutan PBS dan diletakkan pada suhu -200 C. 1500 pasang tersebut semuanya digunakan untuk penelitian. Larutan PBS merupakan salah satu buffer yang sering digunakan dalam percobaan biologi karena larutan tersebut memiliki fungsi utama untuk memelihara pH dan tekanan osmotik seperti memelihara kadar air dalam sel dan senyawa inorganik esensial serta tidak bersifat toksik bagi sel (Medicago, 2010; Cytospring, tanpa tahun). Untuk mencegah degradasi protein kelenjar saliva disimpan pada suhu -200C sampai digunakan (Fontaine, 2011). Kelenjar saliva terdiri atas 1 pasang yang masing-masing terdiri atas 3 lobus.
Gambar 4.3 Morfologi kelenjar saliva An. maculatus. (i) kelenjar saliva dengan 3
lobus, (M) medial lobes; (PL) proximal lateral; (DL) distal lateral (Yoshida, 2008). (ii) sepasang kelenjar saliva An. maculatus hasil isolasi.
i ii PL DL L DL M PL ii i
24
4.1.3 Kadar IL 4 dan IFN γ Individu
Pengukuran kadar IL-4 dan IFN γ menggunakan metode ELISA. Hasil pengukuran kadar IL-4 dapat dilihat pada Gambar 4.4.
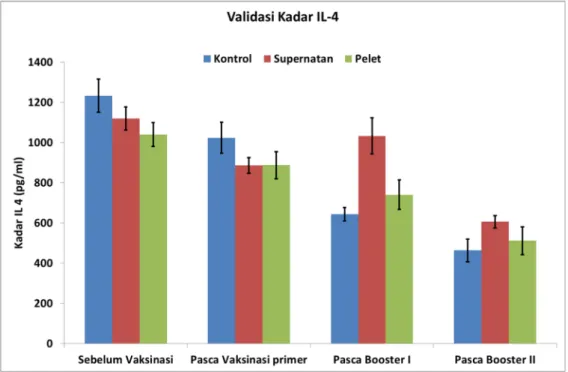
Gambar 4.4 Kadar IL-4 dari masing-masing kelompok dengan waktu pengambilan
plasma sebelum vaksinasi, pasca vaksinasi primer, pasca booster I dan pasca booster II.
Hasil uji ELISA yang didapat dari grafik tersebut di atas dapat dikatakan adanya respon imun hewan coba setelah divaksinasi dengan vaksin model kelenjar saliva. Kadar IL-4 sebelum vaksinasi dan setelah vaksinasi primer menunjukkan kadar yang lebih rendah jika dibandingkan dengan kontrol baik pada pelet maupun supernatan. Namun setelah vaksinasi booster I dan booster II terjadi peningkatan IL-4 pada supernatan dan pelet dibandingkan dengan kelompok kontrol. Meskipun peningkatan kadar IL-4 pada kelompok pelet tidak relatif tinggi seperti pada kelompok supernatan. Akan tetapi jika dilihat dari perjalanan imunnya, maka secara keseluruhan kadar IL-4 mengalami penurunan sejak sebelum divaksinasi sampai
25
pasca booster II. Hal ini mengindikasikan adanya pergeseran respon imun ke arah Th1. Hasil pengukuran kadar IL-4 dapat dilihat pada Gambar 4.5 berikut ini:
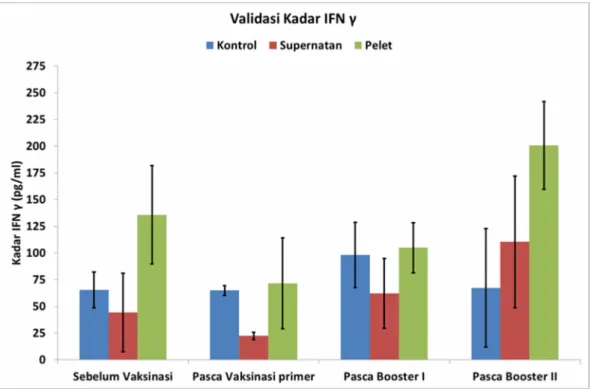
Gambar 4.5 Kadar IFN γ dari masing-masing kelompok dengan waktu pengambilan
plasma sebelum vaksinasi, pasca vaksinasi primer, pasca booster I dan pasca booster II.
Hasil uji ELISA menunjukkan bahwa terjadi perbedaan kadar IFN γ antara kelompok kontrol, supernatan dan pelet. Kontrol memiliki kadar yang berubah naik setelah booster I dan kembali menurun pada booster II. Kelompok supernatan selalu memiliki kadar IFN γ lebih rendah dibandingkan dengan kelompok kontrol kecuali pada pasca booster II. Kadar IFN γ pada kelompok pelet konsisten relatif lebih tinggi jika dibandingkan dengan kelompok kontrol. Meskipun pada pasca vaksinasi primer mengalami penurunan jika dibandingkan dengan sebelum vaksinasi.
26
4.1.4 Kadar IL 4 dan IFN γ Populasi
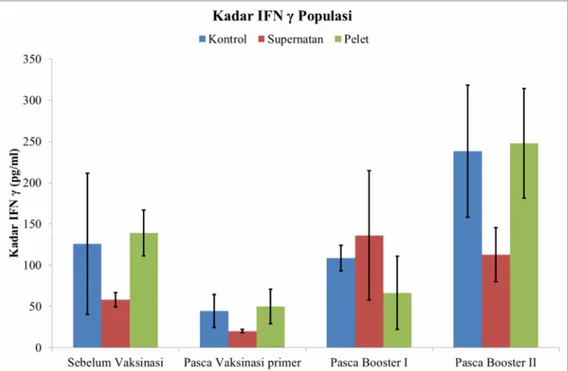
Selain mengukur kadar sitokin IFN γ dan IL-4 pada 1 individu, pada penelitian ini juga mengamati kadar sitokin tersebut pada kelompok populasi, yang ditunjukkan pada Gambar 4.6 dan 4.7.
Hasil pengukuran kadar sitokin IL-4 menunjukkan kecenderungan hasil yang hampir sama dengan hasil pengujian validasi individu. Sebelum vaksinasi dan pasca vaksinasi primer menunjukkan kadar IL-4 yang lebih rendah dari kontrol baik pelet maupun supernatan. Akan tetapi pada pasca booster I dan pasca booster II terjadi peningkatan kadar sitokin baik pada pelet maupun supernatan jika dibandingkan dengan kontrol. Meskipun kelompok pelet tidak mengalami kenaikan yang relatif tinggi pada pasca booster I. Hal ini dimungkinkan juga terjadi pembentukan antibodi terhadap protein saliva pada sebagian individu dalam populasi tersebut dan respon
Gambar 4.6 Kadar IL-4 populasi dari masing-masing kelompok dengan waktu
pengambilan plasma sebelum vaksinasi, pasca vaksinasi primer, pasca
27
imun yang berbeda pada setiap individu. Seperti halnya yang terjadi pada individu yang diuji validasi.
Pada hasil pengukuran IFN γ, menunjukkan hasil yang sama jika dibandingkan dengan hasil pada uji validasi. Sebelum vaksinasi dan pasca vaksinasi primer menunjukkan kadar yang hampir sama dengan kontrol pada kelompok pelet, sedangkan pada kelompok supernatan kadarnya lebih rendah dibandingkan dengan kontrol. Pasca booster I supernatan mengalami penurunan dan pelet mengalami kenaikan, hal ini berbeda dengan hasil pasca booster II. Kadar IFN γ pada pelet menunjukkan peningkatan yang ditunjukkan dengan kadarnya melebihi kontrol, sedangkan pada supernatan mengalami penurunan.
Gambar 4.7 Kadar IFN γ populasi dari masing-masing kelompok dengan waktu
pengambilan plasma sebelum vaksinasi, pasca vaksinasi primer, pasca
28
4.2 Pembahasan
Perbedaan seksual antara nyamuk jantan dan betina dapat dilihat dengan jelas pada morfologi antenanya. Menurut Gandahusada et al. (1998); Raitanarithikul & Harbach (1990) secara morfologi nyamuk jantan dan nyamuk betina bisa dibedakan secara langsung, yaitu melalui pengamatan organ nyamuk pada bagian antena. Nyamuk jantan terdapat rambut yang lebih tebal di bagian antenanya jika dibandingkan dengan rambut antena pada nyamuk betina. Posisi istirahat, dengan 3 utama bagian tubuh (kepala, dada dan perut) yang khas sejajar panjang garis lurus memungkinkan nyamuk dewasa anopheline dapat dengan mudah dibedakan dengan kelompok Culicidae yang lain (Esposito & Habluetzel, tanpa tahun; Harmendo, 2008).
Kelenjar saliva terdiri atas 1 pasang yang masing-masing terdiri atas 3 lobus. Masing-masing lobus dibagi menjadi beberapa bagian yaitu lobus medial, lobus proximal lateral dan lobus distal lateral (Yoshida, 2008). Lobus pada kelenjar saliva nyamuk betina memiliki fungsi yang berbeda-beda. Lobus lateral regio distal mengandung enzim apyrase yang berperan dalam proses blood feeding, dan ada kaitannya dengan penghambatan agregasi plantelet yang mempermudah saat blood feeding. Lobus lateral regio proximal mengandung enzim alpha glucoside yang berperan dalam proses ingesti, digestif dan sugar solubilization yang hanya disekresikan saat sugar feeding (James, 2003; Jariyapan, 2007). Selain itu, kelenjar saliva Anopheles betina berfungsi untuk mensekresikan senyawa yang dapat membantu blood feeding dan mempengaruhi respon imun inang (Jariyapan et. al, 2010). Penelitian lain menunjukkan bahwa kelenjar saliva nyamuk dapat mengganggu homeostasis inang dan mengeluarkan respon inflamasi serta mempengaruhi keberhasilan transmisi patogen (King et. al, 2011). Hal ini dikarenakan adanya protein-protein di dalam kelenjar saliva. Menurut penelitian Jariyapan et. al tahun 2012 menyatakan bahwa protein saliva yang berpengaruh pada proses transmisi dan blood feeding berada pada lobus median dan distal lateral. Protein yang telah ditemukan tersebut dapat dikembangkan untuk mengontrol
29
patogen dan transmisinya. Oleh karena itu dalam penelitian ini dilakukan isolasi pada semua bagian lobus kelenjar saliva.
Pengukuran kadar sitokin yang meliputi IL-4 dan IFN γ menggunakan metode ELISA. Pemilihan sitokin tersebut berhubungan dengan patogenitas malaria. Sitokin IFN γ merupakan sitokin yang dihasilkan oleh sel Th1 yang berperan sebagai sitokin proinflamasi. IFN γ berperan dalam mengontrol replikasi parasit dan mengontrol invansi parasit ke sel hati. Untuk sitokin IL-4, merupakan sitokin yang dihasilkan oleh sel limfosit Th2 yang dapat memacu produksi antibodi spesifik sehingga menghambat reinvasi parasit pada eritrosit sehat (Baratawidjaja & Rengganis, 2009). Pengaturan sitokin yang dihasilkan oleh sel Th2 bersifat antagonis terhadap sel Th1. Jadi respon imun ke arah Th2 akan mengakibatkan penurunan kadar sitokin yang dihasilkan oleh sel Th1 yaitu IFN γ (Baratawijaya, 2010). Sampel plasma yang didapatkan dari semua pengambilan tidak diuji ELISA seluruhnya, akan tetapi dipilih 3 sampel dari masing-masing pengambilan sebagai uji populasi dan nilai validasi ELISA diuji pada 1 sampel dengan 3 kali pengulangan. Pengambilan sampel yang akan digunakan untuk ELISA dipilih yang memiliki volume ± 50 µl dan kondisinya baik, tidak hemolisis. Kondisi sampel yang hemolisis akan mempengaruhi pembacaan pada ELISA Reader (R&D system, 2011).
Adanya penurunan kadar IL-4 pasca vaksinasi primer dapat dijelaskan dengan penelitian Donovan (2007) yang menyebutkan bahwa tampak bahwa saliva mampu untuk memodulasi respon imun ke arah Th-1 dengan meningkatkan kadar IFN-γ dan menurunkan aktivitas sel Th-2 yang ditunjukkan dengan adanya penurunan kadar IL-4. Pasca booster I menunjukkan adanya peningkatan, hal ini dimungkinkan adanya pembentukan antibodi pada hewan coba. Pendapat tersebut didukung oleh penelitian Rocha (2004) menunjukkan bahwa pada hewan coba yang divaksinasi dengan vaksin model kelenjar saliva membentuk antibodi yang berpengaruh pada derajat parasitemia dan tingkat mortalitas. Pada pasca booster II terjadi penurunan jika dibandingkan dengan pasca booster II, akan tetapi kadarnya masih lebih tinggi dari kontrol. Hal ini didukung oleh pernyataan bahwa pada umumnya kelenjar saliva nyamuk dapat
30
mempolarisasi respon kekebalan host terhadap sel Th2. Respon tersebut ditandai oleh produksi sitokin jenis IFN-γ dan IL-12 yang rendah, tetapi produksi yang lebih tinggi pada sitokin seperti IL-4 dan IL-10 (Titus et al., 2006). Hal ini sama dengan yang terjadi pada hewan coba setelah divaksinasi vaksin model kelenjar saliva nyamuk, mereka mengalami peningkatan kadar IL-4. Peningkatan tersebut terjadi pasca booster I dan pasca booster II. Akan tetapi secara keseluruhan IL-4 mengalami penurunan, hal ini dikarenakan antibodi sudah terbentuk pada paparan pertama sehingga ketika booster kadarnya lebih rendah dari sebelumnya. Seperti yang diungkapkan Baratawidjaja & Rengganis tahun 2009 karena adanya paparan berulang, sel T helper tidak perlu menghasilkan IL-4 karena telah terbentuk sel B memori sebagai akibat dari respon imun sekunder. Oleh karena itu sekresi sitokin IL-4 tidak terjadi sehingga kadarnya menurun.
Hasil uji ELISA menunjukkan bahwa terjadi perbedaan kadar IFN γ antara kelompok kontrol, supernatan dan pelet. Pada pasca vaksinasi primer mengalami penurunan jika dibandingkan dengan sebelum vaksinasi. Hal ini dimungkinkan paparan yang hanya sekali dan adanya pengaruh ajuvan alumunium hidroksida. Menurut Brewer tahun 2006 bahwa alumunium hydroxide efektif dalam memproduksi sistem imun humoral dengan menginduksi sitokin IL-4 dan IL-5 sehingga antibodi seperti IgG1 dan IgE meningkat, sebaliknya respon imun seluler yang efektif dalam membunuh parasit malaria justru menurun. Akan tetapi kadar sitokin IFN γ terus meningkat setelah pasca vaksinasi primer, hal ini dapat dikatakan terjadi pergeseran sistem imun ke arah Th1 yang ditandai dengan adanya peningkatan IFN γ. Fenomena ini didukung oleh penelitian Kamhawi (2000) bahwa paparan berulang lalat Plebhotomine yang tidak terinfeksi juga dapat mengakibatkan resistensi terhadap infeksi Leishmania karena mengakibatkan peningkatan sitokin yang dapat menginduksi respon imun inang ke arah Th 1 yaitu ditandai dengan meningkatnya produksi IFN γ.
Hasil pengamatan menunjukan bahwa fraksi protein dari kelenjar saliva yang berperan dalam penurunan kadar IL-4 terdapat di supernatan yang mengindikasikan
31
proteinnnya soluble, sedangkan untuk IFN γ terdapat di pelet yang mengindikasikan proteinnya insoluble. Hal ini ditunjukkan dengan kadar IL-4 yang rendah ketika pra injeksi vaksin model sampai vaksinasi primer, akan tetapi mengalami peningkatan pasca booster I dan pasca booster II. Hal ini dimungkinkan adanya pembentukan antibodi terhadap vaksin model saliva, seperti yang diungkapkan Waitayakul et al., (2006) bahwa paparan berulang pada penduduk daerah endemis dapat memproduksi antibodi terhadap protein saliva nyamuk Anopheles dalam jangka waktu yang panjang. Untuk kadar IFN γ ditunjukkan dengan peningkatan pada kelompok pelet jika dibandingkan dengan kontrol. Hal ini menjadi sangat penting apabila terdapat vektor yang membawa patogen malaria, karena menunjukkan respon imun ke arah Th 1 dan respon imun tersebut sangat penting untuk mengatasi parasitemia yang terjadi pada awal terjadinya infeksi.
Kadar sitokin IL-4 dan IFN γ yang kurang representatif pada populasi disebabkan karena hasil tersebut merupakan hasil dari merata-rata pada 3 individu berbeda sehingga Standart Deviasi (SD) sangat tinggi (lampiran 1). SD yang tinggi tersebut ditunjukkan pada hasil pengukuran IL-4 dan IFN γ jika dibandingkan dengan hasil uji validasi. Seperti yang diungkapkan Martin et al. (2012) bahwa individu merespon secara berbeda terhadap antigen yang masuk termasuk golongan hewan model seperti rodent. Banyak faktor yang mempengaruhi adanya perbedaan tersebut, terutama, dosis dan rute inokulasi, host dan genetika patogen, sudah ada kekebalan, dan infeksi bersamaan dengan spesies mutualistik atau patogen lainnya. Selain itu jumlah populasi yang sedikit juga mempengaruhi tingginya standart deviasi hasil pengukuran sitokin.
Hasil tersebut menunjukkan bahwa pengukuran kadar sitokin secara populasi tidak dapat dijadikan suatu parameter perubahan respon imun individu yang divaksinasi dengan vaksin model kelenjar saliva. Akan tetapi melihat perubahan respon imun pada uji validasi dapat dikatakan bahwa kelenjar saliva memiliki potensi untuk memberikan respon imun terhadap inang terutama pada pembentukan antibodi pada kelompok supernatan dan pergeseran respon imun ke arah Th1 pada kelompok
32
pelet. Hasil tersebut mengindikasikan potensi kelenjar saliva An. maculatus sebagai kandidat vaksin. protein kelenjar saliva bersifat imunogenik dan dapat berfungsi dengan baik sebagai indikator paparan vektor untuk mengukur risiko dari manusia terhadap infeksi malaria. Selain itu, beberapa protein dapat menjadi kandidat yang sangat baik untuk pengembangan multivalent vaksin yang menargetkan komponen yang berbeda dari siklus transmisi malaria (Waitayakul et al., 2006).
33
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Ekstrak kelenjar saliva An. maculatus terbukti mampu memodulasi respon imun inang dalam penelitian ini. Hal ini ditunjukkan dengan perubahan kadar sitokin IL-4 dan IFN γ pada kelompok yang divaksinasi jika dibandingkan dengan kelompok yang tidak divaksinasi dengan vaksin model ekstrak kelenjar saliva tersebut. Faktor immunomodulator yang berperan pada penurunan kadar IL-4 dimungkinkan bersifat soluble sedangkan pada kenaikan kadar IFN γ dimungkinkan bersifat insoluble. Oleh karena itu, pengembangan vaksin berbasis ekstrak kelenjar saliva An. maculatus harus melibatkan kedua fraksi kelenjar saliva tersebut.
5.2 Saran
Keterkaitan injeksi vaksin model kelenjar saliva An. maculatus dalam memodulasi respon imun inang terhadap patogenisitas malaria perlu diuji lebih lanjut. Lebih jauh lagi perlu dilakukan analisis kandungan protein (faktor immunomodulator) pada supernatan dan pelet kelenjar saliva An. maculatus untuk menentukan kandidat target spesifik pengembangan TBV malaria.
34
DAFTAR PUSTAKA
Buku
Baratawidjaja, K. G., Iris R. 2010. Imunologi Dasar Edisi ke-9. Jakarta: Balai Penerbi Fakultas Kedokteran Universitas Indonesia.
Baratawidjaja, K. G & Rengganis, I. 2009. Imunologi Dasar Edisi Ke-8. Jakarta: Fakultas Kedokteran Universitas Indonesia Press.
Bruce – Chwatt, L. J. 1980. Essential Malariology. London : William Heinemann Medical Books Ltd.
Foster WA & Walker ED. 2002. Mosquitoes (Culicidae). In Mullen G, Durden L(ed.). Medical and Veterinary Entomology. Academic Press: San Deigo. Gandahusada, S; D. Henry; Pribadi W. 1998. Parasitologi Kedokteran Edisi Ketiga.
Balai Penerbit FKUI: Jakarta.
Harijanto, P.N. 2009. Malaria: Buku Ajar Penyakit Dalam Jilid III edisi V. Jakarta: Pusat Penerbitan Departemen Ilmu Penyakit Dalam Fakultas Kedokteran Universitas Indonesia.
Harijanto, P.N; Agung; & Gunawan. 2010. Malaria dari Molekuler ke Klinis Edisi 2. Jakarta: EGC.
Soedarto. 2008. Parasitologi klinik. Cet.I. Airlangga University Press: Surabaya. Widoyono. 2008. Penyakit Tropis : Epidemiologi, Penularan, Pencegahan dan
Pemberantasan. Jakarta : Erlangga.
Valkiūnas G. 2004. Avian Malaria Parasites and Other Haemosporidia. CRC Press. ISBN 978-0-415-30097-1.
Tidak Diterbitkan
Dachlan, Y.P. 2004. Resistancy Problem of malaria and Drug Efficacy in Purnomo, B.B. et al (Ed). Proc. Third Basic molecular Biology Course on Infectious Disease, Universitas Brawijaya, Malang.
35
Harmendo. 2008. Faktor Risiko kejadian Malaria di Wilayah Kerja Puskesmas Kenanga kecamatan Sungailiat Kabupaten Bangka Propinsi Kepulauan Bangka Belitun. Tidak Diterbitkan. Tesis. Semarang: Prodram Pasca Sarjana Universitas Diponegoro
Laihad, F.J. 2000. Epidemiologi Resistensi Malaria di Indonesia. Makalah. Kongres nasional PETRI IX, Manado, 9-11 Agustus 2000.
Rinidar. 2010. Pemodelan Kontrol Malaria melalui Pengelolaan Terintegrasi di Kemukiman Lamteuba, Nanggroe Aceh Darussalam. Tesis. Sekolah Pascasarjana Program Doktor Universitas Sumatera Utara.
R&D System. 2011. Quantikine ELISA: Mouse IL-4 and IFN Gamma Immunoassay. Santoso, N.B., Hadi, U.K., Sigit, S.H., & Koesharto, FX. 2004. Karakteristik Habitat
Larva Anopheles maculatus & Anopheles balabacencis di Daerah Endemik Malaria, Kecamatan Kokap, Kulonprogo Daerah Istimewa Yogyakarta. Seminar Nasional Entomologi dalam Perubahan lingkungan dan Sosial, Perhimpunan Entomologi Indonesia. Bogor 5 Oktober 2004.
Ullmann A. J. & Moore. 2011. Tick Salivary Gland Proteins (Salps) As Antigens For Vaccine Development To Decrease Spirochete Load In A Murine Model Of Lyme Borreliosis. Dissertation. Department of Microbiology, Immunology and Pathology.
Zein, U. 2006. Penanganan Terkini Malaria Falciparum. Makalah. Divisi Penyakit Tropik dan Infeksi Bagian Ilmu Penyakit Dalam fakultas Kedokteran Universitas Sumatera Utara.
Terbitan Berkala
Acang, N. 2002. Kasus Malaria Resisten Klorokuin di Bagian Penyakit Dalam Rumah Sakit Dr. M. Jamil, Padang. Majalah Kedokteran Indonesia. Edisi 11: 382-389.
Brewer, J.M. 2005. (How) Do Aluminium Adjuvant Work?. Journal Immunol. Vol. 102(1): 10-15.
Carter, R. 2001. Trasmissin Blocking Malaria Vaccine. Vaccine. Vol 19 (1): 2309 – 2314.