3/i(/:p
> .1I ( 3 b ;i
,,
j t:UALITAS SPERMATOZOA
SEMEN BEKU
P A S ~ A
PADA PRODUKSI EMBRIO DOMBA
IN VlTRO
L A ODE MUHAMMAD ASWAD SALAM
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
LA ODE MUHAMMAD ASWAD SALAM. Kajian Kualitas Spermatozoa Semen Beku Pasca
Swim
Up pada Produksi Embrio Domba In Vitro. Dibawah bimbingan M. AGUS SETIADI dan ARZEF BOEDIONO.Penelitian ini bertujuan menentukan pengaruh metode swim up terhadap kualitas spermatozoa beku serta menelaah hubungan kualitas spermatozoa pasca
-
Aswim up dengan perkembangan embrio in vitro. Semen beku domba g a t yang
akan digunakan dilakukan thawing pada air bersuhu 3 7 ' ~ selama 10 detik.
Kemudian dilakukan swim up yaitu semen disentrifiigasi sebanyak dua kali dalam medium kapasitasi selama 5 menit dengan kecepatan 500G, akan terbentuk dua lapisan, lapisan atas berisi supematan dan bagian bawah berisi endapan spermatozoa. Supematan dibuang dan disisakan %0,2 ml, lalu endapan spermatozoa ditambahkan medium kapasitasi sampai 1 ml dan diekuilibrasi selama 30 menit di dalam inkubtor C02
5%
dengan suhu 3 9 ' ~ . Setelah itu 800 p1 larutan bagian atas diambil dan dilakukan evaluasi spermatozoa. Spermatozoa diiasukkan ke dalam drop pada cawan petri. Selanjutnya digunakan untuk IVF, oosit yang telah dimatangkan sebelumnya dicuci sebanyak 3 kali dengan medium fertilisasi kemudian dimasukkan ke dalam drop yang berisi spermatozoa dan ditutup dengan mineral oil untuk proses fertilisasi dan diinkubasi selama 18 jam. Pada setiap perlakuan baik setelah thawing, swim up maupun IVF dilakukan penilaian spermatozoa terhadap motilitas, hidup mati dan abnormalitas spermatozoa.Hasil penelitian menunjukkan terjadi peningkatan motilitas pasca swim up (39,05% vs 45,46%) dan terjadi penurunan yang nyata persentase motilitas pasca IVF (2,91%). Sementara itu tidak ada perbedaan nyata antara persentase hidup spermatozoa pasca thawing (47,36%) dengan pasca swim up (46,54%) dan tejadi penurunan yang nyata pasca IVF (10,76%). Sementara itu juga terjadi peningkatan abnormalitas spermatozoa pasca swim up (4,20%) dan pasca N F (10,78%). Pada tingkat perkembangan embrio menunjukkan motilitas pasca swim
up 40%, 45% dan 50-55% tidak menunjuMcan perbedaan yang nyata dengan nilai
cleavage rate (37,84%, 34,44% dan 5455%) dan nilai morula rate (28,38%,
19,87% dan 36,36%).
Dapat disimpulkan bahwa metode swim up dapat meningkatkan motilitas spermatozoa beku pasca thawing. Motilitas spermatozoa pasca swim up antara 40%-55% menghasilkan perkembangan embrio yang tidak berbeda.
KAJIAN KUALITAS SPERMATOZOA SEMEN BEKU PASCA
SWIM UP
PADA PRODUKSI EMBRIO DOMBA IN
VITRO
LA ODE MUHAMMAD ASWAD SALAM
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakuktas Kedokteran Hewan Iustitut peratanian Bogor
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Skripsi : Kajian Kualitas Spermatozoa Semen Beku Pasca S ~ v i ~ n Up pada Produksi Embrio Domba In Vitro
Nama Mahasiswa : La Ode Muhammad Aswad Salam Nomor Polok : B04103040
Menyetujui,
Pembimbing I Pembimbing I1
I
Prof. Dr. drh. Arief Boediono
-
NIP. 131 760 848
Mengetahui,
Wakil Dekan Fakultas Kedokteran Hewan
RIWAYAT HIDUP
Penulis dilahirkan di Kolaka, Sulawesi Tenggara pada tanggal 20 Oktober tahun 1985 dari ayah La Ode Nursalam, SH dan Ibu Nur Asiah. Penulis mempakan anak kedua dari tiga bersaudara.
Pada tahun 1991 penulis diterima di Sekoiah Dasar Negeri 9 Kolaka dan pada tahun 1997 penulis menyelesaikan studi di Sekolah Dasar Negeri 2 Batulo. Pada tahun 1997 melanjutkan studi di Sekolah Menengah Pertama Negeri 1 Bau- Bau, Buton dan menyelesaikan studi pada tahun 2000. Pada tahun 2003 penulis menyelesaikan studi di Sekolah Menengah Umum Negeri 1 Bau-Bau, Buton. Pada tahun yang sama penulis diterima di Program Studi Kedokteran Hewan, Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama studi di IPB, penulis pernah menjadi asisten praktikum mata kuliah Embriologi dan Genetika Perkembangan tahun ajaran 200612007 dan asisten praktikum mata kuliah Anatomi Veteriner I dan I1 tahun ajaran 200612007. Selain itu penulis juga aktif di beberapa kelembagaan mahasiswa diantaranya: Anggota DKM Al-Hurriyyah periode 200312004, DKM An-Nahl sebagai Kepala Bagian Kaderisasi periode 200312004 dan Kepala Departemen Kaderisasi periode 200512006, Anggota Himpro Ruminansia tahun 2003-2007, Pengums Besar (PB)
IMAKAHI periode 200412006, KSR PMI Unit 1 IPB sebagai Kepala Departemen
Soskemas periode 200412005 dan Wakil Komandan periode 200512006, BEM
PRAKATA
Alhamdulillah, segala puji dan s y u h kepada Allah SWT, rabb semesta d a m atas segala nikmat, rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penulisan skripsi ini. Shalawat serta salam senantiasa kepada baginda rasullah Muhammad SAW, keluarganya, sahabatnya dan umatnya yang senantiasa istiqomah hingga akhir zaman.
Skripsi ini sebagai salah satu syarat untuk memperoleh gelar sarjana Kedokteran Hewan di Fakultas Kedokteran Hewan Institut Pertanian Bogor (IPB). Judul yang dipilih adalah Kajian Kualitas Spermatozoa Semen Beku Pasca Swim Up pada Produksi Embrio Domba In Vitro.
Tak lupa pula penulis mengucapkan terima kasih yang sebesar-besarnya atas berbagai pihak yang telah membantu baik dalam pelaksanaan maupun penulisan skripsi ini:
1. Mama dan Papa yang selalu mendoakan, m e m b i i i g , menyemangati dan merestui setiap langkah penulis, kakak dan adik serta keluarga besar atas dorongan moril, motivasi, dan doa.
2. Dr. drh. M. Agus Setiadi selaku pembiibing pertama yang dengan sabar memberikan bimbingan, arahan, pemikiran dan motivasi dalam proses penyelesaian skripsi ini.
3. Prof. Dr. drh. Arief Boediono selaku pembimbing kedua yang telah
memeberikan arahan, bimbingan, motivasi, pernikiran dengan penuh kesabaran hingga skripsi ini selesai.
4. Dr. drh. Iman Supriatna selaku dosen penilai dan penguji sehingga dapat melengkapi kekurangan dalam skripsi ini.
5. Dr. drh. Hj. Umi Cahyaningsih, MS selaku dosen pembimbing akademik yang telah banyak membimbing dan memberi arahan serta motivasi kepada penulis selama kuliah di FKH-IPB dan turut serta membantu dalam penyelesaian skripsi ini.
6. Yulnawati, MSi yang telah banyak memberikan bimbingan dalam pelaksanaan penelitian ini dan arahan dalam penulisan skripsi ini.
7. Pegawai dan staff bagian Reproduksi dan Kebiianan dan Anatomi dan Embriologi FKH-IPB.
8. Saudara-saudaraku di MeDIK@, TSA-40, DKM An-Nahl FKH-IPB, DKM Al-Hurriyyah dan KSR PMI UNIT I
P B
9. Kakak-kakakku angkatan 33, 34, 35, 36, 37, 38, dan 39 serta adik-adikku 41,42,43, dan 44 yang senantiasa menyemangati penulis selama kuliah. 10. Teman-teman seperjuangan Gymnolaemata FKH 40.
11. Setiap insan yang telah singgah dalam kehidupanku dan mewarnaninya serta menjadiian hidup ini penuh warna dan makna.
Akhimya, penulis mendoakan semoga Allah SWT memberikan rahrnat dan karunia-Nya kepada semua pihak yang telah memberikan bantuan dan masukan kepada penulis. Semoga apa yang telah dituangkan dalam skripsi ini dapat memberikan manfaat bagi perkembangan ilmu pengetahuan dan pendidikan.
Bogor, Mei 2008 Penulis
DAFTAR IS1 PRAKATA
...
DAFTAR IS1...
DAFTAR TABEL...
DAFTAR GAMBAR...
DAFTAR LAMPIRAN...
...
PENDAHULUAN Latar Belakang...
. .
...
Tujuan Penellhan. .
Manfaat Penel~t~an...
TINJAUAN PUSTAKA...
Spermatozoa...
Fisiologi Spermatozoa...
Kapasitasi Spermatozoa dan Reaksi Akrosom...
.
.
Pemlaan Kualitas Spermatozoa
...
Produksi Embrio In Vifro...
;
Pematangan Oosit In Vifro...
. . .
Fertil~sasi In Vifro
...
Kultur Embrio In Vibo
...
MATERI DAN METODE...
. .
Waktu dan Tempat Penel~tlan
...
. .
Bahan Penelit~an
...
. .
Prosedur penel~t~an
...
Pemeriksaan Kualitas Spermatozoa...
a
.
Pemeriksaan Pasca Thawing...
b.
Pemeriksaan Pasca Swim Up...
c.
Pemeriksaan Pasca IVF (In Vitro Fertilization)...
Evaluasi Spermatozoa...
.
.
Persentase Motllitas
...
Persentase Hidup Mati dan Abnormalitas...
Hubungan Kualitas Spermatozoa dengan Perkembangan Embrio In Vitro..
Halaman v vii ix X xi 1 1 2 2 3 3 3 4 6 7 8 8 9 11 11 11 11 11 11 11 12 12 12 13 13
Proses IVC (In Viho Culture)
...
Analisis Data...
...
HASIL DAN PEMBAHASAN
...
Kualitas Spermatozoa
Hubungan Kualitas Spermatozoa dengan Perkembangan Embrio In Vitro
..
...
KESIMPULAN DAN SARAN
Kesimpulan
...
Saran...
...
DAF'TAR PUSTAKA LAMPIRAN ... V l l l1. Motilitas Spermatozoa Domba da11 Perkembangan Embrio In VVio setelah Fertilisasi Menggunakan Spermatozoa dengan Motilitas
DAFTAR GAMBAR
Halaman 1
.
Morfologi Spermatozoa...
32
.
Grafik Kualitas Spermatozoa Domba GarutPasca Thawing. Swim Up dan Pasca IVF
...
143
.
Pewarnaan Spermatozoa dengan Eosin 2%...
16 4.
Perkembangan Embrio Domba Hasil Produksi Embrio In Vitro...
18DAFTAR LAMPIRAN
Halaman 1. Kualitas Spermatozoa Domba Garut Pasca Thawing,
Pasca Swim up dan Pasca IVF
...
242. Analisa data hasil pengamatan persentase motilitas
spermatozoa domba
...
25 3. Analisa data hasil pengamatan persentase hidupspermatozoa domba
...
26 4. Analisa data h a i l pengamatan persenme abnormalitas...
spermatozoa domba 27
5. Analisa data cleavage rate
...
28PENDAHULUAN
Latar Belakang
Perkembangan teknologi telah banyak menghasilkan perubahan yang besar dalam kehidupan manusia. Salah satu manfaat yang dirasakan yaitu dalam industri peternakan dengan tujuan untuk mencukupi pangan asal hewan, menghasilkan ternak yang berproduksi tinggi, meningkatkan produksi ternak dan memperbaiki mutu ternak. Teknologi-teknologi tersebut antara lain inseminasi buatan
(B),
embrio transfer (ET), dan I n Vitro Fertilization (NF).
Fertilisasi In viho m e ~ p a k a n suatu teknik dimana sel telur difertilisasi oleh spermatozoa diluar rahim (secara in i~iho). Dalam proses ini spermatozoa dan sel telur dipertemukan di dalam sebuah tabung atau cawan petri dengan diberikan perlakuan khusus terlebih dahulu sehingga dapat terjadi fertilisasi.
Fertilisasi ialah peristiwa bersatunya spermatozoa dengan ovum. Karena kedua sel ini berasal dari dua individu, maka untuk dapat bertemu dan bersatu, kedup unsur ini hams melalui perjalanan yang cukup jauh, mengalami berbagai proses persiapan dan tempat pertemuan harus memenuhi syarat bagi keduanya (F'artodihardjo, 1980).
Produksi embrio secara in i i h o dilakukan melalui 3 tahap yaitu pematangan oosit (In Viho MaturatiodIVM), pembuahan oosit (In Vitro FertilizationlIVF), dan kultur embrio (In Vitro CzrlturelIVC). Produksi embrio secara in vitro ini terus mengaiami perkembangan untuk meningkatkan produksi embrio itu sendiri maupun kualitas dari embrio yang dihasilkan yang sangat mendukung perkembangan teknologi dibidang peternakan. Perkembangan ini dilakukan baik pada tahap-tahap produksi embrio secara in vitro (IVM, NF dan IVC) maupun peningkatan kualitas genetik ternak yang akan dihasilkan.
Keberhasilan dari proses IVF sangat ditunjang oleh kualitas spermatozoa dan oosit yang digunakan. Kemampuan spermatozoa dalam membuahi oosit perlu ditinjau berdasarkan evaluasi spermatozoa terutama dalam ha1 motilitas, hidup mati dan abnormalitas.
Oleh karena itu, untuk mengetahui kemampuan spermatozoa tersebut maka dilakukan penelitian: Kajian Kualitas Spermatozoa Semen Beku Pasca
Swim Up pada Produksi Embrio Domba In Vitro.
Tujuan Penelitian
Secara umum tujuan penelitian meliputi:
1. Mengetahui pengaruh metode swim up terhadap kualitas spermatozoa beku 2. Menelaah hubungan kualitas spermatozoa pasca swim up dengan
perkembangan embrio in vitro (cleavage dan morula).
Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi masukan dalam teknik penanganan spermatozoa untuk produksi embrio in vitro.
TINJAUAN PUSTAKA
Spermatozoa
Spermatozoa adalah sel kelarnin jantan yang dibentuk pada tubuli semineferi testes melalui proses yang disebut spermatogenesis (Toelihere, 1993a dan Salisbury dan VanDemark, 1985).
Fisiologi Spermatozoa
Secara garis besar spermatozoa terbagi atas kepala dan ekor (Gamer dan Hafez, 2000). Sedangkan menurut Salisbury dan VanDemark (1985) spermatozoa normal memiliki kepala, leher, badan dan ekor (Gambar 1).
Kepala spermatozoa terisi dengan materi inti mengandung
kr.,
c m ~ ~ ~ m DNA (deoxy ribonucleic acid) yang membawa informasi genetik. Bagian tengahekor (axonema) terdapat sejumlah mitokondria yang dipercaya dapat memberikan energi untuk daya gerak. Bagian ini mengandung sebagian besar mekanisme daya
gerak spermatozoa dan memiliki peranan yang sangat penting terhadap motilitas (Toelihere, 1993a).
End Pieee
Metabolisme spermatozoa dalam keadaan anaerobii menghasilkan asam laktat yang makin tertimbun dan meninggikan derajat keasaman atau m e n d a n pH larutan tersebut. Derajat keasaman sangat mempengaruhi daya tahan hidup spermatozoa. Pada sapi dan dornba, pH semen adalah netral, sekitar 6,s (ToelihereJ 993b).
Spermatozoa juga melakukan proses metabolime secara aktif, dengan adanya enzim yang dibutuhkan untuk reaksi kimia seperti glikolosis, siklus asam trikarbosilik, oksidasi asam lemak dan transpor elektron (Gamer dan Hafez, 2000). Proses metabolisme juga dilakukan untuk menghasilkan dan menyimpan energi berupa ATP (adenosine triphospate) yang digunakan untuk pergerakan atau motilitas spermatozoa (Metz dan Monroy, 1967).
Setelah menyelesaikan spermatogenesis dalam testes, spermatozoa harus terlebih dahulu mengalami pematangan di epididrnis, kapasitasi disaluran reproduksi betina dan reaksi akrosom saat berikatan dengan sel telur agar fertilisasi dapat terjadi (Djuwita et al., 2000). Sedangkan menurut Tomaszewska et al. (1991) spermatozoa mengalami fase pematangan yang kornpleks di dalam saluran reproduksi betina yaitu kapasitasi dan reaksi akrosom.
kapasitasi Spermatotoa dan Reaksi Akrosom
Kapasitasi Spermatozoa. Spermatozoa mamalia mengalami proses
pernatangan di dalam saluran reproduksi jantan (Tomaszewska et al., 1991). Pematangan pada epididimis meliputi penghilangan sisa-sisa sitoplasma (cytoplasmic droplet), p e n a m b h beberapa protein pada membran plasma, serta memperoleh kemampuan bergeraklmotilitas (Djuwita et al., 2000).
Kapasitasi merupakan proses fisiologis yang te rjadi selama spermatozoa melalui saluran reproduksi betina dimana te rjadi perubahan kestabilan membran plasma spermatozoa sehingga memungkinkan terjadmya proses reaksi akrosom (Djuwita et al., 2000). Anderson (1977) mengemukakan bahwa kapasitasi spermatozoa dapat dilihat dari dua mekanisme, pelepasan faktor kimia (faktor dekapasitasi) dari spermatozoa dan aktifasi enzim akrosom (reaksi akrosom).
Proses kapasitasi memungkinkan terjadinya perubahan membra spermatozoa serta pelepasan suatu komponen dari perrnukaan akrosom (Blandau, 1980).
Kapasitasi mencakup pemecahan parsial akrosom bagian luar dan membran plasma, sehingga enzim akrosom dapat dilepaskan. Enzim-enzim tersebut selanjutnya dapat menembus zona pelusida. Kapasitasi juga mengaktifkan metabolisme sel-sel spermatozoa dengan menaikkan laju glikolisis dalam sel dan menaikan metabolisme oksidatif (Randson, 1992).
Menurut Mach ef al. (1991) kapasitasi mengakibatkan terjadinya hipermotilitas spermatozoa dan memudahkan terjadiiya reaksi akrosom walaupun belum menyebabkan terjadiiya pelepasan enzim akrosom karena membran akrosom sebelah luar masih utuh.
Secara in vitro kapasitasi spermatozoa dapat dilakukan dengan pencucian (sentrifugasi) pada medium BO ataupun CRlaa yang telah diberi tambahan kafein, heparin Gosenkrans dan First, 1991). Beberapa metode kapasitasi telah banyak dikembangkan untuk menyiapkan spermatozoa menjadi terkapasitasi, diantaranya menggunakan kafein, heparin, percoll gradient, hipotaurin, liposom, medium berkekuatan ion tinggi (high ionic strength medium) dan masih banyak yang lain (Herawati et al., 2001).
Reaksi Akrosom. Reaksi akrosom yaitu peleburan membran plasma
dengan membran akrosom dari spermatozoa (Djuwita et al., 2000, Garner dan Hafez, 2000 dan Anderson, 1977) yang memungkinkan pengeluaran enzim-enzim hidrolitik yang terkandung di dalam tudung akrosom.
Setelah dekat dengan oosit, spermatozoa yang telah menjalani kapasitasi akan terpengaruh oleh zat-zat dari corona radiata ovum, sehingga isi akrosom dari daerah kepala spermatozoa akan terlepas dan berkontak dengan lapisan corona radiata. Pada saat ini dilepaskan hyaluronidase yang dapat melarutkan corona radiata, hypsine-like agent dan lysine-zone yang dapat melarutkan dan membantu spermatozoa melewati zona pelusida untuk mencapai ovum (Reksoprodjo et al., 2007)
Penilaian Kualitas Spermatozoa
Motilitas Spermatozoa. Semen normal akan mengandung sejurnlah
spermatozoa yang bergerak progresif, mati, hidup tetapi imrnotil, atau motilitasnya lemah (Campbell et al. 2003). Penaksiran motilitas merupakan pe~iilaian subyektif terhadap kemampuan dan kualitas motilitas dari spermatozoa
(Ax et al., 2000). Perkiraan motilitas adalah suatu prosedur secara visual dan hasilnya dimyatakan secara komparatif, tidak mutlak. Oleh karena itu untuk melihat motilitas spermatozoa di dalam suatu sampel semen diteruskan secara keseluruhan atau sebagai rata-rata dari populasi spermatozoa (Toelihere, 1993b dan Salisbury dan VanDemark, 1985).
Motilitas spermatozoa sangat rentan dengan perubahan kondisi lingkungan (Ax et al., 2000). Sewaktu penampungan harus diperhatikan agar eja!:ulat tidak mengalami penurunan suhu secara mendadak (cold shock) yang sangat mempengamhi motilitas spermatozoa. Panas yang berlebih-lebihan dan bahan- bahan kimia atau benda asing lainnya juga m e n d a n motilitas speramatozoa (Toelihere, 1993b).
Hidup Mati Spermatozoa. Perbedaan afinitas zat wama antara sel-sel
spermatozoa yang mati dan yang hidup dipergunakan untuk menghitung jumlah spermatozoa yang hidup secara obyektif. Zat warna yang digunakan adalah eosin atau eosin negrosin (Toelihere, 1993b), sedangkan menurut Salisbury dan VanDemark (1985), eosin adalah pewarna yang paling baik digunakan, dilengkapi dengan opal blue sebagai latar belakang sehingga pengamatan spermatozoa yang benvama dan yang tidak benvama menjadi jelas.
Penghitungan spermatozoa hidup dan mati perlu dinilai secara kritis. Zat warna atau teknik pewamaan yang kurang baik sangat m e m p e n g d i hasil pemeriksaan. Teknik pewamaan dilakukan dengan membuat preparat ulas. Spermatozoa yang mati akan benvama merah dan sepermatozoa yang hidup tak benvama. Suatu kejadian kerusakan spermatozoa yang tinggi biasanya berhubungan dengan motilitas dan fertilitas yang rendah. Akan tetapi motilitas
yang rendah dapat berkaitan dengan persentase spermatozoa hidup yang normal (Toeliiere, 1993b).
Abnormalitas Spermatozoa. Setiap sampel semen mengandung beberapa
spermatozoa abnormal. Morfologi abnormalitas spermatozoa mempunyai hubungan yang besar dengan fertilitas (Ax et
aL,
2000). Ada korelasi positif antara morfologi normal sperma dengan abnormalitas. Pada domba, ketika terdapat 20% atau lebih spermatozoa abnormal menunjukkan ketidaksuburan atau fertilasnya diragukan. Lebih dari 15% spermatozoa abnormal maka tidak dapat digunakan untuk inseminasi buatan (Ax et aL, 2000). Jumlah abnormalitas dihitung dari pemeriksaan sekitar 200 sel spermatozoa. Kelainan morfologi di bawah 20% masih dianggap normal (Toelihere, 1993a).Semen domba yang memiliki motilitas lebih besar dari 85% dan abnormalitas kurang dari 10% menunjukan kualitas yang baik. Namun tidak semata-mata hanya menggunakan dua parameter ini. Jumlah total spermatozoa hidup per inserninasi lebii penting dari persentase spermatozoa abnormal. Ketidakmampuan dari satu spermatozoa untuk penetrasi ke zona pelusida dari sel teIur dipercaya menjadi salah satu faktor yang mempengaruhi fertilisasi (Ax et al., 2000).
Abnormalitas bisa terjadi pada kepala, leher, badan, ekor, atau beberapa kombinasi pada bagian-bagian tersebut. Abnormalitas pada kepala termasuk kepala kembar, kepala pipih atau berbentuk buah per bulat, mengerut, membesar, menyempit, memanjang dan kepala kecil. Abnormalitas pada leher terdiri dari leher patah, dan kepala tak berekor, abnormalitas pada badan umumnya bengkok, patah, pendek, membesar, atau rnenebal, filiform ganda dan seperti batang, penggabungan tanpa sumbu dengan kepala. Abnormalitas pada ekor adalah melingkar, ganda, patah, menggulung (Salisbury dan VanDernark, 1985).
Produksi Embrio In vitro
Proses produksi embrio in vitro secara umum dilakukan melalui tiga tahapan penting yaitu in vifro maturation, fertilisasi in vifro (IVF) dan kultur in vitro (Setiadi, 2001 dan Siturnorang dan Triwulaningsih, 2004).
Pematangan Oosit In vitro
Pematangan oosit meliputi pematangan inti, ekspansi sel kurnulus dan pematangan sitoplasma (Parrish dan Fist, 1991). Pematangan oosit bertqjuan untuk menghasilkan sebuah oosit sekunder haploid yang diperlengkapi dengan berbagai kebutuhan biologis yang diperlukan untuk keberhasilan perkembangan embrio berikutnya (Hyttel et al., 1997). Tingkat kematangan inti oosit lebih dipengaruhi oleh kualitas oosit yang digunakan dan kondisi mikro selama proses pematangan (Boediono et al., 2006)
Oosit didapat dari ovarium dari rumah potong hewan dan dipindahkan ke laboratorium dengan menggunakan NaCL 0,9% yang mengandung antibiotik dengan suhu 23-27OC ( Bavister et al., 1992). Oosit dikumpulkan dengan metode memotong (dissecting), aspirasi maupun penyayatan (Slicing) (Jainudeen et al., 2000), secepatnya setelah hewan dipotong kemudian dimatangkan secara in vifro.
Umumnya medium yang digunakan untuk pematangan oosit adalah tissue culture medium-199 (TCM-199) disuplementasi dengan 10% fetal calf serum
(FCS) dan gonadotropin (FSH, LH) diinkubasi pada suhu 3 8 , 5 3 9 ' ~ pada 5% C02 selama 24 jam (Gordon, 2004 dan Jainudeen et al., 2000).
Fertilisasi In vitro
Untuk dapat melakukan fertilisasi, spermatozoa harus terlebih dahulu mengalami kapasitasi dan reaksi akrosom (Gordon, 2004). Pada semen beku secara in viho kapasitasi spermatozoa dapat memakai metode fisik (teknik swim up, percoll density gradient) atau zat-zat kimia (kafein, teopiline, heparin) (Jainudeen et al., 2000).
Keberhasilan fertilisasi in vitro memerlukan kesiapan yang memadai secara biologis dari oosit dan sperma dan kondisi kultur yang mendukung efektifitas metabolisme dari gamet jantan dan betina (Bracket dan zuelke, 1993). Berbagai aspek kondisi kultur seperti medium, waktu inseminasi dan kapasitasi, dan sistem kultur yang baik dapat meningkatkan keberhasilan fertilisasi in vitro (Jaswandi, 2002).
Fertilisasi pada marnalia melalui tiga peristiwa yang penting yaitu migrasi spermatozoa diantara sel-sel kumulus, penempelan dan migrasi spermatozoa
menembus zona pelusida, dan fusi spermatozoa dan membran sel telur (Hafez dan Hafez, 2000). Djuwita et al. (2000) mengutarakan sebelum spermatozoa menembus dan masuk ke dalam sitoplasma sel telur, spermatozoa harus melalui beberapa lapisan selubung sel telur yaitu dari bagian paling luar berturut-turut adalah sel-sel kumulus, zona pelusida dan membran plasma (membrane vitelin). Spermatozoa menembns lapisan sel-sel kumulus dengan mengeluarkan enzim hyaluronidase yang akan mencerna asam hialuronat yang terdapat diantara sel-sel kumulus. Setelah menembus sel-sel kumulus spermatozoa berikatan dengan zona pelusida melalui ikatan antigen reseptor. Dalam hal ini yang bertindak sebagai antigen adalah protein-protein yang terdapat pada membran plasma spermatozoa dan sebagai reseptor adalah glikoprotein (ZP1, ZP2, dan ZP3). Ikatan spermatozoa-ZP3 akan merangsang reaksi akrosom dan pengeluaran enzim-enzim hidrolitiknya yang berperan mencema dan menembus zona pelusida. Ikatan spermatozoa-ZP3 bersifat sementara dan akan lepas setelah tejadi reaksi akrosom yaitu saat membran plasma spermatozoa melebur dan dilanjutkan ikatan antara membran akrosom sebelah dalam dengan ZP2 yang memungkinkan ikatan sperma-zona pelusida selama proses penembusan zona pelusida oleh spermatozoa. Setelah menembus zona pelusida, spermatozoa masuk ke ruang perivitelin dan menempel pada membran vitelin, kemudian spermatozoa masuk ke dalam sitoplasma sel telur dan melakukan penyatuan (syngami).
Jaswandi (2002) melaporkan bahwa periode fertilisasi dan sistem inkubasi tidak berpengaruh terhadap tingkat fertilisasi oosit domba in vitro. Fertilisasi dapat dilakukan selama enam jam baik pada sistem inkubasi tanpa COz 5% maupun sistem inkubasi dengan butiran efe~esen. Perpanjangan periode fertilisasi sampai 24 jam tidak meningkatkan keberhasilan fertilisasi oosit in vitro.
Kultur Embrio
in
vitroBanyak faktor yang mempengaruhi keberhasilan dalam produksi embrio in vitro. Kondisi kultur dan jenis medium yang digunakan, penambahan serum betina estrus, cairan folikel, fetal bovine serum (FBS), hormon estradiol dan gonadotropin, serta co-culture dengan sel granulosa atau sel oviduk yang sangat
mempengarubi keberhasilan fertilisasi dan perkembangan embrio tahap selanjutnya (Machatkova et al., 1996).
Zigot yang telah dihasilkan setelah
M?
(In vitro Fertilization) hams di kultur untuk perkembangan lebih lanjut sebelum ditransfer ke uterus atau diiopreservasi. Oleh karena itu kultur embrio secara in vitro membutuhkan lingkungan yang cocok untuk pembelahan (cleavage) zigot dan perkembangan sampai tahap morula/blastosis (Peters, 1992). Dalarn medium kultur yang digunakan harus megandung nutrisi, vitamin, faktor pertumbuhan, hormon dan antioksidan yang ditambahkan dengan serum (Gordon, 2004).MATERI DAN
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan dari bulan Juni 2006 sampai Juli 2007 di Laboratorium Fertilisasi In Vitro Bagian Reproduksi dan Kebidanan Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Bahan Penelitian
Penilitian menggunakan semen beku domba garut yang berasal dari empat ekor pejantan unggul yang dikoleksi dari peternakan domba garut "Lesan Putra" di daerah Laladon Bogor sedangkan oosit dikoleksi dari Rumah Potong Hewan
p H )
di daerah Ciampea Bogor.Prosedur Penelitian
Prosedur penelitian dilakukan dengan mengukur dan membandingkan parameter kualitas semen beku (motilitas, persentase hidup dan abnormalitas) pada tahapan produksi embrio in vitro (ihawing, swim up dan IVF) dan perkembangan embrio (cleavage dan morula)
d
-4-. F
+ / .
Pemeriksaan Kualitas Spermatozoa
Pemeriksaan kualitas spermatozoa dilakukan pada tiga tahapan kegiatan produksi embrio in viho yaitu pasca thawing, pasca swim zip dan pasca IVF. a. Pemeriksaan Pasca Thawring
Sebanyak dua buah straw semen beku diambil, kemudian didiamkan di udara, selama 10 detik dan dilanjutkan ihrnving dengan menggunakan air bersuhu
3 7 ' ~ selama *10 detik. Kemudian dilakukan evaluasi spermatozoa.
b. Pemeriksaan Pasca Swim up
Semen dicuci sebanyak dua kali didalam medium kapasitasi (Brackett- Oliphant; BO) dengan cara disentrifbgasi selama lima menit dengan kecepatan 500G untuk mertghilangkan plasma dan bahan pengencer. Akan terbentuk dua
lapisan, lapisan atas berisi supematan dan bagian bawah berisi endapan spermatozoa. Supematan dibuang clan disisakan *0,2
ml,
lalu endapan spermatozoa ditambahkan medium kapasitasi sampai 1 ml dan diekuilibrasi selama 30 menit di dalam inkubtor COz 5% dengan suhu 3 9 ' ~ . Setelah itu 800 p1 larutan bagian atas diambil dan dilakukan evaluasi spermatozoa. Sebelum digunakan medium kapasitasi diekuiblirasi selama 60 menit pada inkubator C02 5%.c. Pemeriksaan Pasca IVF (In Vitro Fertilization)
Sebelum melakukan fertilisasi terlebih dahulu dilakukan koleksi dan seleksi oosit, setelah itu dilakukan maturasi oosit selama 24 jam dengan menggunakan medium maturasi (TCM-199
+
Fetal Bovine Serum (FBS) 10%+
FSWLWestradiol). Proses selanjutnya adalah proses fertilisasi.
Spermatozoa yang telah dilakukan swim up dibuat dalam bentuk drop spermatozoa di dalam cawan petri. Untuk proses fertilisasi, oosit yang telah diiaturasi sebelumnya dicuci sebanyak tiga kali dengan medium fertilisasi (Brackett-Oliphant (BO)
+
heparin+
kafein), kemudian dimasukkan ke dalam drop spermatozoa. Drop spermatozoa yang telah diberi oosit ditutup dengan mineral oil untuk menghindari evaporasi dan menjaga kestabilan pH. Inkubasi selama 18 jam pada inkubator C02 5% dengan suhu 39'~. Setelah itu dilakukan evaluasi spermatozoa.Evaluasi Spermatozoa
Evaluasi spermatozoa dilakukan setelah thawing, swim up dan IVF. Parameter kualitas spermatozoa diukur terhadap persentase motilitas, persentase hidup dan abnormalitas spermatozoa.
a. Persentase Motilitas
Umumnya metode yang dipergunakan untuk melihat motilitas spermatozoa dilakukan secara visual (Salisbury dan VanDemark, 1985). Semen pada setiap tahap pengamatan diletakkan di atas objek glass sebanyak 10 pl dengan menggunakan mikropipet, kemudian ditutup dengan cover glass dan
diamati motilitasnya di bawah mikroskop. Untuk spermatozoa setelah IVF, motilitasnya diamati langsung pada drop rnenggunakan rnikroskop.
b. Persentase Hidup dan Abnormalitas
Sebanyak 10 p1 larutan spermatozoa yang telah diencerkan diletakkan di atas objek glass kemudian ditambah satu tetes eosin 2% (Toelihere, 1993b dan Salisbury dan VanDemark, 1985) dan dibuat preparat ulas. Pengamatan dilakukan pada beberapa lapang pandang mikroskop sebanyak
*
200 spermatozoa. Zat wama eosinakan
mewamai spermatozoa yang mati rnenjadi merah atu merah muda, sedangkan spermatozoa yang hidup tetap tidak benvama (Toelihere,1993b).
Hubungan Kualitas Spermatozoa dengan Perkembangan Embrio In Vitro
Perkembangan embrio diamati pada tingkat pembelahan embrio (cleavage) dan momla. Untuk mengetahui tingkat perkembangan embrio dilakukan kultur embrio in vitro atau IVC (In vitro Culture).
Proses IVC (In
Vitro
Culture)Setelah difertilisasi selama 18 jam, embrio yang dihasilkan dipindahkan dan dicuci sebanyak dua kali dengan medium kultur yaiu TCM-199 ditambah FBS lo%, insulin dan asam amino (Nonessensial amino acid dan Essensial amino acid) untuk proses perkembangan embrio. Kemudian dikultur dalam inkubator COz 5% pada suhu 3 9 ' ~ sampai hari ketujuh. Setiap 48 jam dilakukan penggantian medium kultur.
Analisis Data
Analisa data dilakukan terhadap kualitas spermatozoa dengan tiga perlakuan yaitu pasca thawing, pasca swim up dan pasca IVF. Analisa juga dilakukan untuk mengamati hubungan kualitas spermatozoa pasca swim up dengan kultur embrio in vitro. Data penelitian dianalisa dengan menggunakan uji ANOVA dan dilanjutkan dengan uji Duncan's multipe range test (Matjik dan Sumetajaya, 1999).
HASIL DAN PEMBAHASAN
Kualitas Spermatozoa
Keberhasilan dalam proses fertilisasi sangat membutuhkan peran dari spermatozoa. Salah satu faktor yang sangat menentukan keberhasilan fertilisasi adalah kualitas spermatozoa. Pada penelitian ini parameter kualitas spermatozoa yang dinilai meliputi persentase motilitas, pesentase hidup dan persentase abnormalitas. Data kualitas spermatozoa yang diperoleh dapat dilihat pada Gambar 2. - 47.36% 46,54% - % Motilitas - % Hidup - % Abnormalitas I I I I
Pasca I l ~ m v i r ~ g Pasca swim up Pasca lVF
Pengamatan
Garnbar 2. G r d k Kualitas Spermatozoa Semen Beku Domba Gaiut Pasca Thawing, Pasca Swim Up dan Pasca IVF
Pada gambar 2 menunjukkan peningkatan motilitas speimatozoa pasca
swim up (45,46%) jika dibandingkan dengan motilitas spermatozoa pasca thawing
sebesar 39,09% (Lampiran 1). Hal ini dapat disebabkan karena pada proses swim
up spermatozoa yang terseleksi saja yang dianalisa yaitu spermatozoa yang berada
dilapisan atas dari medium swim up. Seleksi spermatozoa terjadi karena
spermatozoa yang memiliki motilitas progresif yang mampu bergerak ke lapisan atas, sementara spermatozoa immotil tetap pada lapisan bawah. Selain itu, peningkatan motilitas progresif spermatozoa juga dapat disebabkan oleh
kapasitasi spewatozoa akibat p e n g a d zat-zat kimia yang terdapat pa&g medium swim up seperti kafein, teopiline dan heparin (Yainudeen et al. 2000). Seperti yang dilaporkan oleh Jainudeen et al. (2000) dan Mach et al. (1991) bahwa perlakuan dengan metode swim up atau percoll densily gradient dapat menyebabkan terjadinya hipermotilitas.
Sementara itu persentase motilitas spermatozoa pasca IVF mengalami penurunan yang drastis dibandingkan dengan motilitas pasca thawing dan pasca swim up (39,09%, 45,46% dan 2,91%) secara berumtan pasca thawing, swim up dan IVF. Penurunan motilitas pasca IVF kemungkinan akibat peningkatan derajat keasaman (pH), bahan toksik yang dihasilkan oleh spermatozoa yang mati dan radikal bebas. Evan dan Maxwell (1998) mengemukakan bahwa akumulasi asam laktat akan menyebabkan perubahan pH sehingga daya hidup spermatozoa berkurang. Sedangkan menurut Toelihere (1993a) peningkatm derajat keasaman (pH) akibat proses metabolisme spermatozoa yang menghasilkan asam laktat, pH semen domba sekitar 6,s. I4al ini juga ditunjukkan dengan penurunan persentase hidup spermatozoa pasca IVF (10,76%).
Yulnawati d m Setiadi (2005) mengemukakan bahwa penurunan kualitas spermatozoa selama penyimpanan, baik persentase motilitas maupun keutuhan membran plasma diduga akibat banyaknya spermatozoa yang mati dan menjadi toksik terhadap spermatozoa lain yang masih hidup, sehingga secara umurn kualitasnya menurun. Keberadaan zat yang bersifat toksik baik yang berasal dari spermatozoa yang telah mati maupun yang berasal dari zat yang terkandung dari pengencer yang telah mengalami oksidasi akibat penyimpanan dapat menyebabkan tingginya kadar radikal bebas yang dapat merusak keutuhan membran plasma spermatozoa. Apabila membran plasma spermatozoa sudah mengalami kerusakan, maka metabolisme spermatozoa akan terganggu dan mulai kehilangan motilitasnya sehingga menyebabkan kematian spermatozoa.
Selain itu penuriman motilitas dan hidup spermatozoa juga dapat disebabkan akibat berkurangnya nutrisi yang dibutuhkan oleh spermatozoa selama proses IVF (18 jam) sehingga terjadi penurunan energi yang dibutuhkan spermatozoa untuk tetap bergerak dan bertahan hidup. Hal ini karena adanya proses metabolisme yang dilakukan untuk menghasilkan dan menyimpan energi
berupa ATP (adenosine triphospate) yang digunakan untuk pergerakan atau motilitas spermatozoa (Ax et al., 2000; dan Metz dan Monroy, 1967).
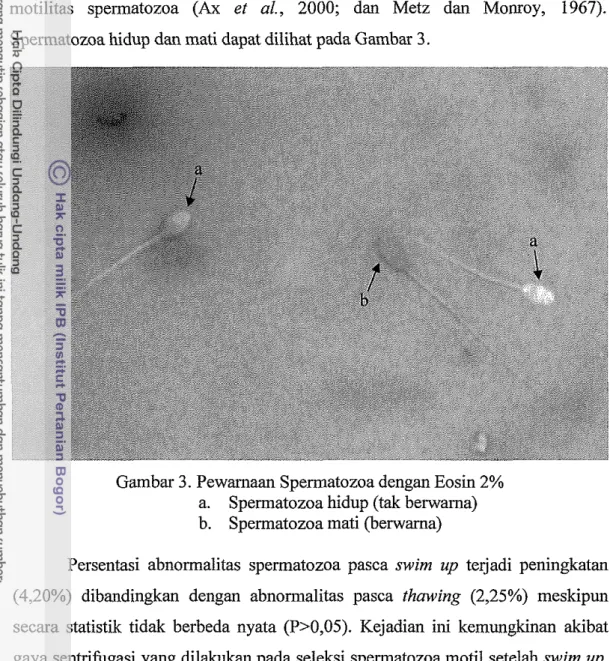
Spermatozoa hidup dan mati dapat dilihat pada Gambar 3.
Gambar 3. Pewamaan Spermatozoa dengan Eosin 2% a. Spermatozoa hidup (tak benvama) b. Spermatozoa mati (benvama)
Persentasi abnormalitas spermatozoa pasca swim up terjadi peningkatan (4,20%) dibandingkan dengan abnom~alitas pasca thawing (2,25%) meskipun secara statistik tidak berbeda nyata (P>0,05). Kejadian ini kemungkinan akibat gaya sentrifugasi yang dilakukan pada seleksi spermatozoa motil setelah swim up. Hal ini sebagaiinana yang dilaporkan oleh Sardjito (2004) bahwa semakin besar gaya sentrifugasi yang digunakan pada proses pencuciau spermatozoa menyebabkan terjadinya peningkatan abnormalitas, disamping itu juga dapat menurunkatl integritas membran yang selanjutnya menyebabkan p e n m a n persentase motilitas dan jumlah hidup. Peningkatan abnormalitas lebih jauh terjadi pada penilaian spennatozoa pasca IVF yaitu sebesar 10,78%. Hal ini kemungkman akibat lamanya waktu IVF sehingga terjadi perubahan pH, bahan toksik yang terbentuk sebagai radikal bebas serta akibat berkurangnya nutrisi yang dibutuhkan oleh spermatozoa selama proses IVF.
Hubungan Kualitas Spermatozoa dengan Perkembangan Embrio In viiro Pada penelitian ini diamati hubungan motilitas spermatozoa terhadap kemampuan perkembangan embrio in vitro. Motilitas yang digunakan dalam penelitian ini yaitu 40%, 45% dan 50-55%. Hubungan antara motilitas dengan perkembangan embrio in vitro disajikan pada Tabel 1. . .
Tabel 1. Motilitas Spermatozoa Domba dan Perkembangan Embrio In Vitro setelah Fertilisasi Menggunakan Spermatozoa dengan Motilitas - -
Berbeda Pasca Swim Up Motilitas Pasca Jumlah
Swim up (%) Oosit Cleavage Rate (%) Morula Rate ,- (%)
40 74 28 (37,84) 21 (28,38)
Data menurnjukkan terdapat kecenderungan peningkatan cleavage rate dengan peningkatan motilitas 50-55% meskipun secara statistik tidak berbeda nyata (Tabel 1). Sementara itu tingkat perkembangan morula pada ketiga tingkat motilitas tidak menunjukkan perbedaan yang nyata. Namun demikian angka clevage rate dan morula rate dari penelitian ini tidak berbeda dengan angka yang diperoleh beberapa peneliti sebelumnya walaupun teknik dan medium yang digunakan berbeda. Crozet et al. (1993) pada embrio kambing rnenghasilkan perkembangan embrio sampai tahap morula/blastosis sebesar 25,5.%. Chochan dan Hunter (2004) pada embrio sapi menghasilkan cleavage rate sebesar 36,7%. Jaswandi (2002) pada embrio domba menghasilkan morula rate sebesar 17,32%. Lalu Yulnawati (2005) pada embrio domba menghasilkan cleavage rate sebesar 50,99% dengan morula rate 18,52%.
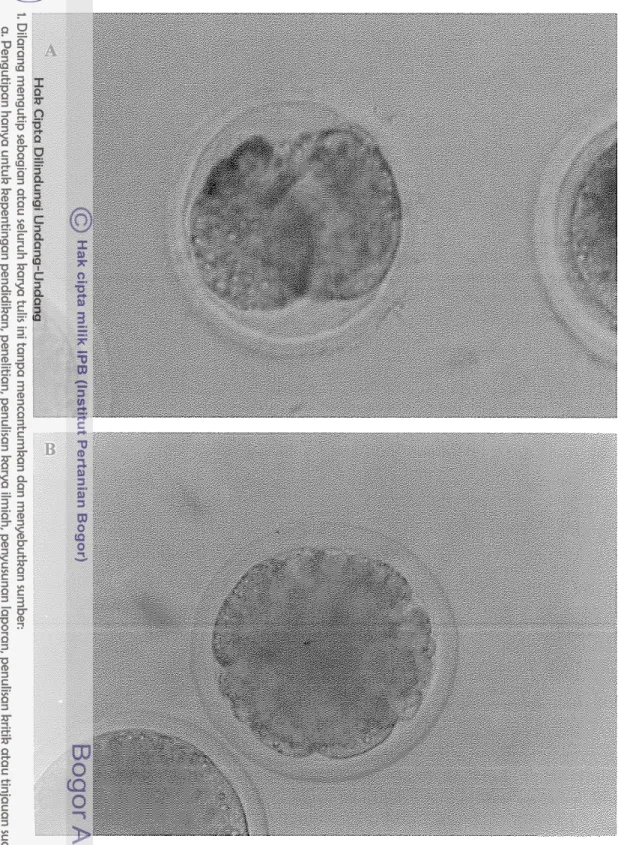
Perbedaan yang tidak s i g n i f h antara ketiga kriteria motilitas yang digunakan karena spermatozoa yang digunakan berasal dari domba-domba pejantan yang unggul dan telah dilakukan seleksi oosit yang baik digunakan sebelum dilakukan proses IVF. Disamping itu dari sekian banyak spermatozoa yang terseleksi hanya satu spermatozoa yang akan membuahi oosit. Perkembangan embrio domba in vitro dapat dilihat pada Gambar 4.
Gambar 4. Perkenlbangan Embrio Hasil Produksi In Vitro. A. Pembelahan (Cleavage) 2 sel;
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian ini dapat ditarik kesimpulan:
1. Seleksi spermatozoa dengan metode swim up dapat meningkatkan motilitas spermatozoa beku pasca thawing.
2. Tingkat perkembangan embrio tidak berbeda pada produksi embrio in vitro menggunakan spermatozoa pasca swim up dengan motilitas 40-55%.
Saran
Saran yang dapat diberikan dalam penelitian ini adalah:
1. Dalam melakukan produksi embrio in vitro sebaiknya menggunakan motilitas progresif spermatozoa pasca swinz up diatas atau sama dengan 40%
2. Perlu dilakukan penelitian lebih lanjut untuk membandingkan kualitas semen segar dan semen beku pada produksi embrio in vitro.
DAFTAR PUSTAKA
Audersoii, G.B. 1977. Fertilization, early development, and embryo transfer.
In
Reproduction in domestic animal. 3th. Academic Press New York San Fransisco London. pp:292-293.
Ax, R.L, M.R. Dally, B.A. Didion, R.W. Lenz, C.C. Love, D.D. Varner, B. Hafez and M.E. Bellin. 2000. Semen evaluation. In: Reproduction in farm W a l s . Ed-7. Edited Bji E.S.E. H&feZ t%iid B. Hafez. Philadelphia: Lippincott Williams and Wilkins.
Bavister, B.D. T.A. Rose-Hellekani and T. Pinyopummintr. 1992. Development of in vitro maturedlin vifro fertilized bovine embryos into momlae and blastocysts in defmed cult'lre media. Theriogenology, 37: 130-146.
Boediono, A, Yulnawati, dan M.A. Setiadi. 2006. Tingkat pematangan inti oosit domba
dari
ovarium dengan status reproduksi dan medium maturasi yangberbeda. Hayati, 13(4):13 1-136.
Brackett, B.G and K.A. Zuelke. 1993. Analysis of factor involved in the in vitro production of bovine embryos. Theriogenology, 39:43-64.
Blandau, R.J. 1980. In vitro fertilization and embryo transfer. Fertility and Sterility, 33: 1 (Abstract).
Campbell, J.R., K,L, Campbell and M.D. Kenedy. 2003, Anatomy and physiology of reproduction and related technologies in farm mamals. In: Animal sciences. 4". New York. Mc Graw-Hill.
Chohan, K.R and A.G. Hunter. In vitro maturation, fertilization and early cleavage rates of bovine fetal oocytes. Theriogenology, 61(2-3): 373-380.
Crozet, N, V. De Smedt, M.A. Ali and C. Sevellec. 1993. Normal development following in vitro oocytes maturation and fertilization in the goat. Theriogeriologji, 39: 206. (Abstract)
Djuwita, I, A. Boediono, K. Mohamad. 2000. Embriologi. Laboratotium Embriologi-Bagian Anatomi Fakultas Kedokteran Hewan-Institut Pertanian Bogor.
Evan, G and M.W.C. Maxwell, 1998. Salomons arificial inseminations of sheep and goat. Butherwonthe, Sydney. pp: 8-16.
Frandson, R.D. 1992. Anatomi dan fisiologi temak. Edisi ke-4. Tejemahan B. Srigando, K. Presno, ed. Soedarsono. Yogyakarta. Gadjah Mada University Press.
Garner, D.L and E.S.E. Hafez. 2000. Spermatozoa and seminal plasma
In:
Reproduction in fann animals. Ed-7. Edited by E.S.E. Hafez and B. Hafez. pGl&delpEz Lip p k c o ~
willimsad
wiws.
Gordon, I. 2004. Reproductive technologies in farm animals. CAB1 Publishing. Hafez, E.S.E and B. Hafez. 2000. Reproduction in farm animals. Ed-7.
Philadelphia: Lippincott Williams and Wilkins.
Herawati, T, S. Susilowati, dan T. Sardjito. 2001. Pengaruh heparin dalam media kapasitasi terhadap presentase hidup, mutilitas spermatozoa dan
pembelw
.age) abiiopa&
iri vi*6pef&.
Eksakta, 2(3):233-239
Hyttel, P, T. Fair, H. Callesen and T. Greve. 1997. Oocytes growth, capacitation and final maturation in cattle. Theriogenology, 47:23-32.
Jainudeen, M.R, H. Wahid and E.S.E. Hafez. 2000. Ovulation induction, embryo production and transfer. In. Reproduction in farm animals. Ed-7. E.Z.E. Hafez and B. Hafez. Philadelphia: Lippincott Williams and Wilkins.
Jaswandi. 2002. Penggunaan hepes dan butiran efervesen dalam sistem inkubasi pada produksi embrio domba secara in vitro. Disertasi. Pasca Sajana InStifxt Pe&i%n Bogor.
Mach, S.R, L.J.D. Zaneveld, C.J. De Jounge, and RA. Anderson, 1991. Human sperm capacitation and the acrosom reaction. Human Reproduction, 6: 1265-1274.
Machatkova, M, E. Jokesova, J. Petelikova, and V. Dvomcek. 1996. Developmental competence of bovine embryos derived from oocytes collected at various stages.of the estrous cycle. Theriogenology, 45: 801- 810.
Matjik, A.A. dan M. Sumetajaya. 1999. Perancangan percobaan dengan aplikasi sas, spss clan minitab. Bogor: IPB Press.
Me=, C.B.
a d
A. Mo~ifoji. 1967. Feifiliatiori. Vol. 1. New York-LoridtlIiParrish, J.J. and N.L. First. 1991. Bovine in vitro fertilization. In: A comparative overview of mammalian fertilization. Edited By B.S. Dunbar and M.G. O'Rand. Plenum Press. New York. pp:351-361.
Partodihardjo, S. 1980. Ilmu reproduksi hewan. Mutiara. Jakarta.
Peters, R.M. 1992. Embryo development in vitro to the blastocysts stage in cattle, pigs and sheep. Anim. Reprod. Sci, 28:415-421.
Reksoprodjo, M, Wibowo, N, Gozali, G.S, dan Gunardi, S. 2007. Gametogenesis,
fertilisasi dan implantasi.
ht~://www.~eocities.~om/Yosemite/Ra~ids/1744
cl(lob6.lifnil. [lo Deseiiiber 20071.
Rosedaans, C.F. and N.L. First. 1991. Culture of bovine zygotes to the blastocyst stage effects of amino acids and vitamins. Theriogenology, 35:266 (Abstiacf)
Salisbury, G.W. and N.L. VanDemark. 1985. Fisiologi reproduksi dan inseminasi pada sapi. Te rjemahan R. Djanuar. Yogyakarta. Gadjah Mada University Press.
Sardjito, T. 2004. Pengamh sentrifugasi spermatozoa sapi terhadap integritas membran, resistensi dan kelay& kondisi pada proses kapasit&i in vitro.
[lo Desember 20071.
Setiadi, 2001. Tinjauan mekanisme pemekaran sel-sel kumulus oosit pada kondisi in vivo dan in vitro: suatu review. Media Veteriner. 8(3):65-68
Siturnorang, P dan E. Triwulaningsih. 2004. Aplikasi dan inovasi teknologi transfer embrio (TE) untuk pengembangan sapi potong. Lokakarya Nasional Sapi Potorig. ijij195-105.
Toelihere, M.R. 1993a. Inseminasi buatan pada ternak. Angkasa. Bandung. Toelihere, M.R. 1993b. Fisiologi reproduksi pada ternak. Angkasa. Bandung. Toiii@Zewsb, M.W, LK. S u m % I.G. Putii
md
T.D. Cliz%iago. 1991. ReprodiilCSitingkah laku dan produksi ternak di Indonesia. PT. Gramedia Pustaka Utama. Jakarta.
Yulnawati. 2006. Optimalisasi produksi embrio domba secara in vitro: penggunaan medium crlaa dan pengamh status reproduksi ovarium. Tesis. Pasca Srijwa Iristifiif P e M w Bogor.
Yulnawati dan M.A. Setiadi. 2005. Motilitas dan keutuhan plasma spermatozoa epididimis kucing selama penyimpanan pada suhu 4 ' ~ . Media Kedokteran Hewan, 21(3): 100-104.
Lampiran 1. Kualitas Spermatozoa Domba k t Pasca Thmving, Pasca Swim trp dan Pasca IVF
Pengarnatan N Motilitas (%) Hidup (%) Abnolmalitas (%)
Pasca thawing 11 3 9 , 0 9 ~ , 7 5 ~ 47,3617,33" 2,2510,79' Pasca swim up 1 1 45,46*4,72" 46,543~7~36" 4,2O*2,6la Pasca
N F
11 2,91+3,56' 10,76*11,69~ 10,7815,46~Keterangan: Huruf superskrip (a-c, P<0,05) yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata. Data d i s a j h . Rataan I Standar Deviasi.
Lampiran 2. Analisa data hasil pengamatan persentase motilitas spermatozoa domba General Linear Models Procedure
Class Level Information Class Levels Values M O T E 3 PIPS F'T
Number of observations in data set = 33
Dependent Variable: RESPON RESPON
Source DF Sum of Squares Mean Square F Value Pr > F Model 2 1 1585.69696970 5792.84848485 354.27 0.0001
30 490.54545455
Error 16.35151515
Corrected Total 32 12076.24242424
R-Square C.V. Root MSE RESPON Mean
0.959379 13.87132 4.04370068 29.15151515
Source DF TypeISS Mean Square F Value Pr > F
M O T E 2 11585.69696970 5792.8484848s 354.27 0.0001 Source DF TypeIlI SS Mean Square F Value PI > F
MOTIL 2 11585.69696970 5792.84848485 354.27 0.0001 Level of
---
RESPON MOTE N Mean SD PI 11 2.9090909 3.56243022 PS 11 45.4545455 4.71939904 PT 11 39.0909091 3.75378597 Duncan's Multiple Range Test for variable: RESPONNOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate
Alpha= 0.05 d+ 30 MSE= 16.35152 NumberofMeans 2 3 Critical Range 3.521 3.701
Means with the same letter are not significantly different.
Duncan Grouping Mean N MOTE
A 45.455 11 PS
B 39.091 11 F'T
C 2.909 11 PI
Keterangan:
Lampiran 3. Analisa data hasil pengamatan persentase hidup spermatozoa domba General Linear Models Procedure
Class Level Information Class Levels Values
HIDUP 3 PIPS PT
Number of observations in data set = 33
Dependent Variable: RESPON RESPON
Source DF Sum of Squares Mean Square F Value Pr > F
Model 2 9607.30150909 4803.65075455 58.93 0.0001
Error 30 2445.43725455 81.51457515
Corrected Total 32 12052.73876364
R-Square C.V. Root MSE RESPON Mean
0.797105 25.88188 9.02854225 34.88363636
Source DF TypeISS Mean Square F Value Pr > F
HIDUP 2 9607.30150909 4803.65075455 58.93 0.0001
Source DF T y p e m SS Mean Square FValue P r > F
HIDUP 2 9607.30150909 4803.65075455 58.93 0.0001 Level of
---
RESPON --- --- HIDUP N Mean SD PI 11 10.7581818 7.3293708 PS 11 46.5372727 7.3604892 PT 11 47.3554545 11.6896213 Duncan's Multiple Range Test for variable: RESPONNOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate
Alpha= 0.05 d e 30 MSE= 81.51458 Number of Means 2 3 Critical Range 7.862 8.262
Means with the same letter are not significantly different.
Duncan Grouping Mean N HIDUP
A 47.355 11
PT
A
A 46.537 11 PS
B 10.758 11 PI
Keterangan:
Lampiran 4. Analisa data hasil pengamatan persentase abnormalitas spermatozoa domba
General Linear Models Procedure Class Level Information Class Levels Values
ABN 3 PIPS PT
Number of observations in data set = 33 Dependent Variable: RESPON RESPON
Source DF Sum of Squares Mean Square F Value Pr > F
Model 2 438.99891515 219.49945758 17.67 0.0001
Error 30 372.64109091 12.42136970
Corrected Total 32 81 1.64000606
R-Square C.V. Root MSE RESPON Mean
0.540879 61.37471 3.52439636 5.74242424
Source DF TypeISS Mean Square FValue Pr > F
ABN
2 438.99891515 219.49945758 17.67 0.0001Source DF TypeIIISS Mean Square FValue Pr > F
ABN 2 438.99891515 219.49945758 17.67 0.0001 Level of
---
RESPON---
ABN N Mean SD PI 11 10.7754545 5.46364414 PS 11 4.2036364 2.60578308 PT 11 2.2481 818 0.78904776 Duncan's Multiple Range Test for variable: RESPONNOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate
Alpha= 0.05
df-
30 MSE= 12.42137 Number ofMeans 2 3 Critical Range 3.069 3.225Means with the same letter are not significantly different.
Duncan Grouping Mean N ABN
A 10.775 11 PI
B 4.204 11 PS
B
B 2.248 11 PT
Keterangan:
Lampiran 5. Analisis Data Cleavage Rate Embrio
General Linear Models Procedure Class Level Information Class Levels Values EMBRIO 3 C40 C45 C50-55 Number of observations in data set = 11 Dependent Variable: RESPON RESPON
Source DF Sum of Squares Mean Square F Value Pr > F
Model 2 617.87905939 308.93952970 2.05 0.1907
Error 8 1203.73261333 150.46657667
Corrected Total 10 182'1.61 167273
R-Square C.V. Root MSE RESPON Mean
0.339194 31.21675 12.266481 39.29454545
Source DF Type I SS Mean Square F Value Pr > F
EMBRIO 2 617.87905939 308.93952970 2.05 0.1907
Source DF Typem SS Mean Square F Value Pr > F
EMBRIO 2 617.87905939 308.93952970 2.05 0.1907 Level of
---
RESPON---
EMBRIO N Mean SD C40 3 34.7333333 11.2563286 C45 5 34.6880000 11.5520808 C50-55 3 51.5333333 14.4312242 Duncan's Multiple Range Test for variable: RESPONNOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate
Alpha= 0.05
d
f
-
8 MSE= 150.4666 WARNING: Cell sizes are not equal. Harmonic Mean of cell sizes= 3.461 538Number ofMeans 2 3 Critical Range 21.50 22.41
Means with the same letter are not significantly different.
Duncan Grouping Mean N EMBRIO
A 51.533 3 C50-55 A A 34.733 3 C40 A A 34.688 5 C45 Keterangan:
Lampiran 6. Analisis Data Morula Rate Embrio
General Linear Models Procedure Class Level Information
Class Levels Values EMBRIO 3 M40 M45 M50-55 Number of observations in data set = 11 Dependent Variable: RESPON RESPON
Source DF Sum of Squares Mean Square F Value Pr F
Model 2 259.60130424 129.80065212 0.53 0.6072
Error 8 1954.57278667 244.32159833
Corrected Total 10 2214.17409091
R-Square C.V. Root MSE RESPON Mean 0.1 17245 67.31870 15.630790 23.21909091
Source DF Type1 SS Mean Square F Value P r y F
EMBRIO 2 259.60130424 129.80065212 0.53 0.6072
Source DF TypeIIISS Mean Square F Value Pr > F
EMBRIO 2 259.60 130424 129.80065212 0.53 0.6072 Level of
---
RESPON---
EMBRIO N Mean SD M40 3 26.4000000 19.9967897 M45 5 17.9840000 8.9169322 M50-55 3 28.7633333 20.4546189 Duncan's Multiple Range Test for variable: RESPONNOTE: This test controls the type I comparisonwise error rate, not the experimentwise error rate
Alpha= 0.05 df= 8 MSE= 244.3216 WARNING: Cell sizes are not equal. Harmonic Mean of cell sizes= 3.461538
NumberofMeans 2 3 Critical Range 27.40 28.55
Means with the same letter are not significantly different.
Duncan Grouping Mean N EMBRIO
A 28.76 3 M50-55 A A 26.40 3 M40 A A 17.98 5 M45 Keterangan: