TUGAS AKHIR – TM 091486
GENERATOR GAS HHO DRY TYPE 6 CELL
TERSUSUN SERI DAN IMPLEMENTASINYA
PADA DUMP TRUCK NISSAN DIESEL CWA 211
NHRR-S 6925 CC.
SUBAIRI RIZAL NRP. 2110100070
Dosen Pembimbing
Prof. Dr. Ir. H. Djoko Sungkono K.,M.Eng.Sc. PROGRAM SARJANA
LABORATORIUM TEKNIK PEMBAKARAN DAN BAHAN BAKAR JURUSAN TEKNIK MESIN
Fakultas Teknologi Industri
FINAL PROJECT – TM 091486
HHO GENERATOR GAS DRY TYPE 6 CELL
WITH ARRANGED SERIES AND
IMPLEMENTATION OF DUMP TRUCK NISSAN
DIESEL CWA 211 NHRR-S 6925 CC.
SUBAIRI RIZAL NRP. 2110100070
Academic Supervisor
Prof. Dr. Ir. H. Djoko Sungkono K.,M.Eng.Sc.
MECHANICAL ENGINEERING DEPARTMENT Faculty of Industrial Technology
Sepuluh Nopember Institute of Technology Surabaya 2014
GENERATOR GAS HHO DRY TYPE 6 CELL
TERSUSUN SERI DAN IMPLEMENTASINYA PADA
DUMP TRUCK NISSAN DIESEL CWA 211 NHRR-S
6925 CC
TUGAS AKHIR
Diajukan untuk Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Teknik
pada
Bidang Studi Konversi Energi Program Studi S-1 Jurusan Teknik Mesin
Fakultas Teknologi Industri Institut Teknologi Sepuluh Nopember
Oleh : SUBAIRI RIZAL NRP. 2110 100 070
SURABAYA JULI, 2014
“Maka sesungguhnya bersama kesulitan itu ada kemudahan, sungguh bersama kesulitan itu ada kemudahan”
(QS : Al-Insyirah : 5-6)
Puji Syukur Alhamdulillah Penulis panjatkan kehadirat Allah SWT, Maha Pencipta, Maha Pemberi Ilimu, Maha Pemberi Rizqi, dan Maha Akan Segalanya, atas limpahan rahmat, hidayah, rizki, dan ijin-Nya sehingga penyusunan tugas akhir ini dapat terselesaikan dengan baik.
Penulis menyadari bahwa keberhasilan penyelesaian tugas akhir ini tidak lepas dari bantuan berbagai pihak baik langsung maupun tidak langsung. Untuk itu, pada kesempatan ini penulis ingin mengucapkan terima kasih kepada pihak-pihak yang telah membantu penyelesaian tugas akhir ini, antara lain:
1. Keluarga besar Bapak Lisyati, selama ini telah memberikan kasih sayang, perhatian, dukungan doa, saran dan materi yang cukup sehingga penulis bisa menyelesaikan tugas akhir ini dengan baik.
2. Ibuku tercinta sam’ah yang tiada henti-hentinya atas pemberian kasih sayangnya, doa dan perhatian sampai penulis bisa menjadi seperti sekarang.
3. Keluarga besar Kakakku Faisol Mustaqim, selama ini telah memberikan perhatian, kesabaran, saran sehingga penulis bisa menyelesaikan tugas akhir ini dengan baik. 4. Keluarga besar omku Abd. Jamil dan Sallim yang selalu
menberikan pengarahan dan dukungan kepada penulis. Tidak lupa pula sepupu-sepupuku Badrut tamam dan Ifa. Serta ponaan satu-satunya Vicky yang penulis sayangi. 5. Bapak Prof. Dr. Ir. H. Djoko Sungkono K., M.Eng.Sc
(Abah) atas bimbingannya serta cerita-cerita pengalaman hidupnya yang begitu berharga dan memotivasi penulis.
Budi Kukuh W. MSc. Serta bapak Dr. Ir. Atok Setyawan, M.Eng.Sc
7. Temen-temen seperjuangan Bidik Misi Teknik Mesin ITS 2010 yang penulis rindukan.
8. Seluruh dosen dan karyawan Teknik Mesin FTI-ITS yang telah memberikan banyak ilmu, pengetahuan dan pengalaman kepada penulis.
9. Segenap karyawan Teknik Mesin, Cak Bud, Cak Ghofur, Cak Mad, Pak No, Cak To, Bu Sri, Pak Untung, dan terutama Pak Karmono dan Mas Ridho yang tak kenal lelah membantu saya dalam tugas akhir ini serta semua karyawan yang belum bisa disebutkan
10. HHO Super Team, Micol, Chandra, Irawan, Putu, Robitha dan Andi.
11. Teman seperjuangan dari teman teman M 53, yang tidak bisa saya sebutkan satu persatu, Terima kasih atas semua yang kalian berikan. “Allah SWT selalu bersama
mahasiswa tingkat akhir”.
12. Semua pihak yang tidak dapat saya sebutkan satu persatu, Terima kasih atas semuanya
Penulis menyadari masih banyak kekurangan dalam penyusunan tugas akhir ini, oleh karena itu saran dan masukan dari semua pihak sangat penulis harapkan. Penulis berharap semoga tugas akhir ini dapat memberikan manfaat dan sumbangsih bagi perkembangan ilmu pengetahuan.
Surabaya, Juli 2014
HALAMAN JUDUL
HALAMAN PENGESAHAN
ABSTRAK ... i
KATA PENGANTAR ... v
DAFTAR ISI ... vii
DAFTAR GAMBAR ... xi
DAFTAR TABEL ... xiii
DAFTAR SIMBOL ... xv
BAB I PENDAHULUAN 1.1. Latar Belakang Masalah ... 1
1.2. Perumusan Masalah ... 3
1.3. Batasan Masalah ... 3
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Hasil Penelitian ... 4
1.6. Sistematika Penulisan ... 5
BAB II TINJAUAN PUSTKA 2.1. Tinjauan Pustaka ... 7
2.2. Penelitian Terdahulu ... 7
2.2.1. Nicholas dan Johan Ritter ... 7
2.2.2. Dr. Yull Brown ... 8
2.2.3. Stanley Meyer ... 8
2.2.4. Djoko Sungkono ... 8
2.2.5.Theo Anggara Kusuma ... 9
2.2.6. Iqbal Wahyudzin ... 11
2.3. Dasar Teori Motor Diesel ... 13
2.3.1. Siklus Diesel 4 Langkah ... 14
2.3.2. Tahap-tahap Proses Pembakaran ... 15
2.4. Bahan Bakar Mesin Diesel ... 17
Dump truck Nissan Diesel CWA211 6925cc ... 22
2.6. Gas HHO (Hidrogen-Hidrogen Oksida) ... 25
2.6.1. Proses Elektrolisis Air Untuk Memproduksi Gas HHO ... 27
2.6.2. Karekteristik Brown Gas (HHO) ... 30
2.7. Komponen Elektrolisis Air ... 31
2.7.1. Prinsip Kerja Generator HHO ... 32
2.7.2. Elektroda ... 35
2.7.3. Elektrolit ... 39
2.8. Performa Generator HHO ... 41
2.8.1. Daya yang Dibutuhkan Generator HHO... 41
2.8.2. Laju Produksi (flowrate) Gas HHO ... 41
2.8.3. Efisiensi Generator HHO... 43
2.9. PenentuanTeganganKerja Generator HHO ... 46
BAB III METODE PENELITIAN 3.1. Diagram Alir (flowchart) Penelitian ... 49
3.2. Pengujian Performa Implementasi Gas HHO ... 53
3.2.1. Peralatan yang Digunakan ... 53
3.2.2. Pengujian Performa Gas HHO ... 62
3.2.2.1. Prosedur Pengujian Performa Generator Gas HHO ... 63
3.2.2.2. Hal –hal yang Harus Diperhatikan Dalam Pengambilan Data ... 66
3.2.3. Pengujian Gas HHO Pada Dump Truck Nissan Diesel CWA 211 6925 cc ... 66
3.2.3.1. Prosedur Pengujian Implementasi HHO .... 68
3.2.3.2. Hal-hal yang Harus Diperhatikan Dalam Pengambilan Data ... 71
BAB IV ANALISA DATA DAN PEMBAHASAN 4.1. Perhitungan Data ... 75
4.1.4. Efisiensi Generator HHO... 78
4.2. Analisa Data ... 80
4.2.1. Analisa Data Performa Generator HHO ... 80
4.2.1.1. Daya yang Dibutuhkan Generator HHO ... 81
4.2.1.2. Waktu Produksi Gas HHO ... 83
4.2.1.3. Spesific Gas Production Generator HHO (SGP) ... 85
4.2.1.4. Efisiensi Generator HHO ... 88
4.2.1.5. Temperatur Elektrolit Generator HHO ... 90
4.2.1.6. Tegangan Generator HHO ... 92
4.2.1.7. Arus Generator HHO ... 94
4.2.2. Analisa Data Implementasi Gas HHO pada Dump truck Nissan Diesel CWA 211 NHRR-S 6925cc. ... 95
4.2.2.1. Data Hasil Percobaan Implementasi Gas HHO pada Dump truck Nissan Diesel CWA 211 NHRR-S 6925cc. ... 96
4.2.2.2. Perhitungan dan Analisa Data Implementasi Gas HHO Pada Dump truck Nissan Diesel CWA211 NHRR-S 6925cc. ... 99
BAB V KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 107
5.2. Saran ... 108
DAFTAR PUSTAKA ... 109 LAMPIRAN
Gambar 1.1 Perkembangan konsumsi minyak bumi di
Indonesia berdasarkan sektor ... 2
Gambar 2.1 Grafik hasil penelitian (Theo Anggara Kusuma 2011) ... 10
Gambar 2.2 Grafik hasil penelitian (Iqbal Wahyudzin) ... 12
Gambar 2.3 Proses kerja motor diesel 4 langkah ... 13
Gambar 2.4 Siklus diesel 4 langkah ... 14
Gambar 2.5 Tahap pembakaran mesin diesel ... 16
Gambar 2.6 Pemecahan molekul air menjadi gas HHO ... 26
Gambar 2.7 Rangkain dasar sistem elektrolisa ... 29
Gambar 2.8 Generator HHO dengan elektroda berbentuk susunan pelat ... 33
Gambar 2.9 Bentuk generator HHO tipe wet cell ... 34
Gambar 2.10 Bentuk generator HHO tipe dry cell ... 35
Gambar 2.11 Luasan elektroda proses terjadinya elektrolisis pada tipe dry cell ... 38
Gambar 2.12 Grafik hubungan reaksi kimia terhadap energi yang dibutuhkan untuk terjadinya reaksi ... 39
Gambar 2.13 Hubungan konsentrasi KOH terhadap konduktifitas ... 40
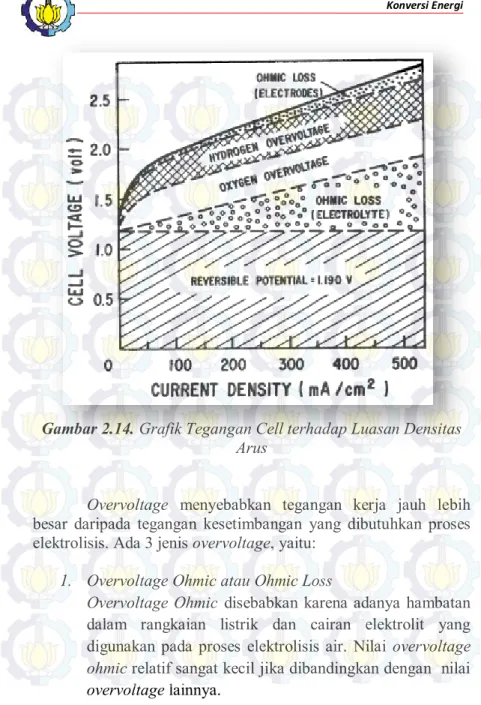
Gambar 2.14 Grafik tegangan cell terhadap luasan densitas Arus ... 47
Gambar 3.1 Diagram alir penelitian ... 52
Gambar 3.2 Generator HHO tipe kering ... 53
Gambar 3.3 Bubbler ... 54
Gambar 3.4 HHO gas flowmeter ... 55
Gambar 3.5 Gelas ukur ... 55
Gambar 3.6 Baterai accu ... 56
Gambar 3.7 Charger accu ... 57
Gambar 3.8 Stopwacth ... 57
Gambar 3.12 Check valve ... 60
Gambar 3.13 Tuas On-Off ... 60
Gambar 3.14 Engine Nissan diesel CWA211 NHRR-S 6925 cc ... 61
Gambar 3.15 Speedometer ... 62
Gambar 3.16 Nozzle ... 62
Gambar 3.17 Skema pengujian flowrate gas HHO ... 63
Gambar 3.18 Sistem pengaliran gas HHO kedalam block engine... 67
Gambar 3.18 Skema pengujian implementasi gas HHO ... 68
Gambar 4.1 Grafik daya generator HHO terhadap jumlah massa KOH ... 81
Gambar 4.2 Grafik waktu produksi HHO per liter terhadap jumlah massa KOH ... 83
Gambar 4.3 Grafik specific gas production terhadap waktu pengujian ... 85
Gambar 4.4 Grafik efisiensi generator HHO terhadap massa KOH ... 88
Gambar 4.5 Grafik temperatur elektrolit generator HHO terhadap waktu pengujian ... 90
Gambar 4.6 Grafik tegangan generator HHO terhadap waktu pengujian ... 92
Gambar 4.7 Grafik arus generator HHO terhadap waktu pengujian ... 94
Gambar 4.8 Skema rute jalan pengambilan data implementasi gas HHO pada Dump truck Nissan diesel CWA 211 NHRR-S 6925 cc ... 97
Tabel 1.1 Data konsumsi fossil fuel dunia ... 1 Tabel 2.1 Perbandingan nilai properties termokimia pada
kondisi atmosfer ... 27 Tabel 2.2 Properties gas hidrogen pada kondisi temperatur
dan tekanan standar ... 31 Tabel 2.3 Standard komposisi stainless steel ... 37 Tabel 4.1 Data hasil pengujian performa standar pada
Dump truck Nissan diesel CWA211 NHRR-S 6925cc ... 98 Tabel 4.2 Data hasil pengujian performa implementasi gas
HHO pada Dump truck Nissan diesel CWA 211 NHRR-S 6925cc ... 98 Tabel 4.3 Hasil perhitungan performa standar Dump truck
Nissan Diesel CWA211 NHRR-S 6925cc ... 102 Tabel 4.4 Hasil perhitungan performa implementasi gas
HHO pada Dump truck Nissan Diesel CWA211 NHRR-S 6925cc ... 103 Table 4.5 Analisa perbandingan performa Dump truk Nissan
Notasi :
𝑁𝐾𝐴 = nilai kalor atas (kal/gram) 𝑚𝑎𝑖𝑟 = massa uap air (gram)
𝑚𝑠𝑎𝑚𝑝𝑙𝑒 = massa sample uji bahan bakar (gram) 𝐿𝐻 = panas latent penguapan air (kal/gram) 𝑉𝑟𝑎𝑡𝑎 = kecepatan rata-rata (km/jam)
𝑆 = jarak tempuh (km) 𝑡 = waktu tempuh (jam)
𝐶𝑘𝑜𝑛𝑠𝑢𝑚𝑠𝑖 = konsumsi bahan bakar solar (km/liter) 𝑣𝑘𝑜𝑛𝑠𝑢𝑚𝑠𝑖 = volume konsumsi bahan bakar solar (liter) 𝐶ℎ𝑒𝑚𝑎𝑡 = pengurangan konsumsi bahan bakar solar (liter) 𝐶𝑜 = konsumsi bahan bakar solar pada kondisi standar
(liter)
𝐶𝑖 = konsumsi bahan bakar solar dengan penambahan sistem gas HHO (liter)
𝐶ℎ𝑒𝑚𝑎𝑡 (%) = persentase pengurangan konsumsi bahan bakar solar (%)
𝐶𝑖𝑟𝑖𝑡 = keiritan jarak tempuh konsumsi bahan bakar solar setelah menggunakan sistem gas HHO (km/ liter) 𝐶ℎℎ𝑜 = konsumsi bahan bakar solar setelah menggunakan sistem gas HHO jarak tempuh terhadap konsumsi
bahan bakar (km/liter)
𝐶𝑠𝑜 = konsumsi bahan bakar solar pada kondisi standar jarak tempuh terhadap konsumsi bahan bakar (km/ liter).
𝐶𝑖𝑟𝑖𝑡(%) = persentase keiritan jarak tempuh konsumsi bahan bakar solar setelah menggunakan sistem gas HHO (%)
𝑃𝑑𝑎𝑦𝑎 = daya yang dibutuhkan generator HHO (watt) 𝑉 = beda potensial/voltase (volt)
𝜌 = massa jenis HHO (kg/m3) 𝑉𝑜𝑙𝑢𝑚 = volume gas terukur (m3) 𝑡𝑝𝑟𝑜𝑑 = waktu produksi gas HHO (s) 𝑃 = tekanan gas ideal (atm) 𝑛 = molaritas senyawa (mol)
𝑅 � = konstanta gas ideal (liter.atm/mol.K) 𝑇 = temperatur, (oK).
𝑉̇ = volume per detik (liter/s)
𝑛̇ = molaritas senyawa per waktu (mol/s) 𝜂 = efisiensi (%)
𝛥ℎ𝑓 = besarnya energi yang dihasilkan untuk penguraian 1 mol ikatan molekul air (+286 kj/mol) 𝑃𝐻𝐻𝑂 = tekanan gas HHO (atm)
𝐼 = arus listrik pada generator HHO (amper) 𝑀𝑟 = massa molekul relatif
𝑚 = massa (kg) 𝑔 = gravitasi bumi (m/s2) 𝐹 = gaya (N) 𝐴 = luasan (m2) 𝑟 = jari-jari (m) Singkatan : 𝐻2𝑂 = air
𝑁𝐾𝐴 = nilai kalor atas 𝑁𝐾𝐵 = nilai kalor bawah 𝑆𝐺 = specific gravity
𝐴𝑃𝐼 = american petroleum institute 𝑁𝑎𝐻𝐶𝑂3 = sodium bikarbonat
𝑁𝑎𝑂𝐻 = natrium hidroksida 𝐾𝑂𝐻 = kalium hidroksida
𝐼𝐷𝑂 = industrial diesel oil 𝐹𝑂 = fuel oil
𝑇𝑀𝐴 = titik mati atas 𝑇𝑀𝐵 = titik mati bawah
BAB I
PENDAHULUAN
1.1 Latar Belakang Masalah
Pada saat ini kebutuhan energi dari fossil fuel menjadi permasalahan serius yang disebabkan adanya kecenderungan semakin meningkatnya pemakaian fossil fuel setiap tahunnya. Hal ini berdasarkan data Internasional Energy Agency (IEA) World
Energy Statistics and Balances pada periode 2002-2012 (sebagian
kecil dapat dilihat pada tabel 1.1). Fossil fuel merupakan energi yang tidak dapat diperbaharui, sedangkan kebutuhan terhadap bahan bakar tersebut masih cenderung meningkat. Adanya ketidakseimbangan antara pemakaian dengan persediaan berpotensi menurunkan persediaan fossil fuel seiring dengan bertambahnya waktu.
Tabel 1.1 Data Konsumsi Fossil Fuel Dunia Tahun 2006 2007 2008 2009 2010 2011 2012 85138 Thousand barrels daily 86575 Thousand barrels daily 86052 Thousand barrels Daily 86064 Thousand barrels daily 87833 Thousand barrels daily 88879 Thousand barrels daily 89774 Thousand barrels daily
(Sumber :Internasional Energy Agency, World Energy Statistics and Balances, BP Statistical Review of World Energy, 2013 )
Sedangkan di Indonesia, salah satu sektor pemakai minyak terbesar adalah dari sektor industri diikuti oleh sektor transportasi yang menduduki posisi kedua dalam konsumsi bahan
bakar minyak Nasional, selanjutnya sektor rumah tangga, sektor komersial dan lain-lain. Hal ini berdasarkan data yang dikeluarkan oleh Kementerian Energi dan Sumber Daya Mineral (ESDM) yang ditunjukkan pada grafik berikut ini.
Keterangan : konsumsi minyak bumi dalam persentase (%) Gambar 1.1 : Perkembangan Konsumsi Minyak Bumi di
Indonesia Berdasarkan Sektor
(Sumber : Handbook of Energy and Economic Statistics of Indonesia, 2012).
Disisi lain, seiring dengan meningkatnya pemakaian minyak bumi di sektor transportasi menyebabkan tingginya emisi polutan yang dihasilkan dari proses pembakaran, seperti karbon monoksida (CO), hidrokarbon (HC), oksida nitrogen (NOX),
sulfur oksida (SOX), dan zat debu timbal (Pb). Kondisi ini akan
memicu meningkatkan angka pencemaran udara, terganggunya kesehatan manusia, hewan, dan tumbuhan (pencemaran lingkungan).
Kondisi ini mendorong manusia berusaha mencari bahan bakar alternatif terbarukan dengan emisi polutan rendah sehingga dapat mengurangi ketergantungan manusia terhadap minyak bumi dan mengurangi tingkat pencemaran udara yang disebabkan oleh
kendaraan bermotor. Salah satu upaya dalam meningkatkan efisiensi penggunaan energi yaitu dengan menambahkan sistem gas Hidrogen Hidrogen Oksida (HHO) pada kendaraan bermotor. 1.2 Perumusan Masalah
Sehubungan dengan penelitian mengenai generator gas HHO Dry type 6 cell tersusun seri dan implementasinya pada
Dump truck Nissan Diesel CWA211 NHRR-S 6925cc, maka
permasalahan yang akan dicari pemecahannya adalah :
1. Bagaimana performa generator gas HHO dry type 6 cell dengan 4 generator HHO yang disusun seri.
2. Bagaimana pengaruh penambahan sistem gas HHO terhadap nilai konsumsi bahan bakar solar mesin diesel
Dump truck Nissan Diesel CWA 211 NHRR-S 6925cc.
1.3 Batasan Masalah
Agar pengujian yang dilakukan tidak keluar dari permasalahan yang ingin dicari pemecahannya, maka ditentukan batasan permasalahan. Adapun batasan masalah untuk penelitian ini adalah :
1. Percobaan ini dilakukan di Laboratorium Teknik Pembakaran dan Bahan Bakar Teknik Mesin ITS untuk mengetahui performa generator gas HHO dan di Pamekasan sebagai implementasi dari gas HHO pada Dump truck Nissan Diesel CWA211 NHRR-S 6925cc.
2. Bahan bakar yang digunakan jenis solar yang ada di pasaran produksi pertamina.
3. Seluruh elektroda, baik elektroda netral, positif, maupun negatif berdimensi sama. Pelat yang digunakan adalah pelat stainless steel tipe 316L dengan dimensi :
Panjang : 110 mm Lebar : 110 mm Tebal : 1.5 mm
4. Ada 4 generator HHO yang digunakan, masing-masing generator berukuran 110mm x 110mm, menggunakan 6 cell dan setiap cell menggunakan 4 pelat netral.
5. Engine yang digunakan adalah engine Nissan Diesel CWA211 NHRR-S 6925cc.
6. Kondisi engine dalam keadaan standar.
7. Cairan elektrolit yang digunakan menggunakan KOH dengan variasi 3 gram, 5 gram dan 7 gram pada setiap satu liter aquades.
8. Gasket yang digunakan yaitu O-ring berbahan karet dengan dimensi :
Diameter dalam : 100 mm Tebal : 3.5 mm
9. Kondisi temperatur dan kelembaban udara adalah setempat.
10. Analisa performa implementasi gas HHO pada Dump
truck Nissan Diesel CWA211 NHRR-S 6925cc hanya
berupa nilai konsumsi bahan bakar solar. 1.4 Tujuan Penelitian
Adapun tujuan yang ingin dicapai dalam penelitian tugas akhir ini adalah :
1. Untuk mengetahui performa generator gas HHO dry
type 6 cell dengan 4 generator HHO yang disusn seri.
2. Untuk mengetahui pengaruh penambahan sistem gas HHO terhadap nilai konsumsi bahan bakar solar mesin diesel Dump truck Nissan Diesel CWA211 NHRR-S 6925cc.
1.5 Manfaat Hasil Penelitian
Dari hasil penelitian, manfaat yang didapatkan dari penelitian ini antara lain :
1. Mendayagunakan energi alternatif yang efektif, efisien dan berdaya guna, yaitu pemanfaatan air dengan cara eletrolisis untuk menghasilkan bahan bakar hidrogen.
2. Sebagai pengembangan penelitian di Indonesia.
3. Memberikan sumbangan pemikiran bagi pengembangan ilmu pengetahuan dan memberikan informasi seluas-luasnya kepada masyarakat tentang gas HHO.
4. Sebagai upaya mendukung program pemerintah tentang pemanfaatan energi alternatif.
5. Sebagai solusi alternatif mengurangi angka pencemaran udara yang disebabkan emisi gas buang kendaraan mesin diesel.
1.6 Sistematika Penulisan
Sistematika penulisan tugas akhir disusun sebagai berikut :
BAB I : Pendahuluan
Berisi latar belakang masalah, perumusan masalah, batasan masalah, tujuan tugas akhir, manfaat penelitian dan sistematika penulisan.
BAB II : Tinjauan Pustaka
Berisi uraian teori-teori, temuan dan bahan penelitian lain yang diperoleh dari acuan yang akan dijadikan landasan dalam tugas akhir ini.
BAB III : Metode Penelitian
Berisi uraian tentang metode penelitian, peralatan eksperimen dan perencanaan eksperimen yang digunakan dalam tugas akhir ini.
BAB IV : Perhitungan Dan Analisa Data
Berisi analisa data hasil penelitian yang telah dilakukan untuk menperoleh suatu kesimpulan. BAB V : Kesimpulan Dan Saran
Berisi tentang kesimpulan dari analisa performa generator gas HHO Dry type 6 cell tersusun seri dan implementasinya pada Dump truck Nissan Diesel CWA 211 NHRR-S 6925cc serta saran-saran yang berhubungan dengan penelitian ini.
BAB II
TINJAUAN PUSTAKA DAN DASAR TEORI
2.1 Tinjauan Pustaka
Gas HHO merupakan suatu sistem elektrolisis air (H2O)
untuk menghasilkan gas hidrogen dengan nilai kalor dan oktan yang tinggi. Apabila gas tersebut ditambahkan pada mesin berbahan bakar solar atau bensin, maka akan dapat meningkatkan kualitas pembakaran, mengurangi konsumsi bahan bakar dan menurunkan emisi gas buang. Selain itu, uap air yang terbawa gas HHO dapat membuat mesin lebih dingin.
Dalam elektrolisis air hidrogen maupun uap air yang diperoleh dapat sekaligus muncul pada keluaran sistem gas HHO. Komponen utama sistem gas HHO terdiri dari generator HHO,
Bubler yang berisi air dengan campuran KOH, elektroda (katoda
dan anoda) serta supply tegangan listrik. Kandungan katalisator, luas permukaan elektroda, besar arus dan besar tegangan sangat berpengaruh terhadap produksi gas yang dihasilkan.
2.2. Penelitian Terdahulu
Pada sub bab ini akan dijelaskan beberapa hasil penelitian-penelitian terdahulu yang dijadikan dasar pertimbangan dalam melakukan penelitian tugas akhir ini, antara lain :
2.2.1. Nicholson dan Johann Ritter (1800)
Penemuan awal elektrolisis air pertama kali ditemukan pada tahun 1800 oleh dua orang peneliti yaitu : Willliam Nicholson dan Johann Ritter. Peneliti tersebut melakukan eksperimen terhadap air untuk memecah molekul air (H2O)
menjadi H2 dan O2, melalui eksperimennya mereka berhasil
menemukan teknologi pemecahan molekul air menjadi gas Hidrogen Hidrogen Oksida yang dikenal dengan cara elektrolisis air (H2O).
2.2.2. Dr. Yull Brown (1974)
Seorang peneliti berkebangsaan Australia yang berdomisili di kota Sidney, Dr. Yull Brown melakukan penelitian mengenai elektrolisis air (H2O). Dalam penelitiannya, ia berhasil
menjalankan kendaraannya menggunakan sistem elektrolisis air (H2O) berupa gas HHO. Selain menggunakan gas HHO pada
kendaraannya, Dr. Yull Brown juga menggunakan hasil elektrolisis air berupa gas HHO untuk pemotongan dan pengelasan (cutting and welding torch). Setelah berhasil dengan penelitiannya, Dr. Yull Brown mematenkan gas Hidrogen Hidrogen Oksida (HHO) dengan namanya sendiri yang dikenal sampai sekarang sebagai Brown’s gas.
2.2.3. Stanley Mayer (1995)
Stanley Mayer adalah seorang peneliti yang berasal dari Ohio, Amerika serikat. Dalam penelitiannya, beliau berhasil menemukan sistem bahan bakar elektrolisa air sekaligus dengan sistem kontrol elektroniknya. Penemuannya itu, kemudian diterapkan pada mobil VW Beetle dan berhasil berjalan sejauh 160 km dengan menggunakan 3 liter air. Bahan bakar yang digunakan pada penelitiannya, murni menggunakan sistem elektrolisis air berupa gas HHO tanpa bahan bakar minyak. Stanley Mayer adalah penemu teknologi bahan bakar air yang paling sempurna yang pernah diaplikasikan pada kendaraan. 2.2.4. Djoko Sungkono (1997)
Prof. Dr. Ir. H. Djoko Sungkono K.,M.Eng.Sc. sebagai guru besar Teknik Mesin ITS mulai melakukan penelitian mengenai gas HHO pada tahun 1997. Dalam penelitiannya yang berlangsung sampai sekarang (generasi ke-8) telah banyak menghasilkan perbaikan dibidang HHO, salah satunya adalah pemilihan jenis air, tipe pelat, pemakaian PWM dan penggunaan jenis katalis. Sampai saat ini, jenis air yang paling bagus untuk proses elektrolisis air adalah air Aquades, untuk pelat digunakan jenis pelat stainless steel tipe 316L, sedangkan untuk katalis
menggunakan Kalium Hidroksida (KOH). Dari tipe pelat yang digunakan dilakukan penelitian dengan variasi ukuran pelat untuk menghasilkan efisiensi yang paling tinggi. Sampai saat ini efisiensi dan laju produksi yang paling baik dihasilkan oleh generator dengan ukuran pelat 110mm x 110mm.
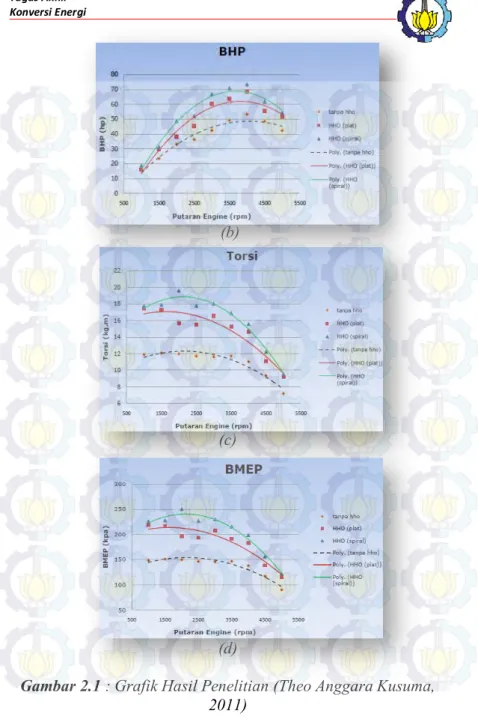
2.2.5. Theo Anggara Kusuma (2011)
Dalam menyelesaikan tugas akhirnya, Theo Anggara Kusuma melakukan pengujian mengenai pengaruh penambahan generator HHO terhadap unjuk kerja mesin diesel otomotif tipe 2KD-FTV 2500cc. Dalam penelitiannya pada mesin Toyota Innova diesel 2500cc dengan pemasangan generator HHO menggunakan elektroda Stainless steel berbentuk pelat berjumlah 6 buah dengan susunan 3 pasang pelat ukuran 5x12 cm menggunakan larutan elektrolit sebanyak 0,7 gr. Hasil dari penelitiannya didapatkan peningkatan daya engine rata-rata sebesar 22,88%, peningkatan torsi engine rata-rata sebesar 28,69% dan penghematan konsumsi bahan bakar rata-rata sebesar 22,43%. Berikut adalah grafik hasil penelitian dari Theo Anggara Kusuma.
(b)
(c)
(d)
Gambar 2.1 : Grafik Hasil Penelitian (Theo Anggara Kusuma,
a. Sfc vs putaran engine b. Bhp vs putaran engine c. Torsi vs putaran engine d. Bmep vs putaran engine
2.2.6. Iqbal Wahyudzin (2012)
Dalam menyelesaikan tugas akhirnya, Iqbal Wahyudzin melakukan pengujian mengenai studi karakteristik generator gas HHO dry cell dan aplikasinya pada kendaraan bermesin injeksi 1300cc. Dalam penelitiannya dilakukan pada kendaraan Toyota Avanza 1300cc menggunakan generator gas HHO tipe kering dengan elekroda baja ss 304. Selain itu, elektrolit yang digunakan berupa KOH sebesar 25% dan 75% Aquades. Dari hasil penelitiannya didapatkan peningkatan torsi sebesar 6,2% dan daya yang dihasilkan 6,16%. Penurunan sfc terbesar pada mobil Toyota Avanza 1300cc yaitu 14,70%. Tingkat emisi gas buang turun, diantaranya : CO2 menurun 15,31% sedangkan nilai HC menurun
16,27% dan nilai NOx menurun sebesar 19%. Berikut adalah grafik hasil penelitian dari Iqbal Wahyudzin.
(b)
(c)
(c)
(d)
a. Torsi vs putaran mesin b. Daya engine vs rpm
c. Konsumsi bahan bakar vs putaran mesin d. Efisiensi campuran KOH dengan Aquades
2.3 Dasar Teori Motor Diesel
Pada motor diesel, volume udara yang dihisap hampir selalu konstan, sedangkan jumlah bahan bakar yang diinjeksikan tergantung dari pembebanan penggunaan engine. Prinsip kerja motor diesel adalah dengan menghisap udara kedalam ruang bakar, kemudian pada saat langkah kompresi udara tertekan sehingga temperatur dan tekanannya naik diatas temperatur nyala bahan bakar. Sesaat sebelum piston mencapai titik mati atas (TMA) bahan bakar diinjeksikan dengan tekanan yang tinggi sehingga berbentuk butiran-butiran halus lalu bercampur dengan udara yang terkompresi dan bertemperatur tinggi tersebut, sehingga terjadi pembakaran.
Proses kerja motor diesel 4 langkah adalah sebagai berikut : Langkah Pemasukan
Langkah Kompresi Langkah Ekspansi Langkah Buang
Berikut ini adalah skema proses kerja dari motor diesel 4 langkah.
(1) (2) (3) (4) Gambar 2.3 : Proses Kerja Motor Diesel 4 Langkah
1.
Langkah pemasukan2.
Langkah kompresi3.
Langkah ekspansi4.
Langkah buang Keterangan : 1. Langkah PemasukanPada langkah ini katup masuk membuka dan katup buang tertutup, udara mengalir kedalam ruang slinder.
2. Langkah Kompresi
Pada langkah ini kedua katup menutup, piston bergerak dari titik mati bawah (TMB) ke titik mati atas (TMA) menekan udara yang ada dalam silinder. Sesaat sebelum mencapai TMA bahan bakar diinjeksikan.
3. Langkah Ekspansi
Pada langkah ini kedua katub tertutup, karena injeksi bahan bakar kedalam silinder yang bertemperatur tinggi, bahan bakar terbakar dan berekspansi menekan piston untuk melakukan kerja sampai piston mencapai TMB. 4. Langkah Buang
Ketika piston hampir mencapai TMB katub buang terbuka dan katub masuk tertutup. Ketika piston bergerak menuju TMA gas sisa pembakaran terbuang keluar ruang bakar. Akhir langkah ini adalah ketika piston mencapai TMA setelah itu siklus kemudian berulang lagi.
2.3.1 Siklus Diesel 4 Langkah
Siklus diesel adalah siklus teoritis untuk Compression
Ignition Engines (CIE) atau motor diesel. Perbedaan antara siklus
diesel dan siklus otto adalah pada diesel penambahan panas terjadi pada tekanan tetap. Karena alasan inilah siklus diesel disebut siklus tekanan tetap. Dalam diagram P-V dan T-s siklus diesel ditunjukkan pada gambar 2.4 siklus diesel 4 langkah.
(a) (b)
Gambar 2.4 : Siklus Diesel 4 Langkah
(a) Diagram P-V (b) Diagram T-s
Keterangan :
1-2 : Kompresi Isentropik (reversible adiabatic) 2-3 : Pembakaran Isobaris
3-4 : Ekspansi Isentropis (reversible adiabatic) 4-1 : Pembuangan Kalor Isocoric
2.3.2. Tahap–Tahap Proses Pembakaran
Proses pembakaran pada motor diesel dibagi atas 4 tingkatan, seperti pada gambar 2.5 tahap pembakaran mesin diesel.
Gambar 2.5 : Tahap Pembakaran Mesin Diesel
Sumber : (Mathur, M. L., Sharma, R,P “A Course in Internal Combustion Engines, ”Dhanpat Rai & Sons, 3rd Edition,
Delhi.,1980)
1. Tingkat pertama.
Ignition delay period adalah rentang waktu atau
interval antara mulai diinjeksikannya bahan bakar pada tekanan tertentu sampai dengan awal terjadinya pembakaran. Periode ini dimulai dari titik A ketika bahan bakar mulai diinjeksikan kedalam silinder dan berakhir sampai pada titik B dan selama periode tersebut belum terjadi pembakaran. Pada tahap ini kondisi bahan bakar siap terbakar namun belum dinyalakan.
2. Tingkat kedua.
Rapid atau uncontrolled combustion digolongkan
sebagai pre-mixed flame adalah periode awal dari pembakaran hingga flame mulai berkembang yaitu dari titik B hingga titik C (dihitung mulai dari akhir periode tunda
sampai titik dengan tekanan tertinggi pada diagram indikator). Selama periode ini, bahan bakar yang diinjeksikan kedalam ruang bakar berupa droplet diselubungi oleh udara bertemperatur tinggi, akibatnya droplet-droplet tersebut mulai terbakar dengan cepat secara tidak beraturan. Pembakaran tersebut menyebabkan kenaikan tekanan yang cukup besar.
3. Tingkat ketiga.
Controlled combustion (dapat digolongkan sebagai diffusion flame) adalah periode flame mulai berkembang
hingga akhir langkah penginjeksian bahan bakar. Setelah titik C, bahan bakar masih tetap diinjeksikan.
Droplet-droplet yang sudah mulai terbakar pada tingkat kedua
menjalarkan pembakaran pada droplet lain, sehingga flame bergerak secara bersama menuju droplet–droplet yang baru diinjeksikan oleh injektor. Periode ini berakhir setelah injektor berhenti menginjeksikan bahan bakar kedalam ruang bakar dan dapat dikontrol melalui laju injeksi.
4. Tingkat keempat.
After burning merupakan proses pembakaran lanjut.
Secara teori, setelah tingkat ketiga atau setelah berakhirnya bahan bakar diinjeksikan, pembakaran sudah berakhir. Tetapi dikarenakan masih terdapatnya sisa-sisa bahan bakar yang belum terbakar pada tingkat ketiga, maka pembakaran terus berlanjut. Bila sisa bahan bakar belum habis, sedangkan piston sudah melakukan langkah buang maka bahan bakar tadi menjadi unburnt fuel.
2.4. Bahan Bakar Mesin Diesel
Syarat terjadinya pembakaran adalah ketersediaan bahan bakar. Bahan bakar diesel (minyak diesel) merupakan hasil penyulingan minyak bumi kasar dan memiliki sifat pelumasan. Minyak bumi adalah hidrokarbon rantai panjang yang terdiri dari molekul-molekul hidrogen dan karbon, yang dibedakan dari titik didihnya. Bahan bakar mesin diesel sebagian besar terdiri dari
senyawa hidrokarbon dan senyawa non hidrokarbon. Senyawa hidrokarbon yang terkandung dalam bahan bakar diesel antara lain parafinik, naftenik, olefin dan aromatik. Sedangkan untuk senyawa non hidrokarbon terdiri dari senyawa yang mengandung unsur non logam, yaitu S, N, O dan unsur logam seperti
vanadium, nikel dan besi.
2.4.1. Klasifikasi Bahan Bakar Mesin Diesel
Di Indonesia, Bahan bakar mesin diesel produksi Pertamina dibagi menjadi tiga jenis berdasarkan putaran mesin diesel antara lain :
a. Minyak solar
Minyak Solar biasa juga disebut High Speed Diesel (HSD) atau Automotive Diesel Oil (ADO), digunakan untuk jenis mesin diesel putaran tinggi (lebih dari 1.000 rpm). Minyak Solar juga dapat digunakan sebagai bahan bakar pada pembakaran langsung dalam dapur-dapur kecil dan menghasilkan pembakaran yang bersih.
b. Minyak diesel
Minyak Diesel (Diesel Fuel), biasa juga disebut Industrial
Diesel Oil (IDO), digunakan untuk jenis mesin diesel putaran
sedang atau lambat dengan kecepatan (300 - 1.000 rpm), atau dapat juga digunakan sebagai bahan bakar pada pembakaran langsung didalam dapur (furnace) boiler.
c. Minyak bakar
Minyak Bakar biasa juga disebut Fuel Oil (FO), digunakan untuk jenis mesin diesel putaran rendah dengan kecepatan kurang dari 300 rpm, atau dapat juga digunakan untuk pembakaran pada dapur (furnance) boiler. Minyak bakar lebih kental dan mempunyai titik tuang (pour point) yang lebih tinggi dibandingkan dengan minyak diesel.
Secara matematis, proses pembakaran dalam motor diesel standar dapat diasumsikan sebagai berikut:
Sedangkan pembakaran mesin diesel dengan penambahan Hidrogen diasumsikan sebagai berkut :
C19H30 + H2 + 27O2 19CO2 + 16H2O + Energi
Hasil proses pembakaran berupa uap air (H2O) dan
karbondioksida (CO2). Konsep diatas terjadi ketika pembakaran
sempurna. Padahal tidak semuanya pembakaran bisa terjadi secara sempurna, sehingga hasil dari pembakaran tidak hanya uap air dan karbondioksida. Salah satunya adalah gas NOx dan SOx. Gas inilah yang berbahaya bagi lingkungan hidup termasuk tumbuhan, binatang dan manusia, gas ini yang biasa disebut emisi (Nugroho, Widodo Priyo 2009).
2.4.2. Karakteristik Bahan Bakar Mesin Diesel
Karakteristik umum yang perlu diketahui untuk menilai kinerja bahan bakar mesin diesel antara lain :
a. Density, specific gravity dan API gravity.
Densitas menunjukkan perbandingan berat per satuan volume dari suatu zat atau bahan tertentu. Sedangkan
specific gravity (SG) adalah harga relatif dari densitas suatu
zat atau bahan terhadap air atau udara.
... (2.1)
Nilai SG dari suatu bahan bakar dapat digunakan untuk memperkirakan angka cetana melalui perhitungan cetane index (CI). Hubungan antara spesific gravity dengan API gravity adalah untuk mencari nilai API gravity harus terlebih dahulu mengetahui besarnya specific gravity dari bahan yang akan kita hitung nilai API gravitynya.
= 141,5131,5
Density, specific gravity dan API gravity diukur pada
temperatur 60˚F atau 15˚C. b. Viscosity (viskositas)
Viskositas adalah tahanan yang dimiliki fluida yang dialirkan dalam pipa kapiler terhadap gaya gravitasi, biasanya dinyatakan dalam waktu yang diperlukan untuk mengalir pada jarak tertentu. Jika viskositas semakin tinggi, maka tahanan untuk mengalir akan semakin tinggi. Karakteristik ini sangat penting karena mempengaruhi kinerja injektor pada mesin diesel. Jika viskositas terlalu tinggi akan menyebabkan atomasi yang rendah sehingga mesin sulit di start, sedangkan jika terlalu rendah akan menyebabkan pompa injeksi cepat aus.
c. Flash point (titik nyala)
Flash point atau titik nyala adalah suatu angka yang
menyatakan temperatur terendah dari bahan bakar minyak dimana akan timbul penyalaan api sesaat, apabila pada permukaan minyak tersebut didekatkan pada nyala api. Flash point mengindikasikan tinggi rendahnya volatilitas dan kemampuan untuk terbakar dari suatu bahan bakar.
d. Pour point (titik tuang)
Pour point atau titik tuang adalah suatu angka yang
menyatakan suhu terendah dari bahan bakar minyak sehingga minyak tersebut masih dapat mengalir karena gaya gravitasi. Pour
point merupakan ukuran daya atau kemampuan bahan bakar pada
temperatur rendah, yang berarti bahwa kendaraan dapat menyala pada temperatur rendah karena bahan bakar masih dapat mengalir. Selain itu terkait dengan proses penyimpanan dalam tangki dan pengaliran pada suatu pipa.
e. Sulphur content (kandungan belerang)
Kandungan belerang dalam bahan bakar diesel dari hasil penyulingan sangat tergantung pada asal minyak mentah yang
akan diolah. Keberadaan belerang tidak diharapkan karena sifatnya merusak yaitu apabila oksida belerang kontak dengan air merupakan bahan yang korosif terhadap logam di ruang bakar. Hal lain yang lebih penting adalah timbulnya polusi bagi lingkungan hidup yang merupakan hasil pembakaran berupa SOx. f. Distilation (distilasi)
Karakteristik destilasi dari bahan bakar menunjukkan kemampuan bahan bakar berubah menjadi uap (volatility) pada temperatur tertentu. Nilai dari mid boiling atau 50% recovery dapat digunakan untuk menghitung nilai cetane index.
g. Cetane number (angka cetana)
Angka cetana merupakan derajat kemampuan suatu bahan bakar untuk dapat terbakar dengan sendirinya pada tekanan dan temperatur tertentu. Atau menyatakan perlambatan penyalaan (ignition delay) dibandingkan dengan campuran volumetris
cetane (C16H34) dan α-methylnaphthalene (C10H7CH3) yang diuji
pada cooperative fuel research (CFR) engine pada kondisi yang sama. Cetane mempunyai nilai 100 dan α-methylnaphthalene mempunyai nilai 0, tetapi referensi yang digunakan sekarang adalah heptamethylnonane yang mempunyai nilai cetana 15. Angka cetana merupakan ukuran kemampuan penyalaan dari bahan bakar mesin diesel. Nilai cetana yang tinggi menyebabkan
ignition delay yang pendek, sedangkan nilai cetana yang rendah
menimbulkan knocking pada diesel. Karena keterbatasan peralatan nilai cetana bisa diperkirakan dengan menggunakan perhitungan cetane index.
h. Calorific value (nilai kalor)
Nilai kalor merupakan suatu angka yang menyatakan jumlah energi panas maksimum yang dibebaskan oleh suatu bahan bakar melalui reaksi pembakaran sempurna persatuan massa atau volume bahan bakar tersebut. Dari bahan bakar yang akan dibakar, nilai kalor yang terkandung akan diubah menjadi energi
mekanik melalui kerja komponen mesin. Besarnya nilai kalor atas diuji menggunakan Bomb calorimeter. Sedangkan untuk nilai kalor bawah (NKB) menggunakan persamaan :
………..(2.3)
dengan :
NKA = nilai kalor atas (kal/gram) mair = massa uap air (gram)
msample = massa sample uji bahan bakar (gram)
LH = panas latent penguapan air (kal/gram)
i. Carbon residue (residu karbon)
Adanya residu karbon dalam ruang pembakaran dapat mengurangi kinerja mesin. Pada temperatur tinggi deposit karbon ini dapat membara, sehingga menaikkan temperatur silinder pembakaran. Banyaknya deposit atau kerak yang ada di ruang bakar mengindikasikan tingginya kandungan residu karbon dari suatu bahan bakar.
j. Ash content (kadar abu)
Kadar abu adalah jumlah sisa-sisa dari minyak yang tertinggal, apabila suatu minyak dibakar sampai habis.
2.5. Analisa Performa Implementasi Gas HHO Pada Dump Truck Nissan Diesel CWA 211 NHRR-S 6925 cc
Performa unjuk kerja mesin diesel terdiri dari : daya efektif (Ne), torsi (T), tekanan efektif rata-rata (bmep), konsumsi bahan bakar spesifik (sfc) dan efisiensi thermis (ηth). Namun,
pada penelitian ini performa yang dianalisa hanya berupa konsumsi bahan bakar solar mesin diesel, hal tersebut dikarenakan keterbatasan alat dalam pengujian daya. Metode yang digunakan pada penelitian ini menggunakan cara perbandingan untuk menganalisa pengaruh penambahan sistem
gas HHO pada Dump truck Nissan Diesel CWA 211 NHRR-S 6925cc pada kondisi standar. Perumusan yang digunakan adalah sebagai berikut :
... (2.4)
dengan:
= kecepatan rata-rata (km/jam)
= jarak tempuh (km) = waktu tempuh (jam)
Sedangkan untuk perhitungan konsumsi bahan bakar solar digunakan persamaan :
... (2.5)
dengan :
= konsumsi bahan bakar solar (km/liter)
= jarak tempuh (km)
= volume konsumsi bahan bakar solar (liter)
Untuk menghitung pengurangan konsumsi pemakaian bahan bakar solar setelah menggunakan sistem gas HHO digunakan persamaan sebagai berikut :
...(2.6)
dengan :
pengurangan konsumsi bahan bakar solar (liter)
konsumsi bahan bakar solar pada kondisi standar
(liter)
konsumsi bahan bakar solar dengan penambahan sistem gas HHO (liter)
Sedangkan untuk menghitung persentase pengurangan konsumsi pemakaian bahan bakar solar setelah menggunakan sistem gas HHO digunakan persamaan berikut :
... (2.7)
dengan :
persentase pengurangan konsumsi bahan
bakar solar (%)
pengurangan konsumsi bahan bakar solar
(liter)
konsumsi bahan bakar solar pada kondisi
standar (liter)
Untuk menghitung keiritan jarak tempuh konsumsi bahan bakar solar setelah menggunakan sistem gas HHO digunakan persamaan berikut :
... (2.8)
dengan :
keiritan jarak tempuh konsumsi bahan bakar solar
setelah menggunakan sistem gas HHO (km/liter)
konsumsi bahan bakar solar setelah menggunakan
sistem gas HHO jarak tempuh terhadap konsumsi bahan bakar (km/liter)
konsumsi bahan bakar solar pada kondisi standar
jarak tempuh terhadap konsumsi bahan bakar (km/liter)
Sedangkan persentase keiritan jarak tempuh konsumsi bahan bakar solar setelah menggunakan sistem gas HHO dihitung menggunakan persamaan berikut:
dengan :
persentase keiritan jarak tempuh konsumsi bahan
bakar solar setelah menggunakan sistem gas HHO (%)
keiritan jarak tempuh konsumsi bahan bakar
solar setelah menggunakan sistem gas HHO (km/liter)
konsumsi bahan bakar solar pada kondisi
standar jarak tempuh terhadap konsumsi bahan
bakar (km/liter)
2.6. Gas HHO (Hidrogen Hidrogen Oksida)
Bahan bakar pada umumnya berasal dari bahan-bahan hidrokarbon, salah satunya adalah minyak bumi. Bahan bakar tersebut tersusun atas karbon dan hidrogen. Tetapi hidrogen saja dapat dijadikan bahan bakar layaknya bahan bakar hidrokarbon. Jika bahan bakar hidrokarbon umumnya didapat dari bahan bakar fosil, bahan bakar hidrogen umumnya diperoleh dengan cara elektrolisis dari berbagai sumber, salah satunya adalah air.
Air adalah suatu substansi kimia dengan rumus kimia H2O dimana dalam satu molekul air tersusun atas dua atom
Hidrogen yang terikat pada satu atom Oksigen. Kedua senyawa yang membentuk air ini merupakan komponen pokok dan mendasar dalam memenuhi kebutuhan seluruh makhluk hidup sebagai sumber energi.
Melalui proses pemecahan air murni (H2O), molekul air
dapat diuraikan menjadi unsur-unsur asalnya dengan mengaliri arus listrik atau disebut proses elektrolisis. Gas yang dihasilkan dari proses elektrolisis air tersebut adalah gas Hidrogen dan Oksigen, dengan komposisi 2 atom Hidrogen dan 1 atom Oksigen atau biasa disebut juga sebagai gas Hidrogen Hidrogen Oksida (HHO) (Peter E.W Lowrie, 2005). Skema pemecahan molekul air
menjadi gas HHO dapat dilihat pada gambar 2.6 pemecahan molekul air (H2O) menjadi gas HHO.
Gambar 2.6 : Pemecahan Molekul Air (H2O) Menjadi Gas HHO
Awal pertama kalinya gas Hidrogen Hidrogen Oksida (HHO) diaplikasikan dimulai pada tahun 1805 oleh Isaac de Rivaz (1752-1828). Isaac de rivaz menggunakan Gas HHO sebagai bahan bakar mesin pembakaran internal (Poempida
Hidayatullah dan F.Mustari, 2008). Pada saat itu bahan bakar
fosil belum ditemukan. Namun, gas hasil dari elektrolisis air tersebut baru diberi nama dan dipatenkan oleh ilmuan bernama Dr. Yull Brown pada tahun 1974. Gas hasil dari elektrolisis air tersebut diberi nama Brown gas.
Perbandingan nilai energi yang dimiliki oleh hidrogen paling besar diantara gas fuel yang lain, seperti yang ditunjukkan pada tabel 2.1. perbandingan nilai properties termokimia pada kondisi atmosfer.
Tabel 2.1 Perbandingan Nilai Properties Termokimia pada
Kondisi Atmosfer.
2.6.1. Proses Elektrolisis Air untuk Memproduksi Gas HHO Proses pemisahan senyawa kimia menjadi unsur-unsur dasar penyusun dari senyawa tersebut atau memproduksi suatu molekul baru dengan memberi arus listrik disebut elektrolisis (Anne Marie Helmenstine, 2001). Sedangkan elektrolisis air adalah proses elektrolisa yang dimanfaatkan untuk memecah
molekul air (H2O) menjadi unsur dasar penyusunnya, yaitu
Hidrogen (H2) dan Oksigen (O2). Elektrolisis air pada dasarnya
dilakukan dengan mengalirkan arus listrik ke air melalui dua buah elektroda yaitu katoda (elektroda negatif) dan Anoda (elektroda positif). Agar proses elektrolisa dapat terjadi dengan cepat maka air tersebut dicampur dengan elektrolit sebagai katalis.
Adanya peristiwa elektrolisis air menyebabkan atom-atom oksigen mendapat tambahan elektron, atom-atom oksigen menjadi sebuah ion bermuatan negatif (O-). sedangkan atom-atom
hidrogen dari air akan kehilangan elektronnya, atom hidrogen menjadi sebuah ion yang bermuatan positif (H+). Karena
bermuatan positif, ion-ion H+ akan tertarik dan berkumpul di
katoda, pada saat menyentuh katoda ion H+ akan menerima
sebuah elektron dan kembali menjadi sebuah atom H biasa tanpa bermuatan. Atom-atom hidrogen bergabung menjadi gas H2
dalam bentuk gelembung-gelembung, melalui katoda akan naik keatas keluar dari tabung. Berikut adalah reaksi yang terjadi pada elektrolisis air.
Reaksi oksidasi di anoda : 2 H2O (l) → O2(g)+ 4 H+(aq)+4 e-
Reaksi reduksi di katoda : 2 H+(aq) + 2 e- → H
2(g)
Reaksi keseluruhan : 2 H2O (l) → 2 H2(g)+O2(g)
Agar proses elektrolisa dapat terjadi dengan cepat maka air tersebut dicampur dengan elektrolit sebagai katalis.
Jika elektrolit yang digunakan adalah larutan basa seperti KOH atau NaOH (basa dari golongan periode IA, alkali tanah) maka akan terjadi reaksi basa. Pada reaksi basa, reaksi reduksi terjadi di katoda dimana molekul air mengikat elektron (e-)
sehingga terpecah menjadi gas Hidrogen (H2(g)) dan anion OH-.
Anion OH- tersebut kemudian tertarik kesisi anoda dan terpecah
menjadi gas oksigen dan molekul H2O(l), Reaksi kimia pada
proses elektrolisis air dengan menggunakan kalium hidroksida (KOH) ditunjukkan sebagai berikut :
Pada elektroda katoda (-) : 4H2O+4e־ 2H2+ 4OH
- Pada elektroda anoda (+) : 4OH־ O2+4e־ + 2H2O Reaksi keseluruhan : 2H2O 2H2+O2
Akan tetapi jika elektrolit yang digunakan dari jenis garam seperti NaCl, KCl,dan Na2CO3, maka akan terjadi reaksi
asam dan basa. Dari kedua reaksi asam ataupun basa dapat dilihat bahwa pada kedua reaksi tersebut produk yang dihasilkan dari elektrolisa 2 mol H2O memiliki komposisi yang sama yaitu 2 mol
gas Hidrogen dan 1 mol gas Oksigen. Pada kedua jenis reaksi diatas gas Hidrogen juga dihasilkan pada elektroda negatif (katoda) dan gas oksigen dihasilkan pada elektroda positif (anoda). Berikut adalah rangkaian dasar sistem elektrolisis air.
2.6.2. Karakteristik Browns Gas (HHO)
Browns gas (HHO) yang dihasilkan dari proses
elektrolisis air terdiri dari gas hidrogen dan Oksigen, dengan perbandingan komposisi mol 2:1. Perbandingan ini adalah perbandingan yang stoikiometri untuk terjadinya reaksi pembakaran (Oksidasi) gas hidrogen oleh gas oksigen. Reaksi pembakaran pada gas HHO pada dasarnya adalah reaksi terikatnya kembali hidrogen pada oksigen untuk membentuk molekul air. Sebagaimana dapat dilihat pada persamaan reaksi kimia berikut ini:
2H2(g) + O2(g) → 2H2O(l)
Persamaan reaksi kimia tersebut merupakan kebalikan dari persamaan kimia pada elektrolisis air. Jika pada proses elektrolisa untuk memecah molekul air membutuhkan energi, maka sebaliknya pada reaksi oksidasi hidrogen dihasilkan sejumlah energi. Gas hidrogen mempunyai beberapa karakteristik yaitu tidak berwarna, mudah terbakar (flameable), sangat ringan, dan sangat mudah bereaksi dengan zat kimia lainnya.
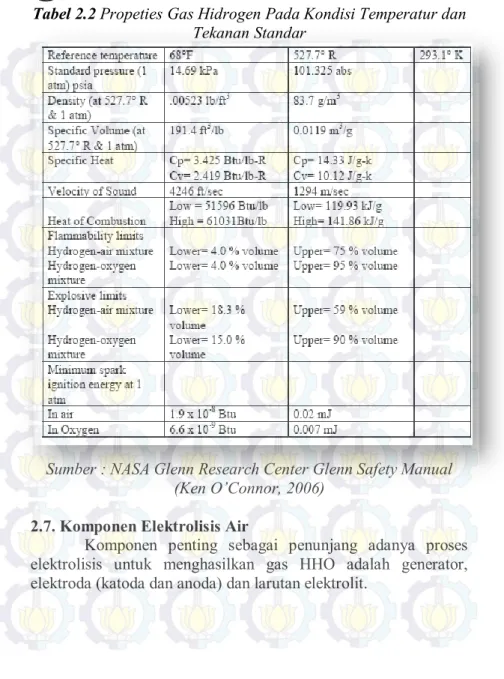
Adapun nilai properties gas hidrogen pada kondisi temperatur dan tekanan standar dapat dilihat pada tabel 2.2. properties gas hidrogen pada kondisi temperatur dan tekanan standar. Namun gas HHO pada kondisi normal tidak akan terbakar dengan sendirinya tanpa ada sulutan api.
Tabel 2.2 Propeties Gas Hidrogen Pada Kondisi Temperatur dan
Tekanan Standar
Sumber : NASA Glenn Research Center Glenn Safety Manual (Ken O’Connor, 2006)
2.7. Komponen Elektrolisis Air
Komponen penting sebagai penunjang adanya proses elektrolisis untuk menghasilkan gas HHO adalah generator, elektroda (katoda dan anoda) dan larutan elektrolit.
2.7.1 Generator HHO
Prinsip kerja generator HHO
Secara umum generator gas HHO tersusun atas 2 komponen dasar, yaitu tabung generator gas HHO dan sumber tenaganya. Tabung generator gas HHO terdiri atas tabung, sepasang elektroda dan elektrolit. Sedangkan sumber energi dapat berupa baterai ataupun aki.
Prinsip kerja generator gas HHO berdasarkan elektrolisa air. Proses elektrolisis air pada generator gas HHO menghasilkan gas hidrogen dan oksigen. Seiring berjalannya waktu, proses elektrolisis terus berlangsung hingga volume dan gelembung gas hidrogen dan oksigen yang melekat pada elektroda akan bertambah, kemudian terlepas mengapung, dan akhirnya bergerak naik.
Hasil dari penelitian, sebagian ahli menyebutkan bahwa gas yang tercipta akan berikatan satu sama lain menjadi gas HHO. Gas HHO terdiri dari dua ion H+ yang berikatan magnetik (ikatan
magnetik) dan mengikat satu ion O2- (R.M.Santili, 2006), berbeda
dengan molekul H2O yang tersusun atas dua ion H+ diikat oleh
satu ion O2- dengan ikatan kovalen. Pendapat ini masih terus
diperdebatkan karena belum ada alat untuk membuktikan bahwasanya kedua gas tersebut berikatan sebagaimana pengertian gas HHO. Sehingga, dalam penulisan penelitian ini, gas Hidrogen dan Oksigen yang terbentuk diasumsikan tidak berikatan satu sama lain, dan selanjutnya campuran kedua gas tersebut tetap disebut sebagai Gas HHO.
Generator HHO Berbentuk Susunan Pelat
Pada penelitian-penelitian terdahulu generator HHO yang banyak digunakan berupa elektroda bentuk spiral. Namun baru-baru ini mulai dikembangkan elektroda bentuk pelat seperti pada gambar 2.8 generator HHO dengan elektroda berbentuk susunan pelat sekaligus menjadi terobosan baru untuk Generator HHO selanjutnya, karena memiliki luas permukaan yang lebih besar dibanding elektroda bentuk spiral.
Gambar 2.8 : Generator HHO Dengan Elektroda Berbentuk
Susunan Pelat
Klasifikasi Generator HHO
Generator HHO diklasifikasikan menjadi 2 tipe yaitu tipe basah (wet type) dan tipe kering (dry type/dry cell).
a. Generator HHO Tipe Wet Cell
Tipe basah (wet type) adalah generator HHO dimana semua elektrodanya terendam cairan elektrolit di dalam sebuah bejana air seperti terlihat pada gambar 2.9 bentuk generator HHO tipe wet cell.
Keuntungan generator HHO tipe wet cell adalah : Gas yang dihasilkan umumnya lebih banyak dan stabil. Perawatan generator lebih mudah.
Gambar 2.9 : Bentuk Generator HHO Tipe Wet Cell b. Generator HHO Tipe Dry Cell
Tipe kering (dry type atau dry cell) adalah generator HHO dimana elektrodanya tidak seluruhnya terendam elektrolit melainkan hanya mengisi celah-celah antara elektroda yang dibatasi oleh gasket yang terbuat dari karet. Bentuk generator tipe
dry cell ini dapat dilihat pada gambar 2.10 bentuk generator HHO
tipe dry cell.
Keuntungan generator HHO tipe dry cell adalah :
1. Air yang dielektrolisa relatif lebih sedikit, yaitu hanya air yang terjebak diantara elektroda.
2. Panas yang ditimbulkan relative kecil, karena selalu terjadi sirkulasi antara air panas dan dingin di reservoir (temperatur relatif tetap). Serta panas dari elektroda juga dapat berkurang karena dibantu oleh pendinginan udara bebas.
3. Arus listrik (Ampere) yang digunakan relatif lebih kecil, karena daya yang terkonversi menjadi panas semakin
sedikit. Selain itu juga karena luas permukaan untuk proses elektrolisa yang relatif lebih kecil.
4. Arus listrik dari elektroda terbatas pergerakannya karena air yang di elektrolisa juga terbatas, yakni diantara pelat elektroda sehingga arus listrik yang digunakan lebih maksimal.
Gambar 2.10 : Bentuk Generator HHO Tipe Dry Cell 2.7.2. Elektroda
Elektroda adalah komponen penting terjadinya proses elektrolisis air. Oleh karena itu bahan yang digunakan sebagai elektroda harus memiliki keunggulan tersendiri.
Pemilihan Stainless Steel sebagai Elektroda
Elektroda adalah salah satu komponen yang sangat penting pada proses elektrolisis air. Elektroda berfungsi sebagai penghantar arus listrik dari sumber tegangan ke air yang akan dielektrolisis. Pada elektrolisis yang menggunakan arus DC, elektroda terbagi menjadi dua kutub yaitu positif sebagai anoda dan kutub negatif sebagai katoda. Material serta luasan elektroda yang digunakan sangat berpengaruh terhadap gas HHO yang
dihasilkan dari proses elektrolisis air. Sehingga material elektroda harus dipilih dari material yang memiliki konduktifitas listrik dan ketahanan terhadap korosi yang baik.
Pemakaian stainless steel sebagai elektroda pada percobaan ini, karena pada dasarnya stainless steel merupakan baja paduan logam besi (Fe) dengan unsur paduan utama Carbon (C), Nikel (Ni), dan Chromium (Cr). Stainless steel merupakan logam paduan yang memiliki konduktifitas dan ketahanan terhadap korosi yang relatif lebih baik dibandingkan logam-logam paduan ataupun logam murni lainnya dan harganya juga relatif lebih terjangkau.
Secara garis besar Stainless dapat dibagi menjadi lima kelompok (Harrold M. Cobb, 1999), yaitu:
1. Austenitic Stainless steel.
2. Duplex Stainless steel (austenitic-feritic). 3. Ferritic Stainless steel.
4. Martensitic Stainless steel.
5. Precipitation Hardening Stainless steel.
Setiap kelompok stainless steel terbagi lagi menjadi beberapa tipe dengan persentase dan kandungan unsur paduan yang berbeda-beda, sebagaimana dapat dilihat pada tabel 2.3. standard komposisi stainless steel. Untuk setiap tipe stainless
steel mempunyai kandungan dan karakteristik yang berbeda
begitu pula dengan konduktifitas listrik dan ketahanannya terhadap korosi.
Tabel 2.3 Standard Komposisi Stainless steel
Sumber : Corossion Science and Technology (David Tabolt,1998)
Berdasarkan tabel 2.3 diatas dapat dilihat bahwa stainless
steel tipe SS 316, 316L, 316N, 317, 329, dan 330 mempunyai
ketahanan korosi diberbagai lingkungan, sehingga stainless steel tipe ini sangat cocok digunakan sebagai elektroda pada proses elektrolisa air untuk memproduksi gas HHO.
Salah satunya Stainless steel tipe SS 316L merupakan
stainless steel yang relatif banyak tersedia dipasaran. SS 316L
merupakan stainless steel yang memiliki ketahanan terhadap korosi sangat baik sehingga dapat dijadikan sebagai elektroda generator HHO.
lubang saluran air
Ø baut M6
Luasan Elektroda Terjadinya Elekrolisis
Pada tipe dry cell, area luasan lingkaran pada pelat elektroda yang terendam air untuk proses terjadinya elektrolisis menghasilkan gas HHO, sedangkan bagian luasan yang lainnya tidak terendam air dan pelat dalam kondisi kering. Luasan yang terjadi elektrolisis air sekitar 60% yang dibatasi dengan O-ring atau seal pada setiap pelat yang digunakan. Selain itu pada setiap pelat terdapat dua lubang berdiameter 18 mm untuk saluran gas HHO yang berada di bagian atas dan di bawah. Pada penelitian ini menggunakan pelat elektroda berdimensi 110mm x 110mm dengan 4 generator HHO dengan 6 cell yang diseri diharapkan dapat menghasilkan gas HHO yang lebih besar, yaitu sedikitnya 4 liter per menit (LPM).
Luasan area dari elektroda yang terendam air untuk terjadinya proses elektrolisis pada generator HHO tipe dry cell pada percobaan ini dapat dilihat pada gambar 2.11 luasan elektroda terjadinya elektrolisis pada tipe dry cell.
Gambar 2.11 : Luasan Elektroda Proses Terjadinya Elektrolisis
pada Tipe Dry Cell
lubang saluran gas HHO
lubang saluran air dari bubler
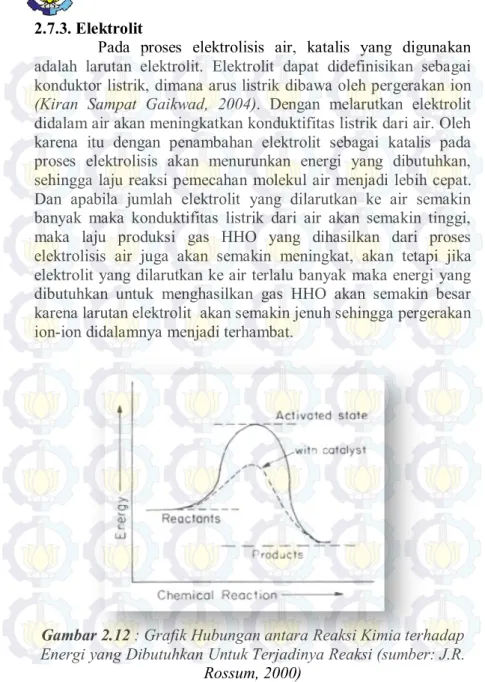
2.7.3. Elektrolit
Pada proses elektrolisis air, katalis yang digunakan adalah larutan elektrolit. Elektrolit dapat didefinisikan sebagai konduktor listrik, dimana arus listrik dibawa oleh pergerakan ion
(Kiran Sampat Gaikwad, 2004). Dengan melarutkan elektrolit
didalam air akan meningkatkan konduktifitas listrik dari air. Oleh karena itu dengan penambahan elektrolit sebagai katalis pada proses elektrolisis akan menurunkan energi yang dibutuhkan, sehingga laju reaksi pemecahan molekul air menjadi lebih cepat. Dan apabila jumlah elektrolit yang dilarutkan ke air semakin banyak maka konduktifitas listrik dari air akan semakin tinggi, maka laju produksi gas HHO yang dihasilkan dari proses elektrolisis air juga akan semakin meningkat, akan tetapi jika elektrolit yang dilarutkan ke air terlalu banyak maka energi yang dibutuhkan untuk menghasilkan gas HHO akan semakin besar karena larutan elektrolit akan semakin jenuh sehingga pergerakan ion-ion didalamnya menjadi terhambat.
Gambar 2.12 : Grafik Hubungan antara Reaksi Kimia terhadap
Energi yang Dibutuhkan Untuk Terjadinya Reaksi (sumber: J.R. Rossum, 2000)
Banyak jenis katalis yang digunakan pada proses elektrolisis. Diantaranya yang sering digunakan yaitu sodium bikarbonat (NaHCO3), natrium hidroksida (NaOH), dan kalium
hidroksida (KOH). Selain itu, katalis tersebut berfungsi untuk mempermudah proses penguraian air menjadi hidrogen dan oksigen karena ion-ion katalisator mampu mempengaruhi kestabilan molekul air menjadi ion H dan OH yang lebih mudah dielektrolisis. Dengan kata lain energi untuk menguraikan air menjadi lebih rendah. Tampak pada grafik gambar 2.13 hubungan konsentrasi KOH terhadap konduktifitas dibawah ini bahwa konduktivitas listrik tertinggi berada disekitar 20%-30% dan dapat diuji dengan hidrometer baterai yang harus mempunyai
spesific gravity 1,1.
Gambar 2.13 : Hubungan Konsentrasi KOH terhadap
2.8. Performa Generator HHO
Ada beberapa parameter yang harus diperhatikan dalam menganalisa performa generator HHO antara lain sebagai berikut: 2.8.1. Daya yang Dibutuhkan Generator HHO
Untuk menghasilkan gas HHO dengan menggunakan proses elektrolisis air dibutuhkan energi listrik. Jika generator HHO dipasang pada kendaraan bermotor, sumber energi listrik diambil dari baterai aki. Pada percobaan ini sumber energi listrik yang digunakan diambil langsung dari baterai aki Dump truck.
Besarnya daya yang dibutuhkan oleh generator HHO untuk menghasilkan gas HHO dapat dicari dengan perumusan sebagai berikut :
... (2.10)
dengan :
Pdaya = daya yang dibutuhkan generator HHO (watt)
V = beda potensial atau voltase (volt) I = arus listrik (ampere)
2.8.2. Laju Produksi (flowrate) Gas HHO ( )
Produk utama proses elektrolisa air dengan menggunakan generator HHO adalah gas HHO. Sehingga untuk mengetahui performa dari generator HHO, maka perlu diketahui laju produksi gas HHO yang dihasilkan oleh generator itu sendiri.
Untuk menghitung mass flowrate gas HHO dapat dicari dengan persamaan berikut :
HHO
m
... (2.11)dengan :
HHO
m
= laju produksi gas HHO (kg/s)= debit produksi gas HHO (m3/s)
= massa jenis gas HHO (kg/m3)
HHO
m
Dengan perumusan debit produksi gas HHO :
... (2.12)
dengan :
Volum = volume gas HHO terukur (m3)
tprod = waktu produksi gas HHO (s)
Dari persamaan reaksi kimia elektrolisis air (H2O) dapat
diketahui besar kandungan massa H2 dalam gas HHO. Jika massa
H2O yang dielektrolisis sebanyak 1 kg, maka massa produk total
H2 dan O2 juga 1 kg, sehingga dengan mengetahui nilai Mr
H2O=18, Mr H2=2, Mr O2=32, maka didapatkan mole H2 :
2H2O(l) 2H2(g) + O2(g)
... (2.13)
Dari perbandingan mol pada persamaan reaksi kimia elektrolisis air dapat dihitung besarnya massa H2 dalam 1 kg gas
HHO, yaitu: kg kg O molH MrH mH 9 1 18 1 2 2 2 2 mol kg O MrH O mH nH O 0,056 18 1 2 2 2 mol O nH O H Koef H Koef nH . 22 0,056 0,056 . 2 2 2 2 kg mol kg mol O MRH O nH mH2 2 2 0,056 2 / 0,112
Jika pada STP massa jenis H2 diketahui sebesar ρH2=
0,08235 gr/liter dan O2 sebesar ρO2=1,3088 gr/liter (ColeParmer Instrument, 2005), maka dapat dicari melalui penurunan
persamaan berikut ini:
Mr
Massa
Mol
HHO HHO HHO
m
V
= HHO O HV
m
m
)
(
2
2 HHO O O H HV
V
V
.
)
.
(
2 2
2 2
2 2 2 23
1
3
2
)
3
1
.
3
2
.
(
O H HHO HHO O HHO HV
V
V
gr/liter
491167
,
0
iter)
1,3088gr/l
(1/3
liter)
0,08235gr/
(2/3
HHO
2.8.3. Efisiensi Generator HHO (ηHHO)
Efisiensi merupakan perbandingan antara energi yang berguna dengan energi yang diberikan pada suatu sistem. Besarnya nilai efisiensi suatu alat konversi energi menunjukkan seberapa optimal alat tersebut dapat bekerja. Besarnya efisiensi dapat dihitung dari persamaan berikut :
...(2.14)
Pada generator HHO hasil yang berguna adalah produk elektrolisis air berupa gas HHO. Gas HHO yang terdiri dari gas H2 dan O2 mempunyai nilai kalor yang tinggi, sehingga dapat
dimanfaatkan energi yang terkandung didalamnya untuk meningkatkan pembakaran pada motor bakar. Karakteristik gas HHO cenderung memilki karakteristik yang hampir sama dengan gas penyusunnya (gas H2).
Perubahan entalpi pembakaran standar adalah perubahan entalpi total pada suatu sistem reaksi (dimana reaktan dan produk reaksi dinyatakan sebagai sistem termodinamik) yang terjadi ketika satu molekul bereaksi sempurna dengan oksigen yang
η =
Energi yang berguna (output)terjadi pada 298oK dan tekanan atmosfer 1 atm. Umumnya, nilai
entalpi pembakaran dinyatakan dalam joule atau kilo joule per satu mol reaktan yang bereaksi sempurna dengan oksigen. Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom-atom dan molekul-molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H). Entalpi akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat, misalnya entalpi untuk air dapat ditulis H H2O(l) dan untuk es
ditulis H H2O(s). Entalpi (H) suatu zat ditentukan oleh jumlah
energi dan semua bentuk energi yang dimiliki zat yang jumlahnya tidak dapat diukur. Perubahan kalor atau entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan dengan perubahan entalpi (Δh).
Ada 2 reaksi dalam larutan, yaitu:
a) Eksoterm, yaitu proses melepaskan panas dari sistem ke lingkungan, temperatur dari campuran reaksi akan naik dan energi potensial dari zat- zat kimia yang bersangkutan akan turun.
b) Endoterm, yaitu menyerap panas dari lingkungan ke sistem, temperatur dari campuran reaksi akan turun dan energi potensial dari zat- zat kimia yang bersangkutan akan naik.
Pada reaksi penguraian air : H2O(l) H2(g) + 0,5O2(g) = +286
kj/mol adalah reaksi endoterm yang menghasilkan energi entalpi yang bernilai positif (+). Energi entalpi yang dihasilkan adalah: = + 286 kj/mol
Sedangkan energi ikatan yang dibutuhkan adalah melalui penurunan persamaan gas ideal pada kondisi STP :