Pengaruh Inokulasi Glomus mosseae terhadap Pertumbuhan dan Aktivitas
Antioksidan pada Artemisia cina Berg ex Poljakov
(Effect of Glomus mosseae Inoculation on the Growth and Antioxidant Activity of
Artemisia cina Berg ex Poljakov)
Anissa Diti Kurniasari1, Sri Kasmiyati2, &Desti Christian Cahyaningrum3 Program Studi Biologi, Fakultas Biologi, Universitas Kristen Satya Wacana
E-mail: anissaditi24@gmail.com; kas@uksw.edu Memasukkan: Juli 2021, Diterima: September 2021
ABSTRACT
Artemisia cina is a wild herbaceous plant that has secondary metabolites as a source of antioxidants. The
addition of mycorrhizal species Glomus mosseae can increase the antioxidant activity of plants Artemisia cina. This study aims to determine the effect of mycorrhizal Glomus mosseae on the growth and content of antioxidant compounds in Artemisia cina. The study used a completely randomized design (CRD), with four levels of treatment, namely: media without G. mosseae (control), media with G. mosseae 5,10 and 15 g with 5 replications for each treatment. Parameters observed were plant height, number of leaves, 5th leaf length and width, wet and dry weight, root length, percentage of mycorrhizal colonization, chlorophyll content, carotenoids, flavonoids, phenols were also observed. Antioxidant activity was determined by the DPPH method. The results showed that the treatment Glomus mosseae with a dose of 15 g was significantly different from the control on plant growth parameters, number of leaves, root length, wet weight and dry weight of plants, and percentage of mycorrhizal colonization in plants. Treatment of Glomus mosseae 15 g on the test results of antioxidant compounds also showed the highest content of chlorophyll, carotenoids, phenols and flavonoids from the statistical test results found in the 15 g treatment, respectively, namely 6,405 g/ml; 0.766 g/ ml; 70.9 g/ml; and 335 g/ml had a significant difference to the control treatment. While the results of the antioxidant activity test using the DPPH method showed that the control treatment had the highest antioxidant activity with an ICvalue50 of 9,494 g/ml. The results showed that the mycorrhizal species of G. mosseae increased the growth and content of antioxidant compounds inplants A. cina.
Keywords: Growth, antioxidant compounds, Glomus mosseae, Artemisia cina ABSTRAK
Artemisia cina merupakan tanaman herba liar yang memiliki senyawa metabolit sekunder sebagai sumber
antioksidan. Penambahan mikoriza jenis Glomus mosseae dapat meningkatkan aktivitas antioksidan pada tanaman Artemisia cina. Penelitian ini bertujuan untuk mengetahui pengaruh mikoriza Glomus mosseae terhadap pertumbuhan dan kandungan senyawa antioksidan pada tanaman Artemisia cina. Penelitian menggunakan rancangan acak lengkap (RAL), dengan empat taraf perlakuan, yaitu: media tanpa G. mosseae (kontrol), media dengan G. mosseae 5,10 dan 15 gr dengan 5 ulangan untuk setiap perlakuan. Parameter pengamatan adalah tinggi tanaman, jumlah daun, panjang dan lebar daun ke 5, bobot basah dan kering, panjang akar, persentase kolonisasi mikoriza, Kandungan klorofil, karotenoid, flavonoid, fenol juga diamati Aktivitas antioksidan ditentukan dengan metode DPPH. Hasil penelitian menunjukkan bahwa perlakuan Glomus mosseae dengan dosis 15 gr berbeda nyata terhadap kontrol pada parameter pertumbuhan tinggi tanaman, jumlah daun, panjang akar, bobot basah dan bobot kering tanaman, dan persentase kolonisasi mikoriza pada tanaman. Perlakuan Glomus mosseae 15 gr pada hasil uji senyawa antioksidan juga menunjukkan kandungan klorofil, karotenoid, fenol dan flavonoid tertinggi dari hasil uji statistik terdapat pada perlakuan 15 gr secara berturut-turut yaitu 6.405 µg/ml; 0.766 µg/ml; 70.9 µg/ml; dan 335 µg/ml memiliki beda nyata terhadap perlakuan kontrol. Sedangkan hasil uji aktivitas antioksidan dengan metode DPPH menunjukkan bahwa perlakuan kontrol memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 9.494 µg/ml. Hasil penelitian menunjukkan bahwa mikoriza jenis G. mosseae meningkatkan pertumbuhan dan kandungan senyawa antioksidan pada tanaman A. cina.
Kata Kunci: Pertumbuhan, Senyawa antioksidan, Glomus mosseae, Artemisia cina PENDAHULUAN
Survei Organisasi Kesehatan Dunia (WHO) melaporkan bahwa 80% populasi dunia bergantung pada obat-obatan non-konvensional, terutama
tumbuhan herbal untuk perawatan kesehatan primer (Neldawati 2013). Banyak kekayaan hayati Indonesia yang mempunyai potensi sebagai bahan obat dan mengandung bahan baku anti osidan sebagai contoh seperti pada kelompok
famili tumbuhan Rubiaceae (Marusin dkk 2013), tumbuhan Sonchus oleraceus (Sucahyo & Kasmiyati
2018), dan tumbuhan Artemisia spp (Rahman et al. 2017). Untuk tanaman spesies Artemisia cina memiliki potensi signifikansi ekonomi yang tinggi karena dapat digunakan sebagai obat-obatan, dan jenis dari genus ini telah dan sering digunakan dalam pengobatan tradisional untuk berbagai penyakit seperti infeksi oleh jamur, bakteri dan virus (Sakipova et al. 2020). Tanaman Artemisia merupakan salah satu tanaman obat yang tumbuh liar di daerah tropis dan sub tropis dengan sebaran yang luas. Genus Artemisia pada penelitian sebelumnya menunjukkan bahwa aktivitas anti-oksidan antara spesies Artemisia berbeda-beda. Carvalho et al. (2011) menyampaikan bahwa Artemisia annua L, dan A. stelleriana Besser memiliki kandungan antioksidan, fenol dan flavonoid 50% lebih rendah dari A. arborescens, A. ludoviciana, A. oelandica, A. princeps. Perbedaan kandungan senyawa antioksidan secara keseluruhan dikarenakan ada interaksi yang berbeda antara komponen antioksidan yang berbeda.
Artemecia spp. merupakan tanaman gulma di dataran tinggi Indonesia (Rahman et al. 2017, Kristiani dkk. 2019), sekaligus sebagai tanaman herba asli Asia. Di pulau Jawa Artemecia spp. dikenal sebagai tanaman obat dan hias (Rahman et al. 2017; Ermayanti dkk. 2019). Pada penelitian ini digunakan tanaman A. cina, yang merupakan salah satu spesies yang diduga memiliki aktivitas antioksidan karena dapat digunakan sebagai obat antimalaria (Darlina dkk. al. 2016), rematik, gangguan pencernaan, antikanker dan anti-leukemia (Ermayanti dkk. 2019). Kandungan antioksidan terdapat pada komponen alam yang menghasilkan metabolit sekunder yaitu fenol dan flavonoid yang terdapat pada tanaman A. cina disebabkan oleh kemampuannya untuk mereduksi muatan elektron dan mendonor hidrogen (Murningsih dkk. 2019). Flavonoid bertindak sebagai agen pengikat untuk oksidan, yaitu anion superoksida. Selain interaksi yang sangat baik dari fenol dengan aktivitas antioksidan dari banyak spesies tanaman, mereka dapat mengikat gugus hidroksil dan bertindak sebagai donor hidrogen yang efektif dan antioksidan yang sangat baik (Temraz & Tantawy 2008). Daun A. vulgaris memiliki kandungan flavonoid dan total fenol lebih
tinggi dibandingkan dengan A. dracunculus. Hal tersebut dipengaruhi oleh kondisi tanaman yang terhindar dari penyakit, pertumbuhan serta perkembangan dan nurisi tersedia. Untuk meningkatkan kesuburan tanaman, dapat digunakan fungi mikoriza arbuskular (FMA), jamur mikoriza bermanfaat untuk meningkatkan nutrisi fosfor (P) tanaman inang (Herawati dkk. 2015). Tanaman yang diberi perlakuan mikoriza mempunyai kandungan fosfat lebih tinggi karena konsentrasi fosfor yang lebih tinggi dalam jaringan tanaman dan akar tanaman (Blanke et al. 2005). Aplikasi FMA dapat meningkatkan sekitar 25%-50% produktivitas tanaman. Tanaman ini men-cangkup kualitas hasil dari kesehatan tanaman, toleransi terhadap cekaman air, serta dapat menekan perkembangan mikroba yang bersifat patogen yang ada dalam tanah (Ansiga et al. 2017). Simbiosis tanaman obat dan FMA mampu mendorong untuk pertumbuhan serta perkembangan, meningkatkan produksi senyawa sekunder yang menambah biomassa tanaman (Dos Santos et al. 2017). Pada penelitian Sbrana et al. (2010) akumulasi senyawa antioksidan meningkatkan 63-90% lebih tinggi yang diinokulasi dengan spesies G. fasciculatum dan G. mosseae dibandingkan dengan perlakuan kontrol pada tumbuhan kemangi (Ocium basilicum L). Begitu juga yang diteliti oleh Lu et al. (2015) bahwa Efek positif FMA pada tanaman dapat meningkatkan hasil ubi, kualitas dan kuantitas metabolit sekunder, sehingga dapat dijadikan sebagai makanan kesehatan. Selain itu, FMA bermanfaat untuk mengurangi kerusakan yang disebabkan oleh logam berat pada tanaman obat dan memperbaiki unsur hara yang ada di dalam tanah (Yang et al. 2016).
Penelitian ini bertujuan untuk mengetahui pengaruh mikoriza Glomus mosseae terhadap pertumbuhan dan kandungan senyawa antioksidan pada tanaman A. cina.
BAHAN DAN CARA KERJA
Penelitian dilakukan pada bulan Januari – April 2021 di Laboratorium Biologi Kimia, Laboratorium Mikrobiologi, Fakultas Biologi, dan rumah kaca Fakultas Sains dan Matematika. Universitas Kristen Satya Wacana, Salatiga dan Salaran, Kopeng, Jawa Tengah.
Percobaan menggunakan Rancangan Acak Lengkap dengan 4 taraf dan 5 ulangan. Taraf perlakuan dibedakan atas aplikasi FMA jenis G. mosseae koleksi Laboratorium Mikrobiologi, Fakultas Biologi, UKSW, yang digunakan yaitu: 0 (kontrol); 5; 10; dan 15 gr. Media tanam yang digunakan berupa sekam padi dengan campuran kotoran ayam dan tanah (1:2:2). Ukuran polybag 30x40 cm, masing-masing diisi 2,5 kg media tanam.
Artemisia cina diperoleh dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat Tradisional (B2P2TOOT) dari daerah Salaran, Kopeng, Jawa Tengah. Tanaman indukan dipotong pada bagian pucuk sepanjang 7 cm yang dijadikan sumber stek, setelah stek bibit yang berumur dua minggu diberi perlakuan G. mosseae. yaitu: 0 (kontrol); 5; 10; dan 15 gr. G. mosseae dibenamkan di dalam polybag sesuai taraf perlakuan, kemudian satu stek A. cina berumur dua minggu ditanam ke dalam semua polybag perlakuan. Setelah itu tanaman disiram dengan 100 ml air setiap polybag (Mandal et al. 2015). Polybag perlakuan kemudian disimpan di rumah kaca. Selama enam minggu penanaman dilakukan pengendalian hama menggunakan pestisida dan ditambah air (1:1000), penyiraman dilakukan selama seminggu sekali atau tergantung keberadaan hama. Parameter tinggi tanaman, jumlah daun, lebar dan panjang daun ke lima dari pucuk diukur enam minggu setelah tanam. Setelah enam minggu tanaman dicabut kemudian ditimbang untuk memperoleh bobot basah. Bobot kering diperoleh dengan mengeringkan tanaman dalam oven suhu suhu 100ºC selama lima hari.
Penentuan kandungan klorofil dan karotenoid dilakukan menggunakan spektrofotometer. Sebanyak 0.01 gr daun dicacah lalu ditambahkan 5 ml Dimetil sulfoksida (DMSO) kemudian diikubasi di dalam ruang gelap pada suhu kamar selama 48 jam. Analisis dilakukan dengan Spektrofotometri UV-Vis menurut metode Sumanta et al. (2014) yang modifikasi dengan pengukuran absorbansi pada λ 649 nm, 665 nm, dan 480 nm. Perhitungan kadar Klorofil dan Karotenoid menggunakan rumus sebagai berikut:
Klorofil A: (12,19 Abs665 – 3,45 Abs649) Klorofil B : (21,99 Abs649 – 5,32 Abs665) Klorofil total : Klorofil a + Klorofil b Karotenoid :
(1000A480 -2.41Klorofil A-70,16Klorofil B)/220
Sebelum analisis flavonoid dan fenol dilakukan ekstraksi daun. Satu gram sampel daun segar dari setiap perlakuan dihaluskan menggunakan mortar lalu dimasersi menggunakan pelarut 20 ml etanol 96% dan diinkubasi selama 24 jam dalam ruang gelap.
Untuk penentuan kandungan flavonoid, diambil 0,2 ml hasil ekstrak sampel daun A. cina, ditambah 0,8 ml akuades ke dalam tabung eppendorf 2 ml lalu dikocok, kemudian ditambahkan 0,06 ml natrium nitrat 0,5%, diinkubasi selama 5 menit, ditambah 0,06 ml AlCl 10%, kembali diinkubasi selama 5 menit. Selanjutnya ditambahkan 0,4 ml NAOH 1 M kedalam larutan kemudian divortex dan ditambah 0.48 ml akuades lalu diinkubasi selama 15 menit. Larutan sampel kemudian diukur dengan spektrofotometri Uv-Vis pada panjang gelombang 511 nm (John et al. 2014). Kadar flavonoid yang telah didapatkan ditetapkan sebagai ekuivalen mg kuersetin per gr sampel. Total flavonoid dihitung mengunakan rumus sebagai berikut:
Keterangan :
QE = kuersetin equivalen
C = konsentrasi total flavonoid (mg/l) V = volume ekstrak (l)
m = berat ekstrak (g)
Kandungan fenol total ditentukan menggunakan metode Follin-Ciocalteau. Diawali dengan mengambil 0,08 ml ekstrak, ditambah dengan 0,72 ml akuades, 0,08 ml reagen Follin-Ciocalteau, lalu divortex dan diinkubasi selama 5 menit. Selanjutnya ditambah 0,8 ml Na2CO3 10% dan divortex, lalu ditambah dengan akuades hingga volume 0,32 ml, kemudian diinkubasi selama 90 menit pada suhu kamar. Absorbansi sampel dibaca pada panjang gelombang 550 nm (Bangol et al. 2014). Kandungan fenol total dari ekstrak dihitung dengan menggunakan kurva standar asam galat 25, 50, 75, 100, 125, dan 150 ppm, dan perhitungan total fenol dihitung mengunakan rumus:
Keterangan :
GAE= kuersetin equivalen C = konsentrasi total fenol (mg/l) V = volume ekstrak (l)
m = berat ekstrak (g)
Kolonisasi mikoriza pada akar dengan cara sebagai berikut: sebanyak 10 potongan akar
sepanjang 1 cm, direndam pada KOH 10% selama 5 hari hingga akar berwarna bening. Kemudian akar dicelupkan secara cepat kedalam 10% HCl, lalu dibilas dengan akuades. Selanjutnya akar direndam dalam 0,05% trypan blue selama 30 menit dibilas dengan akuades yang dimodifikasi dengan dicelupkan ke dalam 50% gliserol (Retno dkk. 2014). Akar diletakkan pada gelas objek, ditekan menggunakan gelas penutup, lalu diamati pada mikroskop cahaya (Olympus CX22) dengan perbesaran 100 kali. Persentase akar terinfeksi adalah jumlah akar terinfeksi dibagi dengan jumlah akar yang diamati dikalikan 100%.
Pengujian aktivitas antioksidan ditentukan menggunakan metode 1,1-diphenyl-2-picrylhdradzyl (DPPH). Sampel yang digunakan adalah stok ekstrak dengan konsentrasi 50.000 ppm. Kemudian dibuat deret standar konsentrasi 5000, 7500, 10.000, 12.500, 17.500, dan 20.000 ppm lalu ditambah metanol sampai mencapai volume 500 μL (0,5 ml). Sebanyak 0,5 ml sampel diambil lalu diletakkan di tabung eppendorf, ditambah 1,5 ml DPPH 0,1 mM, di vortex kemudian diinkubasi selama 30 menit di dalam ruang gelap. Setelah itu dilakukan pengukuran dengan menggunakan spektrofotometeri pada panjang gelombang 517 nm (Dif et al. 2018) dengan blanko 0,1 mM DPPH.
Aktivitas antioksidan ditentukan oleh besarnya hambatan serapan radikal DPPH melalui persentase inhibisi serapan DPPH yang dihitung menggunakan persamaan sebagai berikut:
Nilai IC50 (inhibition concentration 50%) diperoleh dengan menghitung konsentrasi larutan
uji yang dapat menghasilkan hambatan radikal bebas (% inhibisi) menggunakan rumus :
Keterangan :
y = 50
x = konsentrasi larutan uji (k)
Analisis data dilakukan menggunakan SPSS 2.6 yaitu One Way Anova, Uji tukey dan Uji korelasi (Pearson correlation).
HASIL Pertumbuhan
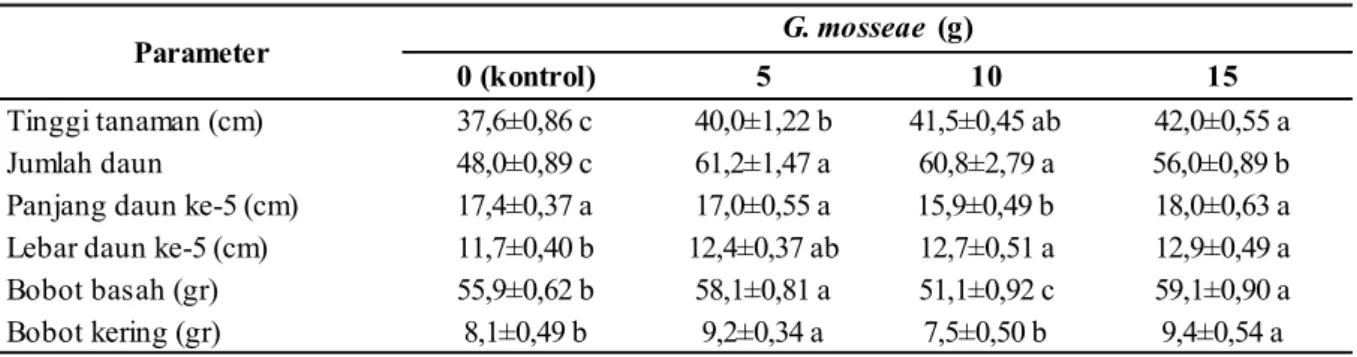
Tabel 1 menunjukkan bahwa parameter tinggi A. cina pada umur 6 minggu dengan pemberian mikoriza G. mosseae 15 gr memiliki paling tinggi berbeda nyata dengan tanaman kontrol dan dengan pemberian 5 gr G. mosseae, namun tidak berbeda nyata dengan pemberian 10 gr G. mosseae. Tanaman terendah didapatkan pada perlakuan kontrol.
Parameter jumlah daun A. cina dengan pem-berian mikoriza G. mosseae 5 gr memiliki paling tinggi berbeda nyata dengan tanaman kontrol dan dengan pemberian 15 gr G. mosseae, namun tidak berbeda nyata dengan pemberian 10 gr G. mosseae. Tanaman terendah didapatkan pada perlakuan kontrol.
Parameter panjang daun ke-5 dengan pem-berian mikoriza G. mosseae 15 gr memiliki paling tinggi berbeda nyata dengan tanaman pemberian 10 gr G. mosseae, namun tidak berbeda nyata dengan kontrol dan dengan pemberian 5 gr G. mosseae. Tanaman terendah didapatkan pada tanaman pemberian 10 gr G. mosseae. Sedangkan pada lebar daun ke-5 dengan pemberian G. mosseae 15 gr memiliki lebar daun paling tinggi
0 (kontrol) 5 10 15
Tinggi tanaman (cm) 37,6±0,86 c 40,0±1,22 b 41,5±0,45 ab 42,0±0,55 a
Jumlah daun 48,0±0,89 c 61,2±1,47 a 60,8±2,79 a 56,0±0,89 b
Panjang daun ke-5 (cm) 17,4±0,37 a 17,0±0,55 a 15,9±0,49 b 18,0±0,63 a Lebar daun ke-5 (cm) 11,7±0,40 b 12,4±0,37 ab 12,7±0,51 a 12,9±0,49 a
Bobot basah (gr) 55,9±0,62 b 58,1±0,81 a 51,1±0,92 c 59,1±0,90 a
Bobot kering (gr) 8,1±0,49 b 9,2±0,34 a 7,5±0,50 b 9,4±0,54 a
Parameter G. mosseae (g)
Keterangan : angka yang diikuti dengan huruf yang sama pada baris yang sama tidak berbeda nyata berdasarkan uji Beda
Nyata Terkecil (BNT) pada taraf α = 0,05
berbeda nyata dengan perlakuan kontrol, namun tidak berbeda nyata dengan pemberian 5 dan 10 gr G. mosseae.
Parameter bobot basah dan bobot kering A. cina dengan pemberian 15 gr G. mosseae di-dapatkan hasil sama yang memiliki berat paling tinggi berbeda nyata dengan tanaman kontrol dan dengan pemberian 10 gr G. mosseae, namun tidak berbeda nyata dengan pemberian 5 gr G. mosseae. Bobot tanaman terendah dengan pemberian 10 gr G. mosseae.
Dari hasil pertumbuhan pada tanaman yang diberikan perlakuan G. mosseae 15 gr memiliki pengaruh pertumbuhan yang lebih baik di-bandingkan dengan tanaman kontrol kecuali pada parameter jumlah daun, hal ini ditunjukkan pada jumlah tinggi tanaman, panjang dan lebar daun ke-5, serta parameter bobot basah dan kering setelah masa tanaman 6 minggu memiliki hasil yang lebih baik dikarenakan mikroriza G. mosseae dapat membentuk spora pada jaringan hifa sehingga membantu penyerapan unsur hara dan air yang lebih pada tanaman.
Panjang dan kolonisasi akar
Tabel 2 menunjukkan bahwa pada panjang dan kolonisasi akar A. cina pada umur 6 minggu dengan pemberian mikoriza G. mosseae 15 gr memiliki paling tinggi berbeda nyata dengan tanaman kontrol maupun dengan pemberian 5 dan 10 gr G. mosseae. Panjang dan persentase kolonisasi akar terendah pada perlakuan kontrol. Pada kolonisasi mikoriza dalam akar dapat dilihat pada Gambar 1 nampak pengaruh nyata terhadap pembentukan koloni G. mosseae di dalam jaringan akar. Koloni yang terbentuk membentuk grafik yang terus meningkat seiring
dengan peningkatan dosis mikoriza yang di-berikan. Artinya semakin tinggi dosis mikoriza, maka semakin tinggi jumlah infeksi yang terjadi oleh mikoriza di bagian akar. Pada perlakuan kontrol tidak menunjukkan terjadinya infeksi dan infeksi mulai terjadi pada semua pemberian 5, 10 dan 15 gr G. mosseae.
Kandungan Klorofil, Karotenoid, Flavonoid, Fenol dan Aktivitas Antioksidan
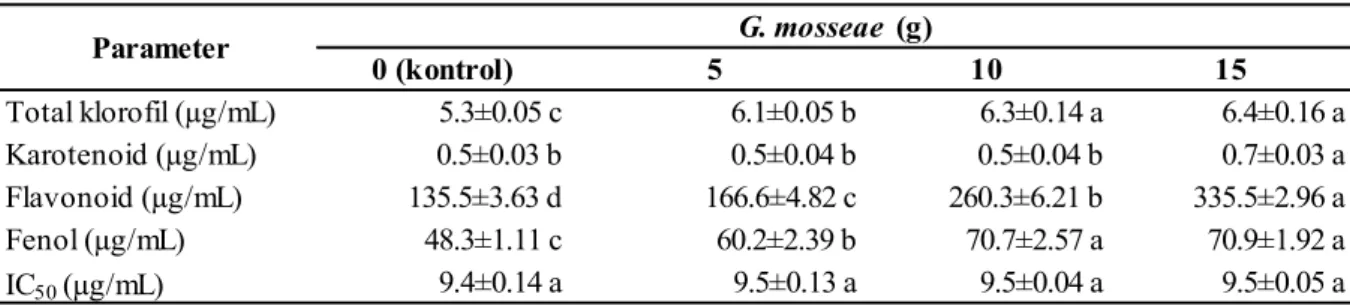
Pada Tabel 3 menunjukkan bahwa analisis uji kandungan klorofil dengan pemberian
(0 g) (5 g) (10 g) (15 g)
Gambar 1. Kolonisasi akar dengan G. mosseae
dengan pewarna trypan blue. Pada perbesaran 100x. Tanda panah merupakan kolonisasi G.
mosseae pada akar A. cina
0 (kontrol) 5 10 15 Panjang akar (cm) 34,6±0,58 d 38,2±1,17 c 40,8±0,68 b 44,0±0,67 a Kolonisasi mikoriza (%) 0,0±0,00 d 36,0±4,90 c 56,0±4,90 b 94,0±8,00 a Parameter G. mosseae (g)
Tabel 2. Rata-rata pengaruh jenis perlakuan G. mosseae terhadap panjang dan kolonisasi
akar minggu keenam tanaman A. cina.
Keterangan : angka yang diikuti dengan huruf yang sama
pada baris yang sama tidak berbeda nyata ber-dasarkan uji Beda Nyata Terkecil (BNT) pada taraf α = 0,05 0 (kontrol) 5 10 15 Total klorofil (µg/mL) 5.3±0.05 c 6.1±0.05 b 6.3±0.14 a 6.4±0.16 a Karotenoid (µg/mL) 0.5±0.03 b 0.5±0.04 b 0.5±0.04 b 0.7±0.03 a Flavonoid (µg/mL) 135.5±3.63 d 166.6±4.82 c 260.3±6.21 b 335.5±2.96 a Fenol (µg/mL) 48.3±1.11 c 60.2±2.39 b 70.7±2.57 a 70.9±1.92 a IC50 (µg/mL) 9.4±0.14 a 9.5±0.13 a 9.5±0.04 a 9.5±0.05 a Parameter G. mosseae (g)
Keterangan : angka yang diikuti dengan huruf yang sama pada baris yang sama tidak berbeda nyata berdasarkan uji Beda
Nyata Terkecil (BNT) pada taraf α = 0,05
Tabel 3. Rata-rata pengaruh jenis perlakuan G. mosseae terhadap kandungan klorofil, karotenoid, flavonoid,
mikoriza G. mosseae 15 gr memiliki kandungan tertinggi berbeda nyata dengan tanaman kontrol dan dengan pemberian 5 gr G. mosseae, namun tidak berbeda nyata dengan pemberian 10 gr G. mosseae. Kandungan terendah didapatkan pada perlakuan kontrol.
Pada analisis uji kandungan karotenoid dengan pemberian mikoriza G. mosseae 15 gr memiliki kandungan tertinggi berbeda nyata dengan tanaman perlakuan kontrol, dengan pemberian 5 dan 10 gr G. mosseae, namun pada perlakuan kontrol, dengan pemberian 5 dan 10 gr G. mosseae tidak berbeda nyata. Kandungan terendah didapatkan pada perlakuan kontrol.
Analisis uji kandungan flavonoid dengan pemberian mikoriza G. mosseae 15 gr memiliki kandungan tertinggi berbeda nyata dengan perlakuan tanaman kontrol maupun dengan pemberian 5 dan 10 gr G. mosseae. Kandungan terendah didapatkan pada perlakuan kontrol.
Analisi uji kandungan fenol dengan pemberian mikoriza G. mosseae dosis 15 gr memiliki kandungan tertinggi berbeda nyata dengan perlakuan kontrol dan dengan pemberian 5 gr G. mosseae, namun tidak berbeda nyata dengan pemberian 10 gr G. mosseae. Kandungan terendah didapatkan pada perlakuan kontrol.
Analisis uji aktivitas antioksidan dengan pemberian mikoriza G. mosseae 5 gr memiliki aktivitas tertinggi namun tidak berbeda nyata dengan perlakuan kontrol, maupun dengan pemberian 5 dan 10 gr G. mosseae. Aktivitas antioksidan terendah didapatkan pada perlakuan kontrol.
PEMBAHASAN
Pertumbuhan
Hasil pertumbuhan menunjukkan bahwa pada parameter tinggi, jumlah daun, lebar daun ke-5, serta bobot basah dan kering yang diberi 15 gr G. mosseae berbeda nyata dengan perlakuan kontrol namun pada panjang daun ke-5 yang diberi 1ke-5 gr G. mosseae tidak berbeda nyata dengan perlakuan kontrol. Hampir seluruh tanaman dengan pemberian G. mosseae meningkat-kan pertumbuhan yang signifimeningkat-kan pada tanaman A. cina. Pemberian G. mosseae dosis 15 gr diduga mempengaruhi peningkatan unsur hara baik sehingga didapatkan pertumbuhan yang lebih baik dibandingkan perlakuan yang lain dan kontrol. Hal
ini selaras dengan penelitian sebelumnya ketika dilakukan inokulasi G. mosseae dan G. intraradices sebanyak 18 spora g-1 secara tunggal pada tanaman daun bawang (Allium porrum) akan meningkatkan serapan total P yang lebih besar setalah 6 minggu setelah tanam (Jansa et al. 2008) demikian hal ini juga kemungkinan terjadi pada A. cina karena pemberian 15 gr G. mosseae secara tunggal dapat meningkatkan pertumbuhan. Mikoriza dapat memperluas penyerapan hara dengan miselium eksternal sehingga pertumbuhan pada tanaman meningkat (Wicaksono dkk. 2014). Tanaman yang diinokulasi mikoriza ini efektif dapat meningkatkan penyerapan unsur hara makro pada tanaman ketapang sehingga membentuk hifa internal dan ekternal yang menyerap fosfor dari dalam tanah (Wulandari 2017). Begitu juga pada penelitian Prasasti et al. (2013), bahwa tanaman kacang tanah yang diinfeksi dengan mikoriza G. fasciculatum menghasilkan jaringan hifa ekternal yang meningkatkan 44% dibandingkan dengan perlakuan kontrol, sehingga meningkatkan kapasitas akar menyerap fosfat, unsur hara dan air. Pemberian G. mosseae 15 gr menghasilkan bobot tanaman paling tinggi dibandingkan dosis lainya. Bobot basah lebih rendah pada dosis 10 gr pada 6 minggu pengamatan dikarenakan adanya ulat yang memakan daun sehingga mempengaruhi hasil rata-rata pada bobot basah. Akan tetapi secara umum peningkatan pemberian mikoriza dosis 30 dan 40 gr dapat meningkatkan bobot kering tanaman yang diduga karena mikoriza membantu penyerapan unsur hara dan membaiknya serapan unsur hara terutama fosfor itu dari media tanam sehingga mempengaruhi bobot tanaman kedelai (Zuhry & Puspita 2008). Panjang dan kolonisasi akar
Pada pertumbuhan akar, pemberian G. mosseae dengan dosis 15 gr memiliki akar yang lebih panjang dari perlakuan kontrol, 5 dan 10 gr G. mosseae. Dengan demikian G. mosseae yang diinokulasi tidak hanya mempengaruhi pertumbuhan tanaman kearah tajuk tetapi juga pertumbuhan pada bagian bawah tanah (akar). Lu et al (2015) menyampaikan bahwa tanaman murbei yang diinokulasikan G. mosseae dan G. fasciculatum masing-masing 300 spora dapat meningkatkan panjang akar 63,3 – 90 %. Pada tanaman A. cina yang ditambahkan dengan 5, 10 dan 15 gr G.
mosseae menigkatkan 8,8 – 30 %. Selain itu FMA merangsang pertumbuhan tanaman semai melalui beberapa mekanisme yang mencakup peningkatan hara sehingga merangsang stimulasi pertumbuhan akar (Artursson 2006).
Pada persentase kolonisasi akar oleh mikoriza G. mossseae memiliki nilai yang berbeda terkait dengan dosis yang diberikan. Pemberian G. mosseae dosis 5, 10 dab15 gr memiliki tingkat kolonisasi 36 – 94 %, karena hifa internal yang berkembang membentuk hifa ekternal yang menyebabkan serapan unsur tanaman (Suharno & Sancayaningsih 2013), menjadi meningkat lebih baik dibandingkan dosis yang lebih rendah. Begitupun pada penelitian Hadianur dkk. (2016) pemberian mikoriza mampu meningkatkan persentase infeksi akar 45%. Sementara keberhasilan simbiosis FMA dengan akar dipengaruhi banyak faktor antara lain pH, efektifitas FMA mengkolonisasi, sumber P dan tanaman inang (Suryati 2017).
Kandungan Klorofil, Karotenoid, Flavonoid, Fenol dan Aktivitas Antioksidan
Kandungan total klorofil dan karotenoid pada perlakuan G. mosseae dosis 15 gr adalah paling tinggi dibandingkan dengan perlakuan kontrol, begitupun pada penelitian yang dilakukan Amiri et al. (2017) bahwa tanaman Geranium yang diinokulasi dengan F. mosseae mengalami peningkatan total klorofil dan karotenoid dibandingkan dengan tanaman kontrol, hal ini karena tumbuhan yang diinokulasi dengan mikoriza dapat mempercepat penyerapan intensitas cahaya yang tersedia sehingga meningkatkan kapasitas fotosintesis pada daun. Shi et al. (2020) juga telah melakukan penelitian bahwa selain meningkatkan pertumbuhan dan biomassa dengan pemberian G. mosseae, juga dapat meningkatkan kandungan klorofil daun X. italicum untuk menyerap energyi cahaya dan memiliki kapasitas fotosintesis yang lebih tinggi. Dengan demikian, diduga meningkatnya kandungan klorofil dan karotenoid yang dalam tanaman A.cina dipengaruhi oleh pemberian G. mosseae.
Flavonoid yang terkandung dalam tanaman menjadi lebih tinggi pada perlakuan inokulasi G. mosseae 15 gr dibandingkan dengan perlakuan kontrol, 5 dan 10 gr G. mosseae. Sistem kerja
flavonoid melalui penyekatan enzim yang dipengaruhi oleh jumlah total gugus hidroksil, konfigurasi dan substitusi yang akan menahan terbentuknya reactive oxygen species (ROS), dan mengikat ROS dan pertahanan serta meningkatkan regulasi proteksi antioksidan pada tanaman Cinnamomum tamala yang diberi jamur A. fumigatus (Pandey et al. 2012). Pada kebanyakan tanaman flavonoid merupakan salah satu metabolit sekunder yang berfungsi sebagai molekul pemberi sinyal antara tumbuhan dan mikroorganisme yang ada di tanah seperti pada tanaman kedelai dengan bradyrhizobium 0,25 g dapat mencegah pem-bentukan radikal bebas melalui pemutusan reaksi berantai dan mengubahnya menjadi produk lebih stabil (Antunes et al. 2006) sehingga menyediakan gugus fungsi hidroksil yang akan menyumbang aktivitas antioksidan terhadap tanaman (Munda et al. 2019). Selain itu tanaman tomat yang diinokulasi dengan G. mosseae maupun G. intraradices pada kandungan flavonoid meningkat 2-8 mM dari perlakuan kontrol dan juga akan memfasilitasi perluasan spora dari hifa yang ada diakar akan mengakumulasi isoflavon pada tumbuhan yang terkait dengan pertumbuhan FMA (Scervino et al. 2005) sehingga pemberian mikoriza G. mosseae memiki pengaruh baik terhadap kandungan flavonoid yang ada pada tanaman A.cina.
Fenol paling tinggi terkandung pada tanaman A.cina dengan perlakuan G. mosseae 15 gr dibandingkan dengan perlakuan kontrol, 5 dan 10 gr G. mosseae, hal serupa juga terjadi pada Amiri et al. (2017) bahwa tanaman geranium yang tidak diinokulasi dengan G. mosseae me-miliki kandungan fenolik total terendah. Dengan demikian menurut Mumivand et al. (2017) kandungan total fenol sangat bekorelasi dengan flavonoid karena termasuk senyawa polifenol yang terdapat pada tanaman A. dracunculus yang merupakan salah satu kelas utama yang digunakan sebagai antioksidan primer. Dengan demikian, bahwa G. mosseae dapat meningkatkan kandungan fenol yang semakin tinggi dan serta pengaruh pelarut etanol yang digunakan untuk maserasi. Menurut penelitian yang dilakukan Bangol et al. (2014) menyatakan bahwa pengaruh ekstrak etanol juga mempengruhi tingginya kandungan total fenol karena sebagian besar
senyawa fenol memiliki sifat polar larut dalam pelarut yang polar.
Pengujian aktivitas antoksidan paling tinggi pada analisis IC50 tanaman A. cina dengan perlakuan 5 gr G. mosseae dan terendah pada kontrol. Dilihat pada Tabel 3 bahwa dari uji statistik tidak ada perbedaan signifikan antara perlakuan kontrol dengan perlakuan 5, 10 dan 15 gr G. mosseae. Nilai IC50 pada aktivitas antioksidan menunjukkan bahwa semakin rendah nilai IC50 maka semakin tinggi aktivitas anti-oksidannya. Hal ini, karena dengan nilai konsentrasi yang didapat semakin rendah dapat menghambat 50% radikal bebas yang ada. Nilai rata-rata IC50 terendah diperoleh pada kontrol, sedangkan tertinggi pada perlakuan G. mosseae dosis 5 gr.
Oleh karna itu, perlakuan G. mosseae pada parameter kandungan klorofil, fenol dan flavonoid memiliki nilai yang tinggi tetapi rendah pada aktivitas antioksidan dibandingkan kontrol. Hal ini berbeda pada penelitian Thokchom et al. (2020) bahwa pada tanaman Ocimum tenuiflorum bahwa dengan kolonisasi FMA meningkatkan kapasitas antioksidan terhadap DPPH hingga 6.67% lebih tinggi dibandingkan dengan perlakuan kontrol. Pada perlakuan A. cina yang diinokulasikan dengan 5, 10, dan 15 gr G. mosseae memiliki aktivitas antioksidan yang rendah dibandingkan dengan kontrol, hal ini mungkin perlakuan G. mosseae belum mampu meningkatkan aktivitas antioksidan pada tanaman A. cina. Pada Artemisia ini juga menghasilkan metabolit artemisin yang sangat potensial sebagai anti malaria dan senyawa terpenoid, flavonoid, kumarin, asam caffeoylquinic dan sterol merupa-kan senyawa utama (Kilam et al. 2017). Oleh karena itu diduga, rendahnya aktivitas antioksidan pada tanaman A. cina perlakuan disebakan FMA tidak mengakumulasi peningkatan senyawa artemisin tersebut. Beberapa faktor yang mempengaruhi yaitu ada sebagian jenis spesies FMA dapat menyebabkan perubahan yang berbeda dalam menghasilkan produksi metabolit sekunder pada tanaman yang sama atau bahkan genotipnya yang sama sekalipun (Copetta et al. 2006). Begitu juga menurut Zubek et al. (2015) bahwa pengaruh FMA pada metabolit sekunder tanaman tidak terkait dengan nutrisi inang. Ekspresi gen yang berubah pada tanaman Lotus japonicus akibat dari kolonisasi FMA jenis Gigaspora sp dan Acaulospora longula
mem-pengaruhi metabolisme mereka dan dapat menyebabkan induksi pertahanan kimiawi (Cameron et al. 2013).
KESIMPULAN
Tanaman Artemisia cina yang diinokulasikan dengan G. mosseae dapat meningkatkan pertumbuhan dan persentase kolonisasi mikoriza terhadap akar tanaman secara signifikan dibandingkan dengan perlakuan kontrol, hal ini ditunjukkan oleh hasil biomassa tanaman dan tingkat kolonisasi G. mosseae pada akar yang meningkat. Pada pengujian metabolit sekunder pada kandungan klorofil, karotenoid, fenol dan flavonoid bahwa juga memiliki peningkatan, faktor yang memepengaruhi peningkatan kandungan senyawa ini karena G. mosseae membantu menyerap unsur hara lebih banyak dibandingkan dengan kontrol. Sedangkan uji aktivitas antioksidan pada IC50 bahwa perlakuan kontrol memiliki aktivitas antioksidan lebih tinggi dibandingkan dengan perlakuan G. mosseae dosis 5, 10, dan 15 gr. Maka dari itu perlu penelitian lebih lanjut mengenai kandungan senyawa utama pada A. cina yaitu artemisin.
UCAPAN TERIMA KASIH
Ucapan terimakasih disampaikan kepada Dr. Sri Kasmiyati, S.Si, M.Si dan Desti Christian Cahyaningrum S.Si, M.Si selaku dosen pembimbing di Fakultas Biologi, Universitas Kristen Satya Wacana-Salatiga yang telah memberi arahan dan bimbingannya selama penelitian berlangsung, Dr. Maria Marina Herawati, SP., MP fakultas pertanian dan bisnis UKSW yang telah memberi materi penelitian berupa stek serta kepala B2P2TOOT Salaran, Kopeng yang telah berbagi stek serta civitas Fakultas Biologi, Universitas Kristen Satya Wacana (Salatiga) yang telah memberikan kesempatan sehingga penelitian dapat terlaksana.
KONTRIBUSI PENULIS
ADK merupakan penulis utama melakukan penulisan dan analisis data dibantu oleh SK dan DCC sebagai pengarah dan pembimbingan dalam penulisan dan analisis data
DAFTAR PUSTAKA
Amiri, R., A. Nikbakht, M. Rahimmalek, & H. Hosseini. 2017. Variation in the Essential Oil Composition, Antioxidant Capacity, and Physiological Characteristics of Pelargonium Graveolens L. inoculated with Two Species of Mycorrhizal Fungi Under Water Deficit Conditions. Journal of Plant Growth Regulation. 36 (2): 502-515. Ansiga, RE., A. Rumambi, DA. Kaligis, I.
Mansur, & W. Kaunang. 2017. Eksplorasi Fungi Mikoriza Arbuskula (FMA) Pada Rizosfir Hijauan Pakan. ZOOTEC: 37(1), 167-178.
Antunes, P. M., I. Rajcan, & MJ. Goss. 2006. Specific Flavonoids As Interconnecting Signals In The Tripartite Symbiosis Formed By Arbuscular Mycorrhizal Fungi, Bradyrhizobium Japonicum (Kirchner) Jordan And Soybean (Glycine Max (L.) Merr.). Soil Biology and Biochemistry. 38 (3), 533-543.
Artursson, V., RD. Finlay, & JK. Jansson. 2006. Interactions between Arbuscular Mycorrhizal Fungi and Bacteria and Their Potential For Stimulating Plant Growth. Environmental
Microbiology. 8(1): 1-10.
Bangol, E., LI. Momuat, & J. Abidjulu. 2014. Aktivitas Antioksidan Ekstrak Etanol Dan N-Heksana Dari Daun Rumput Santa Maria (Artemisia Vulgaris L.) Pada Minyak Ikan. Jurnal Ilmiah Sains. 14 (2): 129-135. Blanke, V., C. Renker, M. Wagner, K. Füllner, M. Held, AJ. Kuhn, & F. Buscot. 2005. Nitrogen Supply Affects Arbuscular Mycorrhizal Colonization of Artemisia Vulgaris In A Phosphate‐Polluted Field Site. New Phytologist. 166 (3): 981-992. Cameron, DD, AL. Neal, SCM. Van Wees, & J.
Ton. 2013. Mycorrhiza-Induced Resistance: More than the Sum of Its Parts?. Trends
Plant Science. 18:539–545.
Carvalho, IS., T. Cavaco, & M. Brodelius. 2011. Phenolic Composition and Antioxidant Capacity of Six Artemisia Species. Industrial
Crops and Products. 33 (2): 382-388.
Copetta, A., G. Lingua, & G. Berta. 2006. Effects of Three Amfungi on Growth, Distribution Of Glandular Hairs, And Essential Oil
Productionin Ocimum Basilicum L. Var. Genovese. Mycorrhiza. 16:485–494
Darlina, D., & K. Teja. 2016. Aktivitas Antimalaria Ekstrak N-Hexana Daun Artemisia Cina Galur Iradiasi Terhadap Plasmodium Berghei ANKA. Jurnal Ilmu Kefarmasian
Indonesia. 14(2): 226-232.
Dif, MM., FB. Toumi, H. Boukaaza, F. Mokaddem, M. Benyahia, & S. Bouazza. 2018. Phenolic Content and Antioxidant Activity Of
Artemisa Herba-Alba, A Medicinal Plant
From Algerian Arid Zone. Phytothérapie. 16 (2): 91-95.
Dos Santos, EL., FA. Da Silva, & FS. Da Silva. 2017. Arbuscular Mycorrhizal Fungi Increase The Phenolic Compounds Con-centration In The Bark Of The Stem Of Libidibia Ferrea In Field Conditions. The Open Microbiology Journal. 11: 283. Ermayanti, TM., J. Juliarni, & Y. Andry. 2019.
Struktur Anatomi Daun Artemisia cina Berg. Ex Poljakov Hasil Kultur Jaringan. Biota: Jurnal Ilmiah Ilmu-Ilmu Hayati. 9 (3): 144-154.
Hadianur, H., S. Syafruddin, & E. Kesumawati. 2016. Pengaruh Jenis Fungi Mikoriza Arbus-cular Terhadap Pertumbuhan Dan Hasil Tanaman Tomat (Lycopersicum Esculentum Mill). Jurnal Agrista. 20 (3): 126-134.
Herawati, MM., E. Pudjihartati, S. Pramono, E. Sulistyaningsih, & A. Purwantoro. 2015. Obtaining Artemisia cina polyploidy through plant growth regulator treatment in shoot culture. AGRIVITA, Journal of
Agricultural Science. 37 (2): 178-184.
Jansa, J. FA. Smith, & SE. Smith. 2008. Are There Benefits Of Simultaneous Root Colonization By Different Arbuscular Mycorrhizal Fungi? New Phytol. 177: 779–789.
John, BIJU., CT. Sulaiman, S. George, & VRK. Reddy. 2014. Total Phenolics and Flavonoids In Selected Medicinal Plants From Kerala. International Journal of
Pharmacy And Pharmaceutical Sciences. 6
(1): 406-408.
Kilam, D., P. Sharma, A. Agnihotri, A. Kharkwal, & A, Varma, 2017. In: Mycorrhiza-Eco-Physiology, Secondary Metabolites, Nano-materials By Varma A., Prasad R., Tuteja N. (Eds.), Chapter 16:
Microbial Symbiosis And Bioactive Ingredients Of Medicinal Plants, Springer, 293.
Kristiani, EBE., S. Kasmiyati, & MM. Herawati. 2019. The potential of Artemisia cina Berg ex Poljakov as Antioxidant Agent.
The Science and Science Education
International Seminar Proceedings. 27
-28 September 2019. 60-67.
Lu, FC., CY. Lee, & CL. Wang. 2015. The Influence of Arbuscular Mycorrhizal Fungi Inoculation On Yam (Dioscorea Spp.) Tuber Weights and Secondary Metabolite Content. Peerj. 3: 1-19.
Mandal, S., S. Upadhyay, VP. Singh, & R. Kapoor. 2015. Enhanced Production Of Steviol Glycosides In Mycorrhizal Plants: A Concerted Effect Of Arbuscular Mycor-rhizal Symbiosis On Transcription Of Bio-synthetic Genes. Plant Physiology and Biochemical. 89: 100-6.
Marusin, S., Saefudin & Chairul. 2013. Potensi Sifat Antioksidan pada 10 Jenis Ekstrak dari Famili Rubiaceae. Jurnal Biologi Indonesia. 9(1): 93 - 100.
Mumivand, H., M. Babalar, L. Tabrizi, LE. Craker, M. Shokrpour, & J, Hadian. 2017. Antioxidant properties and principal phenolic phytochemicals of Iranian tarragon (Artemisia dracunculus L.) accessions. Horticulture, Environment, and Biotech-nology. 58 (4): 414-422.
Munda, S., SK. Pandey, S. Dutta, J. Baruah, & M. Lal. 2019. Antioxidant Activity, Antibacterial Activity And Chemical Com-position Of Essential Oil Of Artemisia Vulgaris L. Leaves From Northeast India. Journal Of Essential Oil Bearing
Plants. 22 (2): 368-379.
Murningsih, T., P. Praptiwi, L. Liana, & A. Fathoni. 2019. TLC profiling and antioxidant activity of phenolic compound from Sterculia oblongata bark extract. Nusantara Bioscience. 11(1): 44-48.
Neldawati, N. 2013. Analisis nilai absorbansi dalam penentuan kadar flavonoid untuk berbagai jenis daun tanaman obat. Pillar of Physics. 2 (1): 76-83.
Pandey, AK., AK. Mishra, & A. Mishra. 2012. Antifungal And Antioxidative Potential Of Oil
And Extracts Derived From Leaves Of Indian Spice Plant Cinnamomum Tamala. Cellular
and Molecular Biology. 58(1), 142-147.
Prasasti, OH., IP. Kristanti, & N. Sri. 2013. Pengaruh Mikoriza Glomus fasciculatum Terhadap Pertumbuhan Vegetatif Tanaman Kacang Tanah Yang Terinfeksi Sclerotium Rolfsii. Jurnal Sains Dan Seni POMITS. 2 (2): 2337–3520.
Rahman, W., A. E. Hafiizh, TM. Ermayanti. 2017. Acclimation and Agronomic Performance of Polyploids Clones of Artemisia annua L. Jurnal Biologi Indonesia. 13 (1): 34-42. Retno, PS., E. Sutariningsih, & Rina Sri, K. 2014.
Asosiasi Fungi Mikoriza Arbuskula (FMA) dan Tumbuhan Bidens pilosa L.(Asteraceae) Usaha Memperoleh Isolat Dari Habitat Tailing.
Prosiding Seminar Nasional
Biologi Indonesia. Jayapura, 7-8
Oktober 2014. 210-220.
Sakipova, Z., TBS. Giorno, T. Bekezhanova, SH. Wong, A. Shukirbekova, PD. Fernandes, & F. Boylan. 2020. Pharmacological Evaluation of Artemisia cina Crude CO2 Subcritical Extract after the Removal of Santonin by Means of High Speed Countercurrent Chromatography. Molecules. 25 (12): 1-15.
Sbrana, C., P. Picciarelli, & M. Giovannetti. 2010. Mycorrhizal colonization impacts on phenolic content and antioxidant properties of artichoke leaves and flower heads. Plant Soil. 335: 311-323
Scervino, JM., MA. Ponce, R. Erra-Bassells, H. Vierheilig, JA. Ocampo, & A. Godeas. 2005. Arbuscular Mycorrhizal Colonization Of Tomato By Gigaspora And Glomus Species In The Presence Of Root Flavonoids. Journal
of Plant Physiology. 162(6): 625-633.
Shi, TJ., ZZ. Long, & M. Miao. 2020. Glomus Mosseae Promotes Xanthium Italicum Invasion. Sains Malaysiana. 49(10): 2425 -2432.
Sucahyo & S. Kasmiyati 2018. Respon Enzim Antioksidatif Sonchus oleraceus terhadap Cekaman Krom pada Media Tanam Berbeda. Jurnal Biologi Indonesia. 14(1): 51-59. Suharno, RP. & Sancayaningsih. 2013. Fungi
Mikoriza Arbuskula: Potensi Teknologi Mikorizoremediasi Logam Berat Dalam
Rehabilitasi Lahan Tambang, Bioteknologi 10 (1): 31-42.
Sumanta, N., CI. Haque, J. Nishika, & R. Suprakash. 2014. “Spectrophotometric Analysis Of Chloro-phylls And Carotenoids From Commonly Grown Fern Species By Using Various Extracting Solvents.” Research Journal Of Chemical Science. 4 (9): 63–69.
Suryati, T. 2017. Studi Fungi Mikoriza Arbuskula Di Lahan Pasca Tambang Timah Kabupaten Bangka Tengah. Jurnal Teknologi
Ling-kungan. 18 (1): 45-53.
Temraz, A., & WH. El-Tantawy. 2008. Characterization Of Antioxidant Activity Of Extract From Artemisia Vulgaris. Pak Journal
Pharmacy of Science. 21 (4): 321-326.
Thokchom, SD., S. Gupta, & R. Kapoor. 2020. Arbuscular Mycorrhiza Augments Essential Oil Composition and Antioxidant Properties of Ocimum Tenuiflorum L.–A Popular Green Tea Additive. Industrial Crops and Products. 153: 112418.
Wicaksono, MI., M. Rahayu, & S. Samanhudi. 2014. Pengaruh Pemberian Mikoriza Dan Pupuk Organik Terhadap Pertumbuhan
Bawang Putih. Caraka Tani: Journal Of
Sustainable Agriculture. 29 (1): 35-44.
Wulandari, RS. 2017. Asosiasi Cendawan Mikoriza Arbuskula (Cma) pada Ketapang (Terminalia Catappa). Jurnal Hutan Lestari. 1 (3): 258-267
.
Yang, YR, Y. Liang, XZ. Han, TY. Chiu, A. Ghosh, H. Chen, & M. Tang. 2016. The Roles Of Arbuscular Mycorrhizal Fungi (AMF) In Phytoremediation And Tree-Herb Interactions In Pb Contaminated Soil. Scientific Report. 6: 1-14.
Zubek, S., K. Rola, A. Szewczyk, ML. Majewska, & K. Turnau. 2015. Enhanced Concentrations Of Elements And Secondary Metabolites In Viola Tricolor L. Induced By Arbuscular Mycorrhizal Fungi. Plant and Soil. 390 (1-2): 129–142.
Zuhry, E. & F. Puspita. 2008. Pemberian Cendawan Mikoriza Arbuskular (CMA) Pada Tanah Podzolik Merah Kuning (PMK) Terhadapa Pertumbuhan Dan Produksi Kedelai (Glycine Max (L) Merrill). Jurnal Sagu. 7 (2): 25-29.