2.1. Pertambangan Timah Belitung Timur 2.1.1. Pertambangan Timah dan Dampaknya
Mineral timah yang mempunyai nilai ekonomis adalah cassiterite yang lebih dikenal sebagai tin ore (biji timah) atau tinstone. Mineral timah (SnO2) mengandung 21,4% oksigen dan 78,6% timah. Timah ditemukan di pulau-pulau Bangka, Belitung, Singkep, dan Karimun Kundur yaitu pada jalur sabuk timah Asia Tenggara (The South East Asia Tin Belt). Selain itu, timah ditemukan di Bangkinang, daratan Sumatera (Sujitno, 1996).
Sukandarrumudi (2007) menjelaskan di Pulau Bangka dan Belitung, batuan tertua terdiri dari batuan endapan malioh yang berumur Permokarbon hingga Trias. Batuan tersebut diterobos oleh granit biotit yang diperkirakan sebagai penyebab terbentuknya endapan timah yang ada. Endapan timah primer terdapat pada batuan granit dan daerah sentuhan dan pada batuan endapan malih dengan jenis pertama terutama di Tikus, bagian barat Pulau Belitung. Endapan timah di Kelapakampit mempunyai jenis yang khas karena terdapat sebagai urat pada bidang perlapisan dan terhampar mengikuti bidang jurus perlapisan.
Kegiatan penambangan timah menimbulkan perubahan morfologi lahan (Atmo dan Widodo, 1992 dalam Badri, 2004). Ciri-ciri tanah yang terganggu yaitu horizon tanah sudah tidak teratur, lapisan hitam dan lapisan-lapisan lainnya sudah terbalik. Selain unsur Sn, timah putih juga mengandung Pb yang biasanya banyak terdapat di timah hitam (Suwardi dan Hidayat, 1998 dalam Badri, 2004).
Logam timah terakumulasi secara alami dibawah permukaan tanah. Timah dan komponennya terakumulasi dalam tanah dan sedimen karena kemampuan terurainya yang rendah dan relatif babas dari degradasi mikroba. Beberapa hasil penelitian di Wales, Inggris mengindikasikan bahwa lapisan permukaan tanah (0-15cm) di lahan tambang memiliki kandungan Pb berkisar antara 15-106 µm/g (Munggoro, et al.,1999 dalam Badri, 2004). Hasil penelitian Zimdahl dan Skogerbae dalam Alloway (1992) menunjukan bahwa selain bahan organik, pH, dan KTK tanah merupakan faktor panting yang berpengaruh terhadap imobilisasi Pb. Hanya sedikit
Pb dalam tanah yang dapat diserap oleh tanaman, terutama jenis rumput - rumputan tertentu (Badri, 2004).
Penambangan timah akan menghasilkan limbah berupa bahan material (pasir) yang disebut tailing. Tailing menimbulkan dampak negatif pada penurunan kualitas lingkungan, yaitu rusaknya vegetasi hutan, rusaknya sistem tata air, meningkatnya laju erosi permukaan, menurunkan produktivitas dan stabilitas lahan. Sifat tailing yang merugikan bagi pertumbuhan tanaman adalah konsentrasi logam berat dan garam tinggi, kurangnya unsur hara penting dan kurangnya mikroorganisma, sifat dan struktur tanah yang membatasi aerasi dan infiltrasi serta tingginya daya pemantulan sinar (PT.Timah,1990 dalam Badri, 2004).
2.1.2. Sejarah Timah Bangka Belitung
Penemuan sumber mineral timah di Indonesia tidak diketahui secara pasti. Hal ini dikarenakan tidak ada catatan yang pasti kapan komoditas timah ini ditemukan di Bangka Belitung. Namun sejarah panjang, sebelum pemerintahan Kolonial Belanda melalui Kesultanan Palembang telah memonopoli perdagangan timah sejak awal abad ke-18 (Sujitno, 1996).
Herman (2005) menjelaskan sumberdaya mineral timah Bangka Belitung sudah dikenal dan dieksploitasi sejak Kesultanan Palembang (1850) dan diteruskan jaman penjajahan Belanda hingga tahun 1953. Sumberdaya timah tersebar di daratan dan perairan Pulau Bangka, Belitung, Singkep, Karimun dan Kundur. Pertama kali, timah di Bangka dikelola oleh badan usaha milik Kolonial Belanda bernama Banka Tin Winning Bedrijf (BTW), sementara di Pulau Belitung dan Singkep diusahakan oleh perusahaan swasta Belanda yaitu Gemeenschappelijke Mijnbow Maatschappij Biliton (GMB) dan NV. Singkep Tin Explitatie Maatschappij (NV.SITEM).
Memasuki masa kemerdekaan RI, pada tahun 1953 – 1958 ketiga perusahaan tersebut dinasionalisasi menjadi tiga perusahaan negara terpisah. Pada tahun 1961, dibentuk Badan Pimpinan Umum Perusahaan Tambang-tambang Timah Negara (BPU PN Tambang Timah) yang bertugas mengkoordinasi ketiga perusahaan tersebut. Kemudian sejak tahun 1968, keempat perusahaan tersebut digabungkan menjadi satu perusahaan bernama Perusahan Negara (PN) Tambang Timah (PT Timah, 2002 dalam Herman, 2005).
Memasuki tahun 1976, berdasarkan Undang-Undang No. 9 Tahun 1969 dan Peraturan Pemerintah No. 19 Tahun 1969, status PN Tambang Timah dan Proyek Peleburan Timah Mentok diubah menjadi PT. Tambang Timah (Persero). Krisis industri timah dunia akibat hancurnya The International Tin Council (ITC), memicu perusahaan melaksanakan perubahan mendasar (restrukturisasi) untuk mempertahankan kelangsungan perusahaan. Restrukturisasi dilakukan dalam kurun waktu 1991-1995 dan berhasil berhasil memulihkan dan meningkatkan daya saing perusahaan (PT Timah, 2002 dalam Herman, 2005).
Pada tahun 1998, PT. Timah Tbk melakukan diversifikasi usaha dan melakukan reorganisasi kelompok usaha dengan cara pemisahan operasi perusahaan menjadi tiga anak perusahaan dengan PT Timah Tbk sebagai induk perusahaan (holding company). PT. Timah Tbk dikenal sebagai perusahaan penghasil logam timah terbesar di dunia dan sedang dalam proses pengembangan usaha di luar penambangan timah dengan tetap berpijak pada kompetensi yang dimiliki (PT Timah, 2002 dalam Herman, 2005).
Selain PT. Timah Tbk, perusahaan lain yang beroperasi di wilayah Pulau Bangka adalah PT. Koba Tin, sebuah Perusahaan Modal Asing (PMA) yang berdiri pada tahun 1971. Perusahan ini memiliki wilayah pertambangan seluas 41.680 Ha yang termasuk kedalam wilayah Kabupaten Bangka Tengah dan Selatan. Perjanjian kontrak karya pertama PT. Koba Tin yaitu tahun 1973 – 2003 (tiga puluh tahun) dan diperpanjang selama sepuluh tahun dari tahun 2003 – 2013. Selain kedua perusahaan besar diatas, usaha pertambangan dilakukan juga oleh Perusahaan dengan Izin Usaha Pertambangan (IUP) dari Pemerintah Daerah, smelter-smelter baru berukuran kecil, kolektor/perusahaan imbalan jasa dan pengusaha tambang inkonvensional (PT Koba Tin, 2004 dalam Herman, 2005).
2.1.3. Tambang Inkonvensional, Potensi dan Permasalahannya
Istilah tambang inkonvensional (TI) secara sederhana diartikan sebagai kegiatan penambangan timah yang dilakukan oleh masyarakat dengan memanfaatkan peralatan mekanis sederhana dan modal usaha berkisar antara Rp 10 – 15 juta. Secara legal formal, TI sebenarnya kegiatan penambangan yang melanggar hukum karena pada umumnya tidak memiliki izin penambangan (Anonim, 2001).
Secara aspek hukum kegiatan TI merupakan pelanggaran terhadap Undang Undang Nomor 41 Tahun 1999 tentang Kehutanan (Pasal 50 ayat 3); Perda Propinsi Kepulauan Bangka Belitung Nomor 3 Tahun 2004 tentang Pengelolaan Usaha Pertambangan Umum (Pasal 8 ayat 2) dan Surat Keputusan Menteri Perdagangan Nomor 443/MPP/KEP/5/2002 tentang pelarangan ekspor bijih timah (Herman, 2005).
Sebelum era reformasi (1997), munculnya kegiatan TI dikarenakan PT Timah melakukan kegiatan pendulangan di daerah-daerah yang tidak ekonomis dengan melibatkan masyarakat sekitar dan hasilnya dijual ke PT. Timah Tbk. Pada tahun 2001, kegiatan tersebut dilakukan di areal kuasa penambangan (KP) PT Timah Tbk, dan setelah cadangan timah habis dipindahkan ke lokasi yang telah ditetapkan PT. Timah Tbk. Kegiatan TI hanya melakukan kegiatan penambangan timah (PT Timah, 2002 dalam Herman, 2005).
Memasuki era reformasi, kegiatan TI berkembang sangat pesat dari pelaku penambangan menjadi pengolah dan eksportir bijih timah bahkan munculnya pabrik-pabrik peleburan skala kecil dan eksport logam timah tanpa merk. Kegiatan TI tersebut menjadi semakin marak sejak dikeluarkannya SK Menperindag No. 146/MPP/Kep/4/1999 tanggal 22 April 1999 bahwa Timah diketegorikan sebagai barang bebas (tidak diawasi) dan pencabutan status timah sebagai komoditas strategis, sehingga tidak dimonopoli lagi oleh satu BUMN dan dapat dieskpor secara bebas oleh siapapun (BIP, 2006).
Lokasi penambangan juga tidak terbatas pada areal kuasa pertambangan (KP) PT Timah Tbk, namun pelaku TI mencari alternatif lokasi baru di luar areal KP PT Timah Tbk. Pengolahan bahan timah dan eksport timah tanpa merek oleh
pelaku TI menyebabkan terjadinya pasar gelap dan menyebabkan penurunan harga timah di pasar internasional (Herman, 2005).
Berdasarkan data tahun 2001, bila diasumsikan terdapat 6000 unit TI dengan rata-rata produksi 10 ton pasir timah, maka jumlah produksi bijih timah yang dihasilkan mencapai 60.000 ton per tahun. Jumlah ini lebih besar dari produksi bijih timah PT. Timah Tbk dan PT. Koba Tin yang hanya mencapai 45.000 ton per tahun. Sementara pada tahun 2006, total eksport logam timah Indonesia diperkirakan mencapai 123.500 ton. Bank Indonesia Palembang (BIP) Tahun 2006 melaporkan bahwa konstribusi PT. Timah Tbk sebesar 43.000 ton dan PT. Koba Tin sebesar 20.500 ton dan sisanya berasal dari smelter swasta illegal sebesar 60.000 ton atau hampir sepertiga produksi timah dunia.
Kegiatan TI di Belitung Timur awalnya juga dilakukan di bekas areal PT Timah Tbk yang sudah ditinggalkan (Anonim, 2001). Kemudian berkembang ke lokasi-lokasi lain dan bahkan perkebunan lada yang dinilai kurang ekonomis dikonversi menjadi areal pertambangan. Lokasi TI tersebar pada jalur antara Tanjung Pandan, Bidang, Kelapa Kampit dan Manggar (sepanjang 91 km) dan antara Manggar, Gantung, Badau dan Tanjung Pandan (sekitar 105 km).
Kegiatan TI berdampak positif bagi perkembangan perekonomian Bangka Belitung terutama sektor pertambangan dan penyerapan tenaga kerja. Namun menimbulkan permasalahan lain (dampak turunan) yang lebih besar antara lain merugikan ekonomi sektor lain terutama pertanian, kerusakan lingkungan dan sosial (BIP, 2006). Dampak keberadaan TI disampaikan pada Tabel 1.
Dampak kerusakan lingkungan akibat kegiatan TI (Widyastuti, 2007) antara lain:
• Lubang bekas galian yang tidak direklamasi membentuk cekungan-cekungan (kolong tambang) dan terisi air pada saat hujan sehingga daerah tersebut menjadi tandus dan gersang.
• Terjadinya pendangkalan sungai di sekitar lokasi penambangan. Kegiatan tambang menggunakan air sungai untuk melakukan penyemprotan untuk pelepasan tanah dari pasir timah.
• Rusak dan hilangnya vegetasi diakibatkan penebangan dan asap mesin eksavator.
• Penurunan kualitas air sungai akibat pembuangan tailing (lumpur) hasil pemisahan bijih timah.
• Rusaknya daerah aliran sungai, kawasan sempadan pantai, hutan produksi dan bahkan hutan lindung.
Tabel 1 Dampak keberadaan TI
No. Sektor Dampak
1. Pertambangan Meningkatkan produksi timah (Indonesia
menguasai 40% produksi timah dunia
Memunculkan negara eksportir timah baru seperti Malaysia, Thailand dan Singapura (meskipun bukan penghasil timah) yang mendapat timah dari Indonesia.
Pasokan timah dunia melimpah Harga timah dunia menurun
2. Pertanian Penyusutan lahan perkebunan lada seluas
50.000 ha (tahun 2000 hingga 2004) menjadi lahan pertambangan timah
Penurunan produktivitas lada dari 2 ton menjadi 1 ton per hektar.
3. Ketenagakerjaan Peningkatan penyerapan tenaga kerja Mengurangi pengangguran secara signifikan
4. Lingkungan Menimbulkan kerusakan lingkungan
(sumberdaya air dan hutan)
5. Pendidikan Peningkatan angka putus sekolah sekitar
16.000 (Juni 2005) karena bekerja di penambangan timah
6. Pendapatan daerah Peningkatan pendapatan daerah dari royalti timah
Sumber: Laporan Perekonomian dan Perbankan Kepulauan Bangka Belitung, 2006
Sistem penambangan TI
Menurut Widyastuti (2007) sistem penambangan TI dilakukan secara berpindah-pindah dari satu lokasi ke lokasi lainnya (bergantung pada cadangan timah yang tersedia). Besarnya cadangan timah di suatu tempat belum dapat diketahui sebelumnya secara pasti.
Modal yang digunakan bervariasi tergantung pada luas area penambangan, kedalaman, dan jarak dengan lokasi sumber air (sungai). Semakin luas area penambangan, maka alat-alat yang digunakan juga semakin banyak. Bahan bakar untuk mesin-mesin penambangan berbahan bakar solar. Biaya penggunaan bahan bakar kegiatan TI di Kecamatan Belinyu, Kabupaten Bangka rata-rata berkisar
Rp 100.000 – Rp 200.000 dengan produktivitas perolehan timah berkisar 15 – 50 kg per hari (Widyastuti, 2007).
Sistem penjualan Timah
Sistem penjualan timah yang dilakukan oleh pemilik TI yaitu dijual secara langsung kepada tengkulak kecil (kolektor). Kolektor biasanya berbentuk badan hukum CV akan menetapkan harga timah sesuai kualitas timah yang diperoleh dan berat hasil penimbangan. Kemudian, kolektor akan menjual hasil timah yang telah dikeringkan kepada smelter yaitu usaha industri logam timah.
Industri logam timah akan melakukan pengolahan timah lanjutan dengan cara peleburan bijih timah hingga pembentukan logam timah yang berbentuk batangan. Smelter akan menjual hasil pengolahan kepada mitra usaha seperti PT. Timah Tbk. Rendahnya harga jual pasar domestik menyebabkan banyaknya penyelundupan timah ke luar negeri dengan harga jual yang relatif tinggi (Widyastuti, 2007). Bagan alir sistem penjualan timah dijelaskan pada Gambar 2.
Pemilik TI
Pasar Luar Negeri PT Timah Tbk
= Jalur resmi = Jalur tidak resmi
Gambar 2 Bagan alir sistem penjualan timah Kolektor Smelter
2.2. Karakteristik Kualitas Perairan
Kualitas perairan merupakan sifat air dan kandungan makhluk hidup, zat, energi, atau komponen lain dalam air. Kualitas perairan terdiri atas parameter kimia, fisika, dan parameter biologi (Effendi, 2003). Parameter fisika meliputi antara lain suhu, kekeruhan, padatan terlarut, padatan tersuspensi. Parameter kimia meliputi antara lain pH, oksigen terlarut, BOD, COD, unsur-unsur logam. Sementara parameter biologi meliputi antara lain plankton, bentos, dan bakteri.
2.2.1. Parameter Fisika a. Suhu
Suhu merupakan parameter fisika yang penting di perairan. Bersama dengan salinitas, dapat mengidentifikasi massa air tertentu. Sedangkan bersama tekanan, suhu mampu menentukan densitas air laut (Romimohtarto, 1984). Kenaikan suhu mempercepat reaksi-reaksi kimiawi; menurut hukum van't Hoff kenaikan suhu 10°C menjadi dua kali lipat kecepatan reaksi, walaupun hukum ini tidak selalu berlaku. Proses metabolisme akan menaik sampai puncaknya dengan kenaikan suhu tetapi kemudian menurun lagi. Setiap perubahan suhu cenderung untuk mempengaruhi banyak proses kimiawi yang terjadi secara bersamaan pada jaringan tanaman dan binatang, karenanya juga mempengaruhi biota secara keseluruhan.
b. Kekeruhan
Kekeruhan menggambarkan sifat optik air yang ditentukan berdasarkan banyaknya cahaya yang diserap dan dipancarkan oleh bahan-bahan yang terdapat dalam air. Timbulnya kekeruhan disebabkan oleh bahan organik dan anorganik baik tersuspensi maupun terlarut seperti lumpur, pasir halus, bahan anorganik seperti plankton dan mikroorganisme lainnya (Davis dan Cornwell, 1991 dalam Effendi, 2003).
c. Padatan Tersuspensi Total (Total Suspended Solid)
Padatan tersuspensi total (TSS) merupakan bahan-bahan tersuspensi yang tertahan pada saringan millipore (diameter pori 0,45 μm) yang terdiri dari lumpur dan pasir halus serta jasad-jasad renik. Nilai TSS bergantung pada kikisan tanah atau erosi tanah yang dapat diendapkan di daratan dan terbawa ke perairan laut.
2.2.2. Parameter Kimia a. Salinitas
Salinitas merupakan konsentrasi dari total ion yang terdapat di perairan (Boyd, 1988). Nilai salinitas ini menggambarkan padatan total di dalam air setelah semua karbonat di konversi menjadi oksida, semua bromida dan iodida telah digantikan oleh klorida dan semua bahan organik telah dioksidasi.
b. Nilai pH
Nilai pH menggambarkan konsentrasi ion hidrogen. Nilai pH berperan penting dalam menjaga kelangsungan hidup biota perairan dan dapat mempengaruhi kecepatan dan bentuk reaksi kimia serta interaksi biologis air. Sebagian besar biota perairan sensitif terhadap perubahan nilai pH dan hidup optimal pada pH sekitar 7 - 8.5. Perubahan nilai pH secara mendadak pada kisaran tertentu dapat menyebabkan kematian biota perairan (Effendi, 2003).
Nilai pH mempengaruhi toksisitas suatu senyawa kimia. Pada pH rendah, toksisitas logam mengalami peningkatan (Novotny dan Olem, 1994 dalam Effendi, 2003). Demikian juga senyawa amoniak mengalami mudah terionisasi pada kondisi pH rendah dan tidak toksik. Namun pada pH tinggi (kondisi alkalis), amoniak umumnya tidak terionisasi dan bersifat toksik.
c. Oksigen Terlarut (Dissolved Oxygen)
Oksigen terlarut (dissolved oxygen) merupakan jumlah gas oksigen yang ditemukan terlarut dalam air. Kadar oksigen terlarut berfluktuasi secara harian dan musiman tergantung pada pencampuran (mixing) dan pergerakan (turbulence) massa air, aktivitas fotosintesis, respirasi, dan keberadaan limbah yang masuk ke badan air. Distribusi oksigen terlarut sangatlah penting bagi banyak organisme akuatik, selain itu oksigen terlarut juga mempengaruhi kelarutan dan keberadaan unsur-unsur nutrien (Wetzel, 2001).
Sumber oksigen terlarut di perairan dapat berasal dari proses difusi oksigen yang terdapat di atmosfer dan produk dari aktivitas fotosintesa oleh tumbuhan air dan fitoplankton. Sebaliknya berkurangnya kadar oksigen di perairan sebagai akibat dari terpakainya oksigen untuk respirasi biota akuatik dan juga terpakainya oksigen oleh mikroba dalam proses dekomposisi bahan organik secara aerobik (Effendi, 2003).
Rendahnya kadar oksigen terlarut dikaitkan dengan pemakaian oksigen oleh mikroba dalam proses dekomposisi yang cenderung melebihi pasokan oksigen oleh aktivitas fotosintesa dan difusi langsung dari udara. Normalnya pasokan oksigen dari aktivitas fotosintesa dapat dikorelasikan dengan rendahnya kadar padatan terlarut dan tersuspensi. Rendahnya kadar padatan terlarut dan
tersuspensi perairan didukung dengan relatif jernihnya perairan yang memungkinkan penetrasi cahaya matahari menembus hingga dasar perairan dan memfasilitasi terjadinya proses fotosintesa pada seluruhkolom air. Kadar oksigen yang sangat rendah dapat membahayakan kelangsungan hidup ikan karena terganggunya proses respirasi seperti terlihat pada Tabel 2. Semakin rendah kadar oksigen terlarut semakin tinggi toksisitas (daya racun) beberapa logam seperti seng, tembaga, timbal, dan juga toksisitas beberapa gas seperti sulfida dan ammonia bebas (Boyd, 1990).
Tabel 2 Kadar oksigen terlarut dan pengaruhnya terhadap kelangsungan hidup ikan
Kadar oksigen terlarut
(mg/l) Pengaruh terhadap kelangsungan hidup ikan < 0,3 Hanya sedikit jenis ikan yang dapat bertahan pada masa
pemaparan singkat (short exposure)
0,3 – 1,0 Pemaparan yang lama (long exposure) dapat
mengakibatkan kematian ikan
1,0 – 5,0 Ikan dapat bertahan hidup, tetapi pertumbuhannya terganggu
> 5,0 Hampir smeua organisme akuatik menyukai kondisi ini Sumber: Modifikasi Swingle (1969) dalam Boyd (1990)
d. Biological Oxygen Demand (BOD)
Kadar BOD menggambarkan jumlah oksigen yang dibutuhkan oleh mikroba aerob untuk mengoksidasi bahan organik menjadi karbondioksida dan air. Penentuan kadar BOD selama 5 hari inkubasi dimaksudkan untuk meminimalkan pengaruh oksidasi ammonia dan berdasarkan perkiraan bahwa sekitar 70-80% bahan organik telah mengalami oksidasi pada hari kelima. Kadar BOD suatu perairan dipengaruhi oleh suhu, kelimpahan plankton, keberadaan mikroba, serta jenis dan kandungan bahan organik dalam perairan tersebut
e. Chemical Oxygen Demand (COD)
COD (chemical oxygen demand) adalah jumlah oksigen yang dibutuhkan oksidator kuat dalam mengoksidasi bahan organik secara kimiawi (Mays, 1996). Kalium dikromat adalah salah satu oksidator kuat yang biasanya digunakan dalam uji COD. Bahan organik yang dioksidasi dalam penentuan COD ini meliputi bahan organik yang bisa didegradasi secara biologis maupun yang sulit. Nilai
COD biasanya selalu lebih besar daripada nilai BOD. Oksidator (kalium dikromat) yang digunakan dalam uji COD dapat mengoksidasi bahan organik dalam jumlah yang lebih banyak dibandingkan bakteri (Sastrawijaya, 2000). Hasil pengamatan terhadap beberapa perairan alami menunjukkan nilai COD yang bervariasi antara < 2 mg/l - 100 mg/l (Mays, 1996).
d. Amoniak Total (NH3-N), Nitrit (NO2-N), dan Nitrat (NO3-N)
Amonia (NH3) adalah salah satu bentuk senyawa nitrogen yang ditemukan di perairan. Ion amonium (NH4+) adalah bentuk transisi dari amonia. Amonia di perairan berasal dari pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat dalam tanah dan air, selain itu amonia juga berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati) yang dilakukan oleh mikroba dan jamur. Amonia yang terukur pada perairan alami adalah amonia total (NH3 dan NH4+) (Boyd, 1990). Kadar amonia bebas pada perairan alami biasanya kurang dari 0,1 mg/l (Effendi, 2003). Toksisitas konsentrasi amonia bebas terhadap ikan air tawar bervariasi antara 0,7 - 2,4 mg/l (Boyd, 1990).
Nitrit (NO2) merupakan bentuk peralihan antara amonia dan nitrat (nitrifikasi), dan antara nitrat dan gas nitrogen (denitrifikasi). Nitrit biasanya ditemukan dalam jumlah yang sangat sedikit di perairan alami, kadarnya lebih kecil daripada nitrat karena nitrit bersifat tidak stabil jika di perairan terdapat oksigen. Keberadaan nitrit menggambarkan berlangsungnya proses perombakan bahan organik secara biologis dengan kadar oksigen terlarut sangat rendah (Novotny dan Olem, 1994). Kadar nitrit (sebagai N) di perairan alami sekitar 0,001 mg/l (Effendi, 2003). Nilai LC50 (96 jam) nitrit (sebagai N) terhadap ikan air tawar bervariasi antara 0,66 - 200 mg/l (Boyd, 1990).
Nitrat (NO3) adalah bentuk nitrogen utama di perairan alami. Nitrat dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan. Semua bahan yang mengandung nitrogen bertendensi untuk teroksidasi menjadi nitrat. Nitrat sangat mudah larut dalam air dan bersifat stabil (Effendi, 2003). Kadar nitrat (sebagai N) pada perairan alami umumnya kurang dari 5 mg/l (Mays, 1996).
Keberadaan amonia, nitrit, dan nitrat di perairan dipengaruhi oleh proses nitrifikasi dan denitrifikasi. Proses nitrifikasi dilakukan oleh bakteri Nitrosomonas dan Nitrobacter pada kondisi aerob; pada kadar DO < 2 mg/l reaksi akan berjalan lambat. Nilai pH optimum bagi proses nitrifikasi ini adalah 8 – 9; pada pH < 6 reaksi akan berhenti. Dan suhu optimum bagi proses nitrifikasi adalah 20 – 25oC; kecepatan nitrifikasi berkurang pada suhu kurang atau lebih dari kisaran tersebut. Proses denitrifikasi juga dilakukan oleh mikroba, namun proses ini terjadi pada kondisi anaerob (Effendi, 2003).
e. Fosfor (PO4-P)
Fosfor merupakan unsur esensial bagi tumbuhan tingkat tinggi dan alga, sehingga fosfor menjadi faktor pembatas bagi tumbuhan dan algae akuatik; fosfor juga sangat mempengaruhi tingkat produktivitas perairan. Ortofosfat (PO43-) adalah bentuk fosfor yang dimanfaatkan secara langsung oleh tumbuhan akuatik. Polifosfat harus mengalami hidrolosis dulu membentuk ortofosfat sebelum dimanfaatkan sebagai sumber fosfor. Fosfat anorganik ini setelah masuk ke tumbuhan akan mengalami perubahan menjadi organofosfat. Total-P menggambarkan jumlah total fosfor, baik berupa partikulat maupun terlarut, dan berupa anorganik maupun organik.
f. Silika (SiO2)
Silikon ditemukan dalam bentuk silika (SiO2) di kerak bumi dalam jumlah yang berlimpah. Silikon tidak ditemukan dalam bentuk elemen bebas, tetapi berikatan dengan oksigen dan elemen lain (Effendi, 2003). Silika tidak larut dalam air maupun asam dan biasanya dalam bentuk koloid.
Perairan tawar alami memiliki kadar silika kurang dari 5 mg/l, perairan sungai dan danau memiliki kadar silika sekitar 5-25 mg/l (Cole, 1988 dalam Effendi, 2003). Perairan payau dan laut, kadar silika tergolong tinggi berkisar 1.000-4.000 mg/l. Keberadan silika di perairan tidak menimbulkan bahaya bagi makhluk hidup karena tidak bersifat toksik.
g. Logam berat
Logam berat didefinisikan sebagai logam yang mempunyai densitas lebih dari 5 gr/cm3. Dengan demikian logam yang memiliki densitas kurang dari 5 gr/cm3 tergolong logam ringan. Istilah lain menyebutkan sebagai logam trace yaitu logam yang dalam keadaan alami berjumlah sangat sedikit (Darmono, 1995).
Widowati et al. (2008) menjelaskan logam berat terdapat 80 jenis dari 109 unsur kimia yang ada di muka bumi. Logam berat dibedakan atas 2 jenis yaitu: a. Logam berat esensial, yaitu logam yang dalam jumlah tertentu dibutuhkan
oleh organisme. Namun dalam jumlah yang berlebihan menimbulkan efek toksik. Logam-logam tersebut antara lain: Zn, Cu, Fe, Co, Mn dan lainnya. b. Logam berat tidak esensial, yaitu logam yang keberadaanya dalam tubuh
masih belum diketahui manfaatnya, bahkan bersifat toksik antara lain Hg, Cd, Pb, Cr, dan lain-lain.
Tingginya kandungan logam berat dalam perairan dapat disebabkan oleh kegiatan pertanian yang terbawa ke perairan laut, aktivitas vulkanik, pelapukan batuan dan proses alam lainnya. Logam berat juga dapat berasal dari proses resuspensi (pengadukan) dasar perairan yang terjadi di perairan dangkal dan terbawa oleh pergerakan massa air. Hampir semua jenis logam berat dibutuhkan oleh biota perairan dan makhluk hidup lainnya pada kandungan tertentu.
Beberapa unsur logam yang termasuk elemen mikro merupakan kelompok logam berat yang tidak mempunyai fungsi biologik sama sekali. Logam tersebut pada kadar tertentu bahkan sangat berbahaya dan dapat menyebabkan keracunan (toksisitas) pada mahluk hidup. Jenis logam tersebut antara lain timbal (Pb), kadmium (Cd), merkuri (Hg), arsen (As) dan aluminium (Al). Toksisitas logam pada manusia menyebabkan pengaruh negatif, terutama mengakibatkan kerusakan jaringan detoksikasi dan eksresi (hati dan ginjal). Beberapa logam toksik tersebut dapat menyerang saraf sehingga mengakibatkan kelainan tingkah laku.
Logam berat dapat menimbulkan efek pada kesehatan manusia, bergantung pada tingkat paparan dan bagian mana yang terikat logam berat dalam tubuh. Toksisitas logam berat mampu menghalangi kerja enzim sehingga menggangu metabolisme tubuh, menimbulkan alergi, bersifat mutagen, teratogen,
atau karsinogenik bagi manusia dan hewan (Widowati et al., 2008). Toksisitas logam berat dalam hewan air dari yang paling toksik yaitu Hg, Cd, Zn, Pb, Cr, Ni, dan Co. Sementara toksisitas logam berat bagi manusia dimulai dari Hg, Cd, Ag, Ni, Pb, As, Cr, Sn, dan Zn.
2.3. Pencemaran Perairan
Pencemaran atau polusi lingkungan perairan menurut Odum (1996) adalah perubahan yang tidak diinginkan pada udara, daratan, dan air secara fisik, kimiawi, ataupun biologi yang mungkin (atau akan) merupakan bahaya bagi kehidupan manusia dan makhluk hidup lainnya, ataupun bagi proses-proses industri, lingkungan hidup, dan nilai-nilai kebudayaan. Sementara menurut Undang-Undang No. 23 tahun 1997 tentang Lingkungan Hidup, pencemaran didefinisikan sebagai masuknya atau dimasukkannya makhluk hidup, zat, energi, dan/atau komponen lain ke dalam lingkungan hidup oleh kegiatan manusia.
Pencemaran perairan disebabkan adanya masukan limbah dari kegiatan industri, pertambangan dan lainnya. Pencemaran perairan cenderung meningkat dari waktu ke waktu. Pencemaran perairan banyak disebabkan akibat manusia. Sumber pencemaran utama di perairan Kabupaten Balitung adalah kegiatan eksploitasi penambangan timah baik secara legal maupun ilegal, kegiatan penangkapan ikan secara ilegal, transportasi laut, dan wisata bahari. Sumber pencemaran perairan dari penambangan timah berasal dari penambangan di darat dan di laut.
Lebih lanjut Widowati et al. (2008) menjelaskan pencemaran perairan oleh kegiatan manusia berasal dari kegiatan industri, pertambangan, pembakaran bahan bakar, dan kegiatan domestik lain yang berpotensi meningkatkan logam di lingkungan. Pencemaran logam pada lingkungan perairan (sungai/laut) berpotensi mencemari manusia melalui ikan, air minum, atau air irigasi lahan pertanian sehingga tanaman menjadi tercemar logam.
Pencemaran logam berat di perairan menimbulkan bahaya bagi makhluk hidup dan kesehatan manusia. Darmono (1995) mengatakan bahwa logam-logam tertentu menjadi sangat berbahaya bila ditemukan dalam konsentrasi tinggi di perairan. Hal ini dikarenakan logam tersebut memiliki sifat yang merusak jaringan tubuh makhluk hidup. Logam-logam berbahaya tersebut antara lain
kadmium (Cd), timbal (Pb), dan merkuri (Hg). Kegiatan pertambangan timah inkonvensional di daratan berpotensi menimbulkan pencemaran logam berat ke perairan.
Kolong-kolong bekas penambangan timah merupakan perairan yang mengandung logam berat yang relatif tinggi. Kolong didefinikan sebagai bagian dari perairan umum yang berbentuk kolam. Kolong dapat juga berbentuk danau atau waduk sebagai akibat adanya aktivitas penambangan bahan galian (Badri, 2004).
Hasil penelitian menunjukkan kondisi perairan kolong bekas penambangan timah memiliki pH air yang cenderung asam. Pembentukan asam disebabkan oleh oksidasi mineral sulfida yang terekspos dengan oksigen dan air pada saaat penambangan (Subarja dan Santoso, 2007). Kolong yang berumur muda (<5 tahun) cenderung memiliki kandungan logam yang tinggi. Semakin tua usia kolong, maka kondisi kualitas perairan semakin baik karena adanya pelarutan logam oleh asam dan pengenceran seiring bertambahnya waktu (Brahmana et al., 2004). Beberapa logam yang terdeteksi tinggi yaitu logam seng (Zn), mangan (Mn), besi (Fe), tembaga (Cu), dan timbal (Pb).
Kolong-kolong bekas penambangan timah umumnya telah tercemar logam berat seperti timbal (Pb), besi (Fe), dan arsen (As). Hasil penelitian LIPI di Kabupaten Bangka, perairan kolong bekas penambangan memiliki rata-rata kandunga Pb yang tinggi dan diatas baku mutu untuk kegiatan budidaya perikanan. Selain itu, tanah kolong muda melepaskan logam berat karena memiliki derajat keasaman yang rendah (Henny, 2007). Kolong-kolong air yang berusia muda dengan kedalaman kurang dari 10 m sangat beresiko untuk budidaya ikan air tawar. Hal ini dikarenakan sangat mungkin logam berat akan terserap kedalam tubuh ikan dan berbahaya bagi kesehatan manusia.
Selanjutnya, Henny (2007) mengatakan bahwa kolong-kolong yang berusia tua dan kedalaman air lebih dari 10 m bisa untuk budidaya perikanan. Namun tetap perlu dilakukan pemantauan terhadap kualitas air kolong secara periodik.
2.4. Sedimen Dasar Perairan
2.4.1. Pengertian Sedimen dan Klasifikasinya
Sedimen atau lumpur merupakan bagian dari sungai, muara dan lautan. Kepekatannya beragam, bergantung kepada keadaan, seperti curah hujan, ciri-ciri daerah aliran sungai, jenis tanah, dan komposisi bahan kimia atau biologinya. Sementara lumpur adalah padatan tersuspensi dapat berasal dari aliran atau dimasukkan ke dalam massa air oleh sedimen yang merupakan bagian utama dasar perairan, yang terlarut kembali ke dalam sistem perairan atau pengendapan kembali ke dasar perairan yang disebut juga sebagai proses sedimentasi.
Sedimen merupakan suatu bahan kimia baik berupa fragmen material padatan atau bahan organik yang terbawa atau terendapkan secara alamiah (angin, air atau proses pembekuan sungai es) di dalam dasar perairan/laut (Encyclopedia-Colombia Univercity Press). Berdasarkan proses pembentukannya, sedimen secara umum diklasifikasikan kedalam 3 golongan utama, yaitu secara mekanik, kimiawi, dan organik.
Secara mekanik
Secara mekanik atau klastik sedimen dibagi berdasarkan proses erosi dari batuan muda di permukaan bumi atau di lautan, yang kemudian terbawa oleh aliran, angin atau glester es ke tempat terjadinya endapan. Aliran endapan sedimen atau partikel ini terbawa ke laut, dimana pengendapan terjadi.
Secara kimiawi
Endapan kimiawi terbentuk melalui reaksi kimia di air laut sebagai hasil pengendapan mineral kristal halus, yang terendapkan didasar laut membentuk sedikitnya lapisan sedimen kimia yang jika sedimen diuapkan akan menghasilkan sedimen kering yang mengandung gypsum dan garam batu.
Secara organik
Secara organik berasal dari hasil tanaman atau hewan melalui pembusukan tanaman dan kemudian memadat seperti tanah gambut dan batu bara.
2.4.2. Sumber dan Karakteristik Fisika-Kimia Sedimen a. Sumber Sedimen
Sedimen meliputi pasir, tanah, lumpur, dan partikel lain yang terendapkan di dasar perairan. Sumber sedimen daerah pegunungan, aliran sungai, erosi daerah pertanian dan lain-lain. Disamping itu sumber dari sedimen meliputi pula akibat aktivitas manusia seperti pertambangan, penebangan hutan, dan perpindahan penduduk dari suatu daerah ke daerah lain (urbanisasi).
Muatan sedimen dapat dibagi ke dalam tiga tipe yakni muatan dasar, suspensi, dan terlarut. Muatan dasar adalah sedimen yang berpindah dan selalu kontak dengan badan perairan. Muatan suspensi merupakan sedimen berasal dari sungai/aliran dasar yang sewaktu-waktu berubah akibat turbulensi air. Sedangkan muatan terlarut merupakan sedimen halus berukuran lebih kecil dari 63µ berasal dari akibat erosi tanah ataupun dataran pegunungan/tanah tinggi. Namun demikian sedimen merupakan komponen sistem perairan (akibat perusakan material induk), kelebihan jumlah sedimen dapat merusak badan air (KLH dan PKRKL-FMIPA-UI, 2005).
Sedimen pada perairan atau laut merupakan habitat yang penting bagi kehidupan biota laut, yang merupakan pula adanya kandungan nutrien yang sangat diperlukan bagi kelangsungan kehidupan biota di dasar laut dan perairan umumnya. Sedimen juga mempengaruhi kondisi lingkungan dari berbagai bahan berbahaya yang terdapat dalam perairan. Umumnya bahan pencemar toksik terakumulasi pada sedimen yang dapat mengancam kelangsungan kehidupan biota laut secara langsung, dan juga berbahaya bagi kesehatan manusia secara tidak langsung bila mengkonsumsi biota laut yang sudah tercemar.
b. Karakteristik Fisika dan Kimia Sedimen
Sifat fisik sedimen seperti ukuran butir sedimen dan densitas, sangat penting dalam sedimentasi dan proses transport. Sedimen memiliki ukuran partikel yang heterogen dari ukuran milimeter hingga sub- mikron. Klasifikasi partikel sedimen berdasarkan ukuran butiran disampaikan pada Tabel 3. Berdasarkan tipenya, sedimen memiliki karakteristik sebagai material kasar, fraksi liat/debu dan pasir. Partikel >2mm tergolong kerang, batuan, kayu dan material terendap lainnya dan bukan sumber bahan bioavailable (Mudroch et al., 1997
dalam NRMMC-PIMC Australia Government). Fraksi liat/debu mempunyai area permukaan yang tinggi sehingga lebih menyerap bahan organik dan logam berat.
Tabel 3 Klasifikasi dan ukuran sedimen
No. Nama Partikel Ukuran (um)
1. Liat halus (fine clay) <0,06
2. Liat sedang (medium clay) 0,06-0.2 ;0,2-0,63
3. Liat kasar (coarse clay) 0,63-2
4. Debu halus (fine silt) 2-6,3
5. Debu sedang (medium silt) 6,3-20
6. Debu kasar (coarse silt) 20-63
7. Pasir (sand) >63
8. Material kasar, batu dan endapan (coarse material, rocks, detritus)
>2mm
Sumber: Mudroch et al. (1997) dalam NRMMC-PIMC (2000)
Tekstur sedimen mempengaruhi penyebaran, komposisi dan jumlah mikroorganisme. Klasifikasi sedimen berdasarkan ukuran partikelnya (Tabel 4) sesuai penggolongan skala Wentworth (Holme dan McIntyre, 1971 dalam Setiabudi, 2007).
Tabel 4 Klasifikasi dan ukuran sedimen berdasarkan skala Wentworth
No. Nama Partikel Ukuran (mm)
1. Batuan (boulder) 256
2. Batuan bulat (cobble) 256-64
3. Batuan kerikil (pebble) 64-4
4. Butiran (granule) 4-2
5. Pasir paling kasar (very coarse sand) 2-1
6. Pasir kasar (coarse sand) 1-0,5
7. Pasir sedang (medium sand) 0,5-0,25
8. Pasir halus (fine sand) 0,25-0,125
9. Pasir sangat halus (very fine sand) 0,125-0,0625
10. Debu (silt) 0,0625-0,0039
11. Liat (clay) <0,0039
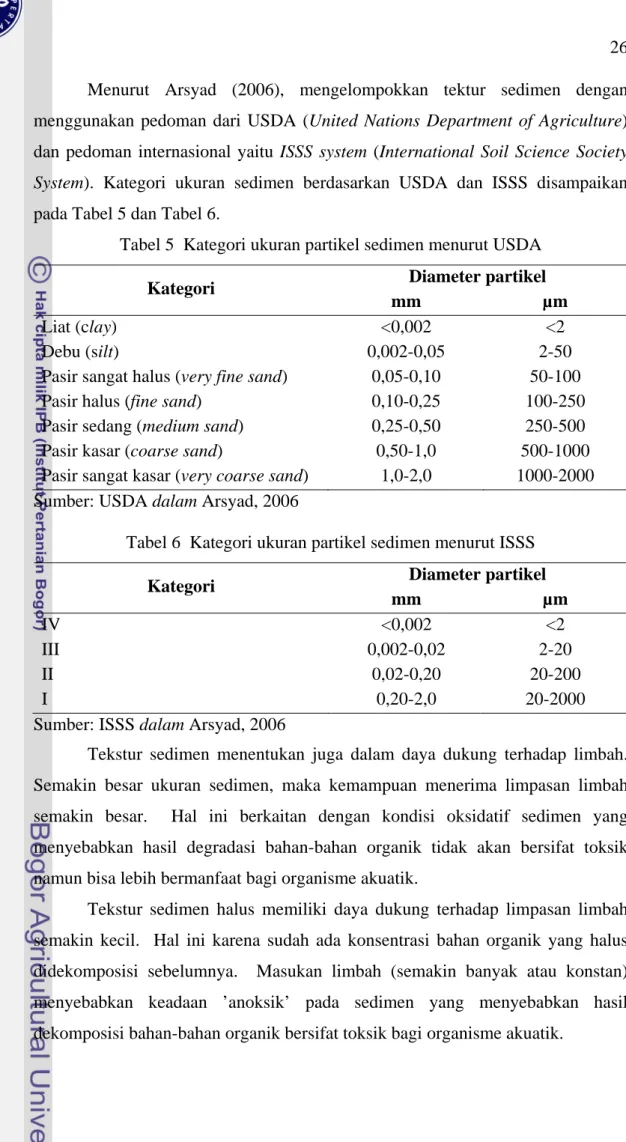
Menurut Arsyad (2006), mengelompokkan tektur sedimen dengan menggunakan pedoman dari USDA (United Nations Department of Agriculture) dan pedoman internasional yaitu ISSS system (International Soil Science Society System). Kategori ukuran sedimen berdasarkan USDA dan ISSS disampaikan pada Tabel 5 dan Tabel 6.
Tabel 5 Kategori ukuran partikel sedimen menurut USDA Diameter partikel Kategori
mm µm
Liat (clay) <0,002 <2
Debu (silt) 0,002-0,05 2-50
Pasir sangat halus (very fine sand) 0,05-0,10 50-100
Pasir halus (fine sand) 0,10-0,25 100-250
Pasir sedang (medium sand) 0,25-0,50 250-500
Pasir kasar (coarse sand) 0,50-1,0 500-1000
Pasir sangat kasar (very coarse sand) 1,0-2,0 1000-2000 Sumber: USDA dalam Arsyad, 2006
Tabel 6 Kategori ukuran partikel sedimen menurut ISSS Diameter partikel Kategori mm µm IV <0,002 <2 III 0,002-0,02 2-20 II 0,02-0,20 20-200 I 0,20-2,0 20-2000
Sumber: ISSS dalam Arsyad, 2006
Tekstur sedimen menentukan juga dalam daya dukung terhadap limbah. Semakin besar ukuran sedimen, maka kemampuan menerima limpasan limbah semakin besar. Hal ini berkaitan dengan kondisi oksidatif sedimen yang menyebabkan hasil degradasi bahan-bahan organik tidak akan bersifat toksik namun bisa lebih bermanfaat bagi organisme akuatik.
Tekstur sedimen halus memiliki daya dukung terhadap limpasan limbah semakin kecil. Hal ini karena sudah ada konsentrasi bahan organik yang halus didekomposisi sebelumnya. Masukan limbah (semakin banyak atau konstan) menyebabkan keadaan ’anoksik’ pada sedimen yang menyebabkan hasil dekomposisi bahan-bahan organik bersifat toksik bagi organisme akuatik.
Besar ukuran dan luas permukaan sedimen berpengaruh dalam proses kapasitas proses pertukaran ion logam dan ketersediaan logam secara alamiah ataupun penyerapan total organic carbon (TOC), besi (Fe) dan mangan (Mn) oksida, asam sulfida (H2S) serta logam-logam pencemar lainnya. Sedimen dengan ukuran partikel yang kecil (halus), seperti lumpur dan tanah umumnya memiliki ratio luas permukaan yang besar terhadap volumenya dan dapat menyerap logam jauh lebih banyak dibandingkan sedimen dengan ukuran besar, seperti pasir. Senyawa total organik karbon yang terdapat pada sedimen awalnya merupakan proses hasil dekomposisi alamiah tanaman dan hewan dan organik karbon dapat mengabsorpsi logam-logam perairan disamping juga senyawa organik lainnya (Liber et al., 1996 dalam KLH dan PKRKL-FMIPA-UI, 2005). Tinggi atau rendahnya kandungan materi organik dalam sedimen sangat berhubungan dengan kemampuan pengurangan bioavilitas dan toksisitas logam (Ankleyet et al., 1996 dalam KLH dan KRKL-FMIPA-UI, 2005).
Ion Fe dan Mn merupakan komponen utama logam yang terdapat dalam tanah maupun sedimen dan berada dalam endapan maupun terlarut. Melalui pergantian ion maka ke dua logam tersebut dapat mengalami pertukaran dengan logam-logam berat lainnya (Fan & Wang, 2001 dalam Bentivegna et al., 2004 ). Ion sulfida dapat berinteraksi dengan Fe dalam kondisi anaerob membentuk padatan (FeS), dan begitu pula logam tembaga (Cu), Timbal (Pb), Nikel (Ni) dan Seng (Zn) dapat digantikan oleh Fe membentuk endapan garam sulfida. Hasil mekanisme ini yang sering dijadikan sebagai parameter indikator dalam menentukan kualitas atau pencemaran sedimen.
Kondisi asam basa atau pH sedimen memiliki operasional sebagai aktivitas ion hidrogen. Kisaran pH normal pada ekosisitem laut berkisar 7.5-8.4. Pada kawasan pesisir yang memiliki muara sungai, rata-rata pH kurang dari 8.4 (Chester 1990). Nilai pH mengindikasikan ekosistem laut khususnya pesisir bersifat basa (lebih dari 7) dan banyak terdapat ion OH- yang menandakan suatu larutan bersifat basa. Berdasarkan skala waktu geologi, pH dikendalikan oleh kesetimbangan antara kolom air dan mineral alami yang ada di sedimen (Chester, 1990).
Relatif tingginya nilai pH pada kawasan pesisir dikarenakan lingkungan pesisir dipengaruhi oleh dua ekosistem besar. Pada daerah yang berhadapan langsung dengan daratan atau dengan lautan terbuka terdapat perbedaan nilai pH yang besar. Kondisi fisik sedimen juga mempengaruhi nilai pH, berkaitan dengan konsentrasi bahan-bahan organik yang ada di sedimen. Semakin kecil ukuran sedimen, nilai pH cenderung lebih rendah (asam) dan juga sebaliknya (Alongi, 1990).
2.4.3. Kualitas dan Sebaran Sedimen a. Kualitas Sedimen
Banyak polutan organik dan anorganik diperairan laut diserap oleh partikulat dalam air yang kemudian membentuk sedimen pada dasar laut. Masuknya bahan pencemar kelingkungan perairan dan terendapkan atau teradsorpsi pada permukaan sedimen, maka akan mengakibatkan terjadinya pengaruh/perubahan kualitas sedimen. Sehingga sedimen sering dijadikan sebagai proses akhir pembawaan persisten polutan kedalam lingkungan perairan. Sedimen sangat diperlukan bagi kehidupan biota laut, termasuk pula spesies penting makanan yang diperdagangkan.
Senyawa toksik yang terakumulasi dalam sedimen memiliki potensi yang berbahaya terhadap organisme laut dan bila dikonsumsi akan berbahaya bagi kesehatan bagi manusia. U.S. Environmental Protection Agency (EPA) sebelumnya telah menetapkan kriteria kualitas sedimen didasarkan pada situasi, atau kondisi tertentu, dimana total organic carbon sama atau melebihi 0,2 % dari berat sedimen kering (1998). U.S. EPA mendefinisikan bahwa sedimen yang terkontaminasi adalah sedimen perairan yang mengandung bahan kimia yang melebihi aspek kesesuaian perairan yang mengandung bahan kimia sedimen dan kesesuaian geokimiawi, toksikologi, kriteria kualitas sedimen dan kesesuaian pengukuran, atau dipertimbangkan sebaliknya memiliki sifat ancaman bahaya bagi kesehatan dan lingkungan . Ada beberapa alasan penting mengapa kriteria kualitas sedimen diperlukan untuk melengkapi kriteria kualitas perairan, seperti sejumlah kontaminan di badan air yang dapat terakumulasi pada tingkat berbahaya pada sedimen (Chapman , 1992).
Kualitas sedimen juga dapat mengintegrasikan gambaran konsentrasi (kuantitas) kontaminan dalam jangka panjang. Lebih jauh bahwa sedimen sangat penting bagi ekosistem perairan, lahan kehidupan, sumber hara, makanan bagi biota perairan. Demikian juga faktor kondisi lingkungan bentik yang terdiri dari cacing, krustasea, dan larva serangga yang hidup pada sedimen didasar badan air sering dijadikan salah satu indikator penting dalam menentukan kualitas sedimen diperairan. Dikarenakan sifat kontaminan yang dapat mematikan atau membuat stress organisme bentik, dan mengurangi ketersediaan makanan bagi hewan besar, sehingga kondisi keberadaan lingkungan bentik sering dijadikan indikator keberadaan kontaminan atau parameter kualitas sedimen dilingkungan perairan tersebut.
Namun demikian didalam menentukan kriteria kualitas penting diperhatikan terutama maksud dan tujuannya, hal ini dikarenakan sifat sedimen yang berubah-ubah yakni karena sifatnya yang dapat terlarut diperairan ataupun terendapkan kembali ke dasar air akibat adanya pengaruh lingkungan perairannya. Sehingga di dalam penentuan kriteria kualitas sedimen , beberapa hal perlu diperhatikan yaitu: adanya petunjuk yang digunakan dalam menentukan kualitas sedimen diantaranya berdasarkan sejauh mana efek/kerusakan biota dilingkungan perairan.
b. Logam dalam Sedimen
Logam memasuki sistem perairan sebagai akibat pelapukan batuan dan tanah, dari erupsi vulkanik dan berbagai aktivitas manusia, meliputi pertambangan, pengelolaan atau penggunaan logam dan/atau bahan yang mengandung logam. Logam berat pencemar yang paling utama adalah timbal, merkuri, kadmium, krom, arsen, dan tembaga. Terdapat berbagai jenis sumber polutan logam: sumber tak bergerak, dimana polutan berasal dari sumber tunggal (polusi terlokalisasi) yang dapat diidentifikasi. Sumber tipe kedua adalah sumber bergerak, dimana polutan berasal dari sumber terdispersi (dan seringkali sulit diidentifikasi). Terdapat beberapa contoh sumber pencemaran logam terlokalisasi, seperti pelapukan alamiah dari bijih batuan dan partikel logam yang berasal dari pabrik bertenaga bahan bakar batu bara, melalui cerobong asap di udara, air dan tanah di sekitar pabrik. Polusi logam dalam air paling umum berasal dari industri
pertambangan. Umumnya industri pertambangan menggunakan sistem drainase pertambangan asam untuk melepas logam berat dari bijihnya, karena logam umumnya sangat mudah larut dalam larutan asam. Setelah sistem drainase, larutan asam tersebut terdispersi dalam air tanah, mengandung logam dalam konsentrasi tinggi (KLH dan PKRKL-FMIPA-UI, 2005).
Berdasarkan kajian pendahuluan KLH dan PKRKL-FMIPA-UI (2005) dijelaskan bahwa jika pH dalam air menurun, kelarutan logam meningkat dan partikel logam menjadi lebih mudah terlepas. Hal ini menyebabkan logam bersifat lebih toksik dalam air lunak. Logam dapat menjadi “terkunci” di dasar sedimen, dan logam tersebut dapat bertahan selama bertahun-tahun. Aliran yang berasal dari drainase di wilayah pertambangan umumnya bersifat sangat asam dan mengandung logam terlarut dalam konsentrasi tinggi dengan sedikit kehidupan akuatik didalamnya. Kedua jenis pencemaran logam, baik yang terlokalisasi maupun terdispersi, dapat menyebabkan kerusakan lingkungan karena logam tidak dapat mengalami biodegradasi. Secara umum, bentuk ion suatu logam bersifat lebih beracun, karena dapat membentuk senyawa yang toksik dengan ion lainnya.
Beberapa logam seperti mangan, besi, tembaga, dan seng merupakan mikronutrien. Logam-logam tersebut bersifat esensial terhadap kehidupan dalam konsentrasi yang tepat, namun jika berlebih, bahan kimia tersebut dapat bersifat racun. Pada saat yang sama, paparan dalam konsentrasi rendah dan jangka panjang terhadap logam berat dapat menyebabkan efek kesehatan yang serius di waktu mendatang. Adanya toleransi terhadap logam juga telah diketahui dalam invertebrata dan dalam ikan.
Sedimen merupakan “adsorben alami” yang mampu mengikat senyawa-senyawa organik dan anorganik dalam konsentrasi tinggi. Pada kebanyakan ekosistem perairan, sedimen mengandung berbagai jenis kontaminan dalam konsentrasi yang tinggi, tergantung pada sifat-sifat adsorpsi dan desorpsi sedimen (Haerudin, 2006).
Jenis-jenis polutan yang dapat ditemukan dalam sedimen atas (US-EPA, 2004):
Nutrien, termasuk kedalamnya senyawa posfor dan nitrogen seperti ammonia. Kadar posfor yang tinggi dalam air dapat menyebabkan pertumbuhan alga
yang tidak terkendali. Bilamana alga mati dan mengalami dekomposisi, kandungan oksigen dalam air menurun tajam. Konsentrasi amoniak yang tinggi dapat meracuni hewan bentos
Hidrokarbon terhalogenasi atau senyawa-senyawa organik persisten, yaitu kelompok bahan kimia yang sulit diurai seperti DDT dan PCB
Hidrokarbon polisiklik aromatik (PAH = polycyclic aromatic hydrocarbon) yaitu kelompok bahan kimia yang dihasilkan oleh industri perminyakan dan hasil sampingannya
Logam termasuk kedalamnya besi, mangan, timbal, kadmium, seng dan raksa; metalloid seperti arsen dan selenium
Konsentrasi logam dalam sedimen biasanya mencapai 3 – 5 kali lebih tinggi dari konsentrasi logam dalam air di atasnya (Bryan and Langston, 1992 dalam Haerudin, 2006). Oleh karena itu identifikasi berbagai jenis logam yang berasal dari berbagai sumber pada kawasan pesisir, dapat diidentifikasi lebih cepat dengan menganalisis sedimen dibanding kuantifikasi konsentrasi logam yang terdapat dalam air (Forster and Wittmann, 1981 dalam Haerudin, 2006).
Sumber utama logam berat di dalam lingkungan ada 5 yaitu: erosi batuan, kegiatan industri pertambangan biji besi dan logam lainnya, pemanfaatan logam dan senyawaan logam dalam industri, pembakaran bahan bakar fosil dan leaching dari tempat pembuangan sampah (Wittman and Fotstner, 1980 dalam Haerudin, 2006). Logam berat dikelompokkan sebagai polutan konservatif oleh karena tidak dapat diurai oleh mikroba dan masih tersedia dalam taraf tertentu untuk tumbuhan dan hewan dan kadang-kadang menimbulkan efek yang berbahaya (Dryssen and Wedborg, 1980 dalam Haerudin, 2006).
Saat ini, baku mutu logam dalam sedimen belum ditetapkan dalam regulasi di Indonesia. Namun beberapa negara telah mengeluarkan quality guideline untuk logam dan organik dalam sedimen. NOAA (National Oceanographic and Atmospheric Administration) melalui program National Status dan Trends di US menetapkan pedoman mutu sedimen dengan pendekatan ERL (effects range-low) dan ERM (effects range-median). ERL adalah konsentrasi elemen logam atau organik dalam sedimen pada persentil kesepuluh yang tidak atau jarang menunjukkan efek toksisitas. Sementara ERM adalah
konsentrasi elemen logam atau organik dalam sedimen pada persentil kesepuluh yang menunjukkan efek toksik.
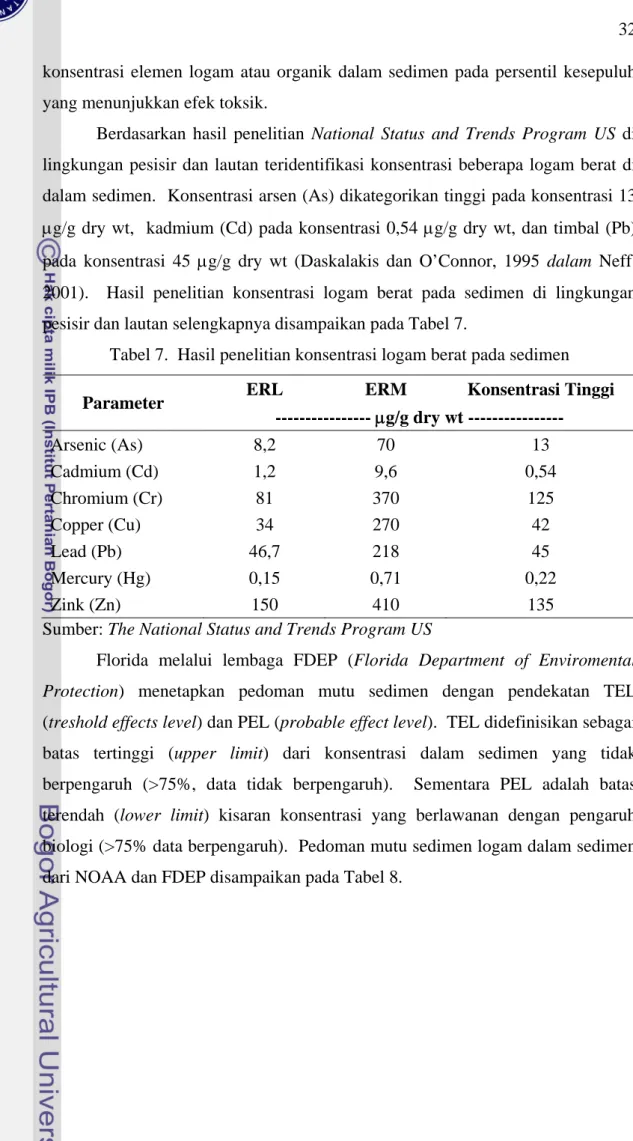
Berdasarkan hasil penelitian National Status and Trends Program US di lingkungan pesisir dan lautan teridentifikasi konsentrasi beberapa logam berat di dalam sedimen. Konsentrasi arsen (As) dikategorikan tinggi pada konsentrasi 13 μg/g dry wt, kadmium (Cd) pada konsentrasi 0,54 μg/g dry wt, dan timbal (Pb) pada konsentrasi 45 μg/g dry wt (Daskalakis dan O’Connor, 1995 dalam Neff, 2001). Hasil penelitian konsentrasi logam berat pada sedimen di lingkungan pesisir dan lautan selengkapnya disampaikan pada Tabel 7.
Tabel 7. Hasil penelitian konsentrasi logam berat pada sedimen
ERL ERM Konsentrasi Tinggi
Parameter --- μg/g dry wt --- Arsenic (As) 8,2 70 13 Cadmium (Cd) 1,2 9,6 0,54 Chromium (Cr) 81 370 125 Copper (Cu) 34 270 42 Lead (Pb) 46,7 218 45 Mercury (Hg) 0,15 0,71 0,22 Zink (Zn) 150 410 135
Sumber: The National Status and Trends Program US
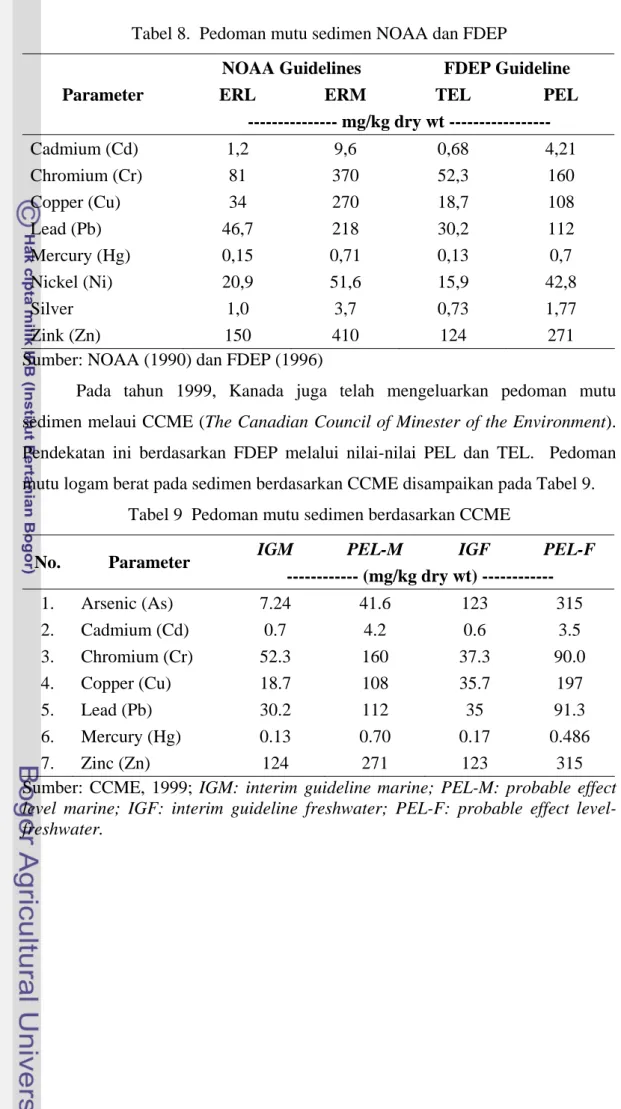
Florida melalui lembaga FDEP (Florida Department of Enviromental Protection) menetapkan pedoman mutu sedimen dengan pendekatan TEL (treshold effects level) dan PEL (probable effect level). TEL didefinisikan sebagai batas tertinggi (upper limit) dari konsentrasi dalam sedimen yang tidak berpengaruh (>75%, data tidak berpengaruh). Sementara PEL adalah batas terendah (lower limit) kisaran konsentrasi yang berlawanan dengan pengaruh biologi (>75% data berpengaruh). Pedoman mutu sedimen logam dalam sedimen dari NOAA dan FDEP disampaikan pada Tabel 8.
Tabel 8. Pedoman mutu sedimen NOAA dan FDEP
NOAA Guidelines FDEP Guideline
Parameter ERL ERM TEL PEL --- mg/kg dry wt --- Cadmium (Cd) 1,2 9,6 0,68 4,21 Chromium (Cr) 81 370 52,3 160 Copper (Cu) 34 270 18,7 108 Lead (Pb) 46,7 218 30,2 112 Mercury (Hg) 0,15 0,71 0,13 0,7 Nickel (Ni) 20,9 51,6 15,9 42,8 Silver 1,0 3,7 0,73 1,77 Zink (Zn) 150 410 124 271
Sumber: NOAA (1990) dan FDEP (1996)
Pada tahun 1999, Kanada juga telah mengeluarkan pedoman mutu sedimen melaui CCME (The Canadian Council of Minester of the Environment). Pendekatan ini berdasarkan FDEP melalui nilai-nilai PEL dan TEL. Pedoman mutu logam berat pada sedimen berdasarkan CCME disampaikan pada Tabel 9.
Tabel 9 Pedoman mutu sedimen berdasarkan CCME
IGM PEL-M IGF PEL-F No. Parameter --- (mg/kg dry wt) --- 1. Arsenic (As) 7.24 41.6 123 315 2. Cadmium (Cd) 0.7 4.2 0.6 3.5 3. Chromium (Cr) 52.3 160 37.3 90.0 4. Copper (Cu) 18.7 108 35.7 197 5. Lead (Pb) 30.2 112 35 91.3 6. Mercury (Hg) 0.13 0.70 0.17 0.486 7. Zinc (Zn) 124 271 123 315
Sumber: CCME, 1999; IGM: interim guideline marine; PEL-M: probable effect level marine; IGF: interim guideline freshwater; PEL-F: probable effect level-freshwater.
c. Sebaran Spasial Sedimen
Keberadaan lumpur di dasar perairan sangat dipengaruhi oleh banyaknya partikel tersuspensi yang dibawa oleh air tawar dan air laut serta faktor-faktor yang mempengaruhi penggumpalan, pengendapan bahan tersuspensi tersebut, seperti arus dari laut (Nybakken, 1988). Kebanyakan estuari didominasi oleh substrat lumpur. Selanjutnya dijelaskan bahwa lumpur yang terdapat didalam muara merupakan penjebak bahan organik yang baik. Knox (1986) menyatakan bahwa sedimen estuaria merupakan lingkungan yang sangat kompleks, karena sedimen yang berada di muara berasal dari beberapa sumber, meliputi dari daratan yang dibawa air sungai (fluvial sediment), dan sedimen dari laut (marine sediment).
Odum (1996) menyatakan bahwa nilai pH substrat erat hubungannya dengan bahan organik substrat, jenis substrat dan kandungan oksigen. Kecepatan arus secara tidak langsung mempengaruhi substrat dasar perairan. Nybakken (1988) menyatakan bahwa perairan yang arusnya kuat akan banyak ditemukan substrat berpasir.
Akumulasi logam berat ke dalam sedimen dipengaruhi oleh jenis sedimen. Tipe sedimen dapat mempengaruhi kandungan logam berat dalam sedimen, dengan kategori kandungan logam berat dalam lumpur>lumpur berpasir>berpasir (Korzeniewski & Neugabieuer, 1991 dalam Amin, 2002).
Aktivitas pertambangan timah di Telaga Tujuh Karimun, Kepulauan Riau hanya sedikit menyumbang logam Cu dan lebih banyak menyumbang logam Pb dan Zn. Namun demikian beberapa aktivitas seperti pelabuhan, pelayaran, pembuatan kapal, perikanan, dan pemukiman penduduk sudah mulai memberikan pengaruh peningkatan Cu (Efriyeldi, 1991).
Meador et al. (1998) menyatakan bahwa paling sedikit ada 4 faktor yang dapat mempengaruhi distribusi polutan dalam sedimen yaitu: ukuran butiran sedimen, status redoks, karbon organik dan bioturbasi. Konsentrasi logam berat pada lumpur (sedimen), tidak saja ditentukan oleh proses pelapukan batuan, tetapi juga dipengaruhi konsentrasi bahan organik, komposisi mineral serta ukuran (partikel) endapan lumpur tersebut (Togwell, 1979 dalam Haerudin, 2006).
Sedimen yang berukuran halus (clay dengan diameter 20 mikron) mampu menyerap polutan dalam jumlah yang lebih besar dibanding sedimen berukuran besar. Karbon mampu melakukan ikatan dengan sedimen dalam bentuk ikatan komplek, sehingga semakin tinggi konsentrasi karbon organik dalam sedimen, kemungkinan akan semakin tinggi konsentrasi polutan yang terdapat didalamnya.
Sedimen halus memiliki presentasi bahan organik yang lebih tinggi dibanding sedimen kasar. Hal ini berkaitan dengan kondisi lingkungan yang tenang, sehingga memungkinkan pengendapan sedimen lumpur yang diikuti oleh akumulasi bahan organik ke dasar perairan (Wood, 1987 dalam Haerudin, 2006). Dalam sedimen kasar kandungan bahan organik biasanya rendah, karena partikel halus tidak mengendap. Sedimen yang halus biasanya mempunyai kendungan bahan organik yang tinggi, karena adanya gaya tarik menarik elektronika antara partikel sedimen dengan partikel mineral, pengikatan oleh partikel organik dan pengikat oleh sekresi lendir organisme.
2.5. Bentos
2.5.1. Pengertian dan Klasifikasi Bentos
Bentos merupakan biota air yang sebagian atau seluruh hidupnya berada di dalam atau di dasar perairan yang pergerakannya relatif lambat. Namun cukup berperan sebagai makanan hewan dasar maupun akan berkembang menjadi dewasa sebagai kerang-kerangan. Makrozoobentos merupakan organisme penghuni dasar perairan yang relatif menetap atau tidak berpindah tempat. Dari segi mata rantai makanan makrozoobentos umumnya sebagai detritus feeder, filter feeder dan scavanger (pemakan bangkai). Dengan demikian, organisme hewani ini berperan dalam memanfaatkan kembali energi yang relatif akan hilang ke dasar perairan.
Nybakken (1988) menyatakan bahwa jenis substrat dan ukurannya salah satu faktor ekologi yang mempengaruhi kandungan bahan organik dan distribusi bentos. Semakin halus tekstur substrat semakin besar kemampuannya menjebak bahan organik. Selain itu, daerah yang kandungan bahan organiknya sangat tinggi berhubungan dengan daerah dimana banyak pemeliharaan kerang-kerangan (mussel), karena berhubungan erat dengan jumlah feses yang banyak dari mussel yang dipelihara (Lopez-Jamar 1981 dalam Efriyeldi, 1999).
Berdasarkan ukurannya, bentos dikelompokkan menjadi tiga kelompok, yaitu makrozoobentos (makrofauna) yang berukuran lebih besar dari 1 mm, meizoobentos (meiofauna) yang berukuran 0,1 – 1 mm dan mikrozoobentos (mikrofauna) berukuran lebih kecil dari 0,1 mm (Nybakken, 1988). Makrozoobentos terdiri dari banyak kelompok organisme di dasar termasuk dalam kelompok taksonomi, kelas Polychaeta, kelas Crustacea, filum Echinodermata dan kelas Mollusca.
Bentos ini dapat dikelompokkan menjadi dua, yaitu kelompok nabati yang disebut fitobentos dan kelompok hewani yang disebut zoobentos. Substrat dasar perairan terdiri dari sedimen lumpur, pasir, liat dan sedikit substrat keras, yang merupakan faktor yang berpengaruh langsung terhadap komposisi dan distribusi organisme bentos (Hawkes, 1978 dalam Mustamin, 2000).
Berdasarkan sebaran secara vertikal, bentos terbagi menjadi dua, yaitu epifauna, yaitu organisme dasar yang hidup pada permukaan substrat, dan infauna yaitu organisme yang hidup di dalam substrat dasar (Nybakken, 1988). Perkembangan maksimum dari epifauna dijumpai di daerah pasang surut, tetapi dapat juga meluas di daerah yang lebih dalam. Infauna mencapai perkembangan maksimum di daerah yang lebih dari kelompok epifauna (Odum, 1996).
Berdasarkan kebiasaan makan, makrozoobentos dapat dibagi menjadi dua kelompok, yaitu suspension feeders adalah makrozoobentos yang menyaring partikel-partikel yang melayang-melayang di perairan dan cenderung melimpah pada substrat berpasir yang mengandung sedikit bahan organik, sedangkan deposit feeders adalah organisme yang mempunyai sifat mengumpulkan detritius sebagai makanannya di dasar dan cenderung melimpah pada sedimen lumpur yang mengandung banyak bahan organik (Nybakken, 1988).
Romimohtarto dan Juwana (2005) menjelaskan bahwa bentos meliputi biota yang menempel, merayap, meliang di dasar laut yang menyebar dari garis pasut sampai abisal. Berdasarkan jenis makanannya, bentos dikelompokkan sebagai biota autotrof yaitu biota yang menghasilkan makanan sendiri dan heterotrof yaitu tidak menghasilkan makanan sendiri.
Pada umumnya makrozoobentos merupakan non selektif feeders, yaitu mengambil semua makanan yang ukurannya sesuai dengan ukuran mulutnya (Cummins, 1975; Levinton, 1982 dalam Mustamin, 2000). Berdasarkan makanannya makrozoobentos dikelompokkan menjadi 4 kelompok, yaitu: (a) Perumput dan penggaruk (grazers dan scraper): herbivora, pemakan alga dasar; (b) Shredder: pemakan detritius, berupa partikel berukuran relatif besar; (c) Pengumpul (collector): pemakan detritius berukuran kecil dan tersuspensi (filter); (d) Predator: pemangsa.
2.5.2. Zoobentos Sebagai Indikator Kualitas Perairan
Makrozoobentos hidupnya relatif menetap dan tidak dapat menghindar dari kontak dengan bahan pencemar serta jangka hidupnya relatif lama, oleh sebab itu makrozoobentos sangat representatif menduga pencemaran perairan (Price, 1979; Abel, 1989 dalam Mustamin, 2002). Beberapa keuntungan penggunaan makrozoobentos untuk menduga kualitas air yang tercemar, yakni:
a. Jumlahnya banyak dan terdiri dari berbagai jenis b. Gerakkannya relatif lambat
c. Siklus hidupnya relatif panjang
d. Kunci identifikasinya telah cukup berkembang, sehingga memungkinkan didapatkan organisme sampai pada tingkat takson yang dibutuhkan
e. Teknik samplingnya telah berkembang.
Dengan sifatnya yang relatif menetap, maka komunitas organisme makrozoobentos merupakan organisme yang paling menderita terkena dampak lingkungan perairan. Oleh karena itu, struktur komunitas makrozoobentos merupakan indikator yang baik bagi dampak lingkungan perairan.
Makrozoobentos mempunyai beberapa peranan dalam ekosistem perairan. Hewan ini mempunyai hubungan yang erat dengan sumberdaya perikanan melalui rantai makanan. Odum (1996) menyatakan bahwa hubungan tersebut berdasarkan rantai makanan detritius, yang dimulai dari organisme mati. Peranan lain adalah indikator biologis perubahan lingkungan.
Makrozoobentos mempunyai sifat kepekaan yang berbeda-beda terhadap berbagai jenis bahan pencemar, mempunyai kecepatan mobilitas yang rendah dan mudah ditangkap serta mempunyai kelangsungan hidup yang panjang (Hawkes, 1976 dalam Mustamin, 2000). Masuknya bahan pencemar ke dalam perairan termasuk ke dalam sedimen dapat menyebabkan ketidakseimbangan ekologis. Seberapa jauh akibat suatu pencemaran terhadap organisme dapat diketahui dengan analisis struktur komunitas (Krebs, 1978). Sebagai upaya untuk tetap hidup makrozoobentos akan beradaptasi terhadap lingkungan, termasuk berusaha untuk menghindari diri dari perubahan lingkungan yang jelek dan predator.
Bentos sebagai organisme dasar perairan mempunyai habitat yang relatif menetap. Perubahan kualitas air dan substrat tempat hidupnya sangat mempengaruhi komposisi dan kelimpahannya (Odum, 1996). Selanjutnya faktor yang sangat berpengaruh langsung terhadap komposisi dan distribusi organisme bentos terdiri dari sedimen lumpur, pasir, liat dan sedikit substrat keras. Deposit feeders cenderung melimpah pada sedimen lumpur yang mengandung banyak bahan organik, sedangkan suspension feeders melimpah pada substrat berpasir yang mengandung sedikit bahan organik (Nybakken, 1988).
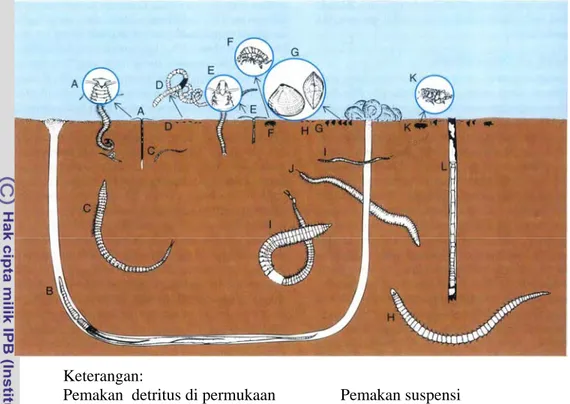
Hewan pemakan bahan-bahan tersuspensi mampu menyaring partikel dari kolom air. Partikel-partikel tersebut dapat berupa organisme plankton atau berbagai partikel organik yang tersuspensi kembali dari dasar pada saat gelombang lewat. Kelompok pemakan bahan tersuspensi yang dominan di pantai pasir yaitu moluska bivalva. Pada pasir datar yang terlindung, pemakan bahan suspensi termasuk bivalva kecil (Gemma) dan amfipoda (Nybakken, 2005). Beberapa jenis bentos di pantai pasir datar disampaikan pada Gambar 3.
Keterangan:
Pemakan detritus di permukaan Pemakan suspensi A. Spiophanes bombyx G. Gemma gemma
B. Saccoglossus kowalewskyi F. Protohaustorius deichmannae
E. Pygospio elegans K. Acanthohaustorius millsi
Pemakan detritus di dasar Pemakan detritus terdasar C. Aricidea sp. L. Clymenella torquata
D. Oligochaeta
H. Exogone hebes
I. Scoloplos spp.
J. Nephtys spp.