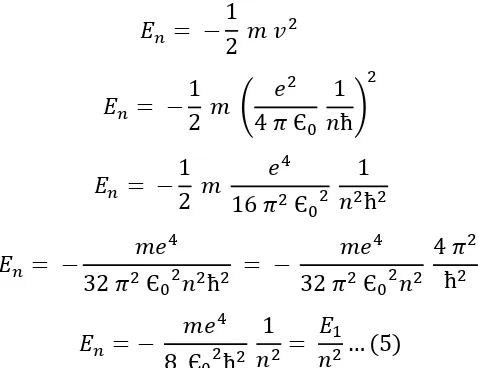LAPORAN PRAKTIKUM EKSPERIMEN FISIKA II DERET BALMER DARI SPEKTRUM ATOM HIDROGEN Diajukan untuk memenuhi salah satu tugas mata kuliah Eksperimen Fisika II
Dosen Pengampu : Drs. Parlindungan Sinaga, M.Si
Oleh :
Rahayu Dwi Harnum (1305957)
PELAKSANAAN PERCOBAAN :
Hari/Tgl/Jam : Senin / 7 Maret 2016 / 09.30 – 12.00 WIB Teman Sekelompok : Fauzan Muhammad Rabbani (1306865)
Rizki Fahmi Sumaryono (1307210)
LABORATORIUM FISIKA LANJUT PROGRAM STUDI FISIKA DEPARTEMEN PENDIDIKAN FISIKA
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS PENDIDIKAN INDONESIA
A. TUJUAN PERCOBAAN
Menentukan Harga Konstanta Rydberg dan Spektrum Atom Hidrogen B. DASAR TEORI
Deret Spektral
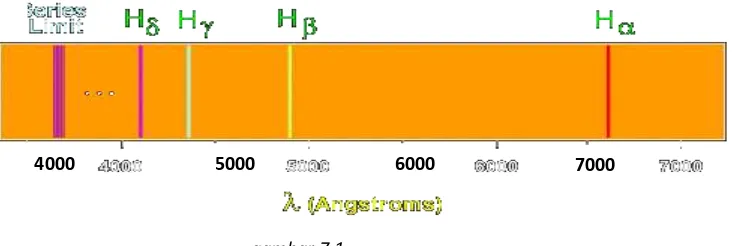
Panjang gelombang yang terdapat pada spektrum atomik jatuh pada kumpulan tertentu yang disebut deret spectral ditemukan pada akhir abad ke-19. Panjang gelombang dalam setiap deret dapat dispesifikasikan dengan rumus empiris yang sederhana. Deret spektral pertama ditemukan oleh J.J Balmer pada tahun 1885 ketika ia mempelajari bagian tampak dari spektrum hidrogen. Ia menempatkan gas hidrogen dalam sebuah tabung lucutan gas. Tabung tersebut diberi beda potensial yang tinggi antara katoda dan anodanya, sehingga terjadi lucutan muatan listrik. Gas hidrogen menjadi bercahaya dan memancarkan cahaya merah kebiru-biruan. Cahaya ini dapt dianalisis dengan sebuah spectrometer (alat untuk menyelidiki spektrum). Pada plat foto akan teramati deretan garis-garis cahaya. Setiap garis menampilkan sebuah panjang gelombang cahaya. Deretan garis-garis ini disebut dengan deret Balmer. Pengamatan tersebut menunjukan bahwa gas yang bersuhu tinggi memancarkan cahaya dengan spektrum garis yang memiliki garis keteraturannya sendiri. Spektrum gas juga dapat diperoleh dengan menempatkan gas itu didalam tabung yang diberi beda potensial cukup tinggi. Gambar berikut menunjukkan spektrum garis yang diperoleh dalam cahaya tampak (deret Balmer) :
Spektrum yang paling sederhana adalah spektrum gas hidrogen seperti gambar di bawah ini:
4000 5000 6000 7000
Gambar 2.3. Spektrum atom hidrogen
Pengamatan menunjukkan bahwa gas yang bersuhu tinggi memancarkan cahaya dengan spektrum garis yang memiliki garis keteraturannya sendiri. Spektrum gas juga dapat diperoleh dengan menempatkan gas itu di dalam tabung yang diberi beda potensial cukup tinggi.
Garis Spektrum
Hidrogen Panjang Gelombang (Å)
Frekuensi
Atom hidrogen merupakan atom yang paling sederhana, terdiri dari sebuah proton dan sebuah elektron. Pada tahun 1913 Neils Bohr mengajukan postulat tentang atom hidrogen sebagai berikut:
Berikut merupakan karakteristik dari atom Hidrogen:
1. Atom Hidrogen terdiri dari sebuah elektron yang bergerak dalam suatu lintas edar berbentuk lingkaran (orbit-orbit) mengelilingi inti atom; gerak elektron tersebut dipengaruhi oleh gaya tarik Coulomb sesuai dengan kaidah mekanika klasik.
Karena elektron yang beredar melalui lintasan cenderung mengarah ke pusat lingkaran yang disebabkan gaya tarik inti, maka dalam hal ini timbul gaya tarik menarik antara elektron dan inti atom. Gaya yang menyebabkan adalah gaya sentripetal dengan gaya coulomb.
Menurut Hukum I Newton :
∑ =
� =
Є = Dengan r = jarak elektron dengan inti. Bila q = e
Є =
= Є …
2. Lintas edar elektron (orbit) dalam atom Hidrogen yang mantap (keadaan stasioner) hanyalah yang mempunyai harga momentum anguler L sebesar:
= ħ Atau
= ħ Maka
= ħ…
3. Dalam lintas edar yang mantap elektron yang mengelilingi inti atom tidak memancarkan energi elektromagnet; dalam hal tersebut energi totalnya tidak berubah
4. Energi elektromagnet dipancarkan oleh atom apabila suatu elektron yang melintasi orbit mantap dengan energi Ei pindah (loncat) kesuatu orbit mantap lain yang
berenergi Ef
Substitusi persamaan (1) ke (2)
= Є
ħ
= Є ħ
= Є ħ …
Dengan r = jari-jari orbit elektron
Kemudian substitusi persamaan (3) ke persamaan (2) diperoleh:
= ħ = ħ Є ħ
=
Є ħ … Dimana v adalah kecepatan elektron mengelilingi inti.
Dengan mengeluarkan v dan r maka energi total sistem diperoleh : = + �
= − Є
= − Є
= − Є
= − Є − Є ħ
� = −
� = − Є ħ
� = −
Є ħ
� = −
Є ħ = − Є ħ
� = − Є ħ = …
Persamaan tersebut dikenal dengan persamaan tingkat energi terkoreksi bagi gerak inti, jika bilangan kuantum keadaan awal (energi lebih rendah) ialah ni dan bilangan kuantum keadaan akhir (energi lebih tinggi) ialah nf. Maka kita nyatakan bahwa
�� � � − �� � ℎ� = �� �
� − � = ℎ …
Gambar 3.3.
Pengukuran panjang gelombang yang dipancarkan oleh atom hidrogen tereksitasi didasarkan pada prinsip interferensi dengan menggunakan kisi-kisi. Interferensi konstruktif terjadi bila beda lintasan merupakan kelipatan dari panjang gelombangnya.
� = sin �
n = orde difraksi
Tetapan Rydberg menurut Bohr
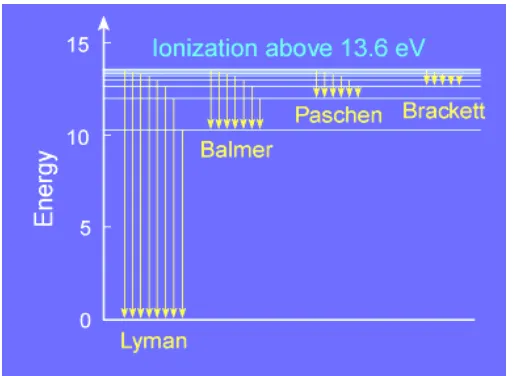
Bohr menemukan bahwa kehadiran tingkat energi diskrit tertentu dalam atom hidrogen menyarankan adanya hubungan dengan spektrum garis. Anggaplah jika sebuah elektron pada tingkat eksitasi jatuh ke tingkat yang lebih rendah, kehilangan energinya dipancarkan sebagai foton cahaya tunggal. Elektron tidak mungkin ada dalam atom kecuali elektron tersebut memiliki tingkat energi tertentu. Berikut suatu diagram tingat energi untuk atom hidrogen :
Jika bilangan kuantum keadaan awal (energi lebih tinggi) ialah nidan bilangan
kuantum keadaan akhir (energi lebih rendah) ialah nf , kita nyatakan bahwa : Substitusi
persamaan (5) ke persamaan (6) diperoleh
�− � = − �
� − � = ℎ
= −ℎ �
� − �
Bila c = . atau c maka
� = − ℎ � � − �
� = � � − � …
Dengan R menyatakan konstanta Rydberg
Bila nf= dan ni≥ maka seluruh garis-garis jatuh didaerah cahaya tampak
membentuk deret yang dinamakan deret Lyman. Bila nf= dan ni ≥ seluruh garis-garis akan jatuh didaerah cahaya tampak membentuk deret yang dinamakan deret Balmer.
Garis dengan panjang gelombang tersesar terletak didaerah merah, disebut Hα yang bersesuaian dengan ni = , selanjutnya H bersesuaian dengan ni = lalu H bersesuaian dengan ni = masing-masing terletak didaerah biru dan hijau, demikian seterusnya dan yang terkecil adalah Hδ yang terletak di daerah ultra ungu.
Pengukuran panjang gelombang yang dipancarkan oleh atom hidrogen tereksitasi didasarkan pada prinsip interferensi dengan menggunakan kisi-kisi. Interferensi konstruktif terjadi bila beda lintasan merupakan kelipatan dari panjang gelombangnya.
� = sin � n = orde difraksi
Lebar kisi dapat dihitung berdasarkan kisi difraksi (copy of Rawland Grating) yang digunakan. Dari persamaan (9) untuk deret Balmer nf= :
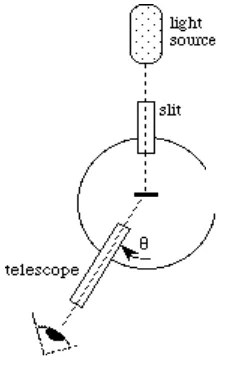
Pada percobaan kali ini, kita akan mencari panjang gelombang cahaya tampak dan besarnya tetapan Rydberg (R). Untuk melakukan percobaan ini, alat yang kita gunakan ialah spektrometer. Sketsa alat :
Sedangkan, untuk mencari tetapan Rydberg (R), kita gunakan prinsip interferensi dengan menggunakan kisi-kisi difraksi. Yang memenuhi hubungan :
sin
nd dengan n = orde difraksi (1,β,γ,….)
Untuk deret Balmer, kita mempunyai rumus :
2 2
Berdasarkan Least Squares :
C. ALAT DAN BAHAN
No Alat dan Bahan Spesifikasi Jumlah
1 Balmer Lamp (1500V, 50mA) 1
1. Menyiapkan alat dan bahan yang akan digunakan
2. Memposisikan lampu Balmer dan spektrometer agar berada pada satu garis lurus 3. Memasang dan memastikan kisi difraksi pada spectrometer agar tegak lurus terhadap
teropong .
4. Mengkalibrasi spektrometer dengan mengatur posisi nol derajat pada meja sudut dengan sudut variabel pada teropong.
5. Menghidupkan power lampu balmer sehingga cahayanya terdistribusikan ke kisi. 6. Mengamati spektrum warna yang terbentuk ,baik untuk posisi pergeseran ke kiri
maupun ke kanan dengan menggunakan teropong.
7. Menentukan titik tengah dari spectrum warna berupa terang pusat berwarna pink. 8. Menggeserkan teleskop kearah kanan atau kiri (dalam hal ini pengamat menggeserkan
teleskop kearah kanan) sampai terlihat garis-garis spektrum warna (orde 1). Menentukan salah satu warna cahaya ditengah-tengah medan pandang teleskop dan mencatat besar sudutnya.
9. Mengulangi langkah delapan untuk setiap spektrum warna yang terbentuk pada orde 1. 10.Menggeserkan lagi teleskop kearah kanan (sesuai arah menentukan orde pertama)
sehingga menemukan garis spketrum warna berikutnya (orde 2) serta mencatat sudut pada data percobaan.
E. DATA PENGAMATAN N =1000 per 10 mm
No Warna
�
n = 1 n = 2
1 Ungu 2.5 5.3
2 Biru 2.8 5.5
3 Hijau 3 -
4 Kuning 3.5 6.5
5 Merah 3.8 7.6
F. PENGOLAHAN DATA � =
= � = = − = −
� = sin �
No Warna � �
� � −
�̅ −
n = 1 n = 2 n =1 n = 2
1 Ungu 6 2 2.5 5.3 4.3619 4.6185 4.4902
2 Biru 5 2 2.8 5.5 4.8850 4.7923 4.8387
3 Hijau 4 2 3 - 5.2336 - 5.2336
4 Kunin
g 3 2 3.5 6.5
6.1049 5.6602 5.8826
5 Merah 3 2 3.8 7.6 6.6274 6.6128 6.6201
� = � ( − � )
� = � � −�
�̅ �̇ � − |� − �̅| |� − �̅|
4490.2 1.0022 - 0.06102 0.003723
4838.7 0.9834 - 0.07982 0.006371
5233.6 1.0191 - 0.04412 0.001947
5882.6 1.2239 0.16068 0.025818
6620.1 1.0875 0.02428 0.00059
� ̅ =1.06322 ∑ .
∆� = √∑|� − �̅|− = . = . −
Dari hasil data pengolahan menggunakan grafik didapatkan R = . ± . − dengan presentase kesalahan presisi
sebesar ∆̅ % = .
. = . % = . %
G. ANALISIS
Berdasarkan eksperimen yang telah dilakukan, warna yang teramati ialah warna
merah, kuning, hijau, biru, dan ungu dengan orde teramati maksimal dua. Panjang gelombang tiap warna yang didapatkan berbeda masing-masing, ungu = 4490.2 amstrong, biru = 4838.7 amstrong, hijau = 5233.6 amstrong, kuning = 5882.6 amstrong, merah = 6620.1 amstrong. Hal tersebut sesuai dengan literature bahwa panjang gelombang warna merah memiliki panjang gelombang paling panjang dibandingkan warna kuning, hijau, biru, ungu. Kemudian setelah panjang gelombang masing-masing warna diketahui, dapat diketahui konstanta Rydberg. Dengan menggunakan kisi 1000/10 mm konstanta Rydberg yang didapat ialah R = . ± . − dengan kesalahan presisi
sebesar ∆̅ % = .
. = . % = . % dan kesalahan akurasi terhadap
literature . − sebesar | . � 7− . � 7|
. � 7 % = . %. Perbedaan hasil eksperimen dengan literature konstanta Rydberg dipengaruhi oleh faktor ketidak telitian pengamat dalam penentuan warna yang diamati.
H. KESIMPULAN
Berdasarkan eksperimen yang telah dilakukan, dapat disimpulkan bahwa panjang gelombang tiap warna yang didapatkan berbeda. Besarnya masing-masing ialah ungu = 4490.2 amstrong, biru = 4838.7 amstrong, hijau = 5233.6 amstrong, kuning = 5882.6
amstrong, merah = 6620.1 amstrong. Konstanta Rydberg yang didapat ialah R = . ± . − dengan kesalahan presisi sebesar . % serta kesalahan
akurasi sebesar . %.
I. SARAN
Dalam melakukan praktikum Menentukan Harga Konstanta Rydberg dan Spektrum
yang berbeda. Hal tersebut bertujuan agar mengetahui pengaruh perbedaan kisi terhadap harga konstanta Rydberg.
J. DAFTAR PUSTAKA
Krane, Kenneth S. 1992. Fisika Modern. Jakarta : Universitas Indonesia Sinaga, Parlindungan, Drs. M.Si dkk. 2001. Petunjuk Praktikum Lab. Fisika