MAKALAH IKATAN KIMIA
“ TEORI VSEPR, HIBRIDISASI, ORDE IKATAN DAN MOLEKUL DIATOMIK HOMONUKLIR “
Disusun Oleh :
Citra Hardiyanti 1503123207
Nanang Kosim 1503113521
Gea Vini Alamanda 1403114807
Tezky Annisa 1503113401
Kelas C
Dosen Penganpu : Dr.Muhdarina, M.Si
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Riau
Kata Pengantar
Segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya kepada penulis, sehingga penulis dapat menyelesaikan makalah materi ikatan kimia.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada Dosen Pengampu mata kuliah Ikatan Kimia Ibu Dr.Muhdarina, M.Si selaku dosen serta kepada seluruh pihak yang telah ikut membantu penulis didalam menyelesaikan makalah ini.
Penulis menyadari bahwa makalah ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan makalah ini dan akhirnya penulis mengharapkan semoga makalah ini dapa tmemberikan manfaat bagi perkembangan ilmu pengetahuan.
Pekanbaru, Desember 2017
BAB I
PENDAHULUAN
A. Latar Belakang
Teori VSEPR (Valence Shell Electron Pair Repulsion) adalah suatu model kimia yang digunakan untuk menjelaskan bentuk-bentuk molekul kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron. Premis utama teori VSEPR adalah bahwa pasangan elektron valensi disekitar atom akan saling tolak menolak, sehingga susunan pasangan elektron tersebut akan mengadopsi susunan yang meminimalisasi gaya tolak menolak. . Teori VSEPR menekankan pada kekuatan tolak menolak diantara pasangan - pasangan elektron pada atom pusat urutan kekuatannya adalah sebagai berikut : Pasangan Elektron Ikatan (PEI) ; Pasangan Elektron Bebas (PEB), sehingga kekuatan tolakan antara PEI vs PEI< PEI vsPEB < PEB vs PEB.Minimalisasi gaya tolakan antar pasangan elektron ini akan menentukan geometri molekul. Jumlah pasangan elektron di sekitar atom disebut sebagai
bilangan sterik.
Teori VSEPR biasanya akan dibandingkan dengan teori ikatan valensi yang mengalamatkan bentuk molekul melalui orbital yang secara energetika dapat melakukan ikatan. Teori ikatan valensi berkutat pada pembentukan ikatan sigma dan pi. Teori orbital molekul adalah model lainnya yang digunakan untuk menjelaskan bagaimana atom dan elektron tersusun menjadi molekul dan ion poliatomik.
Dalam kimia, hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul.Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.Sangatlah penting untuk dicatat bahwa orbital adalah sebuah model representasi dari tingkah laku elektron-elektron dalam molekul. Dalam kasus hibridisasi yang sederhana, pendekatan ini didasarkan pada orbital-orbital atom hidrogen. Orbital-orbital yang terhibridisasikan diasumsikan sebagai gabungan dari orbital-orbital atom yang bertumpang tindih satu sama lainnya dengan proporsi yang bervariasi. Orbital-orbital hidrogen digunakan sebagai dasar skema hibridisasi karena ia adalah salah satu dari sedikit orbital yang persamaan Schrödingernya memiliki penyelesaian analitis yang diketahui.
B. Rumusan Masalah
1. Bagaimana cara menentukan bentuk molekul berdasarkan teori VSEPR? 2. Apa yang dimaksud dengan teori hibridisasi ?
3. Apa saja macam-macam hibridisasi ?
6. Apa perbedaan ikatan dalam molekul diatomik homonuklir dan ikatan dalam molekul diatomik hoteronuklir ?
C. Tujuan
1. Mengetahui cara menentukan bentuk molekul berdasarkan teori VSEPR. 2. Mengetahui dan memahami pengertian teori hibridisasi.
3. Mengetahui jenis - jenis hibridisasi. 4. Mengetahui cara pembuatan hibridisasi. 5. Mengetahui pengaruh hibridisasi.
BAB II
ISI
2.1 VSEPR
A. Struktur Molekul : Model VSEPR
Struktur dari molekul sangat penting untuk menentukan sifat kimianya. Banyak metode yang digunakan untuk menentukan struktur molekul, penyusunan atom dalam molekul tiga dimensi. Model ini disebut sebagai model VSEPR ( valence shell electron pair repulsion ), yang digunakan untuk memprediksi geometri dari molekul yang terbentuk dari nonlogam. Postulat dari model ini yaitu “ prinsip penentuan struktur atom dengan dorongan pasangan elektron minimal.
B. Tahapan Menggunakan Model VSEPR 1. Gambarkan struktur lewis molekul.
2. Hitung pasangan elektron disekitar atom pusat, dan susun mereka dengan tolakan yang minimal.
3. Tentukan posisi atom dari pasangan elektron yang terbagi. 4. Beri nama struktur molekul tersebut dari posisi atomnya.
Cara menggunakan model VSEPR
1. Contoh NH3, Gambarkan struktur lewisnya
2. Hitung pasangan elektron dan atur dalam tolakan yang minimal. Molekul NH3 memiliki 4 pasang elektron dimana ada 3 pasang elektron ikatan dan 1pasang tidak ikatan.
3. Tentukan posisi atom. Atom H mengalami tolakan dari pasangan elektron bebas yang terdapat diatas atom nitrogen
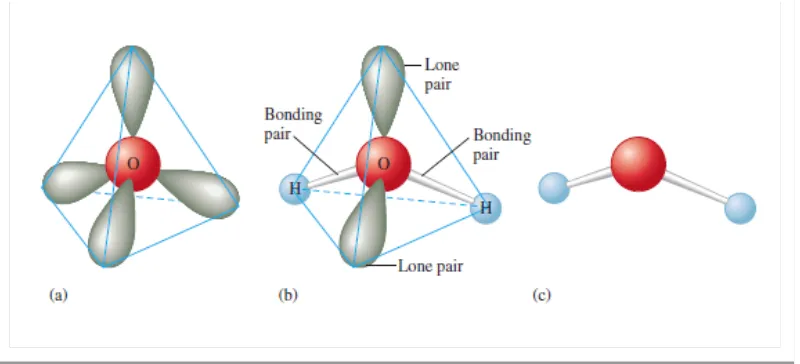
Gambar a menunjukkan susunan tetrahedral dengan empat pasangan elektron disekeliling oksigen dalam molekul air. Gambar b menyatakan dua pasang elektron yang dibagi dengan atom oksigen dan atom hidrogen, dan dua pasang elektron bebas. Gambar c menunjukkan struktur molekular V-Shaped dari molekul air.
2.2 Hibridisasi
A. sp Hibridisasi
Jenis hibridisasi lain terjadi pada karbon dioksida, yang memiliki Struktur Lewis berikut:
Pada molekul CO2 atom karbon memiliki dua pasang efektif yang tersusunpada sudut 180 derajat. Olehkarena itu kita membutuhkan sepasang orbital atom yang berorientasi pada arah yang berlawanan. Inimemerlukan jenis hibridisasi baru, karena orbital hibrida sp3 maupun sp2 tidak sesuai dengan kasus ini.Memperoleh dua orbital hibrida yang diatur pada 180 derajat memerlukan hibridisasi sp, yang melibatkanorbital satu s dansatu orbital p, seperti ditunjukkan secara skematis pada Gambar 1.
Dalam hal model ini, dua pasangan efektif di sekitar atom akan selalu mensyaratkan hibridisasi sp dari atom tersebut. Orbital sp karbon dalam karbondioksida ditunjukkan pada Gambar 2, dan tingkat energi orbital yang sesuai diagram untuk formasi mereka.Orbital hibrida sp adalah digunakan untuk membentuk σ ikatan antara karbon dan atom oksigen. Perhatikan itu dua orbital 2p tetap tidak berubah pada karbon hibridisasi sp. Mereka digunakan untuk membentuk ikatan π ke atom oksigen.
Gambar2
Dalam molekul CO2 masing-masing atom oksigen memiliki tiga pasang efektif itu, membutuhkan susunan planar trigonal dari pasangan.Sejak satu set trigonal Orbit hibrid sesuai dengan hibridisasi sp2, masing-masing atom oksigen bisa diasumsikan sp2 hibridisasi. Orbital pada setiap oksigen tidak berubah proses hibridisasi digunakan untuk ikatan π dengan atom karbon.
Sekarang kita siap untuk memperhitungkan struktur karbondioksida Lewis.Orbital sp pada bentuk karbon ikatan σ dengan orbital sp2 pada dua oksigen atom (Gambar 2).Orbital sp2 yang tersisa pada atom oksigen terus pasangan lone.Ikatan π antara atom karbon dan masing-masing atom oksigen dibentuk oleh tumpang tindih orbital 2p
Gambar3.Orbital hibrida pada molekul CO2dan Diagram tingkat energi orbital untuk pembentukan orbital hibrida sp karbon.
paralel.Atom karbon hibridisasi sp memiliki dua orbital p yang tidak terhibridisasi, digambarkan pada Gambar 4.Masing-masing orbital p ini digunakan untuk membentuk sebuah ikatan π dengan atom oksigen (lihat Gambar 5).
Perhatikan bahwa gambar ikatan ini dengan rapi menjelaskan susunan elektron diprediksi oleh struktur Lewis.
Hal ini berguna untuk mengingatkan kita pada saat ini bahwa karena kita menggunakan model ikatan yang sangat sederhana, gambaran molekul yang kita dapatkan dari model ini adalah perkiraan. Molekul karbon dioksida memberikan contoh yang bagus. Berbagai jenis bukti menunjukkan bahwa kerapatan elektron di sekitar dua ikatan CO di CO2 sebenarnya berbentuk silindris simetris - yaitu, kerapatan elektron homogen di sekitar sumbu molekul OCO.
B. Hibridisasi sp2
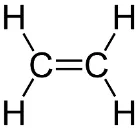
Senyawa karbon ataupun molekul lainnya dapat dijelaskan seperti yang dijelaskan pada metana. Misalnya etilena (C2H4) yang memiliki ikatan rangkap dua di antara karbon-karbonnya. Struktur Kekule metilena akan tampak seperti:
Gambar 4. Struktur metilen dengan karbon ikatan
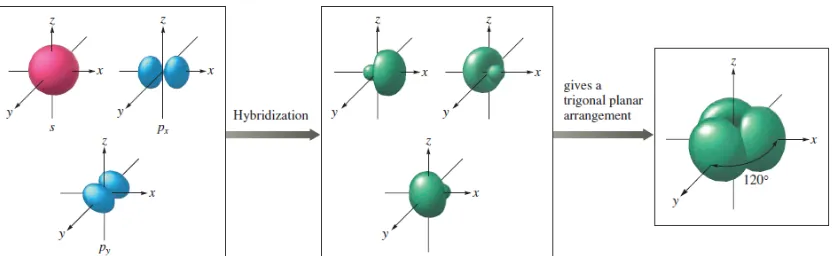
Karbon akan melakukan hibridisasi sp2 karena orbtial-orbital hibrid hanya akan membentuk ikatan sigma (σ) dan satu ikatan pi (π) seperti yang disyaratkan untuk ikatan rangkap dua di antara karbon-karbon. Ikatan hidrogen-karbon memiliki panjang dan kuat ikat yang sama. Dalam hibridisasi sp2, orbital 2s hanya bergabung dengan dua orbital 2p:
Sehingga membentuk orbital sp2 dengan satu orbital p tersisa. Dalam etilena, dua atom karbon membentuk sebuah ikatan sigma dari tumpang tindih dengan dua orbital sp2karbon lainnya dan setiap karbon membentuk dua ikatan kovalen dengan hidrogen dengan tumpang tindih s-sp2 yang bersudut 120°, membentuk geometri trigonal planar.
Gambar4.Orbital dari sp hibridisasi atom karbon.
Gambar 5. Hibridisasi atom s, px dan py hasi dari formasi tiga sp2 dengan orbital pusat xy dengan sudut 1200 dan membentuk trigonal planar...
Ikatan pi antara atom karbon tegak lurus dengan bidang molekul dan dibentuk oleh tumpang tindih 2p-2p (namun, ikatan pi boleh terjadi maupun tidak). Pada formasi orbital sp2, satu orbital 2p pada karbon tidak digunakan. Hal ini menunjukkan bahwa p yakni orbital pz berorientasi tegak lurus pada orbital sp2.
Gambar 6. Diagram tingkat energi orbital
C. Hibridisasi sp3
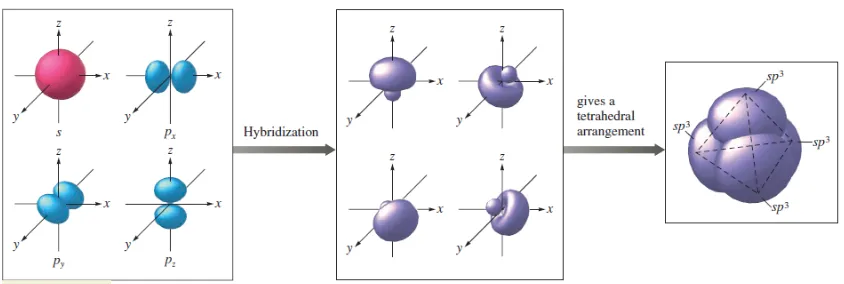
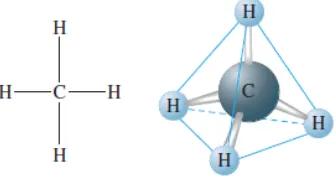
Hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul. Konsep ini adalah bagian tak terpisahkan dari teori ikatan valensi.Hibridisasi menjelaskan atom-atom yang berikatan dari sudut pandang sebuah atom.Sebagai contoh dapat dilihat pada senyawa metana. Atom karbon memiliki konfigurasi elektron 1s2 2s2 2p2 atau dalam bentuk orbital:
Gambar 1. Diagram hibridisasi sp3
Gambar 2. Orbital valensi pada atom C 2s, 2px, 2py dan 2pz serta tumpang tindih orbital.
Pembentukan orbital hybrid melalui proses hibridisasi adalah sebagai berikut :
1. Salah satu electron yang berpasangan berpromosi ke orbital yang lebih tinggi tingkat energinya sehingga jumlah electron yang tidak berpasangan sama dengan jumlah ikatan yang akan terbentuk. Atom yang sedemikian disebut dalam keadaan tereksitasi. Promosi yang mungkin adalah dari ns ke np dan ns ke ns ke nd atau (n-1) 2. Penggabungan orbital mengakibatkan kerapatan electron lebih besar di daera orbital
hybrid.
3. Terjadi tumpang tindih orbital hybrid dengan orbital atom lain sehingga membentuk ikatan kovalen atau kovalen koordinasi.
Gambar 3. Bentuk geometri dari struktur metana (CH4)
Maka bisa dilihat bahwa pada setiap orientasi orbital-orbital p, sebuah hidrogen tunggal akan bertumpang tindih sebesar 25% dengan orbital-s C dan 75% dengan tiga orbital-p C. Hal ini sama dengan persentase relatif antara s dan p dari orbital hibrid sp3 (25% s dan 75% p).
D.dsp3 Hibridisasi
Pada bagian ini kita akan menjelaskan orbital hibrid yang terlibat saat orbital 3d diasumsikan berpartisipasi dalam ikatan. Pertama kita akan mempertimbangkan phosphorus pentachloride (PCl5). Struktur Lewis tradisional untuk PCl5 (dengan asumsi partisipasi orbital d)
Menunjukkan bahwa atom fosfor dikelilingi oleh lima pasang elektron. Karena pada model VSEPR lima pasang memerlukan pengaturan bipyramidal trigonal, kita membutuhkan satu set atomit orbital trigonal bipiramida pada fosfor. Kumpulan orbital semacam itu dibentuk oleh hibridisasi dsp3 dari satu orbital, satu orbital s, dan tiga orbital p, seperti ditunjukkan pada Gambar 6.
Meskipun tidak penting untuk tujuan kita, himpunan orbital hibrida dsp3 berbeda dari hibrida yang telah kita pertimbangkan sejauh ini sehingga orbital hibrida yang menunjuk ke simpul segitiga (sering disebut tiga orbital hulu khatulistiwa) sedikit berbeda pada bentuk dari dua lainnya (orbital aksial). Situasi ini berlawanan dengan Gambar 6.Satu set orbital hibrida dsp3 pada atom fosfor. Perhatikan bahwa himpunan
rangkaian hibrida sp, sp2, dan sp3 dimana masing-masing orbital dalam bentuk tertentu identik bentuknya dengan yang lain.
Atom fosfor hibrid dsp3 dalam molekul PCl5 menggunakan lima atomnya orbital dsp3 untuk berbagi elektron dengan lima atom klorin. Catatbahwaenurutmodel ini adalahsatu set dari lima pasang efektif di sekitar atom tertentu selalu membutuhkan pengaturan bipyramidal trigonal, yang pada gilirannya melibatkan dsp3
hibridisasi atom itu.
Struktur Lewis untuk PCl5 menunjukkan bahwa masing-masing atom klorin dikelilingi oleh empat pasang elektron. Ini memerlukan pengaturan tetrahedral, yang pada gilirannya membutuhkan satu set dari empat orbital sp3 pada masing-masing atom klorin. Sekarang kita bisa menggambarkan ikatan molekul PCl5. Lima PCl ikatan σ dibentuk dengan membagi elektron antara orbital dsp3 pada atom fosfor dan orbital sp3 pada masing-masing klorin. Orbital sp3 lainnya pada masing-masing klorin memegang satu pasang.
E.d2sp3 Hibridisasi
Selanjutnya, kita mempertimbangkan sulfur hexafluorida (SF6), yang memiliki struktur Lewis tradisional.
Ini memerlukan susunan pasangan oktahedral dan, pada gilirannya, satu oktahedral dari enam orbital hibrid. Hal ini menyebabkan hibridisasi d2sp3, di mana dua d orbital,
orbital satu s, dan tiga orbital p digabungkan (lihat Gambar 7). Perhatikan bahwa enam pasangan elektron di sekitar atom selalu disusun secara oktahedral, yang mensyaratkan hibridisasi d2sp3 atom. Setiap orbital d2sp3 pada atom belerang digunakan untuk mengikat atom fluor. Karena ada empat pasang pada setiap atom fluorin, atom fluorin diasumsikan bersifat sp3 hibridisasi.
Atom menyesuaikan untuk memenuhi "kebutuhan" molekul. Saat mempertimbangkan dengan ikatan dalam molekul tertentu, oleh karena itu, kita selalu memulai dengan molekul daripada komponen atom. Dalam molekul, elektron diatur untuk memberi masing-masing atom konfigurasi gas mulia jika memungkinkan dan untuk meminimalkan muntahan pasangan elektron. Kami kemudian berasumsi bahwa atom menyesuaikan orbital mereka dengan hibridisasi agar molekul dapat mengadopsi
Gambar4 Gambar5 Gambar6
Menggambarkan Molekul dengan Model Elektron Lokalisasi : 1. Gambarkan struktur Lewis (s)
2. Tentukan susunan pasangan elektron dengan menggunakan model VSEPR
3. Tentukan orbital hibrida yang dibutuhkan untuk mengakomodasi pasangan elektron. Dalam menerapkan model LE, kita tidak boleh terlalu menekankan karakteristik atom yang terpisah. Atom tertentu yang berasal dari elektron valensi tidak penting; Yang penting adalah di mana mereka dibutuhkan dalam molekul untuk mencapai stabilitas maksimal.
2.3 Model Orbital Molekuler
Harus jelas sekarang bahwa model LE bernilai sangat besar dalam menafsirkan struktur dan ikatan molekul. Namun, ada beberapa masalah dengan model ini pada tingkat perkiraan ini. Misalnya, karena salah mengasumsikan bahwa elektron dilokalisasi, konsep resonansi harus ditambahkan. Selain itu, model ini tidak mudah menangani molekul yang mengandung elektron tak berpasangan. Dan akhirnya, model dalam bentuk ini tidak memberikan informasi langsung tentang energi ikatan.
Model lain yang sering digunakan untuk menggambarkan ikatan adalah model orbital molekul. Untuk mengenalkan asumsi, metode, dan hasil dari model ini, kita akan mempertimbangkan molekul paling sederhana dari semua, H2, yang terdiri dari dua proton dan dua elektron. Molekul yang sangat stabil, H2 lebih rendah energi daripada atom hidrogen yang dipisahkan oleh 432 kJ / mol.
Namun, meski diformulasikan dengan mudah, masalah ini tidak bisa dipecahkan dengan tepat. Kesulitannya sama dengan yang dihadapi dalam berurusan dengan atom polielektronik - masalah korelasi elektron. Karena kita tidak dapat menjelaskan detail gerakan elektron, kita tidak dapat mengatasi interaksi elektron-elektron dengan cara tertentu. Kita perlu membuat perkiraan yang memungkinkan pemecahan masalah tapi itu tidak merusak integritas fisik model. Keberhasilan pendekatan ini dapat diukur hanya dengan membandingkan prediksi dari teori dengan pengamatan eksperimental. Dalam hal ini kita akan melihat bahwa model yang disederhanakan bekerja dengan baik.
Sama seperti orbital atom adalah solusi untuk pengobatan kuantum mekanik atom, orbital molekul (MOs) adalah solusi untuk masalah molekuler. MO memiliki banyak karakteristik yang sama dengan orbital atom. Dua yang paling penting adalah (1) mereka dapat menahan dua elektron dengan putaran yang berlawanan dan (2) kuadrat dari fungsi gelombang orbital molekul menunjukkan probabilitas elektron.
Seperti dalam penerapan mekanika kuantum pada atom terisolasi, perlakuan orbital MO dapat dilakukan pada berbagai tingkat kecanggihan. Dalam uraian kita tentang model ini, kita akan mengasumsikan bahwa MOs untuk H2 dibuat menggunakan orbital hidrogen 1s. Kita mengatakan bahwa orbital 1s membentuk "basis set" untuk MOs. Pengobatan yang lebih rinci akan menggunakan basis dasar yang berbeda-satu di mana bagian radial orbital atom diizinkan bervariasi untuk mencapai energi terendah MO untuk molekul hidrogen. Namun, untuk menghindari komplikasi sebanyak mungkin, saat kita membahas gagasan mendasar dari deskripsi MO tentang molekul, kita akan menggunakan versi sederhana dari model ini.
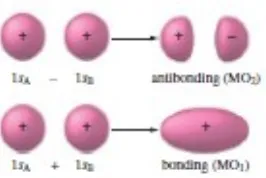
Sekarang kita akan menggambarkan ikatan molekul hidrogen dengan menggunakan model MO. Langkah pertama adalah untuk mendapatkan orbital molekul hidrogen, sebuah proses yang sangat disederhanakan jika kita mengasumsikan bahwa MO dapat dikonstruksi dari orbital hidrogen 1s.Dalam perkiraan ini dari molekul hidrogen, dua hasil MOs:
dimana 1sA dan 1sB mewakili orbital 1s dari dua hidrogen terpisah atom. Proses ini ditunjukkan secara skematis pada Gambar 8. bersamaan dengan fase dari orbital.
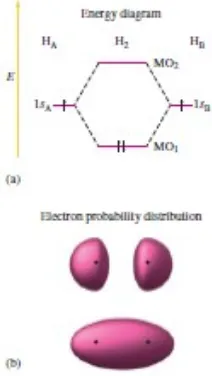
Sifat orbital yang paling diminati adalah ukuran, bentuk (dijelaskan oleh distribusi probabilitas elektron), dan energi. Sifat-sifat ini untuk hidrogen MOs ditunjukkan pada Gambar 9.
Dari gambar ini kita bisa mencatat beberapa poin penting:
1. Probabilitas elektron kedua MO berpusat di sepanjang garis yang melewati dua inti. Untuk MO1, probabilitas elektron terbesar ada di antara nukleus. Dalam kasus ini, fase pencocokan orbital menghasilkan gangguan konstruktif dan kemungkinan elektron yang ditingkatkan antara kedua inti. Untuk MO2, ini berpusat di sepanjang sumbu molekul tapi di luar area antara dua inti. Dalam kasus ini, fasa yang tidak cocok menghasilkan gangguan destruktif yang mengarah ke simpul dalam probabilitas elektron antara dua inti. Dalam kedua MOs kerapatan elektron memiliki simetri silinder sehubungan dengan sumbu molekuler. Artinya, probabilitas electronadalah sama sepanjang garis yang ditarik tegak lurus terhadap sumbu ikatan pada titik tertentu pada sumbu. Distribusi elektron simetrik berbentuk silinder ini digambarkan sebagai sigma (σ), Seperti pada model elektron lokal. Dengan demikian, kita mengacu pada MO1 dan MO2 sebagai sigma (σ) MOs.
2. Dalam molekul, hanya MO yang tersedia untuk pendudukan oleh elektron. Orbital atom 1s tidak lagi ada karena molekul H2 - entitas baru - memiliki orbital baru sendiri. 3. MO1 lebih rendah energi daripada orbital 1s atom hidrogen bebas, namun MO2 lebih
tinggi energi daripada orbital 1s. Fakta ini memiliki implikasi yang sangat penting bagi stabilitas molekul H2: Jika kedua elektron (satu dari setiap atom hidrogen) menempati energi rendah MO, mereka akan memiliki energi lebih rendah daripada yang ada di dua atom hidrogen yang terpisah. Situasi ini mendukung pembentukan molekul karena alam cenderung mencari energi terendah. Artinya, kekuatan pendorong pembentukan molekul di sini adalah bahwa MO yang tersedia pada dua elektron memiliki energi yang lebih rendah daripada orbital atom yang dimiliki elektron ini dalam atom yang terpisah. Situasi ini adalah ikatan "pro".Di sisi lain, jika kedua elektron dipaksa untuk menempati MO energi yang lebih tinggi, mereka pasti Gambar 8.(a) diagram tingkat energi MO untuk molekul H2. (b) Bentuk MOs adalah
akan menjadi ikatan "anti". Dalam hal ini elektron ini akan memiliki energi yang lebih rendah dalam atom yang terpisah daripada molekul; Dengan demikian negara yang dipisahkan akan disukai. Tentu saja, karena energi rendah MO1 tersedia, kedua elektron tersebut menempati MO tersebut dan molekul yang dihasilkan stabil. Kita telah melihat bahwa molekul molekul hidrogen terbagi menjadi dua kelas: ikatan dan antibondasi. MO ikatan lebih rendah energi daripada orbital atom yang terbentuk. Elektron dalam jenis orbital ini menyukai molekul; Artinya, mereka akan menyukai ikatan. MO antibonding lebih tinggi energi daripada orbital atom yang terbentuk. Elektron dalam jenis orbital ini akan menyukai atom yang dipisahkan (antibondasi). Gambar 10. mengilustrasikan gagasan ini.
4. Gambar 9. menunjukkan bahwa untuk ikatan MO pada molekul H2, elektron memiliki probabilitas terbesar berada di antara inti. Inilah yang akan kita harapkan, karena elektron dapat menurunkan energinya dengan secara bersamaan tertarik oleh kedua nukleus. Di sisi lain, distribusi elektron untuk MO antibonding sedemikian rupa sehingga elektron terutama berada di luar ruang antara nuklei. Distribusi jenis ini diharapkan tidak memberikan kekuatan ikatan apapun. Sebenarnya, ini menyebabkan elektron menjadi lebih tinggi dalam energi daripada di atom yang terpisah. Dengan demikian model MO menghasilkan distribusi elektron dan energi yang sesuai dengan gagasan dasar kita tentang ikatan. Fakta ini meyakinkan kita bahwa model itu masuk akal secara fisik.
2.4 Orde Ikatan
Pada dasarnya, molekul terbentuk karena memiliki energi lebih rendah dari pada dipisahkan atom. Pada model MO sederhana ini tercermin dari jumlahikatan elektron (yang mencapai energi rendah dalam pergi dari bebasatom ke molekul) versus jumlah elektron antibondasi (yang itulebih tinggi energi dalam molekul daripada di atom bebas). Jika jumlahelektron ikatan lebih besar dari jumlah elektron antibondasi dalam aMolekul yang diberikan, molekulnya diprediksi stabil.
Indikator kuantitatif stabilitas molekuler (kekuatan ikatan) untuk di-molekul atom adalah urutan ikatan: perbedaan antara jumlah ikatan elektron dan jumlah antibonding elektron, dibagi dengan 2.
Orde Ikatan = Jumlah e- berikatan – Jumlah e- tak berikatan
Kita membagi 2 karena kita terbiasa memikirkan ikatan dalam bentuk pasangan elektron.
Pesanan obligasi merupakan indikasi kekuatan obligasi karena mencerminkan perbedaan antara jumlah elektron ikatan dan jumlah anti-ikatan elektron, yang pada gilirannya mencerminkan kuantitas energi yang dilepaskan saat molekul terbentuk dari atom-atomnya. Oleh karena itu, order obligasi yang lebih besar mengindikasikan kekuatan ikatan yang lebih besar Karena molekul H2 memiliki dua ikatan elektron dan tidak ada antibondingelektron, urutan ikatannya adalah 1:
Orde Ikatan = 2−20 = 1
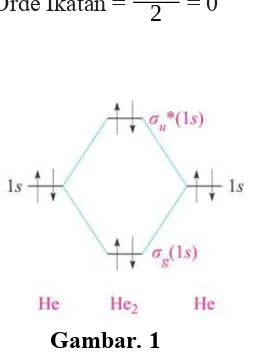
Sekarang kita akan menerapkan model MO ke molekul helium (He2). ApakahModel ini memprediksi bahwa molekul ini stabil? Karena atom Dia memiliki 1s2 konfigurasi, orbital 1s digunakan untuk membangun MOs. Oleh karena itu, elektron. Dari diagram yang ditunjukkan pada Gambar. 1, itu Jelas bahwa dua elektron dinaikkan dalam energi dan dua diturunkan dalam energi.
Orde Ikatan = 2−22 = 0
Gambar. 1
A. Ikatan Molekul Homonuklir Diatomik
Pada bagian ini kita mempertimbangkan molekul diatomikhomonuklear (yang tersusun dari dua atom identik) yang dibentuk oleh unsur-unsur pada Periode 2 dari tabel periodik. Atom lithium memiliki 1s2 2s1 konfigurasi elektron, dan dari diskusi. Pada bagian sebelumnya, tampaknya logis untuk menggunakan Li 1s dan 2s untuk membentuk MO dari molekul Li2. Namun, orbital 1s di Atom lithium jauh lebih kecil dari orbital 2s dan oleh karena itu tidak terlalu banyak.
Prinsip umum berikut ini berlaku: Untuk berpartisipasi dalam orbital molekul, orbital atom harus tumpang tindih di ruang angkasa. Ini berarti bahwa hanya orbital valensi atom yang berkontribusisecara signifikan ke MO molekul tertentu.
Orde Ikatan = 2−20 = 1
Jadi Li2 diharapkan menjadi molekul yang stabil (memiliki energi lebih rendah dari dua atom litium terpisah). Namun, ini tidak berarti bahwa Li2 adalah bentuk yang paling stabil dari lithium unsur. Sebenarnya, pada suhu dan tekanan normal,lithium ada sebagai padatan yang mengandung banyak atom lithium yang terikat bersama.
Untuk molekul berilium (Be2), orbital ikatan dan antibonding keduanya mengandung dua elektron. Dalam hal ini order obligasi adalah (2 2) / 2 0.
Gambar. 2
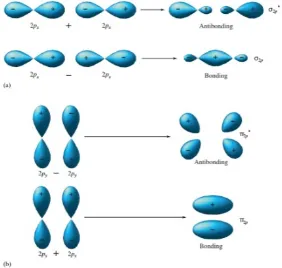
Karena atom boron memiliki konfigurasi 1s2 2s2 2p1, kita menggambarkan B2molekul dengan mempertimbangkan bagaimana p orbital atom bergabung membentuk MOs. Penarikanorbital p memiliki dua lobus dan terjadi pada tiga set bersamaorbital tegak lurus Ketika dua atom B saling berhadapan satu sama lain, dua pasang orbital p dapat tumpang tindih secara paralel.
Orbital p yang tumpang tindih secara paralel juga menghasilkan ikatan dan orbital antibonding. Bila orbital p paralel ditambahkan bersama, fase pertandingan, dan interferensi konstruktif terjadi, memberikan orbital ikatan. Bila fase orbital kanan dibalik dan digabungkan dengan orbital kiri, gangguan destruktif terjadi, memberikan orbital anti-ikatan. Karena probabilitas elektron terletak di atas dan di bawah garis antara nukleus, orbitalnya adalah piMOs. Mereka ditunjuk sebagai 2p untuk ikatan MO dan 2p * untuk antibonding MO.
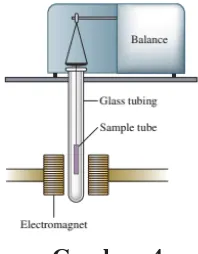
B.Paramagnetik
Pada titik ini kita perlu membahas propertymagnetisme molekul tambahan. Sebagian besar bahan tidak memiliki magnet sampai mereka ditempatkan secara magnetis bidang. Namun, dengan adanya medan seperti itu, daya tarik dua jenis bisa dipaksa. Paramagnetisme menyebabkan zat tertarik ke arah mendorong medan magnet Diamagnetisme menyebabkan zat tersebut ditolak dari medan magnet induksi. Sampel ditimbang dengan elektromagnet dimatikan dan lalu ditimbang lagi dengan elektromagnet dinyalakan. Kenaikan berat molekul Saat medan menyala menunjukkan bahwa sampel bersifat paramagnetik. Studi telah menunjukkan bahwa paramagnetisme dikaitkan dengan elektron yang tidak berpasangan, dan diamagnetisme dikaitkan dengan elektron berpasangan. Setiap zat yang dimilikinya Kedua elektron berpasangan dan tidak berpasangan akan menunjukkan paramagnetisme bersih, karena Efek paramagnetisme jauh lebih kuat daripada diamagnetisme. Demikian Fenomena paramagnetisme menyediakan sarana siap untuk menguji apakah sebuah zat mengandung elektron tak berpasangan.
Gambar. 4
MO. Perhatikan bahwa meskipun kontribusi s dan p terhadap MO adalah no lagi terpisah, kami mempertahankan sebutan orbital sederhana. Pencampuran dari hal dan orbital atom hanya terjadi di MO (2s, 2s *, 2p, dan 2p *).
BAB III
PENUTUP
3.1 Kesimpulan
Kesimpulan yang diberikan pada makalah ini yaitu sebagai berikut :
1. Cara menentukan bentuk molekul berdasarkan teori VSEPR yaitu dengan cara menggambarkan struktur lewis molekul, menghitung pasangan elektron disekitar atom pusat, dan susun mereka dengan tolakan yang minimal, menentukan posisi atom dari pasangan elektron yang terbagi dan memberi nama struktur molekul tersebut dari posisi atomnya.
2. Teori hibridisasi adalah sebuah konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep orbital-orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk orbital molekul dari sebuah molekul.
3. Jenis – jenis hibridisasi yaitu hibridisasi sp, sp2, sp3, dsp3, d2sp3.
4. Proses pembentukan hibridisasi yaitu dengan cara menentukan konfigurasi elektron dari atom pusat, lalu atom pusat akan mengalami hibridisasi untuk menyediakan orbital dengan elektron yang tidak berpasangan sebanyak jumlah atom yang akan masuk.
5. Hibridisasi akan mempengaruhi geometri dari molekul tersebut.
6.Pada ikatan dalam molekul diatomik homonuklir digunakan prinsip umum berikut ini berlaku: Untuk berpartisipasi dalam orbital molekul, orbital atom harus tumpang tindih di ruang angkasa. Ini berarti bahwa hanya orbital valensi atom yang berkontribusisecara signifikan ke MO molekul tertentu.