BAB 2
TINJAUAN PUSTAKA
2.1. Karotenoida
Karotenoida merupakan kelompok pigmen yang berwarna kuning, jingga,merah jingga, dan bersifat larut dalam minyak. Struktur dasar karotenoida terdiri dari ikatan hidrokarbon tidak jenuh yang dibentuk oleh 40 atom C atau 8 unit isoprena dan memiliki dua buah gugus cincin. Karotenoida dibagi menjadi empat golongan, yaitu (1) karotenoida hidrokarbon C40H56 seperti alfa, beta, gamma karoten dan likopen; (2) xantofil dan derivat karoten yang mengandung oksigen dan hikdroksil antara lain kriptosantin, C40H55OH dan lutein, C40H54(OH)2; (3) asam karotenoida yang mengandung gugus karboksil; dan (4) ester xantofil asam lemak (Meyer, H., 1966).
Karotenoida juga dikenal sebagai poliena yang dibentuk oleh unit-unit isoprena. Senyawa hidrokarbon karotenoida juga banyak ditemukan mengandung gugus hidroksil, karbonil, oxiran dan gugus epoksi. Ada beberapa karakteristik umum yang paling dari karotenoida (Sebrell, W.H dan R.S. Harris, 1954) :
1. Kristal pigmen padat
2. Mempunyai susunan unit isopren pada bagian tengah dari molekul jadi gugus metil menempati posisi -1,6 atau -1,5 dan dengan penyusunan tersebut memungkinkan terjadinya pemecahan pada bagian tengah sehingga
menghasilkan vitamin A
3. Mengandung banyak ikatan rangkap karbon-karbon yang terkonjugasi 4. Mengandung paling tidak satu trimetil sikloheksinil atau cincin β-ionon 5. Mempunyai konfigurasi trans
Karotenoida terdapat dalam kloroplas (0.5%) bersama-sama dengan klorofil (9.3%) terutama pada bagian permukaan atas daun, dekat dengan dinding sel palisade (Winarno, F.G., 1997). Karena warnanya mempunyai kisaran dari kuning sampai merah, maka deteksi panjang gelombangnya diperkirakan antara 430 – 480 nm (Schwartz, S.J dan J.H.V. Elbe, 1996). Menurut Meyer (1966) sifat fisika dan kimia karotenoida adalah larut dalam minyak dan tidak larut dalam air, larut dalam kloroform, benzena, karbon disulfida dan petroleum eter, tidak larut dalam dalam etanol dan metanol dingin, tahan terhadap panas apabila dalam keadaan vakum, peka terhadap oksidasi, autooksidasi dan cahaya, dan mempunyai ciri khas absorpsi cahaya. Adanya ikatan ganda menyebabkan karotenoida peka terhadap oksidasi yang akan lebih cepat dengan adanya sinar dan katalis logam, khususnya tembaga, besi, dan mangan (Walfford, J., 1980).
Kadar karoten dalam minyak kelapa sawit berkisar 500-700 terutama α dan β karoten dengan γ karoten sebagai jumlah yang paling sedikit. Telah dilaporkan bahwa karoten memegang peranan penting sebagai anti oksidan dalam fasa minyak dengan menjerap radikal bebas (Ammawath, W dan Y.B.C. Man, 2009), prekursor vitamin A dimana β-karoten mempunyai aktivitas provitamin A yang tertinggi (Goh, S.H., dkk, 1985 ), meningkatkan sistem kekebalan tubuh dan mengkomunikasikan sel (Voet, D., 1995).
Tabel 2.1. Beberapa Jenis dan Komposisi Karoten di Dalam Minyak Kelapa Sawit Jenis-jenis karoten Komposisi (%) γ-Carotene 0,33 δ-Carotene 0,83 Neurosporene 0,29 β-Zeacarotene 0,74 α-Zeacarotene 0,23 Lycopene 1,3 (Wei, P.C., dkk, 2005) Jenis-jenis karoten Komposisi (%) Phytoene 1,27 Cis-β-Carotene 0,68 Phytofluene 0,06 β-Carotene 56,02 α-Carotene 35,16 Cis- α-Carotene 2,49 ζ-Carotene 0,69
2.1.1. Metode-Metode Memperoleh Karotenoida
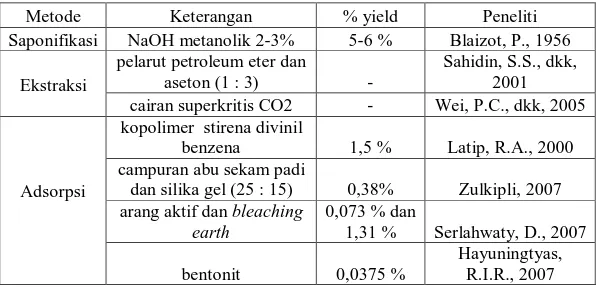
Metode memperoleh karotenoida dari minyak sawit dapat dilakukan dengan berbagai metode yaitu dengan menyabunkan CPO dengan natrium hidroksida metanolik 2-3% selama beberapa jam pada suhu 30-400 C sehingga hampir 98% minyak terkonversi menjadi ester. Gliserin yang terbentuk kemudian dipisahkan dengan cara dekantasi dan produk penyabunan diuapkan pada suhu 100 - 1100 C dalam keadaan vakum bertekanan 0,001 – 0,0001 mmHg sehingga karotenoida tertinggal sebagi residu (Blaizot, P., 1956). Metode esktraksi dengan menggunakan pelarut petroleum eter : aseton ( 1 : 3 ) untuk mengekstraksi karotenoida dari minyak sawit mentah (Sahidin, S.S., dkk, 2001).
Penggunaan CO2 cair sebagai pelarut dapat digunakan untuk memperoleh karotenoida konsentrat melalui sistem Supercritical Fluid Extraction dimana sampel yang ditempatkan dalam bejana ektraksi pada suhu 400C dan tekanan 30 MPa, kemudian gas CO2 didinginkan pada -50C sebelum pompa HPLC digunakan untuk memompa CO2 cair ke ekstraktor secara terus menerus pada kondisi spesifik ekstraksi dengan laju alir yang konstan 5 mL/menit sehingga diperoleh ekstrak karotenoida konsentrat (Wei, P.C., dkk, 2005).
Karotenoida konsentrat dari minyak sawit juga banyak diperoleh melalui proses adsorpsi menggunakan adsorben polimer sintetis diikuti dengan ekstraksi pelarut. Adsorben yang digunakan adalah kopolimer stirena divinil benzena. Proses tersebut pertama dimulai dengan mencampurkan adsorben dengan IPA (isopropanol) kemudian diaduk selama 15 menit. Adsorben dipisahkan dari IPA dan dikeringkan dalam temperatur kamar sehingga dapat digunakan dalam proses adsorpsi. Selanjutnya minyak kelapa sawit dilarutkan dalam IPA (isopropanol). Adsorben kemudian dimasukkan ke dalam kolom diikuti dengan minyak kelapa sawit. Karotenoida kemudian diekstraksi dengan n-heksana untuk memisahkannya dari adsorben. Karotenoida dipekatkan sampai sekitar 15.000 ppm dengan %
recovery 30-62 % dengan variasi yang paling sesuai adalah pada 1,5 jam dan temperatur 400 C (Latip, R.A., 2000).
Selain itu, dapat juga digunakan campuran abu sekam padi dan silika gel sebagai adsorben berdasarkan metode kromatografi adsorpsi dimana adsorben dimasukkan ke dalam kolom yang diikuti dengan metil ester kasar dan dielusi dengan menggunakan pelarut n-heksan kemudian eluat dipekatkan dengan gas N2 dengan perolehan 3754,55 μg/gram dan % recovery adalah 28,8 % (Zulkipli, 2007).
Penggunaan bahan penjerap arang aktif dan belaching earth dalam larutan n-heksana dimana minyak sawit dilarutkan terlebih dahulu dengan n-n-heksana dan ditambahkan dengan bahan penjerap kemudian diaduk selama beberapa saat. Karotenoida yang terjerap dilarutkan dengan campuran n-heksana dan aseton untuk memperoleh karotenoida konsentrat dengan perolehan untuk arang aktif adalah 736,31 μg/gram, % recovery sekitar 16,59 % dan untuk bleaching earth adalah 13103 μg/gram, % recovery adalah 39,16 %(Serlahwaty, D., 2007) dan penggunaan bentonit dimana minyak sawit dan adsorben ( 3 : 1 ) dicampurkan dalam suatu reaktor berpengaduk selama 171 menit. Selanjutnya disaring dengan menggunakan pompa vakum untuk memisahkan minyak dengan adsorben yang telah mengandung β-karoten. Kemudian, karotenoida pada adsorben didesorpsi dengan pelarut n-heksana dan dipekatkan dengan N2 sehingga diperoleh karotenoida konsentrat sekitar 375,5 μm/gram dan % recovery adalah 3,7 % (Hayuningtyas, R.I.R., 2007). Adapun ringkasan metode yang telah digunakan dapat dilihat pada Tabel 2.2 di bawah ini
Tabel 2.2. Metode-Metode Memperoleh Karotenoida
Metode Keterangan % yield Peneliti
Saponifikasi NaOH metanolik 2-3% 5-6 % Blaizot, P., 1956 Ekstraksi
pelarut petroleum eter dan
aseton (1 : 3) -
Sahidin, S.S., dkk, 2001
cairan superkritis CO2 - Wei, P.C., dkk, 2005
Adsorpsi
kopolimer stirena divinil
benzena 1,5 % Latip, R.A., 2000 campuran abu sekam padi
dan silika gel (25 : 15) 0,38% Zulkipli, 2007 arang aktif dan bleaching
earth 0,073 % dan 1,31 % Serlahwaty, D., 2007 bentonit 0,0375 % Hayuningtyas, R.I.R., 2007
2.2. Polistirena
Polistirena adalah polimer linear yang secara kimia besifat inert. Polistirena bersifat kaku, sifat optis yang bagus, tahan terhadap zat alkalis, halida asam dan agen oksidasi-reduksi (Ulrich, H., 1993). Namun, polistirena dapat dinitrasi dengan uap asam nitrat dan disulfonasi dengan asam sulfat pekat pada suhu 1000 C. Polistirena mempunyai bentuk transparan dan indeks bias (1.60) yang tinggi sehingga dapat berguna untuk komponen optik plastik dan baik untuk insulator listrik. Gaya tarik dari polistirena mencapai 8000 psi. Polistirena digunakan untuk injeksi cetakan seperti pada sisir, kancing, mainan, insulator listrik, lensa, radio, televisi, kulkas dan panel pencahayaan. Polistirena dapat dibuat melalui polimerisasi stirena dengan adanya peroksida seperti benzoil peroksida sebagai inisiator. Monomer stirena dibuat dari benzena dan etilena pada suhu 900 C dengan bantuan katalis AlCl3 dimana etil benzena dihidrogenasi ke stirena dengan adanya katalis besi oksida, magnesium oksida atau aluminium oksida pada suhu 6000 C. Stirena dapat dipisahkan dengan metode destilasi (Dara, S.S., 1986)
AlCl3 , 900C CH2 CH3 -H2 katalis Al2O3 atau MgO atau Fe2O3, 6000C CH CH2
benzena etilbenzena stirena
+ CH2 CH2 + H2 CH2 polimerisasi dengan benzoil peroksida CH2 n polistirena Gambar 2.1. Reaksi Pembuatan Polistirena
Terdapat kesukaran dalam pemurnian stirena melalui penyulingan karena monomer mudah terpolimerkan sekalipun pada suhu sedang. Stirena dapat dipolimerkan dengan menggunakan sinar matahari ataupun katalis dimana derajat polimerisasinya bergantung pada kondisi polimerisasi. Polistirena merupakan bahan lentuk-bahang yang bening (kecuali jika ditambahkan pewarna atau pengisi)
dan dapat dilunakkan pada suhu sekitar 1000C. Polistirena tahan terhadap zat pengarat (korosif) tetapi mudah larut dalam hidrokarbon aromatik dan berklor. Dalam propanon (aseton), polistirena hanya mengembung (Cowd, M.A., 1991).
2.2.1. Reaksi Sulfonasi
Sulfonasi adalah suatu reaksi untuk memodifikasi bahan polimer yang memiliki cincin aromatik sebagai rantai utamanya. Karena sulfonasi termasuk ke dalam reaksi elektrofilik maka reaksi ini sangat bergantung pada tipe gugus yang terikat pada cincin aromatis dimana polimer dengan gugus difenil eter dapat disulfonasi di bawah kondisi dingin karena adanya efek donasi elektron dari gugus eter. Sulfonasi dari polimer aromatis bisa menjadi sangat kompleks karena reversibilitasnya. Untuk itu, reproduksibilitas dengan menggunakan kondisi reaksi yang sama bisa menjadi hal yang sangat sulit ( Pinto, B.P., 2006).
Sulfonasi benzena dengan asam sulfat berasap (H2SO4 + SO3) menghasilkan asam benzena sulfonat
+ SO3 H2SO4 400C SO3 H + SO3H asam benzenasulfonat (50%)
Gambar 2.2. Reaksi Pembuatan Asam Benzensulfonat
Sulfonasi bersifat mudah balik dan menunjukkan efek isotop kinetik yang sedang dimana ion benzenonium antara dalam sulfonasi dapat kembali ke benzena atau terus ke asam benzenasulfonat dengan hampir sama mudahnya. Gugus asam sulfonat mudah digantikan oleh anekaragamn gugus lain. Oleh karena itu,asam arilsulfonat merupakan zat antara yang bermanfaat dalam sintesis (Fessenden, R.J dan J.S. Fessenden, 1986).
Sulfonasi polistirena telah banyak dipelajari oleh banyak peneliti meskipun hanya sedikit literatur yang membahas tentang reaksi sulfonasi dan sifat termal
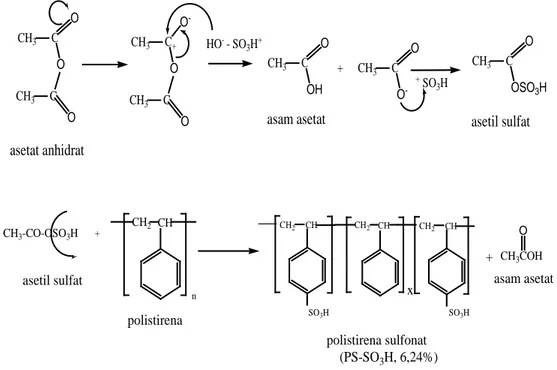
dari produk yang dihasilkan. Secara umum, sulfonasi bahan polimer dapat dilakukan dengan reaksi heterogen dimana bahan polimer dan agen sulfonasi berada dalam fasa yang berbeda atau dengan reaksi homogen dalam pelarut hidrokarbon atau pelarut terklorinasi. Senyawa seperti H2SO4 dan SO3 adalah agen sulfonasi untuk berbagai bahan polimer termasuk polistirena. Agen sulfonasi lain yang bisa digunakan adalah kompleks dari trietil fosfat bersama sulfur trioksida dan kompleks asetil sulfat dalam larutan dikloroetana. Adapun reaksi sulfonasi polistirena dengan menggunakan agen sulfonasi asetil sulfat :
HO- - SO3H+ + asetil sulfat asetat anhidrat asam asetat CH3 C O CH3 C O O CH3 C+ O CH3 C O O -+ SO 3H CH3 C OH O CH3 C O -O CH3 C OSO3H O CH2 CH CH2 CH CH2 CH SO3H SO3H x CH3-CO-OSO3H + + CH3COH O polistirena asetil sulfat polistirena sulfonat (PS-SO3H, 6,24%) asam asetat n CH2 CH
Gambar 2.3. Reaksi Sulfonasi Polistirena dengan Asetil Sulfat
Bahan polimer yang telah tersulfonasi dianggap sebagai senyawa makromolekul yang mengandung gugus sulfonik –SO3H dengan sifat kimia dan mekanik yang disukai sehingga banyak diaplikasikan dalam industri seperti untuk bahan penukar ion, membran untuk ultrafiltrasi dan plasticizers untuk komposit konduktif (Martins, C.R., dkk, 2003).
2.2.2. Polistirena sulfonat
Polistirena sulfonat P(S-SS)x banyak diproduksi dengan sulfonasi post-polimerisasi dari polistirena yang menangkap gugus asam sulfonik pada posisi para dari cincin fenil dan dapat menghasilkan distribusi yang hampi acak, x mewakili derajat sulfonasi. Sifat unik dari polistirena sulfonat ini adalah kekuatannya, sifat hidrofiliknya dan konduktivitas proton mulai dari penggabungan dari asam sulfonik pada level yang bervariasi. Keistimewaannya ini digunakan secara meluas untuk berbagai aplikasi seperti adhesif, membran fuel cell, transfer ion dalam sistem pemurnian elektromigrasi, katalis. Adanya sintetis senyawa ini dalam ukuran kecil memberikan keuntungan karena dapat meningkatkan area permukaan spesifik (Zhou, N.C., dkk, 2006).
2.3. Adsorpsi
Adsorpsi merupakan proses satu arah dengan suhu rendah dan adsorben yang digunakan dapat diperoleh kembali. Adsorpsi merupakan proses yang selektif dan hanya merupakan proses satu arah. Bila ada dua larutan dua zat atau lebih, zat yang satu akan diserap lebih kuat daripada yang lain. Zat-zat yang dapat menurunkan tegangan permukaan antara, lebih kuat diserap. Makin kompleks zat terlarut, makin kuat diserap oleh adsorben. Makin tinggi suhu, makin kecil daya serap. Namun demikian pengaruh suhu tidak sebesar pada adsoprsi gas (Sukardjo, 1985).
Adsorpsi pada fase padat diklasifikasikan ke dalam adsorpsi fisika (fisisorpsi) dan adsorpsi kimia (kemisorpsi). Dalam adsorpsi fisik , molekul gas tertahan pada permukaan padatan yang relatif lemah karena terjadi ikatan intermolekular Van der Waals. Dalam kemisorpsi, reaksi kimia terjadi pada permukaan padatan dan gas tertahan pada permukaan padatan yang relatif merupakan ikatan kimia yang kuat. Adsorpsi fisika tidak terlalu spesifik misalnya, N2 secara fisik akan teradsorpsi pada permukaan padatan yang tersedia dengan temperatur yang cukup rendah. Kemisorpsi sama seperti reaksi kimia yang bersifat lebih spesifik. Seperti N2
dikemisorpsi pada suhu kamar pada Fe, W, Ca dan Ti tetapi tidak pada Ni, Ag, Cu atau Pb (Levine, I.R., 2002).
2.3.1. Sifat-Sifat Umum Proses Adsorpsi
Proses adsorpsi suatu bahan tergantung pada berbagai faktor yang dapat dibagi dalam 5 kategori yaitu (Sukmariah dan Kamianti,1990) :
1. Adsorpsi adalah proses kesetimbangan proses kesetimbangan antara konsentrasi pada satu bidang permukaan dan konsentrasi lain di bidang mana komponen itu terkandung. Jadi keadaaannya adalah reversibel.
2. Banyaknya komponen yang diadsorpsi sebanding dengan luas permukaan zat adsorben.
3. Daya adsorpsi tiap jenis adsorben terhadap suatu zat berbeda, bahkan cara pembuatan adsorben yang berbeda menyebabkan daya adsorpsi yang berlainan.
4. Daya adsorpsi akan berkurang bila suhu bertambah tinggi 5. Adsorpsi diikuti oleh pengeluaran panas(energi).
Adsorpsi hidrokarbon tak jenuh dalam substrat logam merupakan sebuah interaksi fisik lemah, dimana lebih didominasi oleh gaya Van der Waals. Ikatan hidrokarbon tak jenuh dengan logam pertama kali dikembangkan oleh Dewar, Chatt dan Duncanson yang sekarang dikenal sebagai model DCD yang didasarkan pada konsep orbital terdepan . Pada model ini, interaksi ditunjukkan dengan adanya donasi muatan dari orbital π tertinggi yang terisi ke logam dan substansi backdonation dari muatan logam yang terisi ke orbital π* terendah yang tidak terisi (Nilson, A dan L.G. Petterson, 2008).
2.4. Kalsium
Unsur golongan IIA dapat membentuk kompleks dengan 6H2O, seperti Mg(H2O)6Cl2 mengindikasikan bahwa unsur ini memberikan ikatan melalui kontribusi orbital d sekalipun energi tinggi. (Madan, R.D., 2003). Untuk logam kalsium, energi orbital d lebih tinggi dari unsur transisi lainnya. Pemakaian ba
mungkin sedikit berbeda dengan kalsium dalam tingkat besar lobe orbital (4d dan 3d orbital). Sifat ini perlu dikaji untuk mendapatkan reaktifitas dan stabilitas sebagai bahan pemantap senyawa dengan ikatan tidak jenuh (Shriver, D.E., dkk, 1990).
Kemampuan untuk menukar basa berhubungan dengan kekuatan basa logam tersebut : semakin tinggi tingkat kebasaan, semakin mudah menukar basa. Untuk logam golongan , dimana sifat kebasaan meningkat dari lithium ke natrium dan ke kalium, lebih mudah unutk menukar kalium daripada untuk menukar lithium. Pada logam golongan II, sifat kebasaan meningkat dari magnesium ke stronsium ke barium; dimana lebih mudah untuk menukar barium daripada untuk menukar magnesium ( Rizvi, S., 2003).
2.5. Alkena
Alkena adalah senyawa hidrokarbon yang mengandung satu atau lebih ikatan rangkap karbon-karbon. Alkena yang paling sederhana adalah etena dengan rumus C2H4. Ikatan rangkap terkonjungasi adalah ikatan rangkap yang dipisahkan oleh masing-masing satu ikatan tunggal. Adanya ikatan rangkap terkonjungasi dalam suatu molekul akan memberikan sifat fisik dan kimia yang khusus. Banyak molekul yang mengandung sistem ikatan rangkap terkonjungasi mengadsorpsi panjang gelombang spesifik dari sinar tampak (Stoker, H.S dan E.B. Walker, 1991).
Ikatan rangkap karbon-karbon mempunyai dua bagian yaitu ikatan sigma yang dibentuk karena tumpang tindih dari dua orbital sp2 dan ikatan pi yang dibentuk karena tumpang tindih dari dua orbital p. Kekuatan ikatan dari ikatan rangkap alkena lebih besar daripada ikatan tunggal karbon-karbon (Murry, J.M., 1994).
Alkena (etilena) adalah ligan dihapto yang dapat mendonorkan dua elektron karena adanya orbital π terisi ke logam dan orbital π*
dari ligan dapat menerima densitas elektron dari orbital logam terisi. Adanya ikatan logam-alkena karena donasi elektron dari orbital π yang terisi ke logam dan penerimaan densitas
elektron ke dalam orbital π* antibonding dari ligan disebut dengan model Dewar-Chatt. Keseluruhan ikatan dijelaskan dalam teori molekul orbital dimana dalam kompleks alkena, terjadinya backbonding tergantung dari sifat alkena, logam dan ligan lainnya. Logam-logam yang mempunyai orbital d dengan tingkat energi yang tinggi mengalami backbonding karena adanya kelebihan densitas elektron pada orbital π*
alkena sehingga menghasilkan komples yang dikenal sebagai metalocyclopropana. Antara hidrokarbon polimer dengan hidrokarbon dapat terjadi interaksi. Interaksi ini diperkuat oleh adanya interaksi antara ikatan π dengan orbital LUMO dari logam kalsium sehingga kalsium polistiren sulfonat dapat berfungsi sebagai adsorben. (Shriver, D.E., dkk, 1990).
CH2
CH2
M