1 1. PENDAHULUAN
1.1.Latar Belakang
Bakteri asam laktat (BAL) merupakan salah satu contoh mikroorganisme yang menguntungkan dan mempunyai peran penting dalam industri pangan, seperti dalam proses fermentasi makanan sehingga dapat memperpanjang umur simpan produk. BAL selain menguntungkan bagi industri pangan juga memiliki keuntungan bagi kesehatan, terutama bagi pencernaan manusia. Hasil proses fermentasi oleh bakteri asam laktat berupa asam laktat dan sebagian kecil asam-asam lain seperti asam asetat, etanol, dan CO2 yang berperan menghambat aktivitas bakteri pembusuk dan patogen. Contohnya pada penelitian aktivitas antimikroba bakteri asam laktat yang diisolasi dari daging sapi (Al-Allaf et al., 2009), susu fermentasi (Savadogo et al., 2004), dan minuman
fermentasi tradisional Etiopia (Tadasse et al., 2005). Kegunaan BAL dalam industri
pangan mendorong dilakukannya eksplorasi strain BAL dari berbagai sumber seperti
pada produk fermentasi buah dan sayuran (Rahayu & Margino, 1997).
Isolasi serta identifikasi BAL dari berbagai sumber bahan pangan terus dikaji seperti pada penelitian Rahayu (2003) ditemukan BAL spesies Lactobacillus plantarum dan Lactobacillus plantarum-pentosus yang diperoleh dari hasil fermentasi mandai
cempedak yang berasal dari daerah Banjarmasin. Sedang Forouhandeh et al., (2010),
menemukan bahwa di dalam yoghurt yang berasal dari Bahmenj Iran menghasilkan
BAL spesies Lactobacillus fermentum, Lactobacillus rhamnosus, Lactobacillus
paracasei. Penelitian Yuliana & Dizon (2011), pada tempoyak (fermentasi durian) yang berasal dari daerah Filipina terdapat BAL dengan spesies Lactobacillus plantarum, Lactobacillus sp, Weissella paramesenteroides, dan Pediococcus acidilactici.
2 dami nangka (Artocarpus heterophyllus Lamk) var. salak, Gunung Pati, rebung kuning
bambu betung (Dendrocalamus asper) Lokal Mranggen dapat bermanfaat bagi
keragaman bakteri asam laktat bahan baku lokal. Hal ni berarti menambah temuan bakteri asam laktat yang bersumber dari bahan baku lokal. Dalam industri pangan manfaat bakteri asam laktat diantaranya dapat berguna sebagai probiotik dalam makanan ataupun minuman (Soomro et al., 2002). BAL digunakan sebagai probiotik
karena sebagian strain BAL bukan merupakan bakteri patogen dan kemampuannya untuk hidup di saluran pencernaan serta dapat menekan pertumbuhan bakteri patogen (sifat antimikrobial) sehingga dapat dimanfaatkan untuk kesehatan tubuh (Rolfe, 2000). Secara umum beberapa genus BAL telah diketahui memiliki peranan penting dalam industri pangan adalah Lactobacillus, Leuconostoc, Pediococcus dan Streptococcus.
Berdasarkan revisi terbaru, genus yang saat ini termasuk dalam BAL meliputi
Aeroccous, Carnobacterium (Lactobacillius atopikal), Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tertragenococcus
atau Pediococcus halophilus, Weisella, dan Vaganococcus (Rahayu & Margino, 1997).
1.2.Tinjauan Pustaka
1.2.1 Bakteri Asam Laktat (BAL)
Bakteri asam laktat merupakan bakteri chemotrophic, yang memiliki ciri-ciri khas
seperti: (i) tergolong gram positif; (ii) berbentuk cocci, rod-shape, coccobacilli
umumnya membentuk rantai; (iii) hanya membutuhkan sedikit oksigen ( micro-aerophilic); (iv) tidak membentuk spora; (v) tidak bergerak (non-motile); dan (vi)
bereaksi negatif terhadap hidrogen peroksida (H2O2). Bakteri asam laktat tidak menghasilkan enzim katalase yang mengubah hidrogen peroksida menjadi air dan oksigen. Beberapa bakteri yang memerlukan oksigen akan membentuk hidrogen peroksida, yang merupakan produk sampingan metabolisme aerob yang bersifat toksik. Bakteri yang mampu menghasilkan enzim katalase, akan bertahan hidup dalam kondisi aerobik (Tadesse et al., 2005; Battcock & Azam-Ali, 1998). Menurut Josephsen &
Jespersen dalam Hui et al. (2004), bakteri asam laktat menghasilkan asam laktat dan
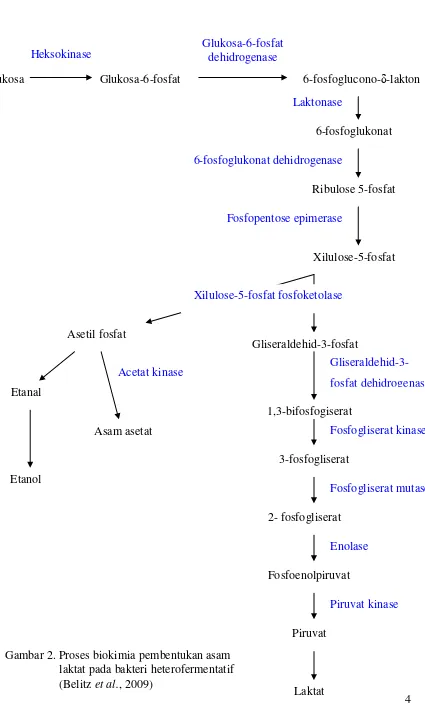
3 BAL terbagi dalam dua golongan, yaitu bakteri homofermentatif dan bakteri heterofermentatif. Bakteri homofermentatif memecah gula menjadi asam laktat, sedangkan bakteri heterofermentatif mengubah gula menjadi asam laktat, asam asetat, dan etanol (Battcock & Azam-Ali, 1998). Proses biokimia pembentukan asam laktat pada bakteri homofermentatif (Gambar 1) dan heterofermentatif (Gambar 2). Asam laktat yang dihasilkan dari aktivitas metabolisme bakteri asam laktat menyebabkan kondisi bahan mentah (makanan) menjadi asam. Hal ini justru menguntungkan, mengingat kondisi pH rendah menghambat hampir semua mikroba perusak (food spoilage microbes).
4
Glukosa Glukosa-6-fosfat 6-fosfoglucono-δ-lakton
Glukosa-6-fosfat
5 1.2.2.Fermentasi Durian, Dami Nangka dan Rebung Kuning Bambu Betung
1.2.2.1. Fermentasi Durian (Durio zibethinus Murr.)
Durian (Durio zibethinus Murr.) seringkali disebut “king of fruit” (Gambar 3) semakin
dikenal oleh masyarakat luas karena mempunyai rasa yang enak. Durian yang memiliki rasa kurang enak seperti rasa yang asam seringkali hanya dibuang begitu saja tanpa ada pengolahan lebih lanjut (Rukmana, 1996).
Gambar 3. Durian (Durio zibethinus Murr.) yang digunakan sebagai bahan fermentasi
tempoyak (Dokumentasi Hengky Saputra, 2011)
6 Tabel 1. Kandungan gizi dalam 100 gram buah durian (Durio zibethinus Murr.)
Kandungan gizi Kadar
1.2.2.2. Fermentasi Dami Nangka (Artocarpus heterophyllus Lamk)
Dami nangka (Gambar 4) merupakan bagian nangka yang dapat diolah dan diproses sebagai bahan makanan tradisional. Jika tidak diolah lebih lanjut, dami nangka sering di buang atau merupakan limbah dan menempati porsi 40-50% dari total limbah yang dihasilkan dari buah nangka. Proses fermentasi dami nangka dengan penambahan garam menghasilkan produk yang dikenal dengan nama “mandai” tanpa penambahan inokulum (Nur, 2009).
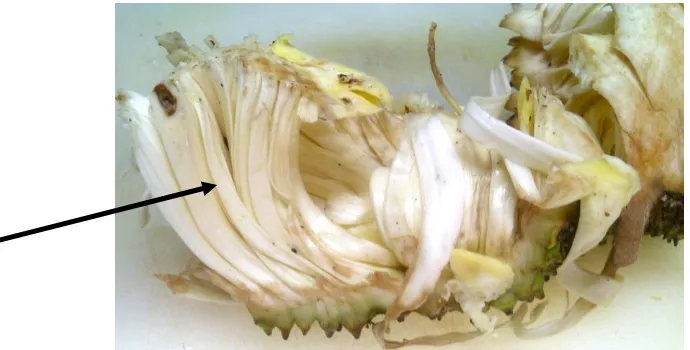
Gambar 4. Dami Nangka (Artocarpus heterophyllus Lamk) var. salak, Gunung Pati
7 (Dokumentasi Elke Novionalita Hartanto, 2011)
1.2.2.3. Fermentasi Rebung Kuning Bambu Betung (Dendrocalamus asper)
Rebung merupakan tunas muda tanaman bambu yang muncul dipermukaan dasar rumpun. Tunas muda bambu dapat dikonsumsi, sehingga digolongkan ke dalam sayuran. Rebung yang dapat dikonsumsi adalah rebung yang berasal dari bambu betung (Dendrocalamus asper), bambu temen (Gigontochloa verticillata), bambu kuning
(Dendrocalamus litiforus), dan bambu hijau (Bambusa aldhami) (Andoko, 2003).
Morfologi rebung berbentuk kerucut, setiap ujung glugut memiliki bagian seperti ujung daun bambu dengan warna kekuningan (Gambar 5). Rebung mentah mempunyai kandungan air sekitar 90% setiap berat bersihnya (Rai, 2007).
Gambar 5. Rebung kuning bambu betung (Dendrocalamus asper) (Dokumentasi Donny
Setiadi, 2011)
Proses fermentasi rebung dilakukan dengan menambahkan larutan garam. Larutan garam berfungsi agar cairan yang terdapat dalam rebung tertarik keluar melalui proses osmosis dan juga berfungsi untuk menghambat pertumbuhan bakteri patogen sehingga diharapkan hanya bakteri asam laktat saja yang tumbuh. Hasil akhir proses fermenatasi sering disebut asinan rebung. Pada proses fermentasi rebung, tidak ditambahkan inokulum.
1.3. Tujuan Penelitian
8 Melakukan uji terhadap bakteri asam laktat dengan menggunakan API 20 STREP
test kit dan API 50 CHL
2. MATERI DAN METODE
Penelitian akan dilaksanakan di laboratorium Mikrobiologi Fakultas Teknologi Pertanian, Unika Soegijapranata untuk fermentasi durian (Durio zibethinus Murr.) lokal
Gunung Pati, dami nangka (Artocarpus heterophyllus Lamk) var. salak, Gunung Pati,
rebung kuning bambu betung (Dendrocalamus asper) Lokal Mranggen
2.1. Materi
2.1.1. Alat
Peeralatan yang digunakan adalah tabung reaksi, tabung durham, labu takar 100 ml,
cawan petri, Erlenmeyer (250 ml dan 500 ml), mikropipet, bluetip, yellowtip, bunsen, autoclave Hirayama HL36AE, jarum ose, blender, penangas air (Yellow Line MAG HS
7), vortex (Thermolyne 37600), mixer, timbangan digital (Ohaus), mikroskop trinokuler
(Olympus BX41) dengan kamera Olympus DP20, kaca preparat, pipet ukur, pipet tetes dan eppendorf tube.
2.1.2. Bahan
Bahan-bahan yang digunakan adalah durian (Durio zibethinus Murr.) lokal Gunung
Pati, Semarang, dami nangka (Artocarpus heterophyllus Lamk) var. salak, Gunung Pati,
rebung kuning bambu betung (Dendrocalamus asper) Lokal Mranggen. Media agar
9 2.2. Metode
Identifikasi spesies
API 50 CHL dan 20 STREP test kit
Pengenceran menggunakan pepton water steril 10-1 sd 10-7
Isolasi pada media MRS agar dari masing-masing pengenceran
Identifikasi
Morfologi (Sneath et al., 1984) Pewarnaan gram (Hadioetomo, 1993) Pewarnaan spora (Lay, 1994)
Aktivitas katalase (Lay, 1994)
Uji Motilitas (Rahayu & Margino, 1997) Uji Produksi gas (Rahayu & Margino, 1997). Pertumbuhan pada berbagai pH, suhu dan NaCl
(Rahayu & Margino, 1997) Tempoyak,
mandai, asinan rebung kuning
10 Gambar 6. Tahapan isolasi dan identifikasi bakteri asam laktat dari tempoyak, mandai
11 2.2.1. Pembuatan Tempoyak, Mandai dan Asinan Rebung Kuning
2.2.1.1. Pembuatan Tempoyak
Sejumlah 125 g daging durian matang ditambahkan 3,75 g garam (3% (b/b)), dicampur hingga rata. Campuran yang sudah rata dimasukkan dalam wadah plastik dan ditutup rapat. Fermentasi akan berlangsung secara alami selama 8 hari pada suhu ruang (28-340C) (Yuliana & Dizon, 2011).
2.2.1.2. Pembuatan Mandai
Dami nangka sejumlah 100 g dicampur dengan larutan garam sejumlah 15% dari berat dami nangka yang digunakan. Dami nangka direndam sampai seluruh permukaan terendam. Kontainer ditutup dan proses fermentasi berlangsung selama 7 hari pada suhu ruang sekitar 30oC (Rahayu, 2003).
2.2.1.3. Pembuatan Asinan Rebung Kuning
Rebung kuning bambu betung yang telah dibersihkan sejumlah 200 g direndam dalam larutan garam 2,5% sebanyak 350 ml (seluruh bagian rebung terendam air larutan garam), kemudian kontainer ditutup. Proses fermentasi berlangsung selama 7 hari pada suhu ruang sekitar 30 oC (Rahayu, 2003).
2.2.2. Pengujian Total Asam Laktat
Masing-masing sampel (tempoyak, mandai, asinan rebung kuning) ditimbang 10 g, dimasukkan ke dalam labu takar 100 ml dan diencerkan dengan air destilasi sampai tanda tera. Sejumlah 5 ml sampel yang telah diencerkan tersebut diambil dan dimasukkan ke dalam Erlenmeyer dan ditambahkan 2 tetes indikator fenolftalein 1%. Selanjutnya dititrasi
12 Total asam laktat (%) = ml NaOH x Normalitas NaOH x 0.9 x 100%
g sampel (Amin et al., 2004)
2.2.3. Isolasi dan Identifikasi Bakteri Asam Laktat
Sejumlah 25 g sampel diencerkan ke dalam 225 ml 0,1% pepton steril (merupakan pengenceran 10-1) dan dilakukan pengenceran hingga 10-6. Setiap pengenceran diambil 0,1 ml dan diinokulasikan pada media agar MRS yang mengandung 1% CaCO3 dengan metode spread plate secara aspetis dan diinkubasi pada suhu 370C selama 48 jam. Koloni yang
membentuk zona bening, diidentifikasi sebagai bakteri asam laktat. Kultur dimurnikan dengan metode dan media yang sama (Yuliana & Dizon, 2011; Amin et al., 2006). Setiap
koloni yang terbentuk diamati dan diidentifikasi hingga tahap genus berdasarkan morfologi, pewarnaan gram, pewarnaan spora, aktivitas katalase, uji motilitas, dan uji produksi gas. Kemudian diseleksi dengan menumbuhkan isolat pada berbagai suhu, pH, dan NaCl (Rahayu & Margino,1997). Penamaan taksonomi dilakukan menggunakan Bergey’s manual of Determinative Bacteriology (Sneath et al., 1984).
2.2.4. Identifikasi Bakteri Asam Laktat Berdasarkan Karakter Morfologikal
Identifikasi isolat bakteri asam laktat berdasarkan jumlah isolat dan bentuk (coccus, rod-shape, coccobacillus) dilakukan dengan pengamatan menggunakan mikroskop (Sneath, et al., 1984).
2.2.4.1. Identifikasi Bakteri Asam Laktat Berdasarkan Pewarnaan Gram
13 dan dibilas dengan akuades. Pengamatan warna yang diserap oleh bakteri asam laktat dilakukan dengan pengamatan mikroskop (Madigan et al., 2003).
2.2.4.2. Identifikasi Bakteri Asam Laktat Berdasarkan Pewarnaan Spora
Isolat bakteri asam laktat dioleskan pada kaca objek dan difiksasi di atas api bunsen. Kaca objek diletakkan di atas kaki tiga dan kaca objek ditutup dengan kertas saring, diberi pewarna hijau melakit dan dipanaskan selama 5 menit. Panas akan mengembangkan lapisan luar spora sehingga hijau melakit dapat masuk ke dalam spora. Kaca objek didinginkan selama 1 menit kemudian kertas saring dibuang dan dibilas dengan air. Diberi pewarna safranin dan didiamkan selama 1 menit, kemudian dibilas dengan air. Pengamatan dibawah mikroskop dengan perbesaran 10 X 100 (Lay, 1994).
2.2.5. Identifikasi Bakteri Asam Laktat Berdasarkan Uji Aktivitas Katalase
Satu ose isolat bakteri asam laktat dioleskan pada kaca objek yang telah diberi alkohol, kemudian ditetesi dengan larutan H2O2. Katalase positif ditandai oleh pembentukan gelembung udara pada koloni dan sekitarnya (Lay, 1994).
2.2.6. Identifikasi Bakteri Asam Laktat Berdasarkan Uji Motilitas
Isolat bakteri asam laktat diambil secara aseptis menggunakan jarum ose yang lurus bagian ujungnya, kemudian isolat bakteri ditusukkan ke dalam MRS agar lunak tegak (konsentrasi agar pada MRS diturunkan sampai 0,5%). Inkubasi dilakukan pada suhu 370C selama 48 jam. Isolat non motil hanya tumbuh pada sekitar tusukan inokulasi sedangkan isolat motil
akan tumbuh menyebar (Rahayu & Margino, 1997).
2.2.7. Identifikasi Bakteri Asam Laktat Berdasarkan Produksi Gas
Isolat ditumbuhkan pada 5 ml media MRS broth yang diberi tabung durham terbalik untuk
14 Kemudian diinkubasi pada suhu 370C selama 48 jam. Isolat yang menghasilkan gelembung diidentifikasi sebagai bakteri heterofermentatif, sedangkan isolat yang tidak menghasilkan gelembung gas disebut homofermentatif (Rahayu & Margino, 1997).
2.2.8. Kemampuan Pertumbuhan Bakteri pada Berbagai Suhu, pH, dan NaCl
2.2.8.1. Pertumbuhan Bakteri pada Suhu (100C, 450C, dan 500C)
Isolat bakteri asam laktat ditumbuhkan dalam 5 ml media MRS broth dan diinkubasi
selama 48 jam pada suhu 370C. Kemudian dari 5 ml inokulum bakteri asam laktat, diambil 50 μl inokulum dan diinokulasikan ke dalam 5 ml medium MRS broth. Kemudian
diinkubasi pada suhu 100C, 450C, dan 500C selama 48 jam. Pengamatan pertumbuhan dilakukan dengan mengukur nilai absorbansi pada panjang gelombang 700 nm jam ke-24 dan ke-48 (Rahayu & Margino, 1997).
2.2.8.2. Pertumbuhan Bakteri pada pH (4,4 dan 9,6)
Isolat bakteri asam laktat ditumbuhkan dalam 5 ml media MRS broth dan diinkubasi
selama 48 jam pada suhu 370C. Kemudian dari 5 ml inokulum bakteri asam laktat, diambil 50 μl inokulum dan diinokulasikan ke dalam 5 ml medium MRS broth yang memiliki pH
4,4 dan 9,6 dengan larutan 1 M HCl atau larutan 0,5 M NaOH kemudian diinkubasi pada suhu 370C selama 48 jam. Pengamatan pertumbuhan dilakukan dengan mengukur nilai absorbansi pada panjang gelombang 700 nm jam ke-24 dan ke-48 (Rahayu & Margino, 1997).
2.2.8.3. Pertumbuhan Bakteri pada Kadar NaCl (6,5% dan 18%)
Isolat bakteri asam laktat ditumbuhkan dalam 5 ml media MRS broth dan diinkubasi
selama 48 jam pada suhu 370C. Kemudian dari 5 ml inokulum bakteri asam laktat, diambil 50 μl inokulum dan diinokulasikan ke dalam 5 ml MRS broth dengan konsentrasi NaCl
15 2.2.9. Identifikasi Bakteri Asam Laktat Menggunakan API 20 STREP test kit
API 20 STREP test kit (Bio Merieux SA, France) merupakan alat identifikasi spesies genus Aerococcus, Alloiococcus, Enterococcus, Gemella, Gardnerella, Globicatella,
Granulicatella, Lactococcus Leuconoctoc, Listeria, Pediococcus dan Streptococcus.
Spesies bakteri asam laktat diidentifikasi berdasarkan kemampuannya dalam memfermentasi 20 jenis sumber karbon yang terdapat pada API 20 STREP test kit.
Pembacaan hasil identifikasi menggunakan API WEB software (API bioMerieux)
(Pelinescu et al., 2009).
2.2.10. Identifikasi Bakteri Asam Laktat Menggunakan API 50 HCL test kit
API 50 CHL adalah test kit yang digunakan untuk identifikasi genus Lactobacillus hingga
ke tingkat spesies. Test kit tersusun atas 49 jenis gula (49 tube) yang selanjutnya akan
difermentasi oleh isolat yang akan diidentifikasi. Apabila isolat yang diuji mampu memfermentasi sumber gula dan menghasilkan asam, maka indikator bromkresol ungu akan mengubah warna larutan gula dari ungu menjadi kuning. Pembacaan hasil identifikasi menggunakan API WEB software (API bioMerieux) (Pelinescu et al., 2009).
2.2.11.Pembuatan Stok Bakteri Asam Laktat
Bakteri asam laktat yang telah diidentifikasi dapat disimpan apabila akan digunakan kembali dalam bentuk kultur stok dalam freezer dengan suhu hingga -10oC pada media
16 3. HASIL PENELITIAN
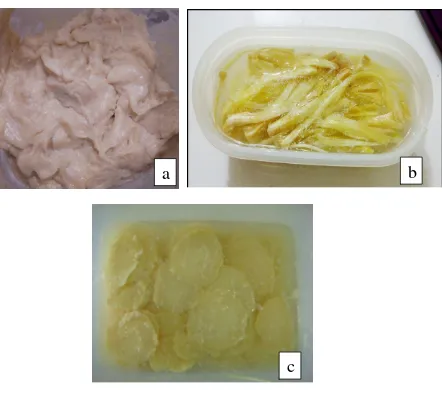
Proses fermentasi untuk durian, dami nangka dan rebung kuning berlangsung sekitar 7 hari secara fakultatif anaerob. Setelah proses fermentasi selesai, tekstur tempoyak menjadi lunak dan berwarna kuning krem (Gambar 7.a.). Fermentasi dami nangka yang sudah selesai teksturnya menjadi lunak dan beraroma alkohol (Gambar 7.b.). Setelah proses fermentasi asinan rebung kuning selesai, menghasilkan aroma alkohol yang menyengat, tekstur yang lunak dan warna rebung berubah menjadi kuning cerah (Gambar 7.c.).
Gambar 7. Tempoyak (a), mandai (b) dan asinan rebung (c) yang digunakan sebagai sumber bakteri asam laktat yang telah melalui proses fermentasi sekitar 7 hari
a
b
17 Berdasarkan hasil pengujian total asam laktat pada tempoyak diketahui bahwa rata-rata total asam laktat adalah 0,495% pada awal fermentasi dan terus meningkat hingga menjadi 1,770% pada akhir fermentasi. Total asam laktat mandai terus meningkat seiring dengan waktu fermentasi, hasilnya berkisar antara 0,0495% - 0,207%. Sedang kandungan asam laktat pada asinan rebung kuning bambu betung semakin meningkat siring bertambahnya waktu fermentasi. Total asam laktat pada hari ke–0 sebesar 0,285% dan pada hari akhir fermentasi (hari ke-7) adalah 0,534 %.
3.1.Isolasi dan Identifikasi Bakteri Asam Lakat Pada Tempoyak, Mandai, Dan Asinan Rebung Kuning Menggunakan Tes Biokimia
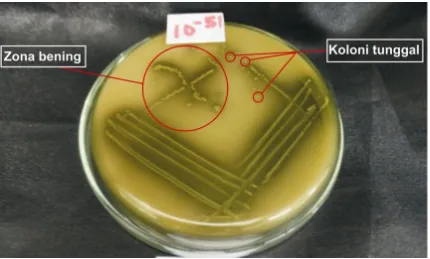
Koloni yang tumbuh pada media agar MRS yang mengandung 1% CaCO3 membentuk zona bening dan diidentifikasi sebagai bakteri asam laktat, kemudian dimurnikan pada media yang sama hingga membentuk koloni tunggal (Gambar 8).
18 3.1.1. Identifikasi Bakteri Asam Laktat Pada Tempoyak
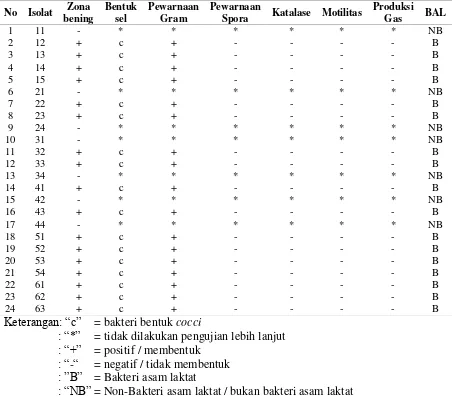
Setiap koloni asam laktat diidentifikasi lebih lanjut hingga tahap genus berdasarkan morfologi, pewarnaan gram, pewarnaan spora, aktivitas katalase, uji motilitas, produksi gas. Pada Tabel 2 diketahui bahwa dari 24 isolat, 7 isolat tidak termasuk bakteri asam laktat karena tidak membentuk zona bening (tanda *) sehingga tidak dilakukan pengujian lebih lanjut. Hasil pengujian menunjukkan semua isolat berbentuk cocci, gram positif, tidak
membentuk spora, katalase negatif, non-motil, dan tidak membentuk gas (homofermentatif).
19 Tabel 2. Hasil tes biokimia identifikasi bakteri asam laktat (BAL) pada tempoyak
Keterangan: “c” = bakteri bentuk cocci
: “*” = tidak dilakukan pengujian lebih lanjut : “+” = positif / membentuk
: “-“ = negatif / tidak membentuk : ”B” = Bakteri asam laktat
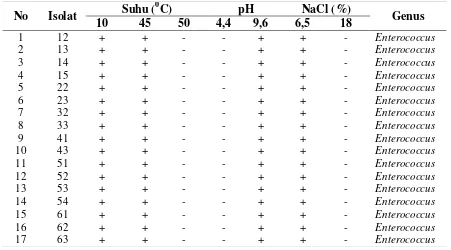
20 Tabel 3. Hasil uji kemampuan tumbuh 17 isolat BAL pada berbagai suhu, pH dan kadar
NaCl
Keterangan: “+” = tumbuh : “-“ = tidak tumbuh
Berdasarkan pada Tabel 3 dapat diketahui bahwa 17 isolat yang diuji dapat tumbuh pada suhu 100C dan 450C, tumbuh pada media dengan pH 9,6 serta tumbuh pada media yang mengandung 6,5% NaCl. Genus Enterococcus merupakan genus bakteri asam laktat yang
tumbuh pada suhu 10 dan 450C, media yang mengandung 6,5% NaCl dan pada pH 9,6.
Isolat yang mempunyai pertumbuhan terbaik dibandingkan dengan isolat lainnya berdasarkan nilai absorbansi pada uji kemampuan pertumbuhan pada berbagai suhu, pH dan NaCl (Lampiran 1; Tabel 12) diidentifikasi lebih lanjut menggunakan API 20 STREP
test kit. API 20 STREP test kit mengandung 20 jenis karbon (20 tube) difermentasi oleh
isolat yang akan diidentifikasi. Kemampuan bakteri asam laktat untuk memfermentasi berbagai jenis karbon diamati secara kualitatif berdasarkan perubahan warna yang terjadi sesuai dengan tube masing-masing. Isolat yang mampu memfermentasi berbagai sumber
karbon, akan mengalami perubahan warna pada tube API 20 STREP test kit seperti Tabel 4.
21 Tabel 4. Warna sumber karbon pada API 20 STREP test kit berdasarkan hasil fermentasi
(Negatif dan Positif)
Tube Komponen aktif Warna hasil fermentasi karbon
Negatif Positif
1 Pyruvate Coklat Merah
2 Hippurate Bening Biru gelap
3 Esculin Kuning pucat Hitam
4 Pyrrolidonyl-2-naphthlyamide Bening Jingga
5 6-Bromo-2-naphthyl_-D-dalactopryranosise Bening Violet
6 Naphthol AS-BI_-D-glucuranote Bening Biru
7 2-naphthyl-_-D-galactopyranoside Bening Violet
8 2- naphthyl phosphate Bening Violet
9 L-leucine-2-naphtylamide Bening Jingga
10 Arginine Kuning Merah
Berdasarkan nilai absorbansi uji kemampuan pertumbuhan pada berbagai suhu, pH dan NaCl (Lampiran 1; Tabel 12), diperoleh 2 isolat yang terbaik dan yaitu isolat 51 dan 63. Isolat 53 dan 61 menunjukkan perbedaan kemampuan memferrmentasi sumber karbon, isolat 51 mampu memfermentasi karbon 2-naphthyl phosphate sedangkan isolate 63 tidak dapat memfermentasi karbon tersebut. Setelah isolat 51 dan 63 diidentifikasi kemampuan memfermentasi berbagai sumber karbon (Tabel 5; Gambar 9), dilanjutkan analisa data dengan menggunakan API WEB software. Hasil identifikasi untuk kedua isolat bakteri
22 Tabel 5. Hasil identifikasi fermentasi berbagai sumber karbon menggunakan API 20
STREP test kit pada tempoyak
Keterangan: *+* : bakteri asam laktat mampu memfermentasi sumber karbon *-* : bakteri asam laktat tidak mampu memfermentasi sumber karbon
Tube Komponen Aktif Isolat
51 63
1 Pyruvate + +
2 Hippurate - -
3 Esculin + +
4 Pyrrolidonyl-2-naphthlyamide - -
5 6-Bromo-2-naphthyl_-D-dalactopryranosise + +
6 Naphthol AS-BI_-D-glucuranote - -
7 2-naphthyl-_-D-galactopyranoside + +
23 Gambar 9. Hasil identifikasi isolat 51 dan 63 menggunakan API 20 STREP test kit
3.1.2. Identifikasi Bakteri Asam Laktat Pada Mandai
Berdasarkan isolasi mandai pada media MRS agar dengan 1% CaCO3, diperoleh 24 koloni tunggal yang dapat dipisahkan menjadi dua kelompok yaitu 20 isolat termasuk dalam bakteri asam laktat (BAL) dan 4 isolat tidak termasuk BAL. Identifikasi genus BAL dilakukan berdasarkan morfologi, pewarnaan gram, aktivitas katalase, motilitas, produksi gas, dan kemampuan tumbuh pada suhu 10oC, 45oC, dan 50oC, pH 4,4 dan 9,6 serta kemampuan tumbuh pada konsentrasi NaCl 6,5%, dan 18% (Tabel 6 dan 7).
24 Tabel 6. Hasil tes biokimia identifikasi bakteri asam laktat (BAL) pada mandai
No Isolat Zona : “NB“ = tidak termasuk Bakteri Asam Laktat
25 genus Lactobacillus karena memiliki ciri-ciri: pada umumnya dapat tumbuh pada suhu
10oC, 45oC, dan 50oC, pada pH 4,4, dan pada konsentrasi NaCl 6,5%, serta tidak dapat tumbuh pada pH 9,6 dan konsentrasi NaCl 18%. Sedangkan 10 isolat lain belum dapat diidentifikasi karena ciri-ciri pertumbuhannya tidak termasuk dengan genus bakteri asam laktat lain seperti Carnobacterium (dapat tumbuh pada suhu 10oC tetapi tidak dapat tumbuh
pada suhu 45oC, konsentrasi NaCl 18% dan pada pH 9,6) dan Bifidobacterium (dapat
26 Nilai absorbansi uji kemampuan pertumbuhan pada berbagai suhu, pH dan NaCl (Lampiran 1; Tabel 13-15), diperoleh 2 isolat yang yang mewakili genus Lactobacillus yaitu isolat
1A1 dan 3B2. Setelah isolat 1A1 dan 3B2 diidentifikasi kemampuan memfermentasi berbagai sumber karbon dengan API 50 CHL test kit (Tabel 8; Gambar 10 dan 11),
dilanjutkan analisa data dengan menggunakan API WEB software. Hasil identifikasi
menunjukkan bahwa isolat 1A1 dan 3B2 merupakan Lactobacillus pentosus dengan tingkat
27 Tabel 8. Hasil identifikasi fermentasi berbagai sumber karbon menggunakan API 50 CHL
test kit pada mandai
Tube Komponen Aktif Isolat
1A1 3B2
28 Identifikasi dengan API 50 CHL test kit digunakan untuk mengetahui kemampuan isolat
untuk memfermentasi 49 jenis gula (Tabel 8). Diketahui adanya perbedaan jenis sumber karbon yang dapat difermentasi oleh isolat 1A1 dan isolat 3B2 yaitu pada kemampuan memfermentasi sumber karbon D-TAGatose. Isolat 1A1 tidak dapat memfermentasi sumber karbon TAGatose sedangkan isolat 3B2 dapat memfermentasi sumber karbon D-TAGatose. Perubahan warna dari API 50 CHL test kit dapat dilihat pada Gambar 10 dan 11.
31 3.1.3. Identifikasi Bakteri Asam Laktat Pada Asinan Rebung Kuning
32
: “*” = tidak dilakukan pengujian lebih lanjut
: “+” = positif / membentuk
: “-“ = negatif / tidak membentuk
: “B” = bakteri asam laktat
33 Tabel 10. Hasil uji kemampuan tumbuh 21 isolat BAL pada berbagai suhu, pH dan kadar
NaCl
Isolat bakteri asam laktat pada asinan rebung kuning tumbuh baik pada suhu 10oC hingga 50 oCkadar NaCl 6,5%, serta pada pH 4,4 dan 9,6 namun tidak dapat tumbuh pada kadar NaCl 18%. Sehingga diperoleh bahwa 8 isolat yang sesuai dengan ciri bakteri asam laktat dengan genus Lactobacillus, dimana genus Lactobacillus memiliki ciri-ciri pertumbuhan
spesifik yaitu tidak tumbuh pada kadar NaCl 18% dan pH 9,6. Sedangkan 13 isolat bakteri asam laktat yang lain belum dapat teridentifikasi karena kurang sesuai dengan ciri-ciri genus bakteri asam laktat berbentuk basil yang lain (Tabel 10). Dua isolat (111 dan 321) yang memiliki karakteristik terbaik untuk ciri-ciri pertumbuhan Lactobacillus yang nampak
dari nilai absorbansi terendah (Lampiran 1; Tabel 16-18), diuji dengan menggunakan API 50 CHL test kit. Setelah inkubasi selama 48 jam terjadi perubahan warna dari ungu menjadi
34 Tabel 11. Hasil identifikasi fermentasi berbagai sumber karbon menggunakan API 50 CHL
test kit pada asinan rebung kuning
Tube Komponen Aktif Isolat 111 321
36 Gambar 13. Hasil identifikasi isolat 321 dengan menggunakan API 50 CHL test kit.
Isolat 111 memiliki kemampuan dalam memfermentasi 25 jenis gula (perubahan warna menjadi kuning pada Gambar 12) dan merupakan Lactobacillus plantarum dengan
presentase kemiripan dengan ciri-ciri pada database API-LAB software sebesar 90,8%
(Gambar 19). Isolat 321 dapat memfermentasi 23 jenis gula (warna menjadi kuning pada Gambar 12) dan merupakan Lactobacillus pentosus dengan presentase kemiripan ciri-ciri
pada database API-LAB software sebesar 84,3% (Gambar 20). Perbedaan kedua isolat
37 4. PEMBAHASAN
Berdasarkan hasil pengujian total asam laktat pada tempoyak, mandai dan asinan rebung kuning menunjukkan adanya peningkatan selama proses fermentasi. Pada tempoyak diketahui rata-rata total asam laktat adalah 0,495% pada awal fermentasi dan meningkat menjadi 1,770% pada akhir fermentasi. Total asam laktat mandai terus meningkat dari 0,0495% sampai 0,207%. Sedang kandungan asam laktat pada asinan rebung kuning bambu betung semakin meningkat pada hari ke–0 sebesar 0,285% dan pada hari akhir fermentasi (hari ke-7) adalah 0,534 %.
Kandungan asam laktat yang meningkat mempunyai hubungan dengan perubahan pH. Semakin tinggi kandungan asam suatu bahan maka akan semakin rendah pH bahan tersebut (Ray & Bhunia, 2007). Bakteri asam laktat akan memproduksi asam laktat secara maksimal pada pH 5,5-6,0 akan berhenti pada pH 4,5 (Rehm & Reed, 1996). Hasil pengukuran pH pada akhir fermentasi rata-rata 4,5. Hal ini menunjukkan indikasi bahwa BAL berada pada fase stasioner pertumbuhannya, kecepatan pertumbuhan akan menurun karena jumlah nutrisi yang sedikit dan jumlah BAL mencapai optimum. Hal ini terjadi karena sebagian sel akan mati dan sel lainnya akan memperbanyak diri untuk mencapai kondisi yang stabil (Ray & Bhunia, 2007).
4.1.Identifikasi Bakteri Asam Laktat Menggunakan Tes Biokimia
Isolat yang diperoleh (17 untuk tempoyak, 15 untuk mandai dan 21 untuk asinan rebung kuning) diidentifikasi berdasarkan morfologi pewarnaan gram, pewarnaan spora, uji motilitas. Hasil identifikasi menunjukkan semua isolat berbentuk cocci, gram positif, tidak
membentuk spora dan tidak bergerak (non-motil) (Tabel 3, 7 dan 10 berurutan untuk
38 negatif dengan hidrogen peroksida (H2O2). Dengan demikian karakteristik isolat yang dihasilkan adalah karakteristik bakteri asam laktat.
Morfologi bakteri berdasarkan pewarnaan gram, dibedakan menurut komposisi dinding selnya. Bakteri gram positif (ungu) memiliki dinding sel yang tersusun atas lapisan peptidoglikan yang tebal yaitu 90% dari total komposisi dinding sel. Sedang bakteri gram negatif (merah muda) tersusun atas lapisan tipis peptidoglikan yaitu 10% dari total komposisi dinding sel dan sebagian besar berupa lipid (Smith & Hussey, 2005). Hasil pewarnaan gram menunjukkan bahwa seluruh isolat bakteri berwarna ungu dan berbentuk basil/batang (untuk mandai dan asinan rebng kuning), sedang bentuk cocci diperoleh pada isolat bakteri pada tempoyak. Menurut De Vuyst & Vandamme (1994), bakteri asam laktat yang berbentuk basil/batang termasuk genus Lactobacillus, Carnobacterium, dan Bifidobacterium. Pada pewarnaan spora, seluruh isolat tidak membentuk spora karena
berwarna merah.
Hasil pengujian semua isolat berdasarkan aktivitas katalase menunjukkan katalase negatif karena tidak membentuk gelembung gas. Katalase merupakan enzim yang berfungsi untuk menguraikan hidrogen peroksida menjadi air dan oksigen (2H2O2 2 H2O + O2 ) (Fugelsang & Edwards, 2007; Hendriksen et al., 2003).
Isolat yang diuji berdasarkan uji motilitas, diidentifikasi bersifat non motil karena hanya mengalami pertumbuhan di sepanjang garis inokulasi. Hal ini menunjukkan bahwa keseluruhan isolate BAL tidak memiliki flagella. Menurut Sharma (2007), flagella
merupakan struktur berfilamen yang tersusun atas protein yang melekat pada permukaan sel dan memungkinkan terjadinya pergerakan dari bakteri yang bersifat motil. Semua isolat pada tempoyak termasuk genus Enterococcus bersifat non-motil (Tabel 3).
Menurut Lorena (2005), genus Enterococcus tumbuh dengan baik pada suhu 100C-450C.
Hal ini sesuai dengan hasil uji pertumbuhan pada bebagai suhu, dimana isolat Enterococcus
39
Enterococcus bersifat homofermentatif yaitu hanya menghasil asam laktat sebagai hasil
metabolismenya yang ditunjukkan dengan tidak terbentuknya gelembung gas pada tabung durham dalam pangujian produksi gas (Tabel 2).
Identifikasi isolat pada mandai berdasarkan kemampuan memproduksi gas dilakukan di dalam media yang mengandung glukosa dan tidak mengandung glukonat. Hasil identifikasi menunjukkan bahwa dari 15 isolat yang diuji, 4 isolat merupakan bakteri asam laktat obligat heterofermentatif karena membentuk gas pada tabung durham. Sedangkan 11 isolat lainnya dapat termasuk dalam bakteri asam laktat fakultatif heterofermentatif atau obligat homofermentatif karena tidak membentuk gas pada tabung durham (Suryani et al., 2010;
De Vuyst & Vandamme, 1994).
Berdasarkan hasil tes biokimia dan hasil pengujian kemampuan pertumbuhan bakteri asam laktat pada berbagai suhu, pH serta kadar NaCl, maka dapat diketahui bahwa bakteri asam laktat yang terdapat dalam asinan rebung kuning termasuk dalam genus obligat homofermentatif atau fakultatif heterofermentatif Lactobacillus. Genus Lactobacillus
umumnya ditemukan pada substrat yang kaya akan karbohidrat seperti pada membran mukosa manusia, sayur-sayuran, buah-buahan, makanan hasil fermentasi serta makanan membusuk (Rahayu & Margino, 1997).
4.2.Identifikasi Bakteri Asam Laktat Menggunakan API 20 STREP Test Kit (Untuk Tempoyak)
Dua isolat Enterococcus yang dipilih yaitu isolat 51 dan 63 berdasarkan nilai absorbansi
terbesar pada uji suhu, pH dan NaCl (Lampiran 1; Tabel 12). diidentifikasi menggunakan API 20 STREP test kit, yang merupakan alat identifikasi bakteri asam laktat berdasarkan
kemampuan isolat memfermentasi berbagai sumber karbon (Pelinescu et al., 2009). Isolat
51 teridentifikasi sebagai Enterococcus faecium dengan signifikansi 99,1% dan isolat 61
teridentifikasi Enterococcus faecium dengan signifikannsi 99,2% (Lampiran 2; Gambar 14).
40 dalam memfermentasi karbon 2-naphthyl phosphate (warna tube violet), sedangkan isolat
63 tidak mampu memfermentasi jenis karbon tersebut (warna tube bening).
Hasil identifikasi isolat pada tempoyak (durian lokal Gunung Pati, Semarang) yang diperoleh berbeda dengan penelitian yang dilakukan Yuliana & Dizon (2011) pada fermentasi tempoyak di Filipina, dimana BAL yang teridentifikasi adalah Lactobacillus plantarum, Weissella paramesenteroides dan Pediococcus acidilactici. Hasil penelitian Yuliana & Dizon (2011), memiliki persamaan dan perbedaan karakteristik dengan
Enterococcus faecium. Persamaannya terletak pada keempat spesies berisifat gram positif,
katalase negatif dan non-motil. Sedangkan perbedaannya terdapat pada tipe fermentasi
dimana Weissella paramesenteroides bersifat heterofermentatif sendangkan Lactobacillus plantarum, Pediococcus acidilactici dan Enterococcus bersifat homofermentatif. Berdasarkan bentuknya Latobacillus plantarum dan Weissella paramesenteroides
berbentuk batang, sedangkan Pediococcus acidilactici dan Enterococcus berbentuk bulat. Berdasarkan pada suhu pertumbuhannya Pediococcus acidilactici dan Latobacillus plantarum merupakan kelompok bakteri termofilik yaitu dapat tumbuh pada suhu 10-500C,
kemudian Weissella paramesenteroides hanya dapat tumbuh pada suhu 370C sedangkan Enterococcus faecium termasuk dalam kelompok bakteri mesofil dapat tumbuh pada suhu
10-450C
Terdapatnya perbedaan hasil penelitian tersebut membuktikan bahwa faktor lingkungan seperti waktu, kelembapan, suhu, oksigen, dan substrat pertumbuhan dalam hal ini adalah varietas dan daerah asal durian yang digunakan berpengaruh terhadap hasil fermentasi tempoyak dan bakteri asam laktat yang berperan didalamnya.
4.3.Identifikasi Bakteri Asam Laktat Menggunakan API 50 CHL Test Kit (Untuk Mandai)
41 heterofermentatif Lactobacillus tidak dapat membentuk CO2 dari glukosa, tapi dapat membentuk CO2 dari glukonat. Hasil identifikasi isolat 1A1 dan 3B2 berdasarkan API 50 CHL test kit menunjukkan bahwa isolat 1A1 merupakan Lactobacillus pentosus dengan
tingkat signifikansi 91,6%. Sedangkan isolat 3B2 juga merupakan Lactobacillus pentosus
dengan tingkat signifikansi 97,3% (Lampiran 2; Gambar 15).
Identifikasi BAL yang diperoleh dari mandai (nangka Gunung Pati, Semarang) berbeda dengan BAL yang diperoleh dari mandai (nangka Kalimantan Selatan) (Rahayu, 2003). Hasil isolasi mandai nangka Kalimantan Selatan merupakan Lactobacillus plantarum-pentosus yang memiliki ciri-ciri: mampu tumbuh pada suhu 15oC dan 45oC, pada pH 3,5
dan 9,0; serta Streptococcus thermophillus, yang memiliki ciri-ciri: mampu tumbuh pada
suhu 15oC, 45oC, dan 50oC, serta pada pH 3,5 dan 9,0 (Rahayu, 2003). Sedangkan hasil isolasi mandai nangka Gunung Pati merupakan Lactobacillus pentosus dengan ciri-ciri:
pada umumnya dapat tumbuh pada suhu 10 oC, 45 oC, dan 50 oC, pada pH 4,4, dan pada konsentrasi NaCl 6,5%, namun tidak dapat tumbuh pada pH 9,6 dan konsentrasi NaCl 18%. Dengan demikian diketahui bahwa perbedaan tempat tumbuh nangka yang digunakan sebagai bahan pembuatan mandai akan mempengaruhi jenis dan kemampuan adaptasi dari bakteri asam laktat yang dapat diisolasi.
4.4.Identifikasi Bakteri Asam Laktat Menggunakan API 50 CHL Test Kit (Untuk Asinan Rebung Kuning)
Isolat 111 dan 321 memiliki kemampuan pertumbuhan paling rendah pada pH 9,6 bila dibandingkan dengan 6 isolat lain yang menunjukan ciri Lactobacillus. Kemampuan
pertumbuhan yang paling rendah ini ditunjukan dengan nilai absorbansi yang paling kecil bila dibandingkan 6 isolat lain yang menunjukan ciri Lactobacillus (Lampiran 1; Tabel 16-
18).
42 spesies Lactobacillus plantarum dengan presentase kemiripan dengan API WEB software
sebesar 90,8%, sedangkan isolat 321 teridentifikasi sebagai Lactobacillus pentosus dengan
presentase kemiripan dengan API WEB software API 50 CHL sebesar 84,3% (Lampiran 2;
Gambar 16).
Lactobacillus plantarum dan Lactobacillus pentosus memiliki karakteristik fenotip yang
mirip. Hal ini diperkuat dengan pernyataan dari Zanoni et al., (1987), dimana yang
membedakan Lactobacillus plantarum dan Lactobacillus pentosus adalah kemampuannya
dalam memfermentasi Gliserol, D-Melezitose, D-xilose, dan α-Methyl-D-Mannoside. Lactobacillus plantarum dapat memfermentasi D-Melezitose dan α-Methyl-D-Mannoside
namun tidak dapat memfermentasi Gliserol dan D-xilose, sedangkan Lactobacillus pentosus
dapat memfermentasi Gliserol dan D-xilose namun tidak dapat memfermentasi D-Melezitose dan α-Methyl-D-Mannoside. Hal ini sesuai dengan hasil identifikasi (Tabel 8),
dimana Lactobacillus plantarum dapat memfermentasi α-Methyl-D-Mannoside sedangkan Lactobacillus pentosus tidak dapat memfermentasi α-Methyl-D-Mannoside. Selain dari
pada kemampuan dari memfermentasi α-Methyl-D-Mannoside, hal lain yang membedakan Lactobacillus plantarum dan Lactobacillus pentosus adalah kemampuan dalam
memfermentasi α-Methyl-D-Glucoside. Lactobacillus plantarum dapat memfermentasi α -Methyl-D-Glucoside sedangkan Lactobacillus pentosus tidak dapat memfermentasi α -Methyl-D-Glucoside.
Lactobacillus plantarum serta Lactobacillus pentosus hasil isolasi asinan rebung kuning
bambu betung (Mranggen) memiliki karakteristik yang berbeda dengan Lactobacillus plantarum serta Lactobacillus pentosus yang diisolasi dari asinan rebung pada daerah
Palembang. Perbedaan karakteristik tersebut merupakan perbedaan kemampuan pertumbuhannya. Lactobacillus plantarum yang diisolasi dari asinan rebung yang berasal
dari daerah Palembang mampu tumbuh pada suhu 15oC-45oC serta pada pH 3,5 hingga pH 9, sedangkan Lactobacillus plantarum yang diisolasi dari asinan rebung kuning bambu
43 Selain itu, hasil penelitian asinan rebung (Palembang) diperoleh Lactobacillus pentosus
yang memiliki kemampuan pertumbuhan yang mirip dengan Lactobacillus plantarum yaitu
tumbuh pada suhu 15oC-45oC serta pada pH 3,5 hingga pH 9. Sedangkan Lactobacillus pentosus pada asinan rebung kuning bambu betung (Mranggen) mampu tumbuh pada suhu
44 5. KESIMPULAN DAN SARAN
5.1.Kesimpulan
Hasil isolasi tempoyak hasil fermentasi durian (Durio zibethinus Murr.) lokal
Gunung Pati, Semarang diperoleh 17 isolat bakteri asam laktat dan semua isolat bakteri asam laktat golongan genus Enterococcus. Berdasarkan uji fermentasi BAL
terhadap 20 komponen aktif sumber gula dengan menggunakan API 20 Strep test kit
diperoleh 2 dari 17 isolat Enterococcus adalah Enterococcus faecium dengan tingkat
signifikasnsi 99,1% dan 99,2% sedangkan 15 isolat lainya belum diidentifikasi. Hasil isolasi mandai nangka (Artocarpus heterophyllus Lamk) var. salak, Gunung
Pati diperoleh 15 isolat bakteri asam laktat yang terdiri atas 5 isolat bakteri asam laktat dengan genus Lactobacillus dan 10 isolat bakteri asam laktat yang belum dapat
diidentifikasi. Berdasarkan uji fermentasi BAL terhadap 49 komponen aktif sumber gula dengan menggunakan API 50 CHL test kit diperoleh 2 isolat merupakan Lactobacillus pentosus dengan tingkat signifikansi 91,6% dan 97,3%.
Pada asinan rebung kuning bambu betung (Dendrocalamus asper) lokal Mranggen,
Jawa Tengah, diperoleh 21 isolat yang termasuk dalam bakteri asam laktat yang terdiri atas 8 isolat bakteri asam laktat dengan genus Lactobacillus dan 13 isolat
bakteri asam laktat belum dapat teridentifikasi. Berdasarkan uji fermentasi BAL terhadap 49 komponen aktif sumber gula dengan menggunakan API 50 CHL test kit
diperoleh 2 isolat merupakan Lactobacillus plantarum dengan tingkat signifikansi
90,8% dan 97,3%. Lactobacillus pentosus dengan tingkat signifikansi 84,3%
5.2. Saran
Penelitian lanjutan diperlukan untuk mendukung penelitian ini, seperti:
Indentifikasi terhadap isolasi bakteri asam laktat lainnya yang belum dapat dilakukan pada penelitian ini baik pada isolasi tempoyak, mandai maupun asinan rebung kuning. Menguji kemampuan bakteri asam laktat hasil isolasi tempoyak, mandai, asinan rebung kuning dalam menghambat pertumbuhan berbagai bakteri patogen. Screening in vivo yang telah ditemukan (Enterococcus faecium, Lactobacillus
pentosus, Lactobacillus plantarum, Lactobacillus pentosus) untuk membuktikan
45 6. PENGHARGAAN
46 7. DAFTAR PUSTAKA
Andoko, A. 2003. Budidaya bambu rebung. Penerbit Kanisius. Yogakarta.
Al-Allaf, M. A. H., Al-Rawi, A. M. M., and Al-Mola, A. T. (2009). Antimicrobial activity of lactic acid bacteria isolated from minced beef meat against some pathogenic bacteria. Iraqi Journal of Veterinary Sciences. Vol 23. Supplement I:
115-117. <http://www.vetmedmosul.org/ijvs/media/conf-1-18e.pdf>. Diakses 5 Januari 2010.
Amin, M.A., J. Zakiah, Ng.L. Khim and K.W. Lai. 2006. Fermentation of tempoyak using isolated tempoyak culture. Research Journal of Microbiology. Vol 1 (3):
243-254.
______________________________. 2004. Effect of salt on tempoyak fermentation and sensory evaluation. Journal of Biology Science. Vol 4 (5): 650-653.
Battcock, M. and S. Azam-Ali. 1998. Fermented fruits and vegetables, a global perspective. FAO Agricultural Services Bulletin No. 134.
http://www.fao.org/docrep/x0560e/x0560e10.htm. Diaskes tanggal 7 januari 2012.
De Vuyst, L. and Vandamme, E.J. 1994. Bacteriocins of Lactic Acid Bacteria. Blackie
Academic & Professional. Glasgow.
Fugelsang, K.C., and Edwards, C.G. 2007. Wine Microbiology, Practical Applications and Procedures. Springer Science + Bussiness Media LLC: New York, USA.
Gawad, A.E., A.E. Fatah and A. Rubayyi. 2010. Identification and Characterization of Dominan Lactic Acid Bacteria Isolated from Traditional Rayeb Milk in Egypt.
Journal of American Science Vol 6 (10): 728-735.
Hendriksen, R.S., Agenaar, J., Bergen, M.V. 2003. Identification of Thermotolerant Campylobacter.http://www.antimicrobialresistance.dk/data/images/campylobacter
4_pdf.pdf. Diakses tanggal 21 Februari 2012.
Hui, Y. H., Meunier-Goddik, L., Hansen, Å. S., Josephsen, J., Stanfield, P. S., and Toldrá, F. (2004). Handbook of food and Beverage Fermentation Technology.
Marcel Dekker, Inc. United States of America.
47 Lorena, M. 2005. Enterococci in Milk Product. Dissertation. University Palmerston
North. New Zealand.
http://epicentre.massey.ac.nz/Portals/0/EpiCentre/Downloads/Publications/Thesi s/MirthaGimenezMVSFinal.pdf. Diakses tanggal 4 Maret 2012.
Madigan, M. T., Martinko, J. M., and Parker, J. (2003). Brock Biology of Microorganism 10th ed. Pearson Education, Inc. New Jersey. xxv + 1019 p.
Nur, H.S. 2009. Suksesi mikroba dan aspek biokimiawi fermentasi mandai dengan kadar garam rendah. Makara Sains. Vol. 60(1): 13-16.
Pelinescu, D.R., E. Sasarman, M. Carmen, Chifiriuc, I. Stoica, A.M. Nohit, I. Avram, F. Serbancea, and T. V. Dimov. 2009. Isolation and identification of some Lactobacillus and Enterococcus strains by a polyphasic taxonomical approach.
Romanian Biotechnological Letters. Vol 14 (2): 4225-4233.
Rahayu, E.S. 2003. Lactic acid bacteria in fermented foods of Indonesian origin.
Agritech. Vol.23 (2): 75-84.
. dan S. Margino. 1997. Bakteri Asam Laktat: Isolasi dan Identifikasi. PAU
Pangan dan Gizi. Universitas Gajah Mada. Yogyakarta.
Rai, S. 2007. Edible bamboo shoot. A review. Bulletin of Arunachal Forest Research. Vol. 23: 39-44. Health. In Symposium: Probiotic Bacteria: Implication for Human Health. American Society for Nutritional Science. Journal of Nutrition Vol 130:
396S-402S.
Rukmana, R. 1992. Durian budidaya dan pascapanen. Penerbit Kanisius. Yogyakarta.
Savadogo, A., Ouattara, C. A. T., Bassole, H. N., and Traore, A., S. (2004). Antimicrobial Activities of Lactic Acid Bacteria Strains Isolated from Burkina Faso Fermented Milk. Pakistan Journal of Nutrition 3 (3) : 174-179.
<http://www.pjbs.org/pjnonline/fin202.pdf>. Diakses tanggal 19 November 2009.
Sharma, A. 2007. Structure of Archael, Eubacterial, and Eukaryotic Microbial Cells.
48 Smith, A.C. and Hussey, M.A. 2005. Gram Stain Protocol.
http://www.microbelibrary.org/component/resource/gram-stain/2886-gram-stain-protocols. Diakses tanggal 3 Maret 2012.
Sneath, P.H.A., N.S. Mair, M.E., Sharpe, J.G. Holt. 1984. Bergeys Manual of Systematic Bacteriology. Vol 2. Williams & Wilkins. Baltimore. New York.
Soomro, A.H., Masud, T., and Anwaar, K. 2002. Role of Lactic Acid Bacteria (LAB) in Food Preservation and Human Health – A Review. Pakistan Journal of Nutrition Vol 1(1): 20-24.
Suryani, Y., Astuti, Oktavia, B., Umniyati, S. 2010. Isolasi dan Karakterisasi Bakteri Asam Laktat dari Limbah Kotoran Ayam Sebagai Agensi Probiotik dan Enzim Kolesterol Reduktase. Prosiding Seminar Nasional Biologi 3 Juli 2010.
Universitas Negeri Yogyakarta.
Tadasse, G., Ephraim, E., and Ashenafi, M. (2005). Assessment of the antimicrobial activity of lactic acid bacteria isolated from Borde and Shamita, traditional Ethiopian fermented beverages, on some food-borne pathogens and effect of growth medium on the inhibitory activity. Internet Journal of Food Safety V:
13-20.
<http://www.internetjfs.org/articles.ijfsv5-3pdf>. Diakses tanggal 19 November 2010.
Verheij, E.W.M. and Coronel, R.E. 1997. Plant Resources of South-Asia 2: Edible fruits and nuts (Sumber daya nabati Asia Tenggara 2: buah-buahan yang dapat dimakan. Diterjemahkan oleh: Sarkat Danimihardja, Hadi Sutarno, Ning Wikan Utami, Djaja Siti Hazar Hoeden). PT Gramedia Pustaka Utama. Jakarta.
Yuliana, N. and E.I. Dizon. 2011. Phenotypic Identification of Lactic Acid Bacteria Isolated from Tempoyak (Fermented Durian) Made in the Philippines.
International of Journal Biology, Vol 3 (2): 145-151.
Zanoni, P.,Farrow, J.A., Phillips, B.A., and Collins, M.D. 1987. Lactobacillus pentosus