4
Bab II
Tinjauan Pustaka
II.1 Karbon
Karbon merupakan unsur dengan nomor atom 6 dan berat atom sebesar 12,0107 g/mol. Karbon memiliki dua isotop di alam yaitu 12C dengan kelimpahan 98,89% dan 13C dengan kelimpahan 1,11%. Isotop 14C merupakan isotop dengan waktu paruh 5730 tahun, terdapat pada material kayu dan spesimen-spesimen arkeologi. Salah satu sifat atom karbon yang menarik dan istimewa adalah katenasi (catenate) yaitu kemampuan secara alamiah untuk melakukan ikatan dengan atom sesamanya membentuk rantai atau cincin karbon baik dengan ikatan tunggal maupun dengan ikatan rangkap. 3
Tabel II.1 Sifat fisik atom karbon 4
Wujud Padat (pada suhu kamar)
Bilangan oksidasi 4 dan 2
Keelektronegatifan 2,55 (skala Pauling) Energi ionisasi Pertama : 1086,5 kJ·mol−1
Kedua : 2352,6 kJ·mol−1 Ketiga : 4620,5 kJ·mol−1
Jari-jari atom 70 pm
Jari-jari kovalen 77 pm Jari-jari Van der Waals 170 pm Sifat magnetik Diamagnetik
Titik sublimasi 4000 K
Panas penguapan 355,8 kJ.mol-1
Alotrop karbon merupakan keberadaan unsur karbon dalam dua atau lebih bentuk yang berbeda-beda. Berdasarkan sifat kristalinnya, alotrop karbon dibedakan atas karbon kristalin dan karbon non kristalin. Yang termasuk karbon kristalin antara lain adalah grafit, intan dan fuleren, sedangkan karbon non kristalin misalnya karbon aktif.
5
II.1.1 Grafit
Grafit merupakan bentuk kristalin karbon berbentuk serbuk dan berwarna hitam. Grafit alam terdapat dalam bentuk endapan dengan kemurnian, ukuran kristal dan kesempurnaan yang beragam. Beberapa sifat fisik grafit adalah sebagai berikut :
Tabel II.2 Sifat fisik grafit 4
Rapat massa 2,267 g.cm-3
Panas fusi 100 kJ.mol-1
Kapasitas panas (25˚C) 8,517 J.mol-1.K-1 Konduktivitas termal (300K) 119 – 165 W.m-1.K-1 Tingkat kekerasan (Mohs) 1 – 2
Dalam struktur grafit, setiap atom hanya dikelilingi oleh tiga atom tetangganya. Setelah membentuk ikatan Setelah membentuk ikatan ∏ dengan setiap atom tetangganya, kemudian berpasangan ke dalam sistem ikatan ∏ Resonansi yang terjadi menghasilkan kesetaraan ikatan antar atom karbon yang membentuk struktur heksagonal sehingga jarak ikatan C – C semuanya berjarak 1,415 . Jarak ini sedikit lebih panjang dari pada jarak C – C yang sesuai dengan orde ikatannya yaitu sebesar 1,33 . Struktur kristal grafit adalah heksagonal di mana ikatan antara atom-atom karbonnya membentuk orbital atom trigonal yang saling berikatan membentuk ikatan kovalen dengan hibridisasi sp2. Hal ini terjadi karena hanya ada tiga orbital ikatan yang terlibat secara efektif terlokalisasi maka orbital keempat memungkinkan elektron bergerak bebas pada lapisan atom C, sehingga menyebabkan grafit bersifat konduktor.4
Struktur kristal grafit terdiri atas pelat-pelat karbon yang disebut lapisan grafena, yang tersusun secara sempurna pada sumbu tegak dan tersusun pada posisi tumpang tindih secara paralel menurut susunan ABAB... di mana A menunjukkan lapisan grafena bentuk pertama dan B lapisan bentuk kedua. Jarak antar lapisan grafena ini sebesar 3,35 Å dengan energi ikatan antar lapisan grafena sebesar 17 kJ.mol-1, sedangkan energi ikatan antar atom C – C dalam suatu lapisan grafena sebesar 477 kJ.mol-1. Berdasarkan data ini, berarti bahwa ikatan antar lapisan grafena lebih lemah. Hal ini menyebabkan sifat halus dan licin
6
karena lapisan grafena yang satu relatif lebih mudah bergeser terhadap lapisan yang lain.3
II.1.2 Intan
Intan merupakan bentuk kristalin dari alotrop karbon yang transparan secara optik dalam daerah sinar tampak dan IR dalam spektrum elektromagnetik. Intan merupakan material yang paling keras dari semua material yang telah ditemukan. Beberapa sifat fisik intan adalah sebagai berikut : 4
Tabel II.3 Sifat fisik intan
Rapat massa 3,513 g.cm-3
Panas fusi 120 kJ.mol-1
Kapasitas panas (25˚C) 6,1155 J.mol-1.K-1 Konduktivitas termal (300K) 900 – 2320 W.m-1.K-1 Diffusivitas termal (300K) 503 – 1300 mm2/s Tingkat kekerasan 10,0 (Mohs)
Struktur kristalin intan terdiri dari dua kisi kubus berpusat muka yang tersusun dengan setiap atom karbon terikat secara kovalen membentuk struktur tetrahedral yang disebut struktur kubus kristal intan. Ikatan antar atom karbon membentuk hibrisasi sp3 yang secara efektif membatasi pergerakan elektron di dalam kristal yang menyebabkan intan tidak reduktif. Struktur intan memiliki sudut ikatan 109o dengan panjang ikatan sebesar 1,54 Å dan rapat massa 3,513 g.cm-1. Pada kondisi yang sama dengan pembentukkan intan, karbon dapat membentuk tiruan intan yang disebut lonsdeleit. Struktur lonsdeleit sangat mirip dengan intan, bedanya struktur ini membentuk kristalin heksagonal.4
II.1.3 Fuleren
Fuleren atau buckyball memiliki struktur seperti grafit, namun susunannya
dapat berupa pentagonal, heksagonal atau heptagonal, dengan lembaran-lembarannya membentuk suatu sferik, ellips atau silinder. Beberapa bentuk
7
fuleren yang telah ditemukan antara lain C38, C60, C70, C540 dan tabung nanokarbon.4
II.2 Karbon Aktif
Karbon aktif merupakan material amorf berkarbon yang memiliki luas permukaan yang besar yang dibangun oleh struktur pori internalnya melalui proses karbonisasi dan aktivasi. Karbon aktif memiliki luas permukaan yang besar sekitar 500 m2/gram bahkan bisa mencapai 1500 m2/gram. Karbon aktif memiliki densitas yang berbeda-beda. Karbon aktif juga memiliki tingkat kekerasan yang berbeda-beda terhadap tekanan atau geseran tertentu. Perbedaan densitas dan kekerasan karbon aktif sangat bergantung dari bahan baku dan cara pengaktivannya. 4
Berdasarkan bentuknya, karbon aktif dapat dibedakan dalam empat golongan yaitu :
1. Karbon aktif serbuk (powdered activated carbon) berbentuk serbuk dengan ukuran partikel kurang dari 0,8 mm.
2. Karbon aktif granular (granular activated carbon), memilik partikel-partikel yang tidak rata dengan ukuran 0,2 – 5,0 mm.
3. Karbon aktif pelet (pelleted activated carbon), berbentuk silinder dengan ukuran diameter 0,8 – 5,0 mm. Karbon aktif ini umumnya digunakan untuk aplikasi dalam fasa gas karena memiliki kandungan debu yang rendah, tetesan bertekanan rendah tapi memilki kekuatan mekanis yang tinggi.
4. Karbon aktif terlapisi polimer (polimers coated carbon), merupakan pori-pori karbon yang dapat dilapisi dengan biopolimer yang mungkin untuk menghasilkan permukaan yang halus dan permeabel tanpa menutupi pori, menghasilkan suatu karbon yang berguna untuk hemoperfusi yaitu suatu teknik treatmen di mana ke dalam darah pasien ditekan dengan senyawa adsorben untuk mengeluarkan senyawa toksik dari dalam darah.
Berdasarkan pori-porinya, karbon aktif dapat dibedakan menjadi tiga jenis yaitu :4 1. Makropori.
8
Merupakan bagian paling luar dari karbon aktif, dengan jari-jari lebih besar dari 25 nm dengan volum pori-pori 0,2 – 0,5 cm3.g-1 dan luas permukaan 0,2 -2 m2.g-1. Makropori dan mesopori memberikan kapasitas adsorpsi karbon aktif dan keduannya terbentuk selama proses aktivasi. 2. Mesopori.
Memiliki jari-jari 1 – 25 nm dengan volum pori-pori mencapai 0,02 – 0,01 cm3.g-1 dengan luas permukaan 1 – 100 m2.g-1. Mesopori merupakan cabang setelah makropori dan berfungsi sebagai sarana transportasi.
3. Mikropori.
Merupakan pori-pori terkecil dengan jari-jari kurang dari 1 nm dengan volum pori 0,15 – 0,5 cm3.g-1 dan luas permukaan mencapai 100 – 1000 m2.g-1.
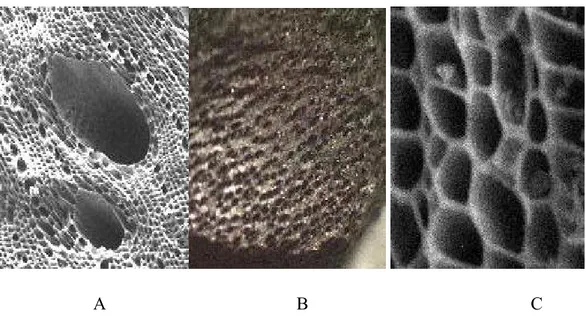
Perbedaan bentuk morfologis permukaan dan pori suatu karbon aktif dapat diamati melalui gambar hasil SEM (Scanning Electron Microscopy) seperti terlihat pada gambar di bawah ini.
A B C
Gambar II.1 Bentuk morfologis permukaan dan pori karbon aktif 4 (A) Makropori, (B) Mesopori, (C) Mikropori
9
II.2.1 Pembuatan Karbon Aktif
Bahan baku pembuatan karbon aktif berasal dari hewan,
tumbuh-tumbuhan, limbah ataupun mineral yang mengandung karbon antara lain: tulang, sekam, tongkol jagung, tempurung kelapa, dan lain-lain.
Karbon dapat dihasilkan secara tradisional, misalnya dengan menggunakan drum atau lubang dalam tanah, dengan tahap pengolahan sebagai berikut : bahan yang akan dibakar dimasukkan dalam lubang atau drum yang terbuat dari plat besi, kemudian dinyalakan sehingga bahan baku tersebut terbakar, pada saat pembakaran, drum atau lubang ditutup sehingga hanya ventilasi yang dibiarkan terbuka. lni bertujuan sebagai jalan keluarnya asap. Ketika asap yang keluar berwarna kebiru-biruan, ventilasi ditutup dan dibiarkan selama kurang lebih 8 jam atau satu malam. Dengan hati-hati lubang atau tutup drum dibuka dan dicek apakah masih ada bara yang menyala. Jika masih ada yang menyala, lubang atau drum ditutup kembali. Tidak dibenarkan mengggunakan air untuk mematikan bara yang sedang menyala, karena dapat menurunkan kualitas karbon.5
Selain cara di atas, karbon juga dapat dihasilkan dengan cara destilasi kering. Dengan cara ini, bahan baku dipanaskan dalam suatu ruangan vakum. Hasil yang diperoleh berupa residu yaitu arang dan destilat yang terdiri dari campuran metanol dan asam asetat. Residu yang dihasilkan bukan merupakan karbon murni, tetapi masih mengandung abu dan tar yang mempunyai titik didih tinggi. Karbon hasil proses karbonisasi ini juga masih mengandung beberapa gugus fungsi senyawa karbon seperti gugus keton, karboksilat, alkohol dan eter siklik.5 O O H OH O HO OH H O O OH O O Gambar II.2 Struktur hipotetik pelat karbon hasil karbonisasi
10
Untuk mendapatkan karbon aktif yang baik, maka karbon hasil proses karbonisasi perlu dilakukan aktivasi. Yang dimaksud dengan aktivasi adalah suatu perlakuan terhadap karbon yang bertujuan untuk memperbesar pori yaitu dengan cara memecahkan ikatan hidrokarbon atau mengoksidasi molekul- molekul permukaan sehingga karbon mengalami perubahan sifat, baik fisika maupun kimia, yaitu luas permukaannya bertambah besar dan berpengaruh terhadap daya adsorpsinya.5
Metoda aktivasi yang umum digunakan dalam pembuatan karbon aktif adalah : a. Aktivasi kimia yaitu proses pemutusan rantai karbon dari senyawa
organik dengan menggunakan bahan-bahan kimia. Beberapa senyawa yang dapat digunakan sebagai zat aktivator antara lain : asam borat, asam nitrat, asam phospat, asam sulfat, besi(III) klorida, seng klorida, mangaan klorida, kalium karbonat, kalium sulfida, kalium hidroksida, kalium tiosianat, natrium hidroksida, natrium fosfat, natrium sulfat, mangaan sulfat, kalsium hidroksida, kalsium klorida, kalsium fosfat dan sianida. b. Aktivasi fisika yaitu proses pemutusan rantai karbon dari senyawa organik
dengan menggunakan panas, uap dan gas CO2.
Untuk aktivasi fisika, biasanya arang dipanaskan di dalam tungku pada temperatur 800-900°C. Oksidasi dengan udara pada temperatur rendah, merupakan reaksi eksoterm sehingga sulit untuk mengontrolnya. Sedangkan pemanasan dengan uap air atau CO2 pada temperatur tinggi merupakan reaksi endoterm, sehingga lebih mudah dikontrol dan paling umum digunakan. Beberapa bahan baku lebih mudah untuk diaktivasi jika diklorinasi terlebih dahulu. Selanjutnya dikarbonisasi untuk menghilangkan hidrokarbon yang terklorinasi dan akhimya diaktivasi dengan uap air.
Untuk aktivasi kimia, bahan baku dicampur dengan bahan-bahan kimia, kemudian campuran tersebut dipanaskan pada temperatur 500-900°C. Selanjutnya didinginkan, dicuci untuk menghilangkan dan memperoleh kembali sisa-sisa zat kimia yang digunakan Akhirnya, diayak sesuai dengan ukuran partikel yang diinginkan dan dikeringkan. Bahan baku dapat dihaluskan sebelum atau setelah aktivasi.5
11
Beberapa batasan pada penguraian komponen bahan baku yang terjadi karena pemanasan pada proses destilasi kering yaitu:6
a. Batasan A adalah suhu pemanasan sampai 200°C. Air yang terkandung dalam bahan baku keluar menjadi uap, sehingga bahan baku menjadi kering, retak-retak dan bengkok. Kandungan karbon lebih kurang 60 %. b. Batasan B adalah suhu pemanasan antara 200-280°C. bahan baku secara
perlahan-lahan menjadi arang dan destilat mulai dihasilkan. Warna arang menjadi coklat gelap serta kandungan karbonnya lebih kurang 70%.
c. Batasan C adalah suhu pemanasan antara 280-500°C, terjadi karbonisasi selulosa, penguraian lignin dan menghasilkan tar. Arang yang terbentuk berwarna hitam serta kandungan karbonnya meningkat menjadi 80%. Proses pengarangan secara praktis berhenti pada temperatur 400°C.
d. Batasan D adalah suhu pemanasan 500°C, terjadi proses pemurnian arang, di mana pembentukan ter masih terus berlangsung. Kadar karbon akan meningkat mencapai 90%. Pemanasan diatas 700°C, hanya menghasilkan gas hidrogen.
Faktor-faktor yang mempengaruhi hasil destilasi kering bahan baku adalah kematangan/kekerasan bahan baku, suhu, tekanan dan lama destilasi. Udara juga mempunyai peranan dalam proses destilasi kering. Dengan persediaan udara terbatas, bahan baku hanya terkarbonisasi dan tidak teroksidasi.
Namun untuk bahan baku tertentu, seperti sekam padi, mengandung cukup banyak silika yang belum terpisahkan setelah proses karbonisasi. Untuk membersihkan silika dari karbon hasil karbonisasi maka perlu ditambahkan reaktan tertentu yang dapat bereaksi dengan silika. Alternatif yang dapat digunakan adalah dengan menambahkan HF, NaOH atau Na2CO3. Pereaksi tersebut memerlukan penanganan khusus, untuk yang pertama karena sifat toksiknya, sedangkan untuk yang kedua dan ketiga reaksinya terjadi pada kondisi cairan.
Reaksinya adalah sebagai berikut :3
12
2NaOH(l) + SiO2(s) Na2SiO3(s) + H2O(l)
Proses pembuatan karbon aktif dapat dilakukan melalui tiga tahap yaitu:5
a. Dehidrasi yaitu proses penghilangan air. Bahan baku dipanaskan sampai temperatur 170°C.
b. Karbonisasi yaitu pemecahan bahan-bahan organik menjadi karbon. Temperatur di atas 170°C akan menghasilkan CO, CO2 dan asam asetat. Pada temperatur 275°C, dekomposisi menghasilkan tar, metanol dan hasil samping lainnya. Pembentukan karbon terjadi pada temperatur 400 – 600˚C.
c. Aktivasi yaitu dekomposisi tar dan perluasan pori-pori. Dapat dilakukan dengan uap atau gas CO2 sebagai aktivator.
II.2.2 Standar Mutu Karbon Aktif
Menurut persyaratan Standard Industri Indonesia (SII) Nomor 0258 – 79, karakteristik suatu karbon aktif sebagai berikut :7
Kadar air : maksimum 10%
Kadar abu : maksimum 2,5%
Kadar zat terbang : maksimum 25%
Kadar karbon : minimum 65%
Bagian yang tidak diperarang : tidak nyata Daya serap terhadap larutan I2 : minimum 20%
II.2.3 Manfaat Karbon Aktif
Pemanfaatan karbon aktif antara lain untuk mengatasi masalah lingkungan (penanganan limbah), pemurnian gas, pemanfaatan dalam bidang medis dan
lain-lain. Karbon aktif juga dapat digunakan sebagai katalis pada pembuatan asam sulfat dari larutan belerang dioksida. Dalam hal ini karbon aktif berfungsi sebagai pengadsorpsi belerang dioksida dari larutan aquousnya, kemudian dioksidasi lebih lanjut di permukaan karbon aktif menjadi belerang trioksida dan dengan adanya molekul air terjadi reaksi pembentukan asam sulfat yang kemudian lepas dari permukaan karbon aktif.8
13
Pemanfaatan karbon aktif antara lain sebagai berikut : 5
1. Dalam pemurnian gas digunakan untuk desulfurisasi yaitu menghilangkan gas beracun, bau busuk, asap dan pencegahan racun.
2. Dalam pengolahan LNG digunakan dalam proses desulfurisasi.
3. Digunakan sebagai katalis atau pengemban dalam bebagai reaksi misalnya untuk mengkatalisa pembentukan sulfur klorida dari sulfur dioksida dan klorin, sebagai pengemban dalam reaksi karbon aktif juga sebagai promoter yang mempengaruhi laju reaksi.
4. Dalam industri obat dan makanan digunakan sebagai bahan penyaring dan penghilang warna, bau serta rasa yang tidak dikehendaki.
5. Dalam industri minuman keras dan ringan digunakan untuk menghilangkan bau dan warna.
6. Dalam budi daya udang dan benur berguna untuk pemurnian air, menghilangkan amonia, nitrit, fenol dan logam berat.
7. Dalam kimia perminyakan digunakan dalam penyaringan bahan mentah atau zat antara.
8. Dalam pengolahan air bermanfaat untuk menghilangkan atau menyaring zat bau, zat warna dan bahan pencemar.
9. Di bidang penyaringan minyak, makanan dan glukosa, untuk menghilangkan bau, warna, serta rasa yang tidak dikehendaki.
10. Dalam pengolahan pulp digunakan pemurnian dan penghilang bau.
11. Kegunaan yang lain antara lain sebagai penghilang bau dalam kamar pendingin dan mobil, bahan penarik kembali bebagai pelarut, crude oil, karet, larutan asam, metanol, etil asetat dan lain-lain.
II.3 Karakterisasi
Karakterisasi terhadap karbon aktif dilakukan antara lain untuk mengidentifikasi sifat-sifat karakteristik seperti : muatan potensial nol, isoterm adsorpsi, gugus permukaan dan bentuk morfologi pori.
14
II.3.1 Kadar Abu
Abu mengandung senyawa-senyawa SiO2, Al2O3, P2O5, Fe2O3, dan lain-lain. Abu dapat mengurangi keaktifan karbon aktif. Abu juga mengurangi efisiensi pada proses pengaktifan kembali (reaktivasi) dari karbon aktif. Semakin tinggi kadar abu, secara umum akan mempengaruhi tingkat pengotoran, keausan, dan korosi peralatan yang dilalui. Oksida-oksida logam (Fe2O3) yang dapat larut, ke luar dari karbon aktif menghasilkan material tak berwarna. Kadar abu secara nyata dapat ditunjukkan dari kelarutannya dalam air atau asam. 4
Kandungan abu dalam suatu arang tergantung dari jenis bahan bakunya. Untuk bahan baku dari sekam padi, fraksi terbesar yang terkandung dalam abu adalah silika. Menurut laporan IPSIT, komposisi abu dari sekam padi adalah sebagai berikut :
Tabel II.4 Komposisi abu dari sekam padi 1
Komposisi Fraksi massa (%)
Silika 80 – 90 Alumina 1 – 2,5 Besi(III) oksida 0,5 Kalsium oksida 1 – 2 Magnesium oksida 0,5 – 2,0 Kalium oksida 0,2
Bagian yang hilang pada pelelehan 10 – 20
II.3.2 Titrasi Massa dan Reaksi Asam-Basa
Karakterisasi karbon aktif biasanya juga dilakukan dengan membandingkan suatu produk terhadap karbon aktif komersial dan norit melalui eksperimen titrasi asam basa dan titrasi massa. Kuantifikasi adanya gugus-gugus basa dan asam ditunjukkan dengan kurva titrasi turunan pertama atau kedua. Jika digunakan asam nitrat dan natrium hidroksida, maka reaksi pada permukaan material karbon dapat dituliskan : 9
15
HA(s) + NaOH(aq) A-Na+(s) + H2O(l) B(s) + HNO3(aq) BH+NO3-(s)
Metode titrasi massa dikembangkan sebagai suatu cara yang cocok untuk penentuan titik muatan potensial nol (pzc) dan densitas muatan permukaan (σ0) pada suatu partikel-partikel koloid oksida logam pada perbedaan kekukatan ionik. Dalam titrasi massa, ke dalam serbuk oksida logam ditambahkan larutan elektrolit dan pH kesetimbangan dispersi diukur. pH sistem akan berubah secara teratur dan mendekati suatu harga tetap, pH , di mana dalam hal ini potensial suatu oksida logam bebas tak murni sama dengan titik muatan potensial nol, pHpzc.10
Sedangkan titrasi massa pada suatu karbon aktif, dengan mengasumsikan bahwa permukaan material karbon memilki gugus fungsional satu basa dan satu asam yang ditentukan oleh harga pKa, pKb dan pH suspensi, tapi masing-masing berdiri sendiri. Indikator yang digunakan adalah harga potensial nol ( potential of
zero charge) atau pzc yang didefinisikan sebagai harga pX di mana muatan
permukaan adalah nol. Untuk material karbon, harga pX adalah sama dengan harga pH atau pOH.9
Reaksi yang terjadi dapat dituliskan sebagai berikut : HA(s) + H2O (l) A-(s) + H3O+(aq) B(s) + H2O(l) BH+(s) + OH-(aq)
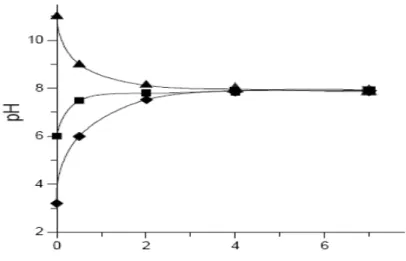
Dalam pengukuran, karbon aktif dengan massa tertentu disuspensikan dengan larutan asam, basa atau air dan setiap penambahan jumlah larutan, pH suspensi diukur. Titik muatan potensial nol (pzc) dapat ditentukan berdasarkan grafik hubungan antara konsentrasi massa karbon aktif dalam larutan (w/v) terhadap pH suspensi. Gambar II.3 di bawah ini memperlihatkan kurva titrasi massa tiga sampel karbon aktif menggunakan larutan HNO3, di mana ketiga sampel tersebut masing-masing memiliki titik muatan nol (TMN) sebesar 11,0, 6,0 dan 3,0.
16
Konsentrasi Massa (g/mL)
Gambar II.3 Hubungan antara pH dan konsentrasi massa 9
II.3.3 Adsorpsi
Sorpsi merupakan istilah umum yang menggambarkan pergerakan materi dari satu fasa ke fasa lain. Bila sorpsi hanya terjadi pada permukaan fasa lain disebut adsorpsi, sedangkan bila materi tersorpsi terbagi rata di seluruh fasa disebut absorpsi.
Teori adsorpsi menyatakan bahwa adsorpsi yang terjadi pada permukaan zat padat disebabkan karena ada gaya tarik atom atau molekul pada permukaan zat padat. Adsorpsi dibedakan atas adsorpsi fisika dan adsorpsi kimia. Gaya yang menyebabkan adsorpsi fisik adalah sama seperti yang menyebabkan kondensasi gas untuk membentuk cairan yang dikenal dengan gaya Van der Waals. Dalam adsorpsi kimia terjadi pembentukan ikatan kimia yang sedemikian ketatnya sehingga spesi aslinya tidak ditemukan.
Adsorpsi merupakan proses di mana karbon aktif memindahkan partikel-partikel adsorbat dari dalam pelarut (air), melalui interaksi kimia atau fisika. Adsorpsi suatu adsorbat oleh karbon aktif melalui tiga langkah. Pertama, adsorbat terserap ke permukaan luar (exterior) granula karbon aktif. Kedua, adsorbat bergerak menuju pori-pori karbon aktif. Dan ketiga adsorbat terserap ke dinding dalam (interior) karbon aktif. 11
17
Kapasitas adsorpsi karbon aktif umumnya diukur berdasarkan aktivitas karbon tetrakloridanya, aktivitas klorofluorokarbonnya dan bilangan iodinnya. Metode karbon klorofluorida telah dikembangkan untuk menghindari sifat toksik dari karbon tetraklorida, namun pada kenyataannya penggunaan karbon klorofluorida dilarang maka di banyak laboratorium tetap menggunakan karbon tetraklorida. Adapun metode penentuan bilangan yodin digunakan sebagai kontrol mutu daya serap karbon aktif terhadap adsorbat dalam fasa aquous.12
Kapasitas adsorpsi karbon aktif terhadap yodin dapat ditentukan secara volumetri/ yodometri. I2 merupakan oksidator lemah, sedangkan iodida secara relatif merupakan reduktor lemah. Kelarutannya dalam air cukup baik dengan pembentukan triiodida, KI3. Larutan ini dapat distandardisasi dengan mengunakan larutan Na2S2O3.5H2O yang terlebih dahulu distandardisasi dengan larutan K2Cr2O7.13
Sifat karbon aktif yang paling penting adalah kapasitas adsorpsinya. Dalam hal ini, ada beberapa faktor yang mempengaruhi kapasitas adsorpsi, yaitu:5
a. Sifat adsorben
Karbon aktif yang merupakan adsorben adalah suatu padatan berpori, yang sebagian besar terdiri dari unsur karbon bebas dan masing- masing berikatan secara kovalen. Dengan demikian, permukaan karbon aktif bersifat non polar. Selain kompisisi dan polaritas, struktur pori juga merupakan faktor yang penting diperhatikan. Struktur pori berhubungan dengan luas permukaan, semakin kecil pori-pori karbon aktif, mengakibatkan luas permukaan semakin besar. Dengan demikian kecepatan adsorpsi bertambah. Untuk meningkatkan kecepatan adsorpsi, dianjurkan agar menggunakan arang aktif yang telah dihaluskan. Jumlah atau dosis karbon aktif yang digunakan, juga diperhatikan. Untuk itu dapat digunakan persamaan Freundlich, yaitu : x/m = KCl/n. Persamaan ini menghubungkan kapasitas adsorpsi persatuan massa karbon (x/m) dengan konsentrasi serapan yang tersisa dalam larutan pada keadaan setimbang. Dalam hal ini, dilakukan percobaan terhadap sederetan sampel
18
dengan menggunakan berat karbon aktif yang berbeda, di mana waktu dan temperatur dibuat tetap untuk semua perlakuan.
b. Sifat adsorbat
Banyak senyawa yang dapat diadsorpsi oleh karbon aktif, tetapi kemampuannya untuk mengadsorpsi berbeda untuk masing-masing senyawa. Adsorpsi akan bertambah besar sesuai dengan bertambahnya ukuran molekul adsorbat dari sturktur yang sejenis, seperti dalam deret homolog. Adsorpsi juga dipengaruhi oleh gugus fungsi, posisi gugus fungsi, ikatan rangkap, struktur rantai dari senyawa adsorbat.
c. Temperatur
Dalam pemakaian karbon aktif dianjurkan untuk menyelidiki temperatur pada saat berlangsungnya proses. Karena tidak ada peraturan umum yang bisa diberikan mengenai temperatur yang digunakan dalam adsorpsi. Jika pemanasan tidak mempengaruhi sifat-sifat senyawa adsorbat, seperti terjadi perubahan warna maupun dekomposisi, maka perlakuan dilakukan pada titik didihnya. Untuk senyawa volatil, adsorpsi dilakukan pada temperatur kamar atau bila memungkinkan pada temperatur yang lebih kecil.
d. pH (derajat keasaman)
Untuk asam-asam organik, adsorpsi akan meningkat bila pH diturunkan, yaitu dengan penambahan asam-asam mineral. Ini disebabkan karena kemampuan asam mineral untuk mengurangi ionisasi asam organik tersebut. Sebaliknya bila pH asam organik dinaikkan yaitu dengan menambahkan alkali, adsorpsi akan berkurang sebagai akibat terbentuknya garam.
e. Waktu kontak
Bila karbon aktif ditambahkan dalam suatu cairan, dibutuhkan waktu untuk mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan jumlah karbon yang digunakan. Selain ditentukan oleh dosis karbon aktif, pengadukan juga mempengaruhi waktu kontak. Pengadukan dimaksudkan untuk memberi kesempatan pada partikel
19
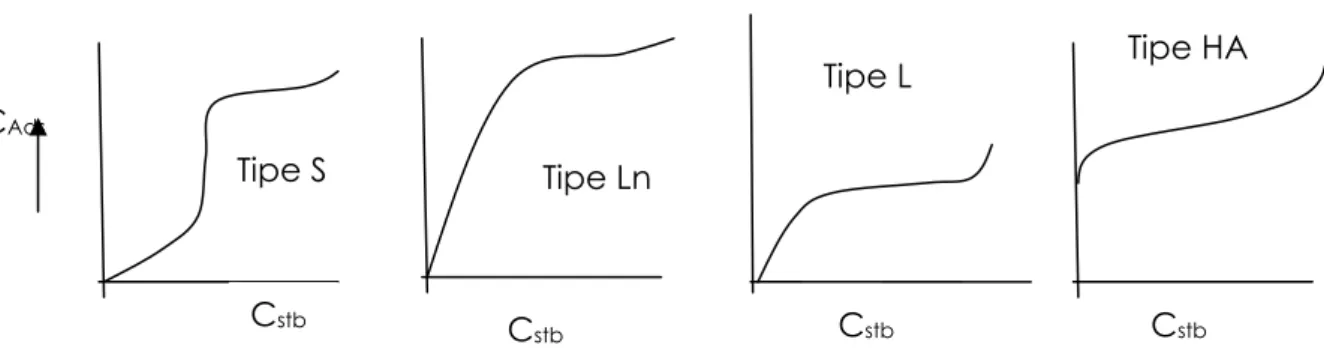
karbon aktif untuk bersinggungan dengan adsorbat. Untuk larutan yang mempunyai viskositas tinggi, dibutuhkan waktu singgung yang lebih lama. Isoterm adsorpsi menggambarkan volum atau berat gas atau zat cair teradsorpsi sebagai fungsi dari tekanan atau konsentrasi adsorbat pada temperatur tetap. Giles dan Mac Ewan mengklasifikasikan isoterm adsorpsi larutan encer oleh zat padat ke dalam empat tipe, yaitu tipe L, tipe S, tipe ln dan tipe HA. Tipe L atau tipe Langmuir merupakan tipe yang umum terjadi pada larutan encer pada zat padat monolayer. Tipe S menghasilkan kurva konsentrasi larutan terhadap konsentrasi kesetimbangan (adsorbat) berbentuk cembung, artinya pada konsentrasi larutan yang rendah zat terlarut sukar teradsorpsi, namun pada konsentrasi yang lebih tinggi berangsur-angsur adsorpsi berjalan lebih mudah. Tipe ln terjadi pada kondisi di mana jumlah site adsorpsi konstan terhadap kenaikan jumlah adsorbat yang terlarut dalam larutan. Sedangkan tipe HA mirip dengan tipe L, di mana zat terlarut memiliki afinitas yang sangat tinggi terhadap adsorben yang berada dalam pelarut yang afinitasnya rendah sehingga terjadi adsorpsi yang sangat tinggi (hampir semua zat terlarut teradsorpsi pada berbagai konsentrasi larutan).
Gambar II.4 Bentuk-bentuk isoterm adsorpsi oleh padatan dalam larutan encer 14 Pengukuran isoterm adsorpsi umumnya didasarkan atas penurunan dari persamaan Langmuir, Freundlich, dan Frumkin. 15
Anggapan dasar Langmuir :
Cstb Cstb Cstb
CAds
Cstb
Tipe S Tipe Ln
20
a. “Site” adsorpsi terdapat pada permukaan zat padat pada P dan T tertentu, dengan fraksi adsorpsi :
θ = (Jumlah site yang mengadsorpsi)/(Jumlah total site yang mungkin) b. Tiap site pada permukaan zat padat hanya dapat berisi satu molekul
adsorbat.
c. Kalor adsorpsi sama untuk setiap site dan tidak tergantung pada . d. Tidak ada antar aksi antar molekul pada berbagai site.
e. Pada saat terjadi kesetimbangan, laju adsorpsi sama dengan laju desorpsi, sehingga dapat diturunkan persamaan : 14
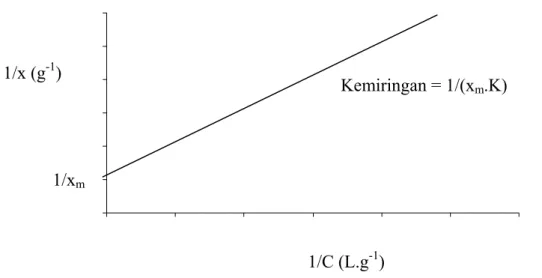
Di mana x kapasitas adsorpsi pada sembarang konsentrasi adsorbat, xm kapasitas adsorpsi maksimal monolayer, K tetapan kesetimbangan adsorpsi-desorpsi dan C konsentrasi kesetimbangan adsorbat dalam fasa larutannya. Plot antara 1/C terhadap 1/x akan diperoleh grafik seperti pada gambar II.5, di mana y
intersep = 1/xm dan kemiringan = 1/(xm.K).15
Gambar II.5 Hubungan antara 1/C dan 1/x
Harga K merupakan tetapan kesetimbangan adsorpsi-desorpsi. Semakin besar harga K akan memberikan grafik yang semakin cembung pada konsentrasi kesetimbangan yang rendah artinya pada konsentrasi rendah adsorbat memiliki afinitas yang besar dengan adsorben dan sebaliknya adsorbat mimiliki afinitas
……….(1) 1/x (g-1) 1/c (L.mg-1) 1/xm 1/C (L.g-1) Kemiringan = 1/(xm.K)
21
yang kecil terhadap pelarutnya. Tipe-tipe kurva isoterm Langmuir berdasarkan perbedaan harga K adalah seperti pada gambar berikut :
Gambar II.6 Tipe kurva isoterm adsorpsi Langmuir
Harga K pada berbagai temperatur dapat digunakan untuk menentukan entalpi adsorpsi, ∆Hads menurut persamaan van’t Hoff sebagai berikut :
2 ln RT H T K = Δ Ads ∂ ∂ ...(2)
Untuk adsorpsi fisika harga entalpi adsorpsi berkisar antara 1 – 10 kkal/mol adsorbat, sedangkan untuk adsorpsi kimia entalpi adsorpsi berkisar antara 20 – 200 kkal/mol adsorbat.
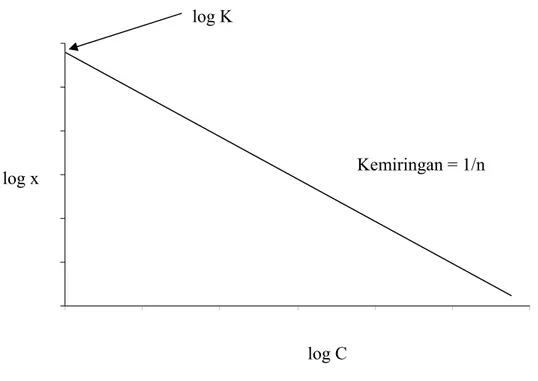
Isoterm adsorpsi Freundlich, seperti halnya isoterm adsorpsi Langmuir juga berlaku untuk adsorpsi yang membentuk monolayer. Untuk adsorpsi zat padat terlarut oleh suatu adsorben, berlaku persamaan isoterm Freundlich sebagai berikut :
log x = log K + 1/n log c..…….…...……..(3) Plot antara log c terhadap log x akan diperoleh grafik seperti pada gambar II.7, di mana y intersep = log K dan slope = 1/n.15
CStb (mg/L) x/m (mg/g adsorbat) K besar K kecil
22
Gambar II.7 Hubungan antara log C dan log x
Persamaan-persamaan tersebut sangat baik untuk adsorpsi monomolekuler atau dalam larutan encer. Namun untuk adsorpsi yang multimolekuler lebih tepat digunakan persamaan BET (Brunauer, Emmett dan Teller). Misalnya untuk adsorpsi gas oleh permukaan adsorben yang multilayer, persamaan BET dapat diturunkan sebagai berikut :14
o m m
p
p
c
v
c
c
v
p
p
v
p
.
.
1
.
1
)
(
0−
+
=
−
………(4)
di mana konstanta c merupakan kekuatan relatif adsorpsi pada permukaan adsorben dan kondensasi adsorbat murninya, p0 tekanan gas adsorbat sebelum teradsorpsi, p tekanan gas adsorbat selama proses adsorpsi berlangsung, v volum gas adsorbat yang teradsorpsi dan vm volum gas adsorbat maksimal monolayer.
Berdasarkan plot antara p/v(p0-p) terhadap p/p0, maka harga v
m dan c dapat ditentukan. Harga c berguna untuk menentukan kapasitas adsorpsi maksimum monolayer. Semakin besar harga c, semakin kecil harga p/p0 maksimal untuk monolayer. Misalnya untuk harga c=100, maka harga p/p0 maksimal untuk monolayer sebesar 0,1. Sedangkan untuk harga c=1,00 maka harga p/p0 maksimal untuk monolayer sebesar 0,5.
log x
log C log K
23
C:\Documents and Settings\USER\My Documents\karbon aa\Gas Adsorption 1_files\ads_fig1.gif
p/p0
Gambar II.8 Tipe kurva isoterm adsorpsi BET
Sedangkan hubungan antara jumlah material adsorbat dengan energi permukaan ditunjukkan dengan persamaan adsorpsi Gibbs sebagai berikut :16
1/S =-(C/RT).(dσ/dC)...(5) Di mana S dan (dσ/dC) masing-masing adalah luas permukaan dan perubahan energi permukaan karbon aktif. Namun persamaan ini tidak sepenuhnya dapat digunakan untuk adsorpsi karbon aktif disebabkan persamaan ini hanya akurat untuk suatu lapisan monomolekular, sedangkan karbon aktif umumnya merupakan lapisan multimolekular.
II.3.4 Luas Permukaan
Luas permukaan suatu karbon aktif menggambarkan luas permukaan satu gram suatu karbon aktif dalam satu satuan luas. Karbon aktif memiliki luas permukaan yang besar disebabkan karena adanya struktur pori internalnya. Penentuan luas permukaan suatu karbon aktif lazim digunakan metilen biru sebagai adsorbat. Metilen biru klorida merupakan padatan berwarna biru kehijauan dan larut dalam air membentuk larutan stabil berwarna biru. Metilen biru memiliki berat molekul 319,85 g/mol dan tiap molekul memilki luas p/v(p0
-p)
c kecil
c besar
24
permukaan 120 Å2 dan menyerap radiasi pada panjang gelombang sekitar 664 nm.18 N H3C CH3 S+ N N CH3 CH3 + Cl
Gambar II.9 Struktur molekul metilen biru klorida
Besarnya luas permukaan karbon aktif dapat dihitung dengan persamaan : S = ...(7)
di mana S adalah luas permukaan, xm kapasitas adsorpsi monolayer maksimal karbon aktif terhadap metilen biru, N tetapan Avogadro dan a luas permukaan metilen biru.
Hukum Lambert-Beer
Jika suatu berkas sinar melewati suatu medium homogen, sebagian dari cahaya datang (P0) diabsorpsi sebanyak Pa, dipantulkan sebanyak Pr dan ditransmisikan sebanyak Pt, dengan efek intensitas murni sebesar :
P0 = Pa + Pt + Pr...(8) Pada kenyataannya, Pr sangat kecil (kurang dari 4%), sehingga untuk tujuan praktis dituliskan :
25
Lambert (1760), Beer (1852) dan juga Bouger menunjukkan hubungan sebagai berikut :
log (1/T) = log(P0/Pt)...(10) atau A = ε.b.C………...…………..(11) di mana P0 intensitas radiasi yang masuk, Pt intensitas radiasi yang ditransmisikan, T transmitans, b jarak tempuh optik, C konsentrasi dan ε koefisien ekstingsi molekuler atau menyatakan absorbtivitas molar.
Hukum di atas dapat ditinjau sebagai berikut :
a. Jika suatu berkas radiasi monokromatik yang sejajar jatuh pada medium pengabsorpsi pada sudut tegak lurus, setiap lapisan yang sangat kecil akan menurunkan intensitas berkas yang masuk.
b. Jika suatu cahaya monokromatik mengenai suatu medium yang transparan, laju pengurangan intensitas dengan ketebalan medium, sebanding dengan intensitas cahaya yang masuk.
c. Intensitas berkas sinar monokromatik berkurang secara eksponensial, jika konsentrasi zat pengabsorpsi bertambah.
Pr
Pa
P0 Pt
Gambar II.10 Berkas sinar yang melewati medium homogen
Hal di atas merupakan persamaan mendasar untuk spektroskopi absorbsi yang dikenal dengan Hukum Lambert-Beer atau Hukum Beer-Bouger.13
Berdasarkan hukum Lambert-Beer, kurva kalibrasi antara absorbans terhadap konsentrasi analit pada berbagai konsentrasi akan menghasilkan garis linier dengan intersep (0,0) dan kemiringan = ε.b. Dalam beberapa keadaan, kurva
26
kalibrasi yang dihasilkan tidak linier. Penyimpangan kelinieran ini dapat dibagi dalam tiga kategori pendekatan yaitu fundamental, chemical dan instrumental.
Menurut pendekatan fundamental, hukum Beer adalah suatu pendekatan di mana ia akan valid jika konsentrasi analit rendah. Pada konsentrasi yang tinggi, jarak antar partikel-partikel analit berdekatan di mana akan terjadi interaksi antara partikel yang satu dengan yang lainnya sehingga dapat merubah harga ε. Selain itu, harga ε juga bergantung pada indeks bias sampel di mana pada konsentrasi yang rendah indeks bias ini pada dasarnya konstan sehingga dihasilkan kurva linier. Penyimpangan secara kimia dari hukum Beer dapat terjadi dalam larutan sampel jika terjadi interaksi antar komponen. Penyimpangan juga dapat terjadi jika sampel mengandung suatu reaksi kesetimbangan. Adapun menurut pendekatan instrumen, hukum Beer akan memberikan hasil yang valid jika radiasi yang digunakan benar-benar monokromatik. Jika digunakan sinar yang polikromatik maka akan terjadi penyimpangan negatif. Di samping itu sinar sesatan (stray radiation) juga dapat menyebabkan penyimpangan hukum Beer. Hal ini terjadi karena ketidaksempurnaan dalam pemilihan panjang gelombang. Dalam hal ini Pstray perlu dimasukkan dalam persamaan penentuan absorbansi, namun untuk konsentrasi analit yang kecil Pstray lebih kecil dari pada PT dan P0 sehingga absorbansi tidak dipengaruhi oleh penyimpangan radiasi.17
II.3.5 Analisa FTIR
Pada uji analisa FTIR, untuk sampel yang berupa padatan dapat dilakukan dengan tiga cara yaitu dalam bentuk pellet KBr, mull, dan bentuk film/lapis tipis. Cara pellet KBr dilakukan dengan cara menumbuk sampel (0,1 – 2,0% berat) dengan KBr kemudian ditekan dengan penekan hidrolik sehingga diperoleh pellet yang tipis dan transparan. Dalam hal ini KBr harus kering dan penumbukkan dilakukan di bawah lampu IR untuk mencegah terjadinya kondensasi uap dari atmosfer yang akan memberikan serapan lebar pada 3500 cm-1. Cara mull atau pasta dibuat dengan mencampurkan cuplikan dengan setetes minyak, kemudian pasta dilapiskan di antara dua keping NaCl yang transparan. Adapun cara lapis tipis dilakukan dengan cara meneteskan larutan dalam pelarut yang mudah
27
menguap pada permukaan kepingan NaCl dan dibiarkan hingga pelarut menguap.19
Gambar II.11 Spektrometer FTIR
Gelombang yang diteruskan oleh sampel akan ditangkap oleh detektor yang terhubung ke komputer yang akan memberikan gambaran spektrum sampel yang diuji. Struktur kimia dan bentuk ikatan molekul serta gugus fungsional tertentu sampel yang diuji terekam dalam bentuk spektrum yang akan diperoleh dari hasil analisa yaitu hubungan antara transmitans pada panjang gelombang IR dengan bilangan gelombangnya. Beberapa serapan karakteristik dari gugus-gugus fungsi sesuai bilangan gelombangnya adalah seperti pada tabel berikut :
Gambar II.12 Bagan korelasi gugus fungsi dan bilangan gelombang
-28
II.3.6 Analisa SEM
Scanning electron microscope (SEM) adalah suatu jenis dari mikroskop
elektron yang mampu menciptakan berbagai gambaran-gambaran dengan cara memfokuskan suatu berkas cahaya energi tinggi dari elektron-elektron ke permukaan dari suatu sampel dan mendeteksi isyarat-isyarat dari interaksi elektron-elektron dengan permukaan sampel. Jenis dari isyarat-isyarat yang terkumpulkan dalam suatu SEM bervariasi, dapat berupa elektron sekunder, sinar-rontgen karakteristik, dan elektron-elektron yang menyebar. Dalam suatu SEM, isyarat-isyarat ini datang tidak hanya dari berkas cahaya primer terhadap sampel, tetapi juga dari interaksi-interaksi lainnya di dekat permukaan sampel. SEM mampu menghasilkan gambaran-gambaran resolusi tinggi dari suatu permukaan sampel.20
Gambar II.13 Alat SEM
Peralatan SEM pertama kali dibuat oleh Manfred von Ardenne pada tahun 1930 – an, dan dikembangkan oleh Charles Oatley dan dikomersialkan oleh perusahaan Cambridge Instruments. Sampel yang akan dilihat di bawah mikroskop perlu diolah sedemikian rupa agar diperoleh sampel yang sebaik-baiknya. Teknik yang digunakan pun bervariasi tergantung jenis spesimen dan analisa yang diperlukan.
II.4 PENELITIAN PENDAHULUAN
Sekam padi yang dibakar pada suhu 400˚C selama 6 jam atau 500˚C selama 3 jam atau 600˚C selama 1 jam menghasilkan abu yang berwarna dari
29
hitam, abu-abu, abu-abu muda dan putih. Warna tersebut disebabkan oleh adanya penguraian senyawa organik yang belum sempurna.21
Pemanasan sekam padi pada suhu 800˚C selama 2 jam menghasilkan abu dengan perbandingan mol C : SiO2 berbanding 1 : 6. Selain mengandung 18% silika, dalam sekam padi juga terdapat sedikit logam Na, K, Mn, Mg, Ca dan Fe.22
Pada pembuatan karbon aktif dari sekam, dedak dan tempurung kalapa, arang hasil karbonisasi diaktivasi dengan menggunakan bahan kimia yang berbeda, antara lain: HCl, HNO3, H2SO4, H3PO4, NaOH, NaCl, KCl, ZnCl2 dan CaCl2. Ternyata kualitas karbon aktif yang dihasilkan sangat dipengaruhi oleh jenis bahan baku dan zat aktivator yang digunakan.23
Pada pembuatan karbon aktif dari sekam padi dengan metode aktivasi kimia satu langkah dalam waktu retensi rendah menggunakan zat aktivator ZnCl2, NaOH dan H3PO4, diperoleh hasil terbaik dari pembuatan menggunakan zat aktivator ZnCl2 dengan perbandingan massa sekam padi : ZnCl2 1:1 yang memiliki luas permukaan SBET sebesar 750 m2/g. 2
Pada penelitian tentang pembuatan karbon aktif dari sekam padi, kayu
Acacia arablica dan batu bara menggunakan metode aktivasi kimia dan aktivasi
fisika dengan mengatur variasi kadar zat aktivator, waktu dan suhu aktivasi serta karakterisasi terhadap karbon aktif yang dihasilkan adalah dengan mengukur kapasitas adsorpsinya, luas permukaan pori menggunakan persamaan BET menggunakan gas nitrogen sebagai adsorbat, analisis terhadap kandungan unsur-unsur C, H, O dan N dan penentuan gugus-gugus fungsi permukaan dengan metode spoktrometri FTIR dan metode netralisasi selektif, dapat ditarik kesimpulan bahwa bahan baku dari sekam padi, kayu Acacia arablica dan batu bara merupakan bahan baku yang prospektif sebagai bahan baku pembuatan karbon aktif.24
Pada penelitian tentang daya serap sekam padi kering yang diaktivasi dengan asam nitrat dan metanol dibandingkan dengan sekam padi kering yang diabukan (abu sekam padi) terhadap 2,4-diklorofenol, diperoleh kesimpulan bahwa abu sekam padi memiliki daya serap yang lebih baik dengan daya serap
30
sebesar 98 ± 1,2 % larutan 2,4-diklorofenol 6,1x 10-5mol.L-1.g-1 pada pH = 6, dan waktu kontak selama 10 menit. 25