II. TINJAUAN PUSTAKA
A. UMBI GARUT
Garut, ararut atau irut (Maranta arundinaceae) adalah sejenis tumbuhan berbentuk terna yang menghasilkan umbi yang dapat dimakan. Tanaman garut tidak pernah menjadi sumber pangan pokok namun kerap ditanam di pekarangan pedesaan sebagai cadangan pangan saat musim paceklik. Tanaman garut termasuk tanaman tahunan dengan ukuran satu hingga satu setengah meter dengan sistem perakaran yang dangkal dan rhizoma menuju ke dalam tanah. Tanaman garut merupakan tanaman jenis rumput-rumputan tegak yang termasuk ke dalam kelas Marantaceae, genus Maranta dan species Maranta arundinaceae L. (Lingga et al, 1986). Rhizoma umbi garut memiliki ukuran panjang antara 20-45 cm dan diameter 2-5 cm. Garut memiliki umbi yang berwarna putih, dilindungi sisik berwarna putih hingga coklat muda yang tersusun secara tumpang tindih. Batang tanaman garut yang berbentuk pelepah membentuk dua barisan dengan sisik yang tidak sama. Daun tanaman garut berbentuk oval dengan ukuran panjang antara 10-15 cm dan lebar 3-10 cm, jumlah tulang daun yang banyak dengan posisi sejajar dan mengalami pembesaran ukuran pada bagian ujung tangkai daun (Lingga et al, 1986).
(a) (b)
Gambar 1. Tanaman Garut (a), Umbi Garut (b)
Penyebaran tanaman garut di Indonesia telah menyebar secara luas. Pembudidayaan tanaman garut secara teratur telah dilaksanakan di daerah Jawa Tengah dan Jawa Timur, sedangkan Lampung dan Sulawesi Tenggara baru sebagian kecil. Penanaman tanaman garut sudah dilakukan di D.I. Yogyakarta, Jambi, Riau dan Jawa Barat meskipun belum teratur. Tanaman ini belum dibudidayakan secara teratur oleh para petani di daerah survei Sumatera Barat, Kalimantan Selatan, Sulawesi Tengah, Sulawesi Selatan dan Maluku. Tanaman ini terdapat pada ladang yang tidak diusahakan petani dipinggir-pinggir hutan. Usaha pemeliharaan tanaman garut oleh para petani baru meliputi menyiang, membumbun dan belum melakukan pemberantasan hama dan penyakit. Pemupukan hanya dilakukan para petani di Jawa Timur dan D.I. Yogyakarta.
Tanaman garut merupakan tanaman yang mudah tumbuh subur di tempat terlindung, tidak harus terkena sinar matahari secara langsung (Syamsudin, 1998). Oleh sebab itu tanaman garut cocok digunakan sebagai tanaman tumpang sari dengan tanaman tahunan seperti jati. Tanaman garut memiliki umur tanam relatif pendek dengan umur tanam 10-12 bulan sudah dapat dipanen. Kandungan pati maksimum dihasilkan oleh umbi yang berumur 12 bulan. Namun proses ekstraksi akan lebih sulit karena pada umur tersebut umbi memiliki serat yang lebih banyak. Villamajor dan Jurkema (1996) menyatakan bahwa umbi garut memiliki dua jenis kultivar penting yaitu Creole dan Banana. Ke dua jenis kultivar ini memiliki umbi yang berwarna putih meskipun memiliki karakteristik yang berbeda. Kultivar Creole memiliki umbi kurus panjang, menjalar luas dan menembus ke dalam
II. TINJAUAN PUSTAKA
A. UMBI GARUT
Garut, ararut atau irut (Maranta arundinaceae) adalah sejenis tumbuhan berbentuk terna yang menghasilkan umbi yang dapat dimakan. Tanaman garut tidak pernah menjadi sumber pangan pokok namun kerap ditanam di pekarangan pedesaan sebagai cadangan pangan saat musim paceklik. Tanaman garut termasuk tanaman tahunan dengan ukuran satu hingga satu setengah meter dengan sistem perakaran yang dangkal dan rhizoma menuju ke dalam tanah. Tanaman garut merupakan tanaman jenis rumput-rumputan tegak yang termasuk ke dalam kelas Marantaceae, genus Maranta dan species Maranta arundinaceae L. (Lingga et al, 1986). Rhizoma umbi garut memiliki ukuran panjang antara 20-45 cm dan diameter 2-5 cm. Garut memiliki umbi yang berwarna putih, dilindungi sisik berwarna putih hingga coklat muda yang tersusun secara tumpang tindih. Batang tanaman garut yang berbentuk pelepah membentuk dua barisan dengan sisik yang tidak sama. Daun tanaman garut berbentuk oval dengan ukuran panjang antara 10-15 cm dan lebar 3-10 cm, jumlah tulang daun yang banyak dengan posisi sejajar dan mengalami pembesaran ukuran pada bagian ujung tangkai daun (Lingga et al, 1986).
(a) (b)
Gambar 1. Tanaman Garut (a), Umbi Garut (b)
Penyebaran tanaman garut di Indonesia telah menyebar secara luas. Pembudidayaan tanaman garut secara teratur telah dilaksanakan di daerah Jawa Tengah dan Jawa Timur, sedangkan Lampung dan Sulawesi Tenggara baru sebagian kecil. Penanaman tanaman garut sudah dilakukan di D.I. Yogyakarta, Jambi, Riau dan Jawa Barat meskipun belum teratur. Tanaman ini belum dibudidayakan secara teratur oleh para petani di daerah survei Sumatera Barat, Kalimantan Selatan, Sulawesi Tengah, Sulawesi Selatan dan Maluku. Tanaman ini terdapat pada ladang yang tidak diusahakan petani dipinggir-pinggir hutan. Usaha pemeliharaan tanaman garut oleh para petani baru meliputi menyiang, membumbun dan belum melakukan pemberantasan hama dan penyakit. Pemupukan hanya dilakukan para petani di Jawa Timur dan D.I. Yogyakarta.
Tanaman garut merupakan tanaman yang mudah tumbuh subur di tempat terlindung, tidak harus terkena sinar matahari secara langsung (Syamsudin, 1998). Oleh sebab itu tanaman garut cocok digunakan sebagai tanaman tumpang sari dengan tanaman tahunan seperti jati. Tanaman garut memiliki umur tanam relatif pendek dengan umur tanam 10-12 bulan sudah dapat dipanen. Kandungan pati maksimum dihasilkan oleh umbi yang berumur 12 bulan. Namun proses ekstraksi akan lebih sulit karena pada umur tersebut umbi memiliki serat yang lebih banyak. Villamajor dan Jurkema (1996) menyatakan bahwa umbi garut memiliki dua jenis kultivar penting yaitu Creole dan Banana. Ke dua jenis kultivar ini memiliki umbi yang berwarna putih meskipun memiliki karakteristik yang berbeda. Kultivar Creole memiliki umbi kurus panjang, menjalar luas dan menembus ke dalam
II. TINJAUAN PUSTAKA
A. UMBI GARUT
Garut, ararut atau irut (Maranta arundinaceae) adalah sejenis tumbuhan berbentuk terna yang menghasilkan umbi yang dapat dimakan. Tanaman garut tidak pernah menjadi sumber pangan pokok namun kerap ditanam di pekarangan pedesaan sebagai cadangan pangan saat musim paceklik. Tanaman garut termasuk tanaman tahunan dengan ukuran satu hingga satu setengah meter dengan sistem perakaran yang dangkal dan rhizoma menuju ke dalam tanah. Tanaman garut merupakan tanaman jenis rumput-rumputan tegak yang termasuk ke dalam kelas Marantaceae, genus Maranta dan species Maranta arundinaceae L. (Lingga et al, 1986). Rhizoma umbi garut memiliki ukuran panjang antara 20-45 cm dan diameter 2-5 cm. Garut memiliki umbi yang berwarna putih, dilindungi sisik berwarna putih hingga coklat muda yang tersusun secara tumpang tindih. Batang tanaman garut yang berbentuk pelepah membentuk dua barisan dengan sisik yang tidak sama. Daun tanaman garut berbentuk oval dengan ukuran panjang antara 10-15 cm dan lebar 3-10 cm, jumlah tulang daun yang banyak dengan posisi sejajar dan mengalami pembesaran ukuran pada bagian ujung tangkai daun (Lingga et al, 1986).
(a) (b)
Gambar 1. Tanaman Garut (a), Umbi Garut (b)
Penyebaran tanaman garut di Indonesia telah menyebar secara luas. Pembudidayaan tanaman garut secara teratur telah dilaksanakan di daerah Jawa Tengah dan Jawa Timur, sedangkan Lampung dan Sulawesi Tenggara baru sebagian kecil. Penanaman tanaman garut sudah dilakukan di D.I. Yogyakarta, Jambi, Riau dan Jawa Barat meskipun belum teratur. Tanaman ini belum dibudidayakan secara teratur oleh para petani di daerah survei Sumatera Barat, Kalimantan Selatan, Sulawesi Tengah, Sulawesi Selatan dan Maluku. Tanaman ini terdapat pada ladang yang tidak diusahakan petani dipinggir-pinggir hutan. Usaha pemeliharaan tanaman garut oleh para petani baru meliputi menyiang, membumbun dan belum melakukan pemberantasan hama dan penyakit. Pemupukan hanya dilakukan para petani di Jawa Timur dan D.I. Yogyakarta.
Tanaman garut merupakan tanaman yang mudah tumbuh subur di tempat terlindung, tidak harus terkena sinar matahari secara langsung (Syamsudin, 1998). Oleh sebab itu tanaman garut cocok digunakan sebagai tanaman tumpang sari dengan tanaman tahunan seperti jati. Tanaman garut memiliki umur tanam relatif pendek dengan umur tanam 10-12 bulan sudah dapat dipanen. Kandungan pati maksimum dihasilkan oleh umbi yang berumur 12 bulan. Namun proses ekstraksi akan lebih sulit karena pada umur tersebut umbi memiliki serat yang lebih banyak. Villamajor dan Jurkema (1996) menyatakan bahwa umbi garut memiliki dua jenis kultivar penting yaitu Creole dan Banana. Ke dua jenis kultivar ini memiliki umbi yang berwarna putih meskipun memiliki karakteristik yang berbeda. Kultivar Creole memiliki umbi kurus panjang, menjalar luas dan menembus ke dalam
tanah. Bila kultivar ini tumbuh di daerah yang kurang subur mempunyai kecenderungan menjadi umbi yang kurus dan tidak berguna. Umbi ini dikenal dengan nama akar cerutu atau cigar root dan kultivar jenis ini setelah dipanen mempunyai daya tahan selama tujuh hari sebelum dilakukan pengolahan. Banana, kultivar ini umumnya menjadi ciri atau sifat yang berlainan dengan creole. Kultivar banana memiliki umbi lebih pendek dan gemuk, tumbuh dengan tandan terbuka pada permukaan tanah. Umbinya terdapat dekat dengan permukaan tanah, maka lebih mudah dipanen. Cara pemanenan dengan alat mekanik pun dapat dilakukan dengan aman. Keuntungan lain dari kultivar ini adalah kecenderungan untuk menjadi akar cerutu sangat kecil sekali, hasil panen lebih tinggi dan kandungan seratnya lebih sedikit, sehingga lebih mudah diolah bila dibandingkan dengan creole. Namun kultivar ini juga memiliki kekurangan yakni kualitas umbi setelah dipanen cepat mengalami penurunan sehingga harus segera diolah paling lambat dalam tempo 48 jam setelah panen.
Beberapa ahli telah melakukan penelitian tentang kandungan gizi umbi garut. Menurut Lingga et al (1986) komposisi zat gizi masing-masing kultivar berbeda. Perbedaan tersebut dipengaruhi oleh umur tanam dan keadaan tanah tempat tumbuhnya. Komposisi zat gizi umbi garut yang pernah dihasilkan oleh beberapa peneliti ditampilkan dalam Tabel 1.
Tabel 1. Komposisi zat gizi dalam umbi garut Komponen Umbi garut Kultivar Bananaa (gram) Kultivar Creolea (gram) Umbi Garutb (persen) Karbohidrat : Pati Serat Gula 19,4 0,6 -21,7 1,3 -22,7 1,3 -Protein 2,2 1 2,2 Lemak 0,1 0,1 0,1 Abu 1,3 1,4 -Air 72 69,1 66,1 Mineral - - 1,6
Sumber :aKay (1973) ;bWijana (1995)
B.
PATI GARUT
Pati atau amilum adalah karbohidrat kompleks yang tidak larut dalam air, berwujud putih, tawar dan tidak berbau. Pati merupakan bahan utama yang dihasilkan oleh tumbuhan untuk menyimpan kelebihan glukosa sebagai produk fotosintesis dalam jangka panjang. Belitz (1999) mengatakan bahwa pati merupakan salah satu jenis polisakarida yang tersebar dalam organ tanaman sebagai cadangan makanan. Pati terdapat pada tanaman hijau yang disimpan dalam berbagai tempat : biji (sereal), akar dan rimpang (tapioka, kentang), batang (sagu) dan buah-buahan (pisang) yang semuanya digunakan sebagai makanan (Vail, 1978). Pati merupakan salah satu bentuk karbohidrat alami yang paling murni dan memiliki kekentalan yang tinggi. Kekentalan ini sangat dipengaruhi oleh keasaman air yang digunakan dalam proses pengolahannya (Kay, 1973). Menurut Hodge dan Osman (1976), pati merupakan hasil reaksi antara karbon dari udara (CO2) dengan air dari dalam tanah pada proses fotosintesis dengan menggunakan energi sinar matahari dalam bentuk bahan organik polisakarida.
Molekul pati memiliki dua ujung berbeda, yakni ujung non pereduksi dengan gugus OH bebas yang terikat pada atom karbon nomor empat dan ujung pereduksi dengan gugus OH bebas anomerik. Gugus hidroksil dari polimer berantai lurus atau bagian lurus dari struktur berbentuk cabang yang terletak sejajar akan berasosiasi melalui ikatan hidrogen yang mendorong pembentukan kristal pati. Daerah dimana rantai-rantai polimer tersusun secara teratur di dalam molekul pati dinyatakan sebagai daerah kristal. Diantara daerah-daerah teratur tersebut, terdapat susunan
rantai-rantai polimer saling mendekati sampai jarak sedemikian dekat, sehingga menyebabkan gaya tarik-menarik yang kuat antar rantai molekul. Rantai-rantai lurus dapat saling mendekati dengan jarak yang lebih pendek dibandingkan dengan rantai bercabang dalam polimer yang sama. Daerah amorf terdiri dari komponen amilosa dan senyawa lain yang terdapat pada kristal, seperti senyawa kompleks fosfolipid. Pada daerah kristal terjadi integrasi antara rantai bercabang amilopektin dengan rantai lurus dari molekul amilosa.
Pati merupakan zat tepung dari karbohidrat dengan suatu polimer senyawa glukosa yang terdiri dari dua fraksi polisakarida, yaitu amilosa dan amilopektin. Amilosa merupakan rantai lurus dari D-glukosa yang dihubungkan oleh ikatan α-1,4 glikosidik. Pada amilosa akan ditemukan titik percabangan setelah lebih dari 500 unit glukosa yang membentuk rantai lurus (Fennema, 1976). Amilopektin merupakan rantai cabang polimer D-glukosa yang dihubungkan dangan ikatan α-1,6 glikosidik. Pada amilopektin banyak ditemukan titik percabangan karena pada setiap 20-25 unit rantai lurus akan membentuk satu titik percabangan (Fennema, 1976). Winarno (1997) menyatakan bahwa pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan
α-(1,4)-D-glukosa, sedangkan amilopektin memiliki titik cabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4-5
% dari berat total.
Gambar 2. Struktur amilosa(http://rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/part2/sugar.htm)
Gambar 3. Struktur amilopektin (http://rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/part2/sugar.htm) Fraksi polisakarida pada pati yakni, amilosa dan amilopektin memiliki karakteristik yang berbeda satu sama lain. Amilosa memiliki kelarutan yang lebih tinggi dalam air dengan kekentalan yang lebih rendah dibandingkan dengan amilopektin. Amilosa sangat mudah membentuk senyawa kompleks jika direaksikan dengan asam lemak dan molekul organik. Kompleks senyawa amilosa dengan yodium akan menghasilkan warna biru. Sebaliknya, amilopektin tidak mudah membentuk senyawa kompleks jika direaksikan dengan asam lemak dan molekul organik. Kompleks senyawa amilopektin akan memberikan warna merah ketika direaksikan dengan yodium (Kulp, 1975). Perbedaan warna ini dapat dijadikan sebagai dasar dalam penentuan kadar amilosa. Winarno (1997) juga mengatakan bahwa pati yang berikatan dengan iodin (I2) akan menghasilkan warna biru. Sifat ini dapat digunakan untuk menganalisa adanya pati. Pati akan merefleksikan warna biru bila berupa polimer glukosa yang lebih besar dari dua puluh, misalnya molekul-molekul amilosa. Bila polimernya kurang dari dua puluh seperti amilopektin, maka akan dapat dihasilkan warna merah. Perbedaan warna ini dapat dijadikan sebagai dasar dalam penentuan kadar amilosa.
Pada umumnya pati yang telah mengalami keseimbangan dalam keadaan atmosfir biasa dapat mengandung 10-17% air. Air diikat oleh pati dalam tiga bentuk, yaitu sebagai kristal, sebagai air yang diabsorpsi atau sebagai air yang berada diantara rongga. Lapisan luar setiap granula pati tersusun secara rapat oleh molekul-molekul pati sehingga sulit ditembus oleh air dingin. Granula pati tidak larut dalam air dingin tetapi bagian amorphous pada granula pati dapat menyerap air dan membengkak. Namun demikian jumlah air yang terserap dan pembengkakannya terbatas. Jika suspensi air dengan pati dipanaskan, molekul-molekul pati akan merenggang sehingga air akan menembus lapisan luar granula yang pada akhirnya menyebabkan pembengkakan granula pati. Proses tersebut akan terjadi ketika temperatur meningkat dari 600C hingga mencapai 850C. Proses tersebut dikenal dengan istilah gelatinisasi. Pada proses gelatinisasi granula-granula pati dapat mengembang hingga volumenya lima kali lebih besar dari volume awal. Ketika ukuran granula tersebut semakin besar, maka campuran pati dengan air akan mengental (Winarno, 1995).
Pada proses gelatinisasi terjadi pengrusakan ikatan hidrogen intramolekuler. Ikatan ini berfungsi untuk mempertahankan struktur integritas granula tepatnya gugus hidroksil yang bebas menyerap air, sehingga selanjutnya terjadi pembengkakan granula pati dengan cepat. Winarno (1997) menambahkan karena jumlah gugus hidroksil dari molekul pati sangat besar maka kemampuan menyerap air juga sangat besar. Terjadinya peningkatan viskositas disebabkan oleh air yang sebelumnya berada di luar granula pati dan bebas bergerak sebelum suspensi dipanaskan, kini berada dalam granula dan tidak dapat bergerak bebas lagi. Suhu gelatinisasi tergantung pada konsentrasi pati. Makin kental larutan, suhu tersebut makin lambat tercapai, sampai suhu tertentu kekentalan tidak bertambah, bahkan kadang-kadang turun (Winarno, 1997). Selain konsentrasi, pembentukan gel dipengaruhi oleh pH larutan. Pembentukan gel optimum pada pH 4 – 7. Pada pH yang terlalu tinggi pembentukan gel terlalu cepat tetapi cepat juga menurun. Sedangkan bila pH terlalu rendah, gel terbentuk secara lambat dan apabila pemanasan diteruskan viskositas akan kembali turun.
Menurut Winarno (1997), jika suspensi pati dalam air dipanaskan, beberapa perubahan selama terjadinya gelatinisasi dapat diamati. Pada awalnya suspensi pati dalam air berwarna keruh seperti susu. Lama-kelamaan pada suhu tertentu suspensi pati akan berwarna jernih, suhu yang terjadi berbeda-beda untuk setiap jenis pati. Winarno (1997) menjelaskan proses masuknya air ke dalam butiran pati pada proses gelatinisasi disebabkan oleh semakin kuatnya energi kinetik molekul-molekul air dibandingkan dengan daya tarik antar molekul di dalam granula pati. Setelah masuk dalam butiran pati, daya serap air menjadi semakin besar dengan semakin besarnya jumlah gugus hidroksil dalam pati. Hal tersebut akan disertai dengan peningkatan viskositas karena air yang pada awalnya berada di luar granula dan bergerak bebas kini berada dalam butiran-butiran pati dan tidak dapat lagi bergerak secara bebas.
Kawabata et al. (1984) mengungkapkan bahwa pati garut mengandung amilosa sebesar 19,4% dengan kandungan mineral kalium dalam jumlah yang cukup besar, sedangkan Swinkels (1984) menyatakan kadar amilosa pati garut sebesar 20% dan amilopektin 80%. Hal ini diperkuat oleh Satin (2001) bahwa kadar amilosa pati garut sebesar 21%, sedangkan kadar amilopektin adalah sebesar 79%. Kandungan pati garut sangat dipengaruhi oleh jenis kultivar, umur panen dan kondisi pertumbuhan tanaman garut. Pada Tabel 2 berikut ini diperlihatkan kandungan gizi dari pati garut.
Tabel 2. Kandungan gizi pati garut (per 100 gram)
Komposisi Gizi Kandungan
Energi (kal) Protein (g) Lemak (g) Karbohidrat (g) Kalsium (mg) Fosfor (mg) 355,00 0,70 0,20 85,20 8,00 22,00
Besi (mg) Vitamin B1(mg) Kadar air (%)
Bahan yang dapat dimakan (%)
1,50 0,09 13,60 100,00 Sumber : Wijana et al.,(1995)
Kay (1973) mengungkapkan bahwa pati garut yang berkualitas komersial di St. Vincent adalah pati garut yang putih dan bersih, dengan kadar air tidak lebih dari 18,5 %, kadar abu dan kadar serat rendah, pH antara 4,5-7 serta viskositas maksimum antara 512-640 Brabender Unit (BU), sedangkan Brautlecht (1953) menyatakan bahwa pati garut komersial mengandung 80-60 % pati, kadar air 12-18 % dan bahan pengotor berupa protein dan serat sekitar 2 % dengan ukuran granula relatif besar dan berbentuk oval.
Pati garut memiliki sifat-sifat yang mudah larut dalam air dan mudah dicerna sehingga sangat cocok digunakan untuk bahan makanan bayi dan orang sakit, granula pati berbentuk oval dengan ukuran antara 15 – 17 mikron, suhu awal gelatinisasi sebesar 700C, mudah mengembang jika terkena air panas dengan daya mengembang 45% (Pudjiono, 1998). Hal itu juga dikatakan oleh Kay (1973) bahwa kegunaan penting dari pati garut adalan sebagai bahan makanan bagi orang sakit atau bayi seperti dalam bentuk biskuit, kue atau puding.
C.
SIKLODEKSTRIN
Penggunaan pati sebagai salah satu bahan baku industri sudah sangat luas, terutama industri pangan. Namun penggunaan pati dalam dunia industri, termasuk industri pangan, masih dibatasi oleh sifat yang dimilikinya. Oleh karena itu perlu dilakukan upaya menghasilkan pati yang termodifikasi untuk pemanfaatan pati yang lebih luas. Glicksman (1969) mengemukakan pati termodifikasi sebagai pati yang diberi perlakuan tertentu dengan tujuan untuk menghasilkan sifat yang lebih baik untuk memperbaiki sifat sebelumnya atau merubah beberapa sifat lainnya. Perlakuan ini dapat berupa penggunaan panas, asam, alkali, zat pengoksidasi atau bahan kimia lainnya yang akan menghasilkan gugus kimia baru atau perubahan bentuk, ukuran serta struktur molekul. Pati termodifikasi memiliki kemampuan mengikat air yang jauh lebih banyak dari pati alami, serta mempunyai sifat rekat yang besar. Oleh karenanya penggunaan pati termodifikasi untuk pengental atau perekat akan jauh lebih sedikit daripada menggunakan pati alami.
Siklodekstrin merupakan salah satu jenis pati termodifikasi yang dihasilkan secara biokimiawi oleh enzim siklodekstrin glikosiltransferase (CGTase). Kainuma (1984) mendefinisikan siklodekstrin sebagai oligosakarida non reduksi berbentuk siklik yang terdiri dari 6, 7 dan 8 monomer glukosa yang dihubungkan dengan ikatan α-1,4 glikosidik. Berdasarkan monomer glukosa yang
menyusunnya, siklodekstrin dibedakan menjadi α-siklodekstrin dengan 6 monomer glukosa,
β-siklodekstrin dengan 7 monomer glukosa dan ϒ-β-siklodekstrin dengan 8 monomer glukosa (Komiyama, 1984). Kitahata (1988) menyatakan bahwa jenis siklodekstrin diklasifikasikan ke dalam
tiga jenis yaitu α-siklodekstrin, β-siklodekstrin, dan ϒ-siklodekstrin. Ke tiga produk tersebut
dihasilkan oleh berbagai jenis bakteri. Bacillus macerans adalah golongan bakteri penghasil enzim
yang memproduksi siloheptaamilase (β-siklodekstrin) sedangkan ϒ-siklodekstrin dihasilkan oleh
Bacillus sp.
Siklodekstrin memiliki struktur molekul yang siklik berbentuk torus seperti kue donat. Charoenlap (2004) menyatakan bahwa siklodekstrin memiliki rongga bagian dalam yang bersifat hidrofobik dan permukaan luar yang bersifat hidrofilik. Oleh sebab itu, siklodekstrin dapat mengikat senyawa organik yang bersifat hidrofobik dan dapat membantu kelarutan dalam air. Sifat molekul siklodekstrin tersebut menyebabkan siklodekstrin memiliki kemampuan membentuk kompleks inklusi dengan berbagai variasi molekul yang lain seperti asam lemak, vitamin, flavor dan lain sebagainya yang ditangkap oleh bagian dalam rongga (Otero, 1991). Komiyama dan Bender (1984) mengatakan
bahwa kemampuan rongga siklodekstrin untuk menampung senyawa lain sangat tergantung pada
ukuran “molekul tamu”. Jika ukuran “molekul tamu” cocok atau lebih kecil dari rongga siklodekstrin maka molekul tersebut dapat tertampung secara sempurna. Tetapi jika “molekul tamu” lebih besar dari rongga siklodekstrin maka interaksi antara siklodekstrin dengan “molekul tamu” menjadi bersifat
parsial dan bersifat lemah. Interaksi siklodekstrin dengan senyawa lain membentuk keseimbangan dinamik.
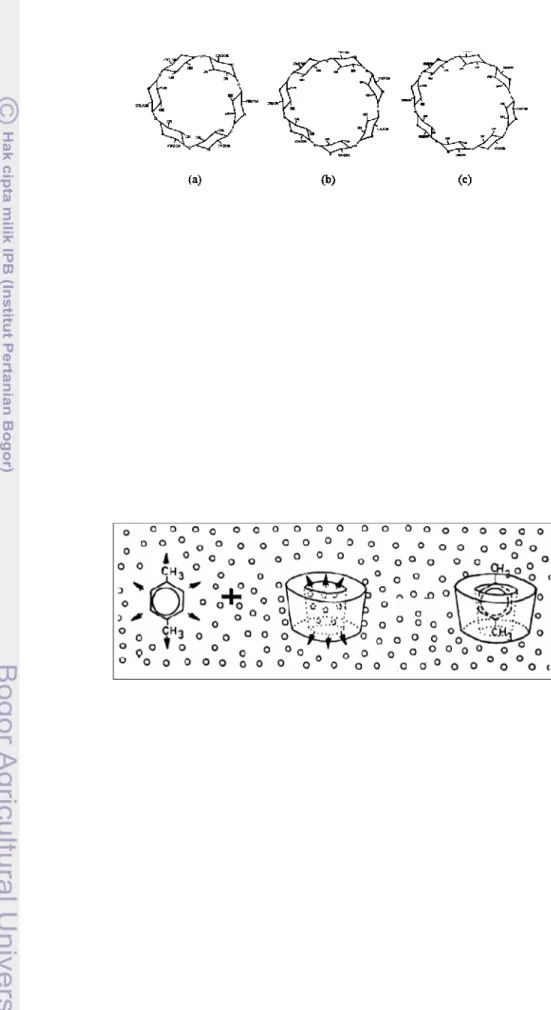
Gambar 4. Struktur molekul α-siklodekstrin (a), β-siklodekstrin (b), dan ϒ-siklodekstrin (c)
(Schmid, 1989).
Psezezola (1988) mengatakan bahwa gugus hidrofobik pada rongga mengakibatkan molekul dengan ukuran cocok dapat bergabung secara non kovalen membentuk kompleks yang stabil, sebagai
contoh β-siklodekstrin dapat membentuk kompleks inklusi dengan substansi flavor yang mempunyai
bobot molekul 80-250. Semua rempah-rempah dan flavor yang mempunyai berat molekul pada
kisaran tersebut dapat membentuk kompleks inklusi dengan β-siklodekstrin. Molekul-molekul tamu
yang akan membentuk kompleks inklusi sekurang-kurangnya harus sesuai secara parsial pada rongga tempat terjadinya kompleks inklusi, jika ukuran molekul tamu kecil atau cocok dengan rongga sikodekstrin maka molekul tersebut tertampung secara sempurna, tapi jika molekul tamu lebih besar dari rongga siklodekstrin, maka interaksi yang terjadi bersifat parsial dan kompleks yang terbentuk lemah. Dengan kata lain kemampuan rongga siklodekstrin untuk menampung senyawa lain tergantung dari ukuran molekul tamu. Jika melekul tamu tersebut merupakan melekul tunggal maka kompleks inklusi yang terjadi dapat merubah sifat fisik dan kimia molekul tamu tersebut.
Gambar 5. Pembentukan kompleks inklusi pada molekul siklodekstrin
Kompleks inklusi yang terbentuk dengan senyawa baru dapat menimbulkan sifat baru dari senyawa inklusi tersebut dengan kemampuan mempertahankan stabilitas dan peningkatan kelarutan dalam air (Oakes, et al., 1991; Otero, 1991) selain itu kompleks yang dihasilkan bersifat stabil sehingga sangat menguntungkan (Pszezola, 1988). Pangington (1987) di dalam Pszezola (1988) mengatakan bahwa cara pembentukan kompleks inklusi dapat dilakukan dengan tiga metode. Pertama,
dengan melakukan pengocokan antara siklodekstrin dengan “molekul tamu”. Kedua, padatan
β-siklodekstrin dicampurkan dengan “senyawa tamu” kemudian ditambahkan air sehingga membentuk pasta. Ketiga, dengan cara melewatkan gas melalui larutan untuk membentuk kompleks.
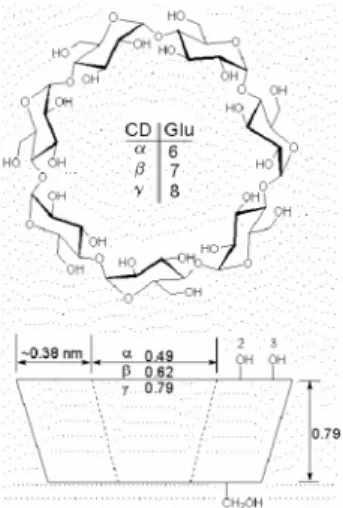
Ketiga jenis siklodekstrin memiliki sifat fisika dan kimia yang berbeda satu sama lainnya. Sifat fisik ketiga jenis siklodekstrin dapat dilihat pada Tabel 3, sedangkan beberapa karakteristik ketiga jenis siklodekstrin lainnya dapat dilihat pada Tabel 4.
Tabel 3. Sifat fisik siklodekstrin (Pszezola, 1988) Jenis CD Unit
Glukosa
Berat Molekul
Ukuran Molekul (A0) Kelarutan (Air) 250C (g/100 ml) [α] D20 (H2O. 1%) Diameter Tinggi Dalam Luar α 6 973 5,7 13,7 7 14,50 150.50 β 7 1135 7,8 15,3 7 1,85 162,50 ϒ 8 1297 9,5 16,9 7 23,20 117,40
Lee et al., (1992) mengatakan diantara ketiga jenis siklodekstrin, β-siklodekstrin lebih mudah
dipisahkan dengan menggunakan pelarut organik karena β-siklodekstrin mempunyai sifat kelarutan
yang rendah dalam air. Siklodekstrin merupakan senyawa yang tahan terhadap larutan alkali encer,
panas, fermentasi oleh khamir dan β-amilase serta agak tahan terhadap proses hidrolisis dan α-amilase
(Whistler, et al., (1984). Lee dan Kim (1991) mengemukakan bahwa pada umumnya produksi siklodekstrin dilakukan dengan terlebih dahulu melikuifikasi dengan panas, dengan atau tanpa enzim penghidrolisis, kemudian baru ditambahkan dengan enzim CGTase untuk sintesis siklodekstrin. Proses tersebut akan menjadi lebih sulit pada konsentrasi pati yang tinggi karena viskositas larutan pati akan meningkat dengan cepat pada saat proses likuifikasi.
Gambar 6. Strutur molekul siklodekstrin beserta dengan dimensi Tabel 4. Beberapa karakteristik α, β dan ϒ –siklodekstrin
Parameter α β ϒ
Jumlah unit glukosa 6 7 8
Berat molekul [g/mol] 972 1135 1297
Kelarutan dalam air pada suhu
ruang [g/100ml] 14,5 1,85 23,2
[α] D pada suhu 250C [0C] 150±0,5 162,5±0,5 177,4±0,5
Diameter rongga [pm] 470-530 600-680 750-830
Ketinggian torus [pm] 790±10 790±10 790±10
Diameter luar [pm] 1460±40 1540±40 1750±40
Perkiraan volume rongga
(106pm3) 174 262 427
Perkiraan volume rongga pada
mol siklodekstrin [ml] 104 1257 256
Perkiraan rongga pada 1g
Hidrolisis olen enzim α-amilase
dari Aspergilus oryzae Diabaikan Rendah Cepat
Entalpi larutan, DH0[kj mol-1] 32,1 34,8 32,4
Entropi larutan, DS0[JK-1mol-1] 57,8 49 61,5
Sumber : Madsen (2000)
Whistler et al., (1984) mengatakan bahwa produk siklodekstrin dipengaruhi oleh jumlah dalam pati. Siklodekstrin akan lebih banyak dihasilkan jika pati yang digunakan lebih banyak mengandung fraksi amilosa daripada fraksi amilopektin. Lee dan Kim (1991) mengatakan bahwa untuk meningkatkan konversi pati menjadi siklodekstrin dapat dilakukan dengan rekayasa genetik (teknik manipulasi gen) dan penambahan pelarut organik. Pelarut organik yang dapat digunakan seperti toluena, dekana, etanol, isopropanol, dan propanol. Meskipun demikian penggunaan siklodekstrin umumnya diperuntukkan untuk makanan, kosmetik, dan farmasi. Pembentukan siklodekstrin dari pati menggunakan enzim CGTase dari B. Circulan var alkalophilus yang
ditambahkan dengan etanol menyebabkan peningkatan produk β-siklodekstrin dan α-siklodekstrin, sedangkan β-siklodekstrin secara perlahan-lahan menurun dengan peningkatan konsentrasi etanol
(Mattson et al., 1991). Peningkatan produk siklodekstrin dengan penambahan pelarut organik akan menurunkan kompleks inklusi siklodekstrin dengan CGTase, karena kompleks dengan CGTase menghambat produksi siklodekstrin. Selain dengan pelarut organik, produksi siklodekstrin juga dapat ditingkatkan dengan penambahan surfaktan, polipropilen glikol (PPG) dan polietilen glikol (PEG).
Pada awalnya produk siklodekstrin belum banyak dimanfaatkan untuk keperluan makanan, karena harga jual yang dimilikinya cukup tinggi dengan produksi yang masih terbatas serta enzim ongkos produksi yang tergolong tinggi. Namun seiring dengan perkembangan zaman siklodekstrin telah diproduksi secara industri walaupun di Indonesia sendiri belum terdapat industri yang memproduksi siklodekstrin. Penggunaan siklodekstrin pada industri makanan yaitu :
1. Mengontrol pengeluaran flavor
Siklodekstrin dapat menstabilkan bahan-bahan volatil (mudah menguap) sehingga tidak terjadi pelepasan flavor yang prematur pada proses pengolahan pangan. Dengan demikian, secara tidak langsung siklodekstrin dapat mengontrol pengeluaran flavor.
2. Menghilangkan odor dan rasa (citarasa) yang tidak disukai
Siklodekstrin dapat mengurangi atau menghilangkan bau berbagai produk seperti ikan, daging kambing, bawang putih, ekstrak khamir, susu kedelai, lesitin dan beras lama. Siklodekstrin dapat juga menutupi rasa pahit dari jus buah jeruk dan anggur. Penutupan bau dan rasa yang tidak diinginkan bersifat efektif pada suhu rendah dan konsentrasi siklodekstrin yang tinggi.
3. Meningkatkan kestabilan emulsi
Siklodekstrin dapat menstabilkan emulsi dari minyak lemak, sehingga siklodekstrin dapat digunakan pada berbagai macam produk seperti salad, mayonaise telur, dan berbagai produk lainnya yang mengaplikasikan emulsi minyak dan air. Menurut Pszezola (1988) bahwa penambahan 1-3% β-siklodekstrin dapat menstabilkan emulsi pada mayonaise yang terbuat dari minyak makan.
4. Meningkatkan kekuatan pembusaan
Volume busa putih telur dapat ditingkatkan dengan menambahkan siklodekstrin. 5. Mengontrol warna
Zat warna alami seperti karatenoid dan flavoroid dapat distabilkan dengan kompleks siklodekstrin. Warna dapat diubah melalui proses kompleks siklodekstrin.
Siklodekstrin dalam pemanfaatannya dapat digunakan juga sebagai pelindung makanan dari proses oksidasi, reaksi akibat cahaya, dekomposisi panas, dan pengurangan kadar air akibat evaporasi. Kompleks kristal tersebut bersifat stabil, sehingga mampu meningkatkan kondisi proses penanganan dan penyimpanan produk. Selain itu kompleks siklodekstrin juga dapat digunakan untuk menyiapkan
Pada produk daging siklodekstrin dapat digunakan meningkatkan kadar air yang tinggal dan memperbaiki tekstur serta dapat digunakan pada pembuatan saos.
Otero et al., (1991) mengatakan bahwa selain untuk industri pangan, siklodekstrin juga dapat digunakan pada industri kosmetika, pestisida, farmasi dan digunakan pada beberapa proses yang melibatkan sel, stimulan pada produksi antibiotika dan meningkatkan produksi vaksin. Siklodekstrin dapat dimodifikasi secara kimiawi untuk keperluan yang lebih khusus. Siklodekstrin dapat dikembangkan dengan sifat yang berbeda dengan sifat awalnya. Hal tersebut dapat dilakukan dengan mengganti beberapa gugus hidroksil pada tepi-tepi molekul siklodekstrin (Pszezola, 1988).
D. ENZIM CGTase (Cyclodextrin Glycosil Transferase)
Siklodekstrin glikosiltransferase (EC.2.4.1.19 CGTase) merupakan katalisator konversi pati menjadi siklodekstrin dengan transglikosilasi intramolekul (reaksi siklisasi). Enzim CGTase digolongkan ke dalam enzim transferase (CGTase, EC. 2. 4. 1. 19), berperan dalam sintesis atau siklisasi dekstrin membentuk siklodekstrin dan mengkatalis pemindahan glikosil sehingga enzim tersebut digolongkan ke dalam enzim transferase (Kitahata, 1988).
Menurut Kitahata (1988) CGTase dapat mengkatalisis tiga jenis reaksi yaitu : 1. Transglikosilasi intramolekul
Transglikosilasi intramolekul adalah pemindahan gugus glukosil pada satu molekul di kedua ujung. Pembentukan siklik (siklodekstrin) dari maltooligosakarida rantai lurus untuk jumlah glukosil lebih dari 6 (maltoheksosa. G6) dilakukan proses transglikosilasi
intramolekul dengan menggunakan bagian luar dari ikatan α-1,4 glikosida pada gula non
pereduksi.
Pati (α, β, ϒ)-siklodekstrin
2. Transglikosilasi intermolekul
Transglikosilasi intermolekul adalah pemindahan gugus glukosa pada satu molekul dengan molekul lain. Molekul tersebut dapat sejenis (maltosa dengan maltosa) atau berbeda jenis (maltosa dengan maltriosa, siklodekstrin dengan maltosa), salah satu molekul berperan sebagai aseptor. Aseptor yang paling efektif pada aksi transfer intermolekul oleh CGTase adalah tipe piranisol yang sama konfigurasinya dengan glukopiranosa yaitu yang mempunyai gugus –OH (hidroksil) bebas pada C2-, C3- dan C4- seperti sorbose dan sukrosa. Dengan adanya aseptor yang cocok seperti glukosa atau sukrosa, pada residu glukosil yang ditransfer
dari α-1,4-glukan atau siklodekstrin ke aseptor melalui reaksi perangkaian (coupling
reaction) atau reaksi disproposionasi.
Pati + Sukrosa (sebagai aseptor) Maltooligosil-sukrosa 3. Reaksi hidrolisis pati
Reaksi hidrolisis pati adalah kemampuan untuk memecah ikatan α-D-1,4-glikosida pada suatu ikatan. Rantai panjang glikosida dilakukan secara acak, CGTase dapat melakukan aktivitas hidrolisis pada pati dan siklodekstrin yang akan menghasilkan hidrolisat berupa beberapa maltooligosakarida. Pati CGTase Maltooligosakarida Hidrolisis Siklodekstrin
Adanya transglikosilasi ini dapat memberikan sifat yang baru dari senyawa yang diglikosilasi, sebagai contoh glikosil asam askorbat akan stabil terhadap oksidasi, disebabkan oleh glikosilasi pada C2-OH dari asam askorbat. Transglikosilasi terhadap D-laktosa yang banyak
digunakan dalam industri makanan dan farmasi, dapat menjadi beberapa produk seperti galaktosil
laktosa oleh β-galaktosidase, fruktosil laktosa oleh fruktofuranosidase dan glukosil laktosa oleh
α-glukosidase (Kitahata, 1988). Transglikosilasi tidak hanya pada akseptor kelompok sakarida, tetapi dapat juga terhadap kelompok flavonoid (rutinose, neosperidose). Adanya transglikosilasi terhadap flavonoid tersebut diharapkan dapat digunakan sebagai pengaman terhadap radiasi sinar UV pada kulit manusia dan juga sebagai antioksidan.
Enzim CGTase mempunyai mekanisme yang mirip dengan fungsi α-amilase, meskipun CGTase termasuk kelompok enzim transferase (Schmid, 1989). CGTasse mengkatalisis pembentukan siklodekstrin dengan cara memutuskan rantai molekul melalui reaksi intramolekular tanpa melibatkan molekul air (Szejtli, 1988). CGTase selain mengkatalisis reaksi siklisasi membentuk siklodekstrin juga mengkatalis reaksi coupling dan disproporsionasi (reaksi intermolekular) seperti yang terlihat pada reaksi berikut (Schmid, 1989).
Keterangan
CGX = Simbol siklodekstrin (X = 6, 7, atau 8) GLCndan GLCm = Rantai α-1,4-glukopyranosyl, dengan n dan m = Residu glukosa
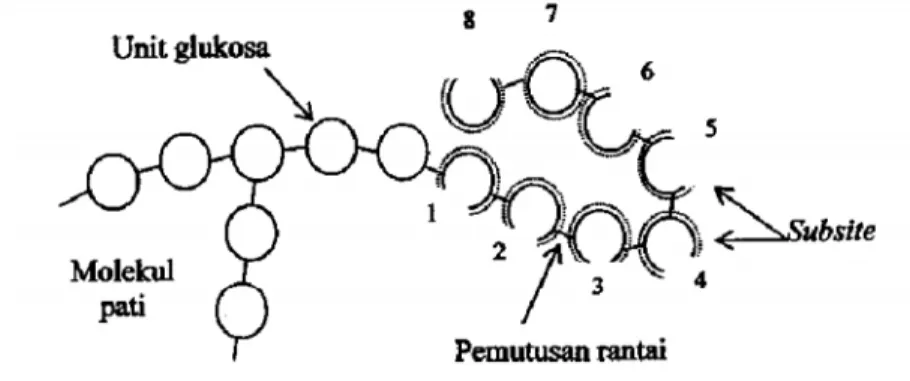
Gambar 7. Reaksi siklisasi, coupling, dan disproporsionasi dalam pembentukan siklodekstrin. Mekanisme CGTase dalam mengkatalisis pembentukan siklodekstrin menurut Schmid (1988) dimulai dengan pengikatan delapan sampai sepuluh (atau lebih besar dari jumlah glukosa yang menyusun siklodekstrin) unit glukosa dari molekul pati. Reaksi tersebut dimulai pada rantai glukosa dari ujung non-pereduksi. Sisi aktif dari CGTase terdiri dari delapan sampai sepuluh (atau lebih)
subsite (unit glukosa yang terikat dengan CGTase) yang berikatan dengan molekul glukosa.
Mekanisme pembentukan α-siklodekstrin adalah dengan cara pengikatan delapan unit
glukosa oleh CGTase, selanjutnya proses pemutusan ikatan α-1,4 glikosidik antara subsite kedua dan ketiga (gambar 8). Hasil antara dari reaksi tersebut adalah maltoheksosa. Maltoheksosa tersebut selanjutnya tersiklisasi melalui ujung non pereduksi yang berikatan dengan subsite ketiga, sehingga
membentuk ikatan α-1,4 glikosidik baru antara unit glukosa satu dengan keenam dari
siklomaltoheksosa (Schmid, 1989).
Gambar 8. Mekanisme kerja CGTase dalam pembentukan siklodekstrin (Schmid, 1989) Aktivitas CGTase sangat dipengaruhi oleh pH dan suhu inkubasi. CGTase stabil pada pH
pada pH 6,0-6,5 dengan suhu 600C (Kainuma, 1984). Lee et al. (1992) mengatakan bahwa aktivitas optimum CGTase adalah antara pH 5,5-7,5 dengan suhu 600C.
Kitahata (1988) menjelaskan bahwa di dalam suatu media dengan sumber karbon adalah pati dengan fraksi amilosa dan amilopektin (tanpa aseptor), CGTase hanya akan mengkatalisis reaksi pembentukan siklodekstrin (siklisasi). Sebaliknya jika di dalam media juga terdapat G2 (maltosa) dan G3 (maltriosa), maka CGTase akan mengkatalisis transglikosasi intermolekul G2 dan G3 membentuk maltooligosakarida, selanjutnya siklodekstrin diproduksi dari maltooligosakarida. Sikodekstrin yang dihasilkan dari G2 dan G3 pada waktu tertentu dapat berkurang kembali , hal tersebut dikarenakan sifat dari G2 dan G3 sebagai aseptor menyebabkan siklodekstrin terdokomposisi.
E. ENZIM PENGHIDROLISIS (α-amilase)
Enzim adalah molekul biopolimer yang merupakan protein, tersusun atas serangkaian asam amino dalam komposisi dan susunan rantai yang tetap dan teratur. Di dalam sel enzim memegang peranan dalam berbagai reaksi biokimia. Salah satunya diantaranya adalah enzim amilase yang dapat menghidrolisis pati, glikogen dan turunan polisakarida dengan jalan memecah rantai ikatan α-1,4 glikosidik. Berdasarkan bagian rantai yang diserang, amilase dapat dipisahkan ke dalam tiga grup. Pertama, α-amilase yang memecah ikatan di bagian dalam substrat sehingga disebut endoamilase.
Kedua, β-amilase yang menghidrolisis unit paling ujung dari substrat. Ketiga, glukoamilase yang
memecah unit glukosa yang ikatannya belum tereduksi (Kulp, 1975).
Enzim α-amilase dikenal dengan nama “dextrogenic amylase” karena hasil utama dari hidrolisisnya terhadap pati adalah dekstrin (Meyer, 1973). Enzim α-amilase akan menghidrolisis ikatan α-1,4 glikosidik yang terdapat di dalam rantai amilosa dan amilopektin meskipun tidak dapat memecah ikatan α-1,6 glikosidik yang terdapat di dalam polimer bercabang (Fogarty, 1983).
Mikroba yang sudah umum digunakan untuk menghasilkan enzim amilase adalah bakteri
Bacillus dan kapang Aspergillus. Kedua mikroba dari genus tersebut mensekresikan beberapa enzim
ekstraselular dalam jumlah yang relatif besar. Enzim amilase merupakan enzim ekstraselular, yaitu enzim yang dihasilkan dihasilkan didalam sel tetapi dikeluarkan ke medium fermentasi untuk membantu kelangsungan hidupnya. Oleh karena itu untuk mengisolasi bakteri yang memproduksi enzim tertentu, diperlukan substrat yang dapat menginduksi produksi enzim tersebut oleh sel bakteri. Enzim jenis ini cocok diproduksi dalam skala besar karena dihasilkan dalam jumlah relatif banyak serta tidak terlalu sulit metode ekstraksinya.
Enzim α-amilase yang berasal dari bakteri memiliki berat molekul 96,900 untuk bentuk
kristal. Walaupun demikian, ada dua fraksi yang diperoleh dari filtrasi gel (Sephadex), yaitu satu komponen yang bergerak lebih cepat memiliki berat molekul 50.000 dan komponen yang lebih lambat dengan berat molekul 100.000. Fraksi yang memiliki berat molekul 50.000 adalah monomer
α-amilase. Komposisi enzim α-amilase juga dipengaruhi oleh asal enzim tersebut. Perbedaan komposisi dan struktur molekul α-amilase akan membedakan pola kerja dan sifat-sifat fisiko kimia enzim
tersebut.
Pengukuran aktivitas α-amilase ditentukan dengan mengukur hasil degradasi pati, biasanya
dari penurunan kadar pati yang terlarut atau dari kadar dekstrin dengan menggunakan substrat jenuh. Pemanfaatan substrat dapat diukur dengan pengurangan derajat pewarnaan yodium terhadap substrat. Bila dekstrin bereaksi terhadap yodium akan membentuk kompleks berwarna coklat. Selain itu,
pengukuran aktivitas α-amilase juga dapat dilakukan dengan cara pengukuran viskositas dan jumlah
pereduksi yang terbentuk (Winarno, 1983). Aktivitas enzim α-amilase terhadap sifat substrat berturut-turut adalah penurunan kekentalan, kenaikan grup-grup yang direduksi, perubahan sifat pengikatan
substrat terhadap yodium dan merupakan rotasi optik. Aktivitas α-amilase digambarkan sebagai
likufikasi, sakarifikasi, dan pembentukan dekstrin. Endoamilase yang penting dalam industri dapat
likuifikasi dengan suhu tinggi. Kedua α-amilase thermolabil, yang digunakan untuk proses sakarifikasi (Norman, 1979).
Mekanisme kerja α-amilase dalam pemecahan α-1,4 glikosidik digolongkan ke dalam tiga
pola. Pertama, singgle chain attack, yaitu dengan cara mendegradasi sebuah molekul polimer sampai selesai sebelum mulai memecah polimer lainnya. Kedua multi chain attack, yaitu dengan cara enzim meninggalkan satu polimer setelah berhasil melepaskan satu produk pertama atau menyelesaikan satu serangan hidrolitik dan memecah polimer lainnya. Ketiga, multiple attack, yaitu enzim memecah satu polimer kemudian beberapa kali memecah sejumlah produk pertama sebelum memecah polimer
lainnya. Mekanisme pemotongan amilosa dan amilopektin pati oleh α-amilase dapat dilihat pada
gambar 9.
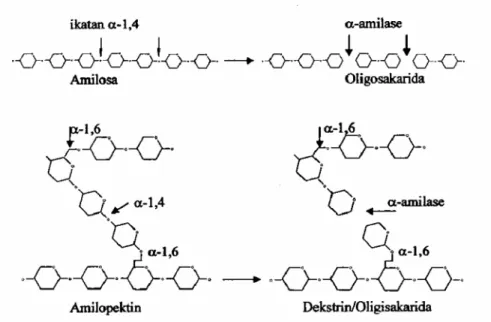
Umumnya α-amilase memotong ikatan di bagian tengah rantai sehingga menurunkan
kemampuan pati mengikat zat warna yodium dan kekentalan larutan pati dengan cepat. Hidrolisis oleh
α-amilase menyebabkan amilosa terurai menjadi maltosa dan maltotriosa. Maltotriosa kemudian
terurai lagi pada tahap berikutnya menjadi maltosa dan glukosa (Fogarty, 1983).
Gambar 9. Mekanisme pemotongan amilosa dan amilopektin pati oleh Enzim α-amilase (Berghmans, 1981 di dalam Suriadi, 1985).
Kerja α-amilase pada amilosa berlangsung dalam dua langkah. Pertama degradasi sempurna dan cepat menjadi maltosa dan maltotriosa. Tahap α-amilolisis ini adalah hasil serangan enzim secara
acak. Degradasi ini terjadi dengan cepat yang diikuti dengan penurunan viskositas secara cepat pula. Langkah kedua jauh lebih lambat dari yang pertama dan meliputi hidrolis oligosakarida dengan pembentukan glukosa dan maltosa yang terjadi dengan secara tidak acak dimulai dari ujung pereduksi (Winarno, 1983).
Hidrolisis amilopektin oleh α-amilase menghasilkan glukosa, maltosa dan satu seri α-limit
dekstrin, serta oligosakarida dengan empat atau lebih unit glukosa yang semuanya mengandung ikatan
α-1,6 glikosidik yang tidak dapat dihidrolisis oleh α-amilase (Winarno, 1983). Alpha-amilase
umumnya stabil pada pH antara 5,5-8,0 dan pada pH yang ekstrim bila ditambahkan kalsium.
Aktivitas optimum α-amilase terjadi pada pH antara 4,8-6,8 (Fogarty, 1983), tetapi ada perbedaan
F.
PENINGKATAN SKALA (SCALE-UP)
Definisi scale-up atau peningkatan skala merupakan tindakan menggunakan hasil yang diperoleh dari laboratorium untuk mendesain prototype dan proses sebuah pilot plant untuk merancang dan membangun pabrik skala penuh atau memodifikasi pabrik yang sudah ada (Hulbert, 1998).
Langkah pertama dalam pengembangan sebuah produk pangan baru adalah mendefinisikan proses yang dibutuhkan untuk membuat produk. Dalam beberapa kasus, terdapat banyak produk yang telah diproduksi pada skala kecil dan para pengusaha menginginkan untuk memperbesar skala proses untuk menyediakan jumlah produksi yang lebih besar. Salah satu perangkat yang berguna dalam hal ini adalah pengembangan diagram aliran proses. Diagram ini menunjukkan laju produksi yang diinginkan dan materi yang dibutuhkan pada setiap tahapan proses. Kebutuhan peralatan ditunjukkan secara skematis pada diagram yang berguna bagi para ahli teknik dalam menghitung biaya dan menyeleksi serta mengukur peralatan untuk proses (Hulbert, 1998).
Langkah kedua adalah memecahkan masalah yang masih terdapat dalam proses peningkatan skala. Kebutuhan ini memerlukan uji coba terhadap peralatan penting di dalam laboratorium pilot
plant. Berdasarkan proses dan tingkat produksi yang diinginkan, scale-up merupakan proses yang
cukup sulit untuk diaplikasikan. Oleh karena itu, perlu dilakukan percobaan-percobaan yang bersifat kontinyu. Percoban-percobaan ini dibutuhkan untuk menentukan parameter optimum untuk skala besar dan untuk menentukan desain peralatan yang dimodifikasi. Selain itu, percobaan juga dilakukan karena di dalam produk pangan sendiri terdapat interaksi kimia dan fisik yang bersifat kompleks (Scott, 2007). Oleh karena itu, pengetahuan dasar tentang interaksi kimia fisik diantara komponen produk penting untuk dipahami. Apabila tidak diperhatikan sifat kimia dan fisik, kemungkinan besar akan terjadi kerusakan produk terutama pada formulasi yang digunakan. Beberapa peralatan akan membantu dalam penentuan ukuran dan ciri-ciri peralatan yang dibutuhkan atau spesifikasi alat yang akan menjadi referensi untuk pembelian alat (Hulbert, 1998).
Untuk dapat melakukan peningkatan skala perlu adanya pengembangan produk dan servis yang terintegrasi. Diantaranya yaitu pengembangan produk (sumber dan formulasinya), menguji unit operasi, mengembangkan kinerja kerja dari spesifikasi alat, dan menentukan titik kritis proses. Produk pangan yang ditingkatkan skalanya akan mempunyai karakteristik yang berbeda dengan produk aslinya. Hal ini disebabkan karena adanya perbedaan rasa, tekstur, aroma dan penampakan visual. Proses skala besar tidak akan menghasilkan produk yang identik dengan produk aslinya, akan tetapi menghasilkan produk yang menyerupai produk aslinya (Scott, 2007).
Proses peningkatan skala membutuhkan kekuatan analisis dalam menentukan langkah-langkah yang akan dilakukan. Beberapa analisis tersebut diantaranya analisis terhadap kondisi operasi, kondisi desain dan proses optimum. Metode untuk melakukan proses peralihan akan dikembangkan dan diujicobakan sebagai kerja praktek. Data dan info-info yang berhubungan lainnya akan berguna untuk ketelitian proses yang dilakukan dalam skala pilot plant (Scott, 2007).
Tahap pilot plant merupakan tahap pertengahan penelitian atau pembuatan produk sebelum masuk ke dalam produksi lebih besar. Tahap pilot plant ini merupakan jembatan yang dapat membantu produksi skala besar karena skala produksi besar terlalu sulit dilakukan apabila mendesain proses mulai dari skala laboratorium. Tahap pilot plant dapat mengevaluasi hasil dari laboratorium dalam pembuatan produk, mengkoreksi dan mengembangkan proses. Selain itu, tahap pilot plant juga dapat menyediakan informasi yang digunakan untuk mengambil keputusan dalam pengembangan proses skala besar (Harper, 2007).
G. PROSES PENCAMPURAN (MIXING)
1.
Pencampuran dan pengadukan
Menurut McCabe et al. (1985), keberhasilan operasi suatu proses pengolahan sering bergantung pada efektifnya pengadukan dan pencampuran zat cair. Istilah pengadukan dan pencampuran berbeda satu sama lain. Pengadukan (agitation) menunjukkan gerakan yang terinduksi menurut cara tertentu pada suatu bahan di dalam bejana, dimana gerakan itu biasanya mempunyai semacam pola sirkulasi. Untuk meningkatkan proses pencampuran umumnya diperlukan adanya pengadukan.
Menurut McCabe et al. (1985), tujuan pengadukan antara lain ialah : 1. Untuk membuat suspensi partikel zat padat
2. Untuk meramu zat cair yang mampu bercampur (miscible)
3. Untuk menyebarkan dispersi gas di dalam zat cair dalam bentuk gelembung-gelembung kecil.
4. Untuk menyebarkan zat cair yang tidak dapat bercampur dengan zat cair lain, sehingga membentuk emulsi atau suspensi butiran-butiran halus.
5. Untuk mempercepat perpindahan kalor antara zat cair dengan kumparan atau mantel kalor. Pencampuran (mixing), di lain pihak adalah peristiwa menyebarkan bahan-bahan secara acak, dimana bahan yang menyebar ke dalam bahan yang lain dan sebaliknya, sedang bahan-bahan itu sebelumnya terpisah dalam dua fase atau lebih. Selanjutnya menurut Bhatia et al. (1992), proses mixing dapat dikategorikan menjadi proses suspensi, dispersi, emulsi, blending, dan pemompaan. Tabel 5 menunjukkan kategori kelas proses pencampuran secara lengkap.
Tabel 5. Kelas proses pencampuran (Mixing)
Proses Fisik Kelas Proses Kimiawi
Suspensi Liquid-solid Pelarutan
Dispersi Liquid-gas Absorpsi
Emulsi Immiscible liquids Ekstraksi
Blending Miscible liquids Reaksi
Pemompaan Fluid motion Tranfer panas
Sumber : Bhatia et al. (1992).
2.
Impeller
Menurut McCabe et al. (1985), ada dua macam impeller pengaduk : jenis pertama membangkitkan arus sejajar dengan poros impeller, dan yang kedua membangkitkan arus pada arah tangensial atau radial. Impeller jenis pertama disebut impeller aliran-aksial (axial-flow
impeller), sedang yang kedua, impeller aliran radial (radial-flow impeller). Dari segi bentuknya,
ada tiga jenis impeller yaitu propeller (baling-baling), dayung (paddle), dan turbin. Dari jenis-jenis impeller tersebut, umumnya impeller turbin lebih efektif untuk jangkauan viskositas yang cukup luas. Impeller turbin pada cairan berviskositas rendah akan menimbulkan arus yang sangat deras yang berlangsung di keseluruhan bejana, mencapai kantong-kantong yang stagnan dan merusaknya.
3.
Rancangan Scale-Up Tangki Pencampuran
penempatannya, demikian pula mengenai perbandingan ukuran tangki/ bejana. Setiap keputusan mengenai pilihan itu berpengaruh langsung pada laju sirkulasi zat cair, pola kecepatan, dan daya yang digunakan. Akan tetapi tidak selalu mudah membuat tangki/ bejana besar yang secara geometrik serupa dengan bejana kecil. Disamping itu, walaupun bisa didapatkan keserupaan geometrik, keserupaan dinamik dan kinematik mungkin tidak bisa dicapai, sehingga hasil pada skala besar tidak selalu bisa diramalkan. Suatu pertimbangan yang sangat penting dalam merancang bejana atau tangki pencampuran adalah kebutuhan daya untuk mendorong impeller. Sebagai titik tolak rancangan tangki pencampuran pada skala besar, dapat digunakan rasio tangki pencampuran dengan impeller.
Menurut McCabe et al. (1985), untuk menaksir daya yang diperlukan untuk memutar
impeller pada kecepatan tertentu, diperlukan suatu korelasi empirik mengenai daya yaitu angka
daya (Np). Dua alat pencampur yang mempunyai perbandingan geometri yang sama seluruhnya, tetapi berbeda ukuran, akan mempunyai faktor-faktor bentuk yang identik.
Tabel 6. Beberapa parameter dalam proses pencampuran
Parameter Kesetaraan Rumus
Bilangan aliran (flow number) ≡
Bilangan daya (power number) ≡
Bilangan Reynolds (Reynolds number) ≡
Bilangan Froude (Froude number) ≡
Rasio penting pada bejana dengan impeller yaitu faktor-faktor S1= Da/Dt, S2= E/ Da, S3= L/ Da, S4= W/ Da, S5= J/ Dt, dan S6= H/ Dt. Faktor-faktor tersebut dapat digunakan untuk
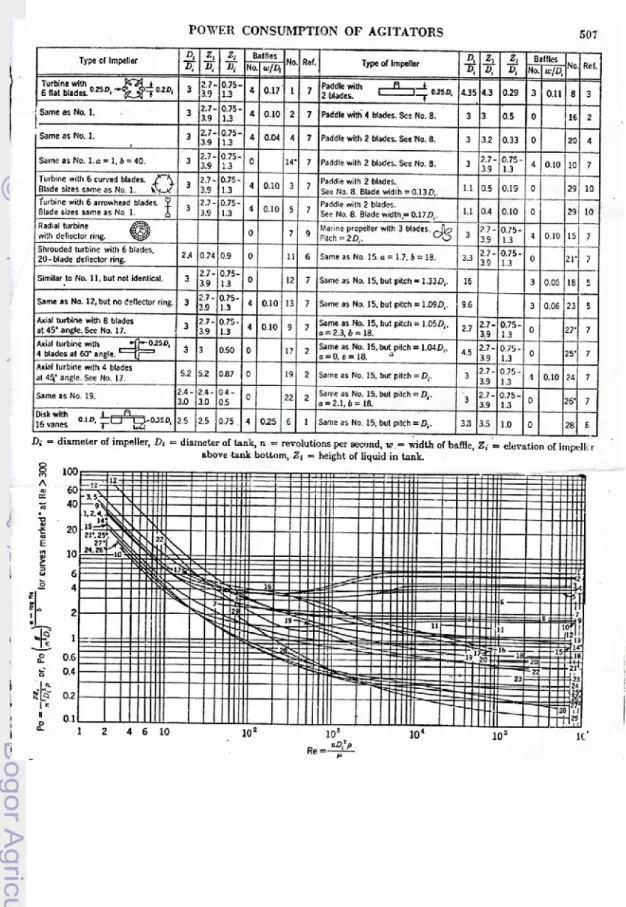
meramalkan besarnya daya yang dibutuhkan impeller sesuai dengan ukuran tangki/ bejana pencampuran. Besarnya kebutuhan daya untuk mendorong impeller pada tangki pencampuran dapat diketahui dengan menggunakan kurva pada grafik hubungan Npvs NRe.
Tabel 7. Konsumsi Tenaga Pengaduk
Gambar 10. Konsumsi tenaga dari berbagai tipe impeller sebagai fungsi dari Po terhadap bilangan Reynold. Kurva hubungan (bilangan power) Np vs NRe(bilangan Reynold) untuk tangki
pencampuran dengan berbagai tipe impeller (Aiba, 1973).
Selanjutnya untuk menentukan kecepatan impeller pada peningkatan skala maupun penurunan skala, maka digunakan persamaan Wang et al. (1978). Sedangkan untuk menghitung lamanya waktu pencampuran pada peningkatan dan penurunaan skala, maka digunakan persamaan McCabe et al. (1985).
H. ANALISIS DIMENSIONAL
Banyak permasalahan teknik penting yang tidak dapat diselesaikan secara lengkap
dengan menggunakan teori maupun metode matematika. Permasalahan ini biasanya
berhubungan dengan aliran fluida, aliran panas, dan proses difusi. Salah satu metode yang
dapat digunakan untuk mengatasi permasalahan dimana persamaan matematika tidak dapat
diturunkan lagi adalah dengan menggunakan data percobaan secara empiris (McCabe, 1993).
Dalam melakukan peningkatan skala pada suatu tahapan proses, seringkali kita harus
menganalisis berbagai angka yang mempunyai dimensi berbeda-beda seperti panjang,
putaran, waktu, dan sebagainya. Permasalahan yang akan dicari jawabannya dalam
peningkatan skala pun akan berupa angka yang mempunyai dimensi tertentu, seperti
diameter reaktor maupun tenaga. Oleh karena itu, peningkatan skala dapat dilakukan dengan
menggunakan salah satu metode yang dikenal dengan istilah analisis dimensional. Metode
ini menggunakan gugus nirmata (tidak berdimensi) sebagai parameter dalam rancang bangun
bioreaktor yang dijaga tetap selama peningkatan skala (
Loebel, 1978).
Dimensi besaran fisis diwakili dengan simbol, misalnya M, L, T yang mewakili
massa, panjang dan waktu. Satuan dan dimensi suatu variabel fisika adalah dua hal berbeda.
Satuan besaran fisis didefinisikan dengan perjanjian, berhubungan dengan standar tertentu
(besaran panjang dapat memiliki satuan meter, kaki, inci, mil, ataupun mikrometer), namun
dimensi besaran panjang hanya satu, yaitu L. Dua satuan yang berbeda dapat dikonversikan
satu sama lain (1 m = 39,37 in; angka 39,37 ini disebut sebagai faktor konversi), sementara
tidak ada faktor konversi antar lambang dimensi.
Tabel 8. Dimensi dan satuan tujuh besaran dalam sistem SI
Besaran dasar
Dimensi
Satuan SI
Massa
M
kg
Panjang
L
m
Waktu
T
s
Suhu
Ɵ
K
Arus listrik
E
A
Intensitas cahaya
I
Cd
Jumlah zat
A
mol
I.
ANALISA FINANSIAL
Sutojo (1983) dan Kadariah et al. (1999) menyebutkan bahwa kajian terhadap keadaan dan prospek suatu pabrik dilakukan atas aspek-aspek tertentu, yaitu aspek teknis, aspek manajerial dan administratif, aspek organisasi, aspek pemasaran, aspek finansial, dan aspek ekonomi. Umar (2005) manambahkan bahwa kajian terhadap keadaan dan proses suatu pabrik juga memerlukan analisis terhadap aspek lingkungan, aspek legalitas, dan aspek sosial dan ekonomi. Aspek-aspek tersebut biasanya dianalisis dengan teknik-teknik tertentu dengan mempertimbangkan manfaat bagi indutri tersebut. Dalam penelitian ini hanya akan dikaji mengenai aspek finansial. Oleh karena itu akan lebih dititikberatkan pada finansial pembuatan usaha siklodekstrin.
Evaluasi aspek finansial dilakukan untuk memperkirakan jumlah dana yang diperlukan. Selain itu, juga dipelajari struktur pembiayaan serta sumber dana yang menguntungkan (Djamin, 1984). Aspek finansial dilakukan setelah selesai evaluasi aspek lainnya dalam rencana investasi proyek selesai dilaksanakan. Analisis finansial adalah perbandingan antara pengeluaran dengan
pemasukan suatu proyek dengan melihat dari sudut badan atau orang yang menanamkan modalnya dalam proyek tersebut memberikan sumbangan atau rencana yang positif dalam pembangunan ekonomi nasional (Kadariah et al,. 1978).
Dari aspek finansial dapat diperoleh gambaran tentang struktur pemodalan bagi perusahaan yang mencakup seluruh kebutuhan modal untuk dapat melaksanakan aktivitas mulai dari perencanaan sampai pabrik beroperasi. Secara umum, biaya dikelompokkan menjadi biaya investasi dan biaya modal kerja. Biaya investasi meliputi pembiayaan kegiatan prainvestasi, pengadaan tanah, bangunan, mesin dan peralatan, berbagai aset tetap, serta biaya-biaya lain yang bersangkutan dengan pembangunan proyek. Biaya kerja meliputi biaya produksi (bahan baku, tenaga kerja, overhead pabrik, dan lain-lain), biaya administrasi, biaya pemasaran, dan penyusutan. Kemudian dilakukan penilaian aliran dana yang diperlukan dan kapan dana tersebut dapat dikembalikan sesuai dengan jumlah waktu yang ditetapkan, serta apakah proyek tersebut menguntungkan atau tidak (Edris, 1993).
Modal investasi dalam analisis finansial dibagi menjadi dua, yaitu modal tetap dan modal kerja. Modal tetap dipergunakan antara lain untuk pembiayaan kegiatan prainvestasi, pengadaan tanah, bangunan, mesin dan peralatan, serta biaya-biaya lain yang bersangkutan dengan pembangunan proyek, serta pengadaan dana modal tetap itu sendiri (Sutojo, 1996). Untuk menghindari salah perhitungan karena timbulnya hal-hal yang tidak dapat diduga sebelumnya, maka ditambahkan biaya lain-lain atau biaya yang biasa disebut dengan biaya kontingensi. Nilai yang lazim digunakan dalam menghitung biaya kontingensi adalah sebesar 10% (Sutojo, 1996).
Penyusutan merupakan pengalokasian biaya investasi suatu proyek pada setiap tahun sepanjang umur proyek tersebut. Menurut De Garmo et al. (1994), metode yang sering digunakan adalah metode garis lurus dimana perhitungan penyusutan didasarkan pada asumsi bahwa penurunan nilai peralatan atau bangunan secara konstan selama umur pemakaian.
Menurut Gray et al. (1993) untuk mencari ukuran yang menyeluruh sebagai dasar penerimaan atau penolakan suatu proyek, telah dikembangkan berbagai cara yang dinamakan sebagai kriteria investasi. Kriteria investasi yang digunakan adalah Break Even Point (BEP), Net Present
Value (NPV), Internal Rate of Return (IRR), Net Benefit Cost Ratio (Net B/C), Payback Period
(PBP), dan analisis sensitivitas. Selain itu, diperlukan perhitungan biaya investasi dan kebutuhan modal kerja (Behrens dan Hawranek, 1991).