1
SINTESIS DUA ANALOG 4’-BROMO CALKON MELALUI KONDENSASI ALDOL DAN UJI ANTIOKSIDAN METODE FERI TIOSIANAT
Maharani1, Yuharmen2, Y. Eryanti2 Email : maharani19@ymail.com 1
Mahasiswa Program Studi S1 Kimia FMIPA-UR 2
Dosen Bidang Organik Jurusan Kimia FMIPA-UR
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Riau Kampus Binawidya Pekanbaru, 28293, Indonesia
ABSTRACT
Chalcons are precursors of open chain flavonoids and isoflavonoids present in edible plants. Their derivatives have become attention for researchers because of their potentioal pharmacological effects. In finding of new efficient antioxidant compounds, substituted-chalcones have been synthesized by condensing benzaldehyde derivatives with 4’-bromoacetophenone in conventional method at room temperature based on Claisen-Schmidt condensation on alkali condition. The structures of the compounds were characterized by using infra red and nuclear magnetic resonance spectroscopy. In terms of antioxidant activity by using ferric thiocyanate (FTC) method, the compounds showed moderate antioxidant activity.
Keywords : chalcone, antioxidant activity and ferric thiocyanate method.
PENDAHULUAN
Calkon di alam memiliki aktivitas biologi yang bervariasi diantaranya sebagai antimikroba, antimalaria, antioksidan, antitumor, anti-inflamasi, antikanker, anti
hepatotoksik, dan lainnya. Aktivitas calkon ini disebabkan oleh gugus etilen keto (-CO-CH=CH-) yang reaktif serta substituen pada cincin A dan B (Prasad dkk., 2008).
Oleh karena itu, calkon banyak dijadikan sebagai model struktur senyawa target oleh para peneliti kimia organik sintesis (Hamada, 2011). Calkon tersusun dari dua cincin aromatik yang dihubungkan oleh tiga atom karbon α,β tak jenuh pada sistem karbonil. Nama IUPAC dari calkon adalah 1,3-difenil-1,2-propena-1-on (1), sehingga dapat diketahui bahwa calkon mempunyai ikatan rangkap yang terkonjugasi terhadap dua cincin benzena (Singh dkk, 2011).
O H H 2' 3' 5' 6' 6 4 5 3 4' 2 A B (1)
2
Keton α,β tak jenuh merupakan prekursor flavonoid yang terdapat pada tumbuhan tingkat tinggi yang dikenal sebagi calkon atau benzalasetofenon. Menurut hipotesis Pelter, calkon merupakan senyawa intermediet dalam pembentukan senyawa flavonoid lainnya seperti flavon, isoflavon, auron, flavanonol dan sebagainya (Markham, 1988). Calkon dapat diperoleh dengan cara isolasi senyawa bahan alam dari tumbuhan. Namun untuk memperoleh calkon dengan metode isolasi ini, terdapat beberapa kekurangan antara lain adalah jumlahnya yang terbatas dibanding dengan senyawa flavonoid lain, persentasenya dalam tumbuhan sangat kecil (3-5%), variasi strukturnya relatif sedikit, serta membutuhkan biaya yang mahal (Harborne, 1994). Oleh karena itu, dibutuhkan suatu solusi yang dapat meminimalisir segala kekurangan metode isolasi senyawa bahan alam yaitu dengan teknik sintesis kimia (Seebah, 1990).
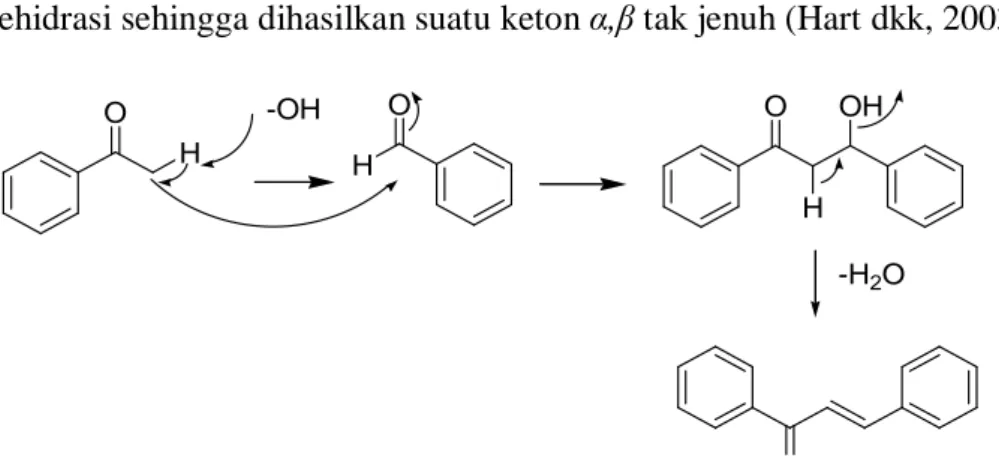
Melalui analisis retrosintesis, senyawa calkon dapat disintesis dengan menggunakan starting material berupa senyawa-senyawa yang mempunyai karbonil aromatik yaitu suatu keton aromatik dan aldehid aromatik (Hamada dkk, 2011). Reaksi ini dapat menggunakan katalis asam atau basa, dan dikenal dengan kondensasi aldol atau lebih spesifik kondensasi Claisen-Schmidt. Reaksi ini dikenal ramah lingkungan karena tidak banyak menggunakan bahan-bahan kimia berbahaya dan prosesnya juga sangat sederhana sehingga sangat mendukung Green Chemistry (Rateb dkk, 2009). Kondisi sedikit asam atau basa, suatu aldehid atau keton yang mempunyai minimal satu atom hidrogen α akan mengalami reaksi adisi sesamanya, reaksi ini kemudian diikuti dengan reaksi dehidrasi sehingga dihasilkan suatu keton α,β tak jenuh (Hart dkk, 2003).
O O H -OH H O O H OH -H2O
Gambar 1. Skema reaksi sintesis calkon
Dewasa ini peneliti telah banyak mengembangkan penelitian sintesis calkon untuk kepentingan terapiutik, salah satunya untuk antioksidan. Suatu senyawa yang mempunyai aktivitas antioksidan dapat mencegah dan melawan terjadinya kerusakan pada jaringan tubuh manusia dengan efek fisiologis oksidasi yang normal. Calkon sebagai antioksidan eksogen mampu menetralkan radikal bebas dengan cara menyumbangkan satu elektron pada spesies reaktif, sehingga radikal terbentuk pada calkon yang kemudian dinetralkan oleh resonansi dari cincin benzen (Patil dkk, 2009). Kehadiran senyawa keto yang reaktif dan grup vinilenik pada analog calkon dapat membuat senyawa tersebut memiliki aktivitas sebagai antioksidan yang baik.
3
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini merupakan metode eksperimen laboratorium yang dilakukan berdasarkan pada tahapan sintesis senyawa calkon menggunakan katalis basa untuk mencari kondisi reaksi, pemurnian, dan penentuan struktur. Kemudian uji antioksidan senyawa yang diperoleh dengan metode feri tiosianat (FTC).
a. Sintesis analog calkon
Sintesis senyawa turunan calkon (4) dapat dilakukan dengan kondensasi aldol menggunakan senyawa awal turunan benzaldehid (2) dan turunan asetofenon (3) dengan menggunakan katalis basa (NaOH) seperti terlihat pada skema reaksi berikut :
O H O O -H2O R1 R2 R1 R2 NaOH
Gambar 2. Skema reaksi kondensasi aldol untuk sintesis calkon
Penelitian ini menggunakan pendekatan kimia kombinatorial yaitu memproduksi sejumlah senyawa secara bersamaan dengan menggunakan senyawa awal keton aromatik 4-bromoasetofenon (A) dan dua senyawa aldehid aromatik yaitu 2-klorobenzaldehid (B1) dan 3-bromobenzaldehid (B2) untuk menghasilkan dua analog calkon yaitu (E)-1-(4’bromofenil)-3-(2-klorofenil)-prop-2-en-1-on (M1) dan (E)-1-(4’-bromofenil)-3-(3-bromofenil)-prop-2-en-1-on (M2), seperti yang tertera pada tabel berikut.
Tabel 1. Tabel kombinatorial hipotetik
H O Cl Br H O B1 B2 Br O Br O Cl Br O Br A M1 M2
b. Karakterisasi senyawa hasil sintesis
Senyawa murni dari hasil sintesis calkon yang diperoleh kemudian ditentukan strukturnya dengan intrumen spektroskopi ultraviolet, spektroskopi IR, dan spektroskopi NMR proton. Pengukuran spektrum UV dan IR dilakukan di jurusan kimia
(4) (3)
4
FMIPA Universitas Riau, sedangkan pengukuran spektrum NMR dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI) Serpong, Tangerang.
c. Penentuan aktivitas antioksidan metode feri tiosianat
Pengujian aktivitas antioksidan menggunakan metode feri tiosianat merupakan oksidasi asam linoleat, yaitu suatu uji yang mengukur kemampuan antioksidan dalam menghambat spesies reaktif atau peroksida secara kualitatif. Sebanyak 50 µl (50,100, 200 dan 300 ppm) sampel calkon dicampurkan dengan 5 ml etanol absolut dan ditambahkan 50 µl asam linoleat. Kemudian campuran tersebut divortek hingga homogen, ukur absorbansi T0 pada panjang gelombang 500 nm. Campuran itu diinkubasi pada suhu ruang selama 24 jam. Setelah 24 jam, campuran tersebut ditambahkan 30 µl FeCl2 0.014M dan 30 µl KSCN 30%, campuran itu divortek hingga homogen dan absorbansi diukur pada panjang gelombang 500 nm. Lakukan hal yang sama terhadap kontrol calkon yang tanpa penambahan asam linoleat dan blanko tanpa penambahan sampel calkon. Lakukan perhitungan persen inhibisi (T24) dengan menggunakan persamaan berikut ini.
% = { − ( − ) −
− } %
Diketahui :
St : Absorbansi sampel pada t (24 jam) So : Absorbansi sampel pada t (0 jam) Bt : Absorbansi blanko pada t (24 jam) Bo : Absorbansi blanko pada t (0 jam) Kt : Absorbansi kontrol pada t (24 jam)
HASIL DAN PEMBAHASAN
Penelitian ini berhasil mensintesis turunan calkon melalui kondensasi aldol, reaksi antara aldehid aromatik 2-klorobenzaldehid dan 3-bromobenzaldehid dengan keton aromatik 4-bromoasetofenon. Peneliti menggunakan basa NaOH sebagai katalis pada saat penggerusan, sehingga diperoleh (E)-1-(4’bromofenil)-3-(2-klorofenil)-prop-2-en-1-on (M1) dan (E)-1-(4’-bromofenil)-3-(3-bromofenil)-prop-2-en-(E)-1-(4’bromofenil)-3-(2-klorofenil)-prop-2-en-1-on (M2).
Senyawa M1 yang diperoleh berupa kristal berwarna putih kekuningan dengan berat 0,7214 g dan rendemen yang dihasilkan sebesar 44,86 %. Menurut Jayapal dkk (2010) rendemen senyawa hasil sintesis yang memiliki starting material dari aldehid dan keton aromatik tersubstitusi gugus halogen dan hidroksi akan relatif kecil. Hal ini dikarenakan oleh adanya kemungkinan terbentuk produk selain molekul target. Adanya gugus halogen pada starting material dalam sintesis senyawa M1 menyebabkan ganguan reaksi kondensasi aldol.
Uji kemurnian senyawa M1 dilakukan dengan KLT menggunakan tiga eluen dengan perbandingan yang berbeda, yaitu etil asetat : heksana (1:9) dengan harga Rf = 0,63; etil
5
asetat : heksana (5:95) dengan harga Rf = 0,52; dan etil asetat : heksana (3:97) dengan harga Rf = 0,38. Hasil uji KLT ini menunjukkan bahwa senyawa M1 telah murni. Untuk memastikan kemurniannya, maka dilakukan pengukuran titik leleh senyawa M1 dan diperoleh range titik leleh 93-95ºC. Range titik leleh sebesar 2oC menunjukkan bahwa senyawa M1 telah murni. Kromatogram KCKT menunjukkan bahwa hanya terdapat satu puncak dominan yaitu pada tR= 18,5 menit pada panjang gelombang 210 dan 310 nm, yang menunjukkan bahwa senyawa M1 yang diperoleh telah murni.
Spektrum IR senyawa (E)-1-(4’bromofenil)-3-(2-klorofenil)-prop-2-en-1-on (M1), menunjukkan adanya serapan pada bilangan gelombang (cm-1) 1662 yang mengindikasikan adanya vibrasi ikatan C=O, 1600 yang mengindikasikan adanya vibrasi ikatan C=C, 3091 yang mengindikasikan adanya vibrasi ikatan C-H aromatik, 625 yang mengindikasikan adanya vibrasi ikatan C-Br, dan bilangan gelombang pada 755 yang mengindikasikan adanya vibrasi ikatan C-Cl.
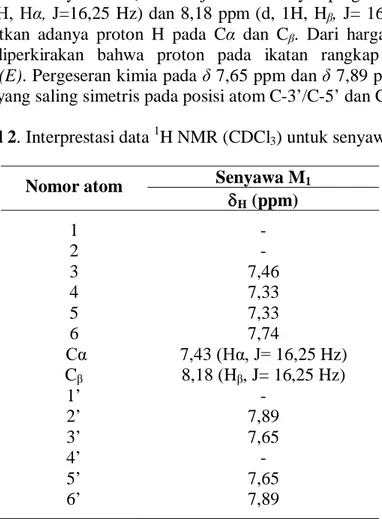
Spektrum 1H NMR senyawa M1 menunjukkan adanya pergeseran kimia pada δ 7,43 ppm (d, 1H, Hα, J=16,25 Hz) dan 8,18 ppm (d, 1H, Hβ, J= 16,25 Hz)
berturut-turut memperlihatkan adanya proton H pada Cα dan Cβ. Dari harga tetapan kopling tersebut dapat diperkirakan bahwa proton pada ikatan rangkap ini mempunyai konfigurasi trans (E). Pergeseran kimia pada δ 7,65 ppm dan δ 7,89 ppm menunjukkan adanya proton H yang saling simetris pada posisi atom C-3’/C-5’ dan C-2’/C-6’ ppm.
Tabel 2. Interprestasi data 1H NMR (CDCl3) untuk senyawa M1
Nomor atom Senyawa M1
H (ppm) 1 - 2 - 3 7,46 4 7,33 5 7,33 6 7,74 Cα 7,43 (Hα, J= 16,25 Hz) Cβ 8,18 (Hβ, J= 16,25 Hz) 1’ - 2’ 7,89 3’ 7,65 4’ - 5’ 7,65 6’ 7,89
Senyawa M2 yang diperoleh berupa kristal berwarna kuning dengan berat 0,5636 g dan rendemen yang dihasilkan sebesar 30,79 %. Seperti senyawa M1, senyawa M2 juga berasal dari aldehid dan keton aromatik yang tersubstitusi halogen. Sedikitnya
6
rendemen yang diperoleh dikarenakan pada reaksi kondensasi di atas juga menghasilkan produk samping (Jayapal dkk, 2010).
Uji kemurnian senyawa M2 dilakukan dengan KLT menggunakan tiga eluen dengan perbandingan yang berbeda yaitu etil asetat : heksana (1:9) dengan harga Rf = 0,69; etil asetat : heksana (5:95) dengan harga Rf = 0,54; dan etil asetat : heksana (3:97) dengan harga Rf = 0,45. Untuk memastikan kemurniannya, maka dilakukan pengukuran titik leleh senyawa M2 dan diperoleh range titik leleh 118-120 ºC. Untuk lebih memastikan kemurniannya, dilakukan analisis kemurnian dengan KCKT. Kromatogram KCKT menunjukkan bahwa hanya terdapat satu puncak dominan yaitu pada tR= 19,8 menit pada panjang gelombang 210 dan 310 nm, yang menunjukkan bahwa senyawa M2 yang diperoleh telah murni.
Spektrum IR senyawa (E)-1-(4’-bromofenil)-3-(3-bromofenil)-prop-2-en-1-on (M2) menunjukkan adanya serapan pada bilangan gelombang (cm-1) 1663 yang mengindikasikan adanya vibrasi ikatan C=O, 1607 yang mengindikasikan adanya vibrasi ikatan C=C, 3087 yang mengindikasikan adanya vibrasi ikatan C-H aromatik, 624 yang mengindikasikan adanya vibrasi ikatan gugus C-Br.
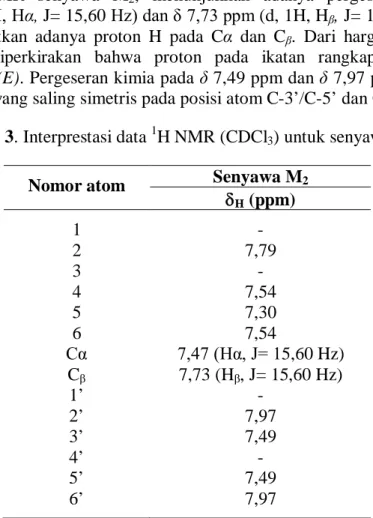
Spektrum 1H NMR senyawa M2, menunjukkan adanya pergeseran kimia pada δ 7,47 ppm (d, 1H, Hα, J= 15,60 Hz) dan δ 7,73 ppm (d, 1H, Hβ, J= 15,60 Hz)
berturut-turut memperlihatkan adanya proton H pada Cα dan Cβ. Dari harga tetapan kopling tersebut dapat diperkirakan bahwa proton pada ikatan rangkap ini mempunyai konfigurasi trans (E). Pergeseran kimia pada δ 7,49 ppm dan δ 7,97 ppm menunjukkan adanya proton H yang saling simetris pada posisi atom C-3’/C-5’ dan C-2’/C-6’ ppm.
Tabel 3. Interprestasi data 1H NMR (CDCl3) untuk senyawa M2
Nomor atom Senyawa M2
H (ppm) 1 - 2 7,79 3 - 4 7,54 5 7,30 6 7,54 Cα 7,47 (Hα, J= 15,60 Hz) Cβ 7,73 (Hβ, J= 15,60 Hz) 1’ - 2’ 7,97 3’ 7,49 4’ - 5’ 7,49 6’ 7,97
7
Pengujian aktivitas antioksidan senyawa M1 dan M2 digunakan metode oksidasi asam linoleat (Lindsey dkk, 2002). Asam linoleat pada suhu 37oC selama penyimpanan akan teroksidasi dan menghasilkan peroksida. Peroksida asam linoleat ini akan mengoksidasi Fe+2 (fero) menjadi Fe+3(feri). Ion feri akan bereaksi dengan ion tiosianat (CNS-) membentuk senyawa kompleks berwarna merah, semakin banyak peroksida yang dihasilkan maka semakin merah pula warnanya. Bilangan peroksidasi dapat diukur pada panjang gelombang 500 nm menggunakan spektrofotometer sinar tampak. Berikut adalah reaksi oksidasi asam linoleat tanpa antioksidan.
CH CH O2 HC O* H C O* H C O* H C O* Fe2+ 2H+ H C OH H C OH + Fe3+ Fe3+ + CNS - Fe(CNS)3 (merah)
Gambar 3. Reaksi oksidasi asam linoleat tanpa antioksidan
Sampel M1 dan M2 dibuat larutan dengan kosentrasi bervariasi (50, 100, 200 dan 300 ppm) menggunakan etanol absolut sebagai pelarut. Kosentrasi yang bervariasi digunakan untuk melihat kecenderungan aktivitas antioksidan senyawa M1 dan M2 yang akan naik dengan meningkatnya kosentrasi, seperti yang terlihat pada persen inhibisi yang berbanding lurus dengan kosentrasi senyawa M1 dan M2 pada Tabel 4. Hal ini dikarenakan dengan semakin tinggi kosentrasi suatu senyawa antioksidan, maka semakin banyak kesempatan senyawa tersebut untuk menghambat reaksi radikal bebas. Tabel 4. Aktivitas antioksidan senyawa M1 dan M2
Sampel Kosentrasi (ppm) Inhibisi(%) ± SD Persamaan*
100 6,61 ± 0,36 200 8,30 ± 0,68 M1 300 13,38 ± 0,21 Y= 0,046x + 0,500 400 20,52 ± 0,12 100 8,91 ± 0,72 200 10,45 ± 0,53 M2 300 400 16,56 ± 0,50 20,84 ± 0,63 Y= 0,041x + 3,715
8
Sifat antioksidan dari senyawa M1 dan M2 dapat digolongkan menjadi antioksidan sekunder karena dapat menghambat tahap propagasi. Senyawa M1 dan M2 dapat memberikan pasangan elektron kepada radikal yang terbentuk pada asam linoleat, sehingga oksidasi ion fero (Fe+2) menjadi ion feri (Fe+3) dapat dihambat. Hal ini dapat dilihat dari absorbansi sampel lebih rendah dibandingkan absorbansi blanko sampel pada waktu 24 jam. Berikut reaksi oksidasi asam linoleat dengan penambahan senyawa M1 dan M2 yang bersifat sebagai antioksidan.
HC CH O2 H C HC O* O* H C HC OHOH + Fe+2 + Fe+2 + Fe+2 2H+ M
Gambar 4. Reaksi oksidasi asam linoleat dengan antioksidan
Perbedaan persen inhibisi senyawa M1 dan M2 tidak terlalu besar, hal ini dapat dilihat dari slope kedua persamaan di atas tidak berbeda nyata. Perbedaan persen inhibisi yang hampir sama ini dikarenakan kedua senyawa memiliki substituen pada cincin B berasal dari golongan halogen.
KESIMPULAN DAN SARAN
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulan bahwa senyawa calkon (E)-1-(4’bromofenil)-3-(2-klorofenil)-prop-2-en-1-on (M1) dan senyawa calkon (E)-1-(4’-bromofenil)-3-(3-bromofenil)-prop-2-en-1-on (M2) telah berhasil disintesis menggunakan katalis NaOH dengan metode gerus. Hasil uji kromatografi lapis tipis (KLT), titik leleh dan kromatografi cair kinerja tinggi (KCKT) menunjukkan yang diperoleh dari hasil penelitian ini telah murni. Karakterisasi kedua senyawa dengan spektroskopi UV, FTIR dan NMR proton menunjukkan struktur sesuai dengan molekul target. Kedua senyawa analog calkon hasil sintesis memiliki aktivitas antioksidan yang baik dalam menghambat oksidasi ion fero (F+2) menjadi ion feri (Fe+3). Perbedaan letak substituen halogen pada cincin aromatik B senyawa analog calkon tidak berpengaruh terhadap aktivitas antioksidannya dan dapat dilihat dari perbedaan slope dari kedua senyawa yang tidak berbeda nyata.
Supaya memperoleh hasil yang lebih baik pada penelitian-penelitian selanjutnya, maka perlu dicari metode sintesis lain untuk mendapatkan rendemen yang lebih baik dan waktu sintesis yang efisien. Selain itu untuk penelitian sintesis analog calkon berikutnya
9
disarankan agar memvariasikan letak substituen pada cincin aromatik A, bukan hanya pada cincin aromatik B. Sedangkan pada uji aktivitas antioksidan perlu dilakukan dengan metode yang berbeda, dan juga pengujian aktivitas biologi lainnya, agar senyawa yang telah disintesis diketahui pemanfaatan dan kegunaannya secara lebih luas.
UCAPAN TERIMAKASIH
1. Ayahanda Masni dan ibunda Parida tercinta yang telah memberikan pengorbanan yang tidak terhitung, semoga Allah membalasnya dengan kebaikan.
2. Drs. Yuharmen, M.Si sebagai pembimbing satu yang banyak memberikan saran, kritikan, dan bantuan moril maupun dukungan finansial sehingga penelitian ini dapat diselesaikan.
3. Dra. Yum Eryanti sebagai pembimbing dua yang banyak memberikan saran dan perbaikan selama berdiskusi dengan beliau.
4. Dr. Hilwan Yuda Teruna, M.Sc dan Rudi Hendra Sy, M.Sc, Apt yang telah membantu peneliti selama penelitian hingga menulis karya ilmiah.
DAFTAR PUSTAKA
Abate,C., Patel, L., dan Raucher, F.J.1990. Redox Regulation of Fos and Jun DNA-Binding Activity in Vitro. Science. 249: 1157-1161.
Abdullah M.A. dan Khan, A.S. 2011. Synthesis and Anti-Bacterial Activities of a Bis-Chalcone Derived from Thiophene and Its Bis-Cyclized Product. Molecules. 16: 523-531.
Ahmed, M. R., Sastry, V. G., Bano, N., Ravichandra, S., dan Raghavendra, M. 2011. Synthesis and Cytotoxic, Anti Oxidant Activites of New Chalcone Derivative. J.Chem. 4 :289-294.
Allen, R.G. dan Tressini, M. 2000. Oxidative Stress and Gene Regulation. Free Radical Bio. Med. 28: 463-99.
Droge, W .2002. Free Radicals in the Physiological Control of Cell Function. Physiol Rev. 82: 47-95.
Fariz, M. 2009. Solvent-free Synthesis of Chalcone by Aldol Condensation Catalyzed by Solid Sodium Hydroxyde (NaOH). Bachelor of Science (hons) Chemistry, Selangor.
Hamada, N.M.M dan Sharshira, E.M. 2011. Synthesis and Antimicrobial Evaluation of Some Heterocyclic Chalcone Derivatives. Molecules. 16: 2304-2312.
Harborne, J.B. 1987. Metode Fitokimia: Penentuan Cara Modern Menganalisis Tumbuhan. Terjemahan Kosasih Padmawinata & Iwang Sudiro. ITB, Bandung. Hart, H., Leslie, E.C., dan David, J.H. 2003. Kimia Organik Suatu Kuliah Singkat.
10
Inoue, M. 2001. Protective Mechanisms Against Reactive Oxygen Species. Philadelphia. 2: 81-90.
Jayapal M.R., Prasad K.S, dan Sreedhar N.Y. 2010. Synthesis and Characterization of 2,6-Dihydroxy Substituted Chalcones Using PEG-400 as a Recyclable Solvent. Journal of Pharmaceutical Science and Research. 2: 450-458.
Jayapal, M.R. dan Sreedhar, N.Y. 2010. Anhydrous K2CO3 as Catalyst for the Synthesis of Chalcones Under Microwave Irradiation. Journal of Pharmaceutical Science and Research. 2(10): 644-647.
Jayapal, M.R., Prasad, K.S., dan Sreedhar, N.Y. 2010. Synthesis and Characterization of 2,5-Dihydroxy Substituted Chalcones Using SOCl2/EtOH. International Journal of Pharma and Bio Sciences. 1(4): 361-366.
Kikazuki, H., Hisamoto, M., Hirose, K., Akiyama, dan Taniguchi, H. 2002. Antioxidant Properties of Ferulic Acid and Its Related Compound. J.Agric. Food Chem. 50: 2161-2168.
Lindsey, L.K., Motsel, L.M., dan Janger, K.A. 2002. Screening of South African Food Plants for Antioxidant Activity. J.Food Sci. 67: 2139-2130.
Markham, K.R. 1988. Cara Mengidentifikasi Flavonoid. Terjemah Kosasih Padmawinata. ITB, Bandung.
Mohrig, J.R. dan Neckers, D.C. 1979. Laboratory Experiment in Organic Chemistry third edition. D. Van Nostrand Company, New York.
Patil, C.B., Mahajan, S.K., dan Katti, S.A. 2009. Chalcone: A Versatile Molecule. Journal of Pharmaceutical Science and Research. 1: 11-12.
Pietta, P. G. 2000. Flavonaid as Antioxidant. Journal of Natural. 63: 1035-1042.
Prasad R.Y., Rao A.L., and Rambabu, R. 2008. Synthesis and Antimicrobial Activity of Some Chalcone Derivatives. E-Journal of Chemistry. 5(3): 461-466.
Proctor, P.H. dan Reynolds, E.S. 1984. Free radicals and disease in man. Physiol Chem Phys Med. 16:175-95.
Rateb, M.N. dan Zohdi, F.H. 2009. Atom Efficient, Solven Free, Green Sinthesys of Chalcones by Grinding. Synthetic Communacation. 39: 2789-2794.
Seebah, D. 1990. Organic Shynthesis-where now?. Angew. Chem Int. 29:1320-1367. Singh, S., Sharma, P.K., Kumar, N., dan Dudhe, R. 2011. Anti-oxidant Activity of
2-hydroxyacetophenone Chalcone. J Adv Sci Re. 2(3): 37-41.
Solomons dan Fryhle. 2011. Organic Chemistry. John Wiley and Sons. Inc.
Usman, H., Jalaluddin, M.N., Harlin, T., Hakim, E.H., Achmad, S.A., Syah, Y,M., latip, J., dan Said, M.I. 2005. Senyawa Calkon Baru Bersifat Antibakteri dari Tumbuhan Crytocarya costata (lauraceae). Koba-ITB, Bandung.
Wingrove, A.S. dan Caret, R.L. 1981. Organic Chemistry. Harper and Row Publishers, New York.
Winter, C. K. dan Davis, S. F. 2006. Scientific Status Summary Organic Food. J.Food Sci. 71: 1-19.