BAB II
TINJAUAN PUSTAKA
2.1 Tetrasiklin
2.1.1 Uraian umum tetrasiklin (Ditjen POM, 2014) Rumus Bangun:
Gambar 2.1 Rumus bangun tetrasiklin Rumus Molekul : C22H24N2O8
Berat Molekul : 444,43
Pemerian : Serbuk hablur, kuning; tidak berbau. Stabil di udara tetapi pada pemaparan dengan cahaya matahari kuat menjadi gelap. Dalam larutan dengan pH lebih kecil dari 2, potensi berkurang, dan cepat rusak dalam larutan alkali hidroksida.
Kelarutan : Sangat sukar larut dalam air; mudah larut dalam larutan asam encer dan dalam larutan alkali hidroksida; sukar larut dalam etanol; praktis tidak larut dalam kloroform dan dalam eter.
2.1.2 Farmakologi tetrasiklin
Tetrasiklin termasuk antibiotik yang terutama bersifat bakteriostatik. Hanya mikroba yang cepat membelah yang dipengaruhi obat ini (Setiabudy, 2012).
Tetrasiklin memperlihatkan spektrum antibakteri luas yang meliputi bakteri Gram-positif dan -negatif, -aerobik dan anaerobik. Selain itu, tetrasiklin juga aktif terhadap spiroket, mikoplasma, riketsia, klamidia, legionela, dan protozoa tertentu (Setiabudy, 2012). Tetrasiklin juga digunakan untuk mengobati ulkus peptikum yang disebabkan oleh Helicobacter pylori (Katzung, dkk., 2004).
Dosis oral tetrasiklin untuk infeksi Helicobacter pylori adalah 500 mg empat kali sehari dan pegobatan selama 10-14 hari (Chey dan Wong, 2007). Untuk infeksi klamidia adalah 500 mg empat kali sehari selama 7 hari dan untuk infeksi akne adalah 500 mg dua kali sehari (Setiabudy, 2012).
2.1.3 Farmakokinetik tetrasiklin
a. Absorpsi: kira-kira 30-80% tetrasklin diserap lewat saluran cerna. Absorpsi ini sebagian besar berlangsung di lambung dan usus halus bagian atas. Berbagai faktor dapat menghambat penyerapan tetrasiklin seperti adanya makanan dalam lambung, pH tinggi, pembentukan kelat (kompleks tetrasiklin dengan zat lain yang sukar diserap seperti kation Ca2+, Mg2+, Fe2+, Al3+ yang terdapat dalam susu dan antasid). Oleh sebab itu sebaiknya tetrasiklin diberikan sebelum atau 2 jam setelah makan (Setiabudy, 2012). b. Distribusi: Dalam plasma, semua jenis tetrasiklin terikat oleh protein
serebrospinal (CSS) kadar golongan tetrasiklin hanya 10-20% kadar dalam serum. Penetrasi ke CSS ini tidak tergantung dari adanya meningitis. Penetrasi ke cairan tubuh lain dalam jaringan tubuh cukup baik. Obat golongan ini ditimbun dalam sistem retikuloendotelial di hati, limpa, dan sumsum tulang, serta di dentin dan email gigi yang belum bererupsi. Golongan tetrasiklin menembus sawar uri yang terdapat dalam air susu ibu dalam kadar yang relatif tinggi. Dibandingkan dengan tetrasiklin lainnya, daya penetrasi doksisiklin dan minosiklin ke jaringan lebih baik (Setiabudy, 2012).
c. Metabolisme: Obat golongan tetrasiklin tidak dimetabolisme di hati (Setiabudy, 2012).
d. Ekskresi: Golongan tetrasiklin diekskresi melalui urin berdasarkan filtrasi glomerulus. Pada pemberian per oral kira-kira 20-55% golongan tetrasiklin diekskresi melalui urin. Golongan tetrasiklin yang diekskresi oleh hati ke dalam empedu mencapai kadar 10 kali kadar serum. Sebagian besar obat yang diekskresi ke dalam lumen usus ini mengalami sirkulasi enterohepatik; maka obat ini masih terdapat dalam darah untuk waktu lama setelah terapi dihentikan. Bila terjadi obstruksi pada saluran empedu atau gangguan faal hati obat ini akan mengalami kumulasi dalam darah. Obat yang tidak diserap diekskresi melalui tinja (Setiabudy, 2012).
2.1.4 Efek samping tetrasiklin
anafilaksis. Demam dan eosinofilia dapat terjadi pada waktu terapi berlangsung. Sensitisasi silang antara berbagai derivat tetrasiklin sering terjadi (Setiabudy, 2012).
b. Reaksi toksik dan iritatif: iritasi lambung paling sering terjadi pada pemberian tetrasiklin per oral. Makin besar dosis yang diberikan, makin sering terjadi reaksi ini. Keadaan ini dapat diatasi dengan mengurangi dosis untuk sementara waktu atau memberikan golongan tetrasiklin bersama dengan makanan, tetapi jangan dengan susu atau antasid yang mengandung alumunium, magnesium atau kalsium. Diare seringkali timbul akibat iritasi dan harus dibedakan dengan diare akibat superinfeksi staphylococcus sp. atau Clostridium difficile yang sangat berbahaya.
Manifestasi reaksi iritatif yang lain adalah terjadinya tromboflebitis pada pemberian IV dan rasa nyeri setempat bila golongan tetrasiklin disuntikkan IM tanpa anestetik lokal. Terapi dalam waktu lama dapat menimbulkan kelainan darah tepi seperti leukositosis, limfosit atipik, granulasi toksik pada granulosit dan trombositopenia (Setiabudy, 2012).
2.1.5 Interaksi tetrasiklin
Tetrasiklin membentuk kompleks tak larut dengan sediaan besi, aluminium, magnesium, dan kalsium, sehingga resorpsinya dari usus gagal. Oleh karena itu, tetrasiklin tidak boleh diminum bersamaan dengan makanan (khususnya susu) atau antasida (Tan dan Rahardja, 2002).
2.2 Penyakit Ulkus Peptikum 2.2.1 Gambaran umum
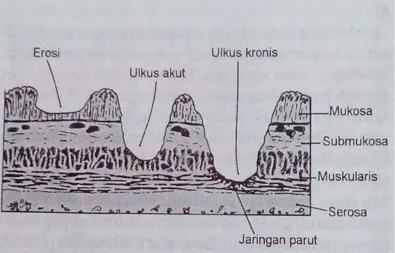
Penyakit ulkus peptikum adalah keadaan di mana kontinuitas mukosa lambung terputus dan meluas sampai di bawah epitel. Kerusakan mukosa yang tidak meluas sampai ke bawah epitel disebut erosi, walaupun sering dianggap sebagai tukak (misalnya tukak karena stress). Tukak kronik berbeda dengan tukak akut karena memiliki jaringan parut pada dasar tukak (Price dan Wilson, 1995).
Berdasarkan lokasinya, ulkus peptikum dapat ditemukan pada setiap bagian saluran cerna yang terkena getah asam lambung, yaitu esofagus, lambung, duodenum, dan setelah gastroenterostomi, juga jejunum (Price dan Wilson, 1995). Gejala utama penyakit tukak lambung adalah adanya rasa sakit dan ketidaknyamanan pada bagian lambung dan gejala lainnya seperti pendarahan pada tinja, muntah, dan tinja yang berwarna hitam menunjukkan bahwa terjadinya pendarahan pencernaan gastrointestinal (Sunil, et al., 2012).
2.2.2 Etiologi penyakit ulkus peptikum
Hipersekresi dari asam lambung dan pepsin ini yang menghambat mekanisme pertahanan mukosa proses penyembuhannya (Berardi dan Welage, 2005).
Penyebab ulkus peptikum yang lain adalah terlalu banyak sekret getah lambung yang berhubungan dengan derajat perlindungan yang diberikan oleh lapisan mukus lambung dan duodenum, serta netralisasi asam lambung oleh getah duodenum. Daerah keadaan normal yang terpapar getah lambung disuplai banyak kelenjar mukosa, mulai dengan kelenjar mukosa komposit pada bagian bawah esofagus, kemudian lambung, sel leher mukosa glandula gastrika, glandula pilorika dalam yang terutama menyekresi mukus, akhirnya kelenjar Brunner pada duodenum atas yang menyekresi mukus yang sangat alkali (Guyton, 1990).
2.2.3 Patofisiologi
Penyebab terjadinya ulkus peptikum saat ini masih sering diperdebatkan. Patifisiologi penyakit tukak lambung dapat digambarkan sebagai ketidakseimbangan antara faktor agresif (Helicobacter pylori, NSAIDs, dan asam lambung) dan faktor pertahanan (mucin, bikarbonat, dan prostaglandin), yang menyebabkan gangguan pada jaringan mukosa (Sunil, et al., 2012).
2.2.4 Helicobacter pylori
Helicobacter pylori adalah penyebab utama tukak lambung yang pertama kali di identifikasi oleh dua ilmuwan austraslia pada tahun 1982. Helicobacter pylori merupakan bakteri bacillus gram negatif, berbentuk spiral, bakteri
spiral dan flagel dari bakteri yang membantunya berpindah-pindah disekitar lumen dalam lambung (Berardi dan Welage, 2005).
Helicobacter pylori memproduksi enzim urease dalam jumlah besar
dimana enzim ini menghidrolisis urea yang terdapat dalam cairan lambung dan mengubahnya menjadi amonia dan karbondioksida. Efek netralisir dari amonia yang dihasilkan akan membentuk suasana netral dan mengelilingi tubuh bakteri yang dapat membantu melindungi bakteri dari pengaruh asam di lambung. Bakteri ini juga memproduksi senyawa protein penghambat asam yang membantunya untuk beradaptasi di lingkungan dengan pH yang rendah dalam lambung. Helicobacter pylori dapat berpindah ketubuh lain melalui tiga jalur yaitu
feses-oral, oral-oral dan iatrogenik (Berardi dan Welage, 2005).
Infeksi H.pylori dapat menyebabkan terjadinya gastritis kronis pada semua individu yang terinfeksi dan secara umum terkait dengan ulkus peptikum, kanker lambung, dan mukosa jaringan limpoid. Namun, hanya sejumlah kecil yang terkena infeksi H.pylori dapat mengakibatkan terjadinya penyakit ulkus peptikum sekitar 20% atau kanker lambung kurang dari 1% (Berardi dan Welage, 2005). 2.2.5 Sawar mukosa lambung
Lapisan mukosa lambung yang tebal merupakan garis depan pertahanan terhadap trauma mekanis dan agen kimia. Prostaglandin terdapat dalam jumlah berlebihan di mukus lambung dan berperan penting dalam pertahanan mukosa lambung. Sawar mukosa penting untuk perlindungan lambung dan duodenum (Price dan Wilson, 1995). Prostaglandin dapat meningkatkan resistensi selaput lendir terhadap iritasi mekanis, osmotik, termis atau kimiawi dengan cara regulasi sekresi asam lambung, sekresi mukus, bikarbonat, dan aliran darah mukosa. Pengurangan prostaglandin pada selaput lendir lambung memicu terjadinya ulkus. Hal ini membuktikan salah satu peranan penting prostaglandin untuk memelihara fungsi sawar selaput lendir (Kartasasmita, 2002).
Destruksi sawar mukosa diduga merupakan faktor penting dalam patogenesis ulkus peptikum. Aspirin, alkohol, garam empedu, dan zat-zat lain dapat merusak mukosa lambung. Kerusakan yang terjadi dapat dilihat pada gambar dibawah ini
2.2.6 Terapi eradikasi Helicobacter pylori
Di Amerika Serikat, terapi eradikasi Helicobacter pylori terdiri atas: terapi lini pertama / terapi tripel, terapi lini kedua / terapi kuadrupel, dan terapi sekuensial (Chey dan Wong, 2007).
Terapi lini pertama digunakan obat antara lain (Chey dan Wong, 2007) : - Proton pump inhibitor + amoksisilin + klaritomisin (70-85%)
- Proton pump inhibitor + metronidazol + klaritomisin (70-85%) - Proton pump inhibitor + metronidazol + tetrasiklin (75-90%) Pengobatan dilakukan selama 10-14 hari
Dosis :
1. PPI: Omeprazole 2x20 mg/hari, Lansoprazole 2x30 mg/hari, Rabeprazole 2x10 mg/hari, dan Esomeprazole 2x20 mg/hari
2. Amoksisilin : 2 x 1000 mg/hari 3. Klaritomisin : 2 x 500 mg/hari 4. Metronidazol : 3 x 500 mg/hari 5. Tetrasiklin : 4 x 250 mg/hari
Terapi lini kedua / terapi kuadrupel dilakukan jika terdapat kegagalan pada lini pertama. Kriteria gagal dapat dilihat apabila 4 minggu pasca terapi, bakteri Helicobacter pylori tetap positif berdasarkan pemeriksaan uji nafas urea atau
hispatologi (Chey dan Wong, 2007).
Terapi lini kedua digunakan obat antara lain (Chey dan Wong, 2007) : - Bismuth subsalicylate + Proton pump inhibitor + amoksisilin +
- Bismuth subsalicylate + Proton pump inhibitor + metronidazol + klaritomisin
- Bismuth subsalicylate + Proton pump inhibitor + metronidazol + tetrasiklin
Pengobatan dilakukan selama 7 hari
Dosis bismuth subsalicylate adalah 2 x 525 mg/hari
Terapi tripel sekuensial menggunakan 3 antibiotik yang mungkin meningkatkan kecepatan eradikasi, terutama resisten klaritomisin. Regimen sekuensial terdiri dari 40 mg pantoprazol, 1 gram amoksisilin, dan placebo, masing-masing diberikan dua kali sehari untuk 5 hari pertama kemudian 40 mg pantoprazol, 500 mg klaritomisin, dan 500 mg tinidazol yang masing-masing diberikan dua kali sehari untuk sisa selama 5 hari. Terapi standar 10 hari terdiri 40 mg pantoprazol, 500 mg klaritomisin, dab 1 gram amoksisilin yang masing-masing diberikan dua kali sehari. Terapi pengobatan keduanya ditoleransi dengan baik tetapi eradikasi dengan regimen sekuensial (89%) secara signifikan lebih baik daripada terapi pengobatan standar (77%) (Hajiani, 2009).
2.3 Lambung
2.3.1 Gambaran umum
menampung sejumlah besar makanan (Leeson, dkk., 1989). Lambung menerima makanan dan bekerja sebagai penampung untuk jangka waktu pendek. Semua makanan dicairkan dan dicampurkan dengan asam lambung dan dicerna oleh usus (Pearce, 2006). Lambung merupakan organ untuk menampung makanan yang ditelan. Lambung dapat membesar sampai mencapai kapasitas dua sampai tiga liter dan tidak mempunyai bentuk yang tetap (Wibowo, 2009).
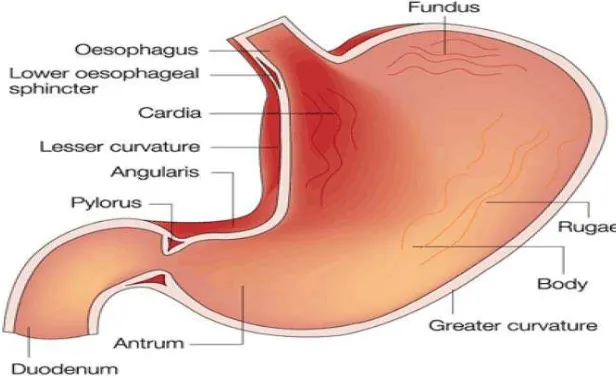
Gambar 2.3 Struktur lambung (Hameed, et al., 2014) 2.3.2 Anatomi lambung
Lambung terdiri dari empat lapisan umum, yaitu: mukosa, submukosa, muskularis, dan serosa (Leeson, dkk., 1989). Mukosa merupakan lapisan dalam lambung yang tersusun dari lipatan-lipatan longitudinal yang disebut rugae. Dengan adanya lipatan-lipatan ini, lambung dapat berdistensi sewaktu diisi makanan (Price dan Wilson, 1995). Mukosa lambung terdiri dari epitel permukaan yang mengalami invaginasi dengan berbagai kedalaman di dalam lamina propria dan membentuk gastric pits. Lamina propria dari lambung terdiri dari jaringan penghubung yang jarang yang diselilingi dengan sel-sel otot polos dan limfoid. Lapisan otot yang memisahkan mukosa dari submukosa adalah mukosa muskularis. Stres dan faktor-faktor psikosomatik lain; konsumsi substansi seperti aspirin, etanol, makanan yang hiperosmolar, dan beberapa mikroorganisme misalnya Helicobacter pylori dapat mengganggu permukaan epitel dan menyebabkan ulkus (Junqueira dan Carneiro, 2005).
Submukosa terdiri dari jaringan aerolar yang menghubungkan lapisan mukosa dan lapisan muskularis. Jaringan ini memungkinkan mukosa bergerak bersama gerakan peristaltik makanan. Lapisan ini juga mengandung pleksus saraf pembuluh darah dan saluran limfa (Price dan Wilson, 1995).
Muskularis dibentuk oleh tiga lapisan otot polos, yaitu: (1) Lapisan luar longitudinal dan (2) Lapisan tengah sirkular yang merupakan lanjutan dari kedua lapisan otot esofagus dan ditambah dengan (3) Lapisan serong (oblik) berbentuk lengkungan otot yang berjalan dari kardia mengitari fundus dan korpus (Leeson, dkk., 1989).
peritoneum yaitu satu lapis sel mesotel gepeng dan pada keadaan ini disebut serosa. Pembuluh darah dan limfa terdapat di serosa dan menuju ke lapisan-lapisan yang lain (Leeson, dkk., 1989).
2.3.3 Fisiologi lambung
Lambung memiliki fungsi utama untuk memproses dan mengangkut makanan. Selain itu, lambung juga berfungsi sebagai tempat penyimpanan makanan dalam jangka waktu singkat yang memungkinkan untuk mengonsumsi makanan dalam jumlah yang banyak secara cepat. Proses pencernaan secara enzimatik berlangsung di dalam lambung (Narang, 2011).
Apabila makanan masuk di dalam lambung maka lambung melemas akibat proses refleks relaksasi reseptif. Relaksasi otot-otot lambung ini dicetuskan oleh gerakan gerakan faring dan esofagus. Relaksasi kemudian diikuti oleh kontraksi peristaltik yang mencampur makanan dan menyemprotkannya ke dalam duodenum dengan kecepatan terkontrol. Gelombang peristaltik yang paling jelas di pusat distal lambung. Apabila berbentuk dengan baik, gelombang kontraksi berlangsung dengan kecepatan 3 kali/menit (Ganong, 1999).
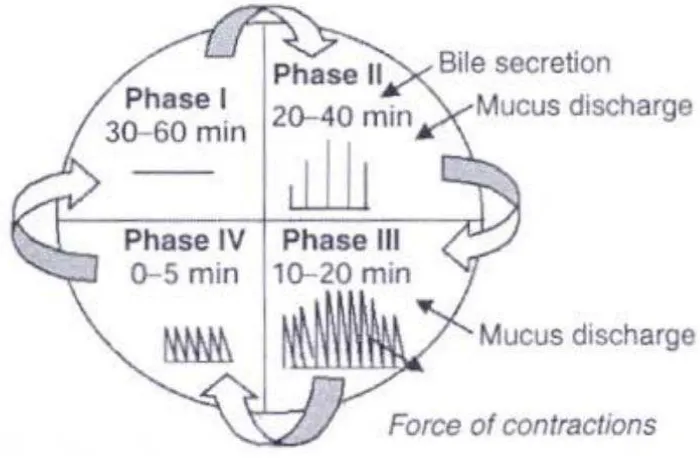
1. Tahap I (fase basal) yang berlangsung selama 30 sampai 60 menit dengan terjadinya awal motilitas kontraksi.
2. Tahap II (fase preburst) yang berlangsung selama 20 sampai 40 menit dengan potensial aksi dan motilitas kontraksi. Pada fase ini berlangsung dengan intensitas dan frekuensi motilitas kontraksi yang meningkat secara bertahap. 3. Tahap III (fase burst) yang berlangsung 10 sampai 20 menit. Fase ini
mencakup kontraksi intens dan rutin yang terjadi dalam waktu singkat
4. Tahap IV berlangsung selama 0 sampai 5 menit dan terjadi diantara fase II dan fase I yang terjadi motilitas kontraksi secara terus-menerus (Hameed, et al., 2014).
Tahapan siklus kontraksi ini dapat dilihat pada Gambar 2.4
Gambar 2.4 Pola motilitas saluran pencernaan (Hameed, 2014). 2.3.4 Sekresi lambung
lipase, mukus, kation (Na+, K+, Mg2+, H+ (pH sekitar 1,0)), dan anion (Cl- dan SO42-). Asam lambung yang disekresikan oleh kelenjar di korpus lambung
membunuh sebagian besar bakteri yang masuk, membantu pencernaan protein, menghasilkan pH yang dibutuhkan pepsin untuk mencerna protein, serta merangsang aliran empedu dan getah pankreas. Asam ini cukup pekat untuk dapat menyebabkan kerusakan jaringan, tetapi pada orang normal mukosa lambung tidak mengalami iritasi atau tercerna karena getah lambung juga mengandung mukus (Ganong, 1999).
Mukus disekresikan oleh permukaan sel-sel mukosa dan leher di korpus dan fundus serta sel-sel yang serupa di bagian lambung lain yang terdiri dari glikoprotein yang disebut musin. Masing-masing musin mengandung 4 submit yang disatukan oleh jembatan disulfida. Mukus membentuk suatu gel fleksibel yang melapisi mukosa. Membran permukaan sel mukosa dan taut erat antara sel-sel juga merupakan bagian sawar mukosa yang melindungi epitel lambung dari kerusakan (Ganong, 1999).
2.4 Sistem Penyampaian Obat 2.4.1 Uraian sistem penyampaian obat
digunakan satu dosis pemberian obat dan selama pengobatan harus menyampaikan obat secara langsung di lokasi tertentu supaya pengobatan menjadi optimal. Para ilmuwan telah berhasil mengembangkan sistem penyampaian obat yang mendekati sistem penyampaian yang ideal dan mendorong para ilmuwan untuk mengembangkan sistem penyampaian obat yang terkontrol atau “Controlled Release System”. Desain penyampaian obat secara oral dimana pelepasan obatnya
dipertahankan berlangsung secara terus menerus yang ditujukan untuk mencapai pelepasan obat yang efektif sehingga konsentrasi obat pada jaringan target dapat ditentukan dan mengoptimalkan efek terapetik obat yang dilakukan dengan cara mengendalikan pelepasan obat di dalam tubuh dengan dosis obat tertentu. Biasanya obat konvensional diberikan dalam dosis berkala yang diformulasikan sedemikian rupa untuk memastikan stabilitas, aktivitas, dan bioavalabilitas sediaan obat. Kebanyakan obat yang diformulasi dalam bentuk sediaan konvensional kurang efektif dalam penyampaian obat di jaringan target (Kumar, et al., 2012).
Rute oral yang secara umum merupakan sistem penyampaian obat yang ideal memiliki dua sifat utama yaitu (Sharma, et.al., 2011):
1. Untuk aksi diperpanjang harus diberikan dalam dosis tunggal. 2. Penyampaian langsung dari obat aktif ke jaringan target. 2.4.2 Sistem penyampaian obat pelepasan lambat
jaringan target atau sel. Sistem penyampaian obat dengan cara ini dikelompokkan ke dalam dua sistem penyampaian obat yaitu “Controlled Release” dan “Extended Release” (Lee, 1987).
a. Controlled Release
Sistem controlled release merupakan sistem penyampaian obat terkontrol yang pelepasannya secara perlahan selama priode waktu tertentu yang pelepasan obatnya diperpanjang (Lee, 1987).
b. Extended Release
Sistem extendend release merupakan sistem penyampaian obat yang pelepasan obatnya lebih lambat dari pelepasan obat secara normal pada umumnya dan dapat mengurangi frekuensi dosis obat (Lee, 1987).
Keuntungan sistem pelepasan lambat adalah mengurangi efek samping secara lokal maupun sistemik yaitu pencegahan iritasi lambung, pemanfaatan obat yang lebih baik yaitu mengakumulasi dosis kronis suatu obat, meningkatkan efisiensi pengobatan,dan meningkatkan kepatuhan pasien dengan mengurangi dosis pemakaian per hari (Isha, et al., 2012).
Pelepasan lambat menguraikan suatu pelepasan yang lambat dari bahan obat suatu sediaan untuk mempertahankan respon terapetik dalam waktu yang panjang yaitu 8-12 jam dan kriteria sediaan SR yaitu jumlah obat yang terdisolusi selama 3 jam adalah 20-50% untuk 6 jam adalah 45-75% dan 12 jam ≥ 75% (Murthy dan Sellasie, 1993).
2.4.3 Sistem penyampaian obat gastroretentif
maksud untuk pemberiaan obat lokal pada saluran cerna bagian atas ataupun untuk efek sistemik. Bentuk sediaan gastroretentif dapat bertahan di lambung untuk waktu yang lama sehingga memperpanjang waktu retensi obat pada lambung (Nayak, et al., 2010).
Jenis sistem penghantaran obat tertahan di lambung terdiri dari (Dehghan dan Khan, 2009; Ami, et al., 2012; Swetha, et al., 2012):
a. Sistem mengembang dan membesar (swelling and expandable system) b. Sistem bioadhesif (bioadhesive systems)
c. Sistem mengapung (floating systems)
d. Sistem berdensitas tinggi (high-density systems)
Gambaran sistem penghantaran obat tertahan di lambung dapat ditunjukkan pada Gambar 2.5.
Tabel 2.1 Perbedaan antara sistem penyampaian obat konvensional dan gastroretentif (Dixit, et al., 2015)
Sistem penyampaian obat konvensional
Sistem penyampaian obat gastroretentif Meningkatkan efek samping Mengurangi efek samping
Mengurangi tingkat kepatuhan pasien
Meningkatkan kepatuhan pasien
Mengurangi waktu retensi lambung Meningkatkan waktu retensi lambung Tidak sesuai untuk penyampaian
obat dengan rentang absorpsi yang sempit pada daerah usus
Sesuai untuk penyampaian obat dengan rentang absorpsi yang sempit pada daerah usus
Tidak banyak bermanfaat bagi obat yang menunjukkan aksi lokal di lambung dan terdegradasi dalam usus dan mengalami absorpsi yang cepat melalui saluran pencernaan
Bermanfaat bagi obat yang menunjukkan aksi lokal di lambung dan terdegradasi dalam usus dan mengalami absorpsi yang cepat melalui saluran pencernaan.
2.4.4 Sistem penyampaian obat mengapung (floating system)
2.4.4.1 Pembagian sistemmengapung
Sistem penghantaran obat mengapung diklasifikasikan pada dua variabel mekanisme yaitu sistem Effervescent dan sistem Non-effervescent.
a. Sistem Effervescent
Sistem ini tidak hanya menggunakan polimer sintetik tetapi juga menggunakan polimer alam untuk dibuat dalam bentuk matriks seperti dengan menggunakan polimer yang dapat mengembang seperti metil selulosa, kitosan, dan berbagai komponen effervescent seperti natrium bikarbonat, asam tartrat, dan asam sitrat. Sediaan ini dirancang sedemikian rupa sehingga ketika kontak dengan cairan lambung, maka gas karbondioksida (CO2) akan terlepas dan terperangkap
dalam sistem hidrokoloid yang mengembang. Hal ini membantu sediaan untuk mengapung. Bahan tambahan yang sering digunakan pada sistem ini adalah HPMC, polimer poliakrilat, polivinil asetat, karbopol, agar, natrium alginat, kalsium klorida, polietilen oksida, dan polikarbonat (Hameed, et al., 2014).
Lapisan terluar sistem effervescent terbuat dari polimer yang dapat mengembang yang permeabilitas terhadap cairan lambung sehingga bila berkontak dengan lapisan effervescent natrium bikarbonat akan menunjukkan reaksi netralisasi dimana karbon dioksida dibebaskan oleh keasaman cairan lambung dan terperangkap dalam sistem hidrokoloid sehingga sediaan bergerak ke atas dan mengapung kemudian obat berdifusi secara perlahan-lahan (Hameed, et al., 2014).
b. Sistem Non-effervescent
Bentuk sediaan mengapung Non-effervescent pada umumnya menggunakan bahan pembentuk gel atau memiliki kemampuan mengembang yang baik seperti senyawa hidrokoloid, polisakarida, dan polimer pembentuk matriks seperti polikarbonat, poliakrilat, polimetaklirat dan polistiren. Metode formulasi sistem ini termasuk sederhana yaitu dengan mencampurkan obat dengan hidrokoloid pembentuk gel. Setelah pemberian oral, bentuk sediaan ini mengembang dan berkontak dengan cairan lambung dan memiliki daya densitas < 1. Udara yang terperangkap dalam matriks akan mengembang sehingga sediaan mengapung. Struktur seperti gel yang mengembang bertindak sebagai reservoir dan memungkinkan pelepasan obat perlahan-lahan melalui resevoirnya (Bharathi, et al., 2015). Contoh tipe sistem penyampaian obat mengapung ini adalah sistem pelindung koloid gel, sistem kompartemen mikroporos, butiran alginat, dan mikrosfer berongga (Amit, et al., 2011).
2.4.4.2 Kandidat obat untuk sediaan mengapung
kerja obat yang lebih baik. Berbagai macam kandidat obat yang tepat untuk diformulasikan pada sistem penghantaran obat mengapung diantaranya:
a. Obat-obat yang aktif bekerja secara lokal di lambung, contoh: misoprostol dan antasida
b. Obat-obat yang memiliki rentang absorpsi sempit dalam saluran pencernaan, contoh: Levodopa, asam p-amino benzoat, furosemid, dan riboflavin.
c. Obat-obat yang tidak stabil pada lingkungan basa di bagian usus atau kolon, contoh: Captopril, ranitidine HCl, dan metronidazol.
d. Obat-obat yang mengganggu aktivitas kerja mikroba di kolon, contoh: antibiotik yang digunakan pada pengobatan Helicobacter Pylori, diantaranya tetrasiklin, klaritomisin, metronidazol, dan amoksisilin.
e. Obat-obat yang menunjukkan kelarutan yang rendah pada pH yang tinggi, contoh: diazepam, klordiazeposid, dan verapamil (Bharathi, et al., 2015).
Berikut beberapa contoh sediaan obat yang diformulasikan dalam bentuk sediaan mengapung ditunjukkan pada tabel dibawah ini.
Tabel 2.2 Berbagai contoh formulasi bentuk sediaan mengapung (Gopalakrishnan dan Chenthilnathan, 2011).
No Bentuk Sediaan Nama Obat
1 Tablet Klorfeniramin maleat, teofilin, furosemid, siprofloksasin, captopril, asam aspirin, nimodipin, amoksisilin, dan verapamil HCl.
2 Kapsul Nicardipine, klordiazeposid HCl, furosemid, misoprostol, diazepam, propanolol.
3 Mikrosper Aspirin, griseofulvin, p-nitroanillin, ketoprofen, ibuprofen, dan terfenadin.
4 Granul Indometasin, natrium diklofenak, dan prednisolon.
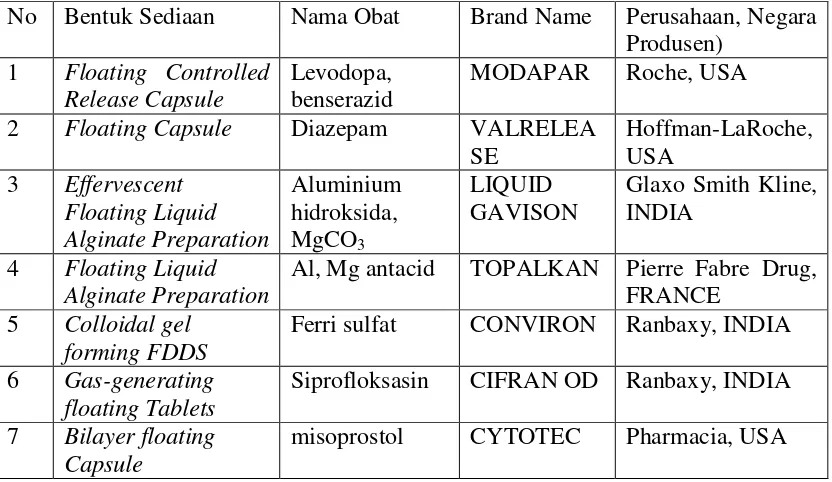
Sementara itu, bentuk sediaan mengapung yang telah tersedia dipasaran dapat dilihat pada tabel dibawah ini
Tabel 2.3 Sediaan mengapung yang telah tersedia di pasaran (Gopalakrishnan dan Chenthilnathan, 2011).
No Bentuk Sediaan Nama Obat Brand Name Perusahaan, Negara Produsen)
1 Floating Controlled Release Capsule
Levodopa, benserazid
MODAPAR Roche, USA 2 Floating Capsule Diazepam VALRELEA
SE
4 Floating Liquid Alginate Preparation
Al, Mg antacid TOPALKAN Pierre Fabre Drug, FRANCE
5 Colloidal gel forming FDDS
Ferri sulfat CONVIRON Ranbaxy, INDIA 6 Gas-generating
floating Tablets
Siprofloksasin CIFRAN OD Ranbaxy, INDIA 7 Bilayer floating
Capsule
misoprostol CYTOTEC Pharmacia, USA
2.4.4.3 Keuntungan sistem penyampaian obat mengapung
Sistem penghantaran obat melalui sistem mengapung ini merupakan teknologi penghantaran obat dengan retensi lambung yang lebih lama dan memiliki beberapa keuntungan dalam pemberian obat dengan sistem ini. Keuntungan ini meliputi:
a. Peningkatan penyerapan obat karena peningkatan waktu tinggal di lambung dan peningkatan waktu kontak obat dengan daerah penyerapan.
b. Penghantaran obat dapat dikendalikan.
c. Penghantaran obat secara lokal untuk daerah kerja di lambung.
f. Menggunakan peralatan yang sederhana dan konvensional.
g. Kemudahan dalam penggunaannya dan meningkatkan faktor kepatuhan pasien menjadi lebih baik.
h. Penghantaran obat pada daerah tertentu (Sharma, et al., 2011).
Berbagai keuntungan ini menjadikan sistem lebih dikembangkan lagi untuk menghasilkan sistem pengahantaran yang ideal (Sharma, et al., 2011). 2.4.4.4 Kekurangan sistem penyampaian obat mengapung
Disamping memiliki banyak keuntungan dalam sistem mengapung ini, terdapat pula kekurangan dari sistem ini. Kekurangan ini meliputi:
a. Retensi lambung yang dipengaruhi oleh banyak faktor seperti makanan, pH, dan motilitas lambung. Faktor-faktor ini tidak pernah tetap dan karenanya daya apung sediaan tidak dapat diprediksi.
b. Obat-obatan yang menyebabkan iritasi dan lesi pada mukosa lambung tidak cocok untuk sistem pemberian obat ini.
c. Variabilitas tinggi dalam waktu pengosongan lambung.
d. Pengosongan lambung untuk pasien pada posisi tidur telentang yang terjadi secara acak tidak dapat diprediksi dan bergantung pada diameter dan ukuran sediaan mengapung. Oleh karena itu sebaiknya tidak diberikan sediaan ini saat pasien akan tidur (Sharma, et al., 2011).
2.5 Polietilen Glikol (PEG)
Polietilen glikol adalah polimer sintetik yang dapat dirumuskan oleh formula HOCH2(CH2OCH2)nCH2OH. Nilai n dapat berkisar dari 1 sampai nilai
150-10.000. Senyawa yang memiliki berat molekul dari 150-700 berbentuk cairan dan senyawa yang berat molekulnya 1.000-10.000 berbentuk padatan. Senyawa glikol dengan berat molekul yang rendah biasanya digunakan untuk larutan kental dimana campuran biasanya dimanfaatkan sebagai basis salep larut air (Grosser, et al., 2011).
Nama lain basis ini adalah carbowax, carbowax Sentry, Lipoxol, Lutrol E, dan Phenol E. Polietilen glikol merupakan polimer dari etilen oksida dan air. Pemberian nomor menunjukkan berat molekul rata-rata dari masing-masing polimer. Polietilen glikol yang memiliki berat rata-rata 200, 400, dan 600 berupa cairan bening yang tidak berwarna dan polietilen glikol yang memiliki berat molekul rata-rata lebih dari 1000 berupa lilin putih, padat, dan kepadatannya bertambah dengan bertambahnya berat molekul (Rowe, et al., 2003).
Polietilen glikol 6000 adalah polietilen glikol H(O-CH2-CH2)n OH dimana
harga n antara 158 dan 204. Pemerian: serbuk licin putih atau potongan putih gading, praktis tidak berbau dan berasa. Kelarutan: mudah larut dalam air, dalam etanol (95%) P, dalam kloroform P, dan praktis tidak larut dalalm eter P. Bobot molekul rata-rata: 7300-9300. Kandungan lembab: sangat higroskopis walaupun higroskopis turun dengan meningkatnya bobot molekul, titik leleh 55-63ºC (Ditjen POM, 2014).
Polietilen glikol 4.000, 6.000 dan 8.000 berbentuk serbuk putih dengan tekstur seperti lilin dan berwarna seperti parafin. Kelarutannya sangat larut dalam air, dalam diklorometan, dan sedikit larut dalam alkohol (Sweetman, 2009).
Polietilen glikol dapat menunjukkan aktivitas oksidasi jika terjadi inkompatibilitas. Aktivitas antibakteri dari bakterisin atau benzilpenisilin dapat dikurangi jika diformulasi dengan salep yang mengandung basis PEG ini. (Sweetman, 2009).
Penggunaan polietilen glikol dan polimer hidrofilik lain dengan konsentrasi tinggi dalam suatu formulasi dapat mempengaruhi sifat obat bahkan ketika obat dicampurkan dengan polimer. Mekanisme polimer hidrofilik dapat meningkatkan kelarutan obat atau meningkatkan tingkat kebasahan yang mengelilingi obat (Attwood dan Florence, 2008).
2.6 Kapsul
Kebanyakan kapsul-kapsul yang diedarkan di pasaran adalah kapsul yang semuanya dapat ditelan oleh pasien untuk memperoleh keuntungan dalam pengobatan. Kapsul gelatin keras merupakan kapsul yang digunakan oleh ahli farmasi dalam menggabungkan obat-obat dan pada umumnya kapsul jenis ini sering diproduksi oleh para pembuat sediaan farmasi (Ansel, 2005).
Kulit kapsul dibuat dari gelatin pelentur dan air. Kulit kapsul dapat juga mengandung bahan-bahan tambahan seperti pengawet, bahan pewarna, bahan pengeruh, pemberi rasa, gula, asam, dan bahan obat untuk mendapat efek yang diinginkan. Plasticizier (pelentur) yang digunakan dengan gelatin pada pembuatan kapsul lunak relatif sedikit. Bahan yang paling banyak adalah Gliserin USP, Sorbitol USP, Pharmaceutical Grade Sorbitol Special, dan kombinasi-kombinasinya. Perbandingan berat plastisator kering terhadap gelatin kering menetukan kekerasan cangkang gelatin dengan anggapan tidak ada pengaruh dari bahan yang dikapsulkan (Lachman, dkk., 2008). Gelatin bersifat stabil diudara bila dalam keadaan kering akan tetapi mudah mengalami peruraian oleh mikroba bila menjadi lembap atau disimpan dalam larutan berair. Biasanya cangkang kaspul gelatin mengandung uap air antara 9-12%. Apabila disimpan pada lingkungan dengan kelembapan yang tinggi, penambahan uap air akan diabsorbsi oleh kapsul dan kapsul keras ini akan rusak dari bentuk kekerasannya. Sebaliknya pada lingkungan udara yang sangat kering, sebagian uap air yang terdapat pada kapsul gelatin mungkin akan hilang, dan kapsul ini menjadi rapuh serta mungkin akan remuk bila dipegang (Ansel, 2005).
menutupi bila dipertemukan dimana bagian tutup akan menyelubungi bagian tubuh secara tepat dan ketat (Ansel, 2005).
Kapsul tidak berasa, mudah pemberiannya, dan mudah pengisiannya tanpa persiapan atau dalam jumlah yang besar secara komersil. Pada praktek peresepan, penggunaan kapsul gelatin keras diperbolehkan sebagai pilihan dalam meresepkan obat tunggal atau kombinasi obat pada perhitungan dosis yang dianggap baik untuk pasien secara individual. Fleksibilitasnya lebih menguntungkan daripada tablet. Beberapa pasien menyatakan lebih mudah menelan kapsul daripada tablet. Oleh karena itu, bentuk sediaan kapsul lebih disukai. Pilihan ini telah mendorong pabrik farmasi untuk memproduksi sediaan kapsul dan di pasarkan, walaupun produknya sudah ada dalam bentuk sediaan tablet (Gennaro, 2000).
2.7 Natrium Alginat
Alginat sangat berlimpah di alam indonesia karena alginat sebagai komponen struktural yang terdapat pada alga coklat (Phaeophyceae) yang komponennya mencapai 40% bahan keringnya (Draget, et al., 2005)
Umumunya, alginat komersil diproduksi dari Laminaria hyperborean, Macrocystis pyrifera, Laminaria digitata, Ascophyllum nodosum, Laminaria
japonica, Edonia maxima, Lessonia nigrescens, Durvillea Antarctica, dan
Sargassum sp (Draget, et al., 2005). Alginat merupakan bahan yang non toksik,
non alergi, biodegradabel, dan biokompatibel (Rehm, 2009).
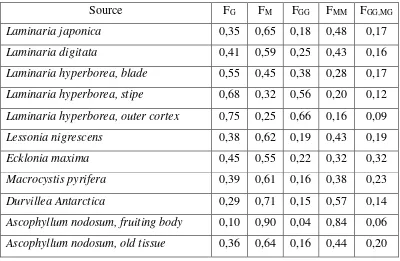
Tabel 2.4 Perbandingan asam uronat dalam berbagai spesies alga (Draget, et al., 2005).
Source FG FM FGG FMM FGG,MG
Laminaria japonica 0,35 0,65 0,18 0,48 0,17
Laminaria digitata 0,41 0,59 0,25 0,43 0,16
Laminaria hyperborea, blade 0,55 0,45 0,38 0,28 0,17 Laminaria hyperborea, stipe 0,68 0,32 0,56 0,20 0,12 Laminaria hyperborea, outer cortex 0,75 0,25 0,66 0,16 0,09
Lessonia nigrescens 0,38 0,62 0,19 0,43 0,19
Ecklonia maxima 0,45 0,55 0,22 0,32 0,32
Macrocystis pyrifera 0,39 0,61 0,16 0,38 0,23 Durvillea Antarctica 0,29 0,71 0,15 0,57 0,14 Ascophyllum nodosum, fruiting body 0,10 0,90 0,04 0,84 0,06 Ascophyllum nodosum, old tissue 0,36 0,64 0,16 0,44 0,20
Asam alginat merupakan kopolimer biner yang terdiri dari residu β -D-mannuronat (M) dan α-L-asam guluronat (G) yang tersusun dalam blok-blok yang
membentuk rantai linier (Grasdalen, et. al., 1979). Kedua unit itu berikatan pada atom C1 dan C4 dengan susunan homopolimer dari masing-masing residu (MM dan GG) dan suatu blok heteropolimer dari dua residu (MG) (Thom, et al., 1982). Struktur alginat dapat dilihat pada Gambar 2.7.
Gambar 2.7 Struktur kimia alginat (Thom, et al., 1982).
Natrium alginat lambat larut dalam air dan membentuk larutan kental, tidak larut dalam etanol, dan eter. Alginat ini diperoleh dari spesies Macrocystis pyrifera, Laminaria, Aschophyllum, dan Sargassum (Belitz, et. al., 2009).
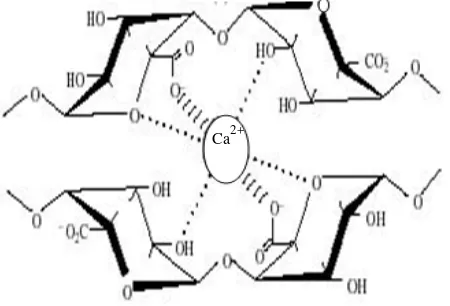
Asam alginat tidak larut dalam air. Oleh karena itu, umumnya yang digunakan di industri adalah dalam bentuk garam natrium dan garam kalium. Salah satu sifat natrium alginat mempunyai kemampuan membentuk gel dengan penambahan larutan garam-garam kalsium seperti kalsium glukonat, kalsium tartrat, dan kalsium sitrat. Pembentukan gel dengan ion kalsium disebabkan oleh adanya ikatan silang membentuk khelat antara ion kalsium dan anion karboksilat pada blok G-G melalui mekanisme antar rantai. Natrium alginat mempunyai rantai poliguluronat menunjukkan sifat pengikatan ion kalsium yang lebih besar (Morris, et al., 1980).
Pembentukan gel dan taut silang dari polimer-polimer adalah terutama dicapai melalui pertukaran ion natrium dari asam guluronat dengan ion kalsium dan membentuk struktur seperti yang ditunjukkan pada Gambar 2.8.
Gambar 2.8 Bentuk konformasi “kotak telur” kalsium alginat
Pengikatan kation dan sifat-sifat pembentukan gel tergantung kepada komposisi dan urutannya. Afinitas terhadap kalsium meningkat dengan
peningkatan jumlah residu α-L asam guluronat pada alginat. Sifat-sifat fisik gel tergantung kepada rasio asam uronat dalam rantai polisakarida. Alginat yang kaya α-L guluronat membentuk gel yang kaku tapi rapuh, sedangkan alginat yang kaya β-D asam mannuronat lebih lemah tetapi lebih fleksibel (Morris, et al,. 1978;
Sachan, et al., 2009).
Kelarutan alginat dalam air ditentukan dan dibatasi oleh tiga parameter berikut, antara lain:
(i) pH pelarut merupakan parameter penting karena akan menentukan adanya muatan elektrostatik pada residu asam uronat.
(ii) Kekuatan ionik total zat terlarut juga berperan penting (terutama efek salting-out kation-kation non-gelling), dan
(iii) Kandungan dari ion-ion pembentuk gel dalam pelarut membatasi kelarutan (Draget, et al., 2005).
Kegunaan alginat dan kemampuannya mengikat air bergantung pada jumlah ion karboksilat, berat molekul, dan pH. Kemampuan mengikat air meningkat bila jumlah ion karboksilat semakin banyak dan jumlah residu kalsium alginat kurang dari 500, sedangkan pada pH dibawah 3 terjadi pengendapan. Secara umum, alginat dapat mengabsorpsi air dan dapat digunakan sebagai pengemulsi dengan viskositas yang rendah (Zhanjiang, 1990).
disimpan dingin dan dilindungi dari cahaya dalam wadah tertutup baik (Voight, 1994). Natrium alginat yang umum digunakan antara 2,5% sampai 10% (Siregar dan Wikarsa, 2010).
Di laboratorium Farmasi Fisik Fakultas Farmasi USU pada beberapa tahun terakhir telah dikembangkan kapsul yang tahan terhadap asam lambung. Cangkang kapsul dibuat dengan bahan dasar berupa natrium alginat dengan kalsium klorida menggunakan cetakan. Telah terbukti bahwa cangkang kapsul alginat tahan atau tidak pecah dalam cairan lambung buatan (pH 1,2). Utuhnya cangkang kapsul alginat didalam medium lambung buatan pH 1,2 disebabkan komponen penyusun cangkang kapsul alginat yaitu kalsium guluronat masih utuh (Bangun, dkk., 2005).
2.8 Disolusi
Pelepasan obat adalah suatu proses dimana obat meninggalkan produk obat dan melibatkan proses absorpsi, distribusi, metabolisme, dan ekskresi (ADME), dan akhirnya menimbukan aksi farmakologis (Singhvi dan Singh, 2011). Pelepasan obat dari bentuk sediaan dan absorbsi dalam tubuh dikontrol oleh sifat fisika kimia obat dan bentuk yang diberikan, serta sifat-sifat fisika kimia dan fisiologis dari sistem biologis. Konsentrasi obat, kelarutan dalam air, ukuran molekul, bentuk kristal, ikatan protein, dan pKa adalah faktor-faktor fisikokimia yang harus dipahami untuk mendesain sediaan pelepasan terkontrol (controlled release) atau terkendali (sustained release). Lepasnya suatu obat dari bentuk
Disolusi secara farmasetikal dapat didefinisikan sebagai laju perpindahan massa dari permukaan padat ke dalam medium disolusi atau pelarut dalam kondisi standar antarmuka cairan/padat, suhu, dan komposisi pelarut. Langkah dasar dalam disolusi obat adalah reaksi antara obat padat dengan cairan dan/atau komponen medium disolusi. Reaksi ini berlangsung pada antarmuka padat-cair dan karena kinetika disolusi tergantung pada tiga faktor, yaitu laju aliran medium disolusi terhadap antarmuka padat-cair, laju reaksi pada antarmuka, dan difusi molekul dari molekul obat terlarut dari antarmuka terhadap medium pelarut (Singhvi dan Singh, 2011).
Gambar 2.9 Langkah dasar mekanisme disolusi obat (Singhvi dan Singh, 2011): (1). Molekul pelarut dan/atau komponen dari disolusi medium
bergerak menuju antarmuka
(2). Adsorpsi (reaksi berlangsung pada antarmuka cairan-padatan) (3). Molekul obat terlarut bergerak menuju medium pelarut
Laju disolusi adalah jumlah zat aktif yang larut per satuan waktu di bawah kondisi yang dibakukan dari antarpermukaan cairan/padat, suhu, dan komposisi pelarut. Disolusi dapat dianggap sebagai suatu tipe spesifik reaksi heterogen tertentu ketika hasil pemindahan massa sebagai suatu pengaruh jaringan bersih antara molekul terlarut yang lepas dan yang mengendap pada permukaan padat (Siregar dan Wikarsa, 2010).
Sejumlah metode untuk menguji disolusi secara in vitro telah dilakukan. Bila suatu sediaan obat dimasukkan kedalam gelas beaker yang berisi air atau dimasukkan kedalam saluran cerna, obat mulai masuk kedalam larutan dari bentuk padatnya. Desintegrasi, deagregasi, dan disolusi bisa berlangsung secara bersamaan dengan melepasnya suatu obat dari bentuk obat yang diberikan.
Faktor-faktor yang mempengaruhi disolusi dibagi atas 3 kategori, yaitu: a. Faktor-faktor yang berhubungan dengan sifat fisikokimia obat, meliputi:
i. Efek kelarutan obat. Kelarutan obat dalam air merupakan faktor utama dalam menentukan laju disolusi. Kelarutan yang besar menghasilkan laju disolusi yang cepat.
ii. Efek ukuran partikel. Ukuran partikel yang kecil dapat memperbesar luas permukaan obat yang berhubungan dengan medium sehingga laju disolusi akan meningkat.
b. Faktor-faktor yang berhubungan dengan sediaan obat, meliputi:
bahan obat yang hidrofob, oleh karena itu disolusi bertambah dan bahan tambahan yang bersifat hidrofob dapat mengurangi laju disolusi.
ii. Efek faktor pembuatan sediaan. Metode granulasi dapat mempercepat laju disolusi obat-obat yang kurang larut. Penggunaan bahan pengisi yang bersifat hidrofil seperti laktosa dapat menambah hidrofilisitas bahan aktif dan dapat menambah laju disolusi.
c. Faktor-faktor yang berhubungan dengan uji disolusi, meliputi:
i. Tegangan permukaan medium disolusi. Tegangan permukaan mempunyai pengaruh nyata terhadap laju disolusi bahan obat. Surfaktan dapat menurunkan sudut kontak, oleh karena itu dapat meningkatkan proses penetrasi medium disolusi ke matriks. Formulasi tablet dan kapsul konvensional juga menunjukkan penambahan laju disolusi obat-obat yang sukar larut dengan penambahan surfaktan kedalam medium disolusi. ii. Viskositas medium. Semakin tinggi viskostas medium maka semakin kecil
laju disolusi bahan obat.
iii. pH medium disolusi. Larutan asam cenderung memecah tablet sedikit lebih cepat dibandingkan dengan air, oleh karena itu akan mempercepat laju disolusi (Gennaro, 2000).
Farmakope Indonesia edisi V memberi beberapa metode resmi untuk melaksanakan uji pelepasan obat yaitu:
a. Metode Keranjang
konstan 37oC. Kecepatan berputar dan posisi keranjang harus memenuhi rangkaian syarat khusus dalam Farmakope Indonesia yang terakhir beredar. Tersedia standar kalibrasi pelarutan untuk meyakinkan bahwa syarat secara mekanik dan syarat operasi telah dipenuhi.
b. Metode Dayung
Metode dayung terdiri dari suatu dayung yang dilapisi bahan khusus yang berfungsi memperkecil turbulensi yang disebabkan oleh pengadukan. Dayung diikat secara vertikal ke suatu motor yang berputar dengan suatu kecepatan yang terkendali. Tablet atau kapsul diletakkan dalam labu pelarutan yang beralas bulat yang juga berfungsi untuk memperkecil turbulensi dari media pelarutan. Alat ditempatkan dalam suatu bak air yang bersuhu konstan, seperti pada metode basket dipertahankan pada suhu 37oC. Posisi dan kesejajaran dayung ditetapkan pada prosedur yang terdapat pada Farmakope Indonesia. Metode dayung sangat peka terhadap kemiringan dayung.
Pada beberapa produk obat, kesejajaran dayung yang tidak tepat dapat mempengaruhi hasil pelepasan obat. Standar kalibrasi pelarutan yang sama digunakan untuk memeriksa peralatan sebelum uji dilaksanakan.
c. Metode Sel yang dapat dialiri
2.9 Bakteri
Bakteri adalah sel prokariotik yang khas, uniseluler, dan tidak mengandung struktur yang dibatasi membran dalam sitoplasmanya. Reproduksi terutama secara aseksual, yaitu pembelahan secara biner sederhana. Beberapa dapat tumbuh pada suhu 0°C dan ada yang tumbuh dengan baik pada sumber air panas yang suhunya 90°C atau lebih (Pelczar dan Chan, 1986).
2.9.1 Klasifikasi bakteri
Berdasarkan bentuk morfologinya, bakteri dapat dibagi atas tiga golongan (Dwidjoseputro, 1990) yaitu:
a. Golongan basil
Berbentuk seperti tongkat pendek, silindris dan dapat dibedakan atas: - Streptobasil, yaitu basil yang bergandeng-gandeng panjang. - Diplobasil, yaitu basil yang bergandengan dua-dua.
b. Golongan kokus
Bakteri yang bentuknya serupa bola-bola kecil. Bentuk kokus ini dapat dibedakan atas:
- Streptokokus, yaitu kokus yang bergandengan panjang serupa rantai. - Diplokokus, yaitu kokus yang bergandengan dua-dua.
- Stafilokokus, yaitu kokus yang mengelompok berupa suatu untaian. - Sarsina, yaitu kokus yang mengelompok serupa kubus.
c. Golongan spiral
2.9.2 Pengaruh lingkungan terhadap pertumbuhan bakteri
Kondisi lingkungan yang mendukung dapat memacu pertumbuhan dan reproduksi bakteri. Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan dan reproduksi bakteri (Tamher, 2008), antara lain:
a. Suhu
Bakteri memerlukan suhu tertentu untuk pertumbuhannya, sama halnya dengan makhluk hidup tingkat tinggi. Berdasarkan suhu yang diperlukan untuk tumbuh, bakteri dapat dibagi menjadi:
- Bakteri psikrofil, yaitu bakteri yang tumbuh pada tumbuh pada suhu antara 0-20°C, dengan suhu optimal 25°C.
- Bakteri mesofil, yaitu bakteri yang tumbuh pada suhu antara 20-40°C, dengan suhu optimal 37°C.
- Bakteri termofil, yaitu bakteri yang tumbuh antara suhu 50-60°C b. pH
Bakteri juga memerlukan pH tertentu untuk pertumbuhannya. Umumnya bakteri memiliki jarak pH yang sempit, yaitu sekitar 6,5-7,5 atau pada pH netral yang biasanya disebut sebagai bakteri neutrofil. Beberapa bakteri yang dapat hidup pada pH 4 disebut dengan bakteri asidofil dan bakteri yang hidup pada pH 10 disebut dengan bakteri alkalofil.
c. Kelembaban
d. Cahaya
Cahaya sangat berpengaruh pada proses pertumbuhan bakteri. Umumnya cahaya merusak sel mikroorganisme yang tidak berklorofil. Sinar ultraviolet dapat menyebabkan terjadinya ionisasi komponen sel yang berakibat menghambat pertumbuhan atau menyebabkan kematian. Pengaruh cahaya terhadap bakteri dapat digunakan sebagai dasar proses sterilisasi atau pengawetan bahan makanan.
e. Pengaruh oksigen
Mikroorganisme sering dibagi menjadi 4 kelompok berdasarkan kebutuhannya akan oksigen (Lay, 1994), yaitu:
- Aerob obligat, yaitu mikroorganisme yang memerlukan oksigen untuk hidupnya.
- Anaerob obligat, yaitu mikroorganisme yang tidak dapat hidup bila ada oksigen.
- Anaerob fakultatif, yaitu mikroorganisme yang mampu tumbuh dalam lingkungan dengan ataupun tanpa oksigen.
- Mikroaerofil, yaitu mikroorganisme yang memerlukan oksigen, namun hanya dapat tumbuh bila kadar oksigen diturunkan menjadi 15% atau kurang.
2.9.3 Bakteri uji
2.9.3.1 Bakteri Staphylococcus aureus
Sistematika dari bakteri Staphylococcus aureus (Holt, 1988), yaitu: Divisi : Schizophyta
Ordo : Eubacteriales Family : Micrococaceae Genus : Staphylococcus
Spesies : Staphylococcus aureus
Bakteri ini termasuk bakteri Gram positif, berbentuk kokus, dan bersifat anaerob falkutatif. Batas-batas suhu untuk pertumbuhannya adalah 15-40°C, sedangkan suhu pertumbuhan optimumnya adalah 35-37°C (Chatim, 1994).
Bakteri Staphylococcus aureus adalah suatu bakteri penyebab keracunan yang memproduksi enterotoksin. Bakteri ini sering ditemukan pada makanan-makanan yang mengandung protein tinggi. Bakteri Staphylococcus aureus merupakan bakteri Gram positif berbentuk kokus dengan diameter 0,7-0,9 µm. Bakteri Staphylococcus aureus tahan garam dan tumbuh dengan baik pada medium yang mengandung 7,5% NaCl, serta dapat memfermentasi manitol (Fardiaz, 1993).
Infeksi bakteri Staphylococcus aureus dapat juga berasal dari kontaminasi langsung dari luka, misalnya pasca operasi infeksi stapfilokokus atau infeksi yang menyerupai trauma (osteomielitis kronik setelah patah tulang terbuka, meningitis yang menyertai patah tulang tengkorak) (Brooks, et al., 2005).
2.9.3.2 Bakteri Escherichia coli
Sistematika dari bakteri Escherichia coli (Holt, 1988), adalah yaitu: Divisi : Schizophyta
Kelas : Schizomycetes Ordo : Eubacteriales Family : Enterobacteriaceae Genus : Escherichia Spesies : Escherichia coli
Bakteri ini termasuk bakteri Gram negatif, berbentuk batang, dan bersifat anaerob fakultatif. Batas-batas suhu untuk pertumbuhannya adalah 8-46°C, sedangkan suhu pertumbuhan optimumnya adalah 37°C. Bakteri ini akan memberikan hasil positif pada tes indol, lisin dekarboksilase, dan fermentasi manitol (Chatim, 1994; Dwidjoseputro, 1990).
Bakteri Escherichia coli merupakan flora normal di dalam intestin yang dapat menyebabkan infeksi saluran kemih yang merupakan infeksi terbanyak (80%); gastroenteritis dan meningitis pada bayi, peritonitis, infeksi luka, dan lainnya (Gibson, 1996).
2.9.4 Media pertumbuhan bakteri
Media biakan dapat dikelompokkan dalam beberapa kategori, yaitu: a. Berdasarkan asalnya, media dibagi atas (Lay, 1994):
- Media sintetik
Media yang kandungan dan isi bahan yang ditambahkan diketahui secara terperinci. Contoh:glukosa, kalium fosfat, dan magnesium fosfat.
- Media non-sintetik
Media yang kandungan dan isinya tidak diketahui secara terperinci dan menggunakan bahan yang terdapat di alam. Contohnya: ekstrak daging dan pepton.
b. Berdasarkan kegunaannya, media dibagi atas (Irianto, 2006): - Media selektif
Media biakan yang mengandung paling sedikit satu bahan yang dapat menghambat perkembang biakan mikroorganisme yang tidak diinginkan dan membolehkan perkembang biakan mikroorganisme tertentu yang ingin diisolasi.
- Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari berbagai jenis dalam suatu lempengan agar-agar.
- Media diperkaya
c. Berdasarkan konsistensinya, media dibagi atas (Irianto, 2006): - Media padat/solid
- Media semi solid - Media cair
2.9.5 Uji sensitivitas bakteri terhadap antibiotik
Uji sensitivitas bakteri terhadap antibiotik bertujuan untuk mengetahui apakah antibiotik yang digunakan masih dapat mengatasi infeksi yang disebabkan oleh bakteri. Uji sensitivitas bakteri terhadap antibiotik pada dasarnya dapat dilakukan dengan beberapa cara, antara lain:
a. Metode Dilusi
b. Metode Difusi
Pada metode difusi, obat dijenuhkan ke dalam cakram kertas. Cakram kertas diletakkan di atas permukaan media padat yang telah dicampur dengan mikroba, diinkubasi pada suhu 37°C selama 18-24 jam. Zona hambat disekitar cakram kertas yang menunjukkan daya hambat antibiotik terhadap pertumbuhan mikroba. Metode difusi terdiri dari beberapa cara, yaitu: cara silinder plat dan cara cakram yang berisi larutan antibiotik yang diletakkan pada media agar yang telah ditanami mikroorganisme. Sensitivitas bakteri terhadap antibiotik dapat dievaluasi menggunakan metode Kirby-Bauer dan Joan-Stokes (Dzen, dkk., 2003).
- Metode Kirby-Bauer, yaitu sensitivitas bakteri ditentukan dengan membandingkan diameter zona hambat disekitar cakram dengan tabel standar yang dibuat oleh masing-masing negara (Dzen, dkk., 2003).
- Metode Joan-Stokes, yaitu sensitivitas bakteri dilakukan dengan membandingkan radius zona hambatan yang terjadi antara bakteri kontrol yang sudah diketahui kepekaannya terhadap obat dengan isolat bakteri yang diuji (Dzen, dkk., 2003).
c. Metode E-test
d. Metode Cup-plate
Metode Cup-plate pada prinsipnya juga menggunakan metode difusi yang dilakukan dengan membuat sumur sedemikian rupa pada media agar yang telah ditanami bakteri. Antibiotik dengan berbagai konsentrasi dimasukkan ke dalam sumur dan diinkubasi pada suhu 37°C selama 18-24 jam, selanjutnya diamati diameter zona hambat disekitar sumur (Pratiwi, 2008).
2.9.6 Metode isolasi biakan bakeri
Metode isolasi biakan bakteri dibagi atas 3 cara (Stanier, dkk., 1982), yaitu:
- Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang diencerkan, kemudian dibuat serangkaian goresan sejajar yang tidak saling menutupi di atas permukaan agar-agar yang telah padat
- Cara sebar
Suspensi mikroorganisme yang telah diencerkan diinokulasikan secara merata dengan menggunakan batang pengaduk pada permukaan media padat. Setelah diinkubasi, koloni akan berkembang pada media padat.
- Cara tuang
Pengenceran inokulum yang berturut-turut diletakkan pada cawan petri steril dan dicampurkan dengan medium agar-agar cair, kemudian dibiarkan memadat. Setelah diinkubasi, koloni yang berkembang akan tertanam di dalam media.
2.9.7 Fase pertumbuhan bakteri
a. Fase Penyesuaian diri (Lag phase)
Pada saat dipindahkan ke media, bakteri tidak langsung tumbuh dan membelah, meskipun kondisi media sangat mendukung untuk pertumbuhan. Bakteri akan mengalami masa penyesuaian untuk menyeimbangkan pertumbuhan.
b. Fase pembelahan (logarhytmik phase)
Selama fase ini, populasi meningkat dua kali pada interval waktu yang teratur. Jumlah koloni bakteri akan terus bertambah seiring lajunya aktivitas metabolisme sel.
c. Fase stasioner/tetap (stasionary phase)
Pada fase ini terjadi kompetisi antara bakteri untuk memperoleh nutrisi dari media untuk tetap hidup. Sebagian bakteri mati sedangkan yang lain tumbuh dan membelah sehingga jumlah sel bakteri yang hidup menjadi tetap.
d. Fase kematian (Death phase)
Jumlah bakteri hidup berkurang dan menurun dari beberapa jenis bakteri timbul bentuk-bentuk abnormal.