GEOKIMIA PANAS BUMI
Niniek Rina Herdianita KK Geologi Terapan Program Studi Sarjana dan Magister Teknik Geologi Program Studi Magister Teknik Panas Bumi Institut Teknologi Bandung
Geokimia Panas Bumi
1. Pendahuluan
2. Geokimia Air Panas Bumi 3. Geokimia Gas Panas Bumi
Pendahuluan
Geokimia Panas Bumi/Geotermal mempelajari komposisi fluida panas bumi (air dan uap) dan proses-proses yang mempengaruhinya untuk mengetahui kondisi dan
Asumsi
Sistem geotermal adalah sistem hidrotermal terbuka
dan air yang didominasi oleh air meteorik merupakan media pembawa panas.
Karakteristik Air (H
2O)
Systematic name water
Alternative names aqua, dihydrogen monoxide, hydrogen hydroxide Molecular formula H2O
Molar mass 18.0153 g/mol
Density and phase 1.000 g/cm0.917 g/cm33, liquid , solid Melting point 0°C (273.15 K) (32ºF)
Boiling point 100°C (373.15 K) (212ºF)
pH H
2O vs Temperatur
pH adalah fungsi dari Konstanta Disosiasi Air (KwH2O)
H2O H+ + OH-
KwH2O = [H+][OH-]
-log KwH2O = -log [H+] + [– log [OH-]] pKw
H2O = pH + pOH
Kw adalah fungsi dari temperatur:
KwH2O (25oC) = 10-14 pKw H2O = 14 KwH2O (100oC) = 10-12 pKw H2O = 12 KwH2O (250oC) = 10-11 pKw H2O = 11
0 10 25 50 75 100 125 150 175 200 225 250 275 300 H2O 14.94 14.54 13.99 13.27 12.71 12.26 11.91 11.64 11.44 11.30 11.22 11.20 11.22 11.30 H2CO3 6.57 6.47 6.36 6.29 6.32 6.42 6.57 6.77 6.99 7.23 7.49 7.75 8.02 8.29 H2S 7.45 7.23 6.98 6.72 6.61 6.61 6.68 6.81 6.98 7.17 7.38 7.60 7.82 8.05 NH4 10.08 9.74 9.24 8.54 7.94 7.41 6.94 6.51 6.13 5.78 5.45 5.15 4.87 4.61 H4SiO4 10.28 10.00 9.82 9.50 9.27 9.10 8.97 8.67 8.65 8.85 8.89 8.96 9.07 9.22 H3BO3 9.50 9.39 9.23 9.08 9.00 8.95 8.93 6.94 8.98 9.03 9.11 9.22 9.35 9.51 HF 2.96 3.05 3.18 3.40 3.64 3.85 4.09 4.34 4.59 4.89 5.30 5.72 6.20 6.80 HSO4 -1.70 1.81 1.99 2.30 2.64 2.99 3.35 3.73 4.11 4.51 4.90 5.31 5.72 6.13 HCl -0.26 -0.24 -0.20 -0.14 -0.06 0.03 0.14 0.25 0.37 0.50 0.66 0.84 1.06 1.37 HCO3- 10.63 10.49 10.33 10.17 10.13 10.16 10.25 10.39 10.57 10.78 11.02 11.29 11.58 11.89 Expressed as -log Ka = pKa Temperature (oC)
Boiling point Vaporization Condensation (solid) (liquid) (gas)
Boiling = Mendidih
Terjadi di bagian atas, yaitu pada kedalaman < 2 km Terjadi pemisahan 2 fasa fluida, yaitu air dan uap
Unsur non-volatil (Cl, SiO2) tinggal di air
Unsur volatil/gas (CO2, H2) berada pada fasa uap
Pemisahan 2 fasa fluida mengakibatkan terbentuknya:
Entalpi liquid (Hliq) Entalpi uap (Hvap)
Manifestasi panas bumi di permukaan memberikan
Boiling Point Depth (BPD)
Tekanan vs titik didih (boiling point) air
Tekanan air (P) sebagai fungsi dari kedalaman (h):
PHidrostatik = 0,1897 h0,8719
PHidrodinamik = 0,2087 h0,8719 = 1.1 P
290oC
Geokimia Panas Bumi
1. Pendahuluan
2. Geokimia Air Panas Bumi 3. Geokimia Gas anas Bumi
Unsur-unsur Kimia Fluida
Terdiri dari unsur-unsur terlarut berupa:
Anion: Cl-, HCO
3-, SO4-2, NH4-, F-, I-, Br-
Kation: Na+, K+, Ca+2, Mg+2, Rb+, Cs+, Li+, Mn+2, Fe+2, Al+3,
ion-ion As
Spesies netral: SiO2, B, CO2, H2S, NH3
SiO2 hadir sebagai silika total dan ekuivalen dengan konsentrasi
H4SiO4
CO2 terlarut adalah ekuivalen terhadap konsentrasi H2CO3
Karbonat total adalah jumlah dari semua spesies karbonat
(CO2 = H2CO3 + HCO3- + CO 3-2)
B adalah boron total (B = H3BO3 + H2BO3- + HBO
3-2 + B+)
As adalah arsenik total yang hadir dalam berbagai muatan ion Amonia adalah sebagai amonia (NH3) atau amonium (NH4-)
Unsur-unsur Kimia Fluida
Berasal dari interaksi antara batuan dan fluida (+ proses magmatik), terdiri dari:
Unsur-unsur pembentuk batuan
Solubilitasnya dipengaruhi oleh kesetimbangan antara
mineral dan air
mis. kation Na, K, Ca, Mg, Rb, Cs, Mn, Fe dan Al
Unsur-unsur terlarut
Lebih banyak berada di larutan dibanding dalam mineral Tidak mudah bereaksi = unsur konservatif
Unsur-unsur Kimia Fluida
Dipengaruhi oleh:
Asal air
Penambahan unsur volatil magmatik
Cl sebagai HCl, C sebagai CO2, S sebagai SO2 Kenampakan isotop Helium (3He/4He)
Kesetimbangan fluida-mineral
Mineral (jenis batuan) Suhu
Dominasi batuan
Proses
Boiling
Air Klorida (Cl)
Menunjukkan air reservoir
Mengandung 0,1 hingga 1,0 wt.% Cl Perbandingan Cl/SO4 umumnya tinggi
Mengandung kation utama : Na, K, Ca dan Mg Berasosiasi dengan gas CO2 dan H2S
pH sekitar netral, dapat sedikit asam dan basa tergantung CO2
terlarut
Sangat jernih, warna biru pada mataair natural Kaya SiO2 dan sering terdapat HCO3-
Air Sulfat (SO
4)
Terbentuk di bagian paling dangkal sistem geotermal
Akibat kondensasi uap air ke dalam air permukaan (steam heated
water)
SO4 tinggi (mencapai 1000 ppm) akibat oksidasi H2S di zona
oksidasi dan menghasilkan H2SO4 (H2S + O2 = H2SO4)
Mengandung beberapa ppm Cl Bersifat asam
Ditunjukkan dengan kenampakan kolam lumpur dan pelarutan
batuan sekitar
Tidak dapat digunakan sebagai geotermometer
Di lingkungan gunung api : air asam SO4-Cl terbentuk akibat
Air Cl dan SO
4Ta: Taal
Ku: Kusatsu Shirane Kb: Kaba
Tin, Tam: Kelimutu Ij: Ijen
Po: Poas
Ma: Maly Semiachik Pu: Kawah Putih Dem: Dempo
Sv: Soufrière St.Vincent Qu: Quilotoa
Kel: Kelud
Sa: Segara Anak
Ny, Mo: Nyos, Monoun
The discharge of magmatic gases (SO2 , H2S, HCl and HF) into a crater lake frequently lead to highly acidic
Air Bikarbonat (HCO
3)
Terbentuk pada daerah pinggir dan dangkal sistem geotermal
Akibat adsorbsi gas CO2 dan kondensasi uap air ke dalam air tanah
(steam heated water)
Anion utama HCO3 dan kation utama adalah Na Rendah Cl dan SO4 bervariasi
Di bawah muka air tanah bersifat asam lemah, tetapi dapat
bersifat basa oleh hilangnya CO2 terlarut di permukaan
Air Meteorik
Air tanah mengandung Ca, Mg, Na, K, SO4, HCO3 dan Cl, dan dapat
mengandung Fe, SiO2 dan Al
Air tanah dapat mengandung gas terlarut O2 dan N2
Air sungai mempunyai anion utama HCO3 dan kation utama adalah
Ca
Air hujan mempunyai anion utama Cl dan kation utama Na
Kandungan kimia air tanah sangat dipengaruhi oleh batuan
dasarnya.
Air Asin
Terbentuk dengan berbagai cara (mis. pelarutan sekuen endapan
evaporit, terperangkap pada cekungan sedimentasi/air formasi, dll)
Merupakan larutan yang berkonsentrasi tinggi pH menunjukkan asam lemah
Unsur utama adalah Cl (10.000 hingga lebih dari 100.000 ppm) Konsentrasi Na (kation utama), K dan Ca tinggi
Na K Mg Ca Cl SO4 HCO3
1 Ngawha NG-9, NZ 230 7.7 893 79 0 3 1,260 18 185
2 Wairakei WK-66, NZ 240 8.5 995 142 0 17 1,675 30 <5 3 Champagne Pool, NZ 99 8.0 1,070 102 0 26 1,770 26 76 4 Miravalles 10, Costa Rica 250 7.8 1,750 216 0 59 2,910 40 27 5 Acque Albule, Italy 22 6.1 138 22 238 1,042 163 1,470 1,403 6 Well C32, Fuzhou, China 93 7.5 187 6 0 23 175 163 52 7 Spring 7, Manikaran, India 95 8.4 96 19 3 52 138 41 210
8 Golden Spring, NZ 45 7.0 224 20 7 11 51 8 670
9 Zunil spring 95 7.0 384 32 39 17 172 234 635
10 Zunil ZQ-3, Guatemala 295 8.1 933 231 0 15 1,810 31 51
Na K Mg Ca Cl SO4 HCO3
11 Radkersburg, Austria 72 8.9 2,215 182 47 3 264 398 4,130 12 Cerro Prieto, Mexico 280 7.3 5,600 1,260 0 333 10,500 14 40 13 Tongonan, Philippines 330 7.0 3,580 1,090 0 128 6,780 16 12 14 Morere spring, NZ 47 7.0 6,690 84 79 2,750 15,670 <3 28 15 Salton Sea well, USA 330 5.2 38,400 13,400 10 22,010 118,400 4 140 16 Reykjanes Spring, Iceland 99 6.2 14,325 1,670 123 2,260 26,100 206 <5 17 Oil well, Leda F., California 100 5.7 13,600 404 275 12,200 44,000 16 80 18 White Island, NZ 98 0.6 5,910 635 3,800 3,150 38,700 4,870 -19 Kawah Ijen, Indonesia 60 0.6 1,030 1,020 680 770 21,800 62,400
-20 Tamagawa, Japan 98 1.3 38 30 35 95 2,970 2,300
Kisaran pH Anion Utama
Air tanah 6 - 7.5 jejak HCO3
-Air klorida (Cl) 4 - 9 Cl, jejak HCO3
-Air klorida-bikarbonat (Cl-HCO3) 7 - 8.5 Cl, HCO3
-Air bikarbonat (HCO3) 5 - 7 HCO3
-Air asam sulfat (SO4) 1 - 3 SO42-, jejak Cl
Tipe air apakah yang hadir
pada manifestasi ini?
Yellowstone National Park, USA Pohutu Geyser, Rotorua
Waimangu, New Zealand
Cl water
Geokimia Panas Bumi
1. Pendahuluan
2. Geokimia Air Panas Bumi 3. Geokimia Gas Panas Bumi
Gas-gas Panas Bumi
Gas dalam sistem panas bumi hadir sebagai:
Uap (H2O)
Non condensible gases (gas-gas yang tidak mudah
terkondensasi) atau gas reaktif: CO2, H2S, NH3, H2, N2, CH4)
kondisi bawah permukaan
Gas-gas inert atau konservatif: gas-gas mulia, hidrokarbon selain
metana) sumber gas
Konsentrasi gas bersama rasio gas/uap dan uap/air
dapat memberikan informasi mengenai kondisi bawah permukaan dan perilaku reservoir.
Keluaran Gas
Fumarol Kaipohan Solfatara :
Fumarol dengan SO2 dan/atau H2S
Daerah steam discharge yang mengandung steaming ground
dan fumarol
Steaming ground Hot pools
CO
2 Gas terbanyak pada sistem panasbumi (~ 95 wt.% atau
vol.%)
Hadir 0.2 - 4% vol/vol dalam udara tanah Terbentuk dari :
Magmatik
Larut dalam air meteorik
Alterasi termal batuan/mineral karbonat
Degradasi material organik pada batuan sedimen
Mengontrol kimia air, densitas, pH, BPD, alterasi batuan,
H
2S
2 hingga 3 kali lebih mudah terlarut dibanding CO2
Merupakan gas reaktif dan akan hilang oleh interaksi
dengan batuan sekitar membentuk sulfida besi.
Terbentuk dari :
Magmatik
Alterasi termal batuan reservoir
Rasio CO2/H2S dapat menunjukkan pola aliran fluida dan
NH
3 Gas panas bumi yang paling mudah larut.
Terbentuk dari alterasi material organik pada batuan
sedimen.
Gas reaktif dan akan hilang oleh interaksi dengan batuan
sekitar, terserap dalam mineral lempung, atau larut dalam kondensasi uap.
Volatil Logam dan Non Logam
Arsen (As) Kandungannya tinggi pada sistem entalpi sangat tinggi.
Mudah hilang oleh proses kondensasi uap dan mixing dengan air
tanah.
Boron (B)
Terkonsentrasi pada fasa liquid, tetapi dapat ditranspor sebagai
uap.
Mudah larut dalam uap kondensat atau air steam heated.
Merkuri (Hg)
Kandungan Hg pada steam discharge dipengaruhi oleh
kandungan Hgvapour dan gas HgS.
Hgvapour akan berkurang dengan meningkatnya konsentrasi H2S. Asosiasi: sulfida, oksida, material organik dan unsur logam
Tritium (3H)
Komposisi Gas atau Uap
Temparatur dan tekanan reservoir Kandungan gas pada fluida reservoir Solubilitas gas pada fasa liquid
Koefisien distribusi massa gas dalam fasa uap
dan liquid (Bgas=cvapour/cliquid)
Reaksi yang terjadi saat naik ke permukaan:
Boiling
Kondensasi Oksidasi
Solubilitas Gas
Kimia Keluaran Gas Geotermal
Field/feature Separation
pressure Enthalpy Steam fraction Total gas in steam CO2 H2S CH2 H2 N2 NH3 (bg) (kJ/kg) (y) (mmol/mol steam) millimoles/mole total gas
Wells: liquid dominated systems
Wairakei, NZ Average 1 1135 0.3 0.2 917 44 9 8 15 6 Tauhara, NZ Well 1 8.8 1120 0.2 1.2 936 64 - - - - Ohaaki, NZ Well 22 10 1169 0.19 10.04 956 18.4 11.8 1.01 8.89 4.65 Ngawha, NZ Well 4 1.87 966 0.19 24.5 945 11.7 28.1 3.0 2.1 10.2 Cerro Prieto, Mexico
Well 19A 6.6 1182 0.289 5.88 822 79.1 39.8 28.6 5.1 23.1 Tongonan, Philippines
Well 103 7.6 1615 0.414 2.95 932 55 4.1 3.6 1.2 4.3 Reykjanes, Iceland
Well 9 19.0 1154 0.135 0.248 962 29 1 2 6 -
Wells: vapour dominated systems
The Geyser, USA
Average - 2793 1.0 5.9 550 48 95 150 30 125 Larderello, Italy Average - 2804 1.0 20.0 941 16 12 23 8 8 Fumarola Wairakei, NZ Karapiti - (115°C) 1.0 1.7 946 23 7.4 10 11 2.6 Larderello, Italy Average - (100°C) 1.0 30.0 923 20.6 14 26 10.7 -
Geokimia Panas Bumi
1. Pendahuluan
2. Geokimia Air Panas Bumi 3. Geokimia Gas Panas Bumi
Estimasi karakteristik reservoir
Temperatur, yaitu dengan menggunakan geotermometer. pH fluida, yaitu dengan menggunakan dasar
kesetimbangan reaksi tertentu.
Komposisi fluida, yaitu dengan mempertimbangkan
terbentuknya fraksi uap (y) dan fraksi air (x) saat boiling terjadi.
Geotermometer
Berdasarkan variasi kandungan beberapa unsur dalam
fluida panasbumi yang hadir sebagai fungsi dari temperatur
Unsur : terlarut, gas, isotop
Data : mata air panas, data pemboran/sumur Kesalahan : 5 hingga 10oC
Kelebihan entalpi dapat memberikan estimasi suhu
reservoir yang lebih tinggi
Geotermometer Unsur Terlarut
Berdasarkan reaksi kesetimbangan kimia antara fluida
dan mineral
Fluida panas bumi muncul ke permukaan dengan cepat
(> 2 kg/sec)
Tidak ada mixing dengan fluida lain. Bila terjadi, mixing
harus dapat dihitung
Tidak ada steam atau gas yang hilang
Re-ekuilibrium fluida-mineral pada kondisi dingin (di
permukaan) berlangsung lambat, sehingga dapat diabaikan
Geotermometer Unsur Terlarut
Geotermometer Silika (SiO2)
Geotermometer Kuarsa Geotermometer Kalsedon Geotermometer Kristobalit Geotermometer Opal CT
Geotermometer Silika Amorf
Geotermometer K-Na Geotermometer K-Mg
Geotermometer K-Na-Mg Geotermometer K-Na-Ca Geotermometer Na-Li
Geotermometer Silika (SiO2)
Geotermometer Kuarsa
Geotermometer K-Na
Geotermometer K-Mg
Geotermometer Silika
Fournier (1981, 1985)
Reaksi dasar : SiO2 (s) + 2 H2O ↔ H2SiO4
Berdasarkan solubilitas berbagai jenis silika yang
Geotermometer Kuarsa
Treservoir = 0 – 250°C
Geotermometer kuarsa
Adiabatik (max steam loss) : baik untuk data sumur dan
mataair dengan kondisi boiling dan kecepatan aliran tinggi (> 2 kg/sec), disertai endapan sinter silika
Konduktif (no steam loss) : baik untuk data mataair dengan
Geotermometer Kuarsa
1. Kuarsa – no steam loss 1309 t 5.19 – log SiOoC = --- – 273
2 t = 0 – 250
oC
2. Kuarsa – max steam loss 1522 t 5.75 – log SiOoC = --- – 273
2 t = 0 – 250
Geotermometer K-Na
Fournier (1979), Giggenbach (1988) K+ + Na-feldspar ↔ K-feldspar + Na+
(albit) (adularia)
Rasio Na/K berkurang dengan meningkatnya temperatur
fluida
tres > 180oC hingga 350oC
tres < 100oC, rasio Na/K tidak lagi mengontrol
kesetimbangan feldspar
Tidak dipengaruhi oleh pelarutan (dilution) dan
Geotermometer K-Mg
Giggenbach (1988)
0.8K-mika + 0.2klorit + 0.4silika + 2K+
2.8K-feldspar + 1.6H2O + Mg2+
Dapat digunakan bila Na dan Ca terlarut dalam fluida
dan dalam batuan tidak setimbang
Geotermometer K-Na-Mg
Giggenbach (1988)
K-Mg lebih cepat bereaksi, sehingga dapat digunakan
untuk menafsirkan suhu reservoar yang lebih rendah
K-Mg lebih sensitif terhadap mixing air asam Baik digunakan untuk sampel yang tidak baik
Geotermometer K-Na, K-Mg, K-Na-Mg
1. Na-K (Fournier) 1271 t log (Na/K) + 1.483 oC = --- – 273 t > 150oC
2. Na-K (Giggenbach) 1390 t log (Na/K) + 1.75 oC = --- – 273 t > 150oC
Geotermometer lain
Geotermometer Gas Geotermometer Isotop
“The choice and interpretation of geothermometer data are the art of the geochemist.”
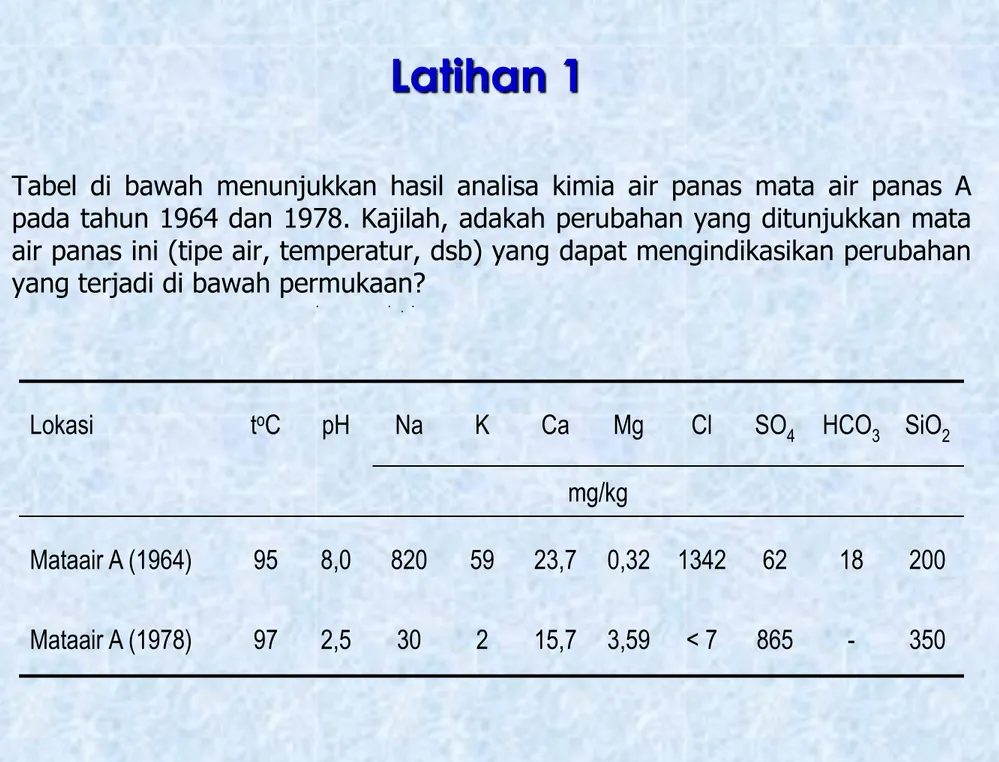
Latihan 1
Tabel di bawah menunjukkan hasil analisa kimia air panas mata air panas A pada tahun 1964 dan 1978. Kajilah, adakah perubahan yang ditunjukkan mata air panas ini (tipe air, temperatur, dsb) yang dapat mengindikasikan perubahan yang terjadi di bawah permukaan?
Lokasi toC pH Na K Ca Mg Cl SO
4 HCO3 SiO2
mg/kg
Mataair A (1964) 95 8,0 820 59 23,7 0,32 1342 62 18 200