TINJAUAN PUSTAKA
Mikroalga merupakan kelompok organisme renik yang dapat berupa sel tunggal maupun koloni yang tersebar luas di alam. Bentuk mikroalga bervariasi meliputi filamen atau berbentuk bulat atau lonjong yang sepanjang hidupnya dapat terapung bebas atau menetap di suatu tempat bahkan ada yang membentuk alat perekat terapung dalam kumpulan di permukaan perairan. Jenis mikroalga ditemukan ada lebih kurang 25.000 spesies (Bold et al. 1980; Wilson & Loomis 1962).
Bila dibandingkan dengan organisme fotosintetik lainnya, mikroalga paling efisien dalam menangkap dan memanfaatkan energi matahari dan CO2 untuk keperluan fotosintesis karena organisme ini mengandung klorofil serta pigmen-pigmen lain untuk melangsungkan fotosintesis menjadi biomassa dan akumulasi pati (Rodjaroen et al. 2007). Dengan demikian keberadaan mikroalga sangat membantu menyerap CO2 dari atmosfer, sehingga dapat mengurangi bahaya gas-gas rumah kaca yang merupakan faktor-faktor penyebab terjadinya global warming atau pemanasan global.
Habitat dan Sebaran
Mikroalga ditemukan diberbagai perairan baik air tawar maupun air laut dan dijumpai hampir di semua lingkungan yang mengandung air, CO2 dan yang terkena sinar matahari (Pelczar & Chan 1986). Pada umumnya mikroalga penyebarannya sangat luas dan kebanyakan hidup pada perairan air tawar terutama dari divisi Chrysophyta. Organisme ini dapat ditemukan pula pada perairan ekstrim yaitu daerah gersang atau tanah yang miskin hara. Bahkan terdapat jenis mikroalga yang mampu hidup di salju dan dapat tumbuh subur pada sumber air panas, dengan suhu sampai 85°C yang merupakan batas suhu tertinggi bagi kehidupan organisme dalam keadaan aktif dan mampu hidup pada pH antara 2-9 (Brown et al. 1994; Wilson & Loomis 1962).Mikroalga dapat bertahan hidup pada kondisi lingkungan yang ekstrim salah satunya disebabkan adanya musilagenous pada permukaan luar tubuhnya yang dapat melindungi organ sel yang ada dalam tubuhnya dari pengaruh temperatur dan pH yang berbeda (Wehr & Sheath 2003).
Jenis Mikroalga Sumber air Panas
Indonesia merupakan negara yang memiliki banyak lokasi sumber air panas. Mikroalga yang mampu untuk beradaptasi pada sumber air panas dengan suhu dan pH yang berbeda kemungkinan adalah jenis yang berbeda. Menurut Stevenson et al. (1996) keanekaragaman spesies mikroalga di alam bertambah pada rentangan suhu antara 0-25°C dan akan mengalami penurunan pada suhu diatas 30°C. Peningkatan suhu perairan menunjukkan adanya perubahan dominasi oleh beberapa kelas mikroalga, antara lain Bacillariophyceae pada suhu kurang dari 20°C, pada suhu 15-30°C didominasi oleh Chlorophyceae, dan pada suhu lebih dari 30°C banyak dijumpai Cyanophyceae. Namun demikian, hasil penelitian Gunawan (2010) sedikit berbeda, yaitu pada empat sumber air panas yang ada di propinsi Jawa Barat dengan rentangan suhu antara 45-53°C dan pH 2-7,6. Chlorophyta merupakan divisi yang paling banyak ditemukan di empat lokasi sumber air panas tersebut, diikuti oleh divisi Cyanophyta dan Bacillariophyta, sedangkan Chrysophyta memiliki jumlah keragaman kelas yang paling sedikit.
Pada empat lokasi sumber air panas di Jawa Barat yang diteliti oleh Gunawan (2010), yaitu Cipanas, Ciwalini, Ciater dan Gunung Pancar ditemukan Chroococcus sp. dari divisi Cyanophyta. Jenis mikroalga ini mampu bertahan hidup dalam kondisi laboratorium pada air media yang berasal dari keempat lokasi penelitian tersebut. Cyanophyta umumnya hidup pada perairan netral atau cenderung basa dan umumnya tidak ditemukan pada perairan dengan pH kurang dari 4 (Prihantini et al. 2008) dengan warna hijau kebiruan, koloni berbentuk spherical (bulat), yang didalam selnya terdapat klorofil a, karoten dan xantofil (pada umumnya tidak dalam bentuk fikoeritrin, fikosianin) dan terdapat vakuola (Prescott 1978). Pada Chroococcus sp. memiliki fikosianin yang merespon sebagian besar energi yang diserap untuk fotosintesis yang hampir mendekati efisiensi energi yang diserap oleh klorofil untuk proses fotosintesis. Dinding selnya tipis dan mempunyai membran yang bagian luarnya dilapisi musilagenous yang menghubungkan bagian dasar dari koloni. Musilagenous pada Cyanophyta mengandung arabinosa, glukosa, galaktosa dan mannosa (Lewin 1962).
Penelitian Yani (2003) di daerah sumber air panas desa Air Putih Kecamatan Lebong Utara Provinsi Bengkulu menemukan beberapa kelas
mikroalga yaitu Cyanophyceae, Chlorophyceae, Bacillariophyceae, Chysophyceae, Cryptophyceae, Rhodophyceae, dan Xanthophyceae. Kandungan unsur hara yang terkandung pada suatu perairan juga berpengaruh pada jenis mikroalga yang mendominasi wilayah tersebut. Pada perairan yang memiliki konsentrasi P yang rendah (0,00-0,02 mg l-1) akan didominasi oleh diatom, pada perairan dengan konsentrasi P yang sedang (0,02-0,05 mg l-1) akan dijumpai Chlorophyceae yang melimpah, dan pada perairan yang memiliki konsentrasi P yang tinggi (>0,10mgl-1), maka Cyanophyceae menjadi dominan (Tambaru 2008). Identifikasi Mikroalga
Identifikasi mikroalga dilakukan dengan pendekatan morfologi harus dilengkapi dengan pendekatan molekuler (Berard et al. 2005) karena adanya plastisitas morfologi mikroalga. Karakterisasi untuk mempelajari morfologi mikroalga memerlukan identifikasi dari isolat dan kultur mikroalga (Kortikov et al. 2001). Identifikasi morfologi mikroalga dapat dilakukan menggunakan buku identifikasi antara lain buku dengan judul Introduction to the algae structure and reproduction second edition (Bold & Wynne 1985) berdasarkan ciri-ciri yang diamati dari spesies mikroalga. Identifikasi spesies secara morfologi memiliki kelemahan karena dapat dipengaruhi oleh kondisi lingkungan, sedangkan identifikasi secara molekuler akan menghasilkan informasi genetik yang lebih akurat dan lebih cepat serta tidak dipengaruhi oleh kondisi lingkungan (Umayah & Purwantara 2006).
Identifikasi molekuler dilakukan dengan mengetahui urutan nukleotida gen 18S rDNA dan gen 16S rDNA. Gen 18S rDNA merupakan gen pengkode rRNA 18S pada organisme eukariotik, sedangkan gen 16S rDNA merupakan gen pengkode rRNA 16S pada organisme prokariotik. Gen ini mempunyai beberapa urutan nukleotida (basa) yang conserved (lestari) dan beberapa urutan yang bervariasi pada organisme Eukariotik dan Prokariotik, sehingga urutan nukleotida gen 18S rDNA dan gen 16S rDNA dapat digunakan untuk identifikasi mikroalga. Pertumbuhan Mikroalga
Pertumbuhan mikroalga meliputi empat tahapan yaitu fase lag, fase eksponensial, fase stasioner atau konstan dan diakhiri dengan fase kematian
(Sidabutar 1999). Fase lag merupakan fase adaptasi mikroalga terhadap media tumbuhnya. Fase eksponensial merupakan fase pertumbuhan secara pesat. Fase stasioner terjadi saat jumlah selnya relatif konstan dimana nutrisi dan jumlah selnya tidak seimbang yang selanjutnya diikuti dengan fase kematian ditandai dengan adanya penurunan jumlah sel.
Pertumbuhan mikroalga sangat dipengaruhi oleh ketersediaan unsur hara makro, mikro dan kondisi lingkungan. Kebutuhan unsur hara makro dan unsur hara mikro pada mikroalga yang hidup di perairan air tawar berbeda dengan yang hidup di perairan laut. Pada umumnya unsur hara utama yang dibutuhkan oleh mikroalga laut memiliki perbandingan rasio C:N:P:Si menurut Redfield berkisar antara 106:16:1:15 (Tambaru 2008). Intensitas cahaya mempengaruhi pertumbuhan dan kandungan lipid pada mikroalga. Penelitian yang dilakukan Gunawan (2010) melaporkan bahwa pada intensitas cahaya 5000 lux menunjukkan pertumbuhan yang optimal pada mikroalga.
Koleksi mikroalga di dalam laboratorium dapat menggunakan satu atau lebih jenis mikroalga yang diberi nutrien khusus ke dalam kultur seperti NO3- atau PO43- serta dilakukan penyinaran lampu (Bold & Wynne 1985). Media tumbuh mikroalga yang digunakan harus mengandung unsur anorganik berupa N, P, Fe dan Si (Chisti 2007). Kultur mikroalga membutuhkan nutrien anorganik berupa unsur hara makro meliputi C, H, O, N, P, K, S, Mg, Si, dan Ca, sedangkan unsur mikro meliputi Fe, Zn, Cu, Na,Mo, Co, B, Mn, Cl dan Ni (Agustini & Kabinawa 2010;Hamim 2007). Unsur hara makro yang utama berupa N dalam bentuk NO3ˉ
dan P dalam bentuk PO43- diperlukan untuk pertumbuhan mikroalga, sehingga kedua unsur tersebut merupakan faktor pembatas dalam pertumbuhan mikroalga.Penelitian yang dilakukan oleh Griffiths dan Harrison (2009) melaporkan bahwa pengurangan konsentrasi nitrogen pada media mikroalga hijau dapat meningkatkan kandungan lipid dari 41% menjadi dua kali lipat.
Unsur P sangat dibutuhkan oleh mikroalga dalam pengaturan proses pertumbuhan dan metabolisme yaitu digunakan untuk menyusun membran sel (fosfolipid), sebagai bahan dasar ATP dan sintesa asam nukleat (Theodorou et al. 1991; Ferrao-Filho et al. 2003). Unsur P dalam larutan nutrien biasanya dalam bentuk PO43- yang akan diserap oleh mikroalga dalam kondisi lingkungan banyak
menerima cahaya dan dalam pH antara 6-7 (Lewin 1962). Unsur hara makro seperti P penting dalam pembentukan protein. Pembatasan unsur P pada mikroalga hijau Selenastrum minutum menurunkan kandungan proteinnya (Theodorou et al. 1991). Hidayat (2008) juga melaporkan bahwa mikroalga menghasilkan kandungan lipid yang tinggi pada konsentrasi N sebanyak 0,2 M dan konsentrasi P sebanyak 0,6 mM dalam medium BG 11. Unsur K berfungsi dalam metabolisme karbohidrat, unsur Fe dan Na berperan dalam pembentukan klorofil. Unsur Si dan Ca merupakan bahan dalam pembentukan dinding sel.
Unsur hara mikro diberikan dalam jumlah kecil dan harus tetap ada dengan fungsi sebagai katalis selama proses biosintesis untuk menunjang pertumbuhan organisme. Dalam media tumbuh mikroalga biasanya ditambahkan EDTA atau sitrat untuk menstabilkan fungsi hara mikro dan juga berfungsi sebagai chelator (Widianingsih et al. 2008). Selain itu penambahan garam-garam fosfat sebagai larutan buffer atau larutan penyangga akan menyebabkan pH media tumbuh menjadi stabil (Sidabutar 1999). Pengkulturan mikroalga biasanya pada rentangan pH antara 7 sampai 9 dan pH yang optimum antara 8,2-8,7 yang akan meningkatkan angka pertumbuhan mikroalga (Abdulazis 2010).
Media tumbuh yang digunakan dalam skala laboratorium atau skala budidaya banyak variasinya dengan komposisi mineral yang berbeda sesuai kebutuhan dan jenis mikroalga yang digunakan. Pengkulturan mikroalga dalam kondisi fase ekponensial biasanya dilakukan dalam 4 sampai 7 hari inokulasi, pada rentangan waktu tersebut sebaiknya mikroalga diberi kondisi media dengan konsentrasi nutrien yang optimal bagi pertumbuhan mikroalga (Sutomo et al. 2007).
Berdasarkan penelitian yang telah dilakukan oleh Hidayat (2008) diketahui bahwa medium BG 11 merupakan medium kultur yang terbaik bagi mikroalga. Menurut Rippka et al. (1979) biasanya medium BG 11 digunakan untuk mengisolasi Cyanophyta dan mikroalga air tawar. Medium BG 11 mengandung NO3ˉ sebagai sumber N, sedangkan HPO4²ˉ dan H2PO4ˉ sebagai sumber P dan sebagai agen buffer (Reine& Trono 2002).
Biomassa Mikroalga
Mikroalga merupakan organisme yang mampu memanfaatkan CO2 karena memiliki enzim Rubisco (Ribulosa 1,5 carboxylic biphosphat) dalam siklus Calvin. Hasil fotosintesis akan terakumulasi dalam bentuk biomassa. Biomassa yang terbentuk menurut perkiraan Chisti (2007) untuk tiap 1 m3 media tumbuh menghasilkan 1 kg bobot kering mikroalga. Berdasarkan perkiraan tersebut, maka untuk lahan 1 ha dalam hal ini setara dengan 10.000 m3 akan menghasilkan 10.000 kg bobot kering mikroalga, sehingga dari 10.000 kg bobot kering akan dihasilkan biodiesel 1.500 sampai 7.700 liter.
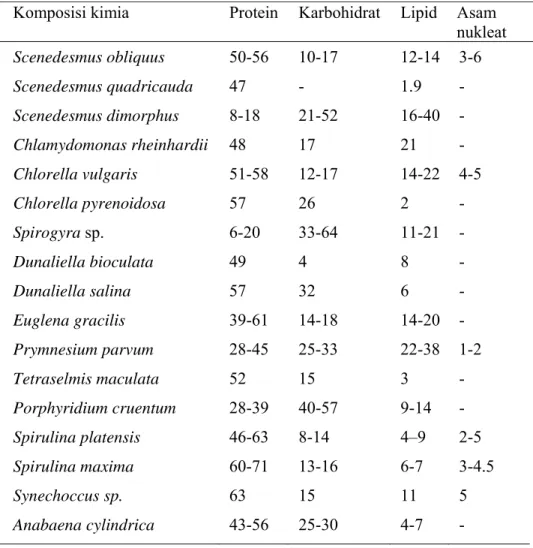
Biomassa yang terdapat dalam mikroalga mengandung karbohidrat, lemak dan protein. Namun, mikroalga lebih efektif menghasilkan selulosa, pati dan lipid (Sheehan et al. 1998). Menurut Becker et al. (1994) mikroalga mempunyai struktur sel yang sederhana yang menghasilkan biomassa dan produksi lipid lebih tinggi dibandingkan tanaman pertanian yang lain. Semua jenis alga memiliki komposisi kimia sel yang terdiri dari lemak (fatty-acids), karbohidrat, protein,dan asam nukleat. Namun masing-masing jenis mikroalga memiliki komposisi kimia berupa protein, karbohidrat (pati) dan lemak yangberbeda (Tabel 1). Perbedaan ini tergantung dari jenis dan faktor-faktor lingkungan yang mempengaruhi kehidupan mikroalga tersebut.
Sebagian besar mikroalga akan menghasilkan lipid dalam jumlah besar dengan adanya keterbatasan N dalam media tumbuhnya tetapi kekurangan nutrisi yang lain dalam media tumbuhnya dapat juga mengakibatkan peningkatan lipid yang dihasilkan (Borowitzka& Borowitzka 1988). Kondisi lingkungan kultur dan tempat yang berbeda juga akan mempengaruhi jumlah kandungan lipid, karbohidrat dan protein yang berbeda pula (Sutomo 2005). Penelitian Griffiths dan Harrison (2009) menyebutkan bahwa Chlorophyta dan Cyanophyta menghasilkan kandungan lipid yang berbeda dengan perlakuan dibawah kondisi medium yang mengandung N 100% dan penghilangan unsur N dari media tumbuh. Kandungan lipid pada Cyanophyta menunjukkan hasil yang lebih rendah dibandingkan dengan kandungan lipid pada Chlorophyta.
1. Lipid Mikroalga
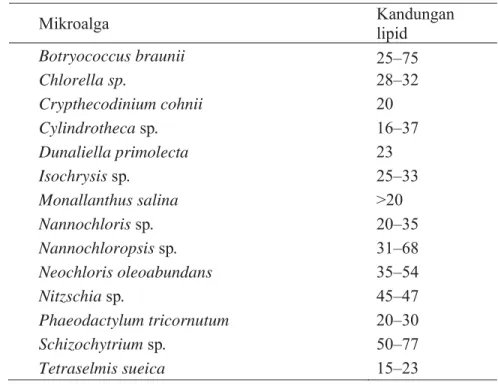
Pada umumnya mikroalga memiliki kandungan lipid bervariasi dari yang terendah sampai tertinggi, yaitu 1,9% sampai 40% (Tabel 1). Namun kondisi kultur dan waktu yang berbeda dapat meningkatkan kandungan lipid terlihat kandungan lipid mikroalga pada jenis mikroalga yang sama (Tabel 1 dan 2) memiliki kandungan lipid berbeda. Pada kondisi pertumbuhan normal kandungan lipid mikroalga 10-30% bobot kering (Schenk et al. 2008). Kandungan lipid mikroalga dengan rata-rata sebesar 40%, melebihi kadar lipid tanaman darat seperti kelapa, jarak pagar, dan kelapa sawit.
Tabel 1 Komposisi kimia protein, karbohidrat, lipid dan asam nukleatdalam% dari bobot kering mikroalga (Becker et al. 1994).
Komposisi kimia Protein Karbohidrat Lipid Asam nukleat Scenedesmus obliquus 50-56 10-17 12-14 3-6 Scenedesmus quadricauda 47 - 1.9 - Scenedesmus dimorphus 8-18 21-52 16-40 - Chlamydomonas rheinhardii 48 17 21 - Chlorella vulgaris 51-58 12-17 14-22 4-5 Chlorella pyrenoidosa 57 26 2 - Spirogyra sp. 6-20 33-64 11-21 - Dunaliella bioculata 49 4 8 - Dunaliella salina 57 32 6 - Euglena gracilis 39-61 14-18 14-20 - Prymnesium parvum 28-45 25-33 22-38 1-2 Tetraselmis maculata 52 15 3 - Porphyridium cruentum 28-39 40-57 9-14 - Spirulina platensis 46-63 8-14 4–9 2-5 Spirulina maxima 60-71 13-16 6-7 3-4.5 Synechoccus sp. 63 15 11 5 Anabaena cylindrica 43-56 25-30 4-7 -
Lipid alami yang dihasilkan oleh mikroalga berupa triasilgliserol serupa dengan lipid yang dihasilkan tumbuhan tinggi bahkan beberapa jenis mikroalga dapat menghasilkan triasilgliserol hingga 60% dari berat tubuh mikroalga (Sheehan et al.1998). Sintesis triasilgliserol (TAGSs) menurut Sheehan et al. (1998) terjadi karena adanya reaksi enzimatik oleh enzim Carboxylic Acetylcoenzyme A (ACCase) dalam biosintesis protein yang dapat mengkonversi lipid menjadi asam lemak. Berdasarkan penelitian Pratoomyot et al. (2005) menyebutkan bahwa asam lemak yang terdapat pada mikroalga mengandung jumlah atom karbon C14, C16, C18 dan C20.
Tabel 2 Kandungan lipid dari bobot kering pada beberapa mikroalga (%) (Chisti 2007).
Mikroalga Kandungan lipid
Botryococcus braunii 25–75 Chlorella sp. 28–32 Crypthecodinium cohnii 20 Cylindrotheca sp. 16–37 Dunaliella primolecta 23 Isochrysis sp. 25–33 Monallanthus salina >20 Nannochloris sp. 20–35 Nannochloropsis sp. 31–68 Neochloris oleoabundans 35–54 Nitzschia sp. 45–47 Phaeodactylum tricornutum 20–30 Schizochytrium sp. 50–77 Tetraselmis sueica 15–23
Lipid mikroalga dapat dimanfaatkan sebagai bahan baku biodiesel. Griffiths dan Harrison (2009) melaporkan bahwa kelompok mikroalga yang bisa dimanfaatkan sebagai bahan baku biodiesel, yakni diatom (Bacillariophyceae), mikroalga hijau (Chlorophyceae), dan mikroalga hijau biru (Cyanophyceae).
2. Karbohidrat Mikroalga
Karbohidrat merupakan salah satu komponen penting dalam metabolisme yang mensuplai energi yang dibutuhkan dalam respirasi dan proses penting lainnya. Kandungan karbohidrat pada beberapa makroalga bervariasi dan diketahui pada Chlorophyta lebih tinggi dibandingkan dengan Phaeophyta dan Rhodophyta (Kumar etal. 2010). Karbohidrat dalam mikroalga yang terlarut dalam sitoplasma dalam bentuk glukosa, sedangkan yang tersimpan sebagai cadangan makanan dalam bentuk pati. Pirenoid di dalam kloroplas merupakan tempat pembentukan pati dan umumnya terdapat butiran lipid didalam atau diluar kloroplas. Endapan pati banyak terdapat pada sel yang tumbuh pada lingkungan yang miskin nutrien dimana ketersediaan N dan P rendah (Hoek et al. 1997;Wilson & Loomis 1962). Pati yang terdapat dalam mikroalga dapat ditemukan dalam bentuk karbohidrat, glukosa dan polisakarida yang lain (Rodjaroen et al. 2007).
3. Protein Mikroalga
Protein mempunyai fungsi penting sebagai katalis enzim, sistem transport dan penyimpanan, mengontrol diferensiasi sel. Protein mikroalga meliputi glutamat, asam aspartat, valin, leusin, alanin, arginin, lysin dan phenyl alanin terdapat dalam konsentrasi tinggi, sedangkan sistein dan histidin dalam konsentrasi rendah (El-Sarraf & El-Shaarawy 1994). Menurut Chrismadha et al. (2006) kandungan protein dipengaruhi oleh konsentrasi N dan P yang terdapat dalam media tumbuh mikroalga sehingga apabila konsentrasi N dan P dalam media menurun akan menyebabkan kandungan protein menurun yang diikuti degradasi komponen sel yang berkaitan dengan proses sintesa protein termasuk klorofil a dan pigmen lainnya. Kandungan protein pada makroalga hijau dan merah rata-rata 21-35% dari berat basah lebih tinggi dibandingkan kandungan protein makroalga coklat pada umumnya dengan rata-rata: 10-17% dari berat basah (Kumar et al. 2010)
Peranan Mikroalga
Mikroalga telah sejak lama dimanfaatkan sebagai bahan makanan, terutama sebagai sumber vitamin, anti oksidan, pewarna atau bahan aditif yang
aman, serta digunakan pula dalam industri farmakologi dalam skala besar. Di alam, mikroalga mengambil peranan yang penting sebagai akumulator logam berat (adsorben logam berat), yaitu mempunyai kemampuan yang cukup tinggi untuk mengadsorpsi ion-ion logam, baik dalam keadaan hidup maupun dalam bentuk sel mati (biomassa). Peranan mikroalga yang lain adalah sebagai penyerap CO2, dan juga berasosiasi dengan bakteri untuk mengikat N (Sheehan et al.1998).
Biodiesel mikroalga merupakan bahan bakar bersifat dapat diperbaharui dan paling ramah serta tidak beracun terhadap lingkungan dibanding minyak tanah yang biasa digunakan sebagai bahan dasar minyak diesel, karena biodiesel dari mikroalga netral dari unsur karbon (tidak terikat dengan karbon) sehingga hanya menyisakan uap air dan energi panas, selain itu dapat terdekomposisi oleh dekomposer (Mahyudin & Kusnandar 2006; Widjaya 2009).
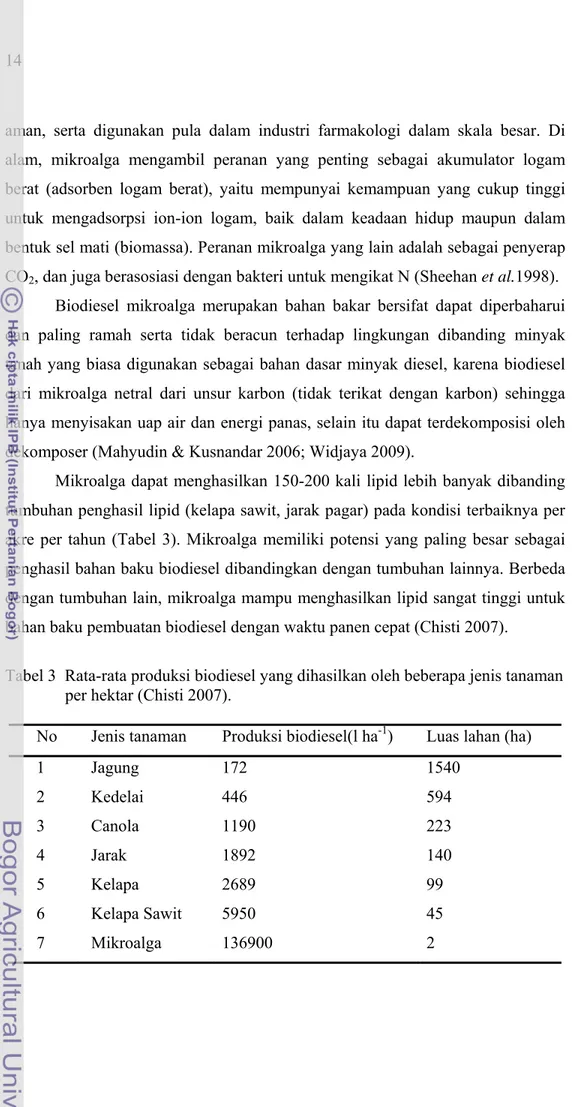
Mikroalga dapat menghasilkan 150-200 kali lipid lebih banyak dibanding tumbuhan penghasil lipid (kelapa sawit, jarak pagar) pada kondisi terbaiknya per akre per tahun (Tabel 3). Mikroalga memiliki potensi yang paling besar sebagai penghasil bahan baku biodiesel dibandingkan dengan tumbuhan lainnya. Berbeda dengan tumbuhan lain, mikroalga mampu menghasilkan lipid sangat tinggi untuk bahan baku pembuatan biodiesel dengan waktu panen cepat (Chisti 2007).
Tabel 3 Rata-rata produksi biodiesel yang dihasilkan oleh beberapa jenis tanaman per hektar (Chisti 2007).
No Jenis tanaman Produksi biodiesel(l ha-1) Luas lahan (ha)
1 Jagung 172 1540 2 Kedelai 446 594 3 Canola 1190 223 4 Jarak 1892 140 5 Kelapa 2689 99 6 Kelapa Sawit 5950 45 7 Mikroalga 136900 2