PENGARUH PENAMBAHAN RAGI BIR DALAM PAKAN
TERHADAP DAYA TAHAN TUBUH IKAN LELE Clarias sp
DARI INFEKSI BAKTERI Aeromonas hydrophila
FAJAR ADI PRATAMA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRACT
FAJAR ADI PRATAMA. The influence of addition of brewer's yeast on the
resistance of Clarias sp against Aeromonas hydrophila infection. Supervised by
DEDI JUSADI and SUKENDA
Motile aeromonad septicaemia caused by Aeromonas hydrophila, induced serious
epidemics disease in freshwater fish, one of them is Clarias sp. This research was
purposed to evaluate the feeding period of brewer's yeast Saccharomyces cerevisae
on the resistance of Clarias sp against A. hydrophila infection. Clarias sp with an
initial body weight of 5.33±0.5 g were cultured for 30 days in 50 x 40 x 35 cm aquarium. During rearing period, fish were fed on the diet contained either 0% or 3% of S. cerevisae. On day10, fish in the groups of K+10 (feeding with 0% S.
cerevisae) and RB10 (feeding with 3% S. cerevisae), were infected with A. hydrophila; while those fish in the groups of K+20 and RB20 were infected on
day 20. Fish in the group of K- were not infected with A. hydrophila. The results showed that on day-30, fish in the groups of K-, RB10, and RB20 had significantly higher survival than fish in K+10 and K+20. The survival of fish in K-, RB10, and RB20 were 100%, 76.7%, and 73.3%, respectively; while those in K+10 and K+20 were only 26,7% and 33.3%, respectively. Therefore, feeding on
S. cerevisae in the period of ten days effectively reduce the mortality of fish due
to the infection of A. hydrophila.
Keywords: Aeromona hydrophila, Clarias sp.,brewer’s yeast.
ABSTRAK
FAJAR ADI PRATAMA. Pengaruh penambahan ragi bir dalam pakan terhadap
daya tahan tubuh ikan lele Clarias sp dari infeksi bakteri Aeromonas hydrophila. Dibimbing oleh DEDI JUSADI dan SUKENDA.
Penyakit motile aeromonad septicaemia yang disebabkan oleh Aeromnas
hydrophila menyebabkan wabah penyakit serius pada ikan air tawar, salah satunya
ikan lele dumbo Clarias sp. Penelitian ini bertujuan untuk mengevaluasi efektivitas lama periode pemberian ragi bir Saccharomyces cerevisae sebagai pakan ikan yang dapat meningkatkan daya tahan tubuh ikan lele dumbo. terhadap infeksi bakteri A. hydrophila. Ikan lele ukuran 5,33±0,5 g dipelihara dalam akuarium ukuran 50 x 40 x 35 cm dengan padat tebar 10 ekor/akuarium, selama 30 hari. Selama masa budidaya, ikan diberi 3% ragi bir dalam pakan dan pakan tanpa ragi bir. Perlakuan yang diujikan adalah lama pemberian pakan yang berbeda sebelum ikan diinfeksi bakteri. Perlakuan tersebut adalah: RB10 (pakan formulasi dengan 3% ragi bir, ikan diinfeksi A. hydrophila pada hari ke-10); RB20 (pakan formulasi dengan 3% ragi bir, ikan diinfeksi A. hydrophila pada hari ke-20); K+10 (pakan formulasi tanpa ragi bir, ikan diinfeksi A. hydrophila pada hari ke-10); K+20 (pakan formulasi tanpa ragi bir; serta ikan diinfeksi A.
hydrophila pada hari ke-20) dan perlakuan kontrol, yaitu K- (pakan formulasi
bahwa pada hari ke-30 masa budidaya, nilai kelangsungan hidup yang tinggi diperoleh pada perlakuan K-, RB10, dan RB 20, yakni masing-masing 100%, 76,7%, dan 73,3%. Sedangkan kelangsungan hidup ikan pada perlakuan K+10 dan K+20, masing-masing 26,7% dan 33,3%. Dengan demikian, pemberian ragi bir selama 10 hari dapat menekan kematian ikan lele akibat serangan bakteri A.
hydrophila.
PENGARUH PENAMBAHAN RAGI BIR DALAM PAKAN
TERHADAP DAYA TAHAN TUBUH IKAN LELE Clarias sp
DARI INFEKSI BAKTERI Aeromonas hydrophila
FAJAR ADI PRATAMA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini menyatakan bahwa skripsi yang berjudul:
PENGARUH PENAMBAHAN RAGI BIR DALAM PAKAN TERHADAP DAYA TAHAN TUBUH IKAN LELE Clarias sp DARI SERANGAN BAKTERI Aeromonas hydrophila
adalah benar merupakan hasil karya sendiri dengan arahan pembimbing, dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2013
Fajar Adi Pratama C14070013
PRAKATA
Puji syukur kehadirat Tuhan Yang Maha Esa yang senantiasa melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini dengan baik. Tema penelitian yang dilakukan dari tanggal 20 Oktober 2012 sampai dengan 18 November 2012 di Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor adalah Pengaruh penambahan ragi bir dalam pakan untuk ketahanan terhadap tubuh ikan lele
Clarias sp terhadap infeksi bakteri Aeromonas hydrophila. Skripsi ini dibuat sebagai syarat untuk menyelesaikan tugas akhir kelulusan di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Banyak bantuan yang telah diberikan berbagai pihak, oleh karena itu, pada kesempatan ini disampaikan ucapan terima kasih kepada: Bapak Dr. Dedi Jusadi sebagai Dosen Pembimbing 1 dan Dr. Sukenda sebagai dosen pembimbing 2 yang telah memberikan bimbingan dan arahannya, orang tua saya yang senantiasa mendukung dan mendoakan, rekan-rekan BDP 44, Trian, Dimas F.K, Dimas Budiman, Ryan Pradiatma, Pembaruan Siregar, Aulia Nugroho, Hedra Akhrari serta BDP 45, Tira, Tiara, Arin, Jengki, Retno dan Dendi atas kebersamaan dan semangatnya. Akhir kata, penulis berharap semoga penelitian ini dapat memberikan manfaat.
Bogor, Maret 2013
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya pada tanggal 23 November 1989 sebagai anak pertama dari empat bersaudara dari pasangan Bapak Dodi Hermanto BSc dan Ibu Yeni Hendriyani. Pendidikan sekolah dasar (SD Dadaha 1 Tasikmalaya) sampai Sekolah Menengah Atas (SMAN 2 Tasikmalaya) dari tahun 1995 hingga 2007. Penulis melanjutkan pendidikan ke Institut Pertanian Bogor
(IPB) pada tahun 2007 melalui Jalur USMI (Ujian Seleki Masuk IPB) dan
mengambil Program Studi Teknologi dan Manajemen Perikanan Budidaya (TMPB) di Fakultas Perikanan dan Ilmu Kelautan (FPIK).
Selama perkuliahan penulis mengikuti beberapa organisasi yaitu, Music Agricultural Xpression (MAX) Angkatan 5 menjabat sebagai anggota. Penulis pernah melaksanakan magang di PT. SEMATA Rancamaya, Singaparna, Tasikmalaya. Selain itu penulis juga aktif di organisasi ekstra kampus yaitu Komunitas Ladang Seni dan Himpunan Mahasiswa Tasikmalaya (HIMALAYA) sebagai kepala bagian HUMAS pada tahun 2008-2009. Selain itu penulis juga menjadi kepanitian kegiatan ekstra kampus diantaranya “Tribute to The Beatles and Koes Plus @LadangseniIPB” tahun 2010 sebagai penanggung jawab visualisasi dan desain grafis dan “Panggung Mahasiswa @LadangseniIPB” tahun 2012 sebagai Head Project yang secara rutin diadakan di Stevia Cafe setiap hari Rabu.
Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi yang berjudul “Pengaruh penambahan ragi bir dalam pakan terhadap daya tahan
Judul Skripsi : Pengaruh penambahan ragi bir dalam pakan terhadap daya tahan tubuh ikan lele Clarias sp dari infeksi bakteri Aeromonas
hydrophila
Nama : Fajar Adi Pratama
NIM : C14070013
Program studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh,
Diketahui oleh,
Dr. Sukenda
Ketua Departemen Budidaya Perairan
Tanggal Lulus: 11 Maret 2013
Dr. Sukenda Dosen Pembimbing II Dr. Dedi Jusadi
i
DAFTAR ISI
DAFTAR TABEL……… ii DAFTAR GAMBAR……… ii DAFTAR LAMPIRAN ………... ii PENDAHULUAN……… 1 Latar Belakang………. 1 Tujuan……….. 2 METODE………. 2Pengeringan Limbah Ragi Bir……….. 2
Pembuatan Pakan Uji………... 2
Pembuatan Media Kultur TSB………. 3
Uji LD50……….. 3
Pemeliharaan dan Perlakuan……… 4
Analisis Statistika………. 5
Parameter Uji……… 5
HASIL DAN PEMBAHASAN……… 6
Hasil………. 6
Perubahan Bobot Individu Ikan………... 6
Kelangsungan Hidup……… 6
Konsumsi Pakan………... 8
Gejala Klinis dan Penyembuhan……….. 8
Pembahasan……….. 11
KESIMPULAN………. 14
ii
DAFTAR TABEL
1. Komposisi pakan uji………... 3
2. Rancangan perlakuan……….. 5
3. Gejala klinis pasca uji tantang……… 9
DAFTAR GAMBAR 1. Peningkatan rata-rata bobot individu ikan lele………... 6
2. Kelangsungan hidup ikan lele………. 7
3. Kelangsungan hidup (SR) ikan lele pada hari ke-30 masa budidaya…. 7 4. Respon makan ikan sebelum dan setelah injeksi……… 8
5. Radang pada H+1 injeksi………. 9
6. Tukak pada H+3 setelah injeksi……… 9
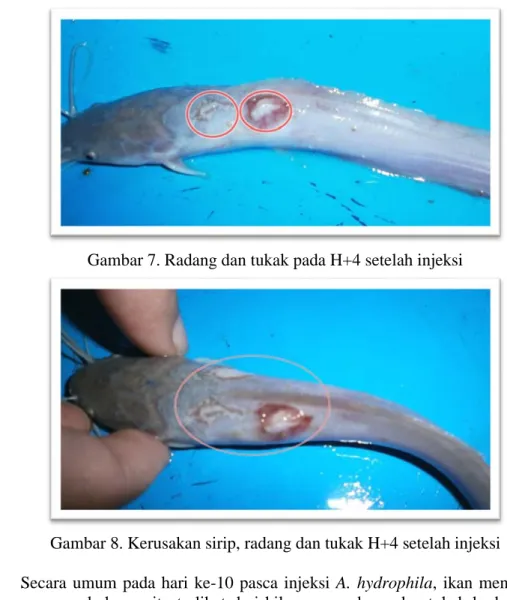
7. Radang dan tukak pada H+4 setelah injeksi……….. 10
8. Kerusakan sirip, radang dan tukak H+4 setelah injeksi………. 10
9. Tukak masih tampak pada perlakuan K+ setelah H+10 injeksi…………. 10
10. Kerusakan sirip ikan pada perlakuan K+ setelah H+10 injeksi………….. 11
11. Tukak mengecil dan meninggalkan bekas pada perlakuan pemberian ragi bir setelah H+10 injeksi……… 11
12. Tidak ada kerusakan sirip pada perlakuan pemberian ragi bir setelah H+10 injeksi………. 11
DAFTAR LAMPIRAN 1. Perhitungan LD50……… 16
2. Perhitungan parameter penelitian……….. 16
3. Data SR hasil uji tantang………. 17
4. Data rata-rata bobot individui awal dan akhir ikan………. 18
PENDAHULUAN
Latar belakang
Produksi bir di Indonesia mencapai 60–100 juta liter per tahun (Rosita,
2011). Sejalan dengan hal ini, maka perusahaan bir juga menghasilkan limbah, yaitu berupa ragi bir Saccharomyces cerevisae. Ragi bir merupakan limbah proses produki bir. Di PT. Multi Bintang, setiap hari dihasilkan sekitar 3 ton ragi bir kering.
Atmaka (1997) dalam Rahman (2003) menyatakan bahwa sebagian besar limbah industri penghasil bir berupa khamir mengandung kadar protein tinggi sekitar 55%. Menurut hasil analisis proksimat, dalam 94.51% bobot kering, limbah ragi bir mengandung kadar abu sebesar 5,89%, protein 56,37%, lemak 1,29%, serat kasar 0.44% dan BETN 36,23%.
Ragi bir sebanyak 2 dan 4% dalam pakan dapat meningkatkan efisiensi pakan pada ikan kakap Eropa Hybrid Stripped bass (Li dan Gatlin III, 2003). Sebanyak 10% ragi bir yang digunakan dalam pakan yang diberikan pada ikan nila (Oreochromis sp.) memperlihatkan pengaruh baik pada penyerapan nutrisi dan efisiensi pakan, meskipun hal tersebut tidak menunjukkan efek yang signifikan pada pertumbuhan. Namun demikian ketika dosis ragi bir dalam pakan melebihi 40% berdampak pada penurunan tingkat efisiensi dan kecernaan protein dan lemak (Ozório et al., 2012).
Beberapa peneliti telah mengevaluasi kandungan nutrisi dari ragi bir
Saccharomyces cerevisae pada lake trout, rainbow trout (Rumsey et al., 1991)
dan sea bass (Oliva-Teles dan Goncalves (2001) dengan membandingkan pertumbuhan, efisiensi pakan, kandungan liver (liver uricase) serta retensi nitrogen. Berdasarkan beberapa studi tersebut, diketahui bahwa ragi bir dapat menggantikan tepung ikan hingga 25-30% tanpa menyebabkan dampak buruk pada pertumbuhan ikan. Bahkan dalam jurnal yang ditulis oleh Zerai et al. (2008) bahwa ragi bir dapat menggantikan hingga 50% protein tepung ikan pada pakan komersial ikan nila.
White et al. (2002) dalam Ferreira et al. (2010) menjelaskan bahwa ragi bir mengandung berbagai macam senyawa imunostimulan seperti β-glukan, asam nukleat dan mannan oligosakarida. Ragi bir adalah sumber asam nukleat dan polisakarida termasuk β-1,3-glukan. β-1.3-glukan telah diketahui secara efektif dapat meningkatkan fungsi imun dari berbagai macam spesies akuakultur termasuk ikan lele Afrika (Yoshida et al., 1995) Atlantic salmon (Engstad et al., 1992 dalam Li dan Gatlin, 2003), Rainbow trout (Jorgensen et al, 1993 dalam Li dan Gatlin, 2003), dan udang windu (Thanardkit et al.,2002 dalam Li dan Gatlin, 2003). β-1,3–Glukan dalam ragi bir secara umum dianggap sebagai faktor dengan mekanisme imunologi (Gannam dan Schrock, 2001 dalam Li dan Gatlin, 2003).
Hal ini telah diamati oleh Ortuno et al. (2002) dalam Ferreira et al. (2010) bahwa ragi bir dapat meningkatkan respons imun serta pertumbuhan beberapa spesies ikan. Selain itu menurut Burr et al. (2008), Li et al. (2009) dalam Ferreira
2 tingkat pertumbuhan dan efisiensi pakan pada ikan hybrid striped bass (Morone
chrysops x M. saxatilis) serta resistensi terhadap infeksi Streptococcus iniae.
Selain itu hasil dari uji respons imun yang dilakukan oleh Li dan Gatlin (2003, 2004, 2005) dalam Ferreira et al. (2010) membuktikan bahwa ragi bir dapat diberikan dalam jangka waktu yang relatif lama tanpa mengakibatkan adanya imunosupresi.
Tujuan
Penelitian ini bertujuan untuk mengevaluasi efektivitas lama waktu penambahan ragi bir dalam pakan yang dapat meningkatkan daya tahan tubuh ikan lele Clarias sp. terhadap infeksi bakteri Aeromonas hydrophila.
METODE
Pengeringan limbah ragi bir
Limbah ragi bir mengandung 80-85% kadar air sehingga diperlukan pengeringan agar dapat dicampurkan ke adonan pakan. Pengeringan di bawah sinar matahari dilakukan selama 12-14 hari kemudian dimasukkan ke dalam oven selama 72 jam pada suhu 60°C untuk menghilangkan kandungan air yang tersisa, selang waktu 48 jam dilakukan penyortiran dan pemisahan terhadap limbah yang telah kering. Hal ini untuk mencegah terjadinya over dry.
Pembuatan pakan uji
Pakan uji yang digunakan berupa pakan fomulasi dengan penambahan 3% ragi bir serta tanpa penambahan limbah ragi bir. Pakan tersebut dibuat dengan mencampurkan seluruh bahan pakan sesuai dengan komposisi pakan pada Tabel 1. Setelah bahan tersebut tercampur rata kemudian pakan dicetak dan dikeringkan dengan oven selama 24 jam.
3 Pembuatan media kultur bakteri TSB
Proses pembuatan media diawali dengan 1,5 g TSB dimasukkan ke dalam Erlenmeyer kemudian dicairkan dengan menggunakan akuades sebanyak 50 ml lalu dipanaskan dengan menggunakan heater agar media TSB tersebut tercampur rata. Setelah dipanaskan media tersebut dimasukkan ke dalam otoklap selama 15 menit
pada suhu yang ditetapkan yaitu 121 oC agar media tetap steril. Setelah disterilkan,
bakteri A. hydrophila yang sudah tersedia dalam media agar digores dengan
menggunakan ose dan dimasukkan ke dalam trypticase soy broth (TSB) yang sudah
disterilkan dan tentunya ditiriskan terlebih dahulu. Setelah bakteri dimasukkan ke dalam media cair lalu dimasukkan ke dalam mesin shaker selama 24 jam agar bakteri tersebut tercampur rata dalam media TSB.
Tabel 1. Komposisi pakan uji
Bahan Baku Perlakuan (%) Kontrol 3 % Ragi Bir
Dedak 10 10 Tepung terigu 18,04 18,04 Tapioka 10 10 Tepung Kedelai 36,4 33,5 Animal pro 20,1 20,1 Fish Oil 1,5 1,5 Minyak hewani 0,5 0,5 Lysine 0,08 0,02 Methionine 0,1 0,1 Mineral Mix 3,2 3,2 Vitamin 0,02 0,02 Ragi Bir 0 3 Total (%) 100 100 Uji LD50
Letal Dosis 50% (LD50) adalah suatu besaran yang diturunkan secara statistik, guna menyatakan dosis tunggal sesuatu senyawa yang diperkirakan dapat mematikan atau menimbulkan efek toksik yang berarti pada 50% hewan coba setelah perlakuan (Sulastry, 2009). LD50 dilakukan untuk menentukan tingkat virulensi bakteri A.
hydrophila. Hal ini penting untuk mengetahui konsentrasi bakteri yang digunakan.
Biakan bakteri A. hydrophila diperoleh dari Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Institut Pertanian Bogor. Bakteri yang diujikan dimudakan terlebih dahulu sebelum digunakan agar tetap terjaga tingkat virulensinya. Bakteri stok dari kultur primer dibiakkan dalam agar miring
4 sebanyak satu ose dan digoreskan ke agar miring kemudian diinkubasi selama 24 jam dalam inkubator. Bakteri yang telah diinkubasikan diambil sebanyak satu ose dan diinokulasikan ke dalam tabung yang berisi 10 ml media TSB dan diinkubasi selama 24 jam dalam inkubator bergoyang (shaker).
Uji LD50 dilakukan dengan menggunakan akuarium berukuran 50 x 40 x 35
cm sebanyak 5 buah masing-masing untuk perlakuan kepadatan bakteri yang
disuntikkan yaitu mulai dari 104, 105, 106, 107 dan 108 cfu/ml. Setiap akuarium diisi
10 ekor ikan dengan bobot 10,17±1,19g. Penyuntikkan dilakukan secara
intramuscular dengan dosis 0,1 ml/ekor. Pengamatan terhadap jumlah ikan yang mati
dan yang masih hidup dilakukan selama 7 hari. Setelah itu dilakukan perhitungan untuk menentukan nilai LD50 (Lampiran 1). Diperoleh bahwa bakteri yang
digunakan untuk uji tantang adalah bakteri dengan kepadatan 108 cfu/ml dengan dosis
yang disesuaikan bobot ikan.
Pemeliharaan ikan dan perlakuan
Ikan lele ukuran 7-8 cm sebanyak 300 ekor ditebar di 15 akuarium berdimensi 50 x 40 x 35 cm. Ikan lele dipelihara dan diadaptasikan sekitar 1 minggu. Selama masa adaptasi, ikan diberi pakan komersial sebanyak 3 kali sehari. Setelah 1 minggu, ikan lele diseleksi, diukur panjang dan bobotnya. Sebanyak 150 ekor ikan lele ukuran 8-9 cm yang telah diadaptasikan, ditebar ke dalam akuarium berdimensi 50 x 40 x 35 cm sebanyak 15 buah yang dirancang dalam sistem resirkulasi yang dilengkapi dengan tandon. Setiap akuarium diisi dengan 10 ekor ikan. Untuk mengontrol suhu air serta oksigen terlarut, setiap akuarium dilengkapi dengan thermostat dan diberi aerasi. Ikan tersebut diberi pakan sebanyak 3 kali sehari secara at satiation. Pakan yang digunakan adalah pakan formulasi yang telah ditambahkan 3 % ragi bir serta pakan formulasi tanpa penambahan 3 % ragi bir sebagai perlakuan kontrol (Tabel 1). Setelah uji tantang, sistem resirkulasi dihentikan agar bakteri tidak menyebar, tetapi ikan uji tetap diberi pakan sesuai perlakuan sampai masa penelitian berakhir..
Perlakuan dalam penelitian ini secara ringkas dapat dilihat dalam Tabel 2. Ikan yang diberi pakan formulasi 3% ragi bir, dibagi ke dalam dua perlakuan waktu infeksi bakteri A. hydrophila yang berbeda, yakni pada hari ke-10 dan 20 masa budidaya. Sedangkan ikan yang diberi pakan kontrol dibagi ke dalam tiga perlakuan, yakni dua perlakuan waktu infeksi bakteri A. hydrophila pada hari ke-10 dan 20, serta satu perlakuan sebagai kontrol negatif (tidak diinfeksi bakteri). Infeksi dilakukan dengan cara menginjeksikan 0,1 ml larutan bakteri A.
hydrophila 108 cfu/ml ke dalam tubuh ikan. Setiap perlakuan diulang sebanyak tiga kali. Ikan di seluruh perlakuan dipelihara selama 30 hari.
5 Tabel 2. Rancangan perlakuan waktu infeksi bakteri Aeromonas hydrophila
pada ikan lele yang diberi pakan formulasi dengan dan tanpa penambahan ragi bir
Perlakuan Pakan Waktu Infeksi Bakteri (hari ke…) Masa Budidaya (hari)
K- Tanpa ragi bir - 30
RB10 3% ragi bir 10 30
RB20 3% ragi bir 20 30
K+10 Tanpa ragi bir 10 30
K+20 Tanpa ragi bir 20 30
Pengamatan kelangsungan hidup ikan dan jumlah konsumsi pakan dilakukan setiap hari, disertai dengan pengamatan timbulnya gejala klinis bakteri di ikan yang terinfeksi A. hydrophila.
Analisis statistik
Penelitian menggunakan rancangan acak lengkap yang diulang sebanyak 3 kali. Analisis statistik menggunakan ANOVA yang diikuti dengan uji lanjut BNJ (beda nyata jujur).
Parameter uji
Parameter yang diamati dan diukur dalam penelitian ini meliputi jumlah konsumsi pakan (JKP) per individu ikan dan tingkat kelangsungan hidup (SR) ikan. Perhitungan untuk masing-masing parameter disajikan pada Lampiran 2. Selain itu juga dilakukan pengumpulan data jumlah dan bobot ikan pada awal pemeliharaan dan ikan yang mengalami kematian pada saat penelitian berlangsung, serta dilakukan pengambilan data harian pasca injeksi tentang data kematian ikan.
6
HASIL DAN PEMBAHASAN
Hasil
Perubahan bobot individu ikan
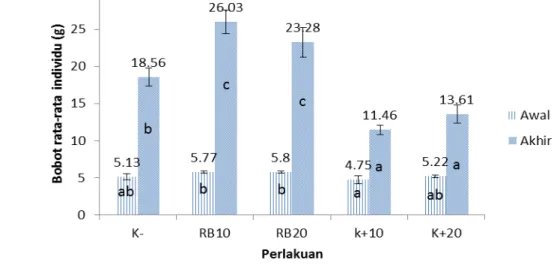
Penggunaan ragi pada pakan uji berbeda yaitu K+10, K+20, RB10, RB20, dan K- yang diberikan selama 30 hari, menunjukkan pertumbuhan ikan lele. Hal ini ditandai dengan peningkatan bobot ikan lele pada setiap perlakuan. Peningkatan tersebut dapat dilihat pada Gambar 1.
Keterangan: K- = kontrol negatif, RB10 = ragi bir 10 hari, RB20 = ragi bir 20 hari, K+10 = kontrol positif 10 hari, K+20 = kontrol positif 20 hari
Gambar 1. Peningkatan rata-rata bobot individu ikan lele yang diberi pakan perlakuan ragi bir dan tanpa ragi bir.
Berdasarkan Gambar 1, secara umum perlakuan penambahan 3% limbah ragi bir pada pakan menunjukkan peningkatan bobot rata-rata yang cukup tinggi dibandingkan dengan perlakuan tanpa penambahan 3% limbah ragi bir. Peningkatan biomassa rata-rata tertinggi ditunjukkan oleh perlakuan RB10 yaitu sebesar 20,26 g, sedangkan biomassa rata-rata terendah ditunjukkan oleh perlakuan K+10 yaitu hanya sebesar 6,71 g. Ikan pada perlakuan RB10 dan RB20, yang diinfeksi dengan bakteri, tetapi dapat tumbuh lebih baik daripada perlakuan kontrol.
Kelangsungan hidup
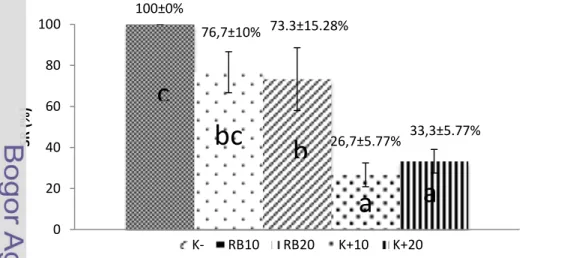
Kelangsungan hidup ikan dihitung setiap hari, sehingga gambar kelangsungan hidup selama masa budidaya dapat dilihat di Gambar 2. Data kelangsungan hidup pada akhir penelitian dapat dilihat di Gambar 3.
7
Keterangan: K- = kontrol negatif, RB10 = ragi bir 10 hari, RB20 = ragi bir 20 hari, K+10 = kontrol positif 10 hari, K+20 = kontrol positif 20 hari
Gambar 2. Kelangsungan hidup ikan lele sebelum dan setelah injeksi dengan
Aeromonas hydrophila.
Kelangsungan hidup ikan paling tinggi adalah pada perlakuan K- sebesar 100±0%, sedangkan kelangsungan hidup ikan terendah adalah perlakuan K+10 yaitu sebesar 26,7±5,77%. Kematian ikan kebanyakan terjadi pada hari pemeliharan ke-13 dan hari ke-23, yaitu 3 hari setelah ikan diinjeksi A.
hydrophila. Pada umumnya setelah hari ke-7 dan ke-8 pasca infeksi bakteri, tidak
terjadi lagi kematian ikan. Perlakuan yang menunjukan penurunan kelangsungan hidup yang sangat signifikan terdapat pada perlakuan K+10. Sedangkan perlakuan yang menunjukkan penurunan kelangsungan hidup terendah terdapat pada perlakuan RB10.
Keterangan: K- = kontrol negatif, RB10 = ragi bir 10 hari, RB20 = ragi bir 20 hari, K+10 = kontrol positif 10 hari, K+20 = kontrol positif 20 hari
Gambar 3. Kelangsungan hidup (SR) ikan lele pada hari ke-30 masa budidaya.
0 20 40 60 80 100 1 2 3 4 5 6 7 8 9 1 0 1 1 1 2 1 3 1 4 1 5 1 6 1 7 1 8 1 9 2 0 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 2 9 3 0 KE LA N GS U N GA N H ID U P ( % ) HARI PEMELIHARAAN K - RB10 RB20 K+10 K+20 100±0% 76,7±10% 73.3±15.28% 26,7±5.77% 33,3±5.77% 0 20 40 60 80 100 SR (% ) K- RB10 RB20 K+10 K+20
c
bc
b
a
a
8
Konsumsi pakan
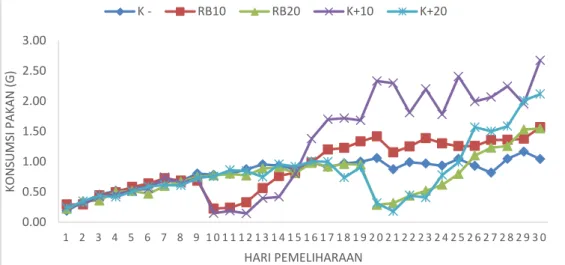
Respon makan dilihat dari jumlah pakan yang dihabiskan dibagi dengan jumlah ikan yang hidup. Respons makan ikan diamati selama 30 hari. Gambaran konsumsi pakan harian rata-rata individu ikan di setiap perlakuan dapat dilihat di Gambar 4.
Keterangan: K- = kontrol negatif, RB10 = ragi bir 10 hari, RB20 = ragi bir 20 hari, K+10 = kontrol positif 10 hari, K+20 = kontrol positif 20 hari
Gambar 4. Jumlah konsumsi pakan harian individu ikan di setiap perlakuan selama masa budidaya.
Jumlah konsumsi pakan setiap individu ikan meningkat seiring dengan meningkatnya masa budidaya. Penurunan respons makan ikan terjadi pada hari ke-10 serta hari ke-20 pemeliharaan, bersamaan dengan waktu infeksi bakteri di masing-masing perlakuan. Respons makan ikan yang diinfeksi bakteri meningkat
seiring bertambahnya hari pasca injeksi. Lima hari pasca injeksi, jumlah konsumsi
pakan ikan di perlakuan RB10, RB20, K+10 dan K+20, semuanya lebih banyak dibandingkan dengan ikan di perlakuan kontrol. Lebih rendahnya konsumsi pakan di perlakuan kontrol berkorelasi dengan kepadatan ikan, yakni ikan di perlakuan kontrol jumlahnya lebih banyak daripada perlakuan lainnya.
Gejala klinis pada infeksi A. hydrophila
Pengamatan gejala klinis pada ikan yang sudah diinfeksi A. hydrophila dilakukan selama 10 hari pasca infeksi. Gejala klinis yang diamati meliputi radang,
haemoragi dan tukak. Pengamatan gejala klinis pada ikan lele pasca uji tantang
dapat dilihat pada Tabel 3.
0.00 0.50 1.00 1.50 2.00 2.50 3.00 1 2 3 4 5 6 7 8 9 1 0 1 1 1 2 1 3 1 4 1 5 1 6 1 7 1 8 1 9 2 0 2 1 2 2 2 3 2 4 2 5 2 6 2 7 2 8 2 9 3 0 KO N SU M SI P AK AN (G ) HARI PEMELIHARAAN K - RB10 RB20 K+10 K+20
9
Tabel 3. Gejala klinis pasca uji tantang
Perlakuan
Radang, Haemoragi dan Tukak (ekor) Hari pemeliharaan ke-
0 10 20 K- 0 0 0 RB10 0 20 0 RB20 0 0 22 K+10 0 29 0 K+20 0 0 27
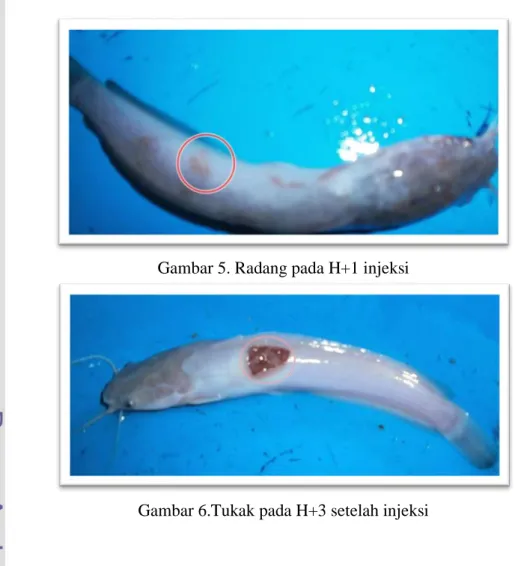
Secara umum ikan menunjukkan radang pada hari ke-1 setelah injeksi. Pada hari ke-3 setelah injeksi, peradangan berubah menjadi haemoragi dan tukak pada bagian punggung ikan serta kerusakan sirip dan kematian (Gambar 5-8).
Gambar 5. Radang pada H+1 injeksi
10
Gambar 7. Radang dan tukak pada H+4 setelah injeksi
Gambar 8. Kerusakan sirip, radang dan tukak H+4 setelah injeksi
Secara umum pada hari ke-10 pasca injeksi A. hydrophila, ikan menunjukkan adanya penyembuhan yaitu terlihat dari hilangnya radang, dan tukak berbekas pada punggung ikan serta tidak adanya kerusakan pada sirip ikan (Gambar 7-9).
11
Gambar 10. Kerusakan sirip ikan pada perlakuan K+ setelah H+10 injeksi
Gambar 11. Tukak mengecil dan meninggalkan bekas pada perlakuan pemberian ragi bir setelah H+10 injeksi
Gambar 12. Tidak ada kerusakan sirip pada perlakuan pemberian ragi bir setelah H+10 injeksi
Pembahasan
Sebelum dilakukan uji tantang dilakukan uji LD50 untuk mengetahui besarnya dosis yang akan diinjeksikan pada ikan. LD50 adalah jumlah yang diharapkan dapat menyebabkan kematian pada setengah (50%) dari populasi dari beberapa spesies hewan tertentu, ketika memasuki tubuh hewan dengan rute tertentu (EHSC, 2001). Berdasarkan hasil Uji LD50 konsentrasi bakteri A.
12
hydrophila yang digunakan adalah 108 cfu/ml. Dalam kurun waktu 7 hari, konsentrasi 108 mampu mematikan ikan sebanyak 50% (Lampiran 1).
Perlakuan K- menunjukan tingkat kelangsungan hidup 100±0% karena tidak diberikan uji tantang yaitu injeksi A. hydrophila. Perlakuan RB10 dan RB20 menunjukkan tingkat kelangsungan hidup sebesar 76,7±10% dan 73,3±15,28%. Sedangkan tingkat kelangsungan hidup pada perlakuan K+10 dan K+20 adalah sebesar 26,7±5.77% dan 33,3±5.77%. Hal ini menunjukkan bahwa pemberian ragi bir dalam pakan ikan selama 10 dan 20 hari memberikan pengaruh yang berbeda nyata dengan perlakuan tanpa pemberian ragi bir dalam pakan dalam waktu yang sama.
Tingginya kelangsungan hidup ikan perlakuan RB10 dan RB20 yaitu masing-masing sebesar 76,7±10% dan 73,3±15,28% dapat disebabkan ragi bir yang tepat dosisnya dan lama pemberian pakan uji yang tepat berefek positif terhadap kelangsungan hidup ikan. Namun pada perlakuan RB10 menunjukan tingkat kelangsungan hidup tertinggi, hal ini dapat diartikan bahwa pemberian ragi bir selama 10 hari merupakan lama pemberian paling efektif untuk menstimulasi respon imun. Hal ini tidak jauh berbeda dengan penelitian yang dilakukan oleh Osman (2010) yang menunjukkan bahwa suplementasi ragi bir dengan dosis 0,1-0,6% dalam pakan ikan nila selama 7 hari sudah mampu meningkatkan respon imun. Tingginya kelangsungan hidup pada perlakuan RB10 dapat disebabkan oleh senyawa imunostimulan yaitu seperti β-glukans pada limbah ragi bir diserap dan bekerja dengan baik melawan bakteri sehingga bakteri tidak mampu berkembang biak. Sebagaimana disebutkan oleh White et al. (2002) dalam Ferreira et al. (2010) yang menjelaskan bahwa ragi bir mengandung berbagai macam senyawa imonustimulan seperti β-glukans, asam nukleat dan mannan oligosakarida dan telah diamati oleh Ortuno et al (2002)., Rumsey et al. (1991) dan Lara-Flores et al. (2002) dalam Ferreira et al. (2010) bahwa ragi bir dapat meningkatkan respon imun serta pertumbuhan beberapa spesies ikan seperti ikan kepala emas (Sparus aurata L), ikan salmon (Onchorhynchus mykiss), ikan nila (Oreochromis niloticus). Begitu pula Yoshida et al. (1995) menyampaikan bahwa ragi bir adalah sumber asam nukleat dan β 1,3-glukans yang telah diketahui secara efektif mampu meningkatkan fungsi imun ikan lele Afrika. Suplementasi β 1,3-glukans mengakibatkan aktivasi mekanisme fagositosis dalam tubuh ikan meningkat seiring dengan bertambahnya dosis β 1,3-glukans. Seperti yang disampaikan oleh Hastuti (2012), semakin tinggi dosis β 1,3-glukans yang diberikan, semakin tinggi pula aktivitas fagositosis. Meningkatnya aktivitas fagositosis menunjukkan adanya peningkatan kekebalan tubuh. Spector (1993)
dalam Hastuti (2012) menjelaskan bahwa proses fagositosis terjadi apabila terjadi
kontak antara partikel dengan permukaan sel fagosit. Membran sel kemudian mengalami invaginasi di mana dua lengan sitoplasma menelan partikel sehingga terkurung dalam sitoplasma sel, terletak dalam vakuola yang dilapisi membran (fagosom). Lisosom yang ada di dekatnya melebur ke dalam fagosom dan mengeluarkan enzim-enzim membentuk fagolisosom atau lisosom sekunder sehingga bakteri atau partikel tersebut mati dan hancur dalam sel fagosit tersebut. Sementara itu Baratawijaya (1991) dalam Hastuti (2012) menyebutkan bahwa penghancuran kuman oleh fagositosis terjadi dalam beberapa tingkat yaitu kemotaksis di mana sel sel fagositosis mendekati mikroorganisme, kemudian menangkap, memakan (fagositosis), membunuh dan mencerna.
13 Secara umum respons makan ikan menurun drastis pada saat ikan diinfeksi
A. hydrophila. Namun peningkatan respons makan ikan membaik pada hari ke-3
pasca injeksi dan terus meningkat seiring dengan bertambahnya hari setelah injeksi. Berdasarkan jumlah pakan yang dihabiskan, ikan pada perlakuan K+10 menunjukkan respons makan paling baik, karena kepadatan ikan pada perlakuan K+10 rendah. Kepadatan ikan yang rendah mengakibatkan pemberian pakan menjadi lebih efektif, karena minimnya persaingan ikan untuk tumbuh. Hal ini sesuai dengan Suresh dan Lin (1992) dalam Sumpeno (2005) Benih yang dipelihara dengan kepadatan tinggi dalam wadah sistem konvensional menyebabkan terjadinya persaingan makanan dan kanibalisme apabila makanan yang tersedia terbatas. Padat penebaran ikan yang tinggi dapat meningkatkan biomassa ikan sebagai total hasil produksi, tetapi belum tentu dapat mempertahankan bobot rata-rata ikan. Hal ini dimungkinkan karena pada padat penebaran yang tinggi tingkat persaingan ikan untuk mendapatkan pakan juga meningkat, sedangkan pemanfaatan pakan oleh ikan untuk pertumbuhannya menurun. Hal ini dapat diartikan bahwa semakin rendah kepadatan ikan dalam satu wadah budidaya, maka pemberian pakan pun semakin efektif dan laju pertumbuhan ikan pun semakin optimal. Namun pada perlakuan K+10 dan K+20 bobot rata-rata individu tidak melebihi bobot rata-rata pada ikan di perlakuan RB10 dan RB20, kemungkinannya dikarenakan lambatnya penyembuhan pada ikan di perlakuan K+10 dan K+20 karena tidak adanya senyawa imunostimulan yang membantu proses penyembuhan pasca injeksi A. hydrophila.
Uji tantang dilakukan dengan menggunakan bakteri yang sudah dipastikan
A. hydrophila dengan kepadatan yang diperoleh pada uji LD50 yaitu 108 cfu/ml. Uji tantang dilakukan untuk mengetahui pengaruh lama pemberian pakan mengandung limbah ragi bir terhadap kelangsungan hidup ikan lele. Setelah dilakukan uji tantang, muncul gejala klinis pada semua ikan uji, kecuali pada perlakuan K- tidak menunjukkan gejala klinis karena tidak diinjeksi. Gejala klinis yang muncul yaitu radang, haemoragi dan tukak pada tempat bekas suntikan, kerusakan pada sirip punggung dan sirip ekor serta kematian. Gejala klinis yang muncul tersebut sesuai dengan gejala klinis yang seharusnya muncul pada ikan yang terinfeksi A. hydrophila. Ikan yang terinfeksi A. hydrophila menunjukkan gejala yaitu kematian mendadak pada ikan yang sehat, kurangnya nafsu makan, kelainan berenang, insang pucat, tukak pada kulit (Swann dan White, 1989 dalam Widiani, 2011), ekor atau sirip membusuk, haemoragi (Cipriano, 2001 dalam Widiani, 2011), sirip ekor, dada, dan perut rusak, ikan lemah, dan pada permukaan tubuh terdapat bagian-bagian yang berwarna merah (Maulina et al., 2006). Gejala klinis berupa radang muncul pada 15 jam setelah injeksi kemudian radang tersebut berubah menjadi tukak pada hari ke-1 pasca injeksi. Secara umum tingkat kematian ikan paling tinggi terjadi pada hari ke-3 setelah injeksi.
Perlakuan K+10 dan K+20 menunjukkan tingkat kematian yang tinggi karena tidak adanya senyawa imunostimulan yang bekerja untuk membantu meningkatkan resistensi ikan terhadap bakteri. Melainkan halnya dengan perlakuan RB10 dan RB20 yaitu perlakuan yang diberikan limbah ragi bir, menunjukan tingkat kematian yang rendah, karena adanya senyawa imunostimulan yang bekerja dengan baik dalam meningkatkan resistensi ikan terhadap penyakit.
14 Proses penyembuhan luka pada sebagian ikan uji mulai terjadi pada hari ke-5, dan mengalami penyembuhan pada hari ke-7 hingga hari ke-10 meskipun masih meninggalkan bekas luka. Diameter tukak yang berubah dari besar menjadi kecil merupakan salah satu indikator penyembuhan luka. Namun pada perlakuan K+10 dan K+20 pada akhir pemeliharaan sebagian ikan masih menunjukan gejala klinis sperti kerusakan pada sirip dan tukak. Hal ini diakibatkan oleh tidak adanya senyawa imunostimulan yang membantu proses penyembuhan luka.
KESIMPULAN
Pemberian pakan yang mengandung 3% ragi bir selama 10 hari telah mampu menekan angka kematian akibat infeksi A. hydrophila, sehingga memberikan nilai kelangsungan hidup ikan lele 76,7±10 %.
DAFTAR PUSTAKA
EHSC [Environment, Health and Safety Committee]. 2001. LD50 (Lethal Dose 50%). Environment, Health and Safety Committee [EHSC]. London.
Ferreira et al. 2010. Brewer’s Saccharomyces Yeast Biomass: Characteristic and Potential Applications. Journal of Trends in Food Science and Technology 21. Hastuti S. R. 2012. Suplementasi β-glucan dari ragi roti (Saccharomyces
cerevisiae) dalam pakan terhadap aktivitas fagositosis, aktivitas NBT, total
protein plasma dan aktivitas aglutinasi darah ikan nila (Oreochromis niloticus). Fakultas Pertanian Peternakan, Universitas Muhammadiyah Malang Jalan Raya Tlogomas No 246, Malang
KKP [Kementrian Kelautan dan Perikanan]. 2010. Budidaya Lele Dumbo. http://www.perikanan-budidaya.kkp.go.id. [15 Juli 2012].
Li, Peng dan Delbert M. Gatlin III. 2003. Evaluation of brewers yeast (Saccharomyces cerevisiae) as a feed supplement for hybrid striped bass (Morone chrysops_M. saxatilis). Aquaculture 219 681–692.
Maulina I., Kiki H., Junianto. 2006. Pengaruh Meniran dalam Pakan untuk Mencegah Infeksi Bakteri Aeromonas sp. pada Benih Ikan Mas (Cyprinus
carpio). Fakultas Perikanan dan Ilmu Kelautan. Universitas Padjajaran.
Bandung.
Oliva-Teles, A., Goncalves, P., 2001. Partial replacement of fishmeal by brewers yeast Saccaromyces cerevisae in diets for sea bass Dicentrarchus labrax
15 Osman, HAM., Taghreed, Ibrahim, W E, Soliman and Maather, M Monier. 2010. Influence of Dietary Commercial Beaker’s Yeast, Sacharomyces cerevisae on Growth Performance, Survival, and Immunostimulation of Oreochromis
niloticus Challanged with Aeromonas hydrophila. Journal of Nature of
Science. Hydrobiology Dept. National Research Center Dokki. Egypt.
Ozório, Rodrigo O. A., Leandro Portz, Ricardo Borghesi and José E. P. Cyrino. 2012. Effects of Dietary Yeast (Saccharomyces cerevisia) Supplementation in Practical Diets of Tilapia (Oreochromis niloticus). Animals 2: 16-24.
Rianto E, Ninik M and Endang P. 2005. Retensi protein pada kerbau muda jantan yang mendapat ampas bir sebagai pengganti konsentrat. Prosiding Seminar Nasional AINI V. Malang, Agustus 2005. p. 300.
Rosita, Maria. 2011. Jumat, 30 Desember 2011. Konsumsi Minuman Berakohol. http://industri.kontan.co.id/news/tahun-berganti-konsumsi-bir-meningkat-15 [19 Juni 2012]
Sulastry F. 2009. Uji Toksisitas Akut yang Diukur dengan Penentuan LD50 Ekstrak Daun Pegagan (Centella asiatica (L.) Urban) terhadap Mencit Balb/C. [Skripsi]. Fakultas Kedokteran. Universitas Diponogoro. Semarang.
Sumpeno, Dedi. 2005. Pertumbuhan dan Kelangsungan Hidup Benih Ikan Lele Dumbo Clarias sp. Pada Padat Penebaran 15, 20, 25, dan 30 ekor/liter Dalam Pendederan Secara Indoor Dengan Sistem Resirkulasi. [Skirpsi]. Program Studi Teknologi Manajemen Budidaya Akuakultur. Fakultas Perikanan dan Ilmu Perikanan. Institut Pertanian Bogor.
Widiani, Iis. 2011. Lama Pemberian Pakan Mengandung Tepung Meniran
Phyllanthus niruri dan Bawang Putih Allium sativum Untuk Pencegahan
Infeksi Bakteri Aeromonas hydrophila Pada Ikan Lele Dumbo Clarias sp. [Skirpsi]. Teknologi dan Manajemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Yoshida, T.; Kruger, R.; Inglis, V. 1995. Augmentation of nonspecific protection in african catfish, Clarias-gariepinus (Burchell), by the long-term oral-administration of immunostimulants. Journal of Fish Diseases.
Zerai, B. Desale, Kevin M. Fitzsimons, Robert J. Collier and Glenn C. Duff. 2008. Evaluation of Brewer’s Waste as Replacement of Fish Meal Protein. Journal of The World Aquaculture Society.
16
Lampiran 1. Perhitungan nilai LD50
Kepadatan
Bakteri Mati Hidup
Akumulasi
Mati Hidup Rasio Kematian %
108 5 3 5 3 5/8 62,5
107 3 5 3 5 3/8 37,5
106 2 6 2 6 1/4 25
105 1 7 1 7 1/8 12,5
104 1 7 1 7 1/8 12,5
Selang Proporsi = Kematian d iatas 50% - 50
Kematian di atas 50% - Kematian di bawah 50%
= 62,5 - 50
62,25 – 12,5
= 0.25
Log Negatif LD50 = - log negatif konsentrasi di atas 50 % + selang proporsi = -log 108 + 0,25 = -8 + 0,25 = 8,25 Log LD50 = 8,25 LD50 = 108,25 LD50 = 108
Lampiran 2. Contoh perhitungan parameter penelitian Jumlah Konsumsi Pakan (JKP)
Pengukuran JKP ditentukan dengan menimbang jumlah pakan yang diberikan dikurangi jumlah pakan yang tidak dimakan.
JKP = pakan yang diberikan (gram) – sisa pakan yang tidak termakan (gram)
Tingkat Kelangsungan Hidup atau Survival Rate (SR)
Kelangsungan hidup ikan dapat diketahui dengan persamaan sebagai berikut:
SR = [Nt / No] x 100% Keterangan :
SR = Survival rate (%)
Nt = Jumlah ikan akhir pemeliharaan (ekor)
17
Lampiran 3. Data SR hasil uji tantang
Ulangan SR (%) K- RB10 RB20 K+10 K+20 1 100 80 70 30 30 2 100 70 60 20 30 3 100 80 90 30 40 Rataan 100 76,67 73,33 26,67 33,33 Deviasi 0 5,77 15,28 5,77 5,77
Keterangan: nilai rataan dari hasil uji tantang pertama dan kedua ANOVA SR hasil uji tantang
Sum of Squares df Mean Square F Sig.
Between Groups 11893,33 4 2973,333 37,167 .000
Within Groups 800 10 80,000
Total 12693,333 14
Uji Tukey
Perlakuan Jumlah
Kelompok pada galat = 0.05 1 3 2 K+10 3 26,67 K+20 3 33,33 RB20 3 73,33 RB10 3 76,67 K- 3 100
*Perlakuan RB10 dan RB20 berbeda nyata dengan semua perlakuan
Keterangan: K- : Kontrol negatif
K+10 : Kontrol positif 10 hari K+20 : Kontrol positif 20 hari RB10 : 3% ragi bir 10 hari RB20 : 3% ragi bir 20 hari
18
Lampiran 4. Data rata-rata bobot individu awal dan akhir ikan selama 30 hari pemeliharaan
1. Rata-rata bobot individu awal ikan uji
Ulangan
Rata-rata bobot individu awal (g)
K- RB10 RB20 K+10 K+20 1 5,61 5,78 5,68 5,14 5,41 2 5,02 5,92 5,97 4,95 5,08 3 4,77 5,61 5,74 4,16 5,16 Rataan 5,13 5,77 5,79 4,75 5,22 Deviasi 0,43 0,15 0,15 0,52 0,17
ANOVA Rata-rata bobot individu awal ikan uji
Sum of
Squares df Mean Square F Sig.
Between Groups 2,398 4 .599 5,620 .012
Within Groups 1,067 10 .107
Total 3,464 14
Uji Tukey
Perlakuan Jumlah Kelompok pada galat = 0.05
1 2 K+10 3 4,75 K- 3 5,1333 5,1333 K+20 3 5,2167 5,2167 RB10 3 5,77 RB20 3 5,7967
*Perlakuan K- dan K+20 tidak berbeda nyata dengan semua perlakuan, perlakuan
K+10 berbeda nyata dengan perlakuan RB10 dan RB20 Keterangan: K- : Kontrol negatif
K+10 : Kontrol positif 10 hari K+20 : Kontrol positif 20 hari RB10 : 3% ragi bir 10 hari RB20 : 3% ragi bir 20 hari
19
2. Rata-rata bobot individu akhir ikan uji H-30
Ulangan Biomassa Akhir (g) K- RB10 RB20 K+10 K+20 1 19,68 25,12 21,14 10,78 12,32 2 17,23 27,89 23,58 11,57 13,76 3 18,76 25,09 25,12 12,02 14,75 Rataan 18,56 26,03 23,28 11,46 13,61 Deviasi 1,24 1,61 2,01 0,63 1,22
ANOVA biomassa akhir ikan uji H-30
Sum of
Squares Df Mean Square F Sig.
Between Groups 459,256 4 114,814 57,224 .000
Within Groups 20,064 10 2,006
Total 479,320 14
Uji Tukey
Perlakuan Jumlah
Kelompok pada galat = 0.05 1 3 2 K+10 3 11.46 K+20 3 13.61 K- 3 18.56 RB20 3 23.28 RB10 3 26.03
*Perlakuan RB10 dan RB20 berbeda nyata terhadap semua perlakuan Keterangan: K- : Kontrol negatif
K+10 : Kontrol positif 10 hari K+20 : Kontrol positif 20 hari RB10 : 3% ragi bir 10 hari RB20 : 3% ragi bir 20 hari
20
Lampiran 5. Data jumlah konsumsi pakan selama 30 hari pemeliharaan
Ulangan Jumlah Konsumsi Pakan
K- RB10 RB20 K+10 K+20 1 242,12 239,67 212,99 161,9 182,27 2 257,72 219,02 208,17 128,89 187,37 3 243,94 212,93 212,81 136,52 190,55 Rataan 247,93 223,87 211,32 142,44 186,73 Deviasi 8,53 14,02 2,73 17,28 4,18
ANOVA jumlah konsumsi pakan selama 30 hari pemeliharaan
Sum of Squares df Mean Square F Sig.
Between Groups 19363,622 4 4840,906 40,833 .000
Within Groups 1185,532 10 118,553