6
BAB II
TINJAUAN PUSTAKA
2.1. Penyakit Trofoblas Gestational
Hippocrates (400 BC) pertama kali mendeskripsikan penyakit trofoblas gestational ini dengan “dropsy of the uterus”. Pengamatan lain telah dilakukan oleh Marchand, pertama sekali mengenai molahidatidosa pada tahun 1895. Jaringan trofoblas yang sehat secara agresif menginvasi endometrium dan meningkatkan vaskularisasi uterus, menghasilkan hubungan antara janin dan ibu yang biasa dikenal sebagai plasenta. Invasi merupakan salah satu ciri khas dari suatu keganasan. Untungnya prilaku ganas dapat dikontrol pada trofoblas yang sehat. Namun, pada penyakit trofoblas ganas terjadi kegagalan mekanisme regulasi, sehingga menghasilkan tumor yang sangat invasif, dapat menyebar dan hipervaskular.9
Penyakit trofoblas gestasional terdiri dari kondisi premalignant (molahidatidosa komplit dan parsial) dan kondisi malignant berupa mola invasif, koriokarsinoma dan plasental site trophoblastic tumour(PSTT) serta molahidatidosa dengan nilai β-hGC yang menetap atau meningkat biasa disebut dengan Persisten Trophoblasic Disease (PTD). Bentuk ganas ini biasa disebut dengan penyakit trofoblas ganas/PTG (Gestational
Trophoblastic Neoplasia/GTN). Molahidatidosa ini adalah bentuk
7
2.2. Insidensi dan epidemiologi
Di Inggris, semua kasus penyakit trofoblas gestasional terdaftar secara nasional, dengan data pusat patologi. Kejadian diperkirakan 1-3 : 1000 kehamilan untuk mola komplit dan 3 : 1000 kehamilan untuk mola parsial, negara Barat lainnya melaporkan data yang sama. Penyakit trofoblas gestasional ini lebih sering di Asia daripada di Amerika Utara atau Eropa. Hal ini mungkin karena perbedaan antara populasi dan data rumah sakit, ketersediaan data pusat patologis atau mungkin mencerminkan diet dan pengaruh genetik.9
Penelitian retrospektif yang dilakukan oleh Aziz MF dkk di RS. Cipto Mangunkusumo tahun 1977-1981. Melaporkan angka kejadian yang tinggi dari molahidatidosa sebanyak 1:77 kehamilan dan insidensi malignansi sebanyak 1:185 kehamilan. Dari 406 kasus molahidatidosa, 22,9% berlanjut menjadi keganasan.10
Peningkatan risiko kehamilan mola terlihat pada wanita muda (<16 tahun), tetapi sebagian besar dijumpai pada wanita usia lanjut (>45 tahun). Dengan riwayat kehamilan mola sebelumnya, risiko mola komplit dan parsial meningkat 1%. Dengan riwayat dua kehamilan mola, risiko mola ketiga adalah 15%-20% dan tidak menurun dengan mengubah pasangan. Frekuensi koriokarsinoma dan PSTT masih kurang jelas, dan dapat timbul setelah semua jenis kehamilan. Risiko berkembang menjadi koriokarsinoma sekitar 1:50000 kehamilan, sedangkan data terakhir menunjukkan bahwa PSTT menyumbang 0,2% dari PTG di UK. Risiko PTG juga berhubungan dengan faktor hormonal karena wanita dengan
8 menarche setelah 12 tahun dan penggunaan kontrasepsi oral akan meningkatkan risiko. Selain itu, risiko keganasan setelah mola hidatidosa dikaitkan beberapa jenis kontrasepsi oral, jika dikonsumsi saat β-hCG masih meningkat. Hormon ini sangat penting untuk diagnosis, manajemen dan pengawasan PTG selanjutnya.9
2.3. Patofisiologi Penyakit Trofoblas Ganas
Kehamilan molahidatidosa dan penyakit trofoblas ganas berasal dari trofoblas plasenta. Molahidatidosa merupakan lesi prekursor pada beberapa keganasan trofoblas.12
Kajii et al dan Lawler dkk, menunjukkan bahwa pada kasus molahidatidosa lebih banyak ditemukan kelainan keseimbangan translokasi dibandingkan dengan populasi normal (4,6% dan 0,6%). Ada kemungkinan pada wanita dengan kelainan sitogenetik seperti ini, lebih banyak mengalami gangguan proses meiosis berupa nondysjunction, sehingga lebih banyak terjadi ovum yang kosong atau yang intinya tidak aktif.13
Banyak teori yang disebutkan tentang patogenesis molahidatidosa komplit, yaitu:14
1. Hertig et al menganggap bahwa pada MH terjadi insufisiensi peredaran darah akibat matinya embrio pada minggu ke 3-5 (missed abortion), sehinggga terjadi penimbunan cairan dalam jaringan mesenkim vili dan terbentukah kista-kista yang makin lama makin besar, sampai akhirnya terbentuklah gelembung mola, sedangkan
9 proliferasi trofoblas merupakan akibat dari tekanan vili yang oedemateus tadi.
2. Park, mengatakan bahwa yang etiologi primer adalah adanya jaringan trofoblas yang abnormal, baik berupa hiperplasi, displasi, maupun neoplasi. Bentuk yang abnormal ini disertai pula dengan fungsi yang abnormal. Keadaan ini menekan pembuluh darah, yang akhirnya menyebabkan kematian embrio.
3. Teori yang sekarang dianut adalah teori sitogenetik. Secara sitogenetik umumnya kehamilan molahidatidosa komplit terjadi karena sebuah ovum yang tidak berinti (kosong) atau yang intinya tidak berfungsi, dibuahi oleh sperma yang mengandung haploid 23 X, terjadilah hasil konsepsi dengan kromosom 23 X, yang kemudian mengadakan duplikasi menjadi 46 XX. Jadi umumnya MHK bersifat homozigot, wanita dan berasal dari bapak (androgenetik). Jadi tidak ada unsur ibu sehingga disebut Diploid Androgenetik.
Teori Diploid Androgenetik
Seperti diketahui, kehamilan yang sempurna harus terdiri dari unsur ibu yang akan membentuk bagian embrional (anak) dan unsur ayah yang diperlukan untuk membentuk bagian ekstraembrional (plasenta, air ketuban, dll) secara seimbang. Karena tidak ada unsur ibu, pada MHK tidak ada bagian embrional (janin). Yang ada hanya bagian ekstraembrional yang paologis berupa vili korialis yang mengalami degenerasi hidropik seperti anggur. Ovum kosong bisa terjadi karena
10 gangguan pada proses meosis, yang seharusnya diploid 46 XX pecah menjadi 2 haploid 23 X, terjadi peristiwa yang disebut nondysjunction, dimana hasil pemecahannya adalah 0 dan 46 XX. Pada molahidatidosa komplit ovum inilah yang dibuahi. Gangguan proses meosis ini, antara lain terjadi pada kelainan struktural kromosom, berupa balance translocation.15
Molahidatidosa komplit dapat terjadi pula akibat pembuahan ovum kosong oleh 2 sperma sekaligus (dispermi). Bisa oleh dua haploid 23X, atau satu haploid 23 X dan atu haploid 23Y. Akibatnya bisa terjadi 46 XX atau 46 XY, karena pada pembuahan dengan dispermi tidak terjadi endoreduplikasi. Kromosom 46 XX hasil reduplikasi dan 46 XX hasil pembuahan dispermi, walaupun tampak sama, namun sesungguhnya berbeda, karena yang pertama berasal dari satu sperma (homozigot) sedangkan yang kedua berasal dari dua sperma (heterozigot). Ada yang menganggap bahwa 46XX heterozigot mempunyai potensi keganasan lebih besar. Pembuahan dispermi dengan dua haploid 23 Y (46 YY) dianggap tidak pernah bisa terjadi (nonviable).14
Pada molahidatidosa parsial, Secara sitogenetik MHP terjadi karena ovum normal dari ibu (23 X) dibuahi secara dispermi. Bisa oleh dua haploid 23 X, satu haploid 23 X san satu haploid 23Y atau dua haploid 2 Y. Hasil konsepsi bisa berupa 69 XXX, 69 XXY, 69 XYY. Kromosom 69 YYY tidak pernah ditemukan. Jadi MHP mempunyai satu haploid ibu dan dua haploid ayah sehingga disebut Diandro Triploid. Karena disini ada unsur ibu, ditemukan bayi. Tetapi komposisi unsur ibu dan unsur ayah tidak seimbang, satu berbanding dua. Unsur ayah yang tidak normal itu
11 menyebabkan pembentukan plasenta yang tidak wajar, yang merupakan gabungan dari vili korialis yang normal dan yang mengalami degenerasi hidropik. Oleh karena itu fungsinya pun tidak bisa penuh sehingga janin tidak bisa bertahan sampai besar. Biasanya kematian terjadi sangat dini.13
Teori Diandro Triploid
Berbeda dengan molahidatidosa komplit, pada molahidatidosa parsial sama sekali tidak ditemukan gejala maupun tanda-tanda yang khas. Keluhannya pada permulaan sama seperti kehamilan biasa. Kalau ada perdarahan sering dianggap seperti abortus biasa. Jarang sekali ditemukan MHP dengan besar uterus yang melebihi tuanya kehamilan. Biasanya sama atau lebih kecil. Dalam hal terakhir disebut Dying Mole. Gambaran USG tidak selalu khas, tapi dapat didiagnosis bila ditemukan hal-hal sebagai berikut. Pada jaringan plasenta tampak gambaran yang menyerupai kista-kista kecil disertaipeningkatan diameter transversa dari kantong janin.16
Trofoblas normal terdiri dari sitotrofoblas, sinsitiotrofoblas dan trofoblas intermediet. Sinsitiotrofoblas menginvasi stroma endometrium dengan implantasi blastokis dan merupakan jenis sel yang memproduksi hCG. Fungsi sitotrofoblas untuk memasok syncytium dengan sel selain membentuk bagian luar korion yang menjadi vili korionik yang menutupi kantung korionik. Vili korionik berbatasan dengan endometrium dan lapisan basal endometrium bersama-sama membentuk plasenta fungsional untuk nutrisi ibu janin dan pertukaran sisa metabolisme.
12 Trofoblas intermediet terletak pada vili, tempat implantasi, dan kantung korionik. Semua 3 jenis trofoblas dapat berkembang biak menjadi Penyakit Trofoblas Ganas.12
Dasar molekuler dan seluler dalam pengembangan sebenarnya dari penyakit trofoblas ganas ini masih kurang dipahami, penyakit trofoblas ganas ini telah lama dianggap sebagai kelompok penyakit yang timbul dari transformasi neoplastik sel trofoblas. Namun penelitian klinikopatologi baru-baru ini menunjukkan bahwa analisis molekuler dari kehamilan trofoblas ganas sebagian besar didasarkan pada karakteristik profil ekspresi gen dari berbagai tipe keganasan dan pola dari ekspresi gen yang unik dapat digunakan untuk membedakan populasi trofoblas yang berbeda pada awal plasenta yang sehat. Setelah transformasi sel induk trofoblas, yang kemungkinan adalah sititrofoblas, program diferensiasi spesifik menentukan jenis tumor trofoblas yang berkembang.12
13
Gambar 2.3.1 . Patogenesis penyakit trofoblas ganas (dikutip dari Shih IeM, 2007, Gestational Trophoblastic Neoplasia-pathogenesis and potential therapeutic
targets)12
Disamping studi tentang histogenesis dari kehamilan trofoblas ganas, penelitian saat ini difokuskan pada faktor biologi dari keganasan dengan menentukan karakteristik ekspresi gen yang penting dalam proses tumorigenesis.12
2.4. Diagnosis dan Stadium PTG
Molahidatidosa (komplit dan parsial) paling sering datang dengan keluhan perdarahan pervaginam pada trimester awal kehamilan. Sering terdiagnosis pada pemeriksaan ultrasonografi trimester pertama kehamilan dengan gambaran berupa massa heterogen menyerupai badai salju (snowstorm) tanpa adanya gambaran janin pada mola komplit,
14 dijumpai juga kista ovarium teka lutein. Pada akhirnya harus dibuktikan dengan pemeriksaan histopatologi.10
Pilihan metode yang paling aman untuk evakuasi adalah dilatasi dan kuretase hisap dengan panduan ultrasonografi untuk memastikan pengosongan yang memadai isi rahim dan untuk menghindari perforasi uterus. Sebagian wanita yang mengalami keguguran atau yang menjalani terminasi kehamilan dengan indikasi medis, dapat menjadi kasus PTG yang tidak terduga jika tidak dilakukan pemeriksaan histopatologi jaringan konsepsi rutin, terlambatnya diagnosis akan meningkatkan morbiditas. Pemeriksaan histologis dari setiap pengakhiran kehamilan tidaklah praktis, pengukuran sederhana β-hCG 3-4 minggu paska kuretase dapat dilakukan untuk memastikan nilai β-hCG kembali normal. Semua wanita dengan diagnosis kehamilan mola memerlukan pemantauan nilai hCG untuk melihat kemungkinan kambuhnya penyakit, peningkatan dan pendataran nilai β-hCG pada tiga dan dua pemeriksaan berturut. Pengulangan biopsi untuk mengkonfirmasi perubahan ganas tidak disarankan karena berisiko memicu perdarahan yang mengancam jiwa.10
Bentuk koriokarsinoma dan PSTT / ETT bisa jauh lebih sulit untuk didiagnosis karena penyakit dapat berkembang dalam hitungan bulan atau tahun setelah kehamilan sebelumnya. Oleh karena itu penting untuk mengukur hCG pada wanita usia subur dengan penyakit metastasis yang tidak dapat dijelaskan. Biopsi lesi tanpa kemampuan untuk mengendalikan perdarahan sangat berisiko pada penyakit ini dan tidak diperlukan untuk memulai kemoterapi. Namun, pengangkatan seluruh massa dapat
15 memberikan konfirmasi histologis untuk konfirmasi diagnostik atau analisis genetik.10
Hampir keseluruhan pasien PTG paska molahidatidosa terdeteksi melalui pemantauan hCG. Informasi yang diperlukan untuk menentukan terapi dapat diperoleh dari riwayat klinis, pemeriksaan, pengukuran hCG serum dan USG doppler pelvik untuk konfirmasi tidak adanya kehamilan, untuk mengukur ukuran dan volume rahim, penyebaran penyakit pelvis dan vaskularisasi. Penilaian pulsatility index dengan doppler nantinya dapat menjadi faktor prognostik independen untuk resistensi terhadap kemoterapi agen tunggal metotreksat (MTX) dan saat ini sedang dievaluasi dalam penelitian prospektif. Metastasis paru adalah penyebaran yang paling umum, sehingga rontgen dada sangat penting.10
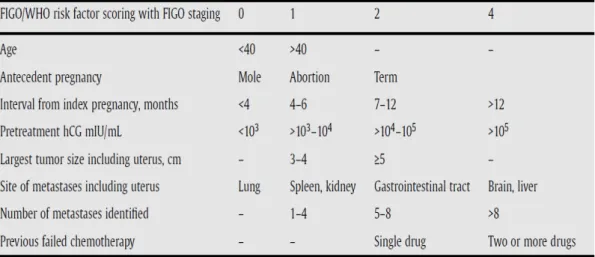
Computed tomography (CT) dada tidak diperlukan jika rontgen dada normal, karena penemuan mikrometastasis, yang didapati pada 40% pasien, tidak mempengaruhi hasil akhir. Namun, jika dijumpai lesi pada toraks, magnetic resonance imaging (MRI) otak dan CT tubuh diperlukan untuk menyingkirkan penyebaran penyakit lainnya, seperti pada otak dan hati yang secara signifikan akan mengubah penanganan. FIGO melaporkan data pada penggunaan sistem skor prognostik dan sistem stadium anatomis pada PTG. Sejak tahun 2002, semua penanganan PTG harus menggunakan sistem ini untuk memungkinkan perbandingan data.10
Skor prognostik digunakan untuk memprediksi kemungkinan resistensi terhadap kemoterapi agen tunggal dengan MTX atau Act-D. Skor 0-6 dan ≥7 menunjukkan risiko rendah dan tinggi terhadap resistensi.
16 Risiko tinggi hampir tidak memiliki kemungkinan sembuh dengan terapi agen tunggal dan membutuhkan pemberian agen multiple. Stadium anatomis tidak membantu penentuan terapi, tetapi memberikan informasi tambahan untuk membantu klinisi yang membutuhkan perbandingan data antar pusat PTG.11
Berdasarkan FIGO 2012, diagnosis PTG dibuat berdasarkan peningkatan kadar hCG, jika memungkinkan diperlukan bukti histologis atau radiologis. Kriteria diagnosis PTG meliputi:3
1. Sekurang-kurangnya 4 nilai plateu hCG yang meningkat secara persisten (hari 1, 7, 14 dan 21) atau lebih lama, atau peningkatan hCG secara sekuensial selama 2 minggu (hari 1, 7, 14) atau lebih lama. 2. Metastasis paru yang ditemukan pada X-Ray toraks.
Pemeriksaan penunjang yang diperlukan dalam diagnosis maupun monitoring PTG adalah:3
1. Pemeriksaan klinis (menilai ada tidaknya metastasis vagina) 2. Pengukuran hCG serum serial mingguan
3. Pemeriksaan darah lengkap dan trombosit, PT, PTT, fibrinogen, BUN, kreatinin, tes fungsi hati
4. Foto toraks
5. CT Scan atau MRI otak (menilai ada tidaknya metastasis otak)
6. CT Scan hati bila ada indikasi. CT Scan seluruh tubuh biasanya dilakukan pada pasien yang memiliki metastasis paru
17 7. Kuretase harus dilakukan bila ada perdarahan uterus. Biopsi dilakukan pada daerah yang memungkinkan. Ada risiko perdarahan hebat pada tempat biopsi.
8. MRI bila diindikasikan.
9. T4, tes fungsi tiroid bila diindikasikan.
10. Scanning selektif dengan antibodi anti-hCG radioaktif iodin atau indium bila ada resistensi terhadap kemoterapi.
Pada tahun 2000, FIGO merekomendasikan stadium klinis tumor trofoblastik gestasional seperti di bawah ini:3
Stadium FIGO Deskripsi
I Tumor trofoblastik gestasional terbatas pada korpus uterus
II Tumor trofoblastik gestasional meluas ke adneksa atau ke vagina, tetapi terbatas pada struktur genitalia
III Tumor trofoblastik gestasional meluas ke paru, dengan atau tanpa keterlibatan traktus genitalia
IV Adanya metastasis
Table 2.4.1. Stadium Klinis PTG, FIGO 2000 (dikutip dari Ngan HY, 2003, FIGO Cancer Report 2012 : Trophoblastic Disease)
Molahidatidosa tidak boleh dikategorikan stadium 0 karena bila hCG tetap meningkat dan pasien memerlukan kemoterapi, diperlukan penilaian ulang stadium.3
18 Pada tahun 2000, FIGO menerima sistem skor WHO berdasarkan faktor prognostik yang pertama kali dikenalkan oleh Bagshawe. Nilai untuk faktor risiko adalah 1,2 dan 4. Ambang batas neoplasia risiko rendah dan tinggi disepakati oleh FIGO pada angka 6. Skor ≤ 6 dikategorikan risiko rendah dan skor ≥ 7 dikategorikan risiko tinggi. Kombinasi stadium FIGO dan WHO telah disetujui sejak tahun 2002.3
Tabel 2.4.2. Sistem skoring FIGO/WHO berdasarkan faktor prognostik (dikutip dari Ngan HY, 2003, FIGO Cancer Report 2012 : Trophoblastic Disease. Int J Gynecol
Obstetri)
2.5. Penatalaksaan PTG risiko rendah
PTG risiko rendah, di mana skor WHO kurang atau sama dengan 6 pada FIGO stadium I-III. Hampir seluruh pasien risiko rendah diterapi dengan kemoterapi agen tunggal dengan MTX atau Act-D. Kemoterapi agen tunggal menunjukkan 50-90% kasus remisi. Terdapat variasi dalam dosis, frekuensi, dan rute pemberian kemoterapi. Pasien yang gagal pada terapi lini pertama, biasanya disebabkan resistensi, dapat dilanjutkan dengan lini kedua bahkan lini ketiga, dengan survival sampai 100%.17,18
19
Gambar 2.5.1. Panduan penatalaksanaan PTG risiko rendah (dikutip dari May T, 2011. Chemotherapy Research and Practice : Current Chemotherapeutic
Management of Patient with Gestational Trophoblastic Neoplasia )
2.5.1. Rejimen kemoterapi agen tunggal
Berikut ini berbagai macam rejimen pemberian kemoterapi agen tunggal :3,9 Molahidatidosa komplit & parsial (PersistenTrophoblastic Disease/PTD) Koriokarsinoma (hislopatologi) Diagnosis PTG
Penjajakan, staging dan scoring faktor risiko
hCG, Darah rutin, RFT, LFT, HST, Foto toraks, USG pelvic (jika foto toraks (+) CT/USG abdomen, terutama hepar, CT & MRI otak (jika ada indikasi)
Stadium III, skor Stadium II, skor
Stadium I, skor
Kemoterapi agen tunggal
Ganti agen atau rejimen kemoterapi
Kemoterapi kombinasi (pertimbangan histerektomi) Follow up (klinis & hCG 12
bulan sebelum diperbolehkan hamil) No Response No Response No Response Resolus i
Kemoterapi multi agen
Kemoterapi multi agen
20 a. Metotreksat 0,4 mg/kg intramuskular selama 5 hari, berulang setiap 2 minggu. Ini adalah satu dari protokol konvensional pada PTG dan masih digunakan di Universitas Yale. Rejimen kemoterapi ini masih merupakan protokol standar di Chicago, di mana obat ini digunakan secara intravena. Angka kegagalan 11-15% untuk penyakit non metastasis dan 27-33% untuk penyakit dengan metastasis (Level of evidence C).
b. Metotreksat dengan selingan pemberian leukovorin. Metotreksat 50 mg secara intramuskular atau 1mg/kgBB 4 dosis diselingi leukovorin 15 mg atau 0,1 mg/kgBB 24-30 jam setelah setiap dosis metotreksat. Protokol ini paling banyak dianut di Inggris dan Amerika dengan angka kegagalan 20-25% (Level of evidence C).
c. Metotreksat 50mg/m2 intramuskular yang diberikan setiap minggu. Regimen ini berhubungan dengan angka kegagalan sebanyak 30%. Bila terjadi kegagalan, diberikan metotreksat 0,4 mg/kg intramuskular untuk 5 hari. Rejimen ini dapat diganti dengan aktinomisin-D 12mikrogram/kg selama 5 hari (Level of evidence C).
d. Aktinomisin-D 1,25 mg/m2 secara intravena selama 2 minggu. Protokol ini memiliki angka kegagalan sebesar 20%. Protokol ini dapat menjadi alternatif mingguan dengan protokol metotreksat. Aktinosmisin D dapat menyebabkan kulit terkelupas bila terinfiltrasi ke kulit dan harus diinjeksi via infus intravena yang baru. Bila terdapat ekstravasasi, area ini harus diinfiltrasi dengan hidrokortison 100 mg dan lidokain 2 mL.
21 e. Aktinomisin-D 12 mikrogram/kg yang diberikan secara intravena atau 0,5 mg secara intravena setiap hari selama 5 hari, diulangi setiap 2 minggu. Protokol ini adalah alternatif untuk protokol metotreksat selama 5 hari. Protokol ini dapat digunakan pada pasien yang memiliki gangguan hepatik. Angka kegagalan ditemukan sebesar 8%.
f. Metotreksat 250 mg drips selama 12 jam. Kemoterapi ini adalah bagaian metotreksat pada protokol EMA-CO (etoposide, metotreksat dengan leucovorin, aktimosiin D, yang diberikan pada hari 1 dan 2 serta siklofosfamid dan vinkristin (Oncovin) yang diberikan pada hari 8). Regimen ini memiliki angka kegagalan sebesar 30% (Level of evidence C).
Bila regimen di atas tidak berespon, hal ini dikarenakan ketidakcukupan pajanan sel selama siklus pemberian obat kemoterapi, tidak mencapai kadar efektif obat di sirkulasi. Dapat digunakan metotreksat 0,4 mg/kg setiap hari selama 4 hari atau aktinomisin D 12 mikrogram/kg selama 5 hari sebelum dijumpai indikasi kemoterapi multiagen.6
Pada meta analisis Cochrane tahun 2009, ditunjukkan bahwa aktinomisin D ditemukan lebih superior dibandingkan metotreksat (Level of evidence A). RCT baru yang membandingkan metotreksat intramuskular mingguan dan aktinomisin D intravena setiap 2 minggu menunjukkan respon yang lebih baik dan toksisitas sedang pada grup aktinomisin D
22 (Level of evidence A). Beberapa pedoman juga telah meletakkan aktinomisin D sebagai regimen lini pertama.19
Evakuasi sekunder sangatlah terbatas, hal ini dilakukan bila hCG <5000 IU/L. Akan tetapi, bila kasus yang didapat adalah jaringan mola parsial, dapat dipertimbangkan untuk histerektomi. Histerektomi akan menurunkan durasi dan dosis kemoterapi.20,21
2.5.2. Kemoterapi Konsolidasi
Setelah nilai β-hCG mencapai normal, setidaknya dibutuhkan tambahan 2 siklus kemoterapi lagi (3 siklus kemoterapi konsolidasi), karena tidak terdeteksinya β-hCG di serum menunjukkan bahwa jumlah sel ganas di dalam tubuh kurang dari 105, dan ini tidak berarti penyakit sudah benar-benar hilang.3
Lybol dkk tahun 2012 mencoba membandingkan angka kekambuhan antara pemberian kemoterapi konsolidasi di Belanda (2 siklus kemoterapi) dan Inggris (3 siklus kemoterapi), didapati angka kekambuhan lebih tinggi pada pemberian 2 siklus kemoterapi konsolidasi yaitu 8,3% berbanding 4%.20
2.6. Faktor Prognostik Keberhasilan Pemberian Kemoterapi MTX
Faktor-faktor yang berpengaruh signifikan secara statistik terkait dengan respon terhadap pemberian MTX tunggal pada PTG risiko rendah adalah usia pasien, nilai hCG pra kemoterapi dan skor FIGO.22
23 Davis dkk tahun 2012 menganalisis faktor-faktor yang berhubungan dengan resistensi terhadap pemberian MTX tunggal, didapati hubungan yang signifikan resistensi terhadap faktor metastasis, penigkatan skor FIGO, histopatologi (terutama koriokarsinoma) dan kadar b-hCG yang lebih tinggi.23
1. Usia
Pada penelitian Chalouhi dkk (2009), pasien resisten MTX didapati lebih tua (33,7 tahun, SD 7,81) dibandingkan dengan pasien remisi komplit (31,7 tahun, SD 9,2).22 Nilai median (kelompok remisi komplit dan resisten) yang sama (median : 30 tahun) dijumpai pada penelitian yang dilakukan Trommel dkk (2006) di Belanda.8 Sementara Chan dkk (2006) mendapat hasil sedikit lebih tinggi, yaitu median usia untuk kelompok remisi komplit adalah 33,7 tahun dan kelompok resisten adalah 33,6 tahun.24
Penelitian-penelitian sebelumnya tidak semua sepakat mengenai peran usia terhadap respon kemoterapi MTX ini, tanpa adanya perbedaan yang signifikan antara kedua hasil, namun beberapa penulis menyatakan usia yang lebih tua cenderung menjadi faktor resistensi, sementara peneliti lain menyatakan bahwa usia tidak berpengaruh terhadap resistensi.22,23,25,26
2. Hasil Patologi Anatomi
Mengingat angka kejadian molahidatidosa komplit adalah yang terbanyak dari seluruh pasien penyakit trofoblas gestasional, beberapa
24 penelitian menunjukkan hasil yang serupa. Chan dkk (2006), mendapat hasil terbanyak adalah molahidatidosa komplit (kelompok remisi komplit 30 pasien (83%) dan kelompok resisten 35 pasien (66%)).24 Maesta dkk (2003) dan Gillani dkk (2013) juga mendapat hasil yang tidak jauh berbeda.6,27
Garrett dkk (2002), menyatakan bahwa hasil patologi anatomi jaringan (molahidatidosa komplit atau parsial) merupakan faktor prediktor independen atas kebutuhan 1 dosis kemoterapi lebih banyak.28
Sebuah penelitian lain juga menyebutkan bahwa hasil histopatologi koriokarsinoma meningkatkan risiko persisten dan resistensi kemoterapi. David dkk (2012) menyebutkan diagnosis koriokarsinoma mengalami resistensi terhadap MTX sebesar 31%, lebih besar dibandingkan dengan PTG postmolar sebesar 17%.23,29
3. Nilai β-hCG pra Kemoterapi
Banyak studi yang menyatakan bahwa nilai hCG pra kemoterapi yang tinggi secara signifikan meningkatkan risiko resisten MTX.1,22,30
Trommel dkk. (2006), mendapatkan nilai median kelompok resisten MTX lebih tinggi dibanding kelompok remisi komplit (median 2098mcg/L (62-12.000) dan 251mcg/L (6,2 – 12.000)).8 Sesuai dengan hasil penelitian Davis dkk (2012) yang menyebutkan tingginya kadar hCG pra kemoterapi memiliki ubungan yang bermakna dengan peningkatan risiko resistensi (p=0,001).23
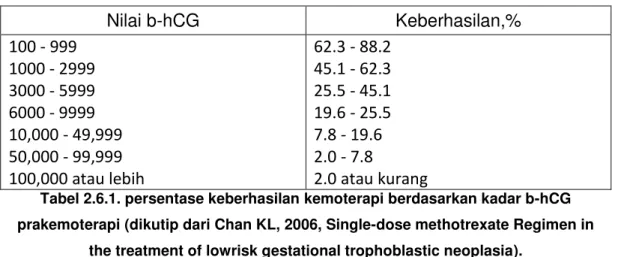
25 Hal ini didukung hasil penelitian Chan dkk, 2006, yang mendapatkan hasil penurunan keberhasilan kemoterapi pada nilai b-hCG yang semakin tinggi, dapat dilihat pada tabel di bawah ini.24
Nilai b-hCG Keberhasilan,% 100 - 999 1000 - 2999 3000 - 5999 6000 - 9999 10,000 - 49,999 50,000 - 99,999 100,000 atau lebih 62.3 - 88.2 45.1 - 62.3 25.5 - 45.1 19.6 - 25.5 7.8 - 19.6 2.0 - 7.8 2.0 atau kurang
Tabel 2.6.1. persentase keberhasilan kemoterapi berdasarkan kadar b-hCG prakemoterapi (dikutip dari Chan KL, 2006, Single-dose methotrexate Regimen in
the treatment of lowrisk gestational trophoblastic neoplasia).
4. Metastasis
Chan dkk (2006) mendapati persentase yang lebih tinggi untuk metastasis pada kelompok resisten dibanding kelompok remisi komplit, yaitu kelompok remisi komplit hanya 2%, sementara kelompok resisten adalah 17,5%.24
Davis dkk (2012), pasien dengan metastasis memiliki persentase resistensi yang lebih tinggi (31%) dibandingkan dengan pasien tanpa metastasis (17%).23
26
5. Skor FIGO resiko rendah
Banyak penelitian melaporkan bahwa skor FIGO yang lebih tinggi secara signifikan meningkatkan risiko resisten MTX.1,22,30 Davis dkk (2012)
mendapati peningkatan skor FIGO berhubungan dengan resistensi MTX tunggal, yaitu 13% pada skor 0-2, 32% pada skor 3-4 dan 48% pada skor 5-6.23
6. Siklus kemoterapi
Trommel dkk (2006), mendapat hasil median jumlah siklus kemoterapi MTX kelompok remisi komplit adalah 5 siklus (range 3-17 siklus), sementara pada kelompok resisten adalah 7 siklus (range 3-16 siklus).8
2.7. Resistensi MTX
MTX merupakan antagonis folat, mekanisme kerja MTX terhadap keganasan adalah melalui penghambatan dihidrofolat reduktase (DHFR), suatu enzim yang berpartisipasi dalam sintesis tetrahidrofolat. Afinitas MTX terhadap DHFR sekitar seribu kali lipat daripada folat. Asam folat diperlukan untuk sintesis denovo dari timidin nukleosida, yang dibutuhkan dalam sintesis DNA. Juga folat sangat penting untuk purin dan pirimidin sebagai dasar biosintesis, sehingga biosintesis DNA, RNA, thymidylates dan protein akan terhambat, dan akan berakhir dengan kematian sel, terutama sel yang aktif membelah.31,32
27
Gambar 2.7.1. Mekanisme kerja MTX sebagai antagonis folat (dikutip dari Rajagopalan PT, 2002, Interaction of dihidrofolate reductase with Methotrexate:
Ensemble and Single-molecule kinetics)
Meskipun pengembangan rejimen kemoterapi yang efektif dari MTX telah meningkatkan terapi sejumlah keganasan, untuk mencapai masa bebas penyakit yang lama masih sangat sulit, bahkan pada keganasan yang sensitif kemoterapi. Khasiat MTX seperti agen kemoterapi lainnya akhirnya dibatasi oleh resistensi.18
Beberapa study mendapatkan angka resistensi MTX yang bervariasi, tetapi masih dibawah 50%, seperti Lurain dkk (1995), mendapat hasil resisten MTX sebesar 10,7% (27 pasien).33 Chalouhi dkk (2009) mendapatkan angka resistensi sebesar 22,5% (32 pasien).22
Chan dkk, 2006, dalam jurnalnya mengatakan bahwa penggunaan kemoterapi rejimen yang berbeda dari MTX tunggal seperti, MTX 5hari
28 ataupun MTX+FA 8hari dapat digunakan dengan angka remisi komplit yang tinggi yaitu 60-90%.24
Tetapi sampai saat ini, belum ada kesepakatan internasional mengenai definisi resisten terhadap kemoterapi lini pertama ini. Beberapa klinisi mendefinisikan resistensi sebagai pendataran atau peningkatan nilai hCG serum dan/atau adanya perkembangan metastasis baru. Sebagai contoh, Mc.Neish dkk tahun 2002 mendefinisikan resistensi dengan adanya peningkatan nilai β-hCG (tanpa disebutkan berapa persen kenaikannya) atau jika dijumpai nilai yang tetap pada dua kali pemeriksaan.18 Matsui H dkk tahun 2005 mendefinisikan resistensi dengan adanya nilai tetap (kurang dari 50% penurunan hCG titer) atau peningkatan nilai hCG pada dua siklus berturut.26
2.8. Pemantauan Paska Kemoterapi dan Pemeriksaan hCG
Risiko relaps setelah kemoterapi adalah sampai 3% dan diperlukan monitoring hCG serial. Metode kontrasepsi apapun dapat digunakan mencakup kontrasepsi oral. hCG dimonitor setiap minggu sampai 6 minggu post kemoterapi sebelum penggantian ke analisis urin. Penelitian Pfeffer dkk. (2007) menunjukkan bahwa pada 15.279 pasien tidak ada rekurensi yang signfikan setelah terapi MTX. Akan tetapi, pada peneltiian Rustin dkk. (1996) pada 26 pasien yang menerima kemoterapi kombinasi, ditunjukkan adanya metastasis.34,35
29
Tabel 2.8.1. Protokol follow up pasien PTG setelah kemoterapi (UK) (dikutip dari Seckl MJ, 2013, Gestational Trophoblastic Disease: ESMO Clinical Practice
Guidelines for diagnosis, treatment and follow-up)
2.9. Evaluasi hormon human Chorionic Gonadotrophin (hCG)
Evaluasi hCG serial dapat digunakan untuk diagnosis kehamilan normal dan abnormal. hCG adalah hormon glikoprotein yang memiliki 2 subunit, alfa dan β, dan merupakan indeks yang penting untuk penyakit tropoblastik gestasional. hCG mencakup subunit alfa pada LH dan subunit β pada TSH. Pemeriksaan untuk deteksi hCG menggunakan antibodi yang langsung pada subunit β. Pada kehamilan, subunit ini biasanya intak dan hiperglikosilasi selama trimester pertama. Di sisi lain, β-hCG yang meningkat akibat kanker dapat tampak pada beberapa bentuk atau fragmen yang berbeda meliputi β nicked bebas, peptida c terminal, β-hCG hiperglikosilasi. Pada tahun 2011, SOCG menunjukkan bahwa level hCG dapat memberikan hasil positif palsu sampai 800 mIU/mL. Hal ini disebabkan antibodi antimencit, antibodi heterofil, dan interface protein
30 non spesifik. Lebih lanjut, hal ini disebabkan banyaknya variasi alat pemeriksaan yang digunakan.36
Pemantauan β-hCG juga dilakukan sebagai monitor terapi pada PTG, beberapa peneliti berupaya membuat kurva regresi β-hCG sebagai alat untuk memantau keberhasilan pemberian kemoterapi ataupun kecenderungan resistensi yang dapat dideteksi lebih dini.36
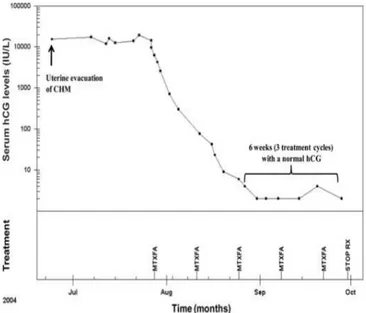
Seckl dkk. (2010) menggambarkan kurva regresi β-hCG pada PTG risiko rendah yang diterapi dengan kemoterapi lini tunggal terhadap satu pasien.9
Gambar 2.9.1. Grafik penanda pengobatan tumor (hCG) mendemonstrasikan seorang pasien yang respon terhadap kemoterapi risiko rendah. Evakuasi molahidatidosa komplit, nilai plateu hCG mengindikasikan PTG persisten, maka pasien diberikan MTX dan folinic acid (MTX-FA). Terapi dilanjutkan sampai 6 minggu normal (<5 IU/l). (dikutip dari Seckl MJ, 2010, Gestational trophoblastic disease)
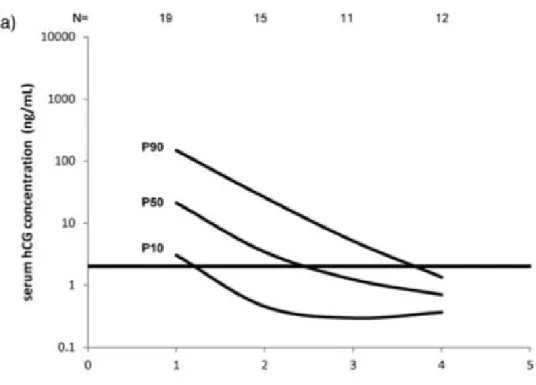
Trommel dkk (2009), merancang suatu kurva regresi β-hCG selama terapi PTG risiko rendah untuk identifikasi resistensi MTX secara dini. Dari
31 kurva tersebut didapat 2,5% pasien mencapai nilai β-hCG normal setelah siklus pertama (minggu ke-2) dan 50% pasien mencapai nilai normal β-hCG setelah mendapat kemoterapi siklus ke-4 (minggu ke-8). Sementara pada persentil 97.5 normalisasi berakhir di kadar β-hCG 4,3 ᴫg/L (cut off 2 ᴫg/L) disebabkan kurva dihentikan pada siklus ke-8.8
Berdasarkan kurva resistensi yang dibandingkan dengan kurva regresi normal, sebelum memulai siklus kemoterapi didapati 4 pasien resisten MTX (13,8%) berada diatas garis p97.5 kurva remisi komplit. Sebelum memasuki siklus ke-4, didapati 22 dari 29 pasien (76%) resisten MTX berada di atas garis p97.5.8
Dengan analisis kurva ROC dapat diidentifikasi 14% pasien yang membutuhkan terapi alternatif sebelum dimulai kemoterapi lini pertama dengan spesifisitas 97.5% (cutoff 9.600ᴫg/L). Pengukuran hCG serum sebelum kemoterapi MTX siklus ke-4 (minggu ke-7), dapat mengidentifikasi 50% pasien yang tidak respon terhadap kemoterapi MTX dengan spesifisitas 97.5% (cutoff 56 ᴫg/L). Pengukuran hCG serum sebelum kemoterapi MTX siklus ke-6 (minggu ke-11), dapat diidentifikasi 60% pasien yang tidak respon terhadap kemoterapi MTX dengan spesifisitas 97.5% (cutoff 24 ᴫg/L).8
32
Gambar 2.9.2. A. Kurva regresi hCG serum normal pasien yang mendapat MTX (grup control, n=79) B. Kurva regresi hCG serum normal grup kontrol dengan pengukuran individual pada grup kasus (n=29) (dikutip dari Trommel FC, 2005, Diagnosis of hydatidiform mole and persistent trophoblastic disease: Diagnosis accuracy of total human chorionic gonadotropin (hCG), free hCG α-and β-subunits, and their ratios,” European Journal of Endocrinology)
Sebagai analogi, Lybol dkk (2012) membentuk dua kurva regresi untuk memprediksi resistensi kemoterapi terhadap pemberian kemoterapi EMA/CO. Konsentrasi hCG inisial pada kelompok PTG risiko tinggi lebih tinggi dikarenakan load tumor yang lebih tinggi pada grup resisten MTX
33 yang telah mengalami regresi tumor dengan MTX (p<0,001). Tujuan analisis kurva untuk menurunkan mortalitas dengan perubahan awal ke regimen platinum (EMA-EP). Persentil 90 dipilih sebagai lini atas kurva regresi. Kurva regresi pasien yang diterapi dengan EMA/CO untuk penyakit resisten MTX ditunjukkan pada gambar di bawah. Konsentrasi hCG median sebelum onset terapi adalah 21 ng/mL dan sebelum siklus EMA/CO ketiga, hampir setengah pasien memiliki kadar hCG normal. Persentil 90 adalah 148 ng/ml sebelum mulai terapi. Sebanyak 90 persen pasien dengan resistensi MTX memiliki kadar hCG normal sebelum siklus EMA/CO keempat mulai. Persentil 10 adalah kurang dari 3 ng/ml sebelum dimulainya siklus pertama.37
Gambar 2.9.3. Kurva regresi pasien PTG resisten MTX yang diterapi dengan EMA/CO (dikutip dari Lybol C. Westerdijk K. Sweep FC. Ottevanger PB. Massuger
LF. Thomas CM. Human chorionic gonadotropin (hCG) regression s for patients with high-risk gestational trophoblastic neoplasia treated with EMA/CO (etoposide,
34 Kurva regresi pasien yang diterapi dengan EMA/CO untuk PTG risiko tinggi ditunjukkan pada gambar dibawah ini. Persentil 90 adalah di kadar 32.781 ng/ml. Pada 90% pasien, konsentrasi hCG mengalami regresi ke normal sebelum siklus EMA/CO kedelapan. Level hCG median adalah 7059 ng/ml pada siklus pertama dan 50% setelah siklus kelima akan memiliki konsentrasi hCG normal. Persentil kesepuluh dimulai dari konsentrasi hCG 1520 ng/ml, dan 10% mengalami remisi sebelum siklus keempat.37
Gambar 2.9.4. Kurva regresi pasien yang diterapi dengan EMA/CO pada PTG risiko tinggi (dikutip dari Lybol C. Westerdijk K. Sweep FC. Ottevanger PB. Massuger LF. Thomas CM. Human chorionic gonadotropin (hCG) regression s for patients with
high-risk gestational trophoblastic neoplasia treated with EMA/CO (etoposide, methotrexate, actinomycin D, cyclophosphamide and Vincristine) Chemotherapy)
Kebanyakan pasien dapat mengharapkan fungsi reproduksi normal 6 bulan setelah terapi. Penelitian menunjukkan tidak ada perbedaan antara pasien yang diterapi dengan kemoterapi kombinasi dan yang diterapi dengan kemoterapi agen tunggal. Pasien harus menunggu 12 bulan
35 setelah kemoterapi dihentikan sebelum merencanakan kehamilan (Level of eveidence C).38,39
36 2.6. Kerangka Teori Keterangan gambar : Variabel penelitian Proses terhambat Sperma - 46XX - 46XY Empty oocyte / normal Proliferasi trofoblas
Edema villous stroma
Grape appearance
Pembelahan Sel sinsitiotrofoblas β-hCG Folic acid Dihidrofolinic acid Tetrahidrofolic DHFR DHFR MTX
Sintesis purin dan thymidilate
DNA & RNA biosinthesis damage (sincytiotrophoblast cell)