MAKALAH KIMIA KATALIS
Oleh: Windi Riyadi 1113096000037
FAKULTAS SAINS DAN TEKNOLOGI PROGRAM STUDI KIMIA
BAB I PENDAHULUAN I.1. Pengertian Katalis
Katalis adalah senyawa yang ketika ditambahkan ke reaksi kimia, mengurangi energi aktivasi dan meningkatkan laju reaksi. Jumlah katalis tidak berubah selama reaksi, karena tidak dikonsumsi sebagai bagian dari proses reaksi. Katalis menurunkan energi yang dibutuhkan untuk mencapai keadaan transisi pada reaksi, memungkinkan interaksi yang lebih pada molekul untuk mencapai keadaan tersebut. Namun, katalis tidak mempengaruhi proses reaksi yang berlangsung. Dengan kata lain, meskipun katalis mempengaruhi kinetika reaksi, keadaan ekuilibrium tetap, tidak terpengaruh. Katalisator adalah Sebuah zat yang meningkatkan laju reaksi kimia tanpa dikonsumsi dalam proses reaksi.
Katalis adalah suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu, tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri. Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi.
I.2. Sejarah Katalis
Istilah katalisator berawal dari penelitian Berzelius (1836) tentang proses proses pemercepatan laju reaksi dan menjabarkannya sebagai akibat adanya gaya katalisis. Sebutan “gaya” katalisis ternyata tidak terbukti, tetapi istilah katalisator tetap digunakan untuk menyebuitkan pengaruh substansi tertentu yang ikut dalam proses tanpa mengalami perubahan. Senyawa yang menurunkan laju reaksi biasa disebut sebagai katalisator negatif atau inhibitor, yang saat ini lebih dikenal dengan istilah katalis.
Definisi katalis pertama kali dikemukakan oleh Ostwalsd sebagai suatu substansi yang mengubah laju suatu reaksi kimia tanpa merubah besarnya energi yang menyertai reaksi tersebut. Pada tahun 1902 Ostwald mendefinisikkan katalis sebagai substansi yang mengubah laju reaksi tanpa terdapat sebagai produk pada akhir reaksi, dengan kata lain katalisator mempengaruhi laju reaksi dan berperan sebagai reaktan sekaligus produk reaksi. Selanjutnya pada tahun 1941, Bell menjelaskan substansi yang dapat disebut sebagai katalis suatu reaksi adalah ketika sejumlah tertentu substansi ditambahkan maka akan mengakibatkan laju reaksi bertambah dari laju pada keadaan stoikiometri biasa. Jika substansi tersebut ditambahkan pada reaksi maka tidak mengganggu kesetimbangan.
Beberapa katalis ternama yang pernah dikembangkan di antaranya:
Katalis Asam-Basa
Katalis asam-basa sangat berperan dalam perkembangan kinetika kimia. Awal penelitian kinetika reaksi yang dikatalisis dengan suatu asam atau basa bersamaan dengan perkembangan teori dissosiasi elektrolit, dimana Ostwald dan Arrhenius membuktikan bahwa kemampuan suatu asam untuk mengkatalisis reaksi tersebut adalah tidak bergantung pada sifat asal anion tetapi lebih mendekati dengan sifat konduktivitas listriknya. Penelitian lain yang menggunakan katalis asam basa antara lain Kirrchoff yang meneliti hidrolisis pati oleh pengaruh asam encer, Thenard yang meneliti dekomposisin hidrogen peroksida oleh pengaruh basa dan Wilhelmy yang meneliti tentang inversi tebu yang dikatalisis dengan asam.
Katalis Ziegler-Natta
Katalis Ziegler-Natta ditemukaan poleh Ziegler pada tahun 1953 yang digunakan untuk polimerisasi etana, yang selanjutnya pada tahun 1955 Natta menggunakan katalis tersebut untuk
polimerisasi propena dan monomer jenuh lainnya. Katalis Ziegler-Natta dapat dibuat dengan mencampurkan alkil atau aril dari unsur golongan 11-13 pada susunan berkala, dengan halida sebagai unsur transisi. Saat ini katalis Ziegler-Natta digunakan untuk produksi masal polietilen dan polipropilen.
Katalis Friedle-Crafts
Pada tahun 1877 Charles Friedel dan James M.Crafts mreakukan penelitian tentang pembuatan senyawa amil iodida dengan mereaksikan amil klorida dengan aluminium dan yodium yang ternyata menghasilkan hidrokarbon. Selanjutnya mereka menemukan bahwa pemakaian aluminium klorida dapat menggantikan alumunium untuk menghasilkan hidrokarbon. Dengan demikian Friedel dan Crafts merupakan orang pertama yang menunjukkan bahwa keberadaan logam klorida sangat penting sebagai reaktan atau katalis. Hingga saat ini penerapan kimia Friedel-Crafts sangat luas terutama di industri kimia.
Katalis dalam Reaksi Metatesis
Pada tahun 1970 Yves Chauvin dari Institut Francais du Petrole dan Jean-Louis Herrison menemukan katalis logam karbena (logam yang dapat berikatan ganda dengan atom karbon membentuk senyawa), atau dikenal juga dengan istilah metal alkilidena. Melalui senyawa logam karbena ini, Chauvin berhasil menjelaskan bagaimana susunan logam berfungsi sebagai katalis dalam suatu reaksi dan bagaimana mekanisme reaksi metatesis. Metatesis dapat diartikan sebagai pertukaran posisi atom dari dua zat yang berbeda. Contohnya pada reaksi AB + CD -> AC + BD, B bertukar posisi dengan C.
Katalis Grubbs
Perkembangan penemuan Chauvin dan Schrock terjadi tahun 1992 ketika Robert Grubbs dan rekannya Grubbs berhasil menemukan katalis metatesis yang efektif, mudah disintesis, dan dapat diaplikasikan di laboratorium secara baik. Mereka menemukan tentang logam rutenium tantalum, tungsten, dan molybdenum (komplek alkilidena) sebagai logam yang paling cocok sebagai katalis. Katalis menjadi standar pembanding untuk katalis yang lain. Penemuan katalis Grubbs secara tidak langsung menambah peluang kemungkinan sintesis organik di masa depan.
Sistem Katalis Tiga Komponen
Sebuah sistem katalis dengan tiga komponen berhasil digunakan untuk membuat polimer bercabang dengan struktur-struktur yang tidak bisa didapat dengan sebuah katalis tunggal atau sepasang katalis yang bekerja bergandengan. Pada tahun 2002 Guillermo C. Bazan, seorang profesor kimia dan material di University of California, Santa Barbara; mahasiswa pascasarjana Zachary J. A. Komon; dan rekan kerja di Santa Barbara dan Symyx Technologies sudah mendemonstrasikan sebuah sistem dengan tiga katalis yang homogen; ketiga campuran bekerja sama mengubah sebuah monomer tunggal - etilen - menjadi polietilen bercabang. Jumlah dan jenis cabang yang dihasilkan dapat dikontrol dengan menyesuaikan komposisi campuran katalisnya. Tiga katalis ini terdiri dari dua persenyawaan organonikel dan sebuah persenyawaan organotitanium. Satu dari katalis dengan unsur dasar nikel mengubah etilen menjadi 1-butena, sedangkan yang lainnya mengubah olefin menjadi penyebaran dari 1-alkena. Persenyawaan titanium menggabungkan etilen dari hasil reaksi-reaksi lainnya menjadi polietilen.
I.3. Jenis Katalis
# Penggolongan katalis berdasarkan fasenya di dalam sistem reaksi: (1) Katalis homogen
Yakni jika fase katalis sama dengan fase reaktan dan fase produk reaksi (atau: fase katalis = fase reaksi). Yang paling umum berupa fase cair, dengan katalis dan reaktan berada dalam larutan. Katalis homogen merupakan katalis yang mempunyai fasa sama dengan reaktan dan produk. Penggunaan katalis homogen ini mempunyai kelemahan yaitu: mencemari lingkungan, dan tidak dapat digunakan kembali. Contoh Katalis Homogen : Katalis dan pereaksi berwujud gas, dan katalis dan pereaksi
berwujud cair. Sebagian besar reaksi katalis homogen adalah asam basa, seperti halnya reaksi hidrolisis dari ester atau mutarotasi glukosa.:
Keunggulan: aktivitas dan selektivitasnya tinggi, tidak mudah teracuni oleh keberadaan pengotor, mudah dioperasikan, mudah dimodifikasi, mudah untuk dipelajari. Kekurangan: sulit dipisahkan dari campuran reaksi, kurang stabil pada suhu tinggi. Karena alasan-alasan tersebut, katalisis homogen terbatas penggunaannya di industri, biasanya dalam pembuatan zat kimia khusus, obat-obatan, dan makanan; kecuali pada produksi asam asetat, proses alkilasi olefin, dan hidroformilasi.
Katalis homogen adalah suatu jenis dari katalisis di mana katalis menempati fase yang sama dengan reaktan. Katalis homogen adalah senyawa yang ada dalam fase yang sama (gas atau cair) sebagai reaktan. Campuran homogen adalah Sebuah zat yang seragam dalam komposisi. Katalisis asam, katalis organologam, dan katalisis enzimatik adalah contoh katalis homogen. Paling sering, katalis homogen melibatkan pengenalan katalis fase cair ke dalam larutan reaktan. Dalam kasus tersebut, asam dan basa sering katalis sangat efektif, karena mereka dapat mempercepat reaksi dengan mempengaruhi polarisasi ikatan. Katalis homogen digunakan dalam berbagai aplikasi industri, karena memungkinkan untuk peningkatan laju reaksi tanpa peningkatan suhu. Katalis homogen umumnya bereaksi dengan satu atau lebih pereaksi untuk membentuk suatu perantara kimia yang selanjutnya bereaksi membentuk produk akhir reaksi, dalam suatu proses yang memulihkan katalisnya. Berikut ini merupakan skema umum reaksi katalitik, di mana C melambangkan katalisnya:
A + C → AC (1) B + AC → AB + C (2)
Meskipun katalis (C) termakan oleh reaksi 1, namun selanjutnya dihasilkan kembali oleh reaksi 2, sehingga untuk reaksi keseluruhannya menjadi,
A + B + C → AB + C Contoh katalis homogen:
Reaksi berkatalis homogen, fase gas
CO (g) + ½ O2 (g) → CO2 (g) katalis: NO (g) CH3CHO (g) → CH4 (g) + CO (g) katalis: uap I2 Reaksi berkatalis homogen, fase cair
C12H22O11 + H2O → C6H12O6 + C6H12O6 katalis: asam CH3COOC2H5 + H2O → CH3COOH + C2H5OH katalis: asam Katalis gas NO2 pada pembuatan gas SO3.
Katalis gas Cl2 pada penguraian N2O
Proses katalitik pada reaksi berkatalis homogen berlangsung melalui pembentukan senyawa kompleks dan penyusunan ulang antara molekul-molekul reaktan dengan ligan katalis.
(2) Katalis heterogen
Yakni jika fase katalis tidak sama dengan fase reaktan dan/atau fase produk reaksi (atau: fase katalis ≠ fase reaksi). Pada umumnya: fase katalis → padatan, fase reaksi → gas
Sifat-sifat katalis heterogen: Mudah dipisahkan dari campuran reaksi, Tahan dan stabil terhadap suhu relatif tinggi, Mudah disiapkan dalam bentuk pellet katalis padat, Konstruksinya sederhana
Hingga tahun 1980-an: sekitar 90% katalis yang digunakan di dalam proses industri kimia berupa katalis heterogen. Katalis heterogen biasanya membutuhkan pendukung (support), karena pendukung katalis memiliki kekuatan mekanik, tahan panas, mempunyai kerapatan ruah yang optimal, dan
kemampuan pelarutan fase aktif. Dalam mempelajari katalis asam basa akan diketahui katalisator asam spesifik, katalisator basa spesifik, katalisator asam umum dan katalisator basa umum.
Satu contoh sederhana untuk katalisis heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi (atau substrat) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi lemah sedemikian sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Contoh:
Katalis padat Fe untuk Proses Haber pada pembuatan amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis padat Fe2O3-BiO2 untuk oksidasi amonia pada pembuatan asam nitrat: 4 NH3 (g) + 5 O2 (g) ↔ 4 NO (g) + 6 H2O (g)
Katalis padat Ni pada hidrogenasi hidrokarbon:
R1CH=CHR2 (l) + H2 (g) → R1CH2CH2R2 (l) (minyak tak jenuh) (lemak jenuh)
Katalis arang (C) pada pembuatan asam khlorida:
H2 (g) + Cl2 (g) → 2 HCl (g)
Katalis logam Ni pada reaksi hidrogenasi etena ( C2H4 ).
Katalis logam Rodium atau Iridium pada proses pembuatan asam etanoat.
Katalis logam Ni pada proses pembuatan mentega.
Katalis logam V2O5 pada reaksi pembuatan asam sulfat ( proses Kontak )
# Penggolongan katalis berdasarkan keberadaannya di alam: (1) Katalis biokimia
Disebut juga enzim. Merupakan senyawa protein berukuran koloid. Dijumpai dalam sistem biokimia dan makhluk hidup. Contoh: enzim dalam sistem pencernaan tubuh manusia enzim-enzim dalam tumbuhan. Bekerja pada suhu ambient. Setiap enzim-enzim mempunyai suhu optimum (suhu operasi ketika aktivitasnya mencapai maksimum). Peningkatan suhu di atas suhu optimumnya akan mengakibatkan kerusakan enzim (denaturasi protein). Contoh: Enzim amilase = membantu menghidrolisis amilum menjadi maltose; Enzim katalase = menguraikan H2O2 menjadi O2 dan H2O;
Enzim lipase = menguraikan lipid menjadi gliserol dan asam lemak. (2) Katalis yang dibuat oleh manusia (man-made catalyst)
Bekerja pada suhu relatif tinggi. Sebagian besar berupa katalis padat. Contoh: Katalis V2O5 untuk reaksi oksidasi SO2 : SO2 (g) + ½ O2 (g) ↔ SO3 (g)
Katalis Fe-base untuk reaksi sintesis amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g) Katalis oksida Cu-Zn untuk reaksi sintesis metanol: nmCO (g) + 2 H2 (g) ↔ CH3OH (g)
I.5. Karakteristik Katalis
Katalis tidak mengalami perubahan yang permanen dalam reaksi, tapi terlibat dalam mekanisme reaksi.
Katalis mempercepat laju reaksi tetapi tidak mengubah jenis maupun jumlah hasil reaksi.
Katalis dapat menurunkan energi aktivasi, tetapi tidak mengubah entalpi reaksi.
Katalis mengubah mekanisme reaksi dengan menyediakan tahap-tahap yang mempunyai energi pengaktifan lebih rendah.
Katalis mempunyai aksi spesifik, artinya hanya dapat mengkatalisis reaksi tertentu.
Katalis hanya diperlukan dalam jumlah sedikit.
Kerusakan aktivitas katalis ditunjukkan dengan adanya peningkatan aktivitas berlebih atau penghambatan aktivitas. Kerusakan aktivitas katalis dapat disebabkan karena adanya kerusakan fisik atau kerusakan kimia katalis. Kerusakan fisik katalis misalnya dapat disebabkan oleh pengkristalan material pendukung katalis atau kerusakan fisik pas katalisnya sendiri. Pengikatan logam berat seperti merkuri, arsen, timah hitam dll. merupakan contoh kerusakan kimia katalis dan biasanya bersifat permanen.
Jika sifat kerusakannya tidak permanen, maka katalis tersebut biasanya masih dapat diregenerasi. Jika kerusakan aktivitas katalis disebabkan oleh kerusakan pada pendukung yang tahan panas, seperti alumina, yang disebabkan oleh penjerapan karbon atau tar, maka pembakaran alumina pada suhu dibawah 500oC dapat menghilangkan karbon dan tar tersebut.
Selanjutnya, melalui serangkaian pengolahan reduksi, aktivitas katalis akan dapat dimunculkan kembali.
I.6. Faktor dalam pemilihan katalis
Secara umum pemilihan katalis adalah berdasarkan pada 5 faktor utama sebagai berikut : • Initial activity (temperature)
• Selectivity (produk yang diinginkan) • Stability (deactivation rate)
• Product quality (desired specification)
• Regenerability (kemudahan untuk diregenerasi) I.7. Fungsi Katalis
Fungsi katalis adalah memperbesar kecepatan reaksinya (mempercepat reaksi) dengan jalan memperkecil energi pengaktifan suatu reaksi dan dibentuknya tahap-tahap reaksi yang baru. Dengan menurunnya energi pengaktifan maka pada suhu yang sama reaksi dapat berlangsung lebih cepat.
Fungsi utama dari katalis ini adalah menyediakan reaksi alternative dalam suatu reaksi kimia. Dengan peranan yang sangat penting ini, maka katalis sangat di perlukan oleh tubuh dalam proses pencernaan makanan di dalam tubuh. Fungsi penting katalis ( enzim ) ini memberikan dampak besar terhadap kelancaran pencernaan makanan di dalam tubuh. Misalnya saja adalah enzim amylase di dalam mulut (air liur) yang membantu memecah amilosa menjadi maltosa. Selain peranan katalis di dalam tubuh, katalis juga berperan dalam proses kimia lainnya.
Katalis mempunyai tiga fungsi katalitik, yakni:
1. Aktivitas (berkaitan dengan kemampuannya mempercepat reaksi),
2. Selektivitas atau spesifisitas (berkaitan dengan kemampuannya mengarahkan suatu reaksi) 3. Stabilitas atau lifetime (berkaitan dengan kemampuannya menahan hal-hal yang dapat mengarahkan terjadinya deaktivasi katalis).
I.8. Pengaruh Katalis berdasarkan Teori Tumbukan
Umumnya reaksi bekerja berjalan lambat bila energi aktivasi suatu reksi terlalu tinggi. Agar reaksi dapat berlangsung lebih cepat, maka dapat dilakukan dengan cara menurunkan energi aktivasi. Untuk menurunkan energi aktivasi dapat dilakukan dengan mencari senyawa antara (keadaan transisi) lain yang energjnya lebih redah. Fungsi katalis dalam hal ini mengubah jalannya reaksi sehingga diperoleh senyawa antara (keadaan transisi) yang energinya relative lebih rendah. Yang bekerja dengan cara ini contohnya katalis homogen.
Misalnya reaksi : A + B → C, berlangsung melalui dua tahapan ; Tahap I : A + B → AB* (AB* merupakan senyawa antara)
Tahap II : AB* → C
Apabila ke dalam reaksi tersebut ditambahkan katalis (Z) maka, tahapan reaksi berlangsung sebagai berikut:
Tahap I : A + Z → AZ* (AZ* senyawa antara yang erbentuk oleh katalis) Tahap II : AZ* + B → C + Z
Pada kedua tahap tersebut terlihat bahwa pada akhir reaksi Z diperoleh kembali dan mengkatalis molekul-molekul A dan B yang lain. Penggambaran energi menunjukkan bahwa dengan adanya jalan reaksi yang berbeda akan memerlukan energi pengaktifan yang rendah. Contoh katalis homogen adalah larutan Fe3+ untuk mengkatalisis pengeuraian H2O2 menjadi H2O dan gas oksigen.
Katalis dapat mempengaruhi terjadinya reaksi, tetapi pada akhir reaksi dapat diperoleh kembali. Fungsi katalis adalah menurunkan energi aktivasi, sehingga jika ke dalam suatu reaksi ditambahkan katalis, maka reaksi akan lebih mudah terjadi. Hal ini disebabkan karena zat- zat yang bereaksi akan lebih mudah melampaui energi aktivasi. Katalis adalah zat yang mempercepat laju reaksi, tetapi tidak mengalami perubahan kimia secara permanen, sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Katalis mempercepat reaksi dengan cara menurunkan harga energi aktivasi (Ea). Sedangkan zat yang dapat memperlambat laju reaksi disebut inhibitor. Meskipun katalis menurunkan energi aktivasi reaksi, tetapi ia tidak mempengaruhi perbedaan energi antara produk dan pereaksi. Dengan kata lain, penggunaan katalis tidak akan mengubah entalpi reaksi.
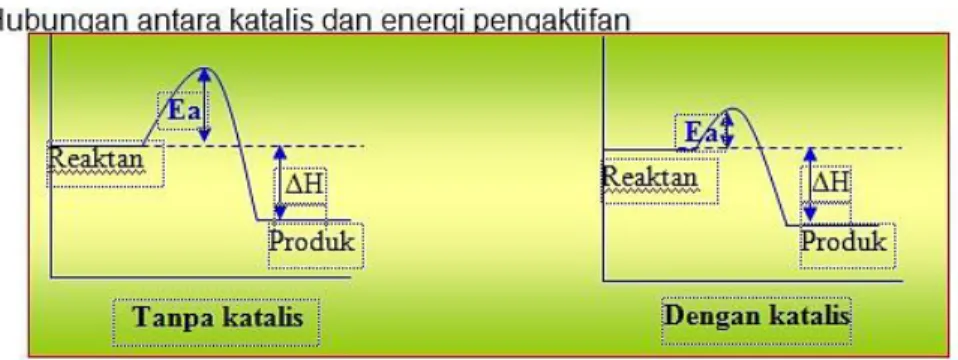
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini.
Gambar 4. grafik pengaruh katalis terhadap energi pengaktifan (Ea) Dengan memperhatikan gambar.4 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
I.9. Pengaruh Katalis Berdasarkan Teori Adsorbsi
Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami perubahan kimia secara permanen. Cara kerjanya yaitu dengan
menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat.
Proses katalis dengan cara adsorpsi umumnya dilakukan oleh katalis heterogen. Pada proses adsorpsi, melekul-molekul pereaksi akan teradsorpsi pada permukaan katalis, dengan terserapnya pereaksi dipermukaan katalis mengakibatkan zat-zat pereaksi terkonsentrasi di permukaan katalis dan ini akan mempercepat reaksi. Kemungkinan yang lain, karena pereaksi-pereaksi teradsorpsi dipermukaan katalis akan dapat menimbulkan gaya tarik antarmolekul yang bereaksi, dan ini menyebabkan molekul-molekul tersebut akan reaktif. Contoh katalis adsorpsi adalah nikel pada pembuatan margarine, untuk mengkatalis reaksi antara gas hydrogen dengan lemak atau minyak menjadi margarine. Pada industri H2SO4 digunakan katalis V2O5 untuk mempercepat reaksi gas SO2 dan O2 menjadi SO3.
I.10. Aplikasi Katalis dalam Industri
Katalis terutama banyak dipergunakan untuk membantu dalam proses industri seperti dalam pengilangan minyak bumi dan proses produksi bahan kimia umum atau kimia khusus. Selain dikedua jenis industri tersebut, katalis juga dipergunakan dalam proses produksi produk makanan, pembangkit listrik tenaga nuklir, kendaraan, dan untuk kegiatan pengendalian pencemaran.
Dalam proses di kilang minyak bumi, katalis yang banyak dipergunakan adalah katalis reforming, isomerasi dan hydrocracking. Fungsi katalis-katalis tersebut pada dasarnya untuk membantu memecah rantai senyawa karbon. Dengan bantuan katalis tersebut minyak mentah (crude oil) dapat diproses sehingga dapat diperoleh variasi turunannya seperti premium, kerosin, avtur, dan produk lainnya tergantung tingkat pemutusan rantai karbonnya.
Untuk industri kimia, kebanyakan katalis yang digunakan adalah katalis yang membantu pembentukan (syntetic catalysts) seperti katalis hidrogenasi, katalis oksidasi, dll. Beberapa katalis yang sering dipakai dalam produksi bahan kimia antara lain: Vynil acetate monomer (VAM), purified terepthalic Acid (PTA) dan proses hidrogenisasi.
Untuk bidang lingkungan, katalis tertentu dapat digunakan untuk mendestruksi senyawa yang menghasilkan bau sehingga berfungsi sebagai deodorant. Ada juga katalis yang bisa memecah rantai senyawa organic volatile (VOC) sehingga dapat digunakan untuk destruksi senyawa berbahaya tersebut.
I.11. Zeolit dan Katalis Logam
Zeolit dapat ditingkatkan kinerjanya dengan cara menempelkan logam katalis pada zeolit. Logam yang diembankan pada zeolit akan dapat meningkatkan aktivitas katalis secara keseluruhan karena logam-zeolit akan memiliki fungsi ganda yaitu disamping logam sebagai katalis logam-zeolitnya sendiri bersifat katalis, katalis semacam ini biasanya disebut sebagai katalis bifungsional. Logam yang biasa digunakan untuk katalis biasanya logam-logam transisi.
Logam-logam transisi mempunyai daya adsorpsi yang kuat karena mempunyai pasangan elektron menyendiri pada orbital d. adanya elektron pada orbital d didukung dengan keadaan elektron orbital s akan menjadi konsentrasi yang lebih besar pada keaktifan yang tinggi dalam pemutusan dan pembentukan ikatan kimia. Hal ini yang menyebabkan logam-logam transisi makin reaktif sebagai katalis (Hegedus, at al, 1999). Logam transisi Ni dan Mo tersulfidasi memilki prospek untuk digunakan sebagai katalis hidrodesulfurisasi, hidrodenitrogenasi dan perngkahan. Ni sebagai promotor dan Mo sulfida sebagai kokatalis yang diemban pada -Alumina dapat mengaktalis proses hidrogenasi minyak bumi dan minyak batubara di industri (Li 1999a).
II.12. Komponen komponen katalis
• Katalis dibentuk dari komponen-komponen yang dapat menunjang sifat katalis yang diharapkan, seperti aktif, selektif, panjang usia (stabil terhadap gangguan fisika, kimia, termal, dan mekanik), dan murah.
• Khusus untuk katalis heterogen, pada kondisi tertentu dibutuhkan sifat-sifat lain seperti: konduktivitas termal yang tinggi serta kemampuan menghasilkan distribusi aliran yang merata dan pressure drop yang rendah di sepanjang unggun (bed).
• Untuk memenuhi sifat-sifat tersebut di atas, pada umumnya katalis padat dibentuk dari tiga komponen utama sebagai berikut :
1. Komponen (atau fasa) aktif
Fungsi: aktivitas kimia, mengemban fungsi utama katalis untuk mempercepat dan mengarahkan reaksi.
Pengelompokan fasa aktif katalis disajikan dalam tabel berikut:
Kelompok Fasa Aktif Konduktor Logam Semikonduktor oksida atau sulfide logam
Insulator garam dan padatan berpusat asam
Tipe Reaksi Reduktor Reduktor Asam dan Basa
Kelompok Reaksi yang Sesuai Hidrogenasi, dehidrogenasi, hidrogenolisis, oksidasi, reduksi Oksidasi, reduksi dehidrogenasi, siklisasi, hidrogenasi Polimerisasi, isomerisasi, perengkahan (cracking), dehidrasi, alkilasi, perpindahan hidrogen, halogenisasi, dehalogenisasi
Contoh Fe, Co, Ni, Rh, Pt, Pd, Ru, Cu, Ag, Os
CuO, AgO, NiO, Fe3O4, Cr2O3, MoO3, WO3, CoO3, V2O5, TiO2, ZnO, CdO
Lempung alam, SiO2, Al2O3, SiO2-Al2O3, zeolit
Faktor yang Berpengaruh Geometri Elektronik Keasaman katalis
2. Penyangga (support atau carrier)
Fungsi: luas permukaan yang tinggi, porositas, sifat-sifat mekanik, kestabilan, aktivitas fungsional ganda, modifikasi komponen aktif. Jenis: oksida dengan melting point tinggi, tanah liat, karbon.
3. Promotor
Fungsi pada komponen aktif: elektronik, morfologi, poisoning. Fungsi pada penyangga: struktural, inhibisi aktivitas, promosi aktivitas.
II.13. Pembuatan Katalis Secara Umum
Metode yang digunakan untuk pembuatan katalis secara umum adalah impregnasi dan presipitasi. I. Metode impregnasi
Impregnasi merupakan metode pembuatan katalis yang paling sederhana. Impregnasi dilakukan dengan mengkontakkan support yang poros dengan larutan yang terdiri dari satu atau lebih garam, logam yang memiliki konsentrasi tertentu (Satterfield, 1991). Support pada proses ini bertujuan untuk meningkatkan stabilitas katalis yang dihasilkan. Tahapan proses metode impregansi dapat dilihat pada diagram alir berikut ini.
I.a. Tahapan Proses Metide Impregnasi
Proses impregnasi diawali dengan memilih support yang akan digunakan. Beberapa pertimbangan yang dijadikan dasar pada pemilihan support yang akan digunakan adalah sebagai berikut:
1. Bersifat inert dan tidak menghasilkan reaksi lain
2. Memiliki sifat-sifat mekanik, termasuk ketahanan secara fisik 3. Stabil
4. Memiliki luas permukaan yang besar 5. Poros
6. Harganya murah (Satterfield,1991)
Selanjutnya support dikeringkan terlebih dahulu untuk menghilangkan kelembaban dan impuritis yang ada. Support ditetesi garam logam, diaduk dan dibiarkan selama 30 menit agar distribusi garam logam dikeringkan untuk menghilangkan sisa-sisa air. Proses kalsinasi dilakukan untuk mendekomposisi garam logam menjadi oksida. Selain itu kalsinasi juga bertujuan untuk meningkatkan stabilitas katalis terhadap perubahan temperatur.
I.b. Keunggulan dan Kelemahan
Keunggulan metode impregnasi adalah jumlah reaktan yang digunakan lebih kecil daripada jumlah reaktan yang digunakan pada metode presipitasi. Selain itu metode impregnasi tidak memerlukan banyak peralatan karena tidak memerlukan penyaringan dan pencucian. Ukuran dan bentuk katalis yang dihasilkan melalu metode impregnasi sama dengan ukuran dan bentuk support yang digunakan. Selain keunggulan yang dimiliki, metode ini memiliki beberapa kelemahan. Salah satunya adalah garam logam menjadi mudah runtuh karena tidak menyatu dengan support (Twigg, 1989). Selain itu pada metode impregnasi, penentuan konsentrasi garam logam yang akan digunakan untuk membentuk lapisan monolayer sangat sulit dilakukan (Makertiharta, 2007). II. Metode Presipitasi
Presipitasi merupakan metode yang paling umum digunakan pada proses pembuatan katalis. Tujuan Presipitasi adalah untuk mengendapkan campuran garam logam dengan precipitating agent yang dapat berupa ammonium hidroksia atau natrium karbonat. Bagian terpenting pada proses Presipitasi adalah pemilihan campuran awal yang akan digunakan. Pertimbangan-pertimbangan yang dijadikan sebagai dasar pada pemilihan campuran awal yang digunakan adalah sebagai berikut: 1. Tinggi rendahnya kelarutan
2. Murah
3. Tidak bersifat korosif
4. Tidak menyebabkan sintering
5. Tidak menimbulkan polusi air dan udara
II.a. Tahapan Proses Metode Presipitasi
Pada awal proses Presipitasi dilakukan pencampuran garam logam dan precipitating agent. Endapan yang terbentuk dari proses Presipitasi selanjutnya disaring dan dicuci. Kemudian dilakukan pemeriksaan pH. Apabila pH pencucian = 7, maka proses penyaringan dan pencucian dihentikan. Setelah dikeringkan untuk menghilangkan sisa-sisa air, endapan dikalsinasi untuk mendekomposisi senyawa hidroksida menjadi oksida dan meningkatkan ketahanan katalis terhadap perubahan temperatur.
II.b. Faktor yang berpengaruh terhadap metode Presipitasi
Faktor-faktor yang berpengaruh terhadap metode Presipitasi adalah sebagai berikut: 1. Temperatur Presipitasi
2. pH
3. Pengadukan 4. Aging
II.c. Keunggulan dan Kelemahan
Keunggulan metode Presipitasi adalah distribusi fasa aktif yang seragam pada partikel katalis, pencampuran yang seragam pada skala molekular dan bentuk, serta ukuran yang tidak terbatas (tidak berdasarkan bentuk support) (Satterfield, 1991). Akan tetapi metode ini memiliki kelemahan yang diantaranya adalah Presipitat yang dihasilkan biasanya berfasa amorf dan lebih mahal karena menggunakan precipitating agent dalam jumlah yang lebih besar.
II.14. Industri yang menggunakan katalis
Industri asam sulfat menggunakan katalisator V2O5 Industri amonia menggunakan De
Metanol menggunakan ZnO
Industri Hidrocraking menggunakan Logam (seperti Pd) pada zeolit C2H2 + 2H2 ® C2H6
Industri pembuatan gas SO3 menggunakan katalis gas NO2
Katalis padat Fe untuk Proses Haber pada pembuatan amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis padat Fe2O3-BiO2 untuk oksidasi amonia pada pembuatan asam nitrat: 4 NH3 (g) + 5 O2 (g) ↔ 4 NO (g) + 6 H2O (g) Katalis padat Ni pada hidrogenasi hidrokarbon:
R1CH=CHR2 (l) + H2 (g) → R1CH2CH2R2 (l) (minyak tak jenuh) (lemak jenuh) Industri pembuatan asam khlorida dengan katalis arang (C):
H2 (g) + Cl2 (g) → 2 HCl (g) Katalis logam Ni pada reaksi hidrogenasi etena ( C2H4 ).
Industri pembuatan asam etanoat menggunakan katalis logam Rodium atau Iridium Industri pembuatan mentega menggunakan katalis logam Ni
BAB II ISI
II.1 KATALIS HOMOGEN
Yakni jika fase katalis sama dengan fase reaktan dan fase produk reaksi (atau: fase katalis = fase reaksi). Yang paling umum berupa fase cair, dengan katalis dan reaktan berada dalam larutan.
Sifat-sifat katalis homogen:
Keunggulan: aktivitas dan selektivitasnya tinggi, tidak mudah teracuni oleh keberadaan pengotor, mudah dioperasikan, mudah dimodifikasi, mudah untuk dipelajari.
Kekurangan: sulit dipisahkan dari campuran reaksi, kurang stabil pada suhu tinggi. Karena alasan-alasan tersebut, katalisis homogen terbatas penggunaannya di industri, biasanya dalam pembuatan zat kimia khusus, obat-obatan, dan makanan; kecuali pada produksi asam asetat, proses alkilasi olefin, dan hidroformilasi.
Contoh katalis homogen:
Reaksi berkatalis homogen, fase gas
CO (g) + ½ O2 (g) → CO2 (g) katalis: NO (g) CH3CHO (g) → CH4 (g) + CO (g) katalis: uap I2 Reaksi berkatalis homogen, fase cair
C12H22O11 + H2O → C6H12O6 + C6H12O6 katalis: asam CH3COOC2H5 + H2O → CH3COOH + C2H5OH katalis: asam
Proses katalitik pada reaksi berkatalis homogen berlangsung melalui pembentukan senyawa kompleks dan penyusunan ulang antara molekul-molekul reaktan dengan ligan katalis.
Katalis ini mempunyai kesamaan phase dengan reaktan dan persentuhannnya tak mempengaruhi laju reaksi, keadaan yang demikian disebut katalis homogen. Sebagai contoh :
Reaksi phase gas CO + ½ O2 CO2
Dengan adanya katalis NO2 maka prosesnya menjadi CO + NO2 CO2 + NO
NO + ½ O2 NO2
--- CO2 + ½ O2 CO2
Iodin uap juga dikenal sebagai katalis sejumlah reaksi pirolisis zat organik, dekomposisi asetaldehid sebagai reaksi berantai dengan proses sebagai berikut :
I2 == 2 I- I- + CH3CHO CH3CO - + HI CH3CO- CH3 + CO I2 + CH3 CH3I + I -HI + CH3 CH4 - + I -HI + CH3I CH4 - + I2
Sehingga diperoleh laju reaksi dengan pendekatan steady state dari intermediet adalah - d(CH3CHO)/dt = k [I2]1/2[CH3CHO]
Mekanisme ini dapat dibandingkan mekanisme reaksi tanpa katalis yang telah diterangkan pada bab sebelum ini (dikti:79), katalis iodin diperoleh kembali diakhir reaksi.
1. Katalis Asam Basa
Sebagian besar reaksi katalis homogen adalah asam basa, seperti halnya reaksi hidrolisis dari ester atau mutarotasi glukosa. Dengan menganggap S adalah suatu subtrat dengan suatu reaksi asam
basa. Sedang asam basa menurut Bronsted – Lowry adalah : HA + H2O à H3O+ + A– A– + H2O à HA + OH– Maka laju reaksi katalitik adalah: r = kkat [S]
di mana kkat = ko + kH [H3O] + kOH [OH] + kHA [HA] + kA [A] dan k0 adalah laju tanpa katalis sedang yang lain adalah laju dengan katalis sesuai dengan zatnya masing – masing
Katalis asam basa, percepatan reaksi kimia dengan penambahan asam atau basa, asam atau basa itu sendiri tidak ikut bereaksi dalam reaksi. Contoh reaksi katalitik dengan katalis asam, seperti dalam kasus dekomposisi dari sukrosa gula menjadi glukosa dan fruktosa dalam asam sulfat, atau untuk katalis basa, seperti dalam penambahan hidrogen sianida untuk aldehida dan keton dengan adanya natrium hidroksida. Banyak contoh reaksi yang dikatalisasi oleh asam dan basa. Mekanisme reaksi asam-basa dan katalis dijelaskan dalam hal konsep Brønsted-Lowry asam dan basa sebagai salah satu di mana ada transfer awal proton dari katalis asam untuk reaktan atau dari reaktan dengan katalis dasar .
Asam Bronsted-Lowry = donor proton (H+)
Basa Bronsted-Lowry = akseptor proton (H+)
Perhatikan contoh berikut : NH4+(aq) + H2O(l) à NH3(aq) + H3O+(aq) Asam basa
H2O(l) + NH3 (aq) à NH4+(aq) + OH–(aq) Asam basa
Dalam hal teori Lewis asam dan basa, reaksi memerlukan pembagian pasangan elektron yang disumbangkan oleh katalis basa atau diterima oleh suatu katalis asam. Asam Lewis : Akseptor pasangan electron; Basa Lewis : Donor pasangan electron.
Katalis asam digunakan dalam sejumlah besar reaksi industri, di antaranya konversi hidrokarbon minyak untuk bensin dan produk-produk terkait. Reaksi tersebut termasuk dekomposisi hidrokarbon dengan berat molekul tinggi (retak) menggunakan katalis alumina-silika (asam Brønsted-Lowry),
polimerisasi hidrokarbon tidak jenuh dengan menggunakan asam sulfat atau hidrogen fluorida (asam Brønsted-Lowry), dan isomerisasi hidrokarbon alifatik menggunakan aluminium klorida (asam Lewis).
Di antara aplikasi industri reaksi katalis basa adalah reaksi diisosianat dengan alkohol polifungsional dengan adanya amina, yang digunakan dalam pembuatan busa poliuretan. Contohnya : Hidrolisis esrer dan inverse gula. Pada teori Ostwald dan Arrhenius mengatakan bahwa katalis asam basa spesifik adalah kemampuan mengkatalisis asam adalah karena kekuatan asam tersebut atau konsentrasi hidrogennya. Hidrolisis ester dilakukan pada larutan asam yang cukup kuat yakni ion hydrogen adalah katalis efektif, ion hidroksil tidak memperlihatkan aktifitas bermakna.
Pada laju reaksinya: v : kH+ [H+][S]
kH+ : tetapan laju reaksi yang dikatalisis ion hydrogen.
Orde keseluruhan reaksi terhadap konsentrasi = 2, tetapi terhadap waktu = 1, karena konsentrasi ion hydrogen tetap.
Laju reaksi orde satu v : kobs [S]
dimana kobs : kH+ [H+], untuk reaksi yang dikatalisis ion hidroksil : kobs = kOH- [OH–]. jika reaksi dikatalisis ion-ion hidrogen dan ion hidroksil serempak dan reaksi berlangsung spontan tanpa katalis, laju reaksi adalah : v =ko [S] + kH+ [H+][S] + kOH- [OH–][S]
maka k (tetapan laju orde 1) : k : ko + kH+ [H+]+ kOH- [OH–] ko = tetapan laju reaksi spontan tanpa katalis
kH+ dan kOH- tetapan laju reaksi yang masing-masing dikatalisis oleh H+ dan OH– kW = [H+][OH–]
k = ko + kH+ [H+]+ kOH- k = ko + kH+ + kOH- [OH–]
Reaksi hanya dikatalisis oleh asam (ion hydrogen) : kobs = kH+ [H+] log kobs = log [H+] + kH+ [H+]
log kobs =-(- log [H+]) + log kH+ log kobs = -pH + log kH+
Pada larutan dapar yang digunakan untuk mempertahankan larutan pada pH tertentu. Reaksi katalisis terjadi karena salah satu komponen dapar yang dapat mempengaruhi laju reaksi, reaksi ini disebut katalisis asam basa umum yang bergantung pada komponen katalitik asam basa. Profil laju pH reaksi yang dipengaruhi katalisis asam basa umum memperlihatkan penyimpangan dari profil katalisis asam basa spesifik. Contoh hidrolisis streptozosin, laju reaksi dapar fosfat > laju reaksi dalam katalisis basa spesifik, karena adanya katalisis oleh anion fosfat. Kekuatan ion atau perbedaan pKa substrat dapat juga memperlihatkan penyimpangan profil laju –pH.
Pembuktian katalisis asam basa umum dapat dibuktikan dengan menentukan laju degradasi obat dalam suatu rangkaian dapar dengan pH asam (perbandingan asam dengan basa tetap), yang dibuat dengan konsentrasi komponen dapar yang menaik.
Tetapan laju orde satu keseluruhan adalah k = ko + ki ci
ko = tetapan laju spesifik dalam air ci = konsentrasi katalitik I
ki = koefisien katalitik
dalam reaksi yang hanya terjadi katalisis asam basa spesifik saja, persamaan menjadi : k : ko + kH+ [H+]+ kOH- [OH–]
Dalam katalisis asam basa terdapat beberapa katalisator, yaitu: 1. Katalisator asam spesifik
Merupakan katalisis oleh proton yang tersolvasi, yaitu H3O+. Hidrolidsis ester merupakan contoh reaksi katalis asam spesifik. Didalam larutan asam kuat, reaksi hanya dipercepat oleh ion hidronium. Persamaan lajunya : Laju: Kass [H3O]+[S]
Dimana [S] : konsentrasi ester; Kass : tetapan laju reaksi hidrolisis spesifik asam 2. Katalisator basa spesifik. Katalisis oleh OH‐ dalam larutan
3. Katalisator asam umum
Katalisis oleh asam proton selain H3O+ , dilakukan oleh asam Bronsted sebagai donor proton. Seperti halnya katalisis spesifik, berhubungan dengan proton diintroduksi kepada bagian molekul yang direaksikan dan serangan electron terhadap molekul air. Perbedaannnya adalah bahwa katalisator asam spesifik menggunakan ion hidronium sedangkan reaksi katalisis asam umum menggunakan sembarang asam Bronsted sebagai donor proton. Untuk katalisis asam umum, pembentukan kation SH+ merupakan tahap lambat. Reaksi kondensasi aidol adalah merupakan contoh reaksi yang bergantung kepada mekanisme.
4. Katalisator basa umum
Katalisis oleh basa Bronsted selain OH‐ dan basa ini berlaku sebagai penerima proton → yaitu berbagi pasangan elektron dengan proton. Katalisis basa umum menyerang air dulu, kemudian air menyerang
reakstan. Air menjadi lebih polar sehingga interaksi elektrostatiknya menjadi lebih besar dan kecepatan reaksi meningkat.
II.2. KATALIS HETEROGEN 1. Pengertian Katalis Heterogen
Katalis heterogen merupakan katalis yang memiliki fasa yang berbeda dengan reaktannya atau dapat didefinisikan bahwa katalis heterogen merupakan katalis yang fasanya tidak sama dengan reaktan dan produk. Katalis heterogen secara umum berbentuk padat dan banyak digunakan pada reaktan berwujud cair atau gas. Reaksi katalisis heterogen adalah reaksi yang menggunakan katalis yang mempunyai fasa yang berbeda dengan fasa reaktannya. Reaksi katalisis heterogen biasanya menggunakan katalis padatan dimana interaksi terjadi di permukaan padatan/gas atau cairan/padatan. Pusat aktivitas katalis terjadi di permukaan pori padatan katalis. Agar interaksi reaktan dengan pusat aktif katalis dapat berlangsung, reaktan harus berpindah dari fasa cair ke permukaan katalis.
Menurut Agustine (1996), reaksi katalisis heterogen memiliki tahapan-tahapan yang lebih kompleks dibandingkan dengan reaksi katalisis homogen. Hal ini terjadi karena pada reaksi katalisis heterogen katalis tidak terdistribusi merata ke dalam media reaksi. Lima tahap penting pada reaksi katalisis heterogen agar reaksi berjalan sempurna yaitu:
a. Transpor reaktan ke permukaan katalis b. Interaksi (adsorpsi) reaktan pada katalis.
c. Reaksi pada permukaan katalis yang melibatkan satu atau lebih reaktan teradsorpsi. d. Desorpsi produk dari permukaan katalis
e. Transpor produk menjauh dari katalis.
Menurut Triyono (1998), inti dari reaksi katalisis terjadi pada tahap ketiga, akan tetapi tahap kedua dan keempat termasuk dalam perubahan kimia, sehingga data kecepatan reaksi yang diamati melingkupi data dari ketiga tahap tersebut. Pengukuran energi aktivasi merupakan aplikasi dari kombinasi ketiga tahap tersebut. Tahap kedua, ketiga dan keempat merupakan penentu laju reaksi dengan ciri-ciri:
a. Laju reaksi sebanding dengan massa katalis atau konsentrasi komponen aktif b. Laju reaksi tidak dipengaruhi oleh pengadukan
c. Energi pengaktifan biasanya lebih besar dari 25 kJ.mol-1.
Adsorpsi reaktan pada situs aktif katalis akan melepaskan energi dalam bentuk panas,
sehingga akan mempermudah molekul reaktan melewati energi aktivasi. Panas yang dilepaskan pada proses adsorpsi berkaitan dengan kekuatan adsorpsi reaktan pada permukaan katalis. Kekuatan adsorpsi reaktan pada permukaan katalis sangat menentukan aktivitas katalis tersebut. Jika adsorpsi yang terjadi sangat lemah, energi yang dilepaskan juga kecil, sehingga hanya sebagian kecil fraksi permukaan yang ditempati oleh reaktan, dan pada akhirnya reaksi berjalan dengan lambat (Gasser, 1985).
Adsorpsi terjadi karena adanya interaksi gaya permukaan padatan dengan molekul- molekul adsorbat. Energi adsorpsi yang dihasilkan bergantung pada tipe adsorpsi yang terjadi. Energi adsorpsi yang dihasilkan bergantung pada adsorpsi yang terjadi. Tipe adsorpsi ini merupakan fungsi logam dan fungsi pereaksi. Adsorpsi gaas pada permukaan padatan katalis dapat dikelompokkan menjadi dua kategori, yaitu adsorpsi fisik (fisisorpsi) dan adsorpsi kimia (kemisorpsi). Adsorpsi fisik terjadi karena adanya gaya molekuler, dimana interaksi molekul-molekul gas terhadap padatan katalis bersifat reversibel, sehingga semua molekul gas yang teradsorpsi secara fisik akan dilepaskan kembali dengan menaikkan temperatur atau menurunkan tekanan. Adsorpsi kimia terjadi karena adanya interaksi tumpang tindih orbital molekul di permukaan padatan dengan molekul adsorbat. Adsorpsi kimia bersifat irreversibel, sehingga untuk melakukan desorpsi diperlukan energi yang jauh lebih besar dibandingkan energi desorpsi pada adsorpsi fisik.
Pada umumnya: fase katalis → padatan fase reaksi → gas Sifat-sifat katalis heterogen:
Mudah dipisahkan dari campuran reaksi
Tahan dan stabil terhadap suhu relatif tinggi
Mudah disiapkan dalam bentuk pellet katalis padat
Konstruksinya sederhana
Hingga tahun 1980-an: sekitar 90% katalis yang digunakan di dalam proses industri kimia berupa katalis heterogen.
Contoh: Katalis padat Fe untuk Proses Haber pada pembuatan amonia: N2 (g) + 3 H2 (g) ↔ 2 NH3 (g)
Katalis padat Fe2O3-BiO2 untuk oksidasi amonia pada pembuatan asam nitrat: 4 NH3 (g) + 5 O2 (g) ↔ 4 NO (g) + 6 H2O (g) Katalis padat Ni pada hidrogenasi hidrokarbon:
R1CH=CHR2 (l) + H2 (g) → R1CH2CH2R2 (l) (minyak tak jenuh) (lemak jenuh)
Katalis arang (C) pada pembuatan asam khlorida:
H2 (g) + Cl2 (g) → 2 HCl (g) 2. Umur Katalis
Umur katalis didefinisikan sebagai suatu periode selama katalis menghasilkan produk yang diinginkan lebih besar dibandingkan dengan produk reaksi tanpa katalis (Hughes, 1984). Pada kebanyakan katalis, aktivitas akan menurun dengan tajam pada awalnya, lalu tercapai keadaan dimana aktivitas katalis menurun jauh lebih lambat dan selektivitas katalis menjadi jelek. Umur katalis dapat dijadikan acuan dalam pemilihan katalis, sehingga biaya proses produksi dapat ditekan. Dalam beberapa reaksi, katalis hanya dapat digunakan sekali dan dalam reaksi lain bisa berulang kali tanpa perlu diregenerasi. Umur katalis sulit diestimasikan tanpa melakukan penelitian yang mendalam. Secara umum, aktivitas katalis akan menurun seiring dengan penggunaannya. Umur katalis ditentukan oleh kecepatan hilangnya aktivitas dan selektivitas katalis dalam mengkatalisis suatu reaksi (Rylander, 1985). Umur katalis dipengaruhi oleh deaktivasi katalis. Deaktivasi katalis menyebabkan penurunan aktivitas dan selektivitas katalis. Penurunan aktivitas dan selektivitas katalis yang terjadi secara terus-menerus pada waktu tertentu akan menyebabkan katalis tidak dapat digunakan lagi untuk mengkatalisis reaksi atau dengan kata lain, katalis tersebut telah mati.Semakin besar proses deaktivasi yang terjadi, semakin pendek umur suatu katalis.
3. Deaktivasi Katalis
Deaktivasi katalis merupakan penurunan aktivitas dan selektivitas katalis selama
pemakaian katalis tersebut. Secara umum, menurut Hughes (1984), ada 3 macam penyebab terjadinya deaktivasi katalis, yaitu:
a. Peracunan
Peracunan secara umum, walaupun tidak tepat, sering diterapkan pada semua bentuk deaktivasi katalis. Peracunan katalis merupakan deaktivasi katalis yang disebabkan oleh sejumlah kecil material tertentu untuk katalis tertentu dan berkaitan dengan adsorpsi racun pada situs aktif katalis, sehingga akan menghalangi proses adsorpsi reaktan oleh katalis. Peracunan sering dihubungkan dengan kontaminan, misalnya senyawaan belerang pada aliran umpan dalam proses fraksinasi minyak bumi, yang sering juga disebut sebagai peracunan oleh pengotor. Kebanyakan proses peracunan katalis adalah proses irreversibele (tidak dapat balik), sehingga katalis yang telah teracuni harus diganti atau diregenerasi bila memungkinkan. Secara prinsip, dimungkinkan upaya untuk menghilangkan pengotor yang bertindak sebagai racun katalis dari aliran material dasar (raw material) suatu reaksi atau dengan menggunakan pelindung katalis (catalyst guard). Tetapi untuk menurunkan kadar pengotor dalam material dasar (misalnya, menurunkan kadar senyawa belerang sebensar dari 1 ppm dalam reaksi metanasi terkatalisis oleh nikel) membutuhkan dana
yang cukup besar. Oleh karena itu usaha yang dilakukan adalah mentoleransi kadar pengotor sampai batas tertentu.
Peracunan pada katalis logam didasarkan pada sifat struktur elektron dari racun dalam fasa gas dan elektron dari katalis dalam fasa padat. Peracunan terjadi karena racun diserap oleh situs aktif katalis membentuk kompleks yang teradsorpsi secara kimia. Racun yang efektif pada proses deaktivasi katalis adalah racun yang mengandung unsur N, P, As, Sb, O, S, Se Te dan molekul yang mengandung ikatan rangkap, misalnya CO. Logam berat (Hg, Pb, Bi, Sn, Zs, Cd, Cu) dapat menurunkan aktivitas katalis. Toksisitas logam berat berkaitan dengan kelima sub orbital d yang terisi elektron secara penuh atau paling sedikit terisi oleh satu pasangan elektron. Toksistas tidak akan teejadi apabila unsur tidak mempunyai orbital d atau kalaupun memiliki orbital d, orbital d-nya kosong. Elektron pada orbital d, berperan pada proses terjadinya ikatan intermetalik antara logam berat dengan katalis yang akan menyebabkan adanya toksisitas.
b. Pencemaran
Secara umum, jumlah material yang berperan dalam proses deaktivasi katalis pada proses pencemaran lebih banyak dibandingkan pada proses peracunan. Tipe proses pencemaran katalis yang paling umum adalah pembentukan kokas (endapan karbon) dan
pengendapan logam pada permukaan katalis. Pembentukan kokas umumnya terjadi pada katalis yang digunakan dalam proses fraksinasi minyak bumi atau reaksi yang menggunakan senyawa organik sebagai umpan. Kokas terbentuk selama reaksi katalisis, dan bukan merupakan pengotor. Secara umum, kokas bisa berasal dari reaktan ataupun produk. Kokas dapat terjadi karena hasil samping reaksi ataupun produk suatu reaksi. Kokas yang merupakan hasil samping suatu reaksi disebut pencemaran pencemaran yang berlangsung secara paralel. Sedangkan kokas yang terbentuk sebagai hasil (produk) reaksi disebut pencemaran secara seri (konsekutif) Karena adanya asosiasi intrinsik secara kimiawi, pencemar katalis tidak dapat dihilangkan dengan cara memurnikan umpan ataupun dengan pemakaian pelindung katalis (catalyst guard). Sepanjang reaksi kimia berlangsung, kokas akan terbentuk. Pembentukan kokas dapat diminimalkan dengan cara pemilihan kondisi reaktor dan pengoperasiannya yang tepat, atau dengan cara memodifikasi katalis yang digunakan.
Perbedaan utama antara peracunan dan pencemaran katalis dapat adalah:
Peracunan. Berkurangnya ukuran partikel katalis akan menyebabkan meningkatnya luas permukaan partikel katalis. Luas permukaan partikel katalis yang besar akan lebih bisa mengakomodasikan racun, karena proses peracunan terjadi pada lapisan aktif yang tipis di dekat permukaan luar partikel katalis.
Pencemaran. Pencemaran katalis, terutama pembentukan kokas, terjadi pada situs katalis yang memiliki laju reaksi paling besar. Bertambahnya jumlah endapan yang relatif besar, akan menutup situs aktif katalis.
c. Sintering (Penggumpalan)
Sintering merupakan proses deaktivasi termal, yaitu proses fisik yang berkaitan: hilangnya area material pengembang atau basa oksida
hilangnya penyebaran kristal logam pada katalis logam pengemban penurunan komponen logam dalam katalis.
Berdasarkan tipe katalis yang digunakan, proses sintering dapat dibedakan menjadi dua. Tipe pertama adalah katalisnya merupakan material tipe pengemban dengan daerah suhu operasional normal sampai tinggi, misalnya SiO2, Al2O3. Pengoperasian katalis tipe ini pada suhu tinggi akan menyebabkan hilangya luas permukaan katalis yang berakibat pada berubahnya struktur pori, sehingga akan menurunkan aktivitas katalis. Tipe kedua adalah katalis dengan bahan aktifnya adalah logam yang diembankan pada pengemban oksida dengan daerah suhu operasional tinggi, misalnya platina yang diembankan pada silika atau alumina. Pada tipe kedua ini, sintering terjadi tidak hanya karena pengurangan ara pengemban, tetapi juga karena hilangnya penyebaran logam pada katalis yang pada akhirnya menyebabkan turunnya aktivitas katalis. Lebih lanjut sintering tipe kedua dapat terjadi pada suhu operasional di bawah suhu minimum yang bisa menyebabkan terjadinya hilangnya area. Pada kasus katalis bifungsi, misalnya platina teremban dalam
alumina, penyimpangan suhu dari suhu daerah operasional akan menurunkan area kedua komponen katalis, yakni platina dan alumina.
Beberapa mekanisme pada proses sintering adalah:
o Penguapan – kondensasi. Karena tekanan uap lebih besar daripada tekanan pada permukaan cembung ataupun cekung pada permukaan katalis, akan terjadi kecenderungan penguapan, dari pertikel penyusun katalis ke permukaan cekung di antara partikel.
o Difusi volume. Difusi atom terjadi dari partikel satu ke partikel yang berdekatan.
o Difusi permukaan. Mekanisme difusi permukaan mencakup migrasi atom ke permukaan partikel o Difusi butiran di daerah batas antar butiran
Laju sintering meningkat dengan cepat seiring dengan meningkatnya temperature. Secara umum proses sintering yang terjadi pada katalis teremban oksida dengan daerah
operasional suhu tinggi meliputi tiga tahap, yaitu:
Tahap I, terjadi pertumbuhan partikel-partikel dari area kontak membentuk leher.
Tahap II, merupakan tahap intermediet, yaitu terjadinya persinggungan atau titik potong di antara leher-leher tersebut membentuk pori yang tertutup.
Tahap III, terjadi pertumbuhan lebih lanjut dari partikel-partikel area kontak tersebut akan menghilangkan pori tertutup pada Tahap II.
Mekanisme proses sintering pada katalis dapat dilihat pada Gambar 2
4. Cara Kerja Katalis Heterogen
Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami perubahan kimia secara permanen. Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat. Secara umum proses suatu reaksi kimia dengan penambahan katalis dapat dijelaskan sebagai berikut. Zat A dan zat B yang direaksikan membentuk zat AB dimana zat C sebagai katalis.
A + B → AB (reaksi lambat)
Bila tanpa katalis diperlukan energi pengaktifan yang tinggi dan terbentuknya zat AB lambat . Namun, dengan adanya katalis C, maka terjadilah reaksi :
Energi pengaktifan diturunkan, maka AC terbentuk cepat dan seketika itu juga AC bereaksi dengan B membentuk senyawa ABC.
AC + B ABC (reaksi cepat).
Energi pengaktifan reaksi ini rendah sehingga dengan cepat terbentuk ABC yang kemudian mengurai menjadi AB dan C. sesuai reaksi
ABC → AB + C (reaksi cepat)
Ada dua macam katalis, yaitu katalis positif (katalisator) yang berfungsi mempercepat reaksi, dan katalis negatif (inhibitor) yang berfungsi memperlambat laju reaksi. Katalis
positif berperan menurunkan energi pengaktifan, dan membuat
orientasi molekul sesuai untuk terjadinya tumbukan. Akibatnya molekul gas yang teradsorpsi pada permukaan logam ini menjadi lebih reaktif daripada molekul gas yang tidak terabsorbsi. Prinsip ini adalah kerja dari katalis heterogen, yang banyak dimanfaatkan untuk mengkatalisis reaksi-reaksi gas.
Adapun mekanisme reaksi katalisis heterogen secara umum adalah sebagai berikut: 1. Difusi molekul reaktan ke permukaan katalis
2. Adsorpsi reaktan pada permukaan katalis. 3. Reaksi difusi reaktan pada permukaan katalis. 4. Reaksi dalam lapisan adsorpsi.
5. Desorpsi produk reaksi dari permukaan katalis. 6. Abfusi pada produk keluar dari permukaan katalis
Mekanisme katalisis heterogen menurut Langmuir-hinshelwood 1. Atom A dan B teradsorpsi kepermukaan katalis.
2. Atom A dan B berdifusi melalui permukaan. 3. Atom A dan B berinteraksi satu sama lain. 4. Sebuah molekul terbentuk dan terjadi desorpsi Mekanisme katalisis heterogen menurut Rideal-Eley 1. Atom A diadsorpsi oleh permukaan katalis (k).
Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis.
2. Atom B lewat, kemudian berinteraksi dengan atom A yang ada dipermukaan katalis (k). Katalis menyediakan suatu permukaan dimana pereaksi-pereaksi (atau substrat) untuk sementara terjerap.
3. Atom A dan B saling berinteraksi satu sama lain 4. Sebuah molekul terbentuk dan terjadi desorpsi.
Terbentuk molekul produk dalam permukaan katalis kemudian terlepas molekul produk dari permukaan katalis. Ikatan dalam substrat-substrat menjadi lemah sehingga memadai terbentuknya produk baru. Ikatan antara produk baru dan katalis lebih lemah sehingga akhirnya terlepas. Permukaan padatan yang kontak dengan suatu larutan cenderung untuk menghimpun lapisan dari molekul-molekul zat terlarut pada permukaannya akibat ketidakseimbangan gaya-gaya pada permukaan. Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian yang berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi
kedalam gas utama merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis.
Permukaan spesifik, Specific surface yang besar lebih diharapkan karena laju perpindahan massa akan meningkat sehingga akan meningkatkan laju reaksi kimia secara keseluruhan. Permukaan spesifik yang besar ini berhubungan dengan diameter partikel yang kecil dan seluruh permukaan porinya. Pori yang kecil membatasi kemampuan senyawa mendifusi ke dalam permukaan sebelah dalam, internal surface, demikian juga difusi produk keluar dari pori. Sehingga didalam pemilihan diameter pori dan keseragaman diameter pori untuk menyediakan specific surface dan tahanan difusi didalam permukaan sebelah dalam perlu diperhatikan. Tahanan difusi yang terjadi di dalam katalis disebabkan karena gesekan antar molekul maupun dengan dinding pori. Proses heterogen selalu melibatkan energi aktivasi yang cukup besar sedang difusi dalam gas tidak melibatkan energi aktivasi. Didalam adsorpsi dan desorpsi sangat lambat didalam poses heterogen karena keduanya melibatkan energi aktivasi yang cukup besar.
Secara umum, apabila suatu partikel padat terdispersi dalam suatu media cair, maka partikel tersebut dapat melalui beberapa mekanisme, yaitu :
1. Terjadinya peristiwa adsorpsi yang bersifat selektif terhadap spesies bermuatan yang terdapat didalam dispersi tersebut.
2. Terjadinya peristiwa ionisasi gugus-gugus yang terdapat pada permukaan padatan, sehingga meninggalkan muatan tertentu pada permukaan padat tersebut. Mekanisme ini sering terjadi ketika pada suatu permukaan partikel padat terdapat gugus yang mudah terionisasi, misalnya –COOH.
Adsorpsi kimia menghasilkan pembentukan lapisan monomolekular adsorbat pada permukaan melalui gaya-gaya dari valensi sisa dari molekul-molekul pada permukaan. Adsorpsi fisika diakibatkan kondensasi molekular dalam kapiler-kapiler dari padatan. Secara umum, unsur-unsur dengan berat molekul yang lebih besar akan lebih mudah diadsorpsi. Terjadi pembentukan yang cepat sebuah kesetimbangan konsentrasi antar-muka, diikuti dengan difusi lambat ke dalam partikel-partikei. Laju adsorpsi keseluruhan dikendalikan oleh kecepatan difusi dari molekul-moleku l zat terlarut dalam pori-pori kapiler dari partikel. Bila digunakan logam atau oksidanya sebagai katalis maka kita berusaha untuk membuat permukaan yang dapat bekerja secara katalisis sebesar-besarnya. Untuk keperluan itu sering kali dipergunakan pendukung. Pendukung disini adalah dengan permukaan yang besar seperti batu apung, arang aktif oksida, aluminium, kalium oksida dan silikat oleh pelekatan bagian-bagian logam diatas bahan pendukung ini. Permukaan aktif kadang-kadang diperbesar sampai seratus kali lipat atau lebih. Karena itu bobot dari katalis dari yang sesungguhnya kadang-kadang hanya berjumlah sebagaian kecil dari seluruh bobot dari katalis yang sesungguhnya. Pada umumnya inhibitor adalah suatu zat kimia yang dapat menghambat atau memperlambat suatu reaksi kimia. Reaksi permukaan katalis dapat terhambat jika suatu substansi asing berikatan pada sisi aktif katalis sehingga memblok kepada subtrat molekul-molekul. Jenis penghambatan ini disebut peracunan dan penghambat atau katalis negatif tersebut merupakan racun katalis. Suatu katalis jika sudah terpakai beberapa kali maka aktivitasnya akan berkurang. Ini berarti bahwa kemampuan untuk mempercepat reaksi tertentu telah berkurang. Gejala ini dapat disebabkan oleh beberapa faktor diantaranya oleh suhu yang terlalu tinggi katalis dapat lumer sebagaian atau disenter, penyebab lain yaitu katalis dapat bereaksi dengan produk atau kotoran yang terdapat didalam bahan dasar. Penyebab yang terkenal dari pengurangan aktivitas katalis adalah belerang dan persenyawaan belerang, air lembab (vouch) dan uap minyak dapat dapat dimasukkan kedalam kelompok ini yang dikenal dengan racun katalis atau poisoning catalyst. Bila setelah beberapa waktu, aktivitas katalis telah turun sampai dibawah minimum yang dapat diterima, katalis itu harus apkir atau berhenti. Beberapa katalis yang tidak aktif dapat diperbaiki kembali dengan jalan regenerasi. Dalam hal ini dipergunakan uap, zat cair, zat asam atau gas lain. Katalis sering juga digenerasi dengan pengolahan memakai asam mineral, dimana logamnya dapat larut.
Didalam dunia industri katalis yang digunakan: 1. Harus murni
2. Stabil tehadap panas
3. Memiliki waktu hidup yang panjang 4. Dapat diregenerasi
6. Kesederhanaan dalam cara pembuatannya 7. Mudah didapat
8. Harganya murah
5. Contoh Katalis Heterogen
Sebagian besar reaksi antara daua phase misalnya pada interface dari gas – padat atau gas–cair, biasanya yang bertindak sebagai katalis adalah yang lebih padat, karenanya luas permukaan dari padatan harus benar – benar diperhatikan. Beberapa contoh yang dilakukan oleh dunia industri lain katalis akan menghasilkan lain produk :
a. Dekomposisi organik
C2H5OH (Al2O3 , 300oC ) C2H4 + H2O C2H5OH (Cu , 300oC ) CH3CHO + H2O b. Dehidrogenasi
C4H8 (Al2O3, Cr2O3 ) CH2=CHCH=CH2 + H2 Ethyl Benzene (Fe2O3, 650oC) Styrene + H2 c. Hidrasi hidrokarbon takjenuh
Dengan adsorben asam posforat dan katalis celite maka
C2H4 + H2O (300oC ) C2H5O H d. Hidroclorinasi
Vinil clorida dibuat dengan katalis merkuriclorida dan arang dari reaksi CHCH + HCl (200oC) CH2=CHCl
Umumnya katalis heterogen berupa zat padat yang terdiri dari logam atau oksida logam. Contoh-contoh dari katalis heterogen adalah zeolit, CaO, MgO, dan resin penukar ion. Proses katalitik menggunakan katalis heterogen dalam industri pertama kali pada tahun 1857, menggunakan Pt untuk mengoksidasi SO2 menjadi SO3 dalam larutan asam.
Tabel 3.1. Beberapa contoh katalis heterogen dalam dunia industri
Reaksi Katalis
C4H10 ® Butena dan C4H6 (butadiena)CH4 atau hidrokarbon lain + H2O ® CO + H2
C2H2 + 2H2 ® C2H6 Hidrocraking
CO + 2H2 ® CH3OH
Cr2O3 – Al2O3Ni support
Pd dalam Al2O3 atau padatan pendukung Ni-Sulfida.
Logam (seperti Pd) pada zeolit Promotor ZnO dengan Cr2O3 atau promoter Cu1 – ZnO dengan Cr2O3 atau Al2O3.
Katalisis heterogen sejauh ini adalah jenis katalisis yang paling penting dalam kimia industry, terutama dalam sintesis berbagai bahan kimia penting. Di sini dijelaskan dua contoh katalisis heterogen yang spesifik.
Pembuatan Asam Nitrat
Asam nitrat ialah salah satu asam anorganik yang paling penting. Asam ini digunakan dalam produksi pupuk, zat warna,obat-obatan dan bahan peledak. Metode industri yang utama dalam memproduksi asam nitrat ialah proses Ostwalk. Bahan awalnya yaitu ammonia dan molekul oksigen, dipanaskan dengan tambahan adanya katalis platina-rodiumsampai sekitar 800̊ C :
4NH3(g) +5O2(g) → 4NO(g) +6H2O(g)
Nitrat oksida yang terbentuk mudah teroksidasi (tanpa katalis) menjadi nitrogen dioksida: 2NO(g) + O2 → 2NO2(g)
Ketika dilarutkan di dalam air, NO2 membentuk asam nitrit dan asam nitrat: 2NO2(g) + H2O(l) → HNO2(aq) + HNO3(aq) Jika dipanaskan, asam nitrit berubah menjadi asam nitrat sebagai berikut:
3HNO2(aq) → HNO3(aq) + H2O(l) + 2NO(g)
NO yang dihasilkan dapat didaur ulang untuk menghasilkan NO2 pada tahap kedua. Konverter Katalitik
Pada suhu tinggi di dalam mesin mobil yang sedang berjalan gas nitrogen dan oksigen bereaksi membentuk nitrat oksida:
N2(g) + O2(g) → 2NO(g)
Ketika lepas ke atmosfer, NO segera bergabung dengan O2 membentuk NO2. Nitrogen dioksida dan gas lain yang diemisikan oleh mobil, seperti karbon monoksida (CO) dan berbagai hidrokarbon yang terbakar, menjadikan mobil sebagai sumber pencemar udara yang utama. Sebagian besar mobil baru dilengkapi dengan converter katalitik. Konverter katalitik yang efisien memiliki dua tujuan : mengoksidasi CO dan H2O, dan mereduksi NO dan NO2 menjadi N2 dan O2. Gas buang panas yang telah diinjeksi dengan udara dilewatkan ke bilik pertama dari salah satu converter untuk mempercepat pembakaran hidrokarbon yang sempurna dan untuk menurunkan emisi CO. Namun karena suhu tinggi meningkat produksi NO, diperlukan satu lagi bilik kedua yang berisi katalis berbeda (logam transisi atau oksida logam transisi) dan bekerja pada suhu yang lebih rendah untuk menguraikan NO menjadi N2 dan O2 sebelum gas dibuang lewat knalpot.
Mekanisme dari katalis padat dengan reaktan fasa gas, dimana terjadi pembentukan kompleks reaktan dengan katalis setelah pembentukan produk adalah sebagai berikut :
2. Difusi reaktan dari permukaan luar masuk melalui pori dalam partikel katalis. 3. Reaktan diadsorpsi pada sisi aktif katalis sehingga menimbulkan energi adsorpsi 4. Reaksi pembentukan produk antara permukaan sampai terjadinya produk. 5. Produk didesorpsi dari katalis keluar melalui pori bagian partikel katalis. 6. Difusi produk menuju permukaan luar partikel katalis.
7. Produk mengikuti aliran gas pembawa.
Persyaratan kunci dalam katalisis heterogen ialah bahwa pereaksi fase gas atau larutan diadsorpsi kepermukaan katalis. Tidak semua atom – atom permukaan sama efektifnya sebagai katalis, bagian yang efektif tersebut disebut sisi aktif katalis. Pada dasarnya, katalis heterogen mencakup :
(1) adsorpsi pereaksi,
(2) difusi pereaksi sepanjang permukaan,
(3) reaksi pada sisi aktif membentuk hasil reaksi yang diadsorpsi, dan (4) lepasnya (desorpsi) hasil reaksi.
6. Peranan Katalis Heterogen
Katalis heterogen merupakan katalis yang memiliki fasa yang berbeda dengan reaktannya. Salah satu peranan katalis heterogen adalah Al2O3 sebagai katalis converter gas buang pada kendaraan bermotor. Jenis katalis heterogen yang berfungsi disini adalah Catalytic converter yang merupakan alat yang digunakan sebagai kontrol emisi gas buang yang diletakkan setelah exhaust manifold pada sistem pembuangan kendaraaan bermotor . Katalis automotive (converter) ini pertama kali didesain pada tahun 1975 di US yang bertujuan untuk mengurangi polusi udara dengan cara mengkonversi gas karbonmonoksida (CO), nitrogen oksida (NOx) dan hidrokarbon (HC) yang merupakan gas buang dari reaksi pembakaran bahan bakar yang tidak sempurna pada kendaraan bermotor.
Katalis heterogen penting juga dalam industry minyak. Salah satu terapan yang menarik adalah produksi bahan bakar cair sintesis seperti bensin dari minyak diesel dengan cara reaksi hidrogemn, H2 dengan karbon monoksida, CO. Dengan suatu katalis logam yang tepat seperti nikel atau kobalt, karbon monoksida akan bereaksi dengan hidrogen untuk menghasilkan air dan hidrokarbon. Penggunaan katalis pada alat control yang disebut auto exhaust emissions. Mobil-mobil yang dijual di Amerika sekarang dilengkapi dengan “catalytic converters”. Alat ini menggunakan suatu lempeng campuran oksida logam dimana gas-gas yang sudah kotor lewat setelah gas-gas tersebut bercampur dengan udara. Katalis secara efektif menaikkan oksidasi CO dan hidrokarbon lain-lain menjadi CO2 dan H2O. Katalis pada catalytic converters yang baru menghilangkan juga pencemar oksida nitrogen dengan mempercepat penguraiannya menjadi nitrogen dan oksigen.
Kekurangan alat ini adalah katalisnya dapat diracuni oleh logam Pb. Akibatnya, mobil yang menggunakannya harus menggunakan bensin yang bebas Pb (timbal). Kekurangan yang lain adalah katalis ini juga akan mempercepat oksidasi SO2 menjadi SO3 yang akan bereaksi dengan uap air membentuk uap asam sulfat. Oleh karena SO2 dihasilkan dari pembakaran bensin yang mengandung kadar sulfur yang tinggi, maka hal ini menjadi persoalan serius.
Keuntungan dari katalis heterogen adalah ramah lingkungan, tidak bersifat korosif, mudah dipisahkan dari produk dengan cara filtrasi, serta dapat digunakan berulangkali dalam jangka waktu yang lama. Selain itu, katalis heterogen meningkatkan kemurnian hasil karena reaksi samping dapat dieliminasi. Keuntungan
lain penggunaan katalis heterogen adalah katalisnya dapat
dipisahkan dengan penyaringan dari produk bila reaksi telah selesai. Banyak proses industri yang menggunakan katalis heterogen, sehingga proses dapat berlangsung lebih cepat dan biaya produksi dapat dikurangi. Beberapa logam ada yang dapat mengikat cukup banyak molekul-molekul gas pada permukannya, misalnya Ni, Pt, Pd dan V. Gaya tarik menarik antara atom logam dengan molekul gas dapat memperlemah ikatan kovalen pada molekul gas, dan bahkan dapat memutuskan ikatan itu.
II.3. BIOKATALIS
Biokatalisator adalah katalisator organik yang dihasilkan oleh sel.Enzim sangat penting dalam kehidupan, karena semua reaksi metabolisme dikatalis oleh enzim. Jika tidak ada enzim, atau aktivitas enzim terganggu maka reaksi metabolisme sel akan terhambat hingga pertumbuhan sel juga terganggu. Reaksi-reaksi enzimatik dibutuhkan agar bakteri dapat memperoleh makanan/ nutrient dalam keadaan terlarut yang dapat diserap ke dalam sel, memperoleh energi Kimia yang digunakan untuk biosintesis, perkembangbiakan, pergerakan, dan lain-lain.
Biokatalis disebut juga enzim. Merupakan senyawa protein berukuran koloid. Dijumpai dalam sistem biokimia dan makhluk hidup. Contoh: enzim-enzim dalam sistem pencernaan tubuh manusia enzim-enzim dalam tumbuhan.Bekerja pada suhu ambient. Setiap enzim mempunyai suhu optimum (suhu operasi ketika aktivitasnya mencapai maksimum). Peningkatan suhu di atas suhu optimumnya akan mengakibatkan kerusakan enzim (denaturasi protein).
Biasanya enzim mempunyai akhiran –ase. Di depan –ase digunakan nama substrat di mana enzim itu bekerja., atau nama reaksi yang dikatalisis. Misal : selulase, dehidrogenase, urease, dan lain-lain. Tetapi pedoman pemberian nama tersebut diatas tidak selalu digunakann. Hal ini disebabkan nama tersebut digunakan sebelum pedoman pemberian nama diterima dan nama tersebut sudah umum digunakan. Misalnya pepsin, tripsin, dan lain-lain. Dalam Daftar Istilah Kimia Organik (1978), akhiran –ase tersebut diganti dengan –asa.
Pada mulanya enzim dianggap hanya terdiri dari protein dan memang ada enzim yang ternyata hanya tersusun dari protein saja. Misalnya pepsin dan tripsin.Tetapi ada juga enzim-enzim yang selain protein juga memerlukan komponen selain protein. Komponen selain protein pada enzim dinamakan kofaktor. Koenzim dapat merupakan ion logam/ metal, atau molekul organik yang dinamakan koenzim. Gabungan antara bagian protein enzim (apoenzim) dan kofaktor dinamakan holoenzim. Enzim yang memerlukan ion logam sebagai kofaktornya dinamakan metaloenzim.. Ion logam ini berfungsi untuk menjadi pusat katalis primer, menjadi tempat untuk mengikat substrat, dan sebagai stabilisator supaya enzim tetap aktif. Seperti halnya katalisator, enzim dapat mempercepat reaksi Kimia dengan menurunkan energi aktivasinya. Enzim tersebut akan bergabung sementara dengan reaktan sehingga mencapai keadaan transisi dengan energi aktivasi yang lebih rendah daripada energi aktivasi yang diperlukan untuk mencapai keadaan transisi tanpa bantuan katalisator atau enzim.
Penggolongan (Klasifikasi) enzim 1. Hidrolase
Hidrolase merupakan enzim-enzim yang menguraikan suatu zat dengan pertolongan air. Hidrolase dibagi atas kelompok kecil berdasarkan substratnya yaitu :