i
PENGARUH INTERFERENSI ION KADMIUM (Cd2+) TERHADAP BIOSORPSI ION TIMBAL (Pb2+) OLEH SEL RAGI Saccharomyces
cereviseae PADA VARIASI WAKTU KONTAK DAN pH MEDIA
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan Guna Memperoleh Gelar Sarjana Sains Kimia
Oleh:
Ariqah Khoirunnisa 12307144016
JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
v MOTTO
“Hasbunallah wa ni’mal wakil (Cukuplah Allah menjadi penolong kami dan Allah adalah sebaik-baik pelindung.”
“Sesungguhnya pelindungku adalah Allah yang telah menurunkan Kitab (Al-Qur’an). Dia melindungi orang-orang saleh.”
(QS. Ali ‘Imran (7)μ 1λ6)
vi
PERSEMBAHAN
Dengan menyebut nama Allah Yang Maha Pengasih lagi Maha Penyayang
vii
KATA PENGANTAR
Assalamu’alaikum Warahmatullahi Wabarakatuh
Puji syukur dipanjatkan kehadirat Allah SWT Tuhan semesta alam atas
limpahan rahmat, karunia, dan hidayah-Nya. Sholawat dan salam selalu tercurahkan
kepada nabi besar Muhammad SAW yang dirindukan syafaatnya di yaumul qiyamat
nanti. Alhamdulillah atas berkat rahmat Allah SWT sehingga laporan tugas akhir ini
mampu terselesaikan.
Penelitian kimia berjudul “Pengaruh Interferensi Ion Timbal (Pb2+) terhadap
Biosorpsi Ion Kadmium (Cd2+) oleh Sel Ragi Saccharomyces cerevisiae pada Variasi
Waktu Kontak dan pH Media” telah dapat diselesaikan dengan baik sebagai
persyaratan memperoleh gelar sarjana sains yang telah ditetapkan oleh Jurusan
Pendidikan Kimia di Universitas Negeri Yogyakarta. Pada kesempatan ini
perkenankanlah penulis mengucapkan terima kasih kepada:
1. Bapak Dr. Hartono selaku Dekan FMIPA Universitas Negeri Yogyakarta yang
telah memberikan izin dalam penulisan tugas akhir ini.
2. Bapak Drs. Jaslin Ikhsan, M.App.Sc., Ph.D selaku Ketua dan Koordinator Tugas
Akhir Skripsi Program Studi Kimia, Jurusan Pendidikan Kimia, Universitas
Negeri Yogyakarta yang telah memberikan kelancaran pelayanan dan urusan
akademik.
3. Bapak Sunarto, M.Si selaku Dosen Penasehat Akademik yang telah memberikan
viii
4. Bapak Dr.rer.nat. Senam, selaku dosen pembimbing utama yang telah memberikan
bimbingan, pengarahan, dan saran.
5. Ibu Prof. Dr. Hj. Indyah Sulistyo Arty, M.S. selaku penguji utama, atas
pertanyaan, kritik, dan saran yang diberikan.
6. Ibu Dr. Das Salirawati, M.Si selaku penguji pendamping, atas pertanyaan, kritik,
dan saran yang diberikan.
7. Ibu Sulistyani, M.Si selaku sekretaris penguji, atas pertanyaan, kritik, dan saran
yang diberikan.
8. Seluruh Dosen, Staf, dan Laboran Jurusan Pendidikan Kiimia FMIPA UNY yang
telah banyak membantu selama perkuliahan dan penelitian.
9. Ibu, Ayah, adik dan seluruh keluargaku yang selalu mendoakan, mendukung,
memotivasi dan segala kasih sayangnya selama ini.
10. Dhaul, Zainab, Kara, Fia, Sita, Nado, Ifa, Tika, April, Titik, sahabat Kawanan
Wanita Bahagia yang selalu memberi dukungan, semangat, dan doa.
11. Teman-teman Kimia Swadana 2012 yang selalu memberi motivasi dan doa.
12. Karamina, mitra kerja selama penelitian yang sudah memberikan bantuan tenaga
dan motivasi.
13. Semua pihak yang telah membantu dan memberikan dukungan secara moral
maupun material dalam penyelesaian Tugas Akhir Skripsi ini, yang tidak dapat
penulis sebut satu per satu.
Semoga semua bantuan dan bimbingan yang telah diberikan kepada penulis,
ix
Penulis menyadari bahwa laporan tugas akhir ini jauh dari kesempurnaan, oleh
karena itu penulis mengharapkan kritik dan saran yang membangun dari berbagai
pihak demi kesempurnaan laporan ini. Semoga laporan ini dapat bermanfaat bagi
semua pihak dan perbaikan pendidikan di masa yang akan datang. Aamiin.
Wassalamu’alaikum Warahmatullahi Wabarakatuh
Yogyakarta, 24 November 2016
xi BAB III METODE PENELITIAN……….……....
A.Subjek dan Objek Penelitian ……….
1.Subjek Penelitian ………
1.Pembuatan Media Yeast Peptone Dextrosa (YPD) Padat ………...
2.Pembuatan Media Yeast Peptone Dextrosa (YPD) Cair ..………………. 3.Peremajaan Sel Ragi S. cerevisiae ………………………………………..
4.Pembuatan Kultur Awal (Starter) …………………………….…………..
5.Pengamatan Profil Pertumbuhan Ragi S. cerevisiae ……………….
6.Pembuatan Larutan Induk Pb2+ ………...
7.Pembuatan Larutan Induk Cd2+………..
8.Pengaruh Variasi Konsentrasi Pb2+ terhadap Pertumbuhan Ragi S. cerevisiae...
9.Pengaruh Interfensi Variasi Konsentrasi Cd2+ terhadap Pertumbuhan Ragi S.
cerevisiae ………...
10. Pengaruh Variasi Waktu Kontak terhadap Biosorpsi Ion Pb2+………... 11. Pengaruh Interferensi Ion Cd2+ terhadap Biosorpsi Ion Pb2+ oleh Sel Ragi S.
cerevisiae pada Variasi Waktu Kontak ……….………...
xii
12. Pengaruh Variasi pH Media terhadap Biosorpsi Ion Pb2+……….….. 13. Pengaruh Interferensi Ion Cd2+ terhadap Biosorpsi Ion Pb2+ oleh Sel Ragi S.
cerevisiae pada Variasi pH Media ……….…………..………...
E.Teknik Analisis Data ……….
1.Pengukuran dengan Spektrofotometri Serapan Atom (SSA)………... 43 44 45 45 BAB IV HASIL PENELITIAN DAN PEMBAHASAN……… A.Profil Pertumbuhan S. cerevisiae…...………...
B.Pengaruh Konsentrasi Ion Pb2+ terhadap Pertumbuhan Sel S. cerevisiae ………..
C.Pengaruh Interferensi Variasi Konsentrasi Ion Pb2+ terhadap Pertumbuhan Sel
S. cerevisiae ………
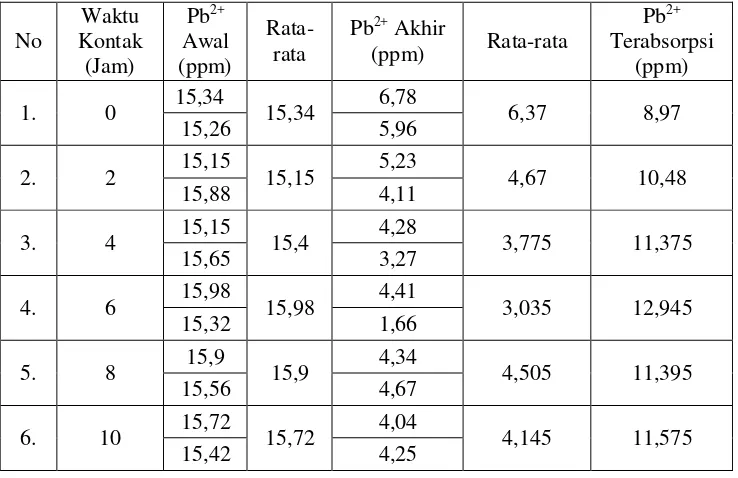
D.Pengaruh Waktu Kontak terhadap Efisiensi Biosorpsi Ion Pb2+………... E.Interfensi Ion Cd2+ terhadap Biosorpsi Ion Pb2+ pada Variasi Waktu Kontak ….. F. Pengaruh pH Media terhadap Efisiensi Biosorpsi Ion Pb2+…..……….…... G.Interfensi Ion Cd2+ terhadap Biosorpsi Ion Pb2+ pada Variasi pH Media ………..
H.Mekanisme Reaksi Biosorpsi ……..………. BAB V KESIMPULAN DAN SARAN ………...
xiii
DAFTAR TABEL
Tabel 1. Kandungan Asam Amino dalam Khamir S. cerevisiae…….…...…. 21 Tabel 2. Klarifikasi Kriteria Lunak-Keras Asam-Basa Lewis …………..… 23 Tabel 3. Volume Larutan Pb2+ pada Setiap Variasi Konsentrasi……….….. 38 Tabel 4. Volume Larutan Cd2+ pada Setiap Variasi Konsentrasi ………..… 40 Tabel 5. Data Absorbansi Kultur Ragi S. cerevisiae…………..……….….. 49 Tabel 6. OD600 Kultur Ragi S. cerevisiae pada Variasi Konsentrasi Pb2+.… 51 Tabel 7. OD600 Kultur Ragi S. cerevisiae pada Variasi Konsentrasi Cd2+.… 53 Tabel 8. OD600 Kultur Ragi S. cerevisiaepada Variasi Waktu Kontak…... 56 Tabel 9. Konsentrasi Ion Pb2+ yang Terbiosorpsi pada Variasi Waktu
Kontak ……… 58
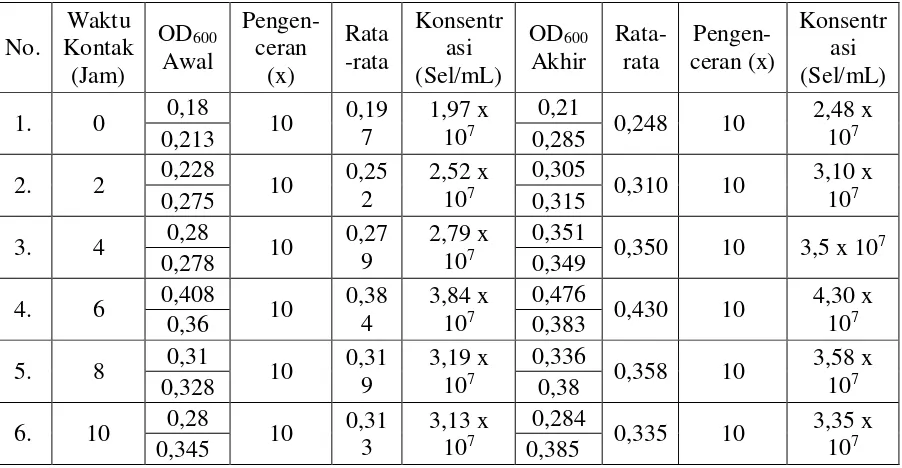
Tabel 10. Efisiensi Biosorpsi Ion Logam Pb2+ pada Variasi Waktu Kontak... 59 Tabel 11. OD600 Kultur Ragi S. cerevisiae pada Variasi Waktu Kontak
dengan Interferensi Cd2+……… 60
Tabel 12. Konsentrasi Ion Pb2+ yang Terbiosorpsi pada Variasi Waktu Kontak dengan Interferensi Cd2+...………...……… 62 Tabel 13. Efisiensi Biosorpsi Ion Logam Pb2+ dengan Interferensi Cd2+ pada
Variasi Waktu Kontak …... 63 Tabel 14. Efisiensi Biosorpsi Ion Logam Pb2+ tanpa dan dengan Interferensi
xiv
Interferensi Cd2+……….……… 71
Tabel 19. Konsentrasi Ion Pb2+ yang Terbiosorpsi pada Variasi pH Media dengan Interferensi Cd2+...………...……….…… 74 Tabel 20. Efisiensi Biosorpsi Ion Logam Pb2+ dengan Interferensi Cd2+ pada
Variasi pH Media …... 75 Tabel 21. Efisiensi Biosorpsi Ion Logam Pb2+ tanpa dan dengan Interferensi
Cd2+ pada Variasi pH Media ...………... 76 Tabel 22. Data Absorbansi Larutan Standar Timbal pada Variasi Waktu
Kontak tanpa Interfensi Cd2+……….. 94 Tabel 23. Data Absorbansi Larutan Standar Timbal pada Variasi pH Media
tanpa Interfensi Cd2+……….……….. 95 Tabel 24. Data Absorbansi Larutan Standar pada Variasi Waktu Kontak dan
pH Media dengan Interferensi Cd2+………...…………
96 Tabel 25. Perhitungan Korelasi X dan Y Larutan Standar Pb2+ pada Variasi
Waktu Kontak ………. 97
Tabel 26. Perhitungan Korelasi X dan Y Larutan Standar Pb2+ pada Variasi
xv
DAFTAR GAMBAR
Gambar 1. Strukur Kimia Kitin ………..………... 16
Gambar 2. Struktur Kimia metallothionein……….……... 16
Gambar 3. S. cerevisiae pembesaran 10 x 40 ………. 18
Gambar 4. Fase Pertumbuhan S. cerevisiae……… 20
Gambar 5. Gambar 6. Komponen pada Spektrofotometer Serapan Atom……… Kerangka Berpikir Biosorpsi Menggunakan S. cerevisiae... 25 30 Gambar 7. Kurva Pertumbuhan Sel Ragi S. cerevisiae………... 49
Gambar 8. Grafik Hubungan Konsentrasi Pb2+ dengan Besarnya OD600 ...… 51
Gambar 9. Grafik Hubungan Konsentrasi Cd2+ dengan Besarnya OD600 …... 54
Gambar 10. Hubungan antara OD600 Sel Ragi S. cerevisiae Sebelum dan Sesudah Dikontakkan pada Variasi Waktu Kontak ……….. 57
Gambar 11. Grafik Hubungan antara Variasi Waktu Kontak dengan Konsentrasi Pb2+……… 58 Gambar 12. Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi S. cerevisiae
pada Variasi Waktu Kontak …...
59 Gambar 13. Hubungan antara OD600 Sel Ragi S. cerevisiae Sebelum dan
Sesudah Dikontakkan pada Variasi Waktu Kontak dengan Ion
Pb2+ dan Cd2+………....
61 Gambar 14. Grafik Hubungan antara Variasi Waktu Kontak dengan
Konsentrasi Ion Pb2+ yang Terbiosorpsi dengan Adanya
Interferensi Cd2+………
63 Gambar 15. Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi S. cerevisiae
pada Variasi Waktu Kontak dengan Interferensi Cd2+ .…... 64 Gambar 16. Perbandingan Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi
S. cerevisiae tanpa dan dengan Interferensi Cd2+ pada Variasi
Waktu Kontak………...
xvi
Gambar 17. Perbandingan OD600 Sel Ragi S. cerevisiae Sebelum dan Sesudah Dikontakkan pada Variasi pH Media ………...
68 Gambar 18. Grafik Hubungan antara Variasi pH Media dengan Konsentrasi
Pb2+yang Terbiosorpsi ………..…………
69 Gambar 19. Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi S. cerevisiae
pada Variasi pH Media ………... Gambar 21. Grafik Hubungan antara Variasi pH Media dengan Konsentrasi
Ion Pb2+ yang Terbiosorpsi dengan Adanya Interferensi Cd2+..…
74 Gambar 22. Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi S. cerevisiae
pada Variasi pH Media dengan Interferensi Cd2+ …... 75 Gambar 23. Perbandingan Efisiensi Biosorpsi Ion Logam Pb2+ oleh Sel Ragi
S. cerevisiaetanpa dan dengan Interferensi Cd2+ pada Variasi pH
Media ………..………... Gambar 25. Kurva Kalibrasi Larutan Standar Timbal pada Variasi Waktu
Kontak tanpa Interfensi Cd2+……… 94 Gambar 26. Kurva Kalibrasi Larutan Standar Timbal pada Variasi pH Media
tanpa Interfensi Cd2+……….………
95 Gambar 27. Kurva Kalibrasi Larutan Standar pada Variasi Waktu Kontak
xvii
DAFTAR LAMPIRAN
Lampiran 1. Skema Kerja ... 84
Lampiran 2. Daftar dan Kurva Larutan Standar ………. 94
Lampiran 3. Uji Signifikansi Garis Regresi ………... 97
xviii
PENGARUH INTERFERENSI ION KADMIUM (Cd2+) TERHADAP BIOSORPSI ION TIMBAL (Pb2+) OLEH SEL RAGI Saccharomyces
cereviseae PADA VARIASI WAKTU KONTAK DAN pH MEDIA
Oleh :
Ariqah Khoirunnisa NIM. 12307144016
Pembimbing: Dr. rer. nat. Senam ABSTRAK
Penelitian ini bertujuan untuk mengetahui pengaruh waktu kontak dan pH media terhadap efisiensi biosorpsi ion Pb2+ oleh sel ragi S. cerevisiae dengan adanya pengaruh interferensi ion Cd2+. Subjek penelitian ini adalah ragi S. cerevisiae dan objek penelitian ini adalah biosorpsi ragi S. cerevisiae terhadap ion Pb2+. Penelitian ini dilakukan secara bertahap untuk mengetahui kondisi biosorpsi meliputi: (1) Penentuan profil pertumbuhan S. cerevisiae pada rentang waktu 0, 2, 4, 6, 8, 16, 24 dan 48 jam, (2) pengukuran terhadap pertumbuhan ragi S. cerevisiae dengan konsentrasi Pb2+ 0, 5, 10, 15, 20, dan 25 ppm, (3) pengukuran terhadap pertumbuhan ragi S. cerevisiae pada variasi waktu kontak 0, 2, 4, 6, 8 dan 10 jam tanpa dan dengan interferensi Cd2+, (4) pengukuran terhadap pertumbuhan ragi S. cerevisiae dengan pH media 3, 5, 7 dan 9 tanpa dan dengan interferensi Cd2+. Karakterisasi sampel dengan menggunakan Spectronic 20 dan Spektrofotometer Serapan Atom (SSA). Hasil penelitian menunjukkan bahwa variasi waktu kontak dan pH media berpengaruh terhadap pertumbuhan ragi S. cerevisiae. Pada waktu kontak 6 jam menunjukkan efisiensi pertumbuhan sebesar 45,31%. Pada pH 5 ragi S. cerevisiae menunjukkan biosorpsi optimum yaitu 43,78%.
xix
THE INFLUENCE OF CADMIUM ION (Cd2+) INTERFERENCE ON THE BIOSORPTION OF LEAD (Pb2+) ION BY S. cerevisiae YEAST
CELL IN THE VARIATION OF TIME CONTACT AND pH MEDIUM
By :
Ariqah Khoirunnisa
Number of Student: 12307144016
Supervisor: Dr. rer. nat. Senam ABSTRACT
The aim of this research are to study the influence of time contact and pH solution at on biosorption of Pb2+ by S. cerevisiae yeast with of interference Cd2+. The subject and the object of this research respectively were S. cerevisiae yeast and biosorption of it. The biosorption process was done step by step to get the best condition. The evaluation of the biosorption consist of: (1) Measurement growth of S. cerevisiae yeast in 0, 2, 4, 6, 8, 16, 24, and 48 hours, (2) Measurement growth of S. cerevisiae yeast with variation concentration: 0, 5, 10, 15, 20 and 25 ppm, (3) Measurenment growth of S. cerevisiae with contact time varied at 0, 2, 4, 6, 8 and 10 hours without Cd2+ and with existence of Cd2+, (4) Measurement growth S. cerevisiae
yeast at pH medium 3, 5, 7 and 9 without Cd2+ and with existence of Cd2+. Samples were characterized by Spectronic 20 and Atomic Absorbtion Spectrofotometer (AAS). The results showed that the growth efficiency of S. cerevisiae at 6 hours contact time was 45,31% and the optimum biosorption of it at media pH 5 was 43,78%.
1 BAB I PENDAHULUAN
A.Latar Belakang Masalah
Air yang menutupi hampir 70% permukaan bumi, memiliki peranan penting
sebagai sumber kebutuhan pokok makhluk hidup yang digunakan untuk
melangsungkan metabolisme, sistem asimilasi, menjaga keseimbangan tubuh dan
lain-lain. Saat ini pemenuhan terhadap air bersih menjadi perhatian khusus, seiring
dengan tingginya tingkat kepadatan penduduk serta meningkatnya aktivitas
penduduk dikarenakan adanya arus globalisasi. Arus globalisasi ini memberikan
pengaruh pada berbagai sektor perindustrian, pertambangan, dan transportasi yang
membawa dampak negatif bagi lingkungan dan manusia. Salah satu dampak
negatif ini berupa pencemaran lingkungan akuatik oleh logam berat.
Limbah logam berat pada lingkungan akuatik membahayakan
keberlangsungan lingkungan, terutama manusia. Peristiwa ini dapat dilihat pada
kasus pencemaran logam berat kadmium yang pernah terjadi di Toyama Jepang.
Peristiwa ini mengakibatkan penduduk menderita penyakit Itai-itai (Ouch-ouch),
yakni tulang mengalami pelunakan (osteomalacia), kemudian menjadi rapuh dan
otot mengalami kontraksi karena kehilangan sejumlah kalsium, serta menderita
2
Pencemaran logam dapat merusak jaringan makhluk hidup. Beberapa logam
berbahaya yang terdapat di lingkungan, antara lain antimony (Sb), arsen (As),
kadmium (Cd), kromium (Cr), kobalt (Co), timbal (Pb), zink (Zn), merkuri (Hg).
Nikel (Ni), strontium (Sr) dan selenium (Se). Pencemaran lingkungan oleh logam
mengganggu kesehatan makhluk hidup bahkan dapat menyebabkan kematian.
Timbal merupakan logam yang bersifat racun jika terakumulasi di dalam
tubuh. Top Hazardous Subtance Priority List (2013) menjelaskan bahwa timbal
menempati urutan ke dua sebagai zat yang paling sering ditemukan dan
menimbulkan potensi yang signifikan bagi kesehatan manusia. Timbal dapat
masuk dalam lingkungan dan tubuh manusia dari berbagai macam sumber, seperti
bensin (petrol), daur ulang atau pembuangan baterai mobil, mainan, cat, pipa,
tanah, beberapa jenis kosmetik dan obat tradisional dan berbagai sumber lainnya
(WHO, 2007).
Pencemaran lingkungan oleh limbah logam berat umumnya diatasi dengan
pengolahan secara fisiko-kimia dan fitoremediasi. Adapun cara-cara fisiko kimia
yang umum digunakan seperti reverse osmosis, elektrodialisis, ultrafiltrasi
pertukaran ion, dan pengendapan kimiawi. Akan tetapi pengolahan secara
fisiko-kimia dan fitoremediasi masih menyebabkan berbagai kerugian misalnya
pemindahan ion logam yang tidak sempurna, kebutuhan energi dan reagen yang
tinggi, biaya yang mahal, menghasilkan lumpur toksik atau produk lain yang justru
3
dibutuhkan pengolahan yang efektif dan efisein dalam usaha mengurangi
pencemaran logam berat.
Metode berbasis bioteknologi seperti biosorpsi atau bioakumulasi menjadi
metode alternatif yang dapat digunakan dalam menangani pencemaran logam
berat. Proses biosorpsi menggunakan mikroorganisme yang terdapat di alam,
seperti rumput laut, fungi maupun bakteri. Faktor utama dalam pemilihan
mikroorganisme tersebut berupa; organisme mudah tersedia di alam, dan dapat
mengalami pertumbuhan cepat, terutama dibudayakan atau diperbanyak untuk
keperluan biosorpsi; efektivitas biaya (Volesky, 2000).
Fungi dapat dibedakan menjadi yeast (khamir, sel ragi), kapang (mold),
cendawan dan jamur lendir. Jamur dan khamir mendapat perhatian yang besar
sebagai penyerap logam, terutama karena keduanya dapat diperoleh pada industri
fermentasi (Gadd, 1992). Ragi S. cereviseae pada penelitian ini digunakan sebagai
mikroorganisme model biosorben, telah banyak diteliti berkaitan dengan
potensinya sebagai biosorben dan bioakumulator, diantaranya karena mudah
diperoleh banyak digunakan pada proses fermentasi serta memiliki presentase
material dinding sel sebagai sumber pengikatan logam yang tinggi. Hasil penelitian
sebelumnya S. cerevisiae telah banyak digunakan dalam mengurangi logam berat,
seperti Zn, Cu, Co, serta Th (Veglio, 1996).
Pada penelitian ini mempelajari ion logam Pb2+ sebagai ion yang dibiosorpsi
oleh ragi S. cereviseae, sedangkan ion Cd2+ digunakan sebagai ion yang
4
memberikan alternatif dalam penanganan pencemaran oleh limbah yang
mengandung ion logam berat pada lingkungan. Proses biosorpsi ion Pb2+ yang
terinterferensi Cd2+ sebagai ion penganggu dari proses penyerapan timbal. Pada
penelitian ini dikaji berdasarkan pengaruh ion logam lain, yaitu Cd2+ pada variasi
waktu kontak, dan pH media yang dimungkinkan mampu mempengaruhi proses
biosorpsi ion Pb2+ oleh sel ragi S. cereviseae.
Pemilihan ion Pb2+ pada penelitian ini didasarkan pada kondisi di lingkungan
dimana banyak ditemui ion Pb2+ pada limbah industri yang mencemari
lingkungan. Pemilihan waktu kontak didasarkan pada pertumbuhan ragi S.
cereviseae yang diperoleh melalui pengamatan profil pertumbuhan ragi. Pengaruh
interferensi oleh logam Cd2+ dilakukan sebagai simulasi keberadaan ion lain dalam
limbah, serta untuk mengetahui pengaruhnya terhadap biosorpsi ion Pb2+ oleh ragi
S. cereviseae yang diambil berdasarkan konsep asam basa lunak keras.
Ion logam Cd2+ pada konsep asam basa lunak-keras terletak pada golongan
asam-lunak, sedangkan ion logam Pb2+ terdapat pada daerah batas. Alasan
menggunakan Cd2+ adalah untuk mengetahui kemampuan biosorpsi ragi
S.cereviseae terhadap kedua logam yang memiliki kemiripan antara pasangan
asam-basanya.
B.Identifikasi Masalah
Berdasarkan latar belakang penelitian ini dapat diidentifikasi masalah
5
1. Belum dilakukan pengolahan limbah cair yang mengandung logam berat timbal
secara optimal, sehingga limbah ion logam yang terbuang mencemari
lingkungan
2. Pengolahan limbah cair khususnya yang mengandung logam berat timbal
menggunakan biomassa S. cerevisiae belum dilakukan.
3. Adanya kemungkinan logam berat lain yang terdapat dalam kandungan limbah
cair yang mengandung timbal, seperti kadmium yang dapat mengganggu proses
biosorpsi.
4. Larutan logam berat timbal dan kadmium yang digunakan dalam penelitian ini
berupa larutan simulasi berupa Pb(NO3)2 dan CdSO4.
5. Pengolahan limbah cair logam berat timbal menggunakan konsentrasi timbal
(II) optimum dengan kondisi S. cerevisiae yang masih dapat hidup.
6. Pengolahan limbah cair yang mengandung logam berat timbal yang
diinterferensi logam kadmium dengan variasi waktu kontak dan pH media
belum diteliti.
C.Pembatasan Masalah
Berdasarkan identifikasi masalah dilakukan pembatasan masalah pada
penelitian ini sebagai berikut:
1. Media pertumbuhan yang digunakan yaitu media YPD (Yeast Peptone
6
2. Variasi konsentrasi larutan ion Pb2+ yang digunakan adalah 0; 5; 10; 15; 20; dan
25 ppm untuk mendapatkan konsentrasi optimum ragi S.cerevisiae masih dapat
hidup dengan baik.
3. Variasi konsentrasi interferensi larutan ion Cd2+ yang digunakan adalah 5; 10;
15; 20; dan 25 ppm untuk mendapatkan konsentrasi interferensi optimum ragi
S.cerevisiae masih dapat hidup dengan baik.
4. Variasi waktu kontak yang digunakan sebesar 0; 2; 4; 6; 8; dan 10 jam.
5. Variasi pH media yang digunakan 3, 5, 7 dan 9.
D.Rumusan Masalah
Rumusan masalah dalam penelitian ini meliputi:
1. Adakah pengaruh interferensi ion Cd2+ terhadap efisiensi biosorpsi ion Pb2+
oleh sel ragi S. cereviseae pada variasi waktu kontak?
2. Adakah pengaruh interferensi ion Cd2+ terhadap efisiensi biosorpsi ion Pb2+
oleh sel ragi S. cereviseae pada variasi pH media?
E.Tujuan Penelitan
Penelitian ini bertujuan untuk menguji:
1. Ada tidaknya pengaruh interferensi ion Cd2+ terhadap biosorpsi ion Pb2+ oleh
sel ragi S.cereviseae pada variasi waktu kontak.
2. Ada tidaknya pengaruh interferensi Cd2+ terhadap biosorpsi ion Pb2+ oleh sel
7 F. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat sebagai berikut:
1. Bagi masyarakat, menambah wawasan pengetahuan mengenai potensi lain sel
ragi S. cereviseae dalam membantu mengatasi pencemaran lingkungan dan
memberikan pengetahuan tentang bidang bioteknologi mengenai pemanfaatan
mikroorganisme ragi dalam kehidupan manusia.
2. Bagi mahasiswa, memberikan pengetahuan mengenai pengaruh interferensi ion
kadmium (II) terhadap biosorpsi ion timbal (II) oleh ragi S. cerevisiae pada
variasi waktu kontak dan pH media dan sebagai acuan bagi referensi
8 BAB II
TINJAUAN PUSTAKA
A.Deskripsi Teori
Deskripsi teori yang terkait dengan biosorpsi ion logam berat oleh
mikroorganisme disajikan secara rinci meliputi:
1. Pencemaran Lingkungan
Definisi pencemaran lingkungan menurut Undang-undang No. 23 tahun
1997 adalah masuknya dimasukkannya makhluk hidup, zat, energi dan
komponen lain ke dalam lingkungan hidup oleh kegiatan manusia sehingga
kualitasnya turun sampai ke tingkat tertentu yang menyebabkan lingkungan
hidup tidak dapat berfungsi sesuai dengan peruntukkannya, kemudian
Undang-undang tersebut diperbaharui kembali dengan Undang-Undang-undang No. 32 tahun
2009 menurut undang-undang tersebut pencemaran lingkungan adalah masuk
atau dimasukannya makhluk hidup, zat, energi dan atau komponen lain ke
dalam lingkungan hidup oleh kegiatan manusia sehingga melampaui baku mutu
lingkungan hidup yang telah ditetapkan.
Sumber pencemaran lingkungan dapat disebabkan oleh limbah industri
dan limbah domestik. Zat atau bahan yang dapat mengakibatkan pencemaran
lingkungan disebut polutan. Syarat-syarat suatu zat disebut polutan bila
keberadaannya dapat menyebabkan kerugian terhadap makhluk hidup. Suatu
9
berada pada waktu yang tidak tepat. Pencemaran lingkungan dalam bidang
industri menjadi suatu perhatian khusus dikarenakan sangat berbahaya bagi
kesehatan. Logam berat yang terkandung dalam pencemaran dalam bentuk ion
logamnya seperti, Zn2+, Ni2+, Cu2+, Pb2+, Ag2+, Cd 2+ dan Cu2+..
Kasus pencemaran timbal dalam lingkungan biasanya disebabkan hasil
samping industri. Industri kertas menghasilkan limbah cair timbal dalam
volume yang besar. Limbah cair tersebut merupakan air dari hasil filtrasi
limbah yang berupa bubur kertas encer yang apabila tidak dikelola dapat
mengganggu kehidupan makhluk hidup (Maharai Haryati dkk, 2012).
Pencemaran lingkungan oleh timbal kebanyakan berasal dari aktivitas manusia
yang mengekstraksi dan mengeksploitasi logam tersebut.
a. Timbal
Timbal (Pb) merupakan salah satu jenis logam berat yang sering juga
disebut dengan istilah timah hitam. Timbal memiliki titik lebur yang rendah,
mudah dibentuk, memiliki sifat kimia yang aktif, sehingga biasa digunakan
untuk melapisi logam agar tidak timbul perkaratan. Timbal adalah logam
yang lunak berwarna abu-abu kebiruan mengkilat dan memiliki bilangan
oksidasi +2 (Sunarya, 2007).
Timbal (Plumbum) beracun baik dalam bentuk logam maupun
garamnya. Garamnya yang beracun adalah: timbal karbonat (timbal putih);
10
asetat (merupakan penyebab keracunan yang paling sering terjadi). Ada
beberapa bentuk keracunan timbal, yaitu keracunan akut, subakut dan kronis.
Baku mutu udara ambien untuk timbal, yaitu sebesar 2,0 g/Nm3
berdasarkan PP RI No. 41 Tahun 1999. Public Health Service Amerika
Serikat (Evi Naria, 2005) menetapkan bahwa sumber-sumber air untuk
masyarakat tidak boleh mengandung timbal lebih dari 0,05 mg/L, sedangkan
WHO menetapkan batas timbal di dalam air sebesar 0,1 mg/L. Indonesia
mempunyai batas maksimum cemaran Timbal (Pb) pada bahan makanan
yang ditetapkan oleh Dirjen POM dalam Surat Keputusan Dirjen POM No.
03725/B/SK/VII/89 tentang Batas Maksimum Cemaran Logam dalam
Makanan. Bahan makanan seperti susu dan hasil olahannya kadar
maksimum adalah 1,0 ppm, untuk sayuran dan hasil olahannya maksimum
2,0 ppm, untuk ikan dan hasil olahannya maksimum 2,0 ppm, dan untuk
beberapa jenis bahan makanan lainnya (Eva Naria, 2005).
Kemungkinan pencemaran timbal (Pb) oleh manusia dikarenakan
luasnya penggunaan timbal oleh manusia seperti dalam bahan bakar bensin,
baterai, cat dan sebagainya (Nana Dyah dkk., 2004). Palar (Meyliana, 2013)
menjelaskan keracunan timbal dapat terjadi jika timbal atau persenyawaanya
masuk ke dalam tubuh. Sama seperti jenis logam berat lainnya, timbal dapat
masuk ke tubuh manusia melalui beberapa cara, antara lain: melalui
11
timbal maupun penetrasi melalui kulit. Peristiwa absorpsi melalui kulit
terjadi untuk senyawa timbal organik (alkil timbal dan naftalenat timbal).
Keracunan timbal dapat menyerang manusia dari berbagai usia. Akan
tetapi, anak usia muda, wanita hamil dan pekerja di industri tertentu lebih
besar resikonya dibandingkan kelompok yang lain (Kessel I & O’Connor,
1997). Anak-anak lebih sensitif dibandingkan orang dewasa karena pusat
perkembangan sistem saraf mereka masih berkembang (Albalak et al, 2003).
b. Kadmium
Widowati (Istana, 2014) menjelaskan kadmium merupakan logam
berwarna putih perak, lunak, mengkilap, tidak larut dalam basa, mudah
bereaksi, serta menghasilkan kadmium oksida bila dipanaskan. Kadmium
(Cd) umumnya terdapat dalam kombinasi dengan klor (Cd klorida) atau
belerang (Cd sulfit). Kadmium membentuk Cd2+ yang bersifat tidak stabil.
Cd memiliki nomor atom 40, berat atom 112,4, titik leleh 321°C, titik didih
767 °C dan memiliki masa jenis 8,65 g/cm3.
Seperti berbagai logam berat lain, logam kadmium membawa sifat
racun yang dapat merugikan makhluk hidup. Sarwoko Mangkoediharjo dan
Ganjar Hardianto (2009) menjelaskan bahwa meskipun kadmium
mempunyai konfigurasi elektronik dan sifat kimia yang mirip dengan seng
tetapi kadmium mempunyai daya racun yang lebih tinggi dibandingkan seng.
Daya racun atau toksisitas logam berat kadmium sangat tinggi, tetapi masih
12
mempunyai sifat mobilitas yang tinggi dalam tatanan lingkungan
dibandingkan logam berat lainnya, sehingga kadmium lebih mudah masuk
ke dalam rantai makanan dan terakumulasi dalam tubuh makhluk hidup.
Terpapar akut oleh kadmium menyebabkan gejala nausea (mual),
muntah, diare, kram otot, anemia, dermatitis, pertumbuhan lambat,
kerusakan ginjal dan hati, dan gangguan kardiovaskuler, emfisema dan
degenerasi testikular. Perkiraan dosis mematikan akut adalah sekitar 500
mg/kg untuk dewasa dan efek dosis akan nampak jika terabsorpsi 0,043
mg/kg per hari. Gejala akut keracunan Cd adalah sesak dada, kerongkongan
kering dan dada terasa sesak, nafas pendek, nafas terengah-engah, dan dapat
berkembang ke arah penyakit radang paru-paru, sakit kepala dan menggigil,
bahkan dapat diikuti dengan kematian. Gejala kronis keracunan Cd yaitu
nafas pendek, kemampuan mencium bau menurun, berat badan menurun,
gigi terasa ngilu dan berwarna kuning keemasan (Widaningrum dkk, 2007).
2. Pengolahan Limbah
Pemisahan logam berat dapat dilakukan secara fisika, kimia dan biologi.
Dyah Purwaningsih (2005) menjelaskan bahwa hampir semua logam berat
dapat dipisahkan dengan cara pengendapan dengan pH tinggi. Oleh karena itu
pada umumnya, cara pemisahan yang sering digunakan adalah cara kimia, yaitu
cara pengendapan dengan pH tinggi yang dilakukan dengan menambahkan
13
yang umum dilakukan adalah absorpsi menggunakan karbon aktif atau dengan
cara penyaringan menggunakan membran. Suyono (Dyah Purwaningsih, 2005)
menjelaskan bahwa pengolahan secara fisika-kimia dibebani suatu harapan
(terpenuhinya) kriteria efisien (tidak mahal) dan efektif. Namun ternyata cara
tersebut tidak memenuhi kedua kriteria secara kompherensif. Harris dan
Ramellow (1990) menjelaskan bahwa cara tersebut membutuhkan teknologi
tinggi, serta peralatan dan sistem monitor yang mahal. Selain itu kelemahannya
cara ini adalah dimasukkannya bahan kimia lain dalam proses pemisahannya.
Oleh karena itu, perlu dikembangkan suatu sistem pengolahan yang
menggunakan bahan (material) murah untuk memisahkan logam berat dari air
buangan. Cara lain yang digunakan yaitu fitoremediasi menggunakan tanaman
tertentu untuk membersihkan tanah, sedimen, dan air yang terkontaminsai
logam. Kerugian menggunakan metode ini ialah dibutuhkan waktu lama untuk
pemindahan logam dan regenerasi tanaman untuk proses biosorpsi lebih lanjut
sukar (Rakhmawati, 2006).
Metode pengolahan limbah logam berat terutama timbal yang perlu
dikembangkan yaitu dengan metode biosorpsi dengan menggunakan
mikroorganisme. Kratochvil & Volesky (Ahalya et al, 2006) menjelaskan
keuntungan utama biosorpsi dibandingkan dengan semua metode penanganan
limbah yang ada ialah murah, efisiensi tinggi, minim bahan kimia dan buangan
lumpur, tidak memerlukan nutrien tambahan, adanya regenerasi biosorben, dan
14 a. Biosorpsi
Biosorpsi merupakan suatu proses dalam pengikatan kation secara
pasif dengan menggunakan mikroorganisme hidup atau mati yang dapat
mengurangi toksisitas dari logam tersebut. Forest (Rakhmawati, 2006)
menjelaskan bahwa biosorpsi dapat didefinisikan sebagai kemampuan dari
materi biologi untuk mengakumulasi logam berat dari perairan baik dengan
cara fisiko-kimia maupun secara metabolik.
Proses biosorpsi melibatkan bahan padat (biosorben: materi biologi)
dan bahan cair (solven: biasanya digunakan air) mengandung logam berat
yang akan diserap (sorbat; ion logam). Dengan adanya daya afinitas yang
tinggi biosorben terhadap sorbat, sorbat akan ditarik dan terikat oleh
mekanisme yang berbeda(Rakhmawati, 2006).
Biosorpsi logam terjadi karena kompleksitas ion logam yang
bermuatan positif dengan pusat aktif yang bermuatan negatif pada
permukaan dinding sel atau dalam polimer-polimer ekstraseluler, seperti
protein dan polisakarida sebagai sumber gugus fungsi yang berperan penting
dalam mengikat ion logam. Proses penyerapan ini berlangsung cepat dan
terjadi pada sel hidup maupun sel yang telah mati (Volesky, 2000). Selain itu
biosorpsi juga terjadi karena adanya peristiwa pertukaran ion dimana ion
monovalent dan divalent seperti Na+, Mg2+, Ca2+, K+ pada dinding sel
15
Absorpsi logam berat (proses biosorpsi): melalui proses passive uptake
dan active uptake (Zarkasyi, 2008). Passive uptake merupakan proses yang
terjadi ketika ion logam berat terikat pada dinding sel biosorben. Mekanisme
passive uptake dapat dilakukan dengan dua cara, pertama dengan cara
pertukaran ion di mana ion pada dinding sel digantikan oleh ion-ion logam
berat; dan kedua adalah pembentukan senyawa kompleks antara ion-ion
logam berat dengan gugus fungsional seperti karbonil, amino, tiol, hidroksi,
posfat dan hidroksi-karboksil secara bolak balik dan cepat (Suhendrayatna,
2001; Ahalya et al., 2004). Dinding sel fungi sangat efisien untuk biosorpsi
logam karena adanya gugus-gugus fungsional yang dimilikinya. Polisakarida
fungi memiliki gugus amino, karboksi, fosfat, dan sulfat (Rakhmawati,
2006).
Protein dan polisakarida yang terdapat dalam fungi memiliki peran dan
proses biosorpsi logam karena ikatan-ikatan kovalen termasuk juga dengan
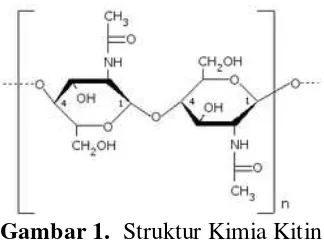
gugus amino dan karboksil. Gambar 1 memperlihatkan struktur kimia dari
kitin yang merupakan penyusun utama dinding sel S. cerevisiae. Kitin
memiliki gugus amino dan karboksil yang dapat berperan dalam biosorpsi
16
Gambar 1. Struktur Kimia Kitin
Mekanisme proses biosorpsi juga dapat diawali dengan pengikatan
logam pada gugus sulfur dari asam amino sistein yang terdapat pada dinding
sel S. cerevisiae. Protein reseptor akan mengenali adanya logam asing (non
esensial), selanjutnya gen akan mengkode untuk pembentukan
metallothionein dalam sel. Gambar 2 memperlihatkan strutur protein dalam
metallothionein. Protein metallothionein merupakan suatu protein pengikat
logam yang memiliki berat molekul 6000-7000 dalton, mengandung 30%
asam amino sistein. Kandungan sistein dan thiol yang tinggi menyebabkan
protein tersebut memiliki daya afinitas yang kuat terhadap logam
(Rakhmawati, 2006).
Gambar 2. Struktur Kimia Mettalothienin (Rakhmawati, 2006)
Active uptake merupakan mekanisme secara simultan terjadi berbagai
17
mikroorganisme dan akumulasi intraseluler ion logam tersebut. Logam berat
dapat diendapkan pada proses metabolisme, proses ini tergantung dari energi
yang terkandung dari energi yang tergantung dan sensifitasnya terhadap
parameter yang berbeda seperti pH, suhu dan kekuatan ionik.
Proses biosorpsi dapat dihambat oleh suhu yang rendah, tidak
tersedianya sumber energi dan beberapa penghambat metabolisme sel, selain
itu biosorpsi logam berat dengan sel hidup sangat terbatas dikarenakan oleh
akumulasi ion yang meracuni mikroorganisme. Mikroorganisme yang tahan
terhadap efek toksik dari ion logam dapat dihasilkan berdasarkan prosedur
seleksi yang ketat terhadap pemilihan jenis mikroorganisme yang tahan
terhadap kehadiran ion logam berat.
3. Saccharomyces cerevisiae
S. cerevisiae merupakan khamir sejati tergolong eukariot yang secara
morfologi hanya membentuk blastopora yang berbentuk bulat lonjong, silindris,
oval atau bulat telur yang dipengaruhi oleh strainnya. Dapat berkembang biak
dengan membelah diri melalui budding cell. Reproduksinya dapat dipengaruhi
oleh keadaan lingkungan serta jumlah nutrisi yang tersedia bagi pertumbuhan
sel. Penampilan makroskopik mempunyai koloni berbentuk bulat, warna kuning
muda, permukaan berkilau, licin, tekstur lunak dan memiliki sel bulat dengan
18
Gambar 3. S. cerevisiae Pembesaran 10 x 40 (Jean-Michel 2005).
Sel S. cerevisiae dapat tumbuh pada medium yang mengandung air gula
dengan konsentrasi tinggi. S. cerevisiae merupakan golongan khamir yang
mampu memanfaatkan senyawa gula yang dihasilkan oleh mikroorganisme
selulotik untuk pertumbuhannya. Spesies ini dapat memfermentasikan berbagai
karbohidrat dan menghasilkan enzim invertase yang bisa memecah sukrosa
menjadi glukosa dan frukosa serta dapat mengubah glukosa menjadi alcohol
dan karbondioksida sehingga banyak digunakan dalam industri pembuatan bir,
roti ataupun anggur (Fardiaz, 1992).
Terdapat beberapa faktor yang mempengaruhi pertumbuhan S. cerevisiae
yaitu (Agustining, 2012):
a. Suhu
S. cerevisiae memiliki suhu optimum untuk pertumbuhannya. Pada
posisi suhu dibawah minimal maupun diatas maksimal dapat menyebabkan
terjadinya denaturasi enzim sehingga S. cerevisiae tidak dapat tumbuh.
19 b. pH
Laju pertumbuhan mikroorganisme S. cerevisiae bergantung pada pH,
adanya perubahan pH dapat mempengaruhi permebilitas sel dan sintesis
enzim, oleh sebab itu diperlukan upaya dalam mempertahankan pH dan
buffer. Adapun nilai pH optimal untuk pertumbuhan S. cerevisiae berada di
antara 2,5-4,5.
Dalam tahapan pertumbuhannya S. cerevisiae mengalami enam fase
yaitu:
a. Fase Adaptasi (Lag Phase)
Fase ini merupakan fase dimana S. cerevisiae menyesuaikan diri
(adaptasi) dengan lingkungan barunya dan belum mengadakan perbanyakan
sel. Mikroba merombak substrat menjadi nutrisi untuk pertumbuhannya
(Satriyo Krido., dkk, 2011).
b. Fase Eksponensial / Pertumbuhan (Log Phase)
S. cerevisiae telah menyesuaikan diri dengan lingkungannya.
Pembelahhan sel terjadi secara sangat cepat secara eksponensial. Dalam
kondisi kultur yang optimum, sel mengalami reaksi metabolisme yang
maksimum. Fase eksponensial ini berlangsung selama 2 jam. Peristiwa ini
dapat menunjukkan bahwa kultur telah berada kondisi aktif dan proses
20 c. Fase Penurunan (Deceleration Phase)
Fase ini berlangsung selama 20 menit, dimana pertumbuhan
mengalami perlambatan (Satriyo Krido., dkk, 2011).
d. Fase Penetapan/ Konstan (Stationer Phase)
Pada fase ini kecepatan pertumbuhan S. cerevisiae adalah nol. Namun
demikian, bukan berarti tidak terjadi pertumbuhan sel. Konsentrasi biomassa
pada fase ini berada dalam keadaan maksimum. Pada fase ini menghasilkan
metabolisme sekunder, yaitu merupakan inhibitor dan bersifat racun. Nutrien
yang merupaka asupan nutrisi bagi S. cerevisiae mulai berkurang, sehingga
adanya persaingan antar mikroba yang mengakibatkan semakin cepat
kematian (Satriyo Krido., dkk, 2011).
e. Fase Kematian (Decline Phase)
Tahapan pada fase ini terhentinya aktifitas kehidupan S. cerevisiae,
dikarenakan tidak adanya energi yang digunakan untuk melakukan
metabolisme (Satriyo Krido., dkk, 2011).
21
Mekanisme dalam proses biosorpsi S. cerevisiae diawali dengan
pengikatan logam pada gugus sulfur yang terdapat dari asam amino sistein yang
terdapat pada dinding sel. Berikut kandungan asam amino yang terdapat dalam
S. cerevisiae:
Tabel 1. Kandungan Asam Amino dalam Khamir S. cerevisiae
No. Asam Amino Jumlah (%)
Gugus sulfur yang terdapat pada asam amino sistein sebesar 0,9% dalam
ragi S. cerevisiae dimungkinkan dapat mengikat logam berat seperti timbal dan
kadmium. Metallothionein sebagai protein pengikat logam (metal-binding
protein) berfungsi dan berperan dalam pengikatan atau penyekapan logam
dalam jaringan makhluk hidup. Kandungan dalam metallothionein berupa
residu sistein yang dibutuhkan dalam mendetoksifikasi logam-logam berat
dengan mengikat kation dalam logam transisi. Terdapat dua domain dalam
metallothionein yang mempunyai peran fungsional yaitu domain β (N-terminal)
yang terlibat dalam homeostasis dari ion logam esensial, dan domain α (C
22
Pertukaran ikatan dengan protein lain dalam metallothionein dapat
berlangsung dengan mudah, meskipun metallothionein dapat mengikat logam
dengan sangat kuat. Peristiwa ini karena ikatan metallothionein terhadap logam
memiliki kestabilan termodinamik yang tinggi namun stabilitas kinetiknya
rendah. Alasan inilah yang menjadikan metallothionein mempunyai fungsi
biologis sebagai distributor dan mediator intraseluler terhadap logam-logam
yang diikatnya (Ekawati, 2014).
4. Asam-Basa Lunak-Keras
Asam-basa lunak merupakan asam basa yang elektron valensinya mudah
dilepaskan, sedangkan asam-basa keras merupakan asam-basa yang mempunyai
sifat terpolarisasi rendah karena sifatnya yang tidak mempunyai elektron
valensi. Istilah lunak-keras bersifat relatif tanpa adanya pemisahan yang tajam
antara keduanya. Daerah batas umumnya banyak terdapat pada logam-logam
transisi. Golongan utama logam pada bagian kanan sistem periodik unsur
bersifat asam lunak. Beberapa ion logam tertentu bersifat asam lunak karena
muatan ion rendah dan keras karena muatan ion tinggi (Cowan, 1997).
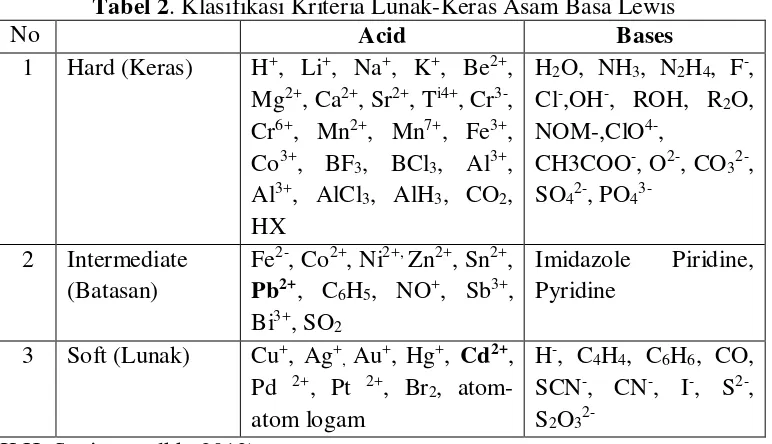
Pearson (1963) menjelaskan bahwa asam-basa Lewis dapat diklasifikasi
sebagai asam basa lunak (soft) atau keras (hard). Asam-basa lunak adalah asam
basa yang elektron-eletron valensinya mudah terpolarisasi atau dilepaskan,
sedangkan asam-basa keras adalah asam-basa yang tiak mempunyai elektron
23
Informasi yang paling penting untuk dipahami adalah bahwa istilah
lunak-keras bersifat relatif tanpa adanya pemisahan yang tajam (mendadak)
antara keduanya sehingga menghasilkan apa yang dapat dikatakan sebagai
“daerah batas” (borderline) bagi keduanya. Secara umum, ion logam-logam
yang terletak pada bagian kiri sistem periodik unsur bersifat asam keras;
peristiwa ini paralel dengan rendahnya sifat elektronegatif atau tingginya sifat
elektropositif logam-logam yang bersangkutan. Daerah batas umumnya
terdapat pada logam-logam transisi. Golongan utama logam pada bagian kanan
sistem periodik unsur bersifat asam lunak. Sifat asam juga berkaitan dengan
muatan ion; beberapa ion logam tertentu bersifat aman lunak bagi muatan ion
rendah dan keras bagi muatan ion ton tinggi. Beberapa contoh sifat asam-basa
menurut klasifikasi Pearson dapat diperiksa pada Tabel 2.
Tabel 2. Klasifikasi Kriteria Lunak-Keras Asam Basa Lewis
No Acid Bases
24 5. Pengukuran
Pengukuran untuk memperoleh data selama pelaksanaan penelitian
dilakukan menggunakan:
a. Spektronik 20
Spektronik 20 dapat mengukur kepekaan sel dalam suspensi dengan
parameter optical density (OD). Dalam mikrobiologi OD sebagai suatu
hitungan karena OD sebanding dengan jumlah sel dalam suspensi biakan
(Bibiana, 1994).
Dalam penggunaanya, penentuan jumlah sel dengan spektronik 20
dengan parameter OD memerlukan dua tahap. Pada tahap pertama,
spektronik 20 dikalibrasikan hingga mempunyai nilai 0 bila tidak ada sel.
Langkah ini dilakukan dengan memasukkan kuvet yang berisi larutan
blanko, sedangkan pada tahap kedua dilakukan dengan memasukkan kuvet
yang berisi larutan sampel hingga diperoleh nilai OD (Bibiana, 1994).
Pengukuran densitas optik dengan menggunakan spektronik 20
didasarkan pada pemisahan cahaya pada panjang gelombang 600 nm.
Panjang gelombang 600 nm memiliki warna oranye, pemilihan panjang
gelombang 600 nm ini dikarenakan dengan panjang gelombang 600 nm
bahan organik lebih mudah menyerap cahaya.
Prinsipnya gelombang cahaya akan melewati suspensi biakan hingga
25
diukur. Jumlah cahaya yang ditransmisikan setelah melewati biakan
berbanding terbalik dengan jumlah mikroorganisme.
Densitas optik suatu supensi tidak langsung menunjukkan jumlah
sampel dalam suatu populasi, namun menunjukkan jumlah cahaya yang
disebar oleh populasi tersebut. Untuk memperoleh jumlah sel
mikroorganisme, maka nilai kerapatan optik harus disetarakan dengan
jumlah organisme. Semakin besar OD600 maka semakin banyak selnya
(OD600 = 1 menjadi 107 sel/mL).
b. Spektroskopi Serapan Atom
Spektrofotometri serapan atom adalah suatu metode yang digunakan
untuk mendeteksi atom-atom logam dalam fase gas. Metode ini seringkali
mengandalkan nyala untuk mengubah logam dalam larutan sampel menjadi
atom-atom logam berbentuk gas yag digunakan untuk analisis kuantitatif
dari logam dalam sampel. Metode spektrofotometri serapan atom
berdasarkan pada prinsip absorpsi cahaya oleh atom. Atom-atom akan
menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat
unsurnya.
26
Spektroskopi serapan atom pada penelitian ini digunakan untuk
mengukur jumlah konsentrasi Pb2+ yang tersisa maupun Pb2+ yang sudah
terinteferensi oleh Cd2+. Metode analisis yang digunakan untuk mengukur
jumlah atom logam yang kembali dari energi tinggi menuju pada energi
dasarnya.
Khopkar (1990) menjelaskan bahwa metode ini mampu mendeteksi
logam sampai jumlah yang sangat kecil, yaitu bagian per juta (ppm). Dengan
metode pengukuran ini dapat mendeteksi kadar logam berat salah satunya
kadmium dan timbal dengan jumlah yang sangat kecil.
Energi radiasi disebabkan oleh terjadinya perpindahan elektron ke
tingkat energi yang lebih tinggi. Pengurangan interaksi yang ditimbulkan
sebanding dengan jumlah atom pada tingkat energi dasar yang menyerap
energi tersebut. Sehubungan dengan itu intensitas radiasi yang dapat diserap
menunjukkan konsentrasi unsur dalam suatu larutan (Khopkar, 1990).
Teknik analisis kuantitatif menggunakan spektrofotometer serapan
atom digunakan untuk mengukur konsentrasi larutan dalam sampel dengan
menggunakan kurva standar berdasarkan persamaan Lambert-Beer, A = bc.
Bila dan b tetap maka persamaan Lambert-Beer secara matematik dapat
dinyatakan dengan Y= aX. Y menyatakan besarnya absorbansi, X
menyatakan konsentrasi dan a menyatakan tetapan dengan a= bc,
27 B.Penelitian yang Relevan
Nunik Ekawati (2014) melakukan penelitian mengenai biosorpsi ion logam
Cd oleh biomassa S. cerevisiae dengan menggunakan logam simulasi. Biosorspi
dilakukan dengan menambahkan biomassa S. cerevisiae yang telah diinokulasi.
Hasil penelitian menunjukkan bahwa biomassa S. cerevisiae mencapai waktu
optimum pada jam ke-6 dan pada suhu 25oC biomassa S. cerevisiae mencapai suhu
optimum. Adanya interferensi logam lain mengakibatkan penurunan efisiensi
biosorpsi dari 24,57% menjadi 16,23% dan pada variasi suhu inkubasi terjadi
penurunan efisiensi dari 44,47% menjadi 35,22%.
Sunardi (2011) telah melakukan penelitian adanya penurunan kadar krom
(VI) dengan Sargassum Sp, S. cerevisiae dan kombinasinya pada limbah cair
industri batik. Berdasarkan hasil penelitian yang dilakukan S. cerevisiae dapat
digunakan untuk menurunkan kadar krom(VI) serta limbah cair industri batik.
Rahmadhan dan Handajani (2010), melakukan penelitian untuk mengetahui
biomassa S. cerevisiae sebagai biosorben untuk menyerap kandungan ion logam
Cr yang terdapat pada larutan. Penelitian dilakukan dengan menguji kemampuan
biosorpsi pada variasi pH, waktu kontak dan konsentrasi logam Cr. Berdasarkan
hasil penelitian menunjukkan bahwa biosorpsi tertinggi mencapai 45% dengan
kapasitas adsorpsi maksimum sebesar 62,5 mg Cr/g sorben.
Muwardi et al (1997) telah meneliti mengenai pemanfaatan biomassa S.
cerevisiae untuk penyerapan logam Pb2+. Hasil penelitian menunjukkan bahwa
28
dengan serapan maksimum 33,04 mg Pb/g biomasaa. Veglio dan Beolchini (1996)
telah menunjukkan kapasitas biosorpsi dari S. cerevisiae dalam mengurangi
logam-logam seperti kobalt, zink, serta uranium.
C.Kerangka Berpikir
Pesatnya arus globalisasi yang ditandai dengan perkembangan industri
menyebakan pencemaran logam berat pada lingkungan, terutama pada lingkungan
perairan. Logam berat yang banyak ditemukan di alam berupa timbal, yang
menempati urutan ke dua sebagai zat yang paling sering ditemukan dan
menimbulkan potensi yang signifikan bagi kesehatan manusia. Selain logam
timbal tidak menutup kemungkinan adanya logam-logam berat lain yang terbawa
dan mampu menyebabkan pencemaran lingkungan akuatik juga. Dalam penelitian
ini digunakan logam berat kadmium sebagai simulasi keberadaan logam lain di
alam.
Untuk mengatasi masalah pencemaran logam tersebut perlu dilakukan
penelitian dengan metode yang ramah lingkungan, salah satunya dengan biosorspi
memanfaatkan sel ragi dengan menggunakan mikroorganisme. Mikroorganisme
seperti jamur, khamir, bakteri, alga secara efisen dapat menyerap logam berat
dengan memiliki berbagai keunggulan lebih murah dibandingkan metode
fisika-kimia. Penelitian ini menggunakan mikroorganisme S. cerevisiae yang berpotensi
sebagai biosorben dan bioakumulator logam berat, diantaranya karena material
29
Penelitian ini mengkaji mengenai kemampuan ragi S. cerevisiae dalam
mengabsorpsi Pb2+ yang tercampur ion logam Cd2+ yang keduanya berbeda
kelompok sesuai klasifikasi asam basa lunak-keras. Hal ini dilakukan berdasarkan
keberadaan ion-ion logam lain dalam limbah selain ion Pb2+ yang mungkin dapat
mengabsorpsi ion Pb2+.
Ion logam dapat diabsorpsi oleh mikroorganisme S. cerevisiae dengan cara
berikatan dengan gugus sulfida dan asam amino sistein pada protein dinding sel
ragi S. cerevisiae. Berdasarkan klasifikasi asam basa lunak keras gugus sulfida
termasuk ke dalam golongan basa lunak. Dengan demikian, secara teori dapat
diramalkan bahwa gugus sulfida akan cenderung mengikat ion golongan asam
lunak atau ion daerah batas.
Berdasarkan konsep asam basa lunak keras ion logam Pb2+ dan ion logam
Cd2+ terletak pada klasifikasi yang berbeda. Pb2+ terletak pada daerah batas dan
Cd2+ terletak pada daerah asam lunak. Ditinjau dari elektron valensi gugus sulfida
dan ion Pb2+ mempunyai elektron yang sesuai yaitu 2- dan 2+, sehingga
dimungkinkan akan lebih mudah terjadi ikatan. Berdasarkan beberapa
kemungkinan di atas maka interferensi ion Cd2+ diduga akan berpengaruh dalam
mempengaruhi biosorpsi ragi S. cerevisiae terhadap logam Pb2+ apabila kedua ion
30
Pada penelitian ini dilakukan dengan menggunakan berbagai variasi yaitu
waktu kontak dan pH media untuk mengetahui efisiensi biosorpsi ion Pb2+ yang
terinteferensi ion logam Cd2+. Secara ringkas kerangka berpikir dapat ditampilkan
melalui Gambar 6.
31 BAB III
METODE PENELITIAN
A.Subjek dan Objek Penelitian
Subjek dan obyek penelitian ini dijelaskan secara rinci dengan memisahkan
antara subyek penelitian dan obyek penelitian.
1. Subjek Penelitian
Subjek penelitian ini berupa sel ragi S. cerevisiae yang mampu
membiosorpsi ion Pb2+ yang diinterferensi oleh ion Cd2+ pada pengaruh variasi
waktu kontak dan pH media.
2. Objek Penelitian
Objek penelitian ini berupa absorptivitas sel ragi S. cereviseae terhadap
ion Pb2+ yang diinterferensi oleh ion Cd2+ pada pengaruh variasi waktu kontak
dan pH media.
B.Variabel Penelitian
Variabel penelitian ini terdiri dari variabel bebas dan variabel terikat yang
masing-masing variabel dijelaskan pada bagian berikut.
1. Variabel Bebas
Variabel bebas pada penelitian adalah variasi perbandingan Pb2+ dan Cd2+
32 2. Variabel Terikat
Variabel terikat pada penelitian ini adalah jumlah ion Pb2+ yang dibiosorpsi
oleh sel ragi S. cereviseae pada media pertumbuhan yang mengandung ion
Pb2+.
C.Instrumen Penelitian
Instrumen dalam penelitian ini terdiri dari alat penelitian, bahan penelitian,
dan tempat penelitian sebagai berikut.
1. Alat Penelitian
Alat yang digunakan dalam penelitian ini antara lain: Spektrofotometer
Serapan Atom (SSA), Shaker Eyela, Autoklaf Model 25 No 25X Wiscosin
Aluminium, sentrifuge H-103n Kokusan, laminar air flow (LAF) SCB- 4000A
Shimadzu, timbangan analitik, tabung sentrifuge, mikropipet 10 mL; 5mL; dan
1 mL, labu ukur 100 mL, erlenmeyer, cawan petri, tabung reaksi, beakerglass,
kawat ose, pipet tetes, stopwatch, tip, dan tabung fihn.
2. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini antara lain: yeast
extract, bacto pepton, bacto agar, sel ragi S. cerevisiae, NaOH 0,5 M, HNO3
0,5 M, serbuk Pb(NO3)2, serbuk CdSO4, kapas, kasa, kertas payung, karet dan
33 3. Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi FMIPA UNY dan
Laboratorium Kimia Organik FMIPA UNY.
D.Prosedur Penelitian
Sebagian besar kerja dan penelitian ini dilakukan dalam kondisi steril untuk
menghindari adanya kontaminasi, terutama ketika menggunakan media
pertumbuhan dan inokulasi sel ragi. Inokulasi dilakukan di Laminar Air Flow
(LAF) yang sebelumnya telah diberi sinar ultraviolet dan disemprot dengan
alkohol 70%.
Semua peralatan gelas, kawat ose, YPD ( Yeast Peptone Dextrosa ) cair dan
padat harus disterilkan terlebih dahulu menggunakan autoklaf pada suhu 121 ͦ C
dan tekanan 1 atm selama 15 menit (Widyatmoko, 2012).
Pengukuran koloni mikroorganisme berdasarkan jumlah koloni secara
kualitatif menggunakan spektronik 20 dengan = 600 nm. Sedangkan pengukuran
secara kuantitatif dengan mengukur kadar timbal menggunakan SSA.
1. Pembuatan Media Yeast Pepton Dekstrosa (YPD) Padat
Sebanyak 2 g glukosa, 1 g yeast extract, 2 g agarosa dan 2 g bacto pepton.
Bacto pepton, yeast extract, dan agarosa dimasukkan ke dalam erlenmeyer 250
mL dan ditambah akuades hingga volume 70 mL. Glukosa dimasukkan dalam
34
larutan disterilkan dengan autoklaf pada suhu 121 ͦC selama 10 menit dan
tekanan 1 atm, kemudian larutan dicampur di dalam Laminar Air Flow. Media
dituangkan pada cawan petri dan ditunggu sekitar 10 menit hingga memadat
(Widyatmoko, 2012). Media YPD padat dapat digunakan setelah dua hari untuk
melihat ada tidaknya kontaminasi jamur lain.
2. Pembuatan Media Yeast Pepton Dekstrosa (YPD) Cair
Sebanyak 2 g glukosa, 1 g yeast exctract, dan 2 g bacto pepton ditimbang.
Bacto pepton dan yeast extract dicampur dalam erlenmeyer 250 mL dan
ditambah akuades hingga volume 70 mL. Glukosa dimasukkan dalam
erlenmeyer lain dan ditambah akuades hingga volume 30 mL. Masing–masing
larutan disterilkan dengan menggunakan autoklaf pada suhu 121oC selama 10
menit dan tekanan 1 atm, kemudian larutan dicampur di dalam Laminar Air
Flow. Media YPD cair siap digunakan (Widyatmoko, 2012).
3. Peremajaan Sel Ragi S. cerevisiae
Media YPD padat pada cawan petri disiapkan. Sel ragi alami (wild type S.
cereviseae) sebagai sel stok diambil dengan kawat ose steril. Sel yang
menempel pada kawat ose digesekkan pada media YPD padat, kemudian
35
berperan sebagai sel stok dan disimpan pada alat pendingin dengan suhu 4oC
untuk dapat digunakan pada penelitian selanjutnya ( Widyatmoko, 2012).
4. Pembuatan Kultur Awal (Starter)
Media YPD cair yang telah disterilkan menggunakan autoklaf
dimasukkan ke dalam erlenmeyer. Sel ragi pada media diambil menggunakan
ose steril, kemudian dimasukkan ke dalam 10 mL YPD cair. Inkubasi dilakukan
pada suhu kamar selama 12 jam (Widyatmoko, 2012).
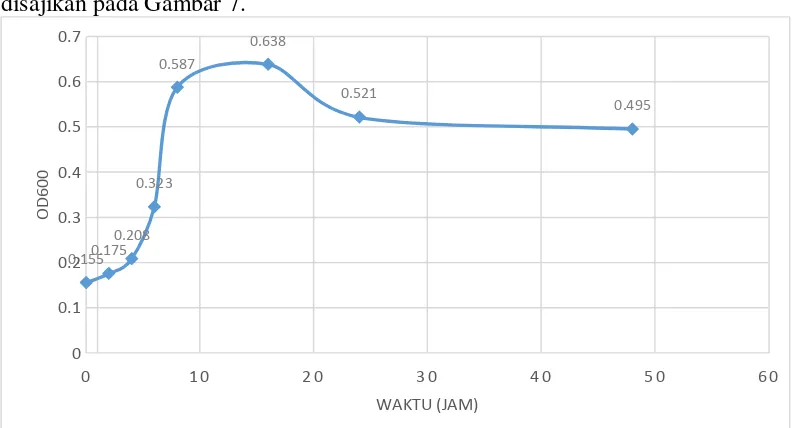
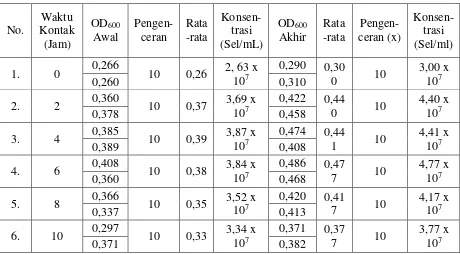
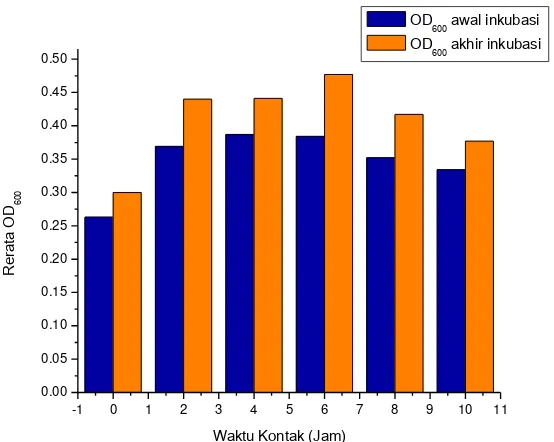
5. Pengamatan Profil Pertumbuhan Ragi S. cerevisiae
Sebanyak 25 mL media YPD cair dimasukkan dalam 2 buah Erlenmeyer
250 mL yang telah disterilkan terlebih dahulu. Media ditambah dengan starter
masing-masing 0,5 mL (dari metode 4). Kultur tersebut diinkubasi
menggunakan shaker dengan kecepatan 125 ppm pada suhu kamar selama 48
jam (erlenmeyer ditutup dengan kapas). Pengukuran OD600 dilakukan pada jam
ke 0, 2, 4, 6, 8, 16, 24 dan 48. Profil pertumbuhan ragi S.cereviseae diketahui
dengan menghubungkan grafik antara waktu kontak dengan OD600
(Widyatmoko, 2012).
6. Pembuatan Larutan Induk Pb2+
Pembuatan larutan induk Pb2+ dilakukan dengan menimbang serbuk
36
Larutan tersebut kemudian dimasukkan dalam labu ukur 100 mL dengan
menambahkan akuades hingga tanda batas. Kemudian larutan digojog hingga
homogen. Larutan induk ini disterilkan menggunakan autoklaf pada suhu 121oC
selama 10 menit dan tekanan 1 atm. Pembuatan larutan induk didasarkan pada
perhitungan (Widyatmoko, 2012).
Massa kristal Pb(NO3)2 =
=
= 159,848 mg
7. Pembuatan Larutan Induk Cd2+
Pembuatan larutan induk Cd2+ dilakukan dengan menimbang serbuk
CdSO4 dan dilarutkan dengan akuades hingga larut dalam erlenmeyer. Larutan
tersebut kemudian dimasukkan dalam labu ukur 100 mL dengan menambahkan
akuades hingga tanda batas. Kemudian larutan digojog hingga homogen.
Larutan induk ini disterilkan menggunakan autoklaf pada suhu 121oC selama
10 menit dan tekanan 1 atm. Pembuatan larutan induk didasarkan pada
perhitungan (Widyatmoko, 2012).
Massa kristal CdSO4 =
=
37
8. Pengaruh Variasi Konsentrasi Pb2+ terhadap Pertumbuhan Ragi S. cerevisiae
Tahap ini dilakukan untuk memperoleh informasi mengenai konsentrasi
larutan Pb2+ maksimum dengan kondisi sel ragi yang masih dapat hidup dengan
baik. Variasi konsentrasi larutan Pb2+ yang digunakan yakni 0; 5; 10; 15; 20 dan
25 ppm (masing-masing dilakukan secara duplo).
Volume larutan Pb2+ yang ditambahkan dapat ditentukan dengan rumus
pengenceran berikut.
V1 x C1 = V2 x C2
Keterangan:
V1 : volume larutan Pb2+ yang akan ditambahkan
C1 : konsentrasi larutan Pb2+ yang akan ditambahkan
V2 : volume total sampel
C2 : konsentrasi larutan Pb2+ total sampel
Volume total sampel yaitu 10 mL termasuk 0,5 mL starter. Melalui rumus
di atas, maka akan diperoleh volume larutan Pb2+ yang ditambahkan pada setiap
38
Tabel 3. Volume Larutan Pb2+ pada Setiap Variasi Konsentrasi
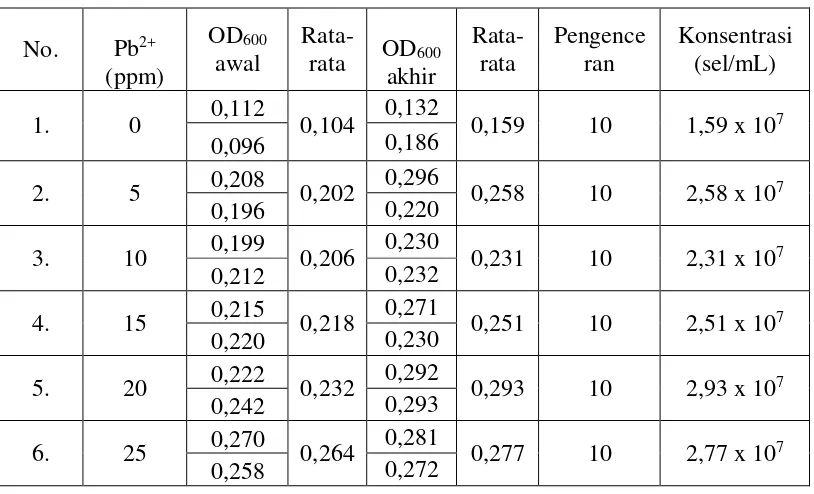
No. Konsentrasi
Sebanyak 12 buah erlenmeyer yang sudah disterilkan dengan autoklaf
diisi dengan media YPD cair sesuai dengan tabel di atas. Setiap dua erlenmeyer
diisi masing-masing 9,5 mL; 9,45 mL; 9,4 mL; 9,35 mL; 9,3 mL; dan 9,25 mL.
Starter sebanyak 0,5 mL ditambahkan pada masing-masing media cair dan
diinkubasi selama 6 jam, kemudian dilakukan pengukuran OD600 setelah media
diinkubasi.
Larutan Pb2+ ditambahkan sesuai dengan variasi konsentrasi, setelah
media diinkubasi selama 6 jam. Masing-masing kultur diinkubasi kembali
menggunakan shaker dengan kecepatan 125 rpm selama 10 jam (sesuai hasil
dari profil pertumbuhan ragi) pada suhu kamar. Untuk mengetahui jumlah sel
ragi yang mampu hidup dalam media yang telah diberi Pb2+, dapat dilakukan
pengukuran dengan menggunakan spektronik 20. Data yang didapatkan berupa
OD600 pada variasi konsentrasi Pb2+. Data ini kemudian digambarkan dalam
sebuah grafik yang menjelaskan mengenai konsentrasi Pb2+ optimum dimana
39
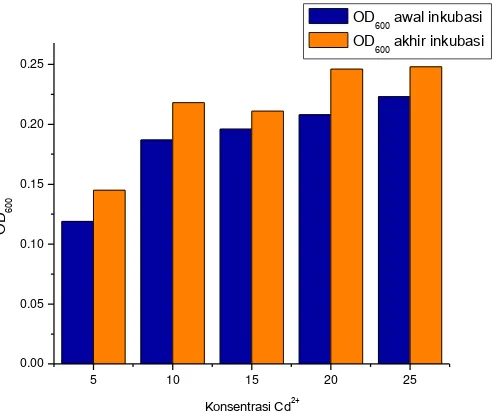
9. Pengaruh Interferensi Variasi Konsentrasi Cd2+ terhadap Pertumbuhan Ragi S. cerevisiae
Tahap ini dilakukan untuk memperoleh informasi mengenai konsentrasi
larutan Cd2+ maksimum dengan kondisi sel ragi yang masih dapat hidup dengan
baik. Variasi konsentrasi larutan Cd2+ yang digunakan yakni 5; 10; 15; 20 dan
25 ppm (masing-masing dilakukan secara duplo).
Volume larutan Pb2+ yang ditambahkan disesuaikan dari hasil konsentrasi
pengaruh variasi konsentrasi Pb2+, sedangkan volume larutan Cd2+ dapat
ditentukan dengan rumus pengenceran berikut.
V1 x C1 = V2 x C2
Keterangan:
V1 : volume larutan Cd2+ yang akan ditambahkan
C1 : konsentrasi larutan Cd2+ yang akan ditambahkan
V2 : volume total sampel
C2 : konsentrasi larutan Cd2+ total sampel
Volume total sampel yaitu 10 mL termasuk 0,5 mL starter, dan 0,15 mL
Pb2+. Dengan menggunakan rumus diatas, maka akan diperoleh volume larutan
Cd2+ yang ditambahkan pada setiap variabel konsentrasi dapat dilihat pada
40
Tabel 4. Volume Larutan Cd2+ pada Setiap Variasi Konsentrasi
No.
Sebanyak 10 buah erlenmeyer yang sudah disterilkan dengan autoklaf
diisi dengan media YPD cair sesuai dengan tabel di atas. Setiap dua erlenmeyer
diisi masing-masing 9,3 mL; 9,25 mL; 9,2 mL; 9,15 mL; dan 9,1 mL. Starter
sebanyak 0,5 mL ditambahkan pada masing-masing media cair dan diinkubasi
selama 6 jam, kemudian dilakukan pengukuran OD600 setelah media diinkubasi.
Larutan Cd2+ sesuai dengan variasi konsentrasi dan larutan Pb2+
ditambahkan, setelah media diinkubasi selama 6 jam. Masing-masing kultur
diinkubasi kembali menggunakan shaker dengan kecepatan 125 rpm selama 10
jam (sesuai hasil dari profil pertumbuhan ragi) pada suhu kamar. Untuk
mengetahui jumlah sel ragi yang mampu hidup dalam media yang telah diberi
Pb2+ dengan interferensi Cd2+, dapat dilakukan pengukuran dengan
menggunakan spektronik 20. Data yang didapatkan berupa OD600 pada variasi
konsentrasi Pb2+ dengan adanya interferensi Cd2+. Data ini kemudian
digambarkan dalam sebuah grafik yang menjelaskan mengenai konsentrasi Pb2+
optimum dimana kondisi ragi S. cerevisiae masih tumbuh dengan baik