PEMANFAATAN KATALIS Al3+-BENTONIT UNTUK REAKSI ESTERIFIKASI ASAM PALMITAT MENJADI METIL PALMITAT
SKRIPSI
SITI MARIYAM
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PEMANFAATAN KATALIS Al3+-BENTONIT UNTUK REAKSI ESTERIFIKASI ASAM PALMITAT MENJADI METIL PALMITAT
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia
Pada Fakultas Sains dan Teknologi Universitas Airlangga
Oleh : SITI MARIYAM NIM. 080810530
Tanggal Lulus : 18 Juli 2012
Disetujui oleh :
Pembimbing I Pembimbing II
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : PEMANFAATAN KATALIS Al3+-BENTONIT UNTUK
REAKSI ESTERIFIKASI ASAM PALMITAT MENJADI METIL PALMITAT
Penyusun : Siti Mariyam
NIM : 080810530
Pembimbing I : Dr. Nanik Siti Aminah, M.Si Pembimbing II : Abdulloh, S.Si., M.Si
Tanggal seminar : 18 Juli 2012
Disetujui Oleh : Pembimbing I,
Dr. Nanik Siti Aminah, M.Si NIP. 19670514 199102 2 001
Pembimbing II,
Abdulloh, S.Si., M.Si NIP. 19710423 199702 1 001
Mengetahui,
Ketua Program Studi S-1 Kimia/Ketua Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penyusun, dan harus menyebutkan sumbernya sesuai dengan kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan hidayah-Nya sehingga penyusun dapat menyelesaikan penulisan naskah skripsi yang berjudul “Pemanfaatan Katalis Al3+-bentonit untuk Reaksi Esterifikasi Asam Palmitat Menjadi Metil Palmitat“. Naskah skripsi ini dibuat dalam rangka memenuhi persyaratan akademis pendidikan sarjana sains dalam bidang
kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. Nanik Siti Aminah, M.Si dan Abdulloh, S.Si, M.Si selaku dosen pembimbing I dan II yang telah memberikan bimbingan dan arahan kepada penulis hingga selesainya naskah skripsi ini.
2. Dr. Mulyadi Tanjung, M.Si dan Drs. Yusuf Syah, MS selaku dosen penguji I dan II yang telah memberikan kritik dan saran kepada penulis hingga selesainya naskah skripsi ini.
3. Drs. Handoko darmokoesoemo, DEA., selaku dosen wali yang telah mengajarkan dan memberikan bimbingan selama perkuliahan.
4. Bapak dan Ibu dosen kimia yang telah mendidik dan memberikan dukungan selama perkuliahan
5. Ummi, bapak, dan saudaraku tercinta (muzdalifah, Sieb Ali, Syarofah, Nur Fadilah, Siti Halimah) yang telah memberikan segala dorongan berupa doa, bantuan materiil dan semangat. Hanya Allah saja yang bisa membalasnya.
Hisbiyah dan Vridayani Anggie yang selalu memberikan semangat, bantuan serta masukan yang sangat membangun dalam hal apapun. 7. Teman-teman terbaikku Deby, Bela, Avi, Riza, Faiz, Rista, Afiyan, dan
Physic Lovers, terima kasih untuk masukan dan dukungan selama ini. 8. Irfan Supriyono, terima kasih untuk kata motivasi “Semangat dan
Sabar” yang selalu diberikan kepada penulis.
9. Rekan-rekan mahasiswa Kimia FST 2008 yang telah memberikan banyak cerita dan kebersamaan selama kuliah di Universitas Airlangga. 10.Karyawan dan karyawati FSAINTEK UNAIR dan petugas laboratorium,
serta pihak-pihak lain yang telah banyak yang membantu namun tidak sempat disebutkan satu-persatu.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan naskah skripsi ini, oleh karena itu penulis sangat mengharapkan kritik dan saran yang bersifat membangun untuk kesempurnaan penulisan naskah skripsi ini agar bermanfaat bagi semua pihak.
Mariyam, S., 2012, Pemanfaatan Katalis Al3+-bentonit untuk Reaksi Esterifikasi Asam Palmitat Menjadi Metil Palmitat, Skripsi ini di bawah bimbingan Dr. Nanik Siti Aminah, M.Si. dan Abdulloh, S.Si., M.Si., Departmen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Asam palmitat merupakan salah satu dari sekian banyak asam lemak yang berasal dari minyak nabati dan hewani. Salah satu turunan asam palmitat adalah metil palmitat.Penelitian ini bertujuan untuk menggunakan Al3+-bentonit pada
reaksi esterifikasi asam palmitat menjadi metil palmitat. Penelitian ini diawali dengan membuat katalis Al3+-bentonit dari bentonit komersial dan bentonit alam
kemudian dikarakterisasi menggunakan XRD, BET dan FT-IR. Katalis Al3+
-bentonit diaplikasikan untuk reaksi esterifikasi asam palmitat menjadi metil palmitat untuk mendapatkan konversinya pada rentang waktu 0.5; 1; 2; 3; 4; 5; 6; dan 7 jam dengan pemanasan 65°C. Nilai maksimum konversi metil palmitat menggunakan katalis Al3+-bentonit komersial dan katalis Al3+-bentonit alam
Turen-Malang berturut-turut adalah 59,14% dan 82.23%. Hasil analisis GC-MS menunjukkan spektra MS untuk produk metil palmitat.
.
Mariyam, S., 2012, Palmitic Acid Esterification into Methyl Palmitic Using Al³⁺-Bentonite Catalyst, This study is under guidance of Dr. Nanik Siti Aminah, M.Si. and Abdulloh, S.Si., M.Si., Chemistry Department, Science and Technology Faculty, Airlangga University, Surabaya
ABSTRACT
Palmitic acid is one of many fatty acids derived from vegetable and animal oils. One of the palmitic acid derivative is methyl palmitate. This research is purposed to use Al3+-bentonite in esterification of palmitic acid into methyl
palmitate. Besides that, this research is to find out the conversion of methyl palmitate using Al3+-bentonite was compared using commercial bentonite and
natural bentonite. This research was started with made Al3+-bentonite from
commercial bentonite and natural bentonite followed by characterizations using XRD and FT-IR. Al3+-bentonite were applied in esterification of palmitic acid into
methyl palmitic to find its convertion in 0,5; 1; 2; 3; 4; 5; 6; and 7 hour with heating at 65°C. Furthermore, the total conversion value of methyl palmitate was determined. The maximum conversion value of methyl palmitate with Al3+ -bentonite commercial were 59,14% and 82,23% with natural Al3+-bentonite. The result of GC-MS analysis gave MS spectra some products of esterification.
DAFTAR ISI
HALAMAN JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
2.8 Karakteristik Metil Palmitat... 14
2.8.1 Bilangan Asam ... 14
2.9 Difraksi Sinar-X ... 15
2.10 Fourier Transform-Infrared (FT-IR) ... 17
2.11 Kromatografi Gas-Spektrometri Massa ... 20
BAB III. METODE PENELITIAN... ... 23
3.4.3 Pembuatan larutan AlCl3 0,5 M ... 26
3.4.4 Pembuatan Phenolphtalein 1% ... 26
3.4.5 Pembuatan katalis Al3+-bentonit... 27
3.4.6 Karakterisasi katalis Al3+-bentonit ... 27
3.4.6.1 Analisis Difraksi Sinar-X (XRD) ... 27
4.4.1 Konversi metil palmitat... 40
4.4.2 karakterisasi metil palmitat menggunakan GCMS ... 42
BAB V KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan... ... 45
5.2 Saran... ... 45
DAFTAR PUSTAKA... ... 47
DAFTAR GAMBAR
No. Judul Halaman
2.1 2.2 2.3
Struktur 3 dimensi asam palmitat... Struktur 3 dimensi metil palmitat... Struktur tiga dimensi montmorillonit...
5 6 8 2.4 Struktur dua lapisan kation montmorillonit dengan
interlayer dan air... 10 2.5 Reaksi esterifikasi dengan katalis asam... 12 2.6 Spesies piridin yang terbentuk melalui interaksi dengan katalis... Spektrum FT-IR Al3+-bentonit...
Pola fragmentasi asam palmitat... Pola fragmentasi metil palmitat... Lempung bentonit Turen Malang... Katalis Al3+-bentonit alam dan Al3+-bentonit komersial
Spektrum XRD bentonit alam dan Al3+-bentonit alam
Spektrum XRD bentonit komersial dan Al3+-bentonit
komersial... Spesies piridin-Bronsted, piridin yang berikatan hidrogen dengan OH-bentonit, piridin-Lewis... Spektrum FT-IR Al3+-bentonit alam...
Spektrum FT-IR Al3+-bentonit komersial...
Hasil esterifikasi (metil palmitat)... Grafik perbandingan konversi metil palmitat... KromatogramGC metil palmitat menggunakan Al3+
DAFTAR TABEL
No. Judul Halaman
2.1 4.1 4.2 4.3
Sifat-sifat Na-bentonit dan Ca-bentonit ... Data XRD bentonit... Hasil analisa luas permukaan bentonit... Hasil perhitungan bilangan asam dan nilai konversi metil palmitat...
DAFTAR LAMPIRAN Lampiran Judul Lampiran
Lampiran 1 Difraktogram XRD Bentonit alam Turen-Malang Lampiran 2 Difraktogram XRD Bentonit komersial
Lampiran 3 Difraktogram XRD Al3+-bentonit alam Turen-Malang
Lampiran 4 Difraktogram XRD Al3+-bentonit Komersial
Lampiran 5 Spektrum FT-IR Bentonit alam Lampiran 6 Spektrum FT-IR Bentonit komersial
Lampiran 7 Spektrum FT-IR Al3+-bentonit alam Turen-Malang
Lampiran 8 Spektrum FT-IR Al3+-bentonit komersial
Lampiran 9 Perhitungan jumlah situs asam BrØnsted dan Lewis
Lampiran 10 Perhitungan bilangan asam metil palmitat
BAB I PENDAHULUAN
1.1 Latar Belakang
Asam palmitat merupakan salah satu dari sekian banyak asam lemak yang berasal dari minyak nabati dan hewani. Minyak kelapa mengandung 92% asam palmitat, minyak kelapa sawit mengandung 50% asam palmitat dan minyak jarak pagar mengandung asam palmitat sekitar 19,5% (Akintayo, 2004). Salah satu turunan asam palmitat adalah metil palmitat. Senyawa ini banyak dimanfaatkan di bidang industri, yaitu kosmetik, parfum, bumbu masakan, dan biodiesel.
Metil palmitat dapat disintesis melalui reaksi esterifikasi menggunakan katalis asam. Katalis asam yang digunakan dapat berada dalam satu fasa (katalis asam homogen) atau berbeda fasa (katalis asam heterogen). Pemakaian katalis heterogen di industri lebih disukai daripada katalis homogen, karena katalis heterogen mudah dipisahkan dari produk, tidak membutuhkan proses netralisasi di akhir reaksi, dapat dipakai berulang-ulang dan ramah lingkungan. Sedangkan katalis homogen susah dipisahkan dari produk, membutuhkan proses netralisasi di akhir reaksi, sehingga tidak bisa digunakan kembali dan berpotensi mencemari lingkungan. (Carmo, et al 2009).
bagian tengah diapit oleh dua buah lapisan silika berbentuk tetrahedral (Syuhada, 2009). Sebagai katalis, bentonit memiliki karakter keasaman, yaitu Lewis dan BrØnsted (Reddy, 2002).
Beberapa studi penggunaan bentonit sebagai katalis yang telah dilaporkan adalah: reaksi esterifikasi asam fenilasetat dengan fenol menghasilkan fenil asetat dengan konversi 67% selama 6 jam (Akintayo, 2004), reaksi esterifikasi anhidrida suksinat dengan p-kresol dalam (p-kresol) suksinat dengan konversi 75% selama 8 jam (Reddy, 2004), reaksi esterifikasi asam suksinat dengan iso butanol menjadi di-(iso-butil) suksinat dengan konversi 96% selama 8 jam (Reddy, 2005) dan reaksi esterifikasi asam propanoat dengan p-kresol menjadi p-kresil propanoat dengan konversi 88% selama 8 jam (Reddy, 2007).
Lempung bentonit di Indonesia terbesar di Pulau Jawa, Sumatera, sebagian Kalimantan dan Sulawesi, dengan cadangan diperkirakan lebih dari 380 juta ton. Di Pulau Jawa, bentonit banyak tersebar di wilayah Jawa Timur khususnya daerah Pacitan, Malang dan Ponorogo.
Berdasarkan uraian tersebut, maka pada penelitian ini akan dilakukan modifikasi bentonit Turen Malang untuk reaksi esterifikasi asam palmitat menjadi metil palmitat. Modifikasi yang dilakukan antara lain dengan pertukaran kation pada ruang antar lembaran aluminasilikat (cation exchange). Pertukaran kation dilakukan dengan menggunakan larutan Al3+. Kation Al3+ dipilih karena kation ini
bentonit alam Turen, maka perlu dibandingkan kinerja katalis tersebut dengan katalis yang sama hasil modifikasi bentonit komersial. Bentonit yang telah dimodifikasi harus dikarakterisasi meliputi struktur, kandungan situs asam serta luas permukaannya untuk mengetahui kualitas dari bentonit tersebut. Apabila bentonit yang telah dimodifikasi memiliki karakteristik yang baik, maka bentonit tersebut dapat dilakukan uji pada reaksi esterifikasi asam palmitat menjadi metil palmitat.
1.2 Rumusan Masalah
Dari latar belakang yang telah diuraikan maka dapat dirumuskan permasalahan sebagai berikut :
1. Bagaimana karakteristik yang meliputi struktur, kandungan situs asam serta luas permukaan pada katalis Al3+-bentonit alam Turen Malang dan Al3+
-bentonit komersial?
2. Apakah Al3+-bentonit alam Turen Malang dan Al3+-bentonit komersial dapat
dimanfaatkan sebagai katalis pada reaksi esterifikasi asam palmitat menjadi metil palmitat?
3. Berapakah konversi yang diperoleh pada reaksi esterifikasi asam palmitat menjadi metil palmitat dengan menggunakan katalis Al3+-bentonit alam Turen
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
1. Mengetahui karakteristik yang meliputi struktur, situs asam, dan luas permukaan pada katalis Al3+-bentonit alam Turen Malang dan Al3+-bentonit
komersial.
2. Memanfaatkan Al3+-bentonit alam Turen Malang dan Al3+-bentonit komersial
sebagai katalis dalam reaksi esterifikasi asam palmitat menjadi metil palmitat. 3. Mengetahui konversi yang diperoleh pada reaksi esterifikasi asam palmitat
menjadi metil palmitat dengan menggunakan katalis Al3+-bentonit alam Turen
Malang dan Al3+-bentonit komersial.
1.4 Manfaat Penelitian
Memberikan informasi mengenai pemanfaatan Al3+-bentonit alam Turen
Malang dan Al3+-bentonit komersial sebagai katalis untuk reaksi esterifikasi asam
BAB II
TINJAUAN PUSTAKA
2.1 Asam Palmitat
Asam palmitat merupakan asam lemak jenuh yang tersusun dari 16 atom karbon CH3(CH2)14COOH. Pada suhu ruang, asam palmitat berwujud padat
berwarna putih. Asam palmitat memiliki massa molar sebesar 256,42 g/mol dan memiliki densitas 0,853 g/cm3 pada suhu 62°C. Titik leleh dari asam palmitat
adalah 62,9°C, sedangkan titik didihnya sebesar 351-352°C. Asam palmitat tidak larut dalam air. Dalam industri, asam palmitat banyak dimanfaatkan dalam bidang kosmetika dan pewarnaan. Dari segi gizi, asam palmitat merupakan sumber kalori penting namun memiliki daya antioksidan yang rendah. (Merck, 2001)
Gambar 2.1 Struktur 3 dimensi asam palmitat
2.2 Metil Palmitat
Metil palmitat merupakan suatu alkil ester yang memiliki rumus molekul CH3(CH2)14COOCH3. Metil palmitat memiliki massa molar sebesar 270,46 g/mol.
manfaat yang lebih beragam. Senyawa ini banyak dimanfaatkan di bidang industri, yaitu kosmetik, parfum, bumbu masakan, dan biodiesel. (Merck, 2001).
Gambar 2.2 Struktur 3 dimensi metil palmitat
2.3 Bentonit
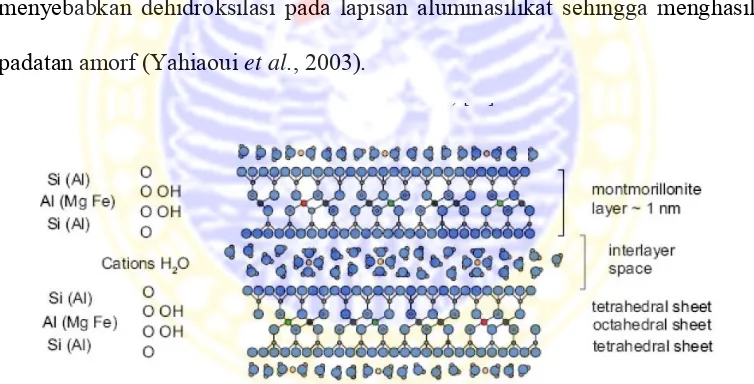
Bentonit adalah istilah pada lempung yang mengandung 80% montmorilonit dalam dunia perdagangan. Lempung bentonit di Indonesia terbesar di Pulau Jawa, Sumatera, sebagian Kalimantan dan Sulawesi, dengan cadangan diperkirakan lebih dari 380 juta ton. Bentonit mempunyai kemampuan mengembang yang tinggi karena adanya ruang anterlamellar yang dapat dimasuki oleh air. Ruangan ini terbentuk dari unit-unit lapisan silika-alumina-silika, atom oksigen dan hidroksil yang bertumpuk secara paralel (Tan, 1991)
Perbedaan antara Hoffman dan Endell dengan struktur Edelman dan Favajee terletak pada susunan jaringan tetrahedral silikanya. Edelman dan Favajee berpendapat bahwa ada suatu susunan alternatif dari tetrahedral silika dengan ikatan Si-O-Si bersudut 180 °C, dengan bidang dasar yang terdiri atas gugus-gugus OH yang terikat pada silika dalam tetrahedron (Tan, 1991).
Bentonit mempunyai muatan negatif pada permukaannya, sehingga memungkinkan terjadinya reaksi pertukaran ion. Muatan negatif pada permukaan bentonit dapat menarik kation-kation dengan gaya elektrostatik. Reaksi pertukaran kation merupakan reaksi stoikiometri untuk mempertahankan elektronetralitas tanah. Reaksi pertukaran kation dalam bentonit dapat terjadi karena substitusi isomorfous atom Al dalam lembar oktahedral. Pertukaran kation hanya bisa dilakukan pada kation yang terletak diantara lapisan supaya tidak mempengaruhi struktur silika-alumina (Yulianto, 2008). Masuknya kation ke dalam ruang antarlapis struktur lempung pada dasarnya merupakan ion penyeimbang (counterion) muatan negatif. Kation tersebut dapat dipertukarkan dengan kation lain yang mempunyai ikatan lebih kuat. Kekuatan pertukaran ion adalah Na+ < K+
< Ca2+ < Mg2+ < NH4+ , yang berarti kation NH4+ dapat menukar ion-ion Na+ , K+ ,
Ca2+, dan Mg2+ (Grim, 1968)
Kation dengan valensi lebih rendah diadsorpsi kurang kuat dan tidak efisien dari pada kation dengan valensi lebih besar. Tetapi hal ini tidak bisa terjadi pada ion Hidrogen karena sifat-sifat hidrasinya yang tidak tentu (Foth, 1988)
Gambar 2.3 Struktur tiga dimensi montmorillonit ( Itälä, 2009)
Bentonit diklasifikasikan menjadi dua kelompok yaitu natrium bentonit dan kalsium bentonit. Pengelompokan ini berdasarkan jenis kation yang mudah dipertukarkan. Natrium bentonit merupakan jenis bentonit dimana kation Na+
mudah dipertukarkan (Onal et al., 2000). Natrium bentonit mengandung lebih banyak ion Na+ dibandingkan ion Ca2+ dan Mg2+. Bentonit ini dapat mengembang hingga 8-15 kali apabila dicelupkan ke dalam air. Sedangkan kalsium bentonit memiliki kandungan Ca2+ dan Mg2+ lebih banyak dari Na+ serta mudah
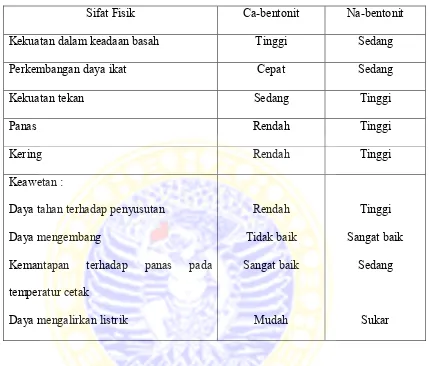
Tabel 2.1 Sifat-sifat Na-bentonit dan Ca-bentonit (Sukandarrumidi, 1990)
Sifat Fisik Ca-bentonit Na-bentonit
Kekuatan dalam keadaan basah Tinggi Sedang
Perkembangan daya ikat Cepat Sedang
Kekuatan tekan Sedang Tinggi
Panas Rendah Tinggi
Kering Rendah Tinggi
Keawetan :
Daya tahan terhadap penyusutan Daya mengembang
Kemantapan terhadap panas pada temperatur cetak
Bentonit memiliki banyak manfaat antara lain, natrium bentonit digunakan sebagai lumpur pembilas pada kegiatan pemboran, penyumbat kebocoran bendungan dan kolam, serta dalam industri minyak sawit. Sedangkan kalsium bentonit digunakan sebagai bahan pemucat warna pada proses pemurnian minyak goreng, katalis pada industri kimia, zat pemutih, zat penyerap, dan sebagai filter pada industri kertas dan polimer (Syuhada, 2009).
Sebagai katalis, bentonit memiliki karakter keasaman BrØnsted, Lewis atau keduanya. Keasaman Lewis dikarenakan kation Al3+ dan Fe3+ yang terletak
pada interlayer dengan kation lain seperti Al3+, Fe3+, NH4+, dan H3O+ (Reddy,
2007).
Keasaman BrØnsted dipengaruhi oleh jumlah air didalam kristal. Bila bentonit dipanaskan pada suhu 100ºC, maka sebagian besar air pada interlayer akan hilang sampai tersisa kira-kira 5% total air dalam bentonit. Pada keadaan ini keasaman Bronsted akan meningkat. Bila dipanaskan lagi pada temperatur yang lebih tinggi (sekitar 200-400ºC), maka air pada interlayer akan hilang semuanya sehingga keasaman BrØnsted akan menurun sedangkan keasaman Lewis akan meningkat. Pemanasan yang lebih tinggi lagi (sekitar 450ºC dan diatasnya) akan menyebabkan dehidroksilasi pada lapisan aluminasilikat sehingga menghasilkan padatan amorf (Yahiaoui et al., 2003).
Gambar 2.4 Struktur dua lapisan kation montmorillonit dengan interlayer dan air (Itälä, 2009)
2.4 Pertukaran Kation (cation exchange)
Mg2+ pada lapisan octahedral, menyebabkan kelebihan muatan negatif pada
permukaannya. Muatan negatif ini dapat diseimbangkan dengan melakukan adsorpsi kation ke dalam interlayer dari bentonit atau dengan mensubstitusi balik menggunakan kation yang bermuatan lebih (Kloprogge, 1998).
Kation-kation yang dapat dipertukarkan dengan kation yang berada pada interlayer antara lain kation logam maupun kation nonlogam, misalnya H3O+,
NH4+, Al3+, dan Fe3+. Syarat kation yang dapat dipertukarkan dengan kation lain
adalah memiliki ikatan yang kuat (Reddy, 2002).
2.5 Esterifikasi
Esterifikasi adalah suatu reaksi ionik yang merupakan gabungan dari reaksi adisi dan reaksi penataan ulang eliminasi. Esterifikasi juga dapat didefinisikan sebagai reaksi antara asam karboksilat dan alkohol (Gandhi, 2007). Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam klorida), dengan berbagai variasi alkohol biasanya metanol, etanol, propanol, butanol, dan amil alkohol. Di antara alkohol tersebut yang paling sering digunakan adalah metanol karena harganya murah dan merupakan alkohol yang paling sederhana (Ozgulsun, 2008).
dengan sebagian katalis basa tersebut membentuk sabun (Tiwari et al, 2007). Keuntungan dalam menggunakan katalis basa yaitu reaksi dapat berlangsung lebih cepat. Akan tetapi, kelemahan dari katalis basa yaitu tidak dapat digunakan secara langsung pada minyak yang mempunyai kandungan asam lemak bebas yang
Gambar 2.5 Reaksi Esterifikasi dengan katalis asam
2.6 Katalis
Fungsi dari katalis adalah untuk mempercepat reaksi dengan menurunkan energi aktivasi reaksi tetapi tidak merubah letak kesetimbangan. Reaksi esterifikasi yang dijalankan tanpa menggunakan katalis membutuhkan suhu 25°C untuk menjalankan reaksi. Katalis yang sering digunakan adalah asam, basa, dan penukar ion. Dengan katalis basa, reaksi dapat berjalan pada suhu kamar, sedang dengan katalis asam suhu yang dibutuhkan yaitu 100 °C (Kirk, 1992).
Penggunaan katalis homogen memiliki beberapa kelemahan diantaranya sulit dipisahkan dari produk dan tidak ramah lingkungan. Katalis homogen tidak dapat digunakan kembali sehingga dapat menimbulkan polusi tanah serta proses penggunaan katalis homogen memerlukan biaya yang tidak murah. Berbeda dengan katalis homogen, katalis heterogen lebih ramah lingkungan, serta dapat digunakan kembali setelah beberapa kali pemakaian. Disamping itu, penggunaan katalis heterogen cukup murah dibandingkan dengan katalis homogen (Mäki, et al., 2004). Oleh karena itu, katalis heterogen kini mulai diaplikasikan oleh beberapa industri karena mudah dipisahkan dari produk dengan filtrasi, dan dapat digunakan kembali dalam jangka waktu yang cukup lama (Yadav & Thathagar, 2002).
2.7 Adsorpsi
Adsorpsi adalah suatu fenomena permukaan dimana molekul-molekul gas atau cairan menempel pada permukaan zat lain (biasanya padatan) dan membentuk lapisan tipis yang menutupi permukaan tersebut ( Hampel dan Hawley, 1982). Pengertian ini berbeda dengan absorbsi, yaitu proses transfer massa dimana absorbat terserap ke dalam seluruh bagian volume dari absorben (Maludzinska, 1990).
dekat oleh karena gaya ini menurun secara drastis dengan jarak. Sedangkan adsorpsi kimia atau “kemisorpsi” melibatkan suatu ikatan kimia. Ikatan yang terlibat biasanya adalah ikatan hidrogen, ikatan elektrostatik dan reaksi koordinsai. Pada umumnya adsorpsi dinyatakan dengan isoterm adsorpsinya, yaitu menunjukkan hubungan hubungan konsentrasi-konsentrasi dari bahan teradsorpsi pada suatu suhu tetap.
2.8 Karakteristik metil palmitat
Untuk mengetahui kualitas metil palmitat yang dihasilkan, maka dilakukan analisis terhadap karakteristik metil palmitat menggunakan metode ASTM
2.8.1 Bilangan Asam
Bilangan asam merupakan bilangan yang menyatakan jumlah miligram NaOH yang dibutuhkan untuk menetralkan asam lemak bebas dari suatu minyak atau lemak. Bilangan asam dapat digunakan untuk mengetahui jumlah asam lemak bebas pada minyak atau lemak (Sudarmaji, 1997). Bilangan asam dapat dihitung menggunakan rumus :
Bilangan Asam = V x N x MrG
Keterangan : N = Volume NaOH untuk titrasi (mL) Mr = Massa molekul relatif NaOH G = Berat sampel (g)
Sinar-X dihasilkan dalam tabung sinar-X. Elektron keluar dari katoda lalu dipercepat oleh sumber tegangan tinggi di dalam vakum anoda berupa logam. Elektron yang berasal dari katoda, selanjutnya menumbuk logam. Tumbukan ini mengakibatkan elektron dalam (misalnya kulit K) atom logam tersebut terlepas. Atom tertinggal dalam keadaan tereksitasi yang bukan keadaan stabil. Maka terjadilah pengisian kekosongan kulit oleh elektron dari kulit yang lebih luar. Perpindahan ini disertai dengan pancaran radiasi dengan panjang gelombang tertentu. Pancaran ini merupakan spektrum yang terdiri dari Kα dan Kβ. Spektrum Kα memiliki intensitas yang lebih besar daripada Kβ. Selanjutnya, kedua spektrum ini masuk pada monokromator dan dihasilkan sinar-X monokromatik (berasal dari spektrum Kα) yang diperlukan untuk difraksi (Sudarningsih, 2008).
Pada tahun 1912 fisikawan Jerman Von Laue menyatakan bahwa kristal terdiri dari barisan atom-atom yang teratur sedangkan sinar-X adalah gelombang yang memiliki panjang gelombang mendekati jarak antar atom pada kristal, maka kristal tersebut mendifraksikan sinar-X. Letak dan intensitas dari sinar difraksi ditentukan oleh geometri kristal serta letak dari komponen-komponen atom penyusun kristal (Ladd, et.al, 1986).
destruktif. Radiasi yang didifraksikan oleh atom kristal harus berada pada fase dan interferensi konstruktif yang ditunjukkan oleh gambar 2.6
Gambar 2.6 Difraksi Bragg sinar-X
Sinar-X jatuh pada kristal dengan panjang gelombang nλ dengan sudut θ tehadap permukaan himpunan bidang Bragg yang jarak antar bidangnya d. Ketentuan terjadinya interferensi konstruktif yaitu, sinar yang terdifraksi harus sejajar dan beda jarak jalannya tepat λ, 2λ, 3λ dan seterusnya. Berkas sinar-X yang didifraksikan oleh atom A dan atom B yang memenuhi persamaan berikut ini yang dikenal dengan Persamaan Bragg
2d sin θ = n λ
Ketentuan; n adalah sudut difraksi, λ adalah panjang gelombang, d adalah jarak antar bidang dan n adalah orde refleksi (1,2,3,4,...).
Metode ini juga digunakan untuk elusidasi struktur senyawa baru, baik bahan alam maupun molekul sintetik. Metode bubuk (X-ray powder) banyak digunakan dalam identifikasi kualitatif pada senyawa kristalin atau senyawa-senyawa yang memiliki fase kristalin. Setiap kristal memiliki pola serbuk yang unik yang dapat digunakan sebagai fingerprint untuk tujuan identifikasi. Oleh karena itu, suatu zat padat dapat diidentifikasi berdasarkan pola serbuknya. Metode bubuk (X-ray powder) banyak digunakan untuk analisis, karena memiliki sumber referensi yang digunakan untuk mengidentifikasi kristal yang belum diketahui. Sumber referensi ini adalah Powder diffraction File (Joint Committee on Powder Diffraction Standards, Swarthmore, USA) yang dikenal dengan data ASTM. Data ini memuat kira-kira 3500 material (kristal) (West, 1984).
2.10 Fourier Transform-Infrared (FT-IR)
FT-IR merupakan pengembangan instrumen spektrometer IR yang dapat digunakan untuk mengidentifikasi adanya gugus fungsi. Prinsip kerja FT-IR hampir sama dengan IR, hanya berbeda pada sistem optiknya. Pada sistem optik FT-IR dipakai radiasi LASER yang berguna sebagai radiasi yang diinterferensikan dengan radiasi IR agar sinyal radiasi IR diterima oleh detektor secara utuh dan lebih baik. Dasar pemikiran FT-IR adalah deret persamaan gelombang elektronik yang dirumuskan oleh Jean Baptiste Fourier (1768-1830) sebagai :
a0 + a1 cos ωt + a2 cos 2ωt + …+ b1 sin ωt + b2 sin 2ωt
Komponen dasar instrumen FT-IR antara lain sumber radiasi, interferometer, tempat sampel (sample compartment), detektor, dan komputer (alat pembacaan). Sumber radiasi berasal dari radiasi inframerah yang selanjutnya menuju interferometer. Dalam interferometer radiasi inframerah ini akan berinterferensi dengan sinar LASER. Selanjutnya berkas sinar meninggalkan interferometer dan masuk pada pada tempat sampel. Berkas cahaya ini ditransmisikan dan dipantulkan kembali oleh permukaan sampel. Pada tempat sampel inilah berkas sinar dengan frekuensi spesifik diabsorpsi. Selanjutnya berkas sinar masuk pada detektor dan sinyal interferogram diukur. Sinyal yang terukur kemudian dikirim ke komputer yang mana di dalamnya telah terdapat Fourier transformation.
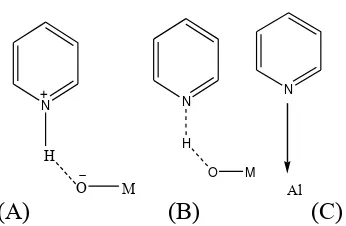
Salah satu aplikasi dari analisis FT-IR adalah penentuan situs asam Bronsted-Lewis pada Bentonit, Zeolit, asam heteropoli, dan lain sebagainya.Metode yang digunakan untuk penentuan keasaman ini adalah metode serapan piridin.Terdapat dua spesies asam yang terbentuk dari interaksi piridin dengan katalis. Spesies piridin-Brønsted (A) yang merupakan ion piridinium yang terbentuk karena adanya ikatan hidrogen antara N (piridin) dengan –OH dari mineral lempung dan terjadi transfer H+ dari sisi asam Brønsted, sedangkan
N
Gambar 2.7. Spesies (A) piridin-Bronsted, (B) piridin yang berikatan hidrogen dengan OH-bentonit, (C) piridin-Lewis
Menurut Parry (1963), daerah di sekitar 1440-1465 cm-1 telah menandakan
adanya ikatan koordinasi antara sisi asam Lewis dengan piridin sedangkan sisi asam Bronsted muncul pada 1540 cm-1, 1640 cm-1, dan 1485 cm-1. Menurut Tyagi
et al. (2006) dalam Fatimah et al. (2008), sisi asam Lewis akan muncul di sekitar 1450-1455 cm-1, sedangkan sisi asam Bronsted muncul pada 1640 cm-1. Sedangkan menurut Nagendrapa et al (2008), Spektrum FT-IR Al3+-bentonit terdapat situs asam Lewis muncul pada bilangan gelombang 1450, 1490, 1590 dan 1620. Sedangkan situs asam Bronsted muncul pada bilangan gelombang 1540 dan 1640.
Gambar 2.8 Spektrum FT-IR Al3+-bentonit (Nagendrapa, 2008) 2.11 Kromatografi Gas-Spektrometri Massa
Kromatografi gas digunakan untuk memisahkan komponen-komponen dalam campuran organik yang mudah menguap, sedangkan spektrometer massa digunakan untuk menganalisis setiap komponen dalam campuran organik tersebut sehingga dapat diketahui berat molekul serta pola fragmentasi dari senyawa organik tersebut (Shriner, 1998).
Cara Kerja dari kromatografi gas-spektrometer massa ini yaitu larutan sampel dimasukkan pada sistem inlet alat kromatografi gas dengan cara penyuntikan menggunakan mikropipet. Agar tidak menimbulkan puncak-puncak berekor yang lebar, penyuntikan sampel harus dalam waktu yang sesingkat-singkatnya (Gritter, 1991). Jumlah sampel yang dapat dianalisis dengan instrument kromatografi gas hanya beberapa milligram hingga 200 mg. Jumlah sampel yang dimasukkan tidak boleh terlalu banyak karena dapat memberikan kromatogram yang tailing sehingga dapat mengakibatkan kesalahan analisis. Kemudian sampel diuapkan dan dialirkan menuju kolom kromatografi oleh gas pembawa inert seperti helium. Sampel yang telah terpisah kemudian masuk pada sistem spektrometer massa untuk dianalisis lebih lanjut, yaitu diubah menjadi ion-ionnya. Hasil dari analisis dengan menggunakan instrumen kromatografi gas-spektrometer massa ini akan didapatkan dua data, yaitu kromatogram dari senyawa (hasil GC) serta spektrum massa (hasil MS) (Shriner, 1998).
dimasukkan pada instrumen ini. Kolom kromatografi gas memiliki temperatur yang cukup tinggi untuk menjaga sampel tetap berada dalam fase gas selama dilakukan pemisahan pada kolom. Sampel yang telah terpisah dapat terdeteksi setelah melalui detektor. Detektor terhubung dengan recorder yang merekam kromatogram dari kromatografi gas (Fritz and Schenk, 1987).
Komponen dasar pada instrumen kromatografi gas antara lain wadah gas murni bertekanan tinggi yang dilengkapi dengan pengatur tekanan, sistem pemasukan cuplikan atau injektor, tanur bertermostat, kolom dengan kemasan yang cocok, detektor (Gritter, 1991).
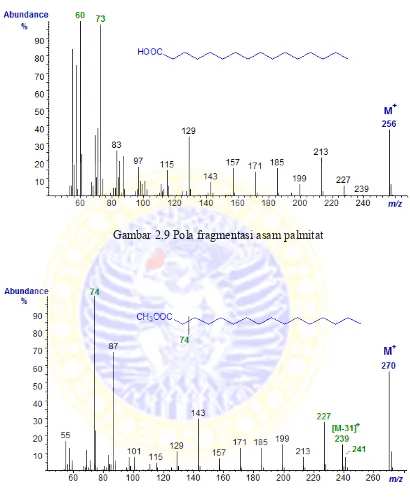
Komponen dasar pada alat spektrometer massa antara lain sistem inlet sampel, sumber ion, sistem percepatan ion, pompa vakum, magnet, tabung analisator massa ion, serta sistem pengumpul (Fessenden and Fessenden, 1986). Pola fragmentasi asam palmitat dapat dilihat pada gambar 2.8, sedangkan metil palmitat pada gambar 2.9. Dari pola fragmentasi asam palmitat tersebut, puncak-puncak yang relatif tinggi terbentuk pada m/z 60 yang dihasilkan dari ion HOOCCH2•⁺ dan puncak asam palmitat terbentuk pada m/z 256. Sedangkan pada
metil palmitat, puncak kelimpahan tertinggi terbentuk pada m/z 74 yang dihasilkan dari CH3OC(OH)CH2•⁺ karena adanya McLafferty rearrangment dan
Gambar 2.9 Pola fragmentasi asam palmitat
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan mulai bulan Januari 2012 sampai dengan bulan Juni 2012. Tempat penelitian dilakukan di Laboratorium Kimia Fisik, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya sebagai tempat perlakuan awal bentonit yakni preparasi katalis Al3+-Bentonit dan tempat
pembuatan reaksi esterifikasi metil palmitat, Analisis akan dilakukan pada beberapa laboratorium di Indonesia.
3.2 Alat dan Bahan 3.2.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah furnace, timbangan digital, seperangkat refluks, pengaduk magnetik, oven, krus porselen, hot plate, termometer, sentrifuge, rotatory vacum evaporator, ayakan dengan ukuran 200 mesh, desikator, termometer dan alat-alat gelas yang lazim digunakan di laboratorium, FT-IR, XRD, BET, dan GC-MS.
3.2.2 Bahan-bahan
Asam palmitat, Bentonit alam Turen malang, Bentonit komersial Sigma-Aldrich, AlCl3 hidrat, AgNO3, CH3OH 99 %, asam oksalat, KOH, indikator
3.3 Diagram Alir Penelitian
3.3.1 Pembuatan katalis Al3+-bentonit
Larutan AlCl3 0,5 M
+ 5 g bentonit sintetik
diaduk dalam 200 ml AlCl3 0,5 M
selama 4 jam + disaring + dicuci dengan akuades hingga bebas ion Cl-
Al3+-bentonit bebas Cl
dipanaskan pada suhu 120ºC selama 24 jam Padatan Al3+-bentonit
dihaluskan dengan mortar Serbuk Al3+-bentonit
Kalsinasi pada suhu 150ºC selama 3 jam
Katalis Al3+-bentonit
Karakterisasi dengan XRD, FT-IR, BET, Situs asam
3.3.2 Reaksi esterifikasi asam palmitat
Direfluks selama 30 menit
direfluks (pada suhu 65°C)
disentrifugasi dievaporasi
Karakterisasi - GC-MS - bilangan asam
metanol 99% Al3+-bentonit
asam palmitat
metil palmitat + katalis
metil palmitat
Metil-palmitat yang terkarakterisasi
3.4 Metode Penelitian
3.4.1 Pembuatan larutan KOH 0,1N
Sebanyak 3,30 g KOH ditimbang kemudian dilarutkan dengan akuades sebanyak 500 mL. Setelah itu campuran diaduk hingga terbentuk larutan yang homogen (Bassett, 1994).
3.4.2 Pembuatan larutan baku asam oksalat
Sebanyak 0,6307 g asam oksalat ditimbang dengan teliti, kemudian dimasukkan ke dalam gelas beaker 100 mL. Setelah itu asam oksalat dilarutkan dengan menggunakan akuades sedikit demi sedikit dalam gelas beker. Selanjutnya, campuran dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan ditambahkan akuades hingga tanda batas. Campuran dikocok hingga terbentuk larutan yang homogen (Bassett, 1994)
3.4.3 Pembuatan larutan AlCl3 0,5 M
Sebanyak 22,596 g serbuk AlCl3 dilarutkan ke dalam 200 mL akuades
secara kuantitatif. Mula-mula, sebagian serbuk dicampur terlebih dahulu di dalam gelas beaker 200 mL dengan akuades 100 mL. Setelah larut, sisa serbuk ditambahkan kemudian diaduk sampai larut sempurna (Bassett, 1994)
3.4.4 Pembuatan Phenolpthalein 1%
3.4.5 Pembuatan katalis Al3+-bentonit
Sebanyak 5 g bentonit dicampurkan dengan larutan AlCl3 0,5 M dalam
200 mL akuadem. Kemudian distirer selama 4 jam dan disaring. Endapan bentonit dicuci dengan akuadem sampai bebas anion Cl- (dilakukan uji kualitatif dengan
AgNO3). Bentonit yang telah bebas dari Cl- dipanaskan pada suhu 120 °C selama
4 jam kemudian hasilnya dihaluskan hingga berbentuk serbuk dengan menggunakan mortar. Setelah ditumbuk, serbuk bentonit kemudian dikalsinasi pada suhu 150°C selama 4 jam. Kemudian bentonit yang telah jadi disimpan dalam desikator dan dianalisis menggunakan XRD dan FT-IR (Reddy, 2009).
3.4.6 Karakterisasi Katalis Al3+-Bentonit 3.4.6.1Analisis difraksi sinar-X (XRD)
Analisis difraksi sinar-X dilakukan untuk mengetahui struktur Al3+
-bentonit. Data yang diperoleh dari analisis dengan difraksi sinar-X ini disajikan dalam bentuk grafik yang absis dan ordinatnya menyatakan sudut difraksi dan intensitas difraksi. Perubahan struktur bentonit dapat ditentukan dengan cara membandingkan besarnya sudut difraksi dan intensitas difraksi dari difraktogram antara struktur bentonit.
3.4.6.2Penentuan situs asam Al3+-bentonit
Sebanyak 0,5 g Al3+-bentonit dimasukkan dalam kurs porselein, ditimbang
menggunakan hotplate selama 24 jam. Bentonit dan kurs porselein yang telah dialiri gas piridin tersebut kemudian ditimbang. Untuk menghilangkan gas piridin yang terserap secara fisik, maka perlu dioven kembali pada suhu 110°C selama 15 menit kemudian ditimbang lagi. Besarnya situs asam dapat diketahui dari selisih berat Al3+-bentonit sebelum dialiri gas piridin dan setelah dialiri gas piridin.
3.4.6.3Analisis FTIR ( Fourier Transform Infra Red)
Analisis FTIR dilakukan untuk mengetahui sisi asam Lewis dan BrØnsted
atau keduanya dari katalis Al3+-bentonit yang telah dibuat baik sebelum maupun
sesudah dimodifikasi. Sebelumnya, Katalis bentonit s sebanyak 0,5 g ditempatkan dalam cawan porselen yang telah dikeringkan dan diketahui berat konstannya, kemudian dimasukkan dalam desikator dan divakumkan. Sebanyak 5 ml piridin dalam gelas beker diuapkan dalam labu desikator dan dibiarkan selama 3 hari. Selanjutnya Al3+-bentonit dioven pada suhu 110ºC selama 1 jam untuk
menghilangkan gas piridin yang terserap secara fisik. Kemudian Al2+-bentonit
yang telah dioven ditimbang dan dianalisis dengan FT-IR.
Ketika sinar Infra merah dilewatkan ke sampel organik, maka akan ada sejumlah frekuensi yang diserap dan ada pula yang diteruskan atau ditransmisikan tanpa diserap. Untuk mengetahui situs asam Lewis dan BrØnsted menggunakan
persamaan Emeis (1993) sebagai berikut :
Dengan B = Luas puncak pita BrØnsted atau Lewis (cm-1)
L = Luas disk sampel (0,785 cm2)
G = Berat sampel (gram)
3.4.6.4Analisis BET (Brunauer-Emmett-Teller)
Analisis BET dilakukan untuk mengetahui luas permukaan katalis Al3+
-bentonit sebelum dan sesudah dimodifikasi. Pada analisis BET ini, diperlukan gas Nitrogen untuk mengusir gas-gas lain yang mengganggu selama proses analisis.
3.4.7 Pembuatan metil palmitat
Sebanyak 12,1 mL metanol dicampurkan dengan Al3+ bentonit sebanyak
0,25 g ke dalam labu leher tiga dan direfluks sambil diaduk menggunakan pengaduk magnetik selama 30 menit dengan dipanaskan pada suhu 65°C sebagai tahap aktivasi katalis. Setelah 30 menit, sebanyak 2,699 g asam palmitat dimasukkan ke dalam labu leher tiga dan diaduk, proses ini dilakukan secara berkesinambungan selama ½, 1, 2, 3, 4, 5, 6, dan 7 jam pada suhu 65°C. Selanjutnya campuran dipisahkan dengan cara sentrifugasi selama 15 menit. Kemudian filtrat diuapkan dengan rotatory vacum evaporator untuk menghilangkan metanol. Konversi asam palmitat menjadi metil palmitat dapat ditentukan secara kuantitatif berdasarkan perubahan bilangan asam dan secara kualitatif ditentukan dengan analisis spektroskopi GC-MS (Reddy, 2005)
3.4.7.1Analisis Bilangan Asam
berwarna merah rosa. Bilangan asam diperoleh dengan memasukkan data ke dalam rumus :
3.3.7.2 Analisis GC-MS
Analisis GC-MS dilakukan untuk mengetahui massa molar dari senyawa metil palmitat. Data yang diperoleh dari analisis dengan GC-MS ini disajikan dalam bentuk spektra yang absis dan ordinatnya menyatakan massa molar senyawa dan % kelimpahan. Dengan membandingkan jumlah massa molar dan % kelimpahan yang tertinggi dari spektra metil palmitat maka dapat ditentukan hasil esterifikasi asam palmitat menggunakan katalis Al3+-bentonit.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pencucian bentonit Turen Malang
Proses pencucian bentonit alam dilakukan untuk memisahkan bentonit dari pengotornya. Pencucian ini dilakukan dengan cara menambahkan aquadem ke dalam bentonit sambil diaduk selama satu jam. Setelah itu didiamkan hingga terbentuk tiga lapisan. Lapisan bawah adalah pengotor bentonit berupa pasir dan kerikil. Lapisan kedua adalah mineral bentonit yang akan diambil dan lapisan paling atas adalah lapisan akuadem dan garam-garam yang terlarut di dalamnya.
4.2 Pembuatan Katalis Al3+-bentonit
Pada penelitian ini bentonit komersial dan bentonit Turen Malang dimodifikasi menjadi Al3+-bentonit dengan harapan dapat meningkatkan situs
asam sehingga katalis bentonit dapat digunakan dalam reaksi esterifikasi. Proses pembuatan katalis Al3+-bentonit dilakukan dengan cara merendam bentonit
dengan larutan AlCl3 selama 4 jam sambil direfluks dan diaduk. Pengadukan
dilakukan untuk mempercepat masuknya Al3+ ke dalam interlayer bentonit. Dalam pembuatan Al3+-bentonit juga dilakukan penghilangan ion-ion Cl- dengan
mencuci Al3+-bentonit berulang-ulang menggunakan akuadem. Tujuan
menghilangkan ion-ion Cl- adalah untuk meningkatkan kualitas dari katalis serta
untuk mendukung distribusi homogen kation antar lapisan sehingga jarak antar lapisan bentonit meningkat (Supeno, 2007). Uji kualitatif yang digunakan untuk mengetahui bahwa ion Cl- telah hilang adalah uji filtrat Al3+-bentonit dengan
AgNO3. Jika setelah penambahan AgNO3 tidak terbentuk AgCl (endapan
berwarna putih) maka ion Cl- sudah hilang. Reaksi yang terjadi antara larutan
AlCl3 dengan bentonit adalah sebagai berikut :
[Al(H2O)3]3+→ [Al(H2O)2OH]2+ + H+
Selanjutnya dilakukan pemanasan dalam oven pada suhu 120°C yang bertujuan untuk menghilangkan air pada interlayer. Menurut Yahiaoui et al. (2003), pemanasan pada temperatur ini menyebabkan situs asam Bronsted meningkat karena masih adanya air yang tersisa pada satu lapisan bentonit atau sekitar 5% dari total air pada seluruh lapisan bentonit. Kemudian Al3+-bentonit
Gambar 4.2 (A) katalis Al3+-bentonit alam, (B) katalis Al3+-bentonit
komersial
4.3 Karakterisasi katalis Al3+-bentonit 4.3.1 Struktur Al3+-bentonit
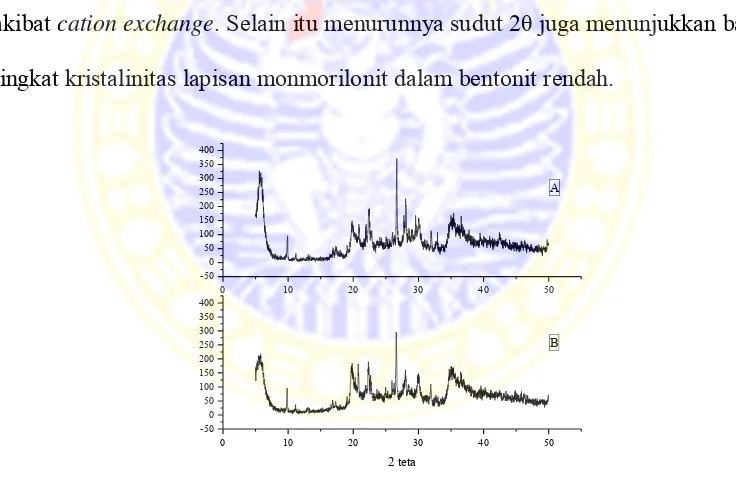
Analisis struktur Al3+-bentonit dilakukan untuk mengetahui perubahan
susunan atom pada bentonit yang telah dimodifikasi dengan analisis menggunakan XRD. Dari analisis tersebut, dapat dibandingkan harga 2θ, jarak difraktogram bentonit sebelum dan sesudah dimodifikasi yang dapat dilihat pada difraktogram dari XRD bentonit alam dan komersial dapat dilihat pada lampiran 1 dan 2. Difraktogram XRD pada Al3+-bentonit alam dan komersial dapat dilihat
pada lampiran 3 dan 4. Perbandingan pola difraksi antara bentonit alam dan Al3+
-bentonit alam dapat diamati pada gambar 4.3 sedangkan -bentonit komersial dan Al3+-bentonit komersial dapat diamati pada gambar 4.4
Dari analisis XRD yang ditampilkan pada tabel 4.1 dapat dilihat bahwa terjadi perubahan d001 menjadi lebih besar. Untuk bentonit komersial terjadi
perubahan sebesar 2,47757 sedangkan bentonit alam sebesar 0,24239. Pergeseran
d001 ini mengindikasikan bahwa terjadi perubahan kation dalam interlayer bentonit
(Yahiaoui et al., 2003). Dalam hal ini perubahan kation terjadi karena adanya proses cation exchange spesi Al3+ ke dalam interlayer bentonit. Menurut Goenadi (1982) dalam Sekewael (2008), montmorilonit yang telah mengalami pemanasan pada atau di atas temperatur 100ºC yang memberikan ciri khas pada mineral ini yaitu jarak dasar d001 sebesar 12,0-15,0 Å.
Untuk sudut 2θ terjadi pergeseran ke arah yang lebih kecil yaitu untuk Al3+-bentonit komersial sebesar 5,87478° dan untuk Al3+-bentonit alam sebesar
5,64893°. Pergeseran ini terjadi karena adanya penataan ulang susunan atom-atom akibat cation exchange. Selain itu menurunnya sudut 2θ juga menunjukkan bahwa tingkat kristalinitas lapisan monmorilonit dalam bentonit rendah.
Gambar 4.3 Spektrum XRD (A) bentonit alam, (B) Al3+-bentonit alam
Gambar 4.4 Spektrum XRD (A) bentonit komersial, (B) Al3+-bentonit komersial
Kandungan utama bentonit yaitu montmorillonit yang dapat dilihat refleksinya pada tabel 4.1
Tabel 4.1 Data XRD bentonit
Parameter Bentonit
Karakterisasi Al3+-bentonit dengan FT-IR bertujuan untuk mengetahui
tingkat keasaman dari layer bentonit. Tingkat keasaman dari bentonit dapat ditentukan dengan metode serapan piridin. Sebelum dilakukan serapan piridin
bentonit diaktivasi pada temperatur 100°C selama 30 menit (Reddy et al, 1009). Serapan piridin dilakukan selama 3 hari dalam desikator yang telah divakumkan.
Untuk mendapatkan nilai dari situs asam bentonit, maka perlu dilakukan analisis FT-IR. Sebelumnya, masing-masing 0,5 gram bentonit alam, komersial, Al3+-bentonit alam, dan Al3+-bentonit komersial ditimbang terlebih dahulu hingga
konstan. Kemudian diletakkan dalam labu desikator dan dialiri 5 mL gas piridin. Tujuan dialiri gas piridin adalah untuk menentukan jumlah situs asam Lewis dan BrØnsted yang terdapat pada bentonit sebelum dan sesudah modifikasi.
Hasil analisis FT-IR dapat digunakan untuk mengetahui apakah katalis yang terbentuk mengandung situs asam Lewis atau BrØnsted atau mengandung
keduanya. Masing-masing spektrum FT-IR dari bentonit alam dan komersial serta Al3+-bentonit alam dan komersial ditampilkan pada lampiran 5, 6,7 dan 8.
Menurut Tyagi et al.(2006) vibrasi yang menunjukkan adanya gugus piridin muncul pada daerah 1400-1700 cm-1. Menurut Reddy (2008), bilangan
gelombang untuk asam BrØnsted muncul di sekitar 1540 dan 1640, sedangkan
bilangan gelombang asam Lewis muncul di sekitar 1450, 1490, 1590, dan 1620 cm-1.
Pada hasil FT-IR, situs asam Lewis pada bentonit komersial muncul pada bilangan gelombang 1493,08 cm-1 sedangkan situs asam brØnsted mucul pada
bilangan gelombang 1639,86 cm-1. Sedangkan untuk Al3+-bentonit komersial,
situs asam Lewis muncul pada bilangan gelombang1492,03 cm-1 dan situs asam
BrØnsted muncul pada bilangan gelombang 1543 cm-1. Hasil FT-IR untuk
gelombang 1491,25 cm-1 dan situs asam BrØnsted muncul pada bilangan
gelombang 1644,87. Sedangkan untuk Al3+-bentonit alam, terlihat bahwa situs
asam Lewis muncul pada bilangan gelombang 1489,71 dan situs asam BrØnsted
muncul pada bilangan gelombang 1549,40 cm-1.
Dari hasil FT-IR katalis Al3+-bentonit alam muncul pita serapan pada
1441,32 cm-1 dan pada katalis Al3+-bentonit komersial muncul pita serapan pada
1444,08 cm-1 yang menunjukkan adanya spesi piridin asam Lewis, misalnya Al3+. Di samping itu, untuk Al3+-bentonit alam juga muncul bilangan gelombang
1635,56 cm-1 dan untukAl3+-bentonit komersial muncul pada bilangan gelombang
1634,55 cm-1 yang mengindikasikan adanya regangan ion piridinium. Ion
piridinium menunjukkan adanya gugus hidroksil yang bersifat asam bronsted. Spesies-spesies piridin yang terbentuk melalui interaksi dengan katalis terdapat pada Gambar 4.5
Gambar 4.5. Spesies (A) piridin-Bronsted, (B) piridin yang berikatan hidrogen dengan OH-bentonit, (C) piridin-Lewis
Gambar 4.6 Spektrum FT-IR Al3+-bentonit alam
Gambar 4.7 Spektrum FT-IR Al3+-bentonit komersial
Melalui suatu proses perhitungan yang dijelaskan pada Lampiran 9 didapatkan jumlah situs asam BrØnsted dan Lewis pada bentonit komersial
sebanyak 0,31923 mmol/gram, pada Al3+-bentonit komersial sebanyak 1,0663
mmol/gram, pada bentonit alam sebanyak 0,66859 mmol/gram, dan pada Al3+ -bentonit alam sebanyak 0,95489 mmol/gram.
4.3.3 Luas permukaan katalis Al3+-bentonit
Luas permukaan katalis Al3+-bentonit sebelum dan sesudah modifikasi
dapat ditentukan melalui analisis BET. Metode ini digunakan untuk permukaan yang datar (tidak ada lekukan) dan tidak ada batas dalam setiap layer yang dapat digunakan dalam menjelaskan luas permukaan. Metode ini digunakan berdasarkan asumsi bahwa pada setiap permukaan mempunyai tingkat energi yang homogen (energi adsorpsi tidak mengalami perubahan dengan adanya adsorpsi di layer yang
1633.56 cm-1
1441.32 cm-1
1634.55 cm-1
sama) dan tidak ada interaksi selama molekul teradsorpsi. Analisis ini dilakukan dengan cara degessing keempat sampel yakni bentonit alam, bentonit komersial, Al3+-bentonit alam dan Al3+-bentonit komersial selama 2 jam pada suhu 100°C.
Kemudian, sampel dimasukkan ke Quantachrome NOVA 100 surface area analyser dan dianalisis menggunakan metode adsorpsi N2. Hasil analisis luas
permukaan bentonit ditunjukkan pada tabel 4.2.
Tabel 4.2 Hasil analisa luas permukaan bentonit
Dari data tersebut menunjukkan bahwa, terdapat pertambahan luas permukaan pada bentonit alam maupun komersial. Luas permukaan bentonit alam bertambah sebesar 7,485 m2/g. Sedangkan luas permukaan bentonit komersial bertambah sebesar 13,092 m2/g. Hal ini dikarenakan terjadinya proses cation
exchange pada permukaan bentonit, sehingga luas permukaan pada masing-masing katalis bertambah.
4.4 Aktivitas Katalis Al3+-bentonit Pada Esterifikasi Asam Palmitat
Uji aktivitas katalis Al3+-bentonit dapat dilakukan pada reaksi esterifikasi
palmitat direaksikan dengan metanol dan katalis yang telah diaktivasi selama ½, 1, 2, 3, 4, 5, 6, dan 7 jam pada suhu 65°C sambil diaduk. Selanjutnya, hasil reaksi disentrifugasi untuk memisahkan metil palmitat dari katalis Al3+-bentonit. Metil
palmitat hasil esterifikasi berbentuk padatan putih kemudian dievaporasi, dengan tujuan menguapkan pelarut yang masih tersisa. Hasil metil palmitat tersebut kemudian dianalisis secara kualitatif menggunakan GC-MS dan secara kuantitatif dengan menghitung konversi yang dihasilkan melalui penentuan bilangan asam.
Gambar 4.8 Hasil esterifikasi (metil palmitat)
4.4.1 Konversi Metil Palmitat
Konversi asam palmitat dapat ditentukan melalui pengukuran bilangan asam. Titrasi bilangan asam dilakukan untuk mengetahui jumlah asam palmitat yang tersisa setelah reaksi esterifikasi. Besar kecilnya kandungan asam palmitat yang tersisa dapat mempengaruhi kualitas dari metil palmitat yang nantinya akan dimanfaatkan di berbagai bidang industri. Nilai bilangan asam yang begitu besar akan berpengaruh buruk pada produk yang diinginkan.
dengan cara melarutkan 0,1 gram metil palmitat kemudian ditambahkan masing-masing 5 mL etanol dan n-heksana dan ditambahkan dengan indikator pp. Setelah itu dititrasi dengan KOH hingga warna campuran berubah menjadi merah jambu. Hasil perhitungan bilangan asam dan konversi metil palmitat menggunakan katalis dapat dilihat pada tabel 4.3.
Tabel 4.3 Hasil perhitungan bilangan asam dan nilai konversi metil palmitat
No Waktu
(jam)
Gambar 4.9 Grafik perbandingan konversi metil palmitat
Apabila diubah ke dalam bentuk grafik, maka dapat dibandingkan konversi metil palmitat yang dihasilkan dengan menggunakan katalis Al3+
-bentonit alam dan komersial yang dapat dilihat pada gambar 4.9. Dari grafik tersebut terlihat bahwa terdapat perbedaan yang signifikan dari konversi metil palmitat menggunakan Al3+-bentonit sintetis dan bentonit alam. Reaksi
esterifikasi asam palmitat menggunakan bentonit alam menghasilkan konversi yang lebih besar. Hal ini dikarenakan karakteristik bentonit alam Turen Malang lebih baik dibandingkan bentonit komersial. Bentonit komersial yang digunakan mengandung campuran mineral-mineral yang dapat mengganggu dalam komersial metil palmitat. Di samping itu, bentonit alam Turen Malang memiliki luas permukaan yang lebih besar dibandingkan dengan bentonit komersial, sehingga ruang interlayer semakin besar dan memudahkan pertukaran ion.
4.4.2 Karakterisasi Metil Palmitat menggunakan GC-MS
Analisis GC-MS dilakukan untuk mengetahui produk metil palmitat yang terbentuk. Dari analisis GC-MS didapatkan kromatogram GC dan spektra MS. Kromatogram menunjukkan waktu retensi (tr) dan luas puncak area dari masing-masing puncak sedangkan spektrum massa menunjukkan berat molekul dan fragmentasi senyawa yang dihasilkan. Analisis GC-MS senyawa metil palmitat ini menggunakan jenis kolom kapiler dengan fase diam innowax (polietilen glikol) yang bersifat nonpolar. Kolom ini banyak digunakan dalam analisis senyawa aromatis, alkohol, minyak atsiri serta pelarut-pelarut.
Pada kromatogram gambar 4.10, terdapat 2 puncak. Puncak 1 merupakan puncak metil palmitat yang memiliki waktu retensi sebesar 18,536 menit dengan luas area sebesar 5,70%, Hal ini membuktikan bahwa, katalis Al3+-bentonit alam
dapat digunakan dalam reaksi esterifikasi asam palmitat menjadi metil palmitat.
Gambar 4.10 KromatogramGC metil palmitat menggunakan Al3+-bentonit alam
Gambar 4.11 . Spektrum massa produk metil palmitat Metil palmitat
Pada kromatogram gambar 4.12, terdapat 3 puncak. Puncak 2 merupakan puncak metil palmitat yang memiliki waktu retensisebesar 19.313 menit dengan luas area sebesar 52.59 %, Hal ini membuktikan bahwa, katalis Al3+-bentonit
komersial juga dapat digunakan dalam reaksi esterifikasi asam palmitat menjadi metil palmitat.
Gambar 4.12 KromatogramGC metil palmitat menggunakan Al3+-bentonit
komersial
Gambar 4.13 Spektrum massa produk metil palmitat menggunakan Al3+-bentonit komersial
Spektra massa pada gambar 4.12 dan 4.13 memiliki berat molekul 270 sebagaimana berat molekul dari metil palmitat. Puncak dasar dengan m/z = 74 merupakan puncak yang khas dari senyawa metil palmitat karena adanya McLafferty rearrangment. (Silverstein, 1986). Fragmentasi metil palmitat terdapat pada gambar 4.14
Metil palmitat
m/z = 270
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Katalis Al3+-bentonit alam dan Al3+-komersial memiliki tingkat kristalinitas
yang rendah dengan nilai d spacing masing-masing sebesar 15,63188 Å dan 15,03142 Å, nilai total situs asam BrØnsted dan Lewis untuk katalis Al3+ -bentonit alam dan Al3+-komersial berturut-turut sebesar 0,95489 mmol/gram
dan 1,0663 mmol/gram, serta memiliki luas permukaan yang besar yaitu untuk katalis Al3+-bentonit alam sebesar 91,266 m2/g dan Al3+-komersial
sebesar 36,836 m2/g .
2. Katalis Al3+-bentonit alam dan Al3+-komersial dapat digunakan sebagai katalis dalam reaksi esterifikasi asam palmitat. Hal ini dibuktikan dengan terbentuknya senyawa metil palmitat.
3. Nilai konversi total Metil palmitat selama 7 jam menggunakan katalis Al3+
-bentonit komersial sebesar 59,14 % sedangkan menggunakan katalis Al3+
-bentonit alam sebesar 82,23%. 5.2 Saran
DAFTAR PUSTAKA
Akintayo, E.T., 2004, Characteristics and Composition of Parkia Biglobbossa and Jatropha Curcas Oils and cakes. Bioresource Technology. Vol 92, p. 307-310
Bassett, J. 1994. Buku Ajaran Vogel Kimia Analisis Kuantitatif Anorganik. Edisi Keempat. Penerbit Kedokteran EGC. Jakarta. Effendi
Carmo, C., Souza, K.C., Carlos, E.F., Longo, E., Zamian, J.R., and Geraldo, N.R., 2009, Production of Biodiesel by Esterification of Palmitic Acid Over Mesoporus Aluminosilicate Al-MCM-41, J. Am. Oil Chem. Vol 88, p. 461-468
Amalia, Firda., 2010, Cation exchanged bentonit Turen-Malang dengan AlCl3 sebagai katalis pada pembuatan biodiesel dari minyak jarak pagar, Skripsi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya ASTM International, 2002, Anual Book of ASTM Standards D 56-D 2596,
Section Five, Petroleum Products, Lubricants (I) and Fossil Fuels, USA
Chrikst, D.E., Krasotkine, I.S., Cheremisina, O.V., Steleskaya, M.I., and Ivanov. V., 2002, Determination of the Surface Area of Minerals by Sorption of Methylene Blue and Thermal Desorption of Argon, Russian Journal of Applied Chemistry. 76, 663-665
Ewing, G.W., 1985, Instrumental Methods of Chemical Analysis, McGraw-Hill Book Co., Singapore.
Fessenden, R. J: Fessenden, J.S., 1995, Kimia Organik II, Edisi Ketiga, alih bahasa Pudjaatmaka, Erlangga, Jakarta.
Foth, H.D., 1988, Dasar-dasar Ilmu Tanah,Gajahmada University Press, Yogyakarta
Fritz, J.S. and Schenk, G.H., 1987, Quantitative Analytical Chemistry, Fifth Edition, Prentice-Hall Inc., New Jersey.
Gandhi, N.N., 1997, Application of Lipase, J. Am. Oil Chem. Soc., 74, 6, 621-634
Grim, R.E., 1968, Clay Mineralogy, McGraw-Hill Book Company, New York. Gritter, Roy J., Bobbit, James M., and Schwarting, A.E., 1991, Pengantar
Kromatografi, Edisi Kedua, terjemahan oleh Kosasih Padmawinata, ITB, Bandung.
Kirk, R. E.,and Othmer, D. F., 1992. Encyclopedia of Chemical Technology. The Interscience Encyclopedia Inc. New York
Ladd, M.F.C. and Lee, W.H., 1986, Introduction to Physical Chemistry, Cambridge University Press, New York.
Mäki-Arvela, P., Kumar, N., Nieminen, S., Salmi, T., and Murzin, D. Y., 2004, Cyclization of Citronellal Over Zeolites and Mesoporous Materials for Production of Isopulegol, J. Catal., 225 155-169
Maryadele J., et al. (editor), 2001, The Merck Indeks an Encyclopedia of Chemicals, drugs, and Biologicals, 13th edition, Merck and Co., Inc. USA Mulja, H.M. dan Suharman, 1995, Analisis Instrumental, Airlangga University
Press, Surabaya.
Norman, Zuckerman., Inorganic Reaction and Methods, Volume 16, VCH Publisher, New York
Nuryono, Wawan., 2010, Modifikasi bentonit Punung Pacitan Menjadi Fe3+ -bentonit sebagai Katalis Pada Pembuatan Biodiesel dari Minyak Jarak pagar, Skripsi, Departemen Kimia, FSAINTEK, Universitas Airlangga, Surabaya
Ozgulsum, A., F. Karaosmanoglu, dan M. Tuter, 2000, Esterification Reaction of Oleic Acid With a Fusel Oil Fraction for Production of Lubricating Oil, J. Am. Oil Chem. Soc., 77, 1, 105-109
Pusch, R. and Yong, R.N., 2006, Microstructure of Smectite Clays and Engineering Performance, Taylor and Francis Group, New York.
Reddy, Ravindra .C., Iyengar, Pushpa, Nagendrappa, Gopalpur., dan Prakash, Jai, B.S., 2004. Esterification of dicarbolxyclic acids ti diesters over Mn+ -montmorillonite clay catalyst. Catalyst Letter, Vol. 101. 87-91
Reddy. C.R., Iyengar, P., Nagendrappa. G., and Prakash J.B.S.,2005, Esterification of Succinic Anhydride to di-(p-crecyl) succinate Over Mn+-montmorillonite Clay Catalyst. Journal of Molecular Catalyst A :
Chemical. Vol. 229. 31-57
Reddy. C.R., Iyengar, P., Nagendrappa. G., and Prakash J.B.S., 2007, Surface Acidity Study of Mn+-montmorillonite Clay Catalyst by FT-IR Spectroscopy : Correlation with Esterification Activity. Catalyst Communications. Vol 8. 241-246
Reddy, ravindra.Bhat, Y.S. Nagendrappa, Gopalpur, dan Prakash, Jai, B.S., 2008, BrØnsted and Lewis acidity of modified montmorillonite clay determined by FT-IR,Catalyst Today.
Oksida-Chinica Acta Vol. 1. No. 1 Jurusan Kimia Fakultas Matematika dan Pengetahuan Alam, Universitas Pattimura Kampus Poka, Ambon, Hal: 26 Shriner, R.L., Herman, C.K.F., Morril, T.C., Curtin, D.Y., and Fuson, R.C., 1998,
The Systematic Identification of Organic Compounds, Seventh Edition, John Wiley & Sons, Inc., New York, Page: 119, 474-475
Silverstein, R.M., Bassler, G. C., dan Morril, T. C., 1986, Penyidikan Spektrometrik Senyawa Organik, Edisi keempat, a.b. A. J Hartono, Erlangga, Jakarta
Sridala, R., Lingaiah, N., Prabhavathi, D., Prasad, R.B.N., Suryanarayana, I., and Prasad, P.S., 2004, Esterification of Palmitic Acid with Methanol Over Tungsten Oxide Supported on Zirconia Solid Acid Catalyst: Effect of Methode of Preparation of the catalyst on its Structural Stability and Reactivity, Journal of Applied Catalyst. Vol 276, p 163-168
Sudarmadji, S., 1997, Prosedur Analisis Bahan Makanan dan Pertanian, Liberty, Yogyakarta
Sudarningsih dan Fahruddin, 2008, Penggunaan Metode Difraksi Sinar-X dalam Menganalisa Kandungan Mineral pada Batuan Ultra Basa Kalimantan Selatan, J. Fisika FLUX, Vol.5 No. 2 (165-173)
Syukur, 1997, Pengaruh perlakuan pemanasan pada bentonit terhadap luas permukaannya, Skripsi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Airlangga, Surabaya
Tan, K.H., 1991, “Dasar-dasar Kimia Tanah”. Terj. Didiek Hadjar Goenardi, edisi 11, gajah Mada University Press, Yogyakarta. 100-107
Tiwari, A.K, A. Kumar and H. Raheman, 2007. Biodiesel Production from Jatropha Oil (Jatropha Curcas) with High Free Fatty Acids : Amn Optimized Process, J. Biombioe, Vol. 31, p. 569-575
West, A.R., 1984, Solid State Chemistry and Its Application, John Wiley & Sons Ltd, New York, Page: 116, 122-123, 146
Widyastuti, L., 2007, Reaksi Metanolisis Minyak Biji jarak PagarnMenjadi Metil EsterSebagai Bahan Bakar Pengganti Minyak Diesel dengan Menggunakan Katalis KOH, Tugas Akhir II, Jurusan Kimia FMIPA, Universitas Negeri Semarang, 30-33
Yadav, G.D. and Thatagar, M. B. 2002. Esterification of Maleic Acid with Ethanol Over Cation-Exchange Resin Catalyst. React. Funct. Polym, 52, 99-110
Yulianto, Agus., 2008, Pembuatan Lempung Terpilar Al13 dari Lempung Alam Turen malang untuk Adsorbsi Ion Pb2+, Skripsi, Departemen Kimia, FSAINTEK, Universitas Airlangga, Surabaya
Lampiran 9 : Perhitungan jumlah situs asam BrØnsted dan Lewis
Jumlah situs asam BrØnsted dan Lewis yang terkandung dalam bentonit dapat
dihitung menggunakan persamaan :
Jumlah situs asam = 𝑚6
𝑀𝑟𝑝𝑖𝑟𝑖𝑑𝑖𝑛𝑥𝑚5
Data yang diperoleh dari hasil penimbangan adalah sebagai berikut :
Sampel M1
(gram) (gram) M2 (gram) M3 (gram) M4 (gram) M5 (gram) M6 Bentonit alam 21,076
9 21,5326 21,6561 21,5567 0,4557 0,0241 Al3+-bentonit
komersial 5 8 0
M3 = berat cawan kosong + bentonit + piridin
M4 = berat cawan kosng + bentonit + piridin setelah dipanaskan 115°C
M5 = berat bentonit = M2 – M1
M6 = berat piridin yang teradsorp = M4 – M2
1. Jumlah situs asam Bentonit alam Turen-Malang = 0,0241
79,1 𝑥 0,4557
= 1,0663 x 10-3 mol/gram
= 1,0663 mmol/gram 2. Jumlah situs asam Al3+-bentonit alam Turen-Malang = 0,0334
79,1 𝑥 0,4422
= 9,5489 x 10
-4 mol/gram= 0,9548 mmol/gram
3.
Jumlah situs asam bentonit komersial = 0,011879,1 𝑥 0,4673
= 3,1923 x 10
-4 mol/gram= 0,31923 mmol/gram
4. Jumlah situs asam Al3+-bentonit komersial = 0,0118
79,1 𝑥 0,4673