FERMENTASI NATA
DENGAN SUBSTRAT LIMBAH BUAH NANAS DAN AIR KELAPA
Misgiyarta
Balai Besar Penelitian dan Pengembangan PascapanenPertanian Jl. Tentara Pelajar No. 12. Bogor. (0251) 321762
E-mail:
masmisgi@plasa.com
Abstract
Pineapple and coconut grow well in Indonesia. Part of pineapple fruit, which wasn’t consumed, consists of fruit peel and flesh fruit in the fruit peel. In pineapple fruit waste there are some sugar especially sucrose, aromatic, and minerals. Whereas on coconut processing, coconut water is wasted. Coconut water consists of growth promoting factors and Mg2+. Pineapple fruit waste and coconut water is the nutrient source for Acetobacter xylinum. The research aims are to compare the ability of five strains of A. xylinum: IFO 3283, CCRC 16382, UICC B4, α 1602 C, and M 1602 C in nata production and to find out of the optimum mixed substrate pineapple waste extract and coconut water for nata production by the best strain of A. xylinum. The selection for getting the best strain from five strains of A. xylinum used the mixed substrate of pineapple waste extract and coconut water with 12.25 : 1 (v/v) ratio. After 15 days fermentation, the thickness of nata are produced by strains of IFO 3283, CCRC 16382, UICC B4, α 1602 C, and M 1602 C are: 0, 0, 19, 5 and 27 respectively in mm. The thickness of nata produced by A. xylinum M 1602 C in substrate of pineapple waste extract, coconut water and mixed substrates of pineapple waste extract and coconut water (v/v) of: 8,75:1; 10,5: 1; 12,25:1; 14:1; and 15,75:1, are 16,5; 24,5; 27,5; 19,5; 21,5; 22,5; and 23,5 respectively in mm. The best substrate ratio of pineapple waste extract and coconut water for nata production is 8.75: 1.
Key words: Pineapple waste extract, coconut water, fermentation, Acetobacter xylinum, and nata.
PENDAHULUAN
Konsumsi buah nanas oleh masyarakat Indonesia cukup besar, karena buah ini memiliki rasa yang khas, manis, segar, mengandung gula, vitamin dan mineral yang diperlukan oleh tubuh. Tidak semua bagian nanas dapat dikonsumsi, hanya 53% dari bagian nanas yang dapat dikonsumsi, dan sisanya masih dibuang sebagai limbah (Mulyohardjo, 1984). Bagian kulit buah nanas masih mengandung daging buah nanas. Kulit buah nanas mengandung : sukrosa, riboflavin, thiamin, beragam mineral (Hulme, 1971), senyawa ester yang membentuk aroma (Tresler & Joslyn, 1971). Noparatnaraporn et al., (1986) mengungkapkan bahwa limbah kulit buah nanas mengandung sukrosa 40,1 g l-1, mineral beragam di antaranya Mg2+ 6,25 mg l-1, protein 0,9 g l-1 (Tabel 1).
Tabel 1. Komposisi kimia limbah kulit buah nanas
Komposisi Kimia Konsentrasi
COD 100,8 Gula reduksi (g l-1) 39,2 Gula total (g l-1) 100,0 Dekstran 1,5 Rafinosa 2,6 Sukrosa 40,1 Glukosa 23,6 Galaktosa 1,7 Fruktosa 14,0 Protein terlarut - Nitrogen kjeldahl - Elemen mikro (mg l-1) Fe 5,43 Ca 3,31 Mn 13,97 Mg 62,50 Co 0,07 Cu 2,02 Cd 0,03 Na 8,61 SO-2 169,7 PO-3 223,8 pH 4,0
Sumber: Noparatnaraporn et al., (1986)
Buah kelapa merupakan komoditas yang banyak dimanfaatkan oleh masyarakat Indonesia. Air kelapa belum banyak dimanfaatkan. Pracaya (1982) mengungkapkan
bahwa kadar sukrosa dalam air kelapa mencapai 1,28%, kadar mineral Mg2+ sebesar 3,54 mg l-1 (Tabel 2). Analisis lain mengungkapkan air kelapa mengandung senyawa faktor pertumbuhan Acetobacter xylinum (Lapuz et al., 1967).
Tabel 2. Komposisi air kelapa
Komponen Konsentrasi (%) Air 95,50 Nitrogen 0,05 Asam posporik 0,56 Kalium 6,06 Kalsium oksida 0,69 mg/100 ml Magnesium oksida 0,59 Besi 0,50 Padatan total 4,71 Gula reduksi 0,80 Abu 0,62
Sumber: Pandalai (1958) cit. Woodroof (1970)
Pemanfaatan limbah buah nanas dan limbah air kalapa masih sangat terbatas. Dengan memperhatikan berbagai komponen yang terkandung dalam kedua macam limbah tersebut perlu dicari alternatif pemanfaatan limbah buah nanas dan limbah air kelapa. A. xylinum merupakan jenis bakteri yang dapat tumbuh baik pada media air kelapa. A. xylinum juga sering ditemukan pada limbah nanas. Dengan demikian ada kemungkinan pemanfaatan kedua macam limbah tersebut sebagai media pertumbuhan A. xylinum. Mikroba tersebut tumbuh baik pada media yang mengandung sukrosa sebagai sumber energi, senyawa faktor tumbuh yang akan meningkatkan pertumbuhan bakteri, serta mineral Mg2+ yang akan membantu aktivitas enzim metabolisme. Kebutuhan Mg2+ dalam substrat sebesar 0,40 g l-1 (Lapuz et al., 1967). Weinhouse & Benziman (1976) mengungkapkan bahwa pada konsentrasi 10 mM Mg2+ menunjukkan adanya aktifitas fosforilasi, sedang pada konsentrasi 12 mM menunjukkan adanya peningkatan fosforilasi yang tinggi. Komponen yang diperlukan untuk pertumbuhan A. xylinum tersedia dalam limbah buah nanas maupun limbah air kelapa. Kandungan ion Mg2+ yang tinggi dalam air kelapa (3,54 mg l-1) memerlukan perbandingan yang tepat untuk membuat media campuran antara limbah buah nanas dengan air kelapa.
A. xylinum adalah bakteri yang memiliki kemampuan menghasilkan Nata de Coco. Nata de Coco merupakan selulosa yang menjerap air sehingga tampak seperti jelli yang kompak, kenyal, jernih. Nata de Coco banyak dikonsumsi sebagai makanan pencuci mulut (desert) dan sebagai makanan diet rendah kalori.
Tujuan penelitian ini adalah memanfaatkan limbah buah nanas dan limbah air kelapa, membandingkan kemampuan lima galur A. xylinum: IFO 3283, CCRC 16382, UICC B4, α 1602 C, dan M 1602 C dalam menghasilkan nata, serta mencari perbandingan yang paling optimum antara ekstrak limbah buah nanas dan air kelapa sebagai substrat campuran untuk menghasilkan nata.
METODOLOGI Bahan penelitian
Limbah buah nanas berupa kulit nanas, daging buah yang terikut kulit dan mata nanas. Air kelapa yang digunakan adalah air kelapa segar belum mengalami penyimpanan. Kedua macam limbah tersebut diperoleh dari pasar. Lima galur bakteri A. xylinum yang digunakan dalam penelitian ini adalah: IFO 3283, CCRC 16382 (diperoleh dari Laboratorium Mikrobiologi, Pusat Antar Universitas, Pangan dan Gizi, Universitas Gadjah Mada, Yogyakarta), UICC B4 (diperoleh dari Laboratorium Mikrobiologi, Jurusan Biologi, F. MIPA, Universitas Indonesia, Jakarta), α 1602 C, dan M 1602 C (diperoleh dari Laboratorium Mikrobiologi, Fakultas Pertanian, Universitas Muhammadiyah Yogyakarta). Media yang digunakan untuk pemeliharaan kultur murni A. xylinum adalah Hassid Barker Agar dalam bentuk agar miring. Bahan kimia dan alat-alat penelitian untuk berbagai analisis diperoleh dari Laboratorium Mikrobiologi, FakultasPertanian, Universitas Gadjah Mada, Yogyakarta.
Metode pemurnian dan perbanyakan kultur
Galur A. xylinum murni diperoleh dengan cara diseleksi dengan metode goresan (steak plating) atau dengan metode tuang permukaan (surface plating) pada media Hassid Barker Agar, dengan diamati sifat morfologi koloni, serta pengamatan morfologi sel : bentuk sel, ukuran sel, dan sifat Gram. Kultur murni yang akan digunakan
diremajakan pada media Hassid Barker Agar miring, pada suhu kamar, selama 48 jam (Lapuz et al., 1967).
Kadar air Limbah buah nanas (AOAC, 1970 cit Sudarmadji et al., 1984)
Sampel limbah buah nanas dipotong-potong kecil kemudian dimasukkan ke dalam botol timbang yang telah diketahui beratnya. Sampel dikeringkan pada oven, dipanaskan pada suhu 100 – 105oC selama 3 – 5 jam. Sampel didinginkan pada eksikator kemudian ditimbang. Perlakuan tersebut diulangi sampai diperoleh berat konstan (selisih penimbangan kurang dari 0,2 mg).
Substrat limbah buah nanas
Limbah buah nanas diekstrak dengan akuades dengan perbandingan (b/v) 40,6 g : 65. Campuran limbah buah nanas dan akuades direbus selama 15 menit. Ekstrak limbah disaring dengan menggunakan kain saring. Kadar sukrosa dianalisis dengan metode AOAC (1970) cit. Sudarmadji et al., (1984). Ke dalam ekstrak ditambakan sukrosa hinggga kadarnya sampai 10%, (NH4)2SO4 0,6 g l-1, K2HPO4 5,0 g l-1, ekstrak
khamir 2,5 g l-1 diaduk hingga homogen. Ditambahkan 2 % asam asetat glasial dan disterilkan pada suhu 115oC, selama 15 menit.
Substrat air kelapa
Air kelapa disaring dengan menggunakan kain saring. Kadar sukrosa dianalisis dengan metode AOAC (1970) cit. Sudarmadji et al., (1984). Ke dalam air kelapa ditambakan sukrosa hinggga kadarnya sampai 10%, (NH4)2SO4 0,6 g l-1, K2HPO4 5,0 g
l-1, ekstrak khamir 2,5 g l-1 diaduk hingga homogen. Ditambahkan 2 % asam asetat glasial dan disterilkan pada suhu 115oC, selama 15 menit.
Substrat campuran
Substrat campuran dibuat dengan mencampurkan ekstrak limbah buah nanas dengan air kelapa. Campuran kedua substrat tersebut dengan perbandingan (v/v): 8,75:1; 10,5 : 1; 12,25:1; 14:1; dan 15,75:1. Kadar sukrosa dianalisis dengan metode AOAC (1970) cit. Sudarmadji et al., (1984). Ke dalam substrat campuran ditambahkan sukrosa
hinggga kadarnya sampai 10%, (NH4)2SO4 0,6 g l-1, K2HPO4 5,0 g l-1 ekstrak khamir
2,5 g l-1, diaduk hingga homogen. Ditambahkan 2 % asam asetat glasial dan disterilkan pada suhu 115oC, selama 15 menit.
Pemilihan galur unggul
Pemilihan galur unggul dari lima galur koleksi menggunakan substrat campuran limbah kulit buah nanas dengan air kelapa ; 12,25 : 1.
Penyiapan starter
Media starter yang digunkaan adalah Hassid Barker Cair. Media 100 ml dimasukkan ke dalam labu erlenmeyer 500 ml, kemudian disterilkan dengan autoklaf pada suhu 115oC, selama 15 menit. Media diinokulasi dengan satu-dua ose kultur A. xylinum. Biakan diinokulasi pada suhu kamar selama 48 jam dengan pengocokan 140 rpm (Masaoka et al., 1993).
Fermentasi pemilihan galur unggul
Pemilihan galur unggul menggunakan substrat campuran limbah buah nanas dengan air kelapa dengan perbandingan 12,5 : 1. Substrat 270 ml dimasukkan ke dalam botol steril diameter 10 cm atau kedalaman media 3,5 cm (Astuti, 1985). Perlakukan berupa lima galur dengan tiga ulangan. Substrat ditutup dengan alumunium foil, selanjutnya disterilkan pada suhu 115oC, selama 15 menit, kemudian didinginkan. Substrat diinokulasi dengan starter sebanyak 30 ml, dengan kerapatan sel 107sel ml-1. Substrat yang telah diinokulasi ditutup dengan kertas koran steril, diinkubasi selama 15 hari tanpa goncangan.
Fermentasi utama:
Fermentasi utama menggunakan tujuh macam substrat: air kelapa, limbah buah nanas, 8,75:1; 10,5 : 1; 12,25:1; 14:1; dan 15,75:1.
Penyiapan starter:
Media starter adalah Hassid Barker Cair. Media cair 200 ml dimasukkan kedalam erlenmeyer 1000 ml, kemudian disterilkan dengan autoklaf pada suhu 115oC, selama 15 menit. Media diinokulasi dengan satu-dua ose kultur A. xylinum. Biakan diinkubasi pada suhu kamar selama 48 jam dengan pengocokan 140 rpm (Masaoka et al., 1993).
Fermentasi :
Substrat 270 ml dimasukkan ke dalam botol steril diameter 10 cm atau kedalaman media 3,5 cm (Astuti, 1985). Perlakukan berupa: macam media air kelapa, limbah buah nanas, substrat campuran 8,75:1; 10,5 : 1; 12,25:1; 14:1; dan 15,75:1. dengan tiga ulangan. Substrat ditutup dengan alumunium foil selanjutnya disterilkan pada suhu 115oC, selama 15 menit, kemudian didinginkan. Substrat diinokulasi dengan starter sebanyak 30 ml, dengan kerapatan sel 107sel ml-1. Substrat yang telah diinokulasi ditutup dengan kertas koran steril, diinkubasi selama 15 hari tanpa goncangan. Pengamatan dilakukan pada hari ke: 0, 3, 6, 9, 12 dan 15. Parameter yang adalah tebal nata yang diukur dengan penggaris.
HASIL DAN PEMBAHASAN
Pemilihan galur A. xylinum unggul
Pemilihan galur A. xylinum unggul bertujuan untuk mendapatkan galur A. xylinum yang paling baik dalam menghasilkan nata. Sebelum proses seleksi galur, dilakukan pemurnian dan peremajaan A. xylinum. Peremajaan A. xylinum menggunakan media Hassid Barker Agar, diinkubasi pada suhu kamar selama 48 jam. Setelah diperoleh pertumbuhan optimal dari berbagai galur yang akan diseleksi baru dilakukan seleksi galur untuk memperoleh galur unggul.
Pemurnian galur A. xylinum dilakukan dengan cara menumbuhkan A. xylinum yang berasal dari satu koloni terpisah sebagai kultur induk. Hasil uji berbagai sifat sel meliputi morfologi sel dan morfologi koloni A. xylinum (Tabel 3) diperoleh koleksi kultur
yang seragam (kultur murni). Kultur murni tersebut yang akan diuji kemampuannya dalam menghasilkan nata.
Tabel 3. Morfologi koloni, morfologi sel dan sifat Gram A. xylinum N
o.
A. xylinum Morfologi koloni Morfologi Sel Sifat
Gram
Bentuk Panjang
(µm)
Diameter (µm)
1 IFO 3283 filamentous, agak
besar, kilap, agak putih, agak lunak
Batang 3,8 2,85 Negatif
2 CCRC
16382
filamentous, besar, kilap, putih, agak lunak
Batang 3,23 2,28 Negatif
3 UICC B4 filamentous, kecil,
agak kilap, agak putih, keras
Batang 4,18 2,66 Negatif
4 α 1602 C filamentous, kecil,
kilap, agak jernih, lunak
Batang 4,01 2,22 Negatif
5 M 1602 C Filamentous, kecil,
kilap, jernih, lunak
Batang 3,29 2,13 Negatif
Dari hasil pengamatan terhadap morfologi sel dan morfologi koloni diketahui sifat galur A. xylinum yang sama adalah: bentuk sel batang, Gram negatif, dan memiliki morfologi koloni filamentaous yaitu bentuk menyerupai benang-benang. Galur-galur A.xylinum terdapat perbedaan: ukuran sel, warna koloni, ukuran koloni, dan tekstur koloni.
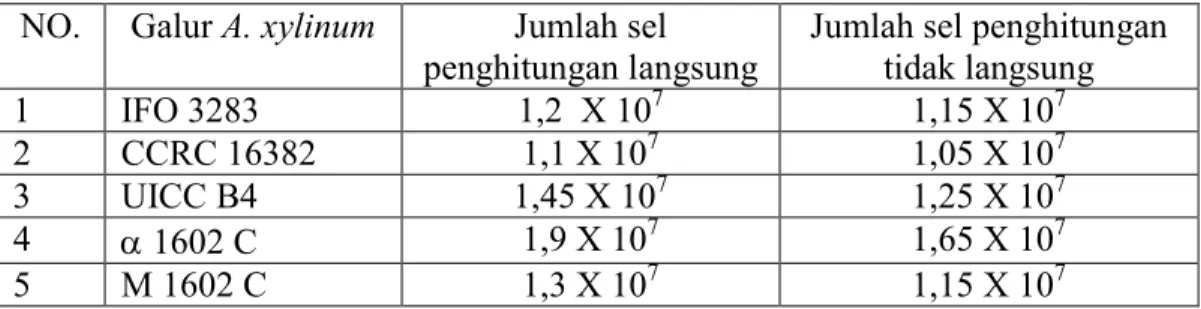
Pemilihan strain unggul diawali dengan preparasi starter yang akan digunakan. Starter setelah umur 48 jam mencapai kerapatan sel 107 sel ml-1 (Tabel 4). Stater yang telah mencapai kerapatan tersebut siap digunakan sebagai bibit fermentasi nata.
Tabel 4. kerapatan sel galur A. xylinum yang digunakan untuk fermentasi seleksi galur
NO. Galur A. xylinum Jumlah sel
penghitungan langsung
Jumlah sel penghitungan tidak langsung 1 IFO 3283 1,2 X 107 1,15 X 107 2 CCRC 16382 1,1 X 107 1,05 X 107 3 UICC B4 1,45 X 107 1,25 X 107 4 α 1602 C 1,9 X 107 1,65 X 107 5 M 1602 C 1,3 X 107 1,15 X 107
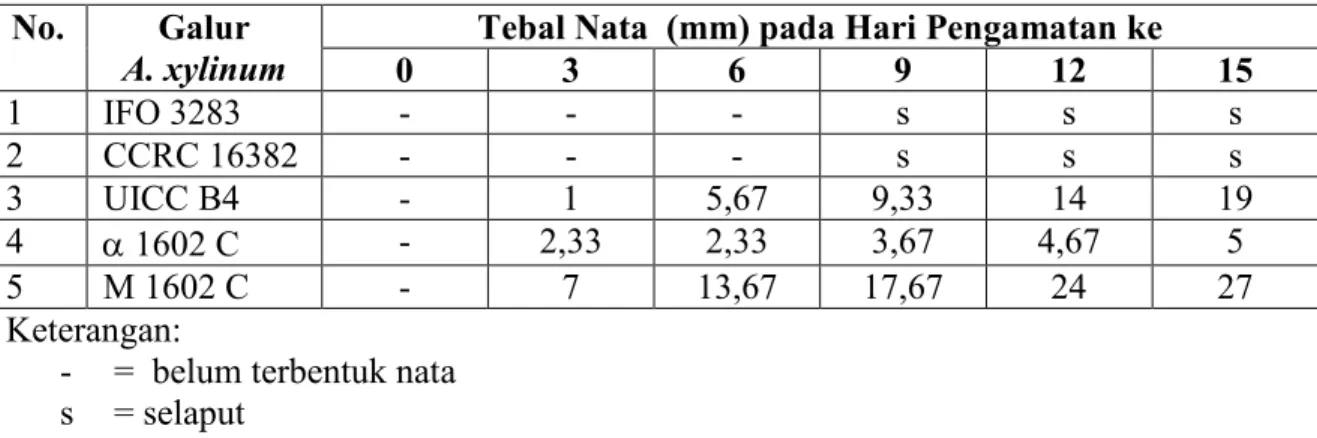
Fermentasi pemilihan galur unggul terjadi selama 15 hari. Tebal nata sebagai parameter untuk memilih galur paling unggul di antara galur yang lain. Dinamika pembentukan nata selama 15 hari fermentasi ditunjukkan pada Tabel 5.
Tabel 5. Tebal rata-rata nata selama 15 hari fermentasi dengan menggunakan lima galur A. xylinum
No. Galur
A. xylinum
Tebal Nata (mm) pada Hari Pengamatan ke
0 3 6 9 12 15 1 IFO 3283 - - - s s s 2 CCRC 16382 - - - s s s 3 UICC B4 - 1 5,67 9,33 14 19 4 α 1602 C - 2,33 2,33 3,67 4,67 5 5 M 1602 C - 7 13,67 17,67 24 27 Keterangan:
- = belum terbentuk nata s = selaput
Dari Tabel 5 dapat diketahui bahwa A. xylinum IFO 3283 dan A. xylinum CCRC 16382 tidak mampu membentuk nata. Dalam substrat yang diinokulasi dengan galur-galur tersebut hanya terbentuk selaput tipis yang mengambang di permukaan substrat. Setelah dilakukan pengujian, ternyata di dalam substrat tersebut terdapat populasi mikroba. Dari hasil uji yang dilakukan mikroba yang terdapat dalam substrat yang tidak membentuk nata memiliki sifat yang sama dengan sifat A. xylinum. Hal tersebut membuktikan bahwa kultur mikroba tersebut tidak memiliki kemampuan menghasilkan nata.
A. xylinum UICC B4, α 1602 C, M 1602 C, merupakan galur-galur yang mampu menghasilkan nata. A. xylinum M 1602 C memiliki kemampuan tertinggi dalam menghasilkan nata. Substrat yang diinokulasi dengan galur M 1602 C pada hari pertama sudah memperlihatkan hasil berupa selaput tipis nata, sedang galur lain belum menunjukkan hasil serupa. Dengan demikian A. xylinum M 1602 C dipilih sebagai strain unggul, selanjutnya digunakan dalam fermentasi utama.
Fermentasi utama
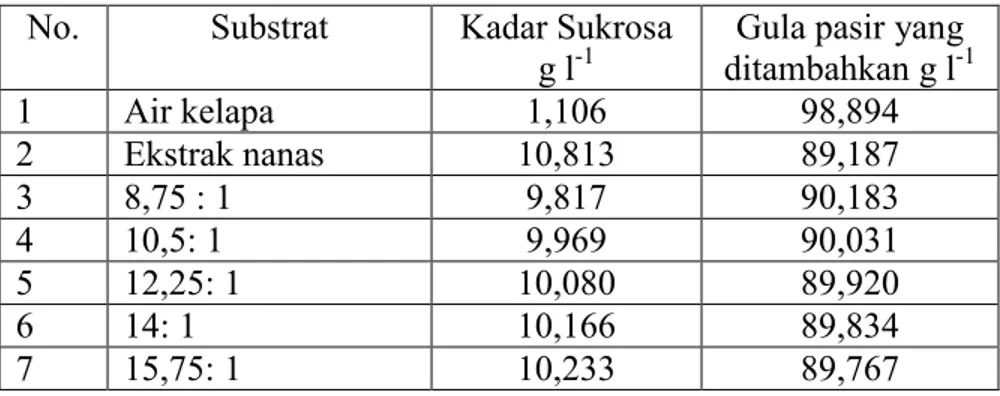
Substrat sebelum digunakan dianalisis kadar sukrosanya terlebih dahulu. Pada Tabel 6 dipaparkan kadar sukrosa substrat campuran, serta penambahan gula pasir sebagai gula sukrosa sehingga kadar sukrosa pada media fermentasi mencapai 10%.
Tabel 6. Kadar gula sukrosa pada substrat dan jumlah gula pasir yang ditambahkan ke dalam substrat
No. Substrat Kadar Sukrosa
g l-1
Gula pasir yang ditambahkan g l-1 1 Air kelapa 1,106 98,894 2 Ekstrak nanas 10,813 89,187 3 8,75 : 1 9,817 90,183 4 10,5: 1 9,969 90,031 5 12,25: 1 10,080 89,920 6 14: 1 10,166 89,834 7 15,75: 1 10,233 89,767
Dinamika terbentuknya nata pada pengamatan dari hari ke 0 hingga hari ke 15 dapat ditunjukkan pada Tabel 7. Data tersebut menunjukkan bahwa substrat campuran yang paling baik untuk fementasi nata adalah substrat campuran dengan perbandingan ekstrak limbah buah nanas dengan air kelapa 8,75 : 1.
Tabel 7. Tebal nata selama 15 hari fermentasi
No. Substrat Tebal nata (mm) pada hari pengamatan ke
0 3 6 9 12 15 1 Air kelapa - 2,0 5,5 10,5 14,5 16,5 2 Ekstrak nanas - 4,0 7,5 15,0 17,5 24,0 3 8,75 : 1 - 4,0 9,0 15,5 19,0 27,5 4 10,5: 1 - 4,0 9,0 10,5 16,0 19,5 5 12,25: 1 - 4,5 7,5 14,0 18,0 21,5 6 14: 1 - 3,5 7,5 12,5 16,0 22,5 7 15,75: 1 - 4,0 7,2 13,5 17,5 23,0
Proses pembuatan nata sangat ditentukan oleh kondisi internal proses metabolisme A. Xylinum, maupun kondisi eksternal yang merupakan kondisi substrat dimana A. xylinum tersebut ditumbuhkan. Dengan memperhatikan faktor-faktor yang mempengaruhi produktifitas dihasilkannya nata oleh A. xylinum maka akan dapat diperoleh kondisi yang optimal untuk menghasilkan nata tersebut. Faktor internal kondisi optimal produksi nata dicapai dengan memilih galur A. xylinum yang unggul. Sedang faktor eksternal dapat didekati dengan cara memilih substrat yang cocok untuk menumbuhkan A. xylinum.
Dari data yang dipaparkan diatas galur A. xylinum yang memiliki kemampuan unggul adalah galur M 1602 C. Galur tersebut pada substrat campuran ekstrak limbah
buah nanas dengan air kelapa dengan perbandingan 8,75 : 1, mampu menghasilkan nata dengan ketebalan mencapai 27,5 mm, setelah 15 hari fermentasi.
Kondisi lingkungan eksternal yang dapat diatur adalah kondisi substrat. Jenis substrat mempengaruhi kemampuan A. xylinum dalam menghasilkan nata. Data hasil penelitian yang dipaparkan pada Tabel 6 menunjukkan bahwa jenis substrat yang berbeda akan menghasilkan ketebalan nata yang berbeda. Demikian pula jenis substrat campuran sama namun perbandingan campuran substrat berbeda akan menghasilkan ketebalan nata yang berbeda. Tabel 6 menunjukkan bahwa jenis substrat yang dapat menghasilkan nata paling tebal adalah substrat campuran antara ekstrak limbah buah nanas dengan air kelapa dengan perbandingan 8,75 : 1. Dengan demikian berarti ketersediaan nutrien yang paling optimal untuk menghasilkan nata terdapat pada substrat campuran dengan perbandingan 8,75 : 1.
Prospek pemanfaatan A. xylinum M 1602 C, dengan menggunakan substrat campuran ekstrak limbah buah nanas dengan air kelapa cukup baik. Beberapa hasil penelitian pembuatan Nata de Coco dengan berbagai substrat menunjukkan hasil nata yang lebih rendah (Tabel 8).
Tabel 8. Perbandingan tebal nata yang dihasilkan dari berbagai penelitian
Parameter Hasil Penelitian ini Siahaan (1992) Rindengan & Lay (1994) Lay et al., (2000) Jenis substrat Ekstrak limbah buah
nanas dengan kelapa (8,75 : 1)
Air kelapa Air kelapa + nira
Air kelapa
Gula pasir 90 g l-1 75 g l-1 - 8 – 10 %
Asam cuka PH 5,5 22 ml - 100 ml l-1
Starter 10% 165 ml 15% 5%
Lama fermentasi 15 hari 15 hari 14 hari 12 hari
Tebal nata 27,5 mm 15 mm 19 mm 15 mm
Data yang dipaparkan pada Tabel 8 menunjukkan bahwa penggunaan substrat campuran ekstrak limbah buah nanas dan air kelapa dengan perbandingan 8,75 :1 memiliki
prospek lebih baik dalam menghasilkan nata sekaligus untuk memanfaatkan limbah kulit buah nanas dan air kelapa yang belum banyak dimanfaatkan.
KESIMPULAN
Pada penelitian ini diketahui galur A. xylynum yang memiliki kemampuan terbaik dalam menghasilkan nata adalah galur M 1602 C. Galur tersebut mampu menghasilkan nata paling baik pada substrat campuran ekstrak limbah nanas dan air kelapa dengan perbandingan 8,75 : 1, dengan ketebalan 27,5 mm.
DAFTAR PUSTAKA
Astuti, A. 1985. Laporan Kerja Lapangan Pembuatan Nata de Coco di CV. Tunas Sari Bogor. Departemen Mikrobiologi, Fakultas Pertanian, Universitas Gadjah Mada, Yogyakarta.
Hulme,A.C. 1971. The Biochemistry of Fruits and Their Pruducts. Vol. 2. Academic Press. London.
Lapuz, M.M., Golardo, E.G., & Palo, M.A. 1967. The Organism – Culture Requirements. Characteristics and Identity. The Philippine J. Science. 96: 101 – 109. Lay, A., David Allorerung dan J.S. Waroka. 2000. Diversifikasi hasil, Pengolahan Hasil
Utama dan Hasil Samping Kelapa.. Dalam: Teknologi Pengolahan Tanaman Perkebunan. Badan Litbang Kehutanan dan Perkebunan. Pusat Penelitian dan Pengembangan Tanaman Perkebunan.
Masaoka, C., Ohe, T., & Sakato, N. 1993. Production of Cellulose from Glucose by Acetobacter xylinum. J. Ferment. Bioeng. 75: 18-22.
Muljohardjo, M. 1984. Nanas dan Teknologi Pengolahannya. Liberty. Yogyakarta.
Noparatnaraporn, N., Wongkornchawalit, W., Kontachote, D. and Nagai, S. 1986. Single Cell Protein Production of Rhodopseudomonas sphaeroides on Pineapple Waste. J. Fermen. Technol. 64 (2): 137 – 143.
Rindengan, B. dan A. Lay. 1994. Pengolahan Nira Kelapa untk Produk Fermentasi Nata de Coco, Alkohol, dan Asam Cuka. Jurnal Penelitian Kelapa. 7 (2): P 21 –33.
Siahaan, D. 1992. Teknologi Pengolahan Nira dan Air Buah Kelapa. Dalam: Kelapa (Cocos nucifera, L.). Asosiasi Penelitian dan Pengembangan Perkebunan Indonesia. Pusat Penelitian dan Pengembangan Perkebunan Marihat. Bandar Kuala. Sumatra Utara.
Sudarmadji, S., Haryono, B., & Suhardi. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Liberty. Yogyakarta.
Tressler, D.R., & Joslyn, M.A. 1971. Fruit and Vegetable Juice Processing Technology. The AVI Publishing Company, Inc. Conecticut.
Wheinhouse, H. & Benziman, M. 1976. Phosphorilation of Glycerol and Dehydroxyacetone in Acetobacter xylinum and It’s Posible Regulatory Role. J. Bacteriol. 127:747 –754.
Woodroof, J.G. 1970. Coconuts: Production, Processing Producs. The AVI Publishing Company, Inc. Conecticut.