KATALISIS
Dhadhang Wahyu Kurniawan @Dhadhang_WK
• Pengertian katalisPengertian katalis, • Cara kerja katalis, k li • Macam katalisator – asam spesifik, – basa spesifik, – asam umum, – basa umum, – nukleofilik
• Kecepatan reaksi secara bertahap dipengaruhiKecepatan reaksi secara bertahap dipengaruhi oleh keberadaan suatu katalis.
• Contoh: hidrolisis sukrosa dalam air pada suhu • Contoh: hidrolisis sukrosa dalam air pada suhu
kamar sangat lambat (dapat diabaikan), tetapi dengan penambahan sejumlah kecil asam
dengan penambahan sejumlah kecil asam, kecepatan reaksi bertambah (asam berlaku sebagai katalisator)
Pengertian Katalis
Pengertian Katalis
Katalis/katalisator adalah substansi yang menambah konstanta kecepatan reaksi tetapi tidak mengubah konstanta kesetimbangan reaksi reaksi. Katalis adalah substansi yang mempengaruhi kecepatan reaksi tanpa dirinya sendirikecepatan reaksi tanpa dirinya sendiri menjadi berubah secara kimiawi.
Katalis tidak dikonsumsi dalam keseluruhan reaksi, maksudnya setelah dikonsumsi akan dilepaskan
Pengertian Katalis
Pengertian Katalis
Katalis memberikan efeknya karena dapatKatalis memberikan efeknya karena dapat
berinteraksi baik secara kovalen atau nonkovalen dengan reaktan Katalis yang menurunkan kecepatan reaksi adalah katalis negatif. K t li ki b b h Katalis mungkin berubah secara permanen selama reaksi Æ inhibitor
Selama katalis tidak berubah pada akhir reaksi Æ Selama katalis tidak berubah pada akhir reaksi Æ tidak mengubah keseluruhan ΔG°, di mana ΔG° = ‐R.T. ln K
Katalisis
Katalisis
• ΔG° = ‐R.T. ln K – Posisi kesetimbangan suatu reaksi reversibel tidak berubah – Katalis meningkatkan kecepatan reaksi sehingga kesetimbangan dicapai lebih cepat – Keq = kforward/kreverseKatalisis
Katalisis
Bagaimana katalis beroperasi???
Bagaimana katalis beroperasi???
1. Katalis bergabung dengan reaktan (substrat) 1. Katalis bergabung dengan reaktan (substrat) membentuk suatu intermediet (kompleks) kemudian terurai membentuk katalis dan produk. Katalis menurunkan energi aktivasi (Ea) d b h k i dengan mengubah proses mekanisme. Katalis menurunkan Ea dengan
meningkatkan energi intermediet sehingga meningkatkan energi intermediet sehingga energi yang harus dilewati untuk menjadi produk menjadi kecil
Bagaimana katalis beroperasi??
Bagaimana katalis beroperasi??
2. Katalis mungkin bereaksi dengan 2. Katalis mungkin bereaksi dengan membentuk radikal bebas, sehingga terjadi reaksi berantai. Radikal bebas sangat reaktif karena berenergi bebas tinggi sehingga kecepatan reaksi menjadi besar. Inhibitor berlaku sebagai pemutus rantai (antiknock agents). Inhibitor diperlukan dalam reaksi‐reaksi eksplosif.
Aksi katalitik
Aksi katalitik
• Katalis homogen: katalis berada dalam satuKatalis homogen: katalis berada dalam satu fase dengan reaktan, contoh: katalis dan
reaktan terlarut dalam media reaktan terlarut dalam media.
• Katalis heterogen: katalis berada dalam fase yang berbeda dengan reaktan contoh: katalis yang berbeda dengan reaktan, contoh: katalis berupa padatan dan reaktan terlarut dalam media
Aksi katalitik
Aksi katalitik
• Katalis serbuk wadah/katalis lapisan pada dinding p p g wadah Æ platina. – Prosesnya disebut katalisis kontak: pereaksi teradsorpsi pada permukaan kasar katalis yang dikenal sebagai pusat aktif Æ adsorpsi iniberakibat melemahnya ikatan molekul berakibat melemahnya ikatan molekul, menurunkan energi aktivasi.
– Molekul teraktivasi kemudian dapat bereaksiMolekul teraktivasi kemudian dapat bereaksi dan hasil reaksi melepaskan diri dari dari
Macam Katalisator
Macam Katalisator
1. Katalisator asam spesifikp
Katalisis oleh proton yang tersolvasi, yaitu H33O+
2. Katalisator basa spesifik
Katalisis oleh OH‐ dalam larutan 3. Katalisator asam umum
Katalisis oleh asam proton selain Hp 33O+ , , dilakukan oleh asam Bronsted sebagai donor protonp
Macam Katalisator
Macam Katalisator
4 Katalisator basa umum 4. Katalisator basa umum
Katalisis oleh basa Bronsted selain OH‐ dan basa ini berlaku sebagai penerima proton Æ basa ini berlaku sebagai penerima proton Æ yaitu berbagi pasangan elektron dengan
proton proton
5. Katalisator nukleofilik
Katalisis oleh suatu basa (nukleofil) yang Katalisis oleh suatu basa (nukleofil) yang berbagi pasangan elektron dengan atom (biasanya atom karbon) selain proton
Macam Katalisator
Macam Katalisator
6 Katalisator elektrofilik 6. Katalisator elektrofilik
Katalisis oleh asam Lewis, seperti ion logam, yang berlaku sebagai katalisator dengan cara yang berlaku sebagai katalisator dengan cara menerima pasangan elektron.
Katalisis Asam Spesifik
Katalisis Asam Spesifik
• Hidrolisis ester adalah contoh reaksiHidrolisis ester adalah contoh reaksi kataliskatalis
asam spesifik. Di dalam larutan asam kuat, reaksi hanya dipercepat oleh ion hidronium reaksi hanya dipercepat oleh ion hidronium. • Persamaan lajunya: L j k [H O]+[S] Laju = kas [H3O]+[S] Dimana [S] : konsentrasi ester kas : tetapan laju reaksi hidrolisis spesifik asam
Katalisis Asam Umum
Katalisis Asam Umum
y Seperti halnya katalisis spesifik, berhubungan dengan
t dii t d k ik k d b i l k l
proton diintroduksikan kepada bagian molekul yang
direaksikan dan serangan elektron terhadap molekul air. y Perbedaannya adalah bahwa katalisator asam spesifikPerbedaannya adalah bahwa katalisator asam spesifik
menggunakan ion hidronium sedangkan reaksi katalisis asam umum menggunakan sembarang asam Bronsted sebagai donor proton.
y Untuk katalisis asam umum, pembentukan kation SH+
merupakan tahap lambat Reaksi kondensasi aidol adalah merupakan tahap lambat. Reaksi kondensasi aidol adalah merupakan contoh reaksi yang bergantung kepada
Katalisis Basa Umum
Katalisis Basa Umum
• Katalis menyerang air dulu kemudian airKatalis menyerang air dulu, kemudian air menyerang reaktan.
• Air menjadi lebih polar sehingga interaksi • Air menjadi lebih polar sehingga interaksi
elektrostatiknya menjadi lebih besar dan kecepatan reaksi meningkat
Katalisis Nukleofilik
Katalisis Nukleofilik
• Katalis langsung menyerang reaktan. Basa g g y g Bronsted akan mendonasikan pasangan elektronnya pada atom lain selain hidrogen ( ) (biasanya C atau P) • Molekul intermediet mempunyai E yang besar maka diserang oleh air dengan kecepatan lebih besar daripada menyerang reaktan sehingga kecepatan reaksi menjadi reaktan sehingga kecepatan reaksi menjadi lebih besarKatalisis nukleofilik intramolekuler
Katalisis nukleofilik intramolekuler
• Gugus dalam molekul menyerang gugus lainGugus dalam molekul menyerang gugus laindalam molekul tersebut
• Dapat juga nukleofil menyerang air dulu • Dapat juga nukleofil menyerang air dulu,
kemudian air menyerang reaktan (dinamakan intramolekuler basa umum)
Faktor‐faktor yang menentukan
k
k
l k
mekanisme katalitik
• Struktur R dan X dari senyawa asil (R‐CO‐X)Struktur R dan X dari senyawa asil (R CO X) • Kekuatan nukleofilik dan stabilitas
intermediet nukleofilik terasilasi. intermediet nukleofilik terasilasi. Nukleofilik lemah Æ katalisis lemah • Polaritas solven. Dengan solven yangPolaritas solven. Dengan solven yang
polaritasnya semakin tinggi, maka katalisis nukleofilik lebih terdorong untuk terjadi. Nukleofilik dinyatakan kuat jika tingkat kebasaan tinggi Æ pKb tinggi.
Intramolecular general base catalysis and intramolecular nucleophilic catalysis: Hydrolysis of aspirin and 3 5‐ nucleophilic catalysis: Hydrolysis of aspirin and 3,5‐
Buffer, General Acid‐Base, and
l
h l
l
h l
l
Nucleophilic‐Electrophilic Catalysis
• The catalysis of chloramphenicol hydrolysis by y p y y y phosphate and acetate buffer was reported in the 1950s (Fig. 79).These buffer species, like hydronium ion and hydroxide ion, participate in formation or breakdown of activated complexes of variousreactions and determine their reaction rate reactions and determine their reaction rate.
• Equation (2.105) describes the degradation rate constant assuming that the monoanion or the constant, assuming that the monoanion or the
dianion of phosphoric acid, or both, participates in degradation of the drug.g g
Effect of phosphate concentration on hydrolysis rate (reciprocal of the half‐life t50) of chloramphenicol
half‐life, t50) of chloramphenicol
(pH 7.00, 97.3°C) (Reproduced with permission of the American Pharmaceutical Association.)
Buffer, General Acid‐Base, and
l
h l
l
h l
l
Nucleophilic‐Electrophilic Catalysis
• Many studies on general acid‐base catalysis haveMany studies on general acid base catalysis have been conducted with phosphate as the buffer species. It has been reported that various phosphate species (there are four possible phosphate species) enhance degradation of various drug substances h b l i illi f d il d b i illi such as benzylpenicillin, cefadroxil, and carbenicillin (Fig. 80).
• Degradation enhanced by phosphate has also been • Degradation enhanced by phosphate has also been
reported for codeine, spironolactone, and heroin as well as many other drug substances.
y Effect of phosphate p p
concentration on hydrolysis rate of representative drug substances for which
substances for which phosphate buffer catalysis is observed: y O Benzylpenicillin, 60°C, pH 7.05; y Δ cefadroxil 35°C pH 7 20; y Δ cefadroxil, 35 C, pH 7.20; y • carbenicillin, 35°C, pH 7.48. (with permission.)
Buffer, General Acid‐Base, and
l
h l
l
h l
l
Nucleophilic‐Electrophilic Catalysis
• In addition to possible general acid‐base catalysis h b ff t ith t d where a buffer can act as either a proton donor or acceptor (Bronsted acid or base), buffer species can also act as a Lewis acid or base through nucleophilic or electrophilic mechanisms. • As shown in Scheme 73 and discussed earlier, aspirin anion undergoes intramolecular general base catalysis anion undergoes intramolecular general base catalysis in the neutral pH region. In contrast, intramolecular nucleophilic catalysis to form a tetrahedralintermediate that oes on to form the mi ed intermediate that goes on to form the mixed
anhydride has been demonstrated for the hydrolysis of 3,5‐dinitroaspirin.
Buffer, General Acid‐Base, and
l
h l
l
h l
l
Nucleophilic‐Electrophilic Catalysis
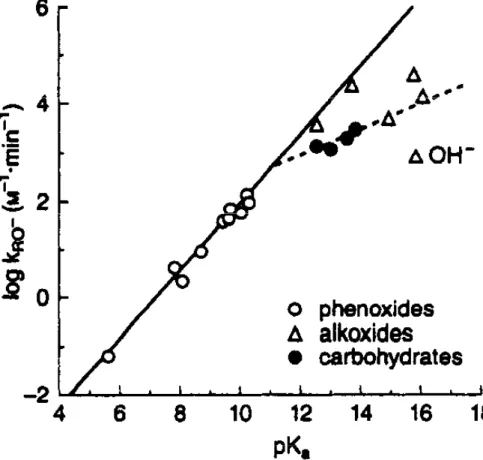
• In the hydrolysis of pnitrophenyl esters, polyalcohol anions such as the glucose anion act by a nucleophilic mechanism.• A plot of the log of the rate constant against the p • A plot of the log of the rate constant against the p
Ka of the anion (Fig. 81) exhibits a deviation from
the linear Brønsted relationship observed for p catalysis by various phenoxide anions when the carbohydrate species are included on the plot. These deviations may be due to the very high These deviations may be due to the very high
basicity of the polyalcohol anions, which leads to very large solvation energy requirements.
Figure 81. Brønsted plots of hydrolysis rate of p‐nitrophenyl esters
susceptible to nucleophilic catalysis at 25°C.
Buffer, General Acid‐Base, and
l
h l
l
h l
l
Nucleophilic‐Electrophilic Catalysis
• Other examples of general base catalysis andOther examples of general base catalysis andnucleophilic catalysis that have been reported include the hydrolysis of cefotiam and
include the hydrolysis of cefotiam and cefsulodin catalyzed by amikacin and
kanamycin and the hydrolysis of moxalactam kanamycin and the hydrolysis of moxalactam catalyzed by various amines.