Seminar Nasional Biologi 2015, Jurusan Biologi, Universitas Tadulako, Palu
POTENSI Azotobacter A10 SEBAGAI AGEN BIOFERTILIZER RAMAH
LINGKUNGAN *
Enny Zulaika1) dan Nur Laili2)
1)
Jurusan Biologi FMIPA ITS, Surabaya; email: enny@bio.its.ac.id 2)
Laboratorium Mikrobiologi Pertanian, LIPI, Indonesia
ABSTRAK
Azotobacter adalah salah satu bakteri yang dapat dimanfaatkan sebagai biofertilizer karena mempunyai
sifat siderofor, melarutkan pospat dan menghasilkan hormon auksin. Azotobacter A10 adalah salah satu bakteri rhizozfer yang diisolasi dari lahan eco urban farming ITS yang diharapkan berpotensi sebagai agen biofertilizer. Potensi siderofor diskrining dengan medium Fe-CAS, pelarut pospat diskrining dengan medium Pikovskaya padat dan produksi auksin diskrining dengan pereaksi Salkoswki. Konsentrasi pospat terlarut dianalisis dengan spektrofotometer UV Vis panjang gelombang 690 nm dan dan produksi auksin dengan panjang gelombang 530 nm. Isolat Azotobacter A10 mampu menghasilkan senyawa siderofor, dapat melarutkan pospat dan mampu menghasilkan hormon auksin. Semakin lama waktu inkubasi, konsentrasi pospat terlarut semakin tinggi, sedangkan hormon auksin tertinggi yang dihasilkan Azotobacter A10 terdapat pada perlakuan suplementasi triptofan 3000 ppm yaitu 8,72 ppm/24 jam dan 9,45 ppm/48 jam.
Kata kunci: Azotobacter, auksin, biofertilizer, pospat-terlarut, siderofor 1. PENDAHULUAN
Produktivitas pertanian merupakan sektor strategis di Indonesia untuk mendukung ketahanan pangan. Tinggi rendahnya produktivitas pertanian ditunjang dengan kesuburan lahan dan ketersediaan nutrisi. Sumber nutrisi yang dapat meningkatkan produktivitas adalah pemberian pupuk kimia, tetapi penggunaan pupuk kimia secara berlebihan dapat menyebabkan penurunan kesuburan lahan (Sihontang, 2009). Pada saat ini telah banyak dikembangkan usaha pertanian
berkelanjutan (sustainable agriculture) dan untuk mencapai sustainable agriculture penggunaan pupuk kimia dapat digantikan dengan pupuk organik yaitu pupuk hasil degradasi secara biologis (Behl et al., 2003). Manfaat ganda yang didapatkan adalah dapat memperbaiki struktur tanah, menambah kemampuan tanah menahan air, dan meningkatkan kegiatan biologi di tanah (Kalpana et al., 2010). Pupuk organik juga dapat meningkatkan kapasitas tukar kation (KTK) tanah dan membentuk
senyawa kompleks dengan ion logam yang meracuni tanaman (Jimenez et al., 2011).
Bioteknologi pupuk hayati melibat kan peran serta mikroorganisme yang mempunyai potensi berbeda-beda dan dinamakan biofertilizer, mikroorganisme yang digunakan umumnya bakteri dan jamur (Aryantha et al., 2004). Azotobacter merupakan salah satu bakteri yang dapat dimanfaatkan sebagai biofertilizer karena bersifat siderofor yang dapat meningkatkan ketahanan tanaman terhadap penyakit, dapat melarutkan pospat dan menghasil kan hormon auksin sehingga meningkatkan ketersediaan nutrisi dalam tanah (Kumar et
al., 2008). Salah satu mikroorganisme
yang berpotensi sebagai bahan baku
biofertilizer adalah genus Azotobacter
yaitu bakteri yang melimpah di tanah. Tujuan dari penelitian ini adalah mendapatkan potensi Azotobacter A10 dari lahan eco urban farming ITS sebagai agen biofertilizer
Seminar Nasional Biologi 2015, Jurusan Biologi, Universitas Tadulako, Palu
2. BAHAN DAN CARA KERJA a. Bakteri Siderofor
Satu ose isolat Azotobacter A10 secara aseptis diinokulasikan ke medium Fe-CAS agar dengan metode streak plate, diinkubasi pada suhu ruang selama 24 jam. Bakteri sebagai penghasil siderofor adalah isolat yang koloninya berwarna kuning sampai oranye yang kontras dengan warna biru media Fe-CAS agar (Husen, 2007).
b. Pelarut pospat
Medium Pikovskaya padat dicair kan, secara aseptis 15 ml dituang ke dalam cawan petri steril dan ditunggu sampai memadat. Selanjutnya Isolat Azotobacter A10 diinokulasikan ke dalam medium Pikovskaya dengan metode spot inoculation (Cappuccino dan Sherman,
2001). Koloni yang mampu membentuk zona bening diindikasikan mampu melarutkan fosfat. Dilakukan pengukuran zona bening setiap 48 jam sampai 336 jam. Berdasarkan zona bening yang terbentuk dihitung Indeks Kelarutan Pospat (IKP) dengan formulasi {(diameter koloni + diameter zona bening)}/diameter koloni (Karpagam dan Nagalakshmi, 2014).
Secara kuantitatif pelarutan pospat dianalisis dengan kurva standar pospat. Secara aseptis 1 ml starter dimasukkan ke dalam 9 ml medium Pikovskaya cair. Kultur diinkubasi menggunakan rotary
shacker 100 rpm. Konsentrasi fosfat yang
terlarut dalam medium dihitung secara periodik setiap 2 hari selama 14 hari (Santosa, 2007 dalam Saraswati et al., 2007).
Sebanyak 10 ml kultur disaring dengan kertas whatman no 1, disentrifus 3.000 rpm (15 menit). Sebanyak 5 ml supernatan dimasukkan ke dalam tabung reaksi, ditambah pereaksi pewarna pospat pekat (0,5 ml), dihomogenkan dan didiamkan 30 menit. Absorbansi diukur dengan Spectrofotometer Spectronic Genesys 20® λ 690 nm (Santosa 2007 dalam Saraswati et al., 2007). Konsentrasi
fosfat terlarut dalam medium dihitung menggunakan persamaan kurva standar fosfat yaitu: y = ax + b (y: nilai absorbansi, a: konstanta, b: koefisien dan x: nilai konsentrasi fosfat)
c. Penghasil hormon auksin
Isolat Azotobacter diinokulasikan pada media agar yang disuplementasi triptofan dengan konsentrasi 100 ppm, diinkubasi pada suhu ruang 48 jam. Pereaksi Salkowski diteteskan pada isolat
Azotobacter A10 yang telah tumbuh dan
diinkubasi dalam ruang gelap 30 menit. Perubahan warna koloni menjadi merah menunjukkan isolat mampu menghasilkan hormon auksin. Uji kuantitatif dilakukan dengan menambahkan L-triptofan 1000, 2000 dan 3000 ppm ke dalam 30 ml kultur (106) Azotobacter A10 (µ jam) dalam medium broth, diinkubasi dalam gelap dan dishaker pada suhu ruang (Shokri & Emtiazi, 2010). Pengukuran konsentrasi auksin dilakukan pada inkubasi ke 0, 24 dan 48 jam. Sebanyak 2 ml kultur disentrifus dengan kecepatan 8000 rpm (10 menit), 1 ml supernatan ditambah 2 ml pereaksi Salkowski (Mohite, 2013), diinkubasi di ruang gelap selama 30 menit. Pengukuran absorbansi menggunakan spektrofotometer UV-VIS dengan panjang gelombang 530 nm.
3. HASIL DAN PEMBAHASAN Genus Azotobacter A10
Bentuk sel Azotobacter A10 ovoid besar, membentuk cysta, bersifat nonmotil, menghasilkan enzim katalase dan mampu memfermentasikan glukosa. Bentuk sel dan cysta pada Azotobacter A10 dapat dilihat pada Gambar 1.
(a) (b)
Gambar 1. Morfologi sel Azotobacter A10 (a. bentuk sel ovoid besar, b. cysta)
Seminar Nasional Biologi 2015, Jurusan Biologi, Universitas Tadulako, Palu
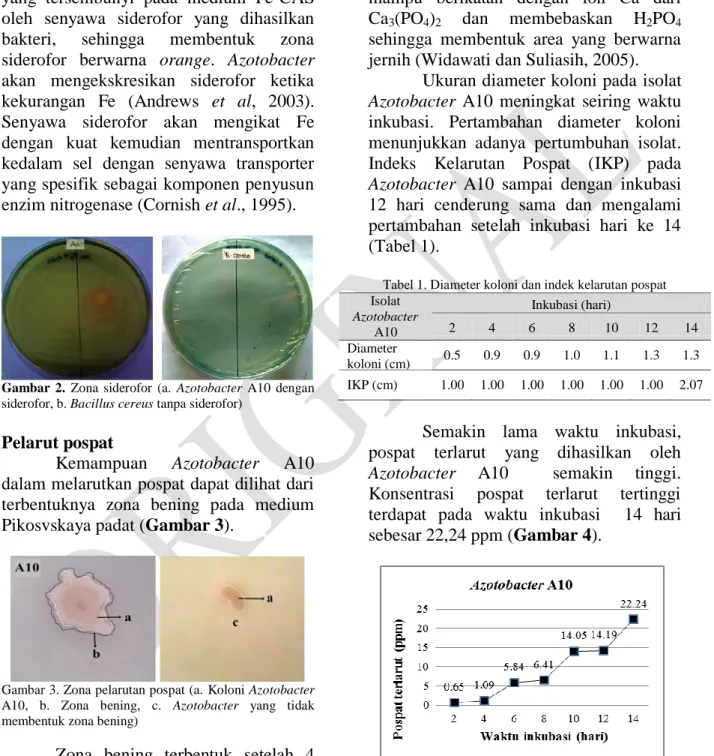
Bakteri siderofor
Azotobacter A10 yang menghasil
kan senyawa siderofor ditandai dengan terbentuknya zona siderofor berwarna
orange di sekitar koloni (Gambar 2). Zona
siderofor terbentuk akibat pengkelatan Fe yang tersembunyi pada medium Fe-CAS oleh senyawa siderofor yang dihasilkan bakteri, sehingga membentuk zona siderofor berwarna orange. Azotobacter akan mengekskresikan siderofor ketika kekurangan Fe (Andrews et al, 2003). Senyawa siderofor akan mengikat Fe dengan kuat kemudian mentransportkan kedalam sel dengan senyawa transporter yang spesifik sebagai komponen penyusun enzim nitrogenase (Cornish et al., 1995).
Gambar 2. Zona siderofor (a. Azotobacter A10 dengan siderofor, b. Bacillus cereus tanpa siderofor)
Pelarut pospat
Kemampuan Azotobacter A10 dalam melarutkan pospat dapat dilihat dari terbentuknya zona bening pada medium Pikosvskaya padat (Gambar 3).
Gambar 3. Zona pelarutan pospat (a. Koloni Azotobacter A10, b. Zona bening, c. Azotobacter yang tidak membentuk zona bening)
Zona bening terbentuk setelah 4 hari inkubasi. Medium Pikovskaya padat berwarna putih kruh karena mengandung Ca3(PO4)2 terikat.. Saat pospat terlepas dalam medium akan membentuk zona bening.
Azotobacter mampu membentuk
zona bening karena menghasilkan asam organik. Asam organik menyebabkan terjadinya pelarutan pospat dari pospat terikat menjadi bentuk yang tersedia (Khiari and Parent, 2005). Asam organik mampu berikatan dengan ion Ca dari Ca3(PO4)2 dan membebaskan H2PO4 sehingga membentuk area yang berwarna jernih (Widawati dan Suliasih, 2005).
Ukuran diameter koloni pada isolat
Azotobacter A10 meningkat seiring waktu
inkubasi. Pertambahan diameter koloni menunjukkan adanya pertumbuhan isolat. Indeks Kelarutan Pospat (IKP) pada
Azotobacter A10 sampai dengan inkubasi
12 hari cenderung sama dan mengalami pertambahan setelah inkubasi hari ke 14 (Tabel 1).
Tabel 1. Diameter koloni dan indek kelarutan pospat Isolat Azotobacter A10 Inkubasi (hari) 2 4 6 8 10 12 14 Diameter koloni (cm) 0.5 0.9 0.9 1.0 1.1 1.3 1.3 IKP (cm) 1.00 1.00 1.00 1.00 1.00 1.00 2.07
Semakin lama waktu inkubasi, pospat terlarut yang dihasilkan oleh
Azotobacter A10 semakin tinggi.
Konsentrasi pospat terlarut tertinggi terdapat pada waktu inkubasi 14 hari sebesar 22,24 ppm (Gambar 4).
Gambar 4. Produksi pospat terlarut oleh Azotobacter A10 Bertambahnya konsentrasi fosfat terlarut terjadi karena adanya aktivitas pelarutan fosfat oleh isolat melalui sekresi asam organik. Fosfat terlarut dimanfaatkan oleh isolat untuk metabolisme sel dan
Seminar Nasional Biologi 2015, Jurusan Biologi, Universitas Tadulako, Palu
pembentukan energi sehingga isolat mampu tumbuh dan membelah dengan baik, jumlah sel bertambah dan produksi asam organik semakin tinggi sehingga fosfat terlarut juga semakin tinggi (Santosa, 2007).
Penghasil hormon auksin
Isolat Azotobacter A10 mampu menghasilkan hormon auksin yang ditunjukkan dengan perubahan warna isolat menjadi kemerahan (Gambar 5). Menurut Rahman et al. (2010) perubahan warna kemerahan pada isolat terjadi karena adanya reaksi antara pereaksi Salkowski dengan IAA, FeCl3 dan HClO4 yang merupakan senyawa penyusun pereaksi Salkoswki membentuk kompleks tris-(indole-3-aceto)-Fe (III) yang membentuk warna merah. Reaksi terjadinya warna merah mengindikasikan isolat Azotobacter mampu me-metabolisme L-triptofan menjadi IAA.
Gambar 5. Produksi hormon auksin secara kualitatif pada Azotobacter A10
Konsentrasi perlakuan triptofan semakin tinggi akan menghasilkan konsentrasi auksin yang relatif lebih tinggi pula. Produksi auksin juga semakin tinggi sebanding dengan lamanya waktu inkubasi. Konsentrasi auksin yang tinggi terdapat pada perlakuan triptofan 3000 ppm yaitu 8,72 ppm/24 jam dan 9,45 ppm/48 jam (Gambar 6). Produksi hormon auksin akan meningkat jika pada medium kultur ditambahkan suatu prekursor auksin yaitu triptofan (Mohite, 2013)
Gambar 6. Produksi auksin oleh Azotobacter A10
KESIMPULAN DAN SARAN
Isolat Azotobacter A10 mampu menghasilkan senyawa siderofor, dapat melarutkan pospat dan mampu menghasil kan hormon auksin. Konsentrasi pospat terlarut yang tertinggi terdapat pada waktu inkubasi 14 hari sebesar 22,24 ppm, sedangkan hormon auksin tertinggi yang dihasilkan Azotobacter A10 terdapat pada perlakuan suplementasi triptofan 3000 ppm yaitu 8,72 ppm/24 jam dan 9,45 ppm/48 jam.
DAFTAR PUSTAKA
Andrews, B. J., Robinson, A. K., dan Rodriguez, Q. F. 2003. Bacterial Iron homeostasis. FEMS
Microbiol Rev. 27:215-237
Aryantha I, DP Lestari, N Pangesti. 2004. Potensi isolat penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones. 9 (2): 43-46.
Behl, R.K., Sharma, H., Kumar, V., & Narula, N. (2003). Interactions amongst mycorhiza,
Azotobacter chroococcum and root characteristics of wheat varieties. J. Agron.
Crop Sci. 189: 151-155.
Cappuccino, J.G., dan Sherman, N. 2001.
Microbiology a Laboratory Manual. New
York: Benjamin Cummings.
Cornish, A. S dan Page, W. J. 1995. Production of the tricatecholate siderophore protechelin by Azotobacter vinelandii. Bio-metals 8:332-338
Husein, E. 2007. Metode Analisis Biologi Tanah. Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian, Badan Penelitian, Departemen Pertanian.
Jiménez, D.J., Montaña, J.S. & Martínez, M.M. (2011). Characterization of free nitrogen fixing bacteria of the genus Azotobacter in organic vegetable-grown Colombian soil.
Brazilian Journal of Microbiology. 42:
Seminar Nasional Biologi 2015, Jurusan Biologi, Universitas Tadulako, Palu
Karpagam, T., dan Nagalakshmi, P.K. 2014. Isolation and Characterization of Phosphate Solubilizing Microbes from Agricultural Soil. Intenational Journal of
Current Microbiology and Applied Science
3(3): 601-614.
Kumar, G.P., Yadav, S.K., Thawale, P.R., Singh, S.K. & Juwarkar, A.A. (2008). Growth of
Jatropha curcas on heavy metal contaminated soil amended with industrial wastes and Azotobacter-A greenhouse study. Bioresour. Technol. 99: 2078-2082. Mohite, B. 2013. Isolation and characterization of
indole acetic acid (IAA) producing bacteria from rhizospheric soil and its effect on plant growth. Journal of Soil
Science and Plant Nutrition 13(3):
638-649.
Rahman, A., Sitepu, I.R., Tang, S.Y., dan Hashidoko, Y. 2010. Salkowski’s Reagent Test As A Primary Screening Index for Functionalities of Rhizobacteria Isolated from Wild Dipterocarp Saplings Growing Naturally on Medium-Strongly Acidic Tropical Peat Soil. Biosci. Biotechnol.
Biochem. 74 (11) : 1003600-1-7.
Santosa, E. 2007. Mikroba Pelarut Fosfat. Dalam. Saraswati, R., Husen, E., dan Simanungkalit, R.D.M. 2007. Metode
Analisis Biologi Tanah. Bogor: Balai
Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian,
Shokri, D. and Emtiazi, G. 2010. Indole-3-acetic acid (IAA) Production in Symbiotic and Non-Symbiotic Nitrogen-Fixing Bacteria and its Optimization by Taguchi Design.
Curr Microbiol. 61: 217-225.
Sihontang, B. (2009). Pembangunan pertanian berkelanjutan dengan pertanian organik. http:// diperta.jabarprov.go.id/index.php/ subMenu/informasi/berita/detailberita/110. Diunduh 23 April 2014
Widawati, S dan Suliasih. 2005. Populasi Bakteri Pelarut Fosfat (BPF) di Cikaniki, Gunung Batol dan Ciptarasa, Serta Kemampuannya Melarutkan P Terikat di Media Pikovskaya Padat. Biodiversitas. 7 (1): 10-14.