commit to user
23
BAB IV
HASIL DAN PEMBAHASAN
A. Gambaran Darah
Gambaran darah merupakan salah satu parameter yang menjadi indikasi adanya perubahan kondisi kesehatan ikan baik akibat faktor infeksi (mikroorganisme) atau karena faktor non infeksi (oleh lingkungan, nutrisi, genetik). Gambaran darah ikan penting karena dapat membantu dalam diagnosa suatu penyakit (Dopongtonung 2008).
Berdasarkan hasil penelitian yang dilakukan, diperoleh data gambaran darah yang meliputi jumlah eritrosit, jumlah leukosit dan kadar hematokrit. Data gambaran darah diperoleh dengan pengambilan sampel darah pada hari ke-15 (Zuhrawati, 2013).
Tabel 2. Gambaran Darah Ikan Nila Setelah Pemberian Perlakuan Konsentrasi Temulawak
Perlakuan Jumlah eritrosit (/μL) Jumlah leukosit (/μL) Kadar Hematokrit (%) P1 80x104 1759x102 10,9 P2 40x104 3000x102 4,0 P3 50x104 2000x102 4,8 P4 76x104 1245x102 10,5 P5 121x104 1265x102 12,5 Keterangan : P1 = 0% temulawak P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak 1. Eritrosit
Eritrosit pada ikan merupakan jenis sel darah yang paling banyak jumlahnya. Bentuk eritrosit pada semua jenis ikan hampir sama. Eritrosit pada
commit to user
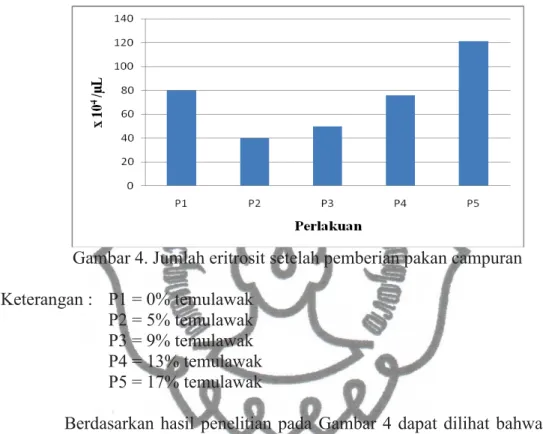
ikan memiliki inti, seperti pada bangsa burung dan reptil. Berdasarkan hasil penelitian jumlah eritrosit pada ikan nila setelah diberi perlakuan pakan campuran terlihat pada Gambar 4.
Gambar 4. Jumlah eritrosit setelah pemberian pakan campuran Keterangan : P1 = 0% temulawak
P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
Berdasarkan hasil penelitian pada Gambar 4 dapat dilihat bahwa terjadi penurunan jumlah eritrosit dari perlakuan kontrol yang selanjutnya terjadi kenaikan dari setiap perlakuan dengan kenaikan tertinggi pada perlakuan P5 yaitu 121x104 μ/L. Terjadinya peningkatan jumlah eritrosit menandakan bahwa temulawak dapat meningkatkan jumlah eritrosit setelah pemberian konsentrasi 17% air rebusan temulawak.
Jika dibandingkan dengan penelitian Bailone et al. (2010) tentang efek vaksinasi polivalen dan serum aglutinasi A.hydrophila pada ikan nila jumlah eritrosit lebih tinggi berkisar 1,12-1,19x106/μL, sedangkan menurut Hardi dkk. (2011) jumlah eritrosit ikan nila ukuran 15g normal berkisar antara 1,05-3,0x106
commit to user
sel/mm3. Hal ini menunjukkan bahwa jumlah eritrosit ikan nila hasil penelitian pada perlakuan P5 mempunyai jumlah eritrosit pada kisaran normal dan pada perlakuan P1, P2, P3 dan P4 jumlah eritrosit lebih rendah dari kisaran normal, yaitu antara 1,05-3,0x106 sel/mm3 (Irianto, 2005). Untuk perlakuan kontrol, perlakuan P2, P3 dan P4 jumlah eritrosit lebih rendah dari kisaran normal dikarenakan faktor lingkungan yang buruk serta anemia yang disebabkan oleh rendahnya jumlah oksigen dalam air sehingga jumlah eritrosit dalam darah menurun. Faktor lingkungan yang buruk bisa dikarenakan kondisi akuarium yang digunakan untuk pemeliharaan ikan kurang steril, dimana sebelumnya dipakai oleh peneliti lain dengan penelitian menggunakan bakteri meskipun sudah beberapa kali dilakukan pencucian akuarium. Faktor yang mempengaruhi jumlah eritrosit yaitu: jenis kelamin, umur, kondisi badan, aktivitas harian dan stres (Soetrisno, 1987). Menurut Oktavia (2011) faktor yang mempengaruhi jumlah eritrosit yaitu spesies, kondisi pakan, kandungan bahan organik, kondisi lingkungan, umur dan musim.
Peningkatan jumlah eritrosit disebabkan karena terdapat kurkumin dalam temulawak yang dapat meningkatkan kerja organ pencernaan sehingga nafsu makan ikan meningkat. Mekanisme meningkatnya nafsu makan yaitu dengan mempercepat sekresi empedu sehingga dapat mempercepat pengosongan lambung serta pencernaan dan absorpsi lemak di usus yang kemudian akan mensekresi berbagai hormon yang dapat menimbulkan rasa lapar dan meregulasi peningkatan nafsu makan. Peningkatan jumlah eritrosit pada ikan dilakukan untuk mengurangi keadaan stres sehingga ikan dapat menyesuaikan kondisi fisiologisnya dengan
commit to user
meningkatkan jumlah eritrosit dalam sirkulasi. Hal ini juga dikarenakan kandungan zat aktif yang terdapat dalam temulawak terutama curcumin dan minyak atsiri dapat digunakan sebagai anti oksidan dan detoksifikasi dalam hati. Curcumin juga mampu untuk mengurangi toksisitas ginjal dan hematotoksisitas melalui efek antioksidan yang dimilikinya dengan cara menghambat injuri oksidatif dan mengembalikan profil enzim antioksidan pada ginjal (Kertia dkk., 2011), dimana ginjal merupakan salah satu organ yang penting dalam pembentukan sel darah merah dengan mengeluarkan hormon eritropoietin.
Kurkumin pada rimpang temulawak diketahui bersifat anti bakteri dan anti inflamasi sementara komponen seperti pati, serat, abu dan zat-zat gizi lain yang akan membatasi proses metabolisme dan fisiologi organ tubuh guna memulihkan kondisi tubuh. Rimpang temulawak mengandung zat berwarna kuning (kurkumin), serat, pati, kalium oksalat, minyak atsiri, dan flavonoid, zat-zat tersebut berfungsi sebagai antimikroba/antibakteri, mencegah penggumpalan darah, anti peradangan, melancarkan metabolisme dan fungsi organ tubuh (Ditjen POM, 2000). Kurkumin mempunyai daya anti hepatotoksik, meningkatkan sekresi empedu dan pancreas, menurunkan kadar kolesterol darah serta mampu menurunkan tekanan darah, bersifat anti bakteri serta mampu mencegah timbulnya perlemakan dalam sel hati (Liang dkk., 1985). Beberapa grup senyawa kimia utama yang bersifat anti mikroba adalah fenol dan senyawa fenoli, alkohol, logam berat dan senyawanya, zat warna dan deterjen, senyawa ammonium khemosterilan. Kurkumin adalah suatu persenyawaan fenolitik maka mekanisme kerjanya sebagai anti mikroba akan mirip dengan sifat persenyawaan fenol
commit to user
lainnya (Pelezer dkk, 1997). Lebih lanjut Darwis (1991) menyatakan bahwa kurkumin mempunyai khasiat anti bakteri dan dapat merangsang dinding kantong empedu untuk mengeluarkan cairan dan merangsang keluarnya getah pankreas yang mengandung enzim lipase, amilase dan protease untuk meningkatkan aktifitas pencernaan bahan pakan karbohidrat, lemak dan protein.
2. Leukosit
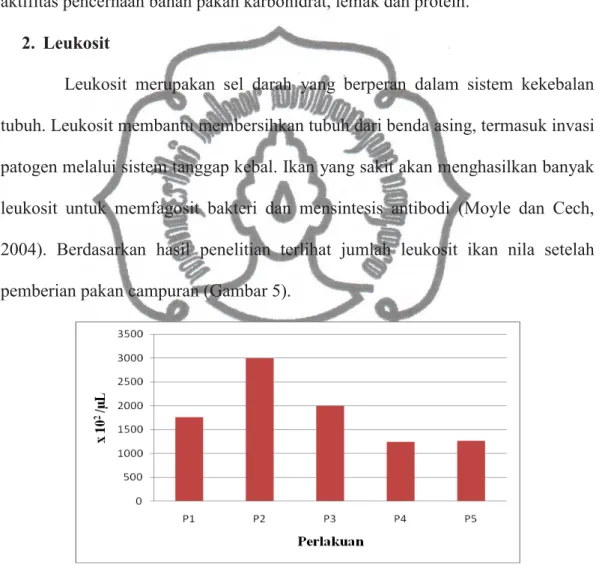
Leukosit merupakan sel darah yang berperan dalam sistem kekebalan tubuh. Leukosit membantu membersihkan tubuh dari benda asing, termasuk invasi patogen melalui sistem tanggap kebal. Ikan yang sakit akan menghasilkan banyak leukosit untuk memfagosit bakteri dan mensintesis antibodi (Moyle dan Cech, 2004). Berdasarkan hasil penelitian terlihat jumlah leukosit ikan nila setelah pemberian pakan campuran (Gambar 5).
Gambar 5. Jumlah leukosit setelah pemberian pakan campuran Keterangan : P1 = 0% temulawak
P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
commit to user
Berdasarkan Gambar 5 terjadi kenaikan jumlah leukosit tertinggi yaitu pada P2 dengan jumlah 3000x102 /μL yang selanjutnya terjadi penurunan jumlah leukosit dan meningkat kembali pada P5 dengan 1265x102 /μL meskipun tidak setinggi perlakuan kontrol atau P1 yaitu 1765x102 /μL.
Jika dibandingkan dengan penelitian Boilone et al. (2010) tentang efek vaksinasi polivalen dan serum aglutinasi A.hydrophila pada ikan nila jumlah leukosit lebih rendah berkisar 17,46-37,66x102 /μL dan menurut Moyle dan Cech (1988) jumlah leukosit total ikan teleostei berkisar antara 20.000-150.000 sel/mm3. Hal ini menunjukkan bahwa jumlah leukosit ikan nila hasil penelitian lebih tinggi dari kisaran normal jumlah leukosit ikan.
Menurut Arry (2007) bahwa peningkatan jumlah total leukosit terjadi akibat adanya respon dari tubuh ikan terhadap kondisi lingkungan pemeliharaan yang buruk, faktor stres dan infeksi penyakit. Penurunan jumlah leukosit disebabkan karena adanya gangguan pada fungsi organ ginjal dan limpa dalam memproduksi leukosit yang disebabkan oleh infeksi penyakit.
Pemberian temulawak dapat meningkatkan tanggap kebal non spesifik ikan dengan meningkatnya total leukosit dikarenakan kandungan zat aktif kurkumin dan minyak atsiri pada temulawak yang merupakan anti bakteri, anti inflamasi dan juga anti kapang (Surharman, 1984 dan Ardiansyah, 2007). Pada penelitian Sari dkk. (2012) tentang perendaman ikan mas pada larutan temulawak yang di infeksi Aeromonas hydrophilla menunjukkan larutan temulawak dapat meningkatkan ketahanan terhadap infeksi bakteri dan menunjukkan efek imun dan penelitian Dayanti dkk. (2013) tentang ketahanan non spesifik ikan mas yang
commit to user
diberi larutan temulawak terhadap A. hydrophilla juga menunjukkan larutan temulawak dapat meningkatkan daya tahan tubuh ikan terhadap infeksi A. hydrophilla.
Keberadaan ekstrak temulawak yang dapat meningkatkan sintasan (persentase ikan yang hidup atau survival rate) dan juga meningkatkan sistem imunitas dalam tubuh karena selain mengandung minyak atsiri, yang di dalamnya mengandung bahan-bahan senyawa fenol yang bersifat anti bakteri. Senyawa-senyawa fenol membunuh bakteri dengan merusak membran selnya (Siagian, 2014).
3. Kadar Hematokrit
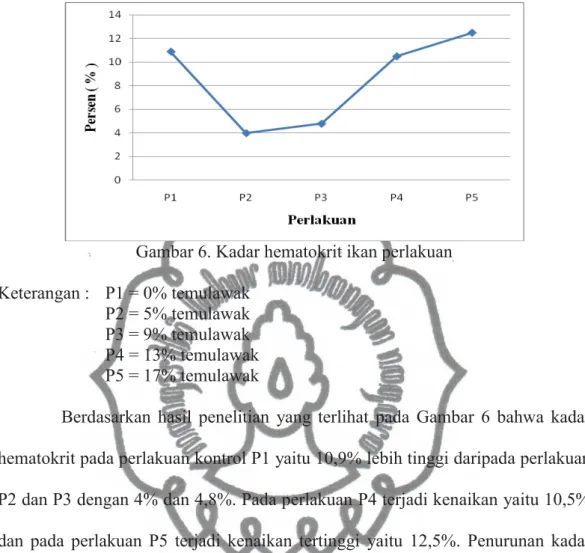
Hematokrit merupakan salah satu indikator untuk menduga efek stress lingkungan bagi kesehatan ikan (Kuswardani, 2006). Menurut Nabib dan Pasaribu (1989) bahwa nilai hematokrit darah ikan berkisar 5%-60%. Kadar hematokrit ini bervariasi tergantung pada faktor nutrisi, umur ikan, jenis kelamin, ukuran tubuh dan masa pemijahan (Kuswardani, 2006). Berikut grafik kadar hematokrit yang diperoleh setelah pemberian pakan campuran (Gambar 6).
commit to user
Gambar 6. Kadar hematokrit ikan perlakuan Keterangan : P1 = 0% temulawak
P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
Berdasarkan hasil penelitian yang terlihat pada Gambar 6 bahwa kadar hematokrit pada perlakuan kontrol P1 yaitu 10,9% lebih tinggi daripada perlakuan P2 dan P3 dengan 4% dan 4,8%. Pada perlakuan P4 terjadi kenaikan yaitu 10,5% dan pada perlakuan P5 terjadi kenaikan tertinggi yaitu 12,5%. Penurunan kadar hematokrit pada perlakuan P2 dan P3 terjadi karena jumlah eritrosit dalam darah menurun. Penurunan jumlah eritrosit berhubungan dengan kenaikan jumlah leukosit yang terjadi pada perlakuan P2 dan P3 dimana pada perlakuan tersebut ikan mengalami infeksi. Penurunan jumlah eritrosit juga terjadi karena ikan mengalami anemia yang dikarenakan kurangnya oksigen dalam air sehingga ikan mudah terkena infeksi. Terjadinya penurunan kadar hematokrit berbanding lurus dengan penurunan jumlah eritrosit. Jika jumlah eritrosit dalam darah menurun maka kadar hematokrit dalam darah juga ikut menurun. Nilai hematokrit dipengaruhi oleh beberapa faktor antara lain eritrosit (jumlah, ukuran, bentuk, perbandingan antikoagulan dengan darah, tempat penyimpanan dan homogenitas),
commit to user
lingkungan, jenis kelamin, spesies dan umur ikan ketika dilakukan pengambilan darah (Suhermanto dkk., 2013).
Pemeriksaan hematokrit ikan berguna untuk melihat kondisi kesehatan ikan. Apabila kadar hematokrit menurun dari kadar hematokrit normal berkisar 5-60% (Nabib dan Pasaribu, 1989) maka ikan mengalami anemia (kurang dari 5%), sedangkan apabila kadar hematokrit diatas normal (lebih dari 60%) menunjukkan ikan mengalami stres. Pada perlakuan P2 dan P3 kadar hematokrit mengalami penurunan yaitu 4,8% dan 4% yang menunjukkan bahwa ikan mengalami anemia sedangkan pada perlakuan P1, P4 dan P5 kadar hematokrit ikan berada dikisaran normal.
Bila dibandingkan dengan penelitian Yulistia dkk. (2015) tentang pemberian pakan yang mengandung larutan temulawak selama pemeliharaan 30 hari kadar hematokritnya lebih tinggi berkisar 13,8-18,5% dan penelitian Dayanti (2013) tentang perendaman ikan pada larutan temulawak selama 5 menit yang dilakukan selama 30 hari pada ikan mas kadar hematokritnya lebih tinggi berkisar 24,48-29,35%. Hal ini menunjukkan bahwa kadar hematokrit ikan dipengaruhi oleh faktor lingkungan serta dapat berubah tergantung pada musim, suhu dan pemberian pakan dan dampak pemberian immunostimulan (Lukistyowati dkk., 2007).
Kadar hematokrit pada ikan nila yang pakannya diberi air rebusan temulawak mengalami peningkatan. Hal ini membuktikan bahwa air rebusan temulawak mengandung bahan imunostimulan yang dapat meningkatkan kadar hematokrit dalam tubuh ikan. Anderson (1992) menyatakan bahwa terjadinya
commit to user
mekanisme peningkatan nilai hematokrit sesudah pemberian immunostimulan disebabkan oleh rangsangan makrofag untuk memproduksi interleukin yang akan membuat limfosit membelah menjadi limfosit-T dan limfosit-B serta membuat limfosit-B menjadi lebih aktif dalam memproduksi antibodi. Limfosit-T memproduksi interferon yang mengaktifkan kembali (meningkatkan kemampuan) makrofag sehingga dapat memakan dan membunuh banyak bakteri, virus dan partikel asing lainnya yang masuk kedalam tubuh.
B. Pertumbuhan
Menurut Effendi (1997), pertumbuhan adalah perubahan ukuran baik panjang, bobot, maupun volume dalam kurun waktu tertentu, atau dapat juga diartikan dengan pertambahan jaringan akibat dari pembelahan sel secara mitosis, yang terjadi apabila ada kelebihan pasokan energi dan protein. Dalam badan ikan, energi dan protein yang berasal dari makanan berperan untuk pemeliharaan hidupnya, yaitu untuk tumbuh, berkembang dan bereproduksi (Yuliana, 2001).
Pertumbuhan merupakan pertambahan ukuran baik panjang maupun berat yang dipengaruhi oleh faktor genetik, hormon serta lingkungan (Fujaya, 2004). Parameter yang diukur dalam penelitian ini adalah pertumbuhan ikan nila yang ditentukan dengan mengukur panjang dan berat ikan.
commit to user
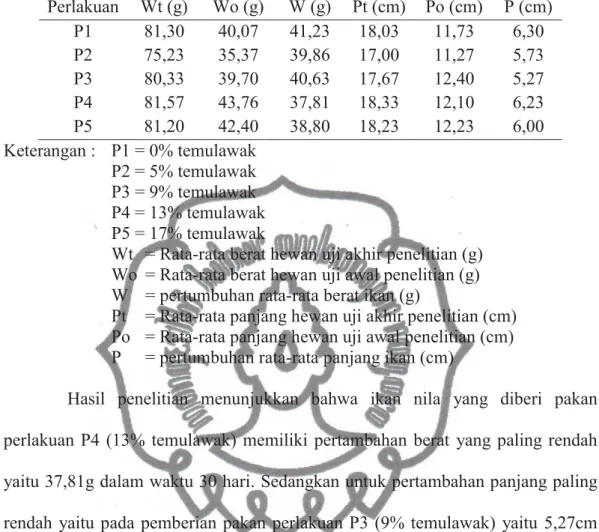
Tabel 3. Hasil Penghitungan Pertumbuhan Ikan Nila
Perlakuan Wt (g) Wo (g) W (g) Pt (cm) Po (cm) P (cm) P1 81,30 40,07 41,23 18,03 11,73 6,30 P2 75,23 35,37 39,86 17,00 11,27 5,73 P3 80,33 39,70 40,63 17,67 12,40 5,27 P4 81,57 43,76 37,81 18,33 12,10 6,23 P5 81,20 42,40 38,80 18,23 12,23 6,00 Keterangan : P1 = 0% temulawak P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
Wt = Rata-rata berat hewan uji akhir penelitian (g) Wo = Rata-rata berat hewan uji awal penelitian (g) W = pertumbuhan rata-rata berat ikan (g)
Pt = Rata-rata panjang hewan uji akhir penelitian (cm) Po = Rata-rata panjang hewan uji awal penelitian (cm) P = pertumbuhan rata-rata panjang ikan (cm)
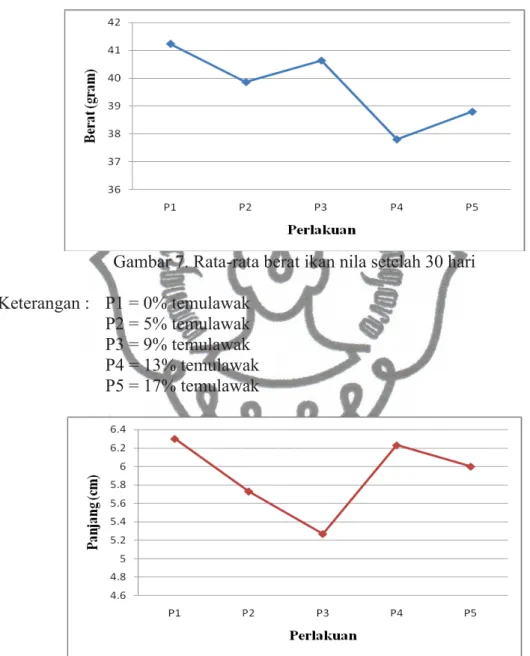
Hasil penelitian menunjukkan bahwa ikan nila yang diberi pakan perlakuan P4 (13% temulawak) memiliki pertambahan berat yang paling rendah yaitu 37,81g dalam waktu 30 hari. Sedangkan untuk pertambahan panjang paling rendah yaitu pada pemberian pakan perlakuan P3 (9% temulawak) yaitu 5,27cm dalam waktu 30 hari. Hasil pertambahan berat dan panjang tertinggi adalah pada ikan nila yang diberi perlakuan P1 (kontrol), yaitu 41,23g (untuk berat) dan 6,3cm (untuk panjang) dalam waktu 30 hari.
Berdasarkan hasil uji ANOVA (Lampiran 6) pada ukuran berat ikan menunjukkan bahwa tidak ada perbedaan secara signifikan. Hal ini dikarenakan hampir dari setiap perlakuan pertambahan berat ikan nila cenderung menurun. Untuk ukuran panjang, hasil uji ANOVA (Lampiran 5) menunjukkan perubahan yang signifikan serta hasil uji Duncan menunjukkan bahwa pada perlakuan A (kontrol), perlakuan B (5% temulawak) dan perlakuan C (9% temulawak) tidak
commit to user
ada beda nyata tetapi perlakuan A (kontrol), perlakuan B (5% temulawak) dan perlakuan C (9% temulawak) berbeda nyata terhadap perlakuan D (13% temulawak) dan perlakuan E (17% temulawak).
Gambar 7. Rata-rata berat ikan nila setelah 30 hari Keterangan : P1 = 0% temulawak
P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
Gambar 8. Rata-rata panjang ikan nila setelah 30 hari Keterangan : P1 = 0% temulawak
P2 = 5% temulawak P3 = 9% temulawak P4 = 13% temulawak P5 = 17% temulawak
commit to user
Pada Gambar 7 dan Gambar 8 menunjukkan bahwa rata-rata pertambahan berat dan rata-rata pertambahan panjang ikan dari pakan perlakuan dan dengan pemberian pakan tanpa perlakuan terdapat penurunan dan peningkatan. Dari hasil penelitian menunjukkan bahwa perlakuan P1 (kontrol) mempunyai pertumbuhan yang lebih baik daripada perlakuan P2, P3, P4 dan P5. Hal ini bisa dikarenakan adanya aroma yang mempengaruhi ikan untuk memakan pakan yang dicampur air rebusan temulawak. Pakan yang dicampur air rebusan temulawak cenderung berbau temulawak karena dalam temulawak terdapat minyak atsiri yang berbau khas serta rasa pahit. Adanya bau dan rasa pahit mempengaruhi nafsu makan ikan sehingga pakan yang masuk lebih sedikit jika dibandingkan dengan pakan kontrol yang tidak dicampur air rebusan temulawak. Kurangnya nafsu makan ikan ini mempengaruhi pertumbuhan ikan yang seharusnya meningkat menjadi tetap atau menurun selain juga disebabkan oleh faktor lingkungan, anemia dan lain-lain. Oleh karena itu, perlu penambahan bahan yang dapat meningkatkan aroma amis pada pakan ikan serta dapat mengurangi rasa pahit yang terdapat pada air rebusan temulawak sehingga ikan mau memakan pakan campuran.
Anemia pada ikan dapat mempengaruhi pertumbuhan ikan. Pada perlakuan P2 dan P3 terjadi penurunan panjang ikan. Hal ini juga terjadi pada jumlah eritrosit dan kadar hematokrit perlakuan P2 dan P3 yang mengalami penurunan karena anemia. Anemia pada ikan dapat menyebabkan nafsu makan ikan menurun. Anemia yang disebabkan oleh meningkatnya jumlah kerusakan eritrosit atau berkurangnya pelepasan eritrosit dalam sirkulasi darah
commit to user
mengakibatkan suplai makanan kedalam sel, jaringan dan organ berkurang sehingga metabolisme terhambat dan pertumbuhan menjadi menurun.
Jika dibandingkan dengan penelitian Belseran dkk. (2015) tentang pemanfaatan jahe untuk pertumbuhan ikan nila pada pertumbuhannya menunjukkan adanya beda nyata dan penelitian Novriadi dkk. (2010) mengenai aplikasi ekstrak temulawak pada pakan terhadap pertumbuhan Lutjanus johni dan Lutjanus argentimaculatus pertambahan berat dan panjang ikan setiap minggu mengalami kenaikan yang signifikan.
Temulawak mengandung kurkumin yang dapat meningkatkan nafsu makan ikan, disamping itu juga terdapat adanya minyak atsiri (Sastroamidjojo, 2001). Kurkumin berfungsi untuk meningkatkan nafsu makan dan berperan meningkatkan kerja organ pencernaan, merangsang dinding empedu mengeluarkan cairan empedu dan merangsang keluarnya getah pankreas yang mengandung enzim amilase, lipase dan protease untuk meningkatkan pencernaan bahan pakan karbohidrat, lemak dan protein, sehingga daya tahan tubuh ikan meningkat dan ikan tidak stress (Dayanti dkk., 2013).
Kurkumin memiliki khasiat yang dapat mempengaruhi nafsu makan (Purwanti, 2008). Menurut Purwanti (2008) mekanisme kurkumin dapat meningkatkan nafsu makan adalah kurkumin dapat mempercepat proses pengosongan isi lambung sehingga nafsu makan akan meningkat, selain itu kurkumin akan menstimulasi proses pengeluaran empedu sehingga aktivitas saluran pencernaan akan meningkat. Kurkumin mempunyai peranan sebagai antibakteri dan dapat merangsang dinding kantung empedu, dimana cairan
commit to user
empedu tersebut dapat memperlancar metabolisme lemak. Cairan empedu adalah cairan garam yang berwarna kuning kehijauan yang mengandung kolesterol, fosfolifid, lesitin dan pigmen empedu. Kandungan garam yang terdapat di dalam empedu merupakan hasil dari pencampuran antara natrium dan kalium dengan asam-asam empedu. Garam tersebut akan bercampur dengan lemak di dalam usus halus membentuk micelles. Terbentuknya micelles akan dapat menurunkan permukaan lemak dan gerakan mencampur pada saluran pencernaan berangsur-angsur akan memecah globules lemak menjadi partikel yang halus sehingga lemak dapat dicerna dan akan berkurang (Darwis dkk., 1991).
Pertumbuhan ikan nila akan mengalami peningkatan apabila pakan yang dikonsumsi secara kuantitas (jumlah pakan yang dikonsumsi sesuai yang dibutuhkan ikan untuk pertumbuhan) dan kualitas (mengandung protein, karbohidrat, lemak yang optimal untuk pertumbuhan ikan) terpenuhi. Untuk penurunan rata-rata panjang dan rata-rata berat ikan, hal ini disebabkan karena ikan belum beradaptasi dengan baik dari pakan perlakuan yang diberikan. Adanya faktor lain seperti faktor lingkungan (suhu, DO, pH dan lain-lain), tingkat kelaparan dan lain-lain mampu mempengaruhi pertumbuhan ikan sehingga ikan yang seharusnya dapat tumbuh dengan baik apabila diberikan pakan yang sesuai dengan kebutuhan (jumlah protein tinggi) justru akan mengalami penurunan atau tetap (tidak tumbuh) dalam hal pertumbuhannya. Tidak semua makanan yang dimakan oleh ikan digunakan untuk pertumbuhan. Sebagian besar energi dari makanan digunakan untuk metabolisme basal (pemeliharaan), sisanya digunakan untuk aktifitas, pertumbuhan, dan reproduksi.