ISOLASI, IDENTIFIKASI DAN AKTIVITAS ANTIBAKTERI BAKTERI ENDOFIT DAUN PEGAGAN (Centella asiatica L.) TERHADAP
Escherichia coli
NASKAH PUBLIKASI SKRIPSI
ADITYAWARMAN I1011141061
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN
UNIVERSITAS TANJUNGPURA PONTIANAK
ISOLASI, IDENTIFIKASI DAN AKTIVITAS ANTIBAKTERI BAKTERI ENDOFIT DAUN PEGAGAN (Centella asiatica L.) TERHADAP
Escherichia coli
NASKAH PUBLIKASI SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Kedokteran (S. Ked) pada Prgram Studi Pendidikan Dokter Fakultas Kedokteran
Universitas Tanjungpura Pontianak
ADITYAWARMAN I1011141061
PROGRAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN
UNIVERSITAS TANJUNGPURA PONTIANAK
ISOLASI, IDENTIFIKASI DAN AKTIVITAS ANTIBAKTERI BAKTERI ENDOFIT DAUN PEGAGAN (Centella asiatica L.) TERHADAP
Escherichia coli
Adityawarman1; Mahyarudin2; Effiana3 Intisari
Latar Belakang: Di Indonesia diare masih merupakan masalah kesehatan masyarakat. Tanaman pegagan telah digunakan untuk pengobatan diare. Bakteri endofit adalah bakteri yang hidup di dalam jaringan tanaman inang. Beberapa jenis bakteri endofit mampu menghasilkan senyawa aktif yang bersifat antibiotik. Tujuan: penelitian ini bertujuan untuk mengetahui efek antibakteri dari bakteri endofit daun pegagan (C. asiatica L.) terhadap bakteri Escherichia coli. Metodologi: penelitian ini merupakan penelitian deskriptif-eksploratif. Isolasi bakteri endofit dari daun pegagan (C.asiatica L.) menggunakan metode tanam langsung, potensi antibakteri diuji dengan metode difusi cakram. Identifikasi bakteri endofit dilakukan dengan pengamatan morfologi koloni, morfologi sel dan uji biokimia. Hasil: sebanyak 4 dari 42 isolat memiliki potensi sebagai antibakteri terhadap pertumbuhan bakteri Escherichia coli. Isolat 16 memiliki kemampuan tertinggi yaitu dengan zona hambat 6,5 mm. isolat 16 memiliki kemiripan dangan genus Pseudomonas. Kesimpulan: Sebanyak 4 isolat bakteri endofit yang mempunyai potensi antibakteri terhadap Escherichia coli
Kata Kunci: Centella asiatica L.,Bakteri endofit, Escherichia coli, zona hambat. 1) Program Studi Pendidikan Dokter, Fakultas Kedokteran, Universitas
Tanjungpura, Potianak, Kalimantan Barat.
2) Departemen Mikrobiologi, Fakultas kedokteran Universitas Tanjungpura, Pontianak, Kalimantan Barat.
3) Departemen Imunologi, Fakultas kedokteran Universitas Tanjungpura, Pontianak, Kalimantan Barat.
ISOLATION, IDENTIFICATION AND ANTIBACTERIA ACTIVITY OF ENDOPHYTE BACTERIA FROM CENTELLA LEAF (Centella asiatica L.)
AGAINTS Escherichia coli Adityawarman1; Mahyarudin2; Effiana3
Abstrack
Background: Diarrhea in indonesia has become one of main health social problem. Centella has been used for the treatment of diarrhea. Endophytic bacteria are bacteria that live in the tissues of host plants. Several types of endophytic bacteria are known to produce active compounds that are antibiotics. Objective: This research aims to determine the antibacterial effects of endophyte bacteria from centella leaf (C. asiatica L.) against Escherichia coli. Method: This research was a descriptive-explorative research. Isolation of endophyte bacteria from centella leaf (C.asiatica L.) was done by direct cropping method, a potency of antibacterial tested by disc diffusion method. Identification of endophytic bacteria was done by observation of colony morphology, cell morphology and biochemical test. Results : a total of 4 isolates from 42 isolates had antibacterial activity againts E.coli. the isolate 16 had highest antibacterial activity againts E. Coli with 6.5 mm inhibition zone, isolates 16 had similarities with the genus Pseudomonas. Conclusion: 4 isolates of endophytic bacteria have antibacterial potency againts E. coli
Keywords: Centella asiatica L., Endophyte bacteria, Escherichia coli, inhibition zone.
1) Medical School, Faculty of Medicine, Tanjungpura University, Pontianak West Kalimantan.
2) Department of Microbiology, Faculty of Medicine, Tanjungpura University, Pontianak West Kalimantan.
3) Department of Immunology, Faculty of Medicine, Tanjungpura University, Pontianak West Kalimantan.
Pendahuluan
Diare adalah buang air besar dengan feses yang berbentuk cair atau setengah cair, kandungan air pada feses lebih banyak dari biasanya yaitu lebih dari 200 gram atau 200 ml/24jam.1 Di Indonesia diare masih merupakan masalah kesehatan masyarakat. Menurut data dari Kemenkes RI pada tahun 2015 telah terjadi kejadian luar biasa (KLB) di 11 provinsi dengan kasus sebanyak 1.213 penderita dengan angka kematian diare sebanyak 2,47%.2 Provinsi Kalimantan Barat khususnya kota Pontianak pada tahun 2015, dilaporkan bahwa angka kejadian diare sebanyak 13.532 kasus dan masih termasuk 10 besar penyakit yang dilayani oleh puskesmas.3 Diare dapat disebabkan oleh bakteri, virus, parasit dan lain-lain. Di negara berkembang, prevalensi diare akut akibat bakteri dan parasit lebih tinggi dibandingkan akibat virus.4 Satu satu penyebab diare adalah Escherichia coli.1
Escherichia coli merupakan bakteri normal yang ada di usus. Bakteri ini merupakan bakteri gram negatif yang berbentuk batang. Escherichia coli termasuk famili Enterobacteriaceae yang memiliki karakteristik tumbuh secara anaerob maupun fakultatif anaerob.5 Diare akut yang terjadi, umumnya karena tidak cukupnya ketersediaan air bersih dan higiene yang buruk.6 Pengobatan untuk diare akut adalah dengan rehidrasi cairan, diet, obat diare dan antibiotik.7 Antibiotik merupakan obat yang paling banyak digunakan pada infeksi yang disebabkan oleh bakteri. Intensitas penggunaan antibiotik yang relatif tinggi menimbulkan berbagai permasalahan dan merupakan ancaman global bagi kesehatan terutama resistensi bakteri terhadap antibiotik.8 Untuk mengatasi infeksi mikroorganisme yang telah resisten terhadap antibiotik dapat menggunakan tanaman obat sebagai pengobatan alternatif.9 Satu diantara tanaman obat tradisional yang memiliki efek pengobatan yaitu tanaman pegagan.
Tanaman pegagan merupakan tanaman liar yang banyak tumbuh di perkebunan, ladang, tepi jalan, pematangan sawah ataupun di ladang.10
Tanaman pegagan telah dilaporkan digunakan untuk pengobatan ulkus lambung, asma, epilepsi, hepatitis, sifilis dan diare.11
Tanaman herbal ini sering digunakan oleh masyarakat baik dalam bentuk segar, kering maupun dalam bentuk ramuan (jamu). Tanaman ini mengandung berbagai bahan aktif seperti triterpenoid, saponin dan kandungan kimia dari pegagan terbagi menjadi beberapa golongan, yaitu asam amino, flavonoid, terpenoid dan minyak atsiri.12 Flavonoid yang terkandung pada tanaman pegagan memiliki bioaktivitas sebagai antikanker, antivirus, antiperadangan dan antialergi.13 Fungsi lain dari pegagan antara lain sebagai obat penenang, obat penghilang sakit, antidepressive dan antimikroba.14 Hasil penelitian telah melaporkan bahwa ekstrak metanol dari tanaman pegagan memiliki aktivitas antibakteri terhadap bakteri Staphylococcus aureus, Shigella boydii, Pseudomonas aeruginosa dan Escherichia coli.15 Pada tanaman terdapat mikroorganisme yang dapat memproduksi metabolit sekunder dengan kemampuan sebagai antibakteri yang disebut bakteri endofit.16
Bakteri endofit adalah bakteri yang hidup di dalam jaringan tanaman inang tanpa menyebabkan gejala-gejala penyakit.17 Bakteri endofit hidup di dalam jaringan vaskular tumbuhan tanpa menyebabkan efek negatif. Hubungan simbiosis mutualisme antara bakteri dan tumbuhan memungkinkan bakteri menghasilkan senyawa bioaktif yang sama seperti terkandung di dalam tumbuhan inangnya.18 Mikroorganisme endofit dapat ditemukan pada berbagai jaringan diantaranya biji, ovula buah, batang, akar, umbi akar dan daun.19,20 Beberapa jenis bakteri endofit diketahui mampu menghasilkan senyawa aktif yang bersifat antibiotik.21
Beberapa bakteri endofit mampu menghasilkan produk potensial yaitu
Streptomyces griseus dari tanaman Kandelia candel menghasilkan asam p-aminoacetophenonic sebagai antimikroba.22 Streptomyces NRRL 30562
munumbicin D (antimalaria).Serratia marcescens dari tanaman Rhyncholacis penicillata menghasilkan oocydin A sebagai antifungal.23 Bakteri Endofit yang diisolasi dari suatu tanaman dapat menghasilkan metabolit sekunder yang sama dengan tanaman aslinya.24 Keuntungan lain yang diperoleh dari pengembangan bakteri endofit adalah dapat menjaga kelestarian tanaman obat, terutama jenis tanaman obat yang langka agar tidak digunakan secara terus menerus sehingga tidak menurunkan jumlah populasi.25
Penelitian mengenai isolasi, identifikasi dan aktivitas bakteri endofit dari daun pegagan terhadap bakteri E. coli hingga saat ini belum pernah dilakukan. Berdasarkan latar belakang tersebut, maka peneliti bertujuan untuk melakukan penelitian mengenai isolasi, identifikasi dan aktivitas bakteri endofit dari daun pegagan (C. asiatica L.) terhadap E. Coli. Penelitian ini bertujuan untuk mengetahui efek antibakteri bakteri endofit dari daun pegagan (C. asiatica L.) terhadap bakteri E. coli.
METODE
ALAT PENELITIAN
Alat yang digunakan dalam penelitian ini adalah cawan petri, tabung reaksi, rak tabung reaksi, batang pengaduk pipet volume, mikropipet, plastik wrapping, erlenmeyer, penangas, ose, bunsen, vortex mixer, gelas objek, penjepit gelas objek, preparat, spidol, jangka sorong, pinset, korek api, Laminar Air Flow Cabinet, autoklaf, inkubator, neraca analitik, mikroskop cahaya, gelas beaker, lemari pendingin, gelas ukur, gunting bedah steril, pipet tetes dan hotplate.
BAHAN PENELITIAN
Bahan-bahan yang digunakan dalam penelitian ini adalah daun pegagan (Centela asiatica L.), biakan murni bakteri Escherichia coli, kantong plastik, kertas cakram, kertas timbang, plastik wrapping, tube mikropipet, spiritus, handscoon, Media Nutrient Agar, Media Nutrient Broth, Media
Mueller Hinton Agar, aquades steril, alkohol 70%, larutan standar Mc Farland, minyak emersi, kristal violet, alkohol 96%, safranin, nistatin 30%, siprofloksasin, larutan NaOCL 1%, reagen tetrametil paraphenildiamin, media MIO (Motility Indole Ornitin), media SIM (sulfida indol motility), H2O2 30%, media glukosa, media sukrosa, media laktosa, media maltosa, media sorbitol, media manitol, media inositol, media urea, media O-F 0,5-1% karbohidrat, media Simmons Citrat Agar, media TSIA, NaCL steril larutan H2SO4 1% dan larutan (BaCl2.2H2O) 1,175%.
PENGAMBILAN DAUN PEGAGAN
Sampel daun yang sehat diperoleh di jalan Khatulistiwa Kecamatan Pontianak timur Kota Pontianak. Sampel yang terkumpul dibawa ke Laboratorium Mikroskopik di Fakultas Kedokteran Universitas Tanjungpura kota pontianak
DETERMINASI DAUN PEGAGAN
Determinasi tanaman pegagan dilakukan di Laboratorium Biologi fakultas Matematika dan Ilmu Pengetahuan Alam (MIPA) Universitas Tanjungpura kota Pontianak provinsi Kalimantan Barat.
STERILISASI PERMUKAAN DAUN
Daun pegagan dicuci menggunakan air, kemudian permukaan daun disterilisasi secara bertahap dengan cara merendam di alkohol 70% selama 1 menit, kemudian direndam di dalam larutan 1% sodium hypochlorite (NaOCl) selama 5 menit, diikuti dengan merendam di alkohol 70 % selama 1 menit. Pada tahap akhir sterilisasi daun, sampel dibilas 3 kali dengan aquades steril.68
KONFIRMASI KEBERHASILAN STERILISASI DAUN
Aquades steril pada bilasan terakhir diambil sebanyak 100µL dan diisolasikan pada media NA dengan dengan menggunakan metode cawan sebar. Jika ditemukan pertumbuhan bakteri pada media, maka bakteri hasil isolasi bukanlah bakteri endofit. Sedangkan pada media NA yang tidak ditumbuhi bakteri, maka bakteri yang tumbuh hasil isolasi awal tersebut adalah bakteri endofit.69
ISOLASI, PEMURNIAN DAN SUBKULTUR BAKTERI ENDOFIT
Daun yang telah disterilisasi kemudian dikeringkan di atas kertas saring steril. Daun dipotong dengan menggunakan pisau bedah steril di dalam Laminar Air Flow Cabinet (LAFC) dan daun dipotong-potong menjadi beberapa bagian dengan menggunakan prosedur aseptik. Bagian dari daun tersebut diinokulasikan pada media nutrien agar (NA) kemudian ditambahkan dengan agen antijamur yaitu nistatin pada konsentrasi 30 ug/mL. Setiap cawan petri berisi tiga atau empat potongan daun. Cawan petri yang berisi sampel daun disegel menggunakan pita paraffin dan diinkubasi pada 37°C selama 24-48 jam.
Bakteri yang tumbuh pada media NA setelah 24-48 jam disubkultur pada media agar nutrien dengan metode cawan gores (streak plate method). Semua isolat bakteri endofit yang tumbuh dilakukan pemurnian dan peremajaan isolat berdasarkan morfologi koloni.70 Setiap isolat bakteri endofit dibuat dua pada media agar miring, masing-masing dipergunakan sebagai working culture dan stock culture.
PEREMAJAAN DAN KONFIRMASI BAKTERI UJI ESCHERICHIA COLI Satu koloni bakteri E. Coli diinokulasikan pada media NA dengan metode cawan gores (streak plate method), setelah itu diinkubasi dalam
inkubator pada suhu 37oC selama 24 jam. Peremajaan ini dilakukan karena dalam pengujian aktivitas antibakteri diperlukan koloni bakteri segar yang berusia 24 jam.71
PEMBUATAN LARUTAN MC FARLAND
Pembuatan larutan Mc Farland dilakukan dengan cara mencampurkan 0,05 ml barium klorida 1,175% (BaCl2.2H2O) dan 9,95 ml asam sulfat 1% (H2SO4).72
PEMBUATAN SUSPENSI BAKTERI UJI
Pembuatan suspensi bakteri dilakukan secara aseptis dengan cara koloni bakteri uji pada media peremajaan yang berumur 24 jam diambil dengan menggunakan jarum ose dan disuspensikan ke dalam tabung berisi 5 mL larutan NaCl steril 0,9%. Kekeruhan yang diperoleh kemudian disetarakan dengan standar Mc farland 0,5% yaitu setara dengan jumlah pertumbuhan 1,5x108 CFU/mL.73
KONTROL POSITIF DAN NEGATIF
Kontrol positif yang digunakan dalam penelitian ini adalah siprofloksasin. Kontrol negatif yang digunakan dalam penelitian ini adalah aquades
UJI SENSITIVITAS ANTIBIOTIK
Suspensi bakteri uji diambil 200 µL dan diratakan pada permukaan media Mueller Hinton Agar (MHA). Permukaan media diberi kertas cakram 4 buah dan kertas cakram tersebut ditetesi suspesi isolat bakteri endofit kemudian diinkubasi dalam inkubator dengan suhu 37°C selama 24 jam. Zona bening pada daerah sekitar antibiotik menunjukkan adanya sensitivitas terhadap bakteri uji.74 zona hambat antibiotik dijabarkan pada tabel 1
Tabel 1 Zona Hambat Antibiotik.75
Jenis Antibiotik
Konsentrasi Cakram Antibiotik
Konsentrasi Zona Hambat Sensitif Intermediet Resisten
Siprofloksasin 5 µ𝑔
𝑚𝑙 ≥21 16-20 ≤15
PRODUKSI METABOLIT ANTIBAKTERI DARI BAKTERI ENDOFIT
Produksi metabolit antibakteri dilakukan dengan metode isolat bakteri endofit yang tumbuh pada medium NA diinokulasikan pada media NB yang bertujuan untuk memproduksi metabolit antibakteri dari bakteri endofit. Isolat bakteri endofit diambil menggunakan jarum ose dan diinokulasikan kedalam tabung tabung reaksi 10 mL yang berisi media cair NB. Tabung reaksi kemudian diinkubasi pada suhu 37oC selama 2-3 hari dalam kondisi stasioner kemudian homogenisasi menggunakan vortex. Kemudian isolat diuji dengan metode difusi cakram untuk uji terhadap bakteri patogen.76
SKRINING BAKTERI ENDOFIT YANG BERPOTENSI SEBAGAI ANTIBAKTERI TERHADAP ESCHERICHIA COLI
Biakan murni bakteri endofit yang diperoleh diuji potensi antibakterinya terhadap E. coli dengan metode Paper Disc Agar Diffusion Technique. Suspensi bakteri uji yang telah diukur kepadatannya kemudian disebar di permukaan media MHA dengan metode swab. Sebanyak 20 µL suspensi bakteri endofit hasil homogenisasi diserapkan pada cakram steril berdiamter 6 mm. Kemudian dilakukan inkubasi selama 24 jam pada suhu 37oC dan diamati ada atau tidaknya zona bening yang terbentuk.77 Cara peletakan kertas cakram pada media uji dapat dilihat pada gambar 1 dan Respon hambatan bakteri dilihat pada Tabel 2
Gambar 1 Skema Peletakan kertas cakram pada media uji.78
Tabel 2 Klasifikasi Respon Hambatan Pertumbuhan Bakteri.79 Diameter Zona Hambat (mm) Interpretasi
0 Tidak memiliki efek antibakteri
1,4 – 6,2 Lemah
6,3 – 10,3 Sedang
10,4 – 26,8 Kuat
>26,8 Sangat kuat
PENGUKURAN ZONA HAMBAT
. Zona hambat yang terbentuk di sekitar cakram kertas saring diukur menggunakan jangka sorong.80 Pengukuran zona hambat dapat dilihat pada gambar 2
Gambar 2 Pengukuran diameter zona hambat. 1 3 4 2 DV DH Keterangan A : Kertas cakram B : Cawan petri DC 2cm B 3cm A
Keterangan :
: Zona hambat DV : Diameter vertikal DH : Diameter horisontal DC : Diameter cakram
Diameter zona hambat diukur dengan rumus: (DV ̶ DC) + (DH ̶ DC)
IDENTIFIKASI BAKTERI ENDOFIT
Bakteri murni yang memiliki efek aktivitas antibakteri tertinggi kemudian dikarakterisasi dan diidentifikasi yang dilakukan secara biokimia dengan mengacu pada Bergey’s Manual of Determinative Bacteriology. karakterisasi yang dilakukan meliputi pengamatan morfologi koloni, morfologi sel dan biokimia bakteri
Hasil
Determinasi Tumbuhan
Hasil Determinasi tumbuhan Pegagan dilakukan di Laboratorium Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Tanjungpura Kota Pontianak. Hasil determinasi menunjukkan bahwa tumbuhan yang digunakan adalah tumbuhan dari famili Apiaceae dengan nama spesies Centella asiatica L. genus Centella.
STERILISASI PERMUKAAN DAUN PEGAGAN
Hasil sterilisasi permukaan daun pegagan yaitu terdapat adanya pertumbuhan bakteri di sekitar daun pada petri yang berisi daun dan tidak adanya pertumbuhan bakteri pada cawan petri konfirmasi keberhasilan sterilisasi daun.
ISOLASI BAKTERI ENDOFIT DARI DAUN PEGAGAN
Telah diperoleh hasil pemurnian isolat bakteri endofit daun pegagan yang berjumlah 42 isolat murni. Hasil isolasi dilihat pada tabel 3
Tabel 3 Hasil Isolasi Bakteri Endofit Daun Pegagan
No Nama Morfologi Koloni
Bentuk Permukaan Tepi Warna
1 Isolat 1 Bulat Cembung Utuh Kekuningan
2 Isolat 2 Iregular Datar Bergerigi Putih
3 Isolat 3 Iregular Cembung Bergelombang Putih
4 Isolat 4 Iregular Datar Bergerigi Putih
5 Isolat 5 Iregular Datar Bergelombang Kuning
6 Isolat 6 Iregular Cembung Bergerigi Putih
7 Isolat 7 Iregular Cembung Begerigi Kuning
8 Isolat 8 Iregular Datar Bergelombang Putih
9 Isolat 9 Iregular Datar Bergelombang Putih Kekuningan 10 Isolat 10 Iregular Cembung Berserabut Putih Kekuningan
11 Isolat 11 Bulat Cembung Utuh Putih
12 Isolat 12 Iregular Datar Bergerigi Putih Kekuningan
13 Isolat 13 Bulat Cembung Utuh Putih
14 Isolat 14 Iregular Datar Utuh Kuning
15 Isolat 15 Iregular Cembung Bergerigi Putih
16 Isolat 16 Iregular Datar Bergerigi Putih Kekuningan
17 Isolat 17 Iregular Datar Bergelombang Putih
18 Isolat 18 Iregular Datar Berserabut Putih
19 Isolat 19 Iregular Cembung Bergelombang Kuning
20 Isolat 20 Iregular Datar Bergelombang Putih Kekuningan 21 Isolat 21 Iregular Cambung Bergelombang Putih Kekuningan
22 Isolat 22 Iregular Cembung Bergerigi Putih
23 Isolat 23 Bulat Cembung Utuh Putih
24 Isolat 24 Iregular Cembung Penuh Putih Kekuningan
25 Isolat 25 Iregular Datar Bergelombang Putih Kekuningan 26 Isolat 26 Iregular Datar Bergerigi Putih Kekuningan
28 Isolat 28 Bulat Cembung Utuh Kuning
29 Isolat 29 Iregular Cembung Bergerigi Putih
30 Isolat 30 Iregular Cembung Utuh Bening
31 Isolat 31 Iregular Datar Bergerigi Putih
32 Isolat 32 Iregular Datar Bergelombang Kuning
33 Isolat 33 Titik Cembung Penuh Putih
34 Isolat 34 Bulat Cembung Bergelombang Kuning
35 Isolat 35 Iregular Datar Bergelombang Putih Kekuningan
36 Isolat 36 Iregular Datar Bergelombang Kekuningan
37 Isolat 37 Bulat Datar Utuh Putih
38 Isolat 38 Iregular Datar Bergelombang Putih Kekuningan 39 Isolat 39 Iregular Cembung Bergerigi Putih Kekuningan
40 Isolat 40 Bulat Cembung Utuh Putih
41 Isolat 41 Iregular Cembung Bergelombang Putih
42 Isolat 42 Iregular Cembung Bergelombang Kuning
HASIL KONFIRMASI BAKTERI UJI
Hasil konfirmasi bakteri uji pada media NA menunjukkan koloni berwarna putih kekuningan, sirkular dan tepian utuh. Hasil konfirmasi bakteri uji dilanjutkan dengan metode pewarnaan gram. bakteri tesebut merupakan gram negatif, berwarna merah dan berbentuk batang. Pada media EMBA (Eosin Methylene Blue Agar) didapatkan pertumbuhan koloni berbentuk bulat dan berwarna hijau metalik. Hasil konfirmasi bakteri uji dilihat pada gambar 2
Gambar 2 (A) media NA (B) Pewarnaan Gram(C) media EMBA
HASIL UJI AKTIVITAS BAKTERI ENDOFIT
. Hasil pengujian aktivitas bakteri endofit daun pegagan terhadap E. coli didapatkan sebanyak 4 isolat bakteri endofit dari 42 isolat memiliki aktivitas terhadap E. coli. Aktivitas isolat bakteri endofit berkisar antara 2 mm – 6,5 mm (aktivitas lemah-sedang) sedangkan kontrol positif sensitif terhadap bakteri E. coli. Hasil dari pengukuran diameter zona hambat aktivitas bakteri endofit terhadap bakteri E. coli ditunjukkan pada tabel 4 dan gambar 3
Tabel 4 Aktivitas Isolat Bakteri Endofit Terhadap Escherichia coli
Gambar 3 a) Isolat 16 b) Isolat 36. c) Isolat 26. d) Isolat 30. No Isolat Zona hambat (dalam mm) Keterangan
1 16 6,5 sedang 2 36 4,5 lemah 3 26 2 lemah 4 30 2 lemah A B
C
DHASIL IDENTIFIKASI ISOLAT BAKTERI ENDOFIT
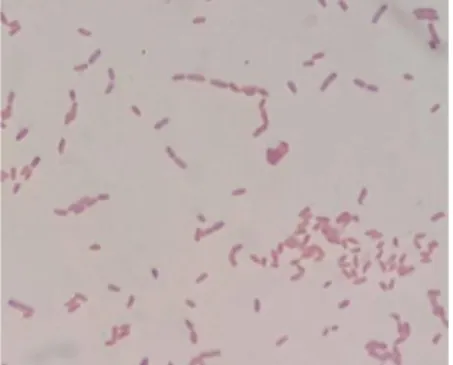
Isolat bakteri endofit yang memiliki zona hambat terbesar yaitu isolat nomor 16. Isolat bakteri endofit paling potensial yang berhasil di isolasi dari daun pegagan memiliki karakter morfologi sel berbentuk bulat dan termasuk kedalam golongan bakteri gram negatif. Hasil pewarnaan gram isolat 16 dilihat pada gambar 4
Gambar 4 Pewarnaan Gram Bakteri Endofit Isolat 16
Uji biokimia bakteri endofit dilakukan di ULK (Unit Laboratorium Kesehatan) Dinas Kesehatan Provinsi. Hasil uji biokimia isolat bakteri endofit yang memiliki kemampuan menghambat pertumbuhan E. coli yang paling potensial menunjukkan bahwa isolat bakteri endofit nomor 16 merupakan bakteri fakultatif anaerob, bakteri tidak motil, fermentasi karbohidrat negatif, indol negatif, H2S negatif, urease negatif, simon sitrat negatif, katalase positif dan fermentatif glukosa OF
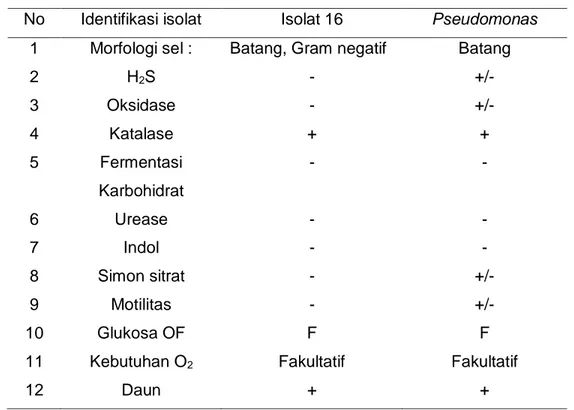
Hasil identifikasi isolat bakteri endofit mengacu pada Bergey’s Manual of Determinative Bacteriology. Bakteri endofit memiliki kemiripan karakterisitik morfologi sel dan biokimia yang sama dengan genus Pseudomonas. Hasil identifikasi dilihat pada tabel 5
Tabel 5 Hasil identifikasi isolat 16 dengan genus Pseudomonas No Identifikasi isolat Isolat 16 Pseudomonas
1 Morfologi sel : Batang, Gram negatif Batang
2 H2S - +/- 3 Oksidase - +/- 4 Katalase + + 5 Fermentasi Karbohidrat - - 6 Urease - - 7 Indol - - 8 Simon sitrat - +/- 9 Motilitas - +/- 10 Glukosa OF F F
11 Kebutuhan O2 Fakultatif Fakultatif
12 Daun + +
Pembahasan
Bakteri endofit adalah bakteri yang hidup dalam jaringan tanaman yang dapat diisolasi melalui sterilisasi permukaan jaringan.81 Jumlah bakteri endofit di dalam tanaman tidak dapat ditentukan secara pasti, namun bakteri ini dapat dideteksi dengan mengisolasi pada media agar.82 Penggunaan media NA lebih cocok untuk isolasi bakteri endofit dan ditambahkan nistatin sebagai antifungi.83,84 Bakteri endofit yang tumbuh pada media NA yang secara makroskopis berbeda dianggap merupakan isolat yang berbeda, namun jika koloni bakteri endofit yang tumbuh di media pertumbuhan yang secara makroskopis sama dianggap isolat yang sama. Bakteri endofit yang berbeda kemudian dilakukan pemurnian. Tujuan pemurnian isolat bakteri endofit adalah untuk memisahkan hasil inokulasi yang terdiri dari banyak koloni yang berlainan jenis sehingga didapatkan koloni murni pada setiap cawan petri.52 Dari hasil setiap bakteri yang dimurnikan didapatkan 42 isolat
bakteri endofit. Penelitian sebelumnya yang dilakukan oleh Sari didapatkan 3 isolat aktinomiset endofit dari daun pegagan sebagai antihipertensi.85
Sebanyak 4 dari 42 isolat Isolat bakteri endofit memberikan efek zona hambat/bening terhadap bakteri Escherichia coli. Berdasarkan tabel 4.2 terdapat 4 isolat akitf yang mampu menghambat pertumbuhan bakteri uji. Masing masing isolat memiliki zona hambat, isolat 16 memiliki zona hambat sebesar 6,5 mm, isolat 36 memiliki zona hambat sebsear 4,5 mm, isolat 26 dan 30 memeiliki zona hambat sebesar 2 mm. hal ini menunjukkan bahwa bakteri endofit dari daun pegagan mampu menghasilkan metabolit sekunder sebagai antibakteri dikarenakan bakteri endofit tersebut memiliki metabolit sekunder yang sama dengan tanaman inangnya.86 Terdapat 38 isolat yang tidak menghasilkan zona hambat pada isolat bakteri endofit nomor 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 17, 18, 20, 21, 22, 23, 24, 25, 27, 28, 29, 31, 32, 33, 34, 35, 37, 38, 39, 40, 41 dan 42. Sedangkan kontrol positif pada penelitian memiliki zona hambat sebesar 39 mm. Faktor yang mempengaruhi ukuran daerah penghambatan yaitu tingkat sensitifitas dari organisme uji, medium kultur dan kondisi inkubasi.51 Terbentuknya zona hambat juga dipengaruhi oleh faktor lingkungan dan bakteri uji yang berlebihan.87 Semakin tinggi konsentrasi antibakteri yang dihasilkan maka semakin tinggi pula daya hambatnya yang ditunjukkan oleh kecilnya pertumbuhan koloni bakteri patogen.88
Setiap tanaman dapat mengandung beberapa bakteri endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang di duga sebagai akibat koevolusi atau transfer genetik dari tanaman inangnya kedalam bakteri endofit.89
Identifikasi bakteri endofit dilakukan berdasarkan hasil morfologi koloni dan morfologi sel serta aktivitas biokimia. Identifikasi mengacu pada pada Bergey’s Manual of Determinative Bacteriology. Berdasarkan buku Bergey’s Manual Of Determinative Bacteriology bakteri yang memiliki potensi sebagai antibakteri tersebut merupakan bakteri genus Pseudomonas dikarenakan memiliki karakterisitik morfologi sel dan morfologi sel yang sama serta aktivitas biokimia yang sama. Pseudomonas dapat ditemukan di tanah, air, tumbuh tumbuhan dan manusia. Dari beberapa penelitian ditemukan adanya bakteri endofit Pseudomnas sp endofit dari tanaman yang memiliki efek baik yaitu senyawa metabolit Pseudomonas sp endofit dari jagung mampu menghambat Fusarium sp.90 kemudian 2 isolat bakteri endofit dari tanaman dahlia yaitu Pseudomonas stutzeri LBKURCC44 dan Pseudomonas cepacia LBKURCC47 yang menunjukkan aktivitas antibakteri terhadap Escherichia coli dan Staphylococcus aureus.91 Hasil Uji fitokimia yang telah dilakukan oleh Halim, menunjukan bahwa Pseudomonas sp. positif mengandung saponin dan terpenoid.92 Saponin merupakan senyawa glikosilat yang terdapat dalam sel tanaman sebagai prekursor tidak aktif tetapi siap diubah menjadi senyawa bioaktif antibiotik oleh enzim apabila diserang oleh patogen.93 Mekanisme terpenoid sebagai antibakteri adalah bereaksi dengan porin (protein transmembran) pada membran luar dinding sel bakteri, membentuk ikatan polimer yang kuat sehingga mengakibatkan rusaknya porin.94
Kesimpulan
Berdasarkan hasil dan pembahasan dari penelitian yang telah dilakukan, dapat disimpulkan bahwa :Hasil identifikasi menunjukan bahwa isolat 16 memiliki kemiripan dengan genus Pseudomonas dan Isolat 16 memiliki aktivitas zona hambat yang paling tinggi dengan membentuk zona hambat sebesar 6,5 mm serta Siprofloksasin yang digunakan sensitif terhadap bakteri Escherichia coli dengan membentuk zona hambat sebesar 39 mm
Saran
Berdasarkan penenlitian yang telah dilakukan maka peneliti memberikan beberapa saran yaitu Perlu dilakukan uji aktivitas antibakteri terhadap bakteri patogen penyebab diare lainnya seperti Vibrio cholerae dan uji kualitatif senyawa metabolit sekunder dari Pseudomonas sp endofit dari daun pegagan (Centella asiatica L.) dan isolasi senyawa metabolit sekunder dari Pseudomonas sp endofit dari daun pegagan (Centella asiatica L.) serta isolasi dan identifikasi molekular bakteri endofit dari daun pegagan (Centella asiatica L.)
Daftar Pustaka
1. Kasper DL, Hauser SL, Jameson JL, Fauci AS, Longo DL, Loscaizo J, et al. Harrison’s Internal Medicine. 19th Edition. USA. McGraw – Hill; 2015. 2. Kementrian Kesehatan Republik Indonesia (Kemenkes RI) Profil data
kesehatan Indonesia tahun 2015. Jakarta: Kementrian Kesehatan RI; 2016.
3. Profil Dinas Kesehatan Kota Pontianak. Kasus Diare, Seksi Pengendalian Penyakit, Dinas Kesehatan Kota Pontianak. Pontianak; 2015.
4. Farthing M, Lindberg G, Dite P, Khelif I, Lindo ES, Ramakrishna BS, et al. Acute diarrhea. World Gastroenterology Organisation Practice Guideline.2012[cited 2016 Des 23]. Available From : http://www.worldgastro enterology.org.
5. Brooks GF, Butel JS, Morse SA. Jawetz, Melnick & Adelberg's Medical Microbiology. 27th ed. USA: The McGraw-Hill; 2016.
6. Qadri F, Svennerholm AM, Faruque AS, Sack RB. Enterotoxigenic Escherichia coli in developing countries: epidemiology, microbiology, clinical features, treatment, and prevention. Clin Microbiol Rev. 2005;18:465-83.
7. Kitaoka M, Miyata ST, Unterweger D, Pukatzki S. Antibiotic resistance mechanisms of vibrio cholerae. J of Med Microbiol. 2011;60(4):297-407. 8. Permenkes RI. Pedoman Umum Penggunaan Antibiotik, Kementrian
Kesehatan RI. Jakarta; 2011.
9. Akbar M, Budiarti LY, Edyson. Perbandingan efektivitas antibakteri antara ekstrak metanol kulit batang kasturi dengan ampisilin terhadap Staphylococcus aureus in Vitro. Jurnal Berkala Kedokteran, 2016;12(1): 1-9.
10. Lusiana, Dhafir F, Masrianih. Pengaruh Pemberian Ekstrak Daun Pegagan (centella asiatica) terhadap Mortilitas Spermatozoa Mencit (Mus musculus) Galur Ddy. E-jipbiol, 2013;2:24-29.
11. Brinkhaus B, Lindner M, Schuppan D, Hahn EG. Chemical, pharmacological and clinical profile of the East Asian medical plant Centella asiatica. Phytomedicine. Erlangen-Nuremberg. 2000;7(5):427-488.
12. Dalimartha, S. Atlas Tumbuhan Obat Indonesia. Jilid 2. Jakarta: Trubus Agriwidya; 2008.(cited 2016 Des 23)Availablefrom; https://books.Google .co.id/books?id=vmrbQE4jfYcC&printsec=frontcove&hl=id&source=gbs_ ge _summary_r&cad=0#v=onepage&q&f=false.
13. Sundaryono, A. Penggunaan batang tanaman betadin ( Jatropha multifida L.) untuk meningkatkan jumlah Trombosit pada Mus Musculus. Artikel asli Media Medika Indoesiana. 2011;45(2):1-5.
14. Brinkhaus B, Lindner M, Schuppan D, Hahn EG. Chemical, pharmacological and clinical profile of the East Asian medical plant Centella asiatica. Phytomedicine. Erlangen-Nuremberg. 2000;7(5):427-488.
15. Panthi,MP, Chaudhary,RP Antibacterial activity of some selected folklore medicinal plants from West Nepal. Scientific world. 2006;4(4):16-21.
16. Pratiwi BE. Isolasi dan skrining fitokimia Bakteri Endofit dari daun Rambutan (Nephelium lappaceum L.) Yang Berpotensi Sebagai Antibakteri [skripsi]. Jakarta. UIN; 2015.
17. Bhore SJ, Sathisha G. Screening of endophytic colonizing bacteria for cytokinin-like compounds: crude cell-free broth of endophytic colonizing bacteria is unsuitable in cucumber cotyledon bioassay. World J. Agric. Sci. 2010;6(4):345-352.
18. Barbara JES, Christine JCB. 2006. What are Endophytes. In Microbial Root Endophytes (Eds: Thomas N. Sieber). Springer-Verlag, Berlin. 19. Altahi, AD. Plasmid profiles, antibiotic and heavy metal resistance
incidence of endhophytic bacteria isplaterd from grapevine ( Vitis vinivera L. ), African J. of Biotech. 2009;8(21):5873-5882.
20. Vega FE, Ripoll M, Posada F, Buyer JS. Endophytic bacteria in Coffea Arabica L. J. Basic. Microbiol, 2005;45:371-380.
21. Castillo U, et al. Kakadumycins, novel antibiotics from Streptomyces sp.NRRL 30566, an endophyte of Grevillea pteridifolia. FEMS Microbiology Letters. 2003;224:180-190.
22. Guan SH, Sattler I, Lin WH, Guo DA, Grabley S. p-Aminoacetophenonic acids produced by a mangroveendophyte: Streptomyces griseus subspecies. J Nat Prod. 2005;68:1198–200.
23. Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. Bacterial endophytes: recent developments and applications Mini Review. FEMS Microbiol Lett. 2008;(278):1–9.
24. Nursulistyarini F. Isolasi dan Identifikasi Bakteri Endofit Penghasil Antibakteri dari daun Tanaman Binahong (Anredera ccordifolia (Ten.) steenis) [Skripsi]. Yogyakarta: Universitas Negeri Sunan Kalijaga; 2014. 25. Besung, INK. Pegagan (Centella aisatica) sebagai alternative
Pencegahan Infeksi pada ternak. Buletin veteriner udayana. 2009;61-67:2.
26. Lulasto, Aprillia Karolin. Karakterisasi dan uji aktivitas antimikroba dari fungi endofit akar tanaman pegagan (Centella asiatica (L.) urban.) terhadap escherichia coli dan staphylococcus aureus. [Skripsi]. Surabaya : Widya Mandala Catholic University Surabaya; 2015.
27. Rachmawati, F, Nuria MC. Uji aktivitas antibakteri fraksi kloroform ekstrak etanol pegagan (Centella asiatica (L) Urb) serta identifikasi Senyawa aktifnya. e-Publikasi Ilmiah Fakultas Farmasi Unwahas Semarang. 2011; 7-13.
28. Yusran, ilyas A, Saleh, HA. Bioaktivitas ekstrak metanol daun pegagan (Centella Asiatica L.) terhadap pertumbuhan bakteri Mycobacterium tuberculosis. Al-Kimia. 2016;4(1): 1-8.
29. Roni, Muhammad Adil. Formulasi Minuman Herbal Instan Antioksidan dari Campuran Teh Hijau (Camellia Sinensis), Pegagan (Centella Asiatica), dan Daun Jeruk Purut (Citrus Hystrix). Bogor: Institut Pertanian Bogor; 2008.
30. ITIS Report Taxonomic Hierarchy Centella asiatica L. Urban. L. Urb, Taxonomic Serial,No:29612(internet). 2017 (Updated 2016 Des 6; Cited 2016Des6.Availablefrom:http://www.itis.govservlet/SingleRpt/SingleRpt?s earch_ topic=TSN&searchvalue= 29612
31. Aziz. Z.A, Davey MR, Power JB, Anthony P, Smith RM, Lowe KC et al.. Production of asiatikosida and madekasosida in Centella asitica in vitro and in vivo. Biologia Plantarum. 2007;51(1): 34-42.
32. Direktorat Obat Asli Indonesia, Serial data ilmiah terkini tumbuhan obat pegagan Centella asiatica (L.) Urban. Badan Pengawas Obat dan Makanan. 2010: 23.
33. Seevaratnam V, Banumathi P, Premalatha MR, Sundaram SP, Arumugam, T et al. Functional properties of Centella asiatica (L.): A review. Int J Pharm Pharm Sci. 2012;4(5): 8-14.
34. Singh S, Gautam A, Sharma A, Batra A. Centella asiatica (L.): a plant with immense medicinal potential but threatened. Intl J of Pharma Sci Rev and Res. 2010;4(2):1-9.
35. Rohyani IS, Aryanti E, Suripto. Kandungan fitokimia beberapa jenis tumbuhan lokal yang sering dimanfaatkan sebagai bahan baku obat di Pulau Lombok. Pros Sem Nas Masy Biodiv Indon. 2015;1(2):388-391. 36. Juliantina F, Citra DA, Nirwani B, Nurmasitoh T, Bowo ET. Manfaat sirih
(Piper crocatum) sebagai agen antibakterial terhadap Gram positif dan Gram negatif. JKKI. 2009;1(1):5.
37. Chusnie TPT, Lamb AJ. Review Antimicrobial activity of Flavonoids, Int J of Antimicrob Agents. 2005;26(1):343-56.
38. Kurniawan B; Aryana WF. Binahong (cassia alata l) as inhibitor of Escherichia coli growth. J Majority. 2015;4(4):100-4.
39. Bangham AD, Horne RW. Action of Saponins on Biological Cell Membrane. Nature. 2006;196:952-3.
40. Darsana IGO, Besung INK, Mahatmi H. Potensi Daun Binahong (Anredera Cordifolia (Tenore) Steenis) dalam Menghambat Pertumbuhan Bakteri Escherichia coli secara In Vitro. Indonesia Medicus Veterinus. 2012;1(3):337-351.
41. Poeloengan M, Praptiwi. Uji Aktivitas Antibakteri Ekstrak Kulit Buah Manggis (Garcinia mangostana L.). Media Litbang Kesehatan. 2010;20(2): 65-69.
42. Handini, Zhenita Vinda Tri, and Abdjad Asih Nawangsih. "Keefektifan bakteri endofit dan bakteri perakaran pemacu pertumbuhan tanaman dalam menekan penyakit layu bakteri pada Tomat. Jurnal Fitopatologi Indonesia. 2014;10(2): 61-67.
43. Budiman A. Isolasi dan penapisan isolat-isolat bakteri endofit sebagai penghasil senyawa antibakteri asal tanaman sambiloto (Andrographis paniculata Ness.) [skripsi]. Bogor: Universitas Pakuan; 2009.
44. Desriani, Bintang M, Akhmad R, Puspita L, Safira UM. Isolasi dan Karakterisasi Bakteri Endofit dari Tanaman Binahong dan Katepeng China. Jurnal Kesehatan Andalas. 2014; 3(2):89-93.
45. Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G. Rang & Dale's Pharmacology: With Student Consult Online Access. 8th edition. USA: Elsevier Health Sciences; 2015.
46. Katzung BG, Masters SB, Trevor AJ. Basic & Clinical Pharmacology. 13th edition. USA: The McGraw-Hill Companies Inc; 2014.
47. Adriani. Aktivitas Antibakterial fungi endofit Caulerpa racemosa terhadap bakteri Escherichia coli dan Staphylococcus aureus. Prosiding Seminar Biologi; 29 januari 2015; Makasar. UIN: 2015.
48. Firmansyah R. Potensi endofit dan filopenia asal daun Mucuna pruriens Linn. dalam memacu pertumbuhan Tanaman dan menekan penyakit bercak daun Cercospora sp. pada tanaman Kacang tanah (Arachis hypogaea L Mer).[Skripsi] Bandung: Fakultas Pertanian, Universitas Padjajaran; 2012.
49. Leonita S. Isolation and Identification of Endophytic Bacteria from Ficus variegata Blume as Antibacterial Compounds Producer. Current Biochemistry. 2016; 2(3): 116-128.
50. Indarti S. Biopeptisida Berbahan Aktif Mikroba Kitinolitik untuk Pengendalian Nematoda Parasit (Pratylenchus coffeae) pada Tanaman Kopi. Sirinov. 2008; 1(3):117-122.
51. Prescott LM, Harley JP. Laboratory Exercises In Microbiology. McGraw-Hill Science 2002.
52. Pelczar, Michael J, Chan ECS. Dasar-dasar Mikrobiologi jilid I. Jakarta: UI Press; 2008. .
53. Hadioetomo RS. Mikrobiologi dasar dalam praktek teknik dan prosedur dasar laboratorium. Jakarta: PT Gramedia Pustaka. 1993.
54. Deasywaty. Aktivitas antimikroba dan identifikasi komponen aktif rimpang temulawak (Curcuma xanthorrhiza Roxb.) [Tesis]. Depok: Program Pascasarjana Studi Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Indonesia; 2011.
55. Songer JG, Post KW. Veterinary Microbiology: Bacterial and fungal agents of animal disease. Elsevier Saunders: Missouri; 2005.
56. Tortora G, Funke BR, Case CL. Introduction to Microbiology. 2007.
57. Manning, Shannon D, Hilary B. Escherichia coli infections. New York: Infobase Publishing; 2010.
58. Parija, SC. Textbook of microbiology& immunology. India: Elsevier; 2009. 59. Dubreuil, J.D . Escherichia coli STb enterotoxin. Microbiology. 1997:
143;1783–1795.
60. Donnenberg MS, Whittam TS. Pathogenesis and evolution of virulence in enteropathogenic and enterohemorrhagic Escherichia coli, J. Clin. Invest. 2011: 107(5);539–548.
61. Parsot C. Shigella spp. and enteroinvasive E. coli pathogenicity factors, FEMS Microbiol. Lett. 2005:252;8–11.
62. Karch, H. The role of virulence factors in enterohemorrhagic Escherichia coli (EHEC) associated hemolytic uremic syndrome, Semin. Thromb. Hemost. 2001:27(3);207–214.
63. Eslava, C, García FN, Czeczulin JR, Henderson IR, Cravioto A, Nataro JP et al. Pet. An autotransporter enterotoxin from enteroaggregative Escherichia coli, Infect. Immun. 2009;66(7):3155–3163.
64. Khan GJ, Khan RA, Majeed I, Siddiqui FA. Ciprofloxacin; The Frequent Use In Poultry And Its Consequences On Human Health. Professional Medical Journal. 2015;22(1).
65. Whalen K. Lippincott’s illustrated reviews: Pharmacology. Philadelphia: Wolters Kluwer; 2015.
66. Jorgensen JH, Ferraro MJ. Antimicrobial susceptibility testing: a review of general principles and contemporary practices. Clin Infect Dis. 2009 Dec; 49(11):1749-55.
67. Schwalbe R, Steele ML, Goodwin, Avery C. Antimicrobial susceptibility testing protocols. US: Crc Press; 2007; p. 53-91.
68. Primanita M, Wahyudi AT, Lestari Y. 16S rRNA-based Metagenomic Analysis of Endophytic Actinomycetes Diversity from Tinospora crispa L. Miers. Microbiol Ind, 2015;9.1:25.
69. Coombs JT, Franco CMM. Isolation and Identification of Actinobacteria from Surface Sterilized Wheat Roots. Appl Environ Microbiol. 2003;69(9):5603-8.
70. Anjum N, Chandra R. Endophytic bacteria optimizaton of isolation procedure from various medicinal plants and their preliminary characterization. Asian J of Pharm and Clin Res. 2015;8(4):233-8.
71. Faisal, M. uji kepekaan bakteri yang diisolasi dan diidentifikasi dari sputum penderita bronkhitis di Rsup Prof Dr. Rd Kandou Manado terhadap antibiotik golongan sefalosporin (sefiksim), penisilin (amoksisilin) dan tetrasiklin (tetrasiklin).Pharmacon. 2015;4(3):88-95. 72. Andrews JM. Determination of minimum inhibitory concentrations. J
antimicrob Chemo. 2001;48:5-16.
73. ICMR. Detection of antimicrobial resistance in comon gram negative and gram positive bacteria encountered in infectious disease-an update. ICMR Bulletin. 2009; 39(1):1-20.
74. Elliott T, Worthington T. Buku Mikrobiologi Kedokteran dan Infeksi. Edisi 4. Jakarta: Buku Kedokteran EGC;2013.
75. Clinical and Laboratory Standars Institute (CLSI). Performance standards for antimicrobial susceptibility testing. Approved Standards-Twelfth Edition. CLSI document M02-A11.Wayne, PA: CLSI; 2016.
76. Priyanto Simarmata, Rumella, Sylvia L, Harmastini S. Isolasi mikroba endofitik dari tanaman obat sambung nyawa (Gynura procumbens) dan analisis potensinya sebagai antimikroba. Berk Penel Hayati. 2007; 13: 85-90.
77. Priharta AAYD. Isolasi dan identifikasi bakteri endofit dalam batang tanaman Artemisia annua L. yang diuji potensi antibakterinya terhadap Escherichia coli dan Staphylococcus aureus.[Skripsi] Yogyakarta. USD; 2008.
78. Waluyo L. Mikrobiologi Umum. Malang: Universitas Muhammadiyah; 2004
79. Tchaou WS, et al. Inhibition of pure cultures of oral bacteria by root canal filling materials. Pediatric Dentistry. 1996;18(7): 444-449.
80. Toy TSS, Lampus BS, Hutagalung BSP. Uji Daya Hambat Ekstrak Rumput Laut Gracilaria Sp Terhadap Pertumbuhan Bakteri Staphylococcus Aureus. E-GigI. 2015;3(1):1-7.
81. Hallmannn J, Quadt-Hallmannn A, Mahaffee WF, Kloepper JW.. Bacterial endophytes in agricultural crops. Can J Microbiol. 1997; 43:895-914 82. Bacon CW, Hinton DM.. Bacterial endophytes: the endophytic niche, its
occupants, and its utility. Di dalam: Gnanamanickam SS, editor, Plant- Associated Bacteria. Netherland : Springer. 2006
83. Sulistiyani TR. Keragaman bakteri endofit tanaman kunyit putih (Curcuma zedoaria) dan toksisitasnya terhadap embrio ikan zebra. [Tesis]. Bogor: Institut Pertanian Bogor. 2014
84. Kumala S, Siswanto EB. Isolation and screening of endophytic microbes from Morinda citrifolia and their ubility to produce antimicrobial subtances. Microbiology Indonesia. 2007;1: 145-148
85. Sari WE. Aktivitas antihipertensi aktinomiset endofit asal tanaman pegagan dan belimbing wuluh [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, 2011.
86. Radji, M. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Pharmaceutical Sciences and Research, 2012; 2(3):113-126
87. Strobel, GA. Microbial gifts from rain forests. Canadian Journal of Plant Pathology, 2002; 24(1):4-20.
88. Sunariasih, Linda NP, Suada IK, Suniti NW. Identifikasi jamur endofit dari biji padi dan uji daya hambatnya terhadap Pyricularia oryzae Cav. Denpasar. E-jurnal ageoteknologi tropika 2014;3(2).
89. Tan RX, Zou WX.. Endophtyes: a rich source of functional metabolites. Nat Prod Rep; 2001;18: 4483459
90. Hanif, Andini, Bonny P, Wahyu S, Munif A. Seleksi Bakteri Endofit Penghasil Senyawa Metabolit untuk Pengendalian Cendawan Patogen Terbawa Benih Jagung. Jurnal Fitopatologi Indonesia. 2017;12(5)149 91. Elita A, Saryono S, Jose C. Penentuan waktu optimum produksi
antimikroba dan uji fitokimia ekstrak kasar fermentasi bakteri endofit Pseudomonas sp. dari umbi tanaman dahlia (Dahlia variabilis). Jurnal Indonesian Chemia Acta, 2013;3(2):56-62.
92. Halim, Jasril, Saryono. Optimalisasi produksi senyawa metabolit sekunder dari pseudomonas sp. Endofit tanaman dahlia (Dahlia variabilis). Jurnal indonesian chemia acta, 2014, 5.1: 8-14.
93. Turk FM. Saponins versus plant fungal pathogens, Journal of Cell and Molecular Biology. 2006; 5:13-17.
94. Cowan M. Plant products as antimicrobial agents, Clinical microbiology reviews. 1999;12(4) 564‐82