i
OPTIMASI KONDISI PROSES ELEKTROKOAGULASI ION LOGAM TEMBAGA (II) DALAM LIMBAH CAIR ELEKTROPLATING
TUGAS AKHIR SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta untuk Memenuhi Sebagian
Persyaratan Guna Memperoleh Gelar Sarjana Sains
Oleh:
Ferdinand Dos Santos NIM 13307141040
PROGRAM STUDI KIMIA JURUSAN PENDIDIKAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
ii
OPTIMASI KONDISI PROSES ELEKTROKOAGULASI ION LOGAM TEMBAGA (II) DALAM LIMBAH CAIR
ELEKTROPLATING Oleh:
Ferdinand Dos Santos NIM 13307141040
ABSTRAK
Tujuan dari penelitian ini adalah mengetahui kondisi optimum proses elektrokoagulasi untuk mengurangi kadar ion logam tembaga (II) dalam limbah cair elektroplating.
Subjek pada penelitian ini adalah ion logam tembaga (II). Objek penelitian adalah persen efisiensi proses elektrokoagulasi terhadap pengurangan kadar ion logam tembaga (II) pada limbah cair elektroplating. Karakterisasi sifat limbah cair elektorplating dengan melihat sifat fisika limbah dan pengukuran beberapa kadar logam dilakukan dengan AAS. Optimasi kombinasi elektroda dilakukan dengan variasi Fe-Fe, Al-Fe, Fe-Al, Al-Al sebagai katoda-anoda. Optimasi waktu dilakukan dengan variasi 30; 60; 90; dan 120 menit. Optimasi pH dilakukan dengan vaiasi pH inisial limbah, 4; 8; 10; 10,5 dengan menambahkan NH3 2 M
tetes demi tetes. Optimasi rapat arus dilakukan dengan variasi 1,25; 3,75; 6,25; 8,75 mA/cm2. Kondisi optimum ditunjukkan dengan nilai persen efisiensi paling
besar.
Hasil penelitian menunjukkan bahwa karakter limbah cair elektroplating sebelum proses elektrokoagulasi adalah tidak berbau, berwarna biru, pH sekitar 2,5, dan logam Cd, Pb, Zn, Cu melebihi ambang batas yaitu 0,01; 0,1; 1; 0,5 mg/L secara berturut-turut yang diatur dalam Standar Baku Mutu Limbah Cair untuk Industri Pelapisan Logam Peraturan Gubernur Provinsi DIY No:7 Tahun 2010. Kombinasi elektroda optimum adalah Al-Fe; waktu elektrokoagulasi optimum adalah 120; pH optimum adalah 8; dan rapat arus optimum adalah 1,25 mA/cm2.
iii
OPTIMIZATION OF THE ELECTROCOAGULATION PROCESS CONDITION OF COPPER (II) METAL ION FROM
ELECTROPLATING WASTEWATER By:
Ferdinand Dos Santos NIM 1307141040
ABSTRACT
The purpose of this research is to examine the optimum condition of electrocoagulation process for copper (II) metal ion removal from electroplating wastewater.
The subject of this research was copper (II) metal ion. The object was the electrocoagulation percent efficiency to copper (II) metal ion removal in the electroplating wastewater. The characterization of the electroplating wastewater was characterized by means observed the physic properties and several metals level was measured with AAS. The optimization of the electrode combination was treated by Fe-Fe, Al-Fe, Fe-Al, and Al-Al as cathode-anode variation. The optimization of electrocoagulation time was treated by 30, 60, 90, 120 minutes variation. The pH optimization was treated under initial, 4, 8, 10, 10,5 pH value by adjusting the pH using 2 M NH3. Current Density was treated with the variation of
1.25; 3.75; 6.25; 8.75 mA/cm2. The optimum conditions were shown by the
maximum percent efficiency.
The results of this research are shown that the properties of the electroplating wastewater before electrocoagulation treatment for the physics aspect is odorless and blue colored with pH 2,5. Cadmium, Pb, Zn, Cu exceed the threshold of 0.01; 0.1; 1; 0.5 mg/L respectively which is regulated in Wastewater Quality Standards for Metal Coating Industry Regulation of the Provincial Governor of DIY No: 7 of 2010. The optimum combination of the electrodes is Al-Fe. The time optimum are 120 minutes. The pH optimum is 8. The current density optimum is 1.25 mA/cm2.
iv
HALAMAN PERSETUJUAN
Tugas Akhir Skripsi dengan Judul
Optimasi Kondisi Proses Elektrokoagulasi Ion Logam Tembaga (II) dalam Limbah Cair Elektroplating
Disusun oleh: Ferdinand Dos Santos
NIM 13307141040
Telah memenuhi syarat dan disetujui oleh Dosen Pembimbing untuk dilaksanakan Ujian Tugas Akhir Skripsi
bagi yang bersangkutan.
Yogyakarta, 31 Maret 2017 Mengetahui,
Ketua Program Studi
Drs. Jaslin Ikhsan, M.App. Sc., Ph.D NIP. 19680629 199303 1 001
Disetujui,
Dosen Pembimbing
Siti Marwati, M.Si
v
HALAMAN PENGESAHAN
Tugas Akhir Skripsi
Optimasi Kondisi Proses Elektrokoagulasi Ion Logam Tembaga (II) dalam Limbah Cair Elektroplating
Disusun oleh: Ferdinand Dos Santos
NIM 13307141040
Telah dipertahankan di depan Tim Penguji Tugas Akhir Skripsi Program Studi Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negeri Yogyakarta Pada tanggal 12 Juli 2017
TIM PENGUJI
Nama/ Jabatan Tanda Tangan Tanggal
Siti Marwati, M.Si Ketua Penguji
……….. ...
I Made Sukarna, M.Si Penguji Utama
... ...
Erfan Priyambodo, M.Si Penguji Pendamping
... ...
Yogyakarta, 12 Juli 2017
Fakultas Matematika dan Ilmu Pengetahuan Alam Dekan,
Dr. Hartono, M.Si
vi
HALAMAN PERNYATAAN
Saya yang bertanda tangan dibawah ini:
Nama : Ferdinand Dos Santos NIM : 13307141040
Program Studi : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Judul TAS :Optimasi Kondisi Proses Elektrokoagulasi Ion Logam Tembaga (II) dalam Limbah Cair Elektroplating.
menyatakan bahwa skripsi ini benar-benar karya saya sendiri di bawah tema penelitian payung dosen atas nama Siti Marwati, M.Si dan Regina Tutik Padmaningrum, M.Si Jurusan Pendidikan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam tahun 2016 yang berjudul “Model Pengolahan Limbah Cair Elektroplating secara Elektrokoagulasi” sepanjang pengetahuan saya tidak terdapat karya atau pendapat yang ditulis atau diterbitkan orang lain, kecuali sebagai acuan kutipan dengan mengikuti tata penulisan karya ilmiah yang telah lazim. Tanda tangan dosen penguji yang tertera dalam halaman pengesahan adalah asli, jika tidak asli, saya siap menerima sanksi ditunda yudisium pada periode berikutnya.
Yogyakarta, 12 Juli 2017 Yang menyatakan,
vii MOTTO
Ketika kita sudah berjuang namun gagal, percayalah bahwa ada orang lain yang telah berjuang lebih keras dari kita dan dia pantas mendapatkannya.
viii
HALAMAN PERSEMBAHAN Kupersembahkan skripsi ini kepada:
1. Kedua orangtua saya Dominggus Da Santos dan Partilah yang telah memberikan kepercayaan kepada saya untuk bisa terus melanjutkan studi sampai tingkat universitas.
2. Kedua adik saya Dimas Sanjaya dan Cornellia Emi Care yang menjadi alasan kenapa saya harus sukses.
Terima Kasih kepada:
1. Semua anggota keluarga besar Mujiharjo tanpa terkecuali terutama mbok tuo, pak tuo, mbak Tri, mbak Titin, mas Tyo, mas Yono, dan Selfi yang selalu membantu dalam kehidupan sehari-hari selama kuliah di Jogja.
2. Ibu Siti Marwati, M.Si dan Ibu Regina Tutik Padmaningrum, M.Si yang telah mempercayai saya sebagai bagian dari penelitian ini.
3. Partner penelitian yang superb (Risanto Wibowo, Enny Dwi Cahyanti, Resti Syara Ronita) yang tanpa mereka mungkin penelitian ini tidak bisa berjalan mulus.
ix
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa atas berkat karena atas berkat rahmat dan karunia-Nya, Tugas Akhir Skripsi dalam rangka untuk memenuhi sebagian persyaratan untuk mendapatkan gelar Sarjana Sains dengan judul “Optimasi Kondisi Proses Elektrokoagulasi Ion Logam Tembaga (II) dalam
Limbah Cair Elektroplating” dapat disusun sesuai dengan harapan. Tugas akhir skripsi ini dapat diselesaikan tidak lepas dari bantuan dan kerjasama dengan pihak lain. Berkenaan dengan hal tersebut, penulis menyampaikan ucapan terima kasih kepada yang terhormat:
1. Ibu Siti Marwati, M.Si selaku Dosen Pembimbing TAS serta Ketua Tim Penelitian yang telah mempercayai saya sebagai mahasiswa bimbingannya dan banyak memberikan semangat, dorongan, serta bimbingan dalam penelitian terutama selama penyusunan Tugas Akhir Skripsi ini.
2. Ibu Regina Tutik Padmaningrum, M.Si sebagai anggota tim penelitian Ibu Siti Marwati, M.Si yang juga telah mempercayai saya untuk ikut andil dalam penelitian serta bimbingan selama masa kuliah dan penelitian.
3. Bapak Prof. K.H. Sugiyarto yang telah mempercayai kemampuan saya dan mendorong saya agar mencoba belajar di universitas di Thailand.
4. Ibu Prof. Endang Widjajanti yang selama masa kuliah saya kerap membantu dalam permasalahan perkuliahan hingga motivasi-motivasi yang beliau berikan. 5. Bapak Jaslin Ikhsan, Ph. D selaku Ketua Jurusan Pendidikan Kimia.
x
7. Bapak I Made Sukarna, M.Si dan Bapak Erfan Priyambodo, M.Si selaku dewan penguji sidang skripsi yang telah bersedia menguji serta memberikan masukan kepada saya selama sidang dan penyusunan skripsi. 8. Bapak Dr. Hartono, M.Si selaku Dekan Fakultas MIPA yang memberikan
persetujuan pelaksanaan Tugas Akhir Skripsi.
9. Seluruh Dosen, Staf, dan Laboran Jurusan Pendidikan Kimia FMIPA UNY yang telah banyak membantu selama perkuliahan dan penelitian.
10.Semua pihak yang telah membantu dalam penyelesaian skripsi ini.
Akhirnya, semoga segala bantuan yang telah diberikan semua pihak di atas menjadi amalan yang bermanfaat dan mendapatkan balasan dari Tuhan Yang Maha Esa. Harapannya Tugas Akhir Skripsi ini menjadi informasi bermanfaat bagi pembaca atau pihak lain yang membutuhkannya.
Yogyakarta, 12 Juli 2017
xi DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
ABSTRAK ... ii
ABSTRACT ... iii
HALAMAN PERSETUJUAN ... iv
HALAMAN PENGESAHAN ... v
HALAMAN PERNYATAAN ... vi
MOTTO ... vii
HALAMAN PERSEMBAHAN ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN A. Latar Belakang Masalah... 1
B. Identifikasi Masalah ... 4
C. Batasan Masalah ... 5
D. Rumusan Masalah ... 6
E. Tujuan Penelitian ... 6
F. Manfaat Penelitian ... 7
BAB II KAJIAN PUSTAKA A. Deskripsi Teori ... 8
1. Limbah Cair Elektroplating ... 8
2. Elektrokoagulasi ... 10
3. Mekanisme Elektrokoagulasi... 15
4. Mekanisme Destabilisasi Koloid ... 17
5. Parameter Perlakuan ... 18
6. Atomic Absorption Spectroscopy (AAS) ... 21
B. Penelitian yang Relevan ... 24
C. Kerangka Berpikir ... 26
BAB III METODE PENELITIAN A. Subjek dan Objek Penelitian ... 28
B. Variabel Penelitian ... 28
C. Instrumen Penelitian ... 29
D. Skema Rangkaian Alat Penelitian ... 30
E. Prosedur Penelitian ... 30
F. Teknik Analisis Data ... 36
BAB IV HASIL DAN PEMBAHASAN A. Karakterisasi Limbah Cair Elektroplating ... 38
xii
C. Optimasi Waktu Elektrokoagulasi ... 42
D. Optimasi pH ... 44
E. Optimasi Rapat Arus ... 46
BAB V KESIMPULAN DAN SARAN G. Kesimpulan ... 51
H. Saran ... 51
DAFTAR PUSTAKA ... 52
xiii
DAFTAR TABEL
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Reaksi Selama Proses Elektrokoagulasi... 15
Gambar 2. Grafik Hubungan Konsentrasi dengan Absorbansi ... 22
Gambar 3. Skema AAS ... 24
Gambar 4. Reaksi Ion Fe2+ Terhidrat dengan Amonia ... 53
xv
DAFTAR LAMPIRAN
1 BAB I PENDAHULUAN A. Latar Belakang Masalah
Limbah cair elektroplating dari industri perak di Kotagede, Yogyakarta, mengandung banyak logam berat seperti Ag+, Hg22+, Pb2+, Hg2+, Bi3+, Cu2+, Co2+,
Al3+, Cr3+, Fe2+, Mn2+, Ni2+, dan Zn2+ (Marwati, 2008). Limbah cair elektroplating yang dibuang langsung ke saluran pembuangan tanpa diolah terlebih dahulu tentunya akan menyebabkan pencemaran. Air bersih yang tercemar limbah cair elektroplating tentunya akan membahayakan kesehatan jika terdapat dalam air sumur yang akan digunakan untuk kebutuhan sehari-hari. Dampak dari pencemaran logam tersebut bermacam-macam, sebagai contoh jika seseorang terpapar Cu melebihi ambang batas maka kelebihan Cu dalam tubuh dapat menyebabkan gangguan perut, mual-mual, dan jika dibiarkan terus dapat merusak organ hati dan ginjal (ATSDR, 2004). Oleh karena itu, pengolahan limbah cair elektroplating ini perlu dilakukan agar tidak mencemari lingkungan.
2
terdapat ion logam yang tidak terpresipitasi karena tertutup lumpur (sludge). Lumpur ini perlu ditangani agar tidak mencemari lingkungan kembali. Metode lain dalam pengolahan limbah cair elektroplating yang sudah dilakukan adalah metode recovery atau pemanfaatan ion logam dari limbah cair elektroplating yang
dilakukan secara elektrolisis. Metode ini cukup efektif dalam mengolah limbah cair elektroplating karena limbah cair ini masih mengandung ion logam yang dapat digunakan sebagai bahan pelapis. Selain itu, metode ini mudah serta murah. Dalam pengolahan limbah cair elektroplating dengan metode recovery terjadi kenaikan kadar beberapa ion logam yang berarti masih perlu dikembangkan dan dari segi hasil masih belum optimal seperti lapisan yang tidak merata dan terdapat noda-noda pada logam (Marwati, 2009). Oleh karena, itu perlu dilakukan pengembangan atau metode lain agar pemanfaatan limbah cair elektroplating dapat maksimal.
3
elektrokoagulasi ini dapat dimanfaatkan sebagai bahan gelasir keramik (Marwati, 2009).
Faktor-faktor yang mempengaruhi proses elektrokoagulasi ion logam dalam limbah cair elektroplating antara lain adalah material pada elektroda, pH larutan, rapat arus, waktu treatment, potensial elektroda, konsentrasi polutan, konsentrasi anion, suhu, dan beberapa parameter lain seperti jarak antar elektroda (Vepsäläinen, 2012). Dengan demikian, perlu dilakukan optimasi beberapa parameter agar elektrokoagulasi ion logam tersebut dapat dilakukan dengan optimum. Pengkondisian parameter ini diharapkan bahwa ion logam berat yang terkoagulasi dapat maksimum sehingga kadar ion logam berat dalam limbah cair elektroplating dapat dikurangi. Selain itu, flok yang terbentuk dalam jumlah maksimum dan flok tersebut dapat digunakan lebih lanjut.
Jenis elektroda yang digunakan dalam elektrokoagulasi biasanya adalah besi dan atau alumunium. Kombinasi elektroda optimum untuk pengurangan ion logam tembaga (II) yang didapatkan Heidman (2010) adalah Fe-Al sebagai katoda-anoda, dengan pH optimum lebih dari 5. Akbal (2011) juga meneliti efek dari kombinasi elektroda, pH, dan rapat arus. Pada penelitian Akbal (2011) didapatkan hasil yaitu Fe-Fe dan Al-Fe sebagai kombinasi elektroda optimum, pH 9, dan rapat arus sebesar 10 mA/cm2. Tezcan (2015) mengidentifikasi limbah simulasi menggunakan elektroda Fe untuk mengetahui efek pH, waktu elektrokoagulasi, serta rapat arus dan didapatkan pH 7 sebagai pH optimum dengan waktu elektrokoagulasi selama 90 menit serta rapat arus sebesar 30 mA/cm2. Penelitian yang dilakukan Heidman
4
proses elektroplating logam atau dari limbah galvanic yang mengandung logam Ni, Cu, dan Cr, sedangkan penelitian Tezcan (2015) menggunakan limbah simulasi yang terdiri dari Cd, Ni, Cu. Limbah yang digunakan oleh para peneliti tersebut dapat dikatakan berjenis sama yaitu limbah dari hasil elektroplating logam namun kondisi optimum tiap penelitian berbeda karena limbah yang diteliti memiliki kandungan yang berbeda-beda. Limbah cair elektroplating di Kotagede, Yogyakarta, selain mengandung banyak logam berat seperti Cd, Cr, Pb, Cu, Zn, limbah cair elektroplating di Kotagede juga mengandung anion-anion seperti Cl-, SO42-, NO3-, No2-, CN-, dan F-. Oleh karena itu, optimasi kondisi elektrokoagulasi
limbah cair elektroplating dalam penelitian ini perlu dilakukan.
B. Identifikasi Masalah
Berdasarkan latar belakang masalah di atas maka dapat diidentifikasikan masalah sebagai berikut:
1. Banyaknya Industri kerajinan perak (industri elektroplating) yang membuang limbahnya ke saluran pembuangan tanpa pengolahan terlebih dahulu.
2. Limbah cair elektroplating yang mengandung banyak ion logam berat berbahaya bagi kesehatan sehingga perlu diolah terlebih dahulu.
3. Terdapat berbagai macam cara pengolahan limbah cair elektroplating namun masih menghasilkan hasil pengolahan yang belum efektif.
4. Elektrokoagulasi memiliki berbagai parameter dalam pengolahannya dan dibutuhkan kondisi yang optimum dalam pengolahannya.
5
6. Variasi waktu elektrokoagulasi berpengaruh terhadap proses elektrokoagulasi ion logam tembaga (II).
7. Variasi pH berpengaruh terhadap proses elektrokoagulasi ion logam tembaga (II).
8. Variasi rapat arus berpengaruh terhadap proses elektrokoagulasi ion logam tembaga (II).
C. Batasan Masalah
1. Limbah yang digunakan sebagai sampel penelitian ini adalah limbah cair elektroplating dari pengrajin perak di Kotagede, Yogyakarta.
2. Ion logam berat yang akan dianalisis adalah ion logam tembaga (II)
3. Proses Elektrokoagulasi dilakukan dengan sistem batch atau reaktor 1 bejana. 4. Parameter yang dioptimasi yaitu kombinasi elektroda, pH, rapat arus, dan
waktu.
5. Kombinasi eletkroda yang akan dipelajari berupa kombinasi katoda-anoda dari pelat elektroda Al dan Fe dengan kombinasi Al-Fe, Fe-Fe, Fe-Al, Al-Al (katoda-anoda).
6. Variasi waktu elektrokoagulasi yang dipelajari adalah 30, 60, 90, 120 menit. 7. Variasi pH yang akan dipelajari adalah pH awal limbah, 4, 8, 10, 10,5. 8. Variasi rapat arus yang akan dipelajari adalah 1,25; 3,75; 6,25; 8,75 mA/cm2. 9. Kondisi optimum elektrokoagulasi adalah kondisi yang memiliki persen
6 D. Rumusan Masalah
Berdasarkan uraian dari latar belakang dan batasan masalah di atas maka rumusan masalah adalah sebagai berikut:
1. Bagaimana karakter limbah cair elektroplating dari industri perak di Kotagede sebelum proses elektrokoagulasi?
2. Bagaimana kombinasi elektroda optimum pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
3. Berapa waktu optimum pada proses elektrokoogulasi ion logam tembaga (II) dalam limbah cair elektroplating?
4. Berapa pH optimum pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
5. Berapa rapat arus optimum pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
E. Tujuan Penelitian
1. Mengetahui karakter limbah cair elektroplating dari industri perak di Kotagede sebelum proses elektrokoagulasi?
2. Mengetahui kombinasi elektroda optimum pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
3. Mengetahui waktu optimum pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
7
5. Mengetahui rapat arus pada proses elektrokoagulasi ion logam tembaga (II) dalam limbah cair elektroplating?
F. Manfaat Penelitian 1. Manfaat Teoritis
a. Penelitian ini diharapkan dapat menjadi acuan untuk pengembangan metode elektrokoagulasi dalam pengolahan air limbah, terutama limbah cair elektroplating.
b. Penelitian ini diharapkan memiliki kontribusi dalam bidang kimia terutama kimia lingkungan.
2. Manfaat Praktis
a. Penelitian ini memberikan pengalaman bekerja di laboratorium dan lapangan, melatih menganalisis data, dan melatih keahlian laboratorium bagi peneliti.
b. Dapat menjadi refrensi pustaka bagi penelitian-penelitian lainnya terkait pengolahan ion logam tembaga (II) dalam limbah elektroplating.
3. Manfaat bagi Masyarakat
a. Penelitian ini telah memberikan model yang optimum dalam pengolahan limbah cair elektroplating bagi para pengrajin perak di Kotagede untuk mengatasi persoalan pembuangan limbah.
8 BAB II
KAJIAN PUSTAKA
A. Deskripsi Teori
1. Limbah Cair Elektroplating
Limbah cair elektroplating berasal dari pencucian, pembersihan dan proses elektroplating. Bak elektroplating merupakan sumber limbah utama yang mengandung Cu, Ni, Ag, Zn, Cr, Cd, Sn, Fe, Pb, amonia dan anion seperti ion sianida, fosfat, klorida, sulfida, sulfat, nitrat dan lain-lain (Husain, 2014).
Limbah cair elektroplating dari industri perak di Kotagede,Yogyakarta, mengandung banyak logam berat seperti Ag+, Hg22+, Pb2+, Hg2+, Bi3+, Cu2+, Co2+,
Al3+, Cr3+, Fe2+, Mn2+, Ni2+, dan Zn2+ (Marwati, 2008).
Pengrajin perak menggunakan larutan elektrolit untuk menjaga mutu dan penampilan produk. Larutan elektrolit ini selalu diganti setiap dua minggu yang menyebabkan bertambahnya limbah. Larutan yang digunakan mengandung bahan kimia berbahaya dan beracun (Marwati, 2008).
Polutan dalam limbah cair biasanya berbentuk partikel koloid yang tidak mudah dihilangkan dengan pemisahan sejenis penyaringan sedimen atau flotasi karena polutan dalam bentuk ini stabil dalam air. Partikel ini memiliki sifat khusus akibat dari ukurannya yang kecil dan luas permukaan yang besar (Vepsäläinen, 2012:14).
9
Tabel 1. Baku Mutu Air Limbah
Parameter Kadar Paling Tinggi Pelapisan Logam (mg/L) Bahan Paling Tinggi Pelapisan Logam (gr/m2)
Kadar Paling Tinggi Galvanisasi (mg/L) Beban Paling Tinggi Galvanisasi
(gr/m2)
TSS 20 0,4 20 0,04
Cu 0,5 0,01 0,5 0,001
Zn 1,0 0,02 1,0 0,0005
Cr6+ 0,1 0,002 - -
Cr 0,5 0,01 - -
Cd 0,05 0,001 0,05 0,0001
Pb 0,1 0,002 0,1 0,0002
Ni 1,0 0,02 1,0 0,002
CN 0,2 0,004 0,2 0,0004
Ag 0,5 0,001 0,5 0,001
pH 6-9 6-9
Kuantitas air limbah paling tinggi
20 L per m2 produk pelapisan logam
2 L per m2 produk pelapisan logam
10
dasarnya baik untuk kesehatan karena tembaga membantu membentuk melanin, tulang, dan jaringan penghubung lainnya. Biasanya manusia mendapatkan asupan tembaga dari makanan sehari-hari seperti hati dan organ lainnya, makanan laut, kacang kacangan, dan biji-bijian (Rita Shater, Rochester Unviersity) akan tetapi terpapar tembaga dengan dosis besar dapat berbahaya bagi kesehatan. Tembaga yang terminum dapat menyebabkan mual, muntah, kram perut, diare. Terpapar tembaga dalam jumlah banyak yang disengaja dapat menyebabkan kerusakan hati dan ginjal, dan bahkan kematian (ATSDR, 2004). “Batas maksimum logam tembaga yang dapat ditoleransi oleh tubuh per hari (Provisional Maximum Tolerable Daily Intake) berdasarkan batas yang ditetapkan oleh Badan Kesehatan
Dunia (WHO) dan FAO sebesar 0,05-0,5 mg/kg per minggu per berat badan”(Kusuma, 2014).
2. Elektrokoagulasi
11
Semakin banyak polutan yang terangkat ke atas maka ukurannya akan bertambah besar (Kusrijadi, 2013).
Elektrokoagulasi adalah teknik pemisahan yang memiliki beberapa kesamaan dengan teknik koagulasi secara kimia namun juga memiliki perbedaan, seperti reaksi samping. Dalam sistem Elektrokoagulasi terjadi reaksi elektrokimia yang terjadi sekaligus pada katoda dan anoda. Reaksi-reaksi yang terjadi dapat dibagi menjadi mekanisme reaksi utama yang menyebabkan destabilisasi polutan, dan reaksi samping seperti pembentukan hidrogen (Vepsäläinen, 2012).
a. Reaksi Utama
Elektroda yang menghasilkan koagulan ke dalam sel elektrokoagulasi biasanya digunakan besi atau alumunium. Ketika potensial diberikan oleh sumber tegangan (power supply), logam anoda (Fe/Al) akan mengalami oksidasi atau akan terlarut, sedangkan pada katoda akan terjadi reduksi atau akan terjadi deposisi logam. Reaksi pada elektroda dapat diringkas sebagai berikut:
Reaksi pada Anoda
Fe(s) → Fe2+(aq) + 2e- E0 = +0,44 V (1)
Fe(s) → Fe3+(aq) + 3e- E0 = +0.04 V (1b)
Al(s) → Al3+(aq) + 3e- E0 = -1,66 V (2) 2H2O(l) → 4H+(g) + O2(g) + 4e- E0 = -1,23 V (3)
Reaksi pada Katoda
Fe3+(aq) + 3e- → Fe(s) E0= -0,04 V (4) Fe2+(aq) + 2e- → Fe(s) E0= -0,44 V (4b)
2H2O(l) + 2e-→ H2(g) +2OH- E0 = -0,83 V (5)
12
Jika besi atau alumunium digunakan sebagai elektroda, kation logam yang terbentuk dari anoda akan segera bereaksi dengan OH- yang terbentuk pada katoda
menghasilkan hidroksida/polihidroksida yang sesuai tergantung dari kondisi sistem. Sebagai contoh, ion Al3+ terhidrolisis menghasilkan [Al(H2O)6]3+,
[Al(H2O)5OH]2+,[Al(H2O)4(OH)]2+ dan produk hidrolisis dapat membentuk
banyak spesies monomerik dan polimerik seperti [Al(OH)]2+, [Al(OH)]2+, [
Al(OH)2]+, [Al2(OH)2]4+, [Al(OH)4]-, [Al6(OH)15]3+, [Al7(OH)17]4+, [Al8(OH)20]4+,
[Al13O4(OH)24]7+, [Al13(OH)34]5+ untuk elektroda Al dan untuk elektroda Fe dapat
membentuk ion monomerik, Fe(OH)3 dan polimerik hidroksi komplek, yaitu,
[Fe(H2O)6]3+, [Fe(H2O)5(OH)]2+, [Fe(H2O)4(OH)]2+, [Fe2(H2O)8(OH)2]4+,
[Fe2(H2O)6(OH)4]4+ namun semua spesies ini terbentuk tergantung oleh pH
medium. Hidroksida/polihidroksida/polihidroksilogam memiliki affinitas yang kuat untuk partikel terdispersi begitu juga sebagai counter ion untuk menyebabkan koagulasi. Gas yang terbentuk pada elektroda dapat membuat material yang ter-koagulasi mengalami flotasi. Keberhasilan proses elektroter-koagulasi juga ditentukan oleh ukuran gelembung. Semakin kecil gelembung maka luas area yang dibutuhkan untuk partikel terkoagulasi menempel akan lebih besar sehingga pemisahan akan lebih baik (Mollah, 2009).
13
hidroksida dapat menghilangkan polutan dalam sistem dengan adsorpsi, kopresipitasi, dan atraksi elektrostatik yang kemudian diikuti dengan koagulasi.
Ion hidroksida yang terbentuk pada katoda meningkatkan pH limbah dan dapat menyebabkan presipitasi logam dalam bentuk hidroksida yang sesuai dengan kondisi limbah (Heidmann, 2010).
Alumunium selain larut dari anoda juga terlarut dari katoda ketika pH pada permukaan katoda berkurang karena pembentukan OH- atau penggunaan ion
hydronium/proton dalam pembentukan gas hidrogen. Selain itu pada pH tinggi,
Alumunium terlarut sebagai aluminat
2Al(s) + 6H2O +2HO-(aq) → 2[Al(OH)4]-(aq) + 3H2(g) (7)
b. Reaksi Samping
Salah satu reaksi samping yang terjadi adalah bertambahnya pH karena pembentukan ion hidroksida atau pemakaian proton dan reduksi logam pada katoda. Terbentuknya ion hidroksida dari reaksi elektrolisis air di katoda menghasilkan perubahan pH, atau menaikan pH. Dengan pemberian potensial yang lebih besar, hidrolisis pada anoda dalam pemembentukan gas oksigen dapat terjadi (Heffron, 2015).
Pembentukan oksigen pada anoda terjadi karena pH tinggi yang juga menyebabkan laju pelarutan berkurang (Nepo, 2016).
2H2O(l) → O2(g)+ 4H++4e- (8)
14
Elektrokoagulasi meningkatkan pH larutan ketika larutan memiliki pH awal yang asam, netral, atau sedikit basa dan berkurang ketika pH awal sangat basa. Perubahan pH selama proses elektrokoagulasi memengaruhi spesiasi dari hidroksida alumunium dan besi (Vepsäläinen, 2012). Dalam elektrokoaglasi, limbah dihilangkan melalui mekanisme koagulasi dan kopresipitasi. Heidmann (2008) mempelajari tentang penghilangan logam seperti Zn(II), Cu(II), Ni(II), Ag(I), dan Cr(VI) dalam limbah menggunakan eletkrokoagulasi. Mereka mengatakan bahwa Zn(II), Cu(II), Ni(II), dan Ag(I) dapat dihilangkan dengan elektrokoagulasi dan mekanisme yang terjadi adalah kopresipitasi.
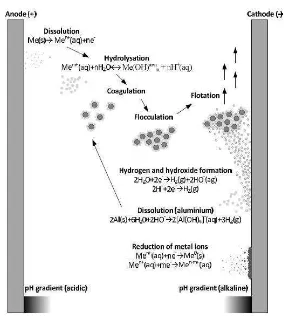
Reaksi yang terjadi selama elektrokoagulasi dapat diringkas menjadi pembentukan koagulan dari pelarutan anoda, destabilisasi polutan, dan flokulasi serta flotasi seperti pada Gambar 1.
15 .
3. Mekanisme Elektrokoagulasi
Ion logam yang terbentuk dari anoda terjadi karena adanya proses oksidasi Al/Fe, sedangkan di katoda terjadi reaksi pembentukan H2 (Akbal, 2011). Secara
bersamaan, ion hidroksil yang diproduksi pada katoda akan meningkatkan pH elektrolit dan dapat menyebabkan kopresipitasi Cu2+, Zn2+, dan Cr (III) dalam bentuk hidroksida masing-masing (Adhoum, 2004).
[image:30.595.169.453.110.426.2]Pada teknik koagulasi konvensional dibutuhkan garam anorganik yang mengandung kation logam yang mudah terhidrolisis, seperti alumunium sulfat dan besi klorida. Pada teknik elektrokoaglasi kation-kation tersebut dihasilkan secara in situ karena pelarutan elektrolitik pada anoda (Marriaga, 2014).
16
Dalam elektrokoagulasi ada 3 tahap utama dalam penghilangan polutan. Tahap pertama adalah pembentukan koagulan. Tahap ini dimulai dari terbentuknya kation dari anoda yang mengalami pelarutan akibat pemberian arus listrik. Kemudian kation logam akan bereaksi dengan ion hidroksida (OH-) menghasilkan spesies hidroksil, komplek ion bermuatan positif. Komplek ion bermuatan positif yang terbentuk tergantung pada pH suspensi, sehingga hidroksil yang terbentuk memiliki wujud yang beragam (Marriaga, 2014).
Ion logam dan ion hidroksida yang terbentuk akan segera bereaksi membentuk hidroksida, Fe(OH)2, Al(OH)3, dan polimerik kompleks-hidroksil,
yang berbeda sesuai pada pH medium. Hidroksida besi dan alumunium yang tersuspensi dapat menghilangkan polutan dari larutan dengan mekanisme adsorpsi, presipitasi atau atraksi elektronik, yang kemudian diikuti dengan koagulasi (Vlachou, 2013).
Tahap kedua yaitu destabilisasi kontaminan. Pada pH asam komplek-kation akan mendestabilisasi partikel koloid dengan menetralkan muatan superficial (charge neutralization). Pada pH yang lebih tinggi, komplek-kation akan terhidroli-sis sepenuhnya untuk menghasilkan spesies amorphous yang tidak larut (oksida, hidroksida, dan oksihidroksida) yang menyebabkan sweep coagulation (Marriaga, 2014). Pada tahap ini juga terjadi pemecahan emulsi, destabililsasi kontaminan, dan partikel tersuspensi (Vlachou, 2013).
17
air akan melekat pada partikel terkoagulasi karena adanya fenomena superficial dan akibat dari sifat apung alami dan akan mengapung ke permukaan limbah (Marriaga, 2014). Selain 3 tahap di atas, beberapa reaksi fisika-kimia dapat terjadi seperti reduksi katodik dari senyawa seperti nitrit dan nitrat, elektrodeposisi oleh kation, dan pasivasi.
4. Mekanisme Destabilisasi Koloid
Koloid stabil di dalam air karena tolakan elektrostatik antara partikel, selain itu sifat koloid yaitu gerak brown menyebabkan partikel koloid tetap bergerak dalam air dan karena koloid berukuran kecil maka tidak terendapkan oleh gaya gravitasi. Koagulan yang terbentuk secara in situ dalam elektrokoagulasi akan mengurangi energi antara partikel, sehingga partikel akan mudah teraglomerasi. Flokulasi terjadi ketika partikel saling menempel ke partikel lainnya (Vepsäläinen, 2012).
Mekanisme yang dapat mendestabilisasikan partikel koloid dalam air:
a. Compression of electrical double layer
Bertambahnya konsentrasi ion dalam larutan akan mengompresi EDL (Electrical Double Layer) sehingga tolakan antar partikel dapat diperkecil.
b. Adsorption destabilization
18
c. Inter-particle bridging.
Koagulan logam terpolimerisasi dapat membentuk jembatan antar partikel. Polimer dapat mengadsorb pada permukaan partikel dengan berbagai mekanisme, seperti charge-charge interaction. Ketika satu rantai polimer mengadsorb beberapa partikel, proses penjembatan terjadi dan masa molekul bertambah.
d. Precipitation and enmeshment mechanism
Pendestabilisasian dengan garam logam berkonsentrasi tinggi pada daerah mendekati pH netral. Pada pH tersebut, garam logam, seperti alum atau Fe(III) sulfat, membentuk produk yang tidak larut dan berpolimerisasi. Partikel koloid kemudian dapat terjerat kedalam produk ini menyebabkan sweep coagulation.
Pada proses koagulasi, pengurangan polutan dapat dicapai dengan cara penetralan muatan koloid dengan bertambahnya konsentrasi koagulan sehingga mengurangi gaya tolak antar partikel (Marriaga, 2014).
5. Parameter Perlakuan
Ada beberapa parameter yang memiliki efek terhadap persen efisiensi pada Elektrokoagulasi untuk mengurangi jumlah polutan dalam limbah yaitu:
a. Kombinasi pelat elektroda
Kombinasi pelat elektroda menentukan reaksi elektrokimia yang terjadi. Alumunium larut sebagai Al3+ , sedangkan besi dikatakan larut menjadi bentuk Fe2+
dan dapat teroksidasi menjadi Fe3+jika terdapat oksidan seperti oksigen dengan jumlah yang cukup dan pH nya alkali. Fe3+ memiliki kemampuan lebih optimum
19
Jenis elektroda menentukan logam mana yang terlarut kemudian meng-hasilkan spesi hidroksida yang berbeda. Hidroksida besi dan alumunium yang tersuspensi dapat menghilangkan polutan dari larutan dengan adsorpsi, presipitasi atau atraksi elektronik, yang kemudian diikuti dengan koagulasi (Vlachou, 2013). b. Waktu elektrokoagulasi
Koagulan yang terbentuk jumlahnya dipengaruhi oleh jumlah logam pada anoda yang terlarut. Waktu elektrokoagulasi memiliki pengaruh yang berbanding lurus dengan jumlah koagulan yang terbentuk berdasarkan persamaan Faraday:
� =� � �� �
Dimana m adalah massa (g) alumunium atau besi yang terlarut, M adalah massa molekul (g/mol) dari logam yang terarut, I adalah arus (A), t adalah waktu elektrolisis (s), dan z adalah jumlah elektron yang terlibat dalam reaksi, dan F adalah konstanta Faraday (96,485 C/mol) (de mello, 2013). Dari persamaan ini jelas terlihat bahwa semakin besar t maka m juga makin besar sehingga jika m makin banyak, koagulan yang terbentuk juga akan semakin banyak kemudian proses koagulasi dapat berjalan dengan optimum. Laju pembentukan koagulan ini bisa saja melebihi nilai teoritis karena faktor yang mempengaruhi tidak hanya waktu, misalnya yang berpengaruh besar adalah pH (Heffron, 2015).
c. pH
pH memiliki pengaruh terhadap konduktivitas larutan, pelarutan pada elektroda, spesiasi hidroksida, dan zeta-potensial pada partikel koloid. Kation alumunium dan besi, serta hidroksida menyebabkan destabilisasi koloid. Koagulan
20
tinggi Al(OH)4-dan Fe(OH)4- terbentuk dan ion ini memiliki kemampuan koagulasi
yang rendah (Vepsäläinen, 2012).
pH meningkat selama proses elektrolisis, namun pada pH yang sangat asam (pH 2), kebasaan yang terbentuk selama elektrolisis tidak cukup untuk meningkatkan pH larutan. Ketika pH inisial berada dalam kondisi asam, maka pH akhir setelah elektrolisis akan meningkat atau menuju basa dan ketika pH inisial berada pada kondisi basa, pH akhir akan turun atau menuju asam. Pada pH 2 dan pH 12, pH tidak berubah (Mouedhen, 2008). Menurut (Vepsäläinen, 2012) fenomena yang ditunjukkan pada penelitian (Mouedhen, 2008) dapat dipahami karena ketika pH di atas 9, pH akhir akan turun karena pembentukan [Al(OH)4]-.
d. Rapat Arus
21
6. Atomic Absorption Spectroscopy (AAS)
Prinsip metode AAS adalah absorpsi cahaya oleh suatu atom. Atom-atom akan menyerap cahaya pada panjang gelombang yang spesifik, tergantung pada unsur-nya (Kristianingrum, 2005: http://staff.uny.ac.id). AAS adalah teknik analisis yang mengukur konsentrasi suatu elemen. AAS sangat sensitif dan dapat mengukur sampai ke tingkat part per billion (ppb) (µg dm-3) dalam sampel. Teknik ini menggunakan panjang gelombang dari sinar yang spesifik diserap oleh suatu elemen. Energi tersebut sesuai dengan energi yang dibutuhkan untuk mempro-mosikan elektron dari satu level energi ke tingkat energi lainnya yang lebih tinggi.
Dalam AAS, sebagai contoh sampel (timbal) mengalami atomisasi dimana sampel diubah menjadi atom bebas pada keadaan ground state dalam fasa uap dan suatu sinar dari radiasi elektromagnetik yang diemisikan dari atom timbal pada sumber sinar yang tereksitasi akan melewati sampel yang tervaporasikan. Sebagian dari radiasi tersebut ada yang diserap oleh atom timbal dalam sampel. Semakin besar jumlah atom timbal dalam uap, maka radiasi yang diserap oleh sampel juga semakin besar. Jumlah sinar yang diserap sebanding dengan jumlah atom timbal.
22
Teknik pengukuran logam menggunakan AAS dapat dilakukan secara kualitatif dan kuantitatif. Analisa secara kualitatif cukup dilakukan pengujian sampel dengan instrumen AAS dan menjalankan pengukuran suatu logam, jika sampel menun-jukkan nilai absorbansi maka dapat dikatakan sampel tersebut mengandung logam yang diinginkan dengan catatan stansumber radiasi (Hollow Cathode Lamp) harus sesuai dengan logam yang diinginkan. Sedangkan analisa secara kuantitatif diten-tukan dari nilai absorbansi menggunakan persamaan dari hukum Lambert-Beer.
A = a.b.C Keterangan:
A = absorbansi
a = absortivitas molar B = tebal medium (cm) C = konsentrasi (ppm)
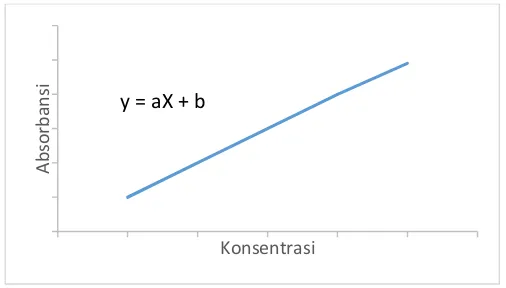
Rumus diatas menyatakan bahwa hubungan antara absorbansi dan konsentrasi berbanding lurus. Oleh karena itu, hubungan tersebut dapat dibuat kedalam bentuk kurva seperti pada Gambar 2.
Gambar 2. Grafik Hubungan Konsentrasi dengan Absorbansi
Ab
so
rb
an
si
Konsentrasi
[image:37.595.196.449.539.683.2]23
Gambar 2 adalah kurva kalibrasi yang menyatakan hubungan absorbansi pada sumbu Y dengan konsentrasi larutan standar pada sumbu X. Dengan mengukur absorbansi larutan standar dengan konsentrasi yang bervariasi dan dibuat grafik hubungan konsentrasi (sumbu X) dan absorbansi (sumbu Y) seperti Gambar 2 dan diperoleh persamaan y = ax + b; y = absorbansi; a = slope; x = konsentrasi; dan b = intersep. Konsentrasi sampel dapat dihitung menggunakan persamaan y = ax + b dengan memasukan nilai absorbansi yang terukur pada sampel kedalam nilai y (absorbansi) dengan demikian nilai x (konsentrasi) sampel dapat diketahui.
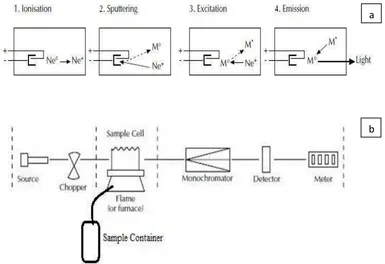
Skema pengukuran konsentrasi logam menggunakan AAS dapat diringkas sesuai Gambar 3. Pada gambar tersebut, bagian dengan nama source merupakan sumber sinar dan yang umum digunakan adalah Hollow Cathode Lamp (HCL). HCL terdiri dari tungsten anoda dan katoda yang terbuat dari elemen yang akan ditentukan. HCL ini ditutupi dengan tabung kaca yang diisi dengan gas inert seperti Neon atau Argon pada tekanan sekitar 1 Nm-2 dan 5 Nm-2. Ionisasi sejumlah atom gas terjadi dengan memberikan beda potensial sekitar 300-400 V pada anoda dan katoda. Gas yang terionisasi ini akan membombardir katoda dalam proses yang disebut pemercikan (sputtering). Atom-atom pada katoda yang terpercik akan berada dalam keadaan tereksitasi dan kemudian akan memancarkan radiasi karakteristik dari logam tersebut ketika kembali ke keadaan dasar (ground state). Proses terbentuknya sumber sinar diringkas dalam Gambar 3(a).
24
monokromator yang sudah diatur untuk menerima dan mentransmisikan radiasi pada panjang gelombang yang spesifik terhadap logam Pb kemudian meneruskannya ke detektor. Detektor mengukur intensitas sinar. Ketika sinar diserap oleh logam, intensitas sinar tersebut menurun. Detektor mencatat penurunan intensitas tersebut sebagai absorpsi dan data tersebut akan ditunjukkan pada alat keluaran. (Sevostianova: web.nmsu.edu).
[image:39.595.109.494.314.578.2]Berikut adalah gambar ringkasan proses yang terjadi dalam AAS
Gambar 3. Skema AAS: (a) Proses Terbentuknya Sumber Sinar pada HCL: (b) Ringkasan Skema AAS
Gambar 3 diambil dari leafet oleh Royal society of chemistry fine chemicals and medicinals group.
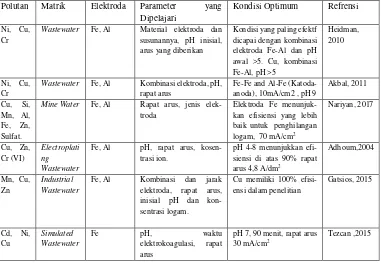
B. Penelitian yang Relevan
Penelitian tentang elektrokoagulasi sudah banyak dikembangkan untuk mengurangi kandungan logam tembaga dalam limbah, berikut adalah penelitian
a
25
[image:40.595.118.499.196.459.2]yang sudah dilakukan dalam usaha untuk mengurangi kadar logam tembaga dengan berbagai kondisi yang disajikan dalam Tabel 2.
Tabel 2. Penelitian Relevan Tentang Proses ELektrokoagulasi Pengurangan Logam Tembaga
Polutan Matrik Elektroda Parameter yang Dipelajari
Kondisi Optimum Refrensi
Ni, Cu, Cr
Wastewater Fe, Al Material elektroda dan susunannya, pH inisial, arus yang diberikan
Kondisi yang paling efektf dicapai dengan kombinasi elektroda Fe-Al dan pH awal >5. Cu, kombinasi Fe-Al, pH >5
Heidman, 2010
Ni, Cu, Cr
Wastewater Fe, Al Kombinasi elektroda, pH, rapat arus
Fe-Fe and Al-Fe (Katoda-anoda), 10mA/cm2 , pH 9
Akbal, 2011 Cu, Si,
Mn, Al, Fe, Zn, Sulfat.
Mine Water Fe, Al Rapat arus, jenis elek-troda
Elektroda Fe menunjuk-kan efisiensi yang lebih baik untuk penghilangan logam, 70 mA/cm2
Nariyan, 2017
Cu, Zn, Cr (VI)
Electroplati ng Wastewater
Fe, Al pH, rapat arus, kosen-trasi ion.
pH 4-8 menunjukkan efi-siensi di atas 90% rapat arus 4,8 A/dm2
Adhoum,2004
Mn, Cu, Zn
Industrial Wastewater
Fe, Al Kombinasi dan jarak elektroda, rapat arus, inisial pH dan kon-sentrasi logam.
Cu memiliki 100% efisi-ensi dalam penelitian
Gatsios, 2015
Cd, Ni, Cu
Simulated Wastewater
Fe pH, waktu
elektrokoagulasi, rapat arus
pH 7, 90 menit, rapat arus 30 mA/cm2
Tezcan ,2015
26
tembaga (II) adalah lebih dari 5, sedangkan pada Adhoum (2004) adalah 4-8 dan pada Tezcan (2015) adalah 7. Variasi rapat arus milik Akbal (2011), Nariyan (2017), Adhoum (2004), Tezcan (2015) berturut-turut adalah 4,8 mA/cm2, 10
mA/cm2, 70 mA/cm2, dan 30 mA/cm2. Rapat arus yang didapat bervariasi karena tiap limbah memerlukan optimasi kondisi elektrokoagulasi.
C. Kerangka Berpikir
Industri perak di Kotagede, Yogyakarta, menghasilkan produk komersil dan juga menghasilkan limbah cair. Limbah cair elektroplating mengandung anion serta kation yang berbahaya terhadap lingkungan. Tembaga (II) merupakan kation dalam limbah cair elekroplating yang juga berbahaya terhadap lingkungan sehingga perlu diolah dan dimanfaatkan.
Sesuai dengan Peraturan Menteri Lingkungan Hidup Republik Indonesia Nomor 5 Tahun 2014 Tentang Baku Mutu Air Limbah. Kandungan logam tembaga yang diperbolehkan dalam limbah cair elektroplating adalah sebesar 0,5 mg/L. Kadar logam tembaga melebihi batas yang diijinkan artinya dapat menimbulkan bahaya bagi lingkungan, sehingga diperlukan metode pengolahan libah. Pada penelitian berjudul “Optimasi Kondisi Proses Elektrokoagulasi Logam Kromium
27
28 BAB III
METODE PENELITIAN A. Subjek dan Objek Penelitian
1. Subjek Penelitian
Subjek pada penelitian ini adalah ion logam tembaga (II) dalam limbah cair elektroplating.
2. Objek Penelitian
Objek dalam penelitian ini adalah persen efisiensi pengurangan ion logam tembaga (II) melalui elektrokoagulasi dalam limbah cair elektroplating.
B. Variabel Penelitian 1. Variabel Bebas
a. Kombinasi elektroda (Katoda-Anoda; Fe-Fe, Fe-Al, Al-Fe, Al-Al) b. Waktu elektrokoagulasi (30, 60, 90, 120 menit)
c. Variasi pH sistem (inisial, 4, 8, 10, 10,5)
d. Variasi rapat arus sebesar 1,25; 3,75; 6,25; dan 8,75 mA/ cm2. 2. Variabel Kontrol
Variabel kontrol dalam penelitian ini adalah: a. Pelat besi (7,5 x 4 x 0,5 cm)
b. Pelat alumunium (7,5 x 4 x 0,3 cm) c. Suhu (suhu ruang 28 oC)
29 g. Kecepatan pengadukan 200 rpm h. Ukuran magnetic bar 4 cm
i. Sumber limbah berasal dari pengrjain perak di Kotagede, Yogyakarta yang diambil pada tanggal 19 Maret 2016
3. Variabel Terikat
Persen efisiensi penurunan kadar ion logam tembaga (II) dalam limbah cair elektroplating.
C. Instrumen Penelitian
1. Alat-alat yang digunakan adalah:
a. AAS (Atomic Absorption Spectroscopy) b. DC Power Supply
c. Magnetic stirrer d. Neraca ohaus e. Gelas kimia 1 L f. Labu takar 500 mL g. Termomete
h. pH meter digital i. Capit buaya j. Amplas
30 2. Bahan yang digunakan adalah:
a. Limbah cair elektroplating dari Kotagede, Yogyakarta. b. Larutan buffer 4, 7, dan 10
c. Kertas saring whatman no.42
d. Elektroda Fe dan Al ( 15 x 3 x 0,3 cm) e. Aseton
f. Larutan NH3
g. Wrap plastic h. Akuades
i. Larutan NH3 2 M
D. Skema Rangkaian Alat Penelitian
Rangkaian alat elektrokoagulasi dimana A adalah sumber tegangan DC, B adalah magnetic stirrer, dan C reaktor yang berupa gelas kimia berukuran 1 L yang berisi 500 mL limbah cair elektroplating serta 2 buah elektroda (katoda-anoda).
E. Prosedur Penelitian
1. Pengambilan Sampel Limbah Cair Elektroplating
31
ditampung dalam wadah berukuran 25 L sebanyak 2 buah dan sampel pada 2 wadah berukuran 25 L dihomogenkan dengan cara dicampur dan digojok.
2. Karakterisasi Limbah Cair Elektroplating
Limbah yang telah dihomogenkan kemudian dikarakterisasi sifat kimia dan fisikanya, karakterisasi sifat fisika dilakukan untuk mendapatkan data berupa warna limbah, suhu, bau, dan kekeruhan, sedangkan sifat kimia limbah cair yang ditentukan seperti kandungan anion, logam berat, kesadahan, DO, pH. Karakterisasi limbah cair elektroplating dan elektroda ditujukan untuk mendapatkan gambaran awal kondisi limbah cair baik secara kimia maupun fisikanya. Karakterisasi dilakukan di Balai Laboratorium Kesehatan Yogyakarta. Data kadar ion logam tembaga (II) dalam limbah cair merupakan data kadar awal ion logam tembaga (II) dalam limbah yang diuji menggunakan AAS.
3. Optimasi Kombinasi Elektroda
a. Sebanyak 500 mL sampel limbah cair elektroplating dimasukan ke dalam gelas kimia berukuran 1 L dan magnetic bar berukuran 4 cm juga turut serta dimasukan.
b. Gelas kimia yang berisi 500 mL limbah dan magnetic bar berukuran 4 cm ditaruh di atas magnetic stirrer.
c. Suhu dan pH diukur terlebih dahulu sebelum proses sebagai data awal d. Dirangkai elektroda Fe-Fe sebagai katoda-anoda dengan luas elektroda yang
tercelup sebesar 16 cm2atau 4 x 4 cm2 dan jarak antar elektroda diatur sejauh
32
alat bantu dilapisi dengan plastic wrap guna mencegah terjadinya induksi. e. Elektroda disambungkan dengan sumber tegangan DC.
f. Magnetic stirrer diputar dengan kecepatan pada skala 7 (dalam alat) atau sekitar 200 rpm.
g. Potensial pada alat sumber tegangan DC diatur sebesar 1 Volt dan waktu ketika sumber tegangan DC dinyalakan mulai dihitung.
h. Proses elektrokoagulasi dijalankan selama 60 menit.
i. Setelah proses selesai perubahan diamati dan pH diukur kembali sebagai data akhir.
j. Limbah hasil elektrokoagulasi disaring menggunakan kertas saring whatman no.42 dan residu atau flok yang tertinggal di kertas saring dikeringkan dengan dioven pada suhu 70oC.
k. Filtrat diambil 50 mL untuk diukur kadar ion logam tembaga (II) akhir menggunakan AAS untuk mendapatkan kadar akhir ion logam tembaga (II). l. Langkah –langkah tersebut diulangi dengan perlakuan yang sama untuk
kombinasi elektroda yang lainnya (Al-Fe, Fe-Al, Al-Al). 4. Optimasi Waktu Elektrokoagulasi
a. Sebanyak 500 mL sampel limbah cair elektroplating dimasukan ke dalam gelas kimia berukuran 1 L dan magnetic bar berukuran 4 cm juga turut serta dimasukan.
b. Gelas kimia yang berisi 500 mL limbah dan magnetic bar berukuran 4 cm ditaruh di atas magnetic stirrer.
33
d. Rangkai elektroda, atur pH menggunakan variasi yang optimum pada optimasi sebelumnya dengan luas elektroda yang tercelup sebesar 16 cm2 atau 4 x 4 cm2 dan jarak antar elektroda diatur sejauh 1 cm. Pengaturan
elektroda dilakukan dengan membuat alat bantu yang diatur agar jarak elektroda dan luasan yang tercelup konstant. Bagian ujung alat bantu dilapisi dengan plastic wrap guna mencegah terjadinya induksi.
e. Elektroda disambungkan dengan sumber tegangan DC.
f. Magnetic stirrer diputar dengan kecepatan pada skala 7 (dalam alat) atau sekitar 200 rpm.
g. Potensial pada alat sumber tegangan DC diatur sebesar 1 Volt dan waktu ketika sumber tegangan DC dinyalakan mulai dihitung.
h. Proses elektrokoagulasi dijalankan selama 60 menit.
i. Setelah proses selesai perubahan diamati dan pH diukur kembali sebagai data akhir.
j. Limbah hasil elektrokoagulasi disaring menggunakan kertas saring whatman no.42 dan residu atau flok yang tertinggal di kertas saring
dikeringkan dengan dioven pada suhu 70oC.
k. Filtrat diambil 50 mL untuk diukur kadar ion logam tembaga (II) akhir menggunakan AAS untuk mendapatkan kadar akhir ion logam tembaga (II). l. Langkah-langkah tersebut diulangi dengan perlakuan yang sama untuk
kombinasi elektroda yang lainnya (Al-Fe, Fe-Al, Al-Al). 5. Optimasi pH
34
gelas kimia berukuran 1 L dan magnetic bar berukuran 4 cm juga turut serta dimasukan.
b. Gelas kimia yang berisi 500 mL limbah dan magnetic bar berukuran 4 cm ditaruh di atas magnetic stirrer.
c. Suhu dan pH diukur terlebih dahulu sebelum proses sebagai data awal d. Rangkai elektroda menggunakan variasi yang optimum pada optimasi
sebelumnya dengan luas elektroda yang tercelup sebesar 16 cm2atau 4 x 4 cm2 dan jarak antar elektroda diatur sejauh 1 cm. Pengaturan elektroda
dilakukan dengan membuat alat bantu yang diatur agar jarak elektroda dan luasan yang tercelup konstant. Bagian ujung alat bantu dilapisi dengan plastic wrap guna mencegah terjadinya induksi.
e. Elektroda disambungkan dengan sumber tegangan DC.
f. Magnetic stirrer diputar dengan kecepatan pada skala 7 (dalam alat) atau sekitar 200 rpm.
g. Atur pH menggunakan NH3 2 M sampai pH 4.
h. Potensial pada alat sumber tegangan DC diatur sebesar 1 Volt dan waktu ketika sumber tegangan DC dinyalakan mulai dihitung.
i. Proses elektrokoagulasi dijalankan selama variasi waktu yang optimum pada optimasi waktu elektrokoagulasi.
35
k. Limbah hasil elektrokoagulasi disaring menggunakan kertas saring whatman no.42 dan residu atau flok yang tertinggal di kertas saring
dikeringkan dengan dioven pada suhu 70oC.
l. Filtrat diambil 50 mL untuk diukur kadar ion logam tembaga (II) akhir menggunakan AAS untuk mendapatkan kadar akhir ion logam tembaga (II). m. Langkah-langkah tersebut diulangi dengan perlakuan yang sama untuk
variasi pH yang lain (inisial, 8, 10, 10,5).
6. Optimasi Rapat Arus
a. Sebanyak 500 mL sampel limbah cair elektroplating dimasukan ke dalam gelas kimia berukuran 1 L dan magnetic bar berukuran 4 cm juga turut serta dimasukan.
b. Gelas kimia yang berisi 500 mL limbah dan magnetic bar berukuran 4 cm ditaruh di atas magnetic stirrer.
c. Suhu dan pH diukur terlebih dahulu sebelum proses sebagai data awal d. Rangkai elektroda, atur pH menggunakan variasi yang optimum pada
optimasi sebelumnya dengan luas elektroda yang tercelup sebesar 16 cm2 atau 4 x 4 cm2 dan jarak antar elektroda diatur sejauh 1 cm. Pengaturan elektroda dilakukan dengan membuat alat bantu yang diatur agar jarak elektroda dan luasan yang tercelup konstant. Bagian ujung alat bantu dilapisi dengan plastic wrap guna mencegah terjadinya induksi.
e. Elektroda disambungkan dengan sumber tegangan DC.
36 sekitar 200 rpm.
g. Potensial pada alat sumber tegangan DC diatur sebesar 1 Volt dengan kuat arus 0.02 A dan waktu ketika sumber tegangan DC dinyalakan mulai dihitung.
h. Proses elektrokoagulasi dijalankan selama variasi waktu yang optimum pada optimasi waktu elektrokoagulasi.
i. Setelah proses selesai perubahan diamati dan pH diukur kembali sebagai data akhir.
j. Limbah hasil elektrokoagulasi disaring menggunakan kertas saring whatman no.42 dan residu atau flok yang tertinggal di kertas saring dikeringkan dengan dioven pada suhu 70oC.
k. Filtrat diambil 50 mL untuk diukur kadar ion logam tembaga (II) akhir menggunakan AAS untuk mendapatkan kadar akhir ion logam tembaga (II). l. Langkah-langkah tersebut diulangi dengan perlakuan yang sama untuk
variasi rapat arus yang lain (1,25; 3,75; 6,25; 8,75 mA/cm2). F. Teknik Analisis Data
1. Data hasil karakterisasi limbah cair elektroplating yang diuji di Balai Laboratorium Kesehatan Yogyakarta dibandingkan dengan Baku Mutu Limbah Cair untuk Industri Pelapisan Logam Peraturan Gubernur Provinsi DIY No:7 Tahun 2010 agar dapat diketahui apakah limbah cair elektroplating dalam penelitian ini aman atau tidak jika dibuang ke lingkungan.
37
Efisiensi % =C − CC x %
Keterangan:
Co : Konsentrasi ion logam tembaga (II) awal C1 : Konsentrasi ion logam tembaga (II) akhir
38 BAB IV
HASIL DAN PEMBAHASAN
Penelitian yang berjudul “Optimasi Kondisi Proses Elektrokoagulasi Ion
Logam Tembaga (II) dalam Limbah Cair Elektroplating” bertujuan untuk menge -tahui karakter limbah cair elektroplating serta mendapatkan kondisi optimum pengurangan ion logam tembaga (II) menggunakan metode elektrokoagulasi dengan memvariasi beberapa parameter seperti kombinasi elektroda, waktu elektrokoagulasi, pH, dan rapat arus dengan melihat persen efisiensi dalam limbah cair elektroplating. Limbah cair elektroplating yang diambil dari salah satu kerajinan perak di Kotagede, Yogyakarta berwarna biru agak kehijauan dan limbah tidak berbau.
A. Karakterisasi Limbah Cair Elektroplating
Karakterisasi limbah cair elektroplating ini dilakukan guna mengetahui kondisi limbah secara fisika dan kimia serta untuk mengetahui kadar awal ion logam tembaga (II) dalam limbah. Karakterisasi dilakukan di Balai Laboratorium Kesehatan Yogyakarta. Limbah yang didapat dari pengrajin perak ditampung dalam 2 wadah berukuran 25 L dan telah dihomogenkan. Sebanyak 1,5 L sampel yang telah dihomogenkan diambil dan ditaruh dalam wadah berukuran 2 liter untuk dibawa ke Balai Laboraotirum Kesehatan Yogyakarta. Parameter yang diuji berupa sifat fisika seperti bau, kekeruhan, warna, suhu dan sifat kimia seperti kandungan anion, logam-logam berat, DO, pH.
39
Pelapisan Logam Peraturan Gubernur Propinsi DIY No 7: Tahun 2010 adalah Cd, Pb, Zn, Cu. Kondisi limbah secara fisik yaitu tidak berbau, tidak keruh dan berwarna biru. Dari hasil krakterisasi, kadar awal ion logam tembaga (II) dalam limbah adalah 11,3455 ppm dan 14,196 ppm. Kadar awal ion logam tembaga (II) dilakukan 2 kali pengujian di Balai Laboratorium Kesehatan Yogyakarta pada tanggal 19 Maret 2016 dan 26 Juli 2016. Hasil pengujian pertama sebesar 11, 3455 ppm dan digunakan sebagai kadar awal untuk optimasi kombinasi elektroda kemudian sampel yang digunakan diuji kembali kadar ion logam tembaga (II) dan didapatkan kadar awal yang berbeda.
B. Optimasi Kombinasi Elektroda
Pada optimasi kombinasi elektroda diharapkan hasil yang optimum dalam proses pengurangan kadar ion logam tembaga (II) pada limbah cair elektroplating. Variasi yang diberikan adalah (Al-Al, Al-Fe, Fe-Fe, Fe-Al) sebagai katoda-anoda, sedangkan kondisi yang dikontrol dalam sistem adalah volum limbah 500 mL, pH 2,5, potensial 1 Volt, rapat arus 1,25 mA/cm2, waktu elektrokoagulasi 60 menit,
40
demikian, elektroda Fe berperan sebagai anoda, maka reaksi yang terjadi pada anoda adalah pelarutan besi menghasilkan ion Fe2+ dan atau Fe3+.
Fe(S) → Fen+(aq)+ ne- (9)
Koagulan yang berperan berasal dari hidroksida Fe. Ion Fe (Fe2+/Fe3+) akan bereaksi dengan ion hidroksida (OH-) yang berasal dari elektrolisis air pada katoda membentuk hidroksida Fe(OH)2 atau Fe(OH)3 .
Fe terlarut menghasilkan 80 % Fe2+. Dengan demikian, jumlah Fe3+
sangatlah sedikit (Ben Sasson: 2009). Hidroksida dari Fe2+ memiliki performa lebih rendah dibanding dengan Fe3+ sebagai koagulan karena solubilitas hidroksida Fe2+ lebih tinggi dan kurang bermuatan positif (Vepsäläinen, 2012). Persen efisiensi yang didapat sangat rendah dikarenakan kecepatan oksidasi Fe2+ menjadi Fe3+ berkurang. Kecepatan oksidasi Fe2+ menjadi Fe3+ dipengaruhi oleh pH. Dalam
media asam Fe2+ teroksidasi sangat lambat, sedangkan dalam pH netral dan mendekati alkali, oksidasi Fe2+ menjadi Fe3+ lebih cepat (Nepo, 2016). Ben Sasson dalam (2009) mempelajari oksidasi Fe2+, menurut hasil studi mereka, pada pH 5 tidak terjadi oksidasi Fe2+ menjadi Fe3+ yang signifikan, pada pH 6 oksidasi meningkat dibanding pH 5 dan pada pH 7-9 oksidasi Fe sangatlah cepat. Sampel limbah cair elektroplating pada penelitian ini pada optimasi kombinasi elektroda memiliki pH di bawah 3, maka oksidasi Fe2+ menjadi Fe3+ sangat lambat.
Menurut Gnanaprakash (2007) endapan Fe(OH)2 mulai terbentuk pada pH
di atas 7, sedangkan pada pH 2 endapan Fe(III) sudah terbentuk (Inagaki: 2009). Fe3+ bereaksi dengan ion OH- yang terbentuk dari elektrolisis air pada katoda
41
10-39 sedangkan Fe(OH)2 dengan harga Ksp Fe(OH)2 sebesar 4,9 x 10-17 dan
Al(OH)3 dengan harga Ksp sebesar 1,9 x 10-33 tidak mampu membentuk endapan
hidroksida pada pH dibawah 3. Oleh karena itu, koagulan yang berperan pada optimasi kombinasi elektroda berasal dari hidroksida Fe(III). Selain itu, warna endapan yang terbentuk pada optimasi elektroda adalah merah kecoklatan seperti yang ditunjukkan Gambar 7. Menurut Moreno (2009) warna dari Fe(OH)3 adalah
merah-coklat sehingga kedua hal ini dapat membuktikan bahwa koagulan yang terbentuk pada optimasi kombinasi elektroda hanyalah hidroksida dari Fe(III) yang pada pH asam berjumlah sedikit.
Mekanisme yang terjadi adalah adsorpsi karena koagulan Fe(OH)3 pada
optimasi kombinasi elektroda bermuatan positif. Inagaki (2009) mengatakan bahwa muatan pada permukaan hidroksida bergantung pada pH lingkungan. Jika pH lingkungan di atas titik isoelektriknya maka muatan pada permukaan hidroksida adalah bermuatan negatif. Titik isoelektrik Fe(OH)3 adalah pH 8,5 dan pH limbah
2,5 sehingga muatan pada koagulan Fe(OH)3 adalah positif dimana koagulan ini
efektif untuk mengadsoprsi polutan bermuatan negatif. Limbah tembaga dalam limbah cair elektroplating berbentuk koloid bermuatan negatif karena pada umumnya polutan pada air berbentuk partikel koloid (Vepsäläinen: 2012).
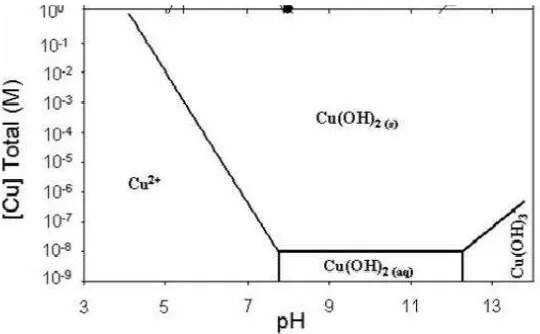
Mekanisme pengurangan kadar ion logam tembaga (II) pada optimasi kombinasi elektroda bukanlah pembentukan hidroksida (presipitasi) tembaga karena Cu yang memiliki Ksp = 4,8x10-20 akan membentuk endapan Cu(OH)2 pada
pH 7,5-12,3 dengan konsentrasi lebih dari 10-8 M, sesuai dengan data solubilitas
-42
[image:57.595.195.465.166.333.2]pada katoda, namun kenaikan pH ini tidak cukup untuk membentuk endapan Cu(OH)2 karena pH sistem masih sangat asam.
Gambar 8. Spesiasi Tembaga pada pH dan Konsentrasi Tertentu
Gambar 8 diambil dari Albrecht (2011). Pada optimasi kombinasi elektroda, gelembung pada katoda terjadi pada menit pertama. Gelembung pada elektroda Al tersebut adalah gelembung dari gas hidrogen sesuai dengan persamaan (5).
Gelembung gas yang terbentuk akan mengangkat polutan yang sudah terakumulasi membentuk flok ke permukaan limbah. Pada menit ke-31 limbah yang semula berwarna biru seperti yang ditunjukkan Gambar 3. menjadi tak berwarna seperti yang ditunjukkan pada Gambar 10.
C. Optimasi Waktu Elektrokoagulasi
43
Pada optimasi waktu elektrokoagulasi, jenis elektroda yang digunakan adalah Al-Fe karena Al-Fe merupakan kombinasi optimum dalam pengurangan kadar ion logam tembaga (II) dalam limbah. Setelah proses elektrokoagulasi maka akan didapat kadar akhir ion logam tembaga (II). Data kadar awal dan akhir digunakan dalam perhitungan persen efisiensi.
cair elektroplating adalah 120 menit dengan persen efisiensi sebesar 25,74 %. Koagulan yang terbentuk semakin banyak seiring bertambahnya waktu sehingga polutan makin banyak yang dijerap oleh koagulan yang terbentuk dari proses elektrokoagulasi. Jumlah koagulan yang terbentuk akibat pelarutan logam pada anoda mengikuti persamaan Faraday.
� =� � �� � (10)
Dimana m adalah (g) alumunium atau besi yang terlarut, M adalah berat molekul (g/mol) dari logam yang terarut, I adalah arus (A), t adalah waktu elektrolisis (s), dan z adalah jumlah elektron yang terlibat dalam reaksi, dan F adalah konstanta Faraday (96,485 C/mol) (de mello, 2013). Dari persamaan Faraday ini dapat dilihat bahwa hubungan antara waktu (t) dan jumlah logam terlarut (m) adalah berbanding lurus yang berarti semakin lama waktu proses maka logam terlarut dan koagulan yang terbentuk juga makin banyak. Laju pembentukan koagulan bisa melebihi nilai teoritis karena faktor yang memengaruhi tidak hanya waktu, misalnya yang berpengaruh besar adalah pH (Heffron, 2015).
44
F-. Ion F- bersaing dengan tembaga untuk berinteraksi terhadap situs aktif dari adsorben yang terbentuk secara elektrokimia (Vasudevan, 2012) sehingga dapat mengurangi laju pengurangan ion logam tembaga (II) pada waktu yang relatif singkat seperti 30, 60 menit. Molekul oksigen dapat terbentuk pada anoda dan bereaksi dengan ion logam menghasilkan produk yang tidak larut pada permukaan elektroda yang menyebabkan pasivasi serta mengurangi kecepatan disolusi pada anoda (Marriaga, 2014).
D. Optimasi pH
Pada optimasi pH elektrokoagulasi diharapkan kondisi pH yang optimum dalam proses pengurangan kadar ion logam tembaga (II) pada limbah cair elektroplating. Tujuan dari pengaturan pH pada optimasi pH adalah agar limbah memiliki nilai pH tertentu sebelum dimulainya proses elektrokoagulasi atau sebelum dialiri arus listrik, selain itu tujuan lainnya adalah mengetahui efek pH berbeda-beda terhadap proses pengurangan ion logam tembaga (II). Variasi yang diberikan ialah pH inisial, 4, 8, 10, 10,5. Kondisi yang dikontrol dalam sistem adalah volum limbah 500 mL, waktu elektrokoagulasi 120 menit, potensial 1Volt, rapat arus 1,25 mA/cm2, kombinasi elektroda Al-Fe (katoda-anoda), kecepatan pengadukan 200 rpm, suhu 280C, jarak elektroda 1cm.
45
pH memberikan efek terhadap pengurangan kadar logam karena ion OH -yang diproduksi dari katoda akan meningkatkan pH dalam sistem dan dapat menyebabkan presipitasi Cu2+ dalam bentuk hidroksida yang sesuai. Hidroksida yang terbentuk dapat menyebabkan kopresipitasi. Selain akibat dari proses adsorpsi dan penetralan muatan oleh koagulan, Kopresipitasi juga dapat mengurangi jumlah polutan (Adhoum, 2010).
Pengaturan pH dengan penambahan basa dapat menyebabkan presipitasi logam sebelum proses elektrokoagulasi berlangsung sehingga mengakibatkan konsentrasi awal limbah berkurang dan pH inisial bertambah (Hanay, 2011). Konsentrasi Cu2+ berkurang akibat presipitasi oleh penambahan basa maka efek konsentrasi logam dalam optimasi pH juga berpengaruh. Bertambahnya kosentrasi menurut El Ashtoukhy (2010) mengakibatkan penurunan persen efisiensi, hal ini terjadi karena rapat arus yang digunakan tidak berubah sehingga laju pembentukan koagulan dan pembentukan gas hidrogen konstan, karenanya kapasitas adsorpsi koagulan atau jumlah koagulan yang terbentuk tetap, tidak dipengaruhi oleh konsentrasi logam. Oleh karena itu, jika konsentrasi awal logam berkurang maka penurunan atau persen efisiensi akan bertambah.
Pada optimasi pH, penambahan NH3 2 M sedikit demi sedikit dilakukan
sebagai pengaturan pH. Terbentuk endapan berwarna biru seperti yang ditunjukkan pada Gambar 13a ketika pH diatur menjadi pH 8. Warna biru tersebut adalah Cu(OH)2(S) sesuai dengan reaksi (11) dan ketika pengaturan pH 10,5 warna larutan
46
kesetimbangan yang terjadi pada sistem seperti persamaan reaksi (11-12) (Clark, 2017:http://www.chemguide.co.uk).
[Cu(H2O)6]2+(aq) + 2NH3(aq)⇋[Cu(H2O)4(OH)2](s)+ 2NH4+(aq) (11)
[Cu(H2O)6]2+(aq)+ 4 NH3(aq)⇋ [Cu(NH3)(H2O)2]2+(aq)+ 4H2O(l) (12)
Efek dari pengaturan pH pada pH 8 dapat menyebabkan presipitasi Cu(OH)2
sehingga pada optimasi pH efek penambahan NH3 atau basa bukan saja akan
mempengaruhi kondisi limbah yang menyebabkan efek berbeda-beda terhadap reaksi-reaksi pada elektrokoagulasi namun juga menyebabkan berkurangnya kadar awal limbah yang memberikan efek lain terhadap proses pengurangan ion logam tembaga (II) yaitu ketika kadar awal limbah berkurang dengan pemberian arus tetap maka persen efisiensinya akan bertambah.
E. Optimasi Rapat Arus
Pada optimasi rapat arus diharapkan kondisi optimum untuk pengurangan kadar ion logam tembaga (II) pada limbah cair elektroplating. Variasi yang diberikan adalah 1,25; 3,75; 6,25; 8,75 mA/cm2. Kondisi yang dikontrol dalam
sistem adalah volum limbah 500 mL, pH 8, potensial 1V, waktu elektrokoagulasi 120 menit, kombinasi elektroda Al-Fe (katoda-anoda), kecepatan pengadukan 200 rpm, suhu 280C, dan jarak elektroda 1cm.
47
elektrokoagulasi. Data kadar awal dan akhir digunakan dalam perhitungan persen efisiensi.
Pada penelitian Akbal (2011), Heidman (2010), Adhoum (2004), diketahui bahwa dengan bertambahnya rapat arus maka persen efisiensi penghilangan logam juga bertambah. Rapat arus menurut Wided (2014) berperan penting dalam mengatur laju reaksi dalam reaktor elektrokimia. Ketika rapat arus bertambah, waktu proses berkurang karena pada elektroda terjadi pelarutan yang kuat. Hal ini mengakibatkan destabilisasi polutan lebih lanjut begitu juga kenaikan produksi gas hidrogen yang ukurannya berkurang seraya bertambahnya rapat arus.
Peranan rapat arus dalam penelitian Nepo (2017) adalah berfungsi untuk menentukan dosis koagulan pada anoda dan gas hidrogen pada katoda dimana hubungannya terkait dalam hukum Faraday. Densitas dari gelembung yang terben-tuk mempengaruhi sistem hidrodinamik dan akan mempengaruhi transfer massa antara polutan, koagulan, dan gelembung-gas mikro, pada akhirnya akan terjadi laju tumbukan (collision rate) dari partikel yang terkoagulasi sehingga menghasilkan flok. Rapat arus juga memengaruhi terbentuknya spesies logam ter-hidrolisis akibat
perubahan pH selama proses elektrokoagulasi. Arus muncul untuk menghasilkan lingkungan kimia yang secara langsung mengatur mekanisme koagulasi/flokulasi dan menyokong elektromigrasi dari ion dan koloid bermuatan (Nepo, 2017).
48
pemberian potensial yang lebih besar, reaksi samping juga dapat terjadi, yaitu elektrolisis pada anoda membentuk gas oksigen (Heffron, 2013).
2H2O →O2(g) +4H+ +4e- (13)
Gas oksigen akan bereaksi dengan Fe dan menghasilkan FeO(s) yang merupakan spesies tidak mudah larut dan dapat mengurangi laju pelarutan (Mariaga, 2014) sehingga dosis koagulan berkurang dan keefektifannya juga berkurang.
Persen efisiensi dalam penelitian ini berangsur turun ketika rapat arus ditambah, hal ini bertentangan dengan teori dari Feryal Akbal (2011) namun hal ini juga dapat dijelaskan sesuai dengan teori dari Nepo (2017) bahwa rapat arus yang disarankan berkisaran 2-2,5 mA/cm2. Rapat arus optimum pada optimasi ini tidak berada dalam range tersebut namun masih mendekati range. Begitu juga pada rapat arus 3,75 mA/cm2.
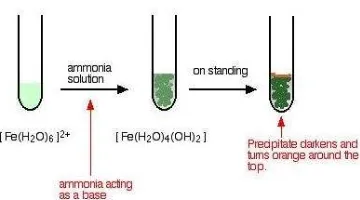
Limbah pada optimasi rapat arus diatur pada pH 8 dan menjadi berwarna biru seperti pada Gambar 13a dan setelah proses elektrokoagulasi warna larutan berangsur-angsur berubah warna. Perubahan warna tersebut adalah reaksi pengomplek ion besi dengan amonia.
49
Gambar 16. Reaksi Ion Fe2+ Terhidrat dengan Amonia
Gambar 16 diambil dari chem.libretexts.