BAB II
TINJAUAN PUSTAKA
2.1. Pengertian air secara umum
Mutu air adalah kadar air yang diperbolehkan dalam zat yang akan digunakan.Air murni adalah air yang tidak mempunyai rasa, warna dan bau, yang terdiri dari hitrogen dan oksigen dengan rumus kimia H2O. Karena air yang bersifat universal, maka yang paling alamiah maupun buatan manusia hingga tingkat tertentu ada zat yang terlarut didalamnya. Disamping itu akibat daur hidrologi, air juga mengandung berbagai zat lain termasuk gas. Zat-zat ini sering disebut pencemaran yang terdapat didalam air.
Dalam penelitian mutu air, pencemaran didalam air biasanya diklasifikasikan atas fisik,kimiawi dan biologis.
1. Sifat-sifat fisik dalam air
Sifat-sifat fisik yang utama dalam air adalah : a. Kekeruhan
b. Warna c. Rasa dan bau d. Suhu
Kekeruhan mengurangi kejernihan air yang diakibatkan oleh pencemaran- pencemaran yang terjadi di dalam air, kekeruhan biasanya diakibatkan oleh lempeng, partikel-partikel tanah dan pencemaran-pencemaran koloid lainnya.
Tingkat kekeruhan tergantung pada kehalusan partikel dan konsentrasinya.
Standart untuk perbandingan adalah turbiditas. Kekeruhan diukur dengan suatu alat potensiometer yang mengukur gangguan cahaya melalui contoh air.
Air kadang-kadang mengandung warna yang diakibatkan oleh jenis-jenis tertentu dari bahan organik yang terlarut dan koloid yang terbilas dari tanah dan tumbuh-tumbuhan yang membusuk. Intensitas warna diukur dengan perbandingan visual contoh air yang bersangkutan dengan menggunakan tabung-tabung nesler yaitu tabung-tabung gelas yang terisi dengan intensitas warna yang berbeda.
Rasa dan bau didalam air disebabkan oleh adanya bahan organik yang membusuk atau bahan kimia yang menguap. Suhu air merupakan hal yang penting jika dikaitkan dengan tujuan penggunaan dan pengolahannya. Suhu air bervariasi menurut kedalaman dan sumber airnya.
2. Sifat-sifat kimiawi dari air
Sebagai indikator keasaman atau kebasaan air diambil nilai pH, yang menurut Sorensen didefenisikan sebagai logaritma dari konsentrasi ion hydrogen dengan diberi ion negatif atau logaritma dari kebalikan konsentrasi ion hydrogen dengan nol per liter.
Nilai pH air biasanya diperoleh dengan alat potensometer yang mengandung indikator universal sebagai petunjuk warna.
Alkalinitas didalam air disebabkan oleh ion-ion karbonat (CO3-2
), Bikarbonat (HCO3-) dan hidroksida (OH-). Dalam air tanah alkalinitas sebagian besar diakibatkan oleh adanya bikarbonat dan sisanya adalah karbonat. Pada
keadaan tertentu atau pada siang hari adanya ganggang dan lumut dalam air menyebabkan turunnya kadar karbondioksida dan bikarbonat. Dalam keadaan seperti ini jika kadar karbonat dan hidroksida naik menyebabkan pH Larutan naik.
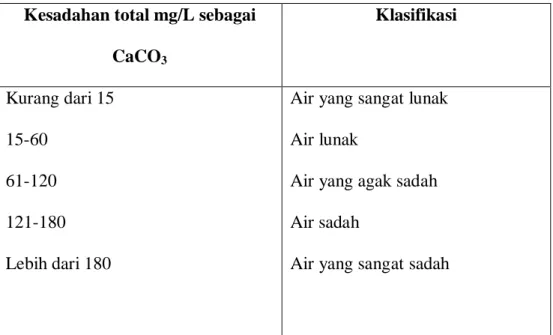
Kalsium dan magnesium adalah gangguan yang utama penyebab kesadahan air. Kesadahan dinyatakan dengan mg/L sebagai kalsium karbonat.
Tabel 1 : Perbandingan air berdasarkan tingkat kesadahan.
Kesadahan total mg/L sebagai CaCO3
Klasifikasi
Kurang dari 15 15-60
61-120 121-180 Lebih dari 180
Air yang sangat lunak Air lunak
Air yang agak sadah Air sadah
Air yang sangat sadah
3. Sifat-sifat biologis air
Mikroorganisme biasanya terdapat dalam permukaan, tetapi umumnya tidak dan terdaftar pada kebanyakan air tanah karena penyaringan oleh Akiver yang dapat membuat air keruh dan jumlah mikroorganisme dapat dihilangkan atau dikurangi dengan cara Klorinasi, yaitu dengan penambahan klorin(Cl2) kedalam air.
Persyaratan air minum tidak saja harus jernih, tetapi juga harus bebas dari bakteri pathogen (yang menyebabkan penyakit). Dengan cara disinveksi, bakteri pathogen dapat dihilangkan, dan jumlah mikroorganisme dapat dikurangi, yang dapat digunakan dalam pengurangan jumlah mikroorganisme adalah klorinasi, yaitu dengan menambahkan klorin (Cl2) dalam air.
2.2. Pengolahan Air
Zat-zat pencemar didalam air dapat dihilangkan dengan melakukan metode pengolahan secara fisik maupun kimiawi.
1. Metode pengolahan fisik
Metode pengolahan fisik yang sering digunakan adalah:
a. Flokulasi
Flokulasi dilakukan dengan baik yang diberi pengaduk horizontal atau partikel. Penngadukan ini berputar pelan yang tujuannya memperbesar ukuran flok, tetapi juga mencegah jangan sampai endapan yang terbentuk mengendap ke bawah, untuk memperbesar ukuran flok ini ditambahkan bahan-bahan pengental kedalam air yang mengandung kekeruhan. Untuk membentuk kumpulan partikel yang mengendap ini dilakukan pengadukan cepat selama 20-30 menit yang akan menyebabkan tumpukan partikel yang akan membentuk ukuran partikel yang lebih besar.
b. Sedimentasi
Sedimentasi adalah suatu cara penjernihan air, dimana air dilewatkan pada suatu bak, untuk jangka waktu tertentu, Dimana air mengalir pelan-pelan (kecepatan rendah) sehingga partikel yang berat jenisnya lebih besar akan segera mengendap.
c. Filtrasi
Filtrasi adalah suatu cara penjernihan air dengan cara penyaringan. Filter biasanya terdiri dari berbagai lapisan pasir dan batu-batuan dengan diameter yang bervariasi dari yang sangat halus hingga terkasar. Air akan mengalir melalui filter sedangkan partikel-partikel yang tersuspensi didalamnya akan melekat pada butiran pasir. Hal ini akan memperkecil ukuran celah-celah yang dapat dilalui air dan akan mengurangi daya penyaringan. Maka untuk mengaktifkan kembali, filter dicuci kembali dengan membuang bahan-bahan yang akan melekat ini diperlukan pembilas dengan arah aliran pembilas berlawanan dengan arah aliran air yang akan disaring, pembilas ini dinamakan backwash.
2. Metode pengolahan kimiawi
Metode pengolahan kimiawi yang sering digunakan adalah : a. Koagolasi
Koagulasi adalah mekanisme dimana partikel-partikel koloid yang bermuatan negatif akan dinetralkan, sehingga muatan yang netral tersebut saling mendekat dan menempel satu sama lain, dan membentuk flok. Untuk
menambah besarnya ukuran koloid dapat dilakukan dengan jalan reaksi kimia diikuti dengan pengumpulan atau dengan cara penyerapan.
Partikel koloid memiliki ukuran yang lebih kecil dari suatu mikro, akan menimbulkan sifat-sifat yang berbeda, karena kecilnya ukuran partikel maka luas permukaan tiap satuan massa akan semakin besar. Untuk menjamin agar pengendapan berlangsung dengan sempurna, maka alkalinitas dan pH dari air yang akan dibersihkan perlu diatur dengan cara menambahkan basa atau asam, apabila hal ini tidak dilakukan, maka pengendapan oleh koagulan tidak sempurna, disamping itu kemungkinan adanya tertinggal sisa aluminium dan besi tersebut dalam air yang tidak dijernihkan. Ada beberapa faktor yang mempengaruhi untuk menghasilkan koagolasi yang baik :
1. Pengontrolan pH
Setiap koagulan mempunyai range pH yang spesifik dimana presipitasi yang maksimum akan terbentuk sekaligus titik kelarutan maksimum, pH yang optimum tergantung pada penggunaan koagulan tersebut dan karakteristik kimiawi dari air baku.
2. Temperatur
Pada temperatur yang rendah, kecepatan reaksi lebih lambat dan viskositas air lebih besar sehingga flok lebih sukar mengendap.
3. Dosis koagulan
Air dengan turbiditi tinggi memelukan dosis koagulan yang lebih banyak. Dosis koagulan persatuan unit turbiditi tinggi, akan lebih kecil dibandingkan dengan dosis persatuan untuk air dangan turbiditi rendah. Hal
ini disebabkan karena dalam air yang mempunyai turbiditi tinggi.
Kemungkinan terjadinnya tumpukan antara partikel akan lebih besar.
4. Pengadukan
Sebaiknya proses koagulan juga ditentukan oleh pengadukan, pengadukan ini diperlukan agar tumpukan antara partikel untuk netralisasi menjadi sempurna.
b. Disinfeksi
Bermacam-macam zat kimia yang sering dipergunakan seperti ozon (O3), Chlor (Cl 2), Klorodioksida (ClO2), dan proses fisik seperti penyaringan
ultraviolet, pemanasan dalam proses disinfeksi air dan zat kimia diatas yang sering dipergunakan oleh chlor, karena harganya murah dan masih mempunyai daya disinfeksi dalam beberapa jam.
Selain dapat membasmi bakteri dalam mikroorganisme, ganggang dan lain-lain, Chlor juga dapat mengoksidasi ion logam seperti Fe2+, Mn2+ menjadi Fe3+ dan memecah molekul organik seperti warna selama dalam proses chlor sendiri direduksi menjadi chloride (Cl-) yang tidak mempunyai daya disinfeksi ion chloride tidak aktif sedangkan gas Cl2 dan HOCl dan Cl- dianggap sebagai bahan yang aktif. HOCl yang tidak terurai adalah zat pembasmi yang paling efektif pada suasana netral atau bersifat asam lemah.
2.3 Jenis-jenis bahan koagulan 1. Poly aluminium chlorida
Poly aluminium chlorida sering disingkat dengan PAC, PAC adalah garam yang dibentuk dari aluminium-aluminium chlorida yang khusus ditentukan guna memberi daya koagulasi dan flokulasi (pengumpulan dan pemadatan penggupalan) yang lebih besar dibandingkan garam-garam aluminium dari besi lainnya. PAC sebenarnya merupakan senyawa kompleks berintikan banyak ion-ion aquo aluminium yang terpolimerasi yaitu suatu jenis dari polimer senyawa organik. Berbagai bahan kimia baik senyawa organik maupun anorganik biasanya dibutuhkan sebagai koagulan air (katalisator penggumpalan) tetapi untuk PAC biasanya tidak membutuhkan zat tersebut. Poli aluminium chloride dengan arti vital yang kuat mengumpulkan setiap zat-zat yang tersuspensi atau secara koloidal tersuspensi didalam air, membentuk flok-flok (kepingan, gumpalan-gumpalan) yang mengendap dengan cepat agar membentuk sludge (Lumpur endapan) yang dapat disaring dengan mudah, dimana pH PAC air lebih kecil dari 6 (enam) disebut asam dan jika lebih dari 7 (tujuh) maka disebut bersifat basa, Sifat-sifat koloid dapat dibedakan yaitu koloid yang suka air dapat saling bergabung dan membentuk partikel yang lebih besar sehingga menggumpal dan mengendap. Sementara koloid yang tidak suka air berasal dari logam-logam dan garam-garam dan dapat stabil karena adanya permukaan air yang terikat dan menghalangi terjadinya kontak dari partikel-partikel sekitarnya. Koloid ini dapat dihilangkan dengan menurunkan potensial yaitu dengan menggunakan tabel
lapisan 6-9 dengan pH netral adalah 7. Bersangkutan sehingga mengendap kembali.Hal ini merupakan salah satu sebab kandungan dalam sumur yang dangkal lebih rendah. Besi dalam jumlah yang sedikit dan air minum diperlukan untuk pembentukan sel darah merah, tetapi kalau sudah melebihi konsentrasi yang diperlukan akan dapat menyebabkan penyakit dan warna air kemerh-merahan sehingga menimbulkan kekeruhan serta rasa dan bau air yang tidak enak, chlor dalam air dapat mengoksidasi ion-ion Fe+2 menjadi Fe+3 mengakibatkan turbiditas air yang semakin tinggi karena terbentuknya zat-zat yang tersuspensi. Dengan rumus kimia Poly Aluminium Chlorida (PAC). Fungsi dari Poly Aluminium Chlorida adalah untuk menurunkan turbiditas dari air atau menurunkan kekeruhan dari air.
2. Soda kapur (Ca(OH)2) dan kegunaannya
Dalam proses pengolahan air, selalu ditambahkan zat kimia yang masing-masing memiliki fungsi sendiri. Adanya proses penjernihan air melalui proses koagulasi PAC maka pH air akan menjadi turun. Dan penurunan nilai pH dalam air ini mengakibatkan flok-flok yang terbentuk akan susah mengendap. Maka untuk menetralisasikan nilai pH ini dilakukan penambahan soda kapur Ca(OH)2, adapun reaksi yang terjadi :
Al(OH)Cl2 + 4H2O 2Al(OH)3 + 4HCl
Bahan penetral (soda kapur) dimasukkan kedalam hasil, proses larutan tersebut sampai kadar pH diperoleh mendekati nilai netralisasi.
2Al(OH)3 + 4HCl + 2Ca(OH)2 2Al(OH)3 + 2CaCl2 + 4H2O
Proses diatas terjadi pada bak flokulator, Apabila nilai pH di bak ini dibawah 7,0 maka penambahan volume soda kapur Ca(OH)2 dilakukan sedikit demi sedikit. Netralisasi pH ini mengakibatkan proses terbentuknya flok-flok akan lebih cepat dan sempurna, selain untuk menetralkan air, Ca(OH)2 juga dapat digunakan untuk melunakkan air sadah. Karena air sadah kurang baik untuk digunakan mencuci pakaian dan dipakai untuk mencuci mesin-mesin.
Ion-ion Ca2+ dan Mg2+ pada air sadah akan menyebabkan sifat detergen sabun hilang, sehingga sabun tidak dapat lagi dibersihkan. Pada mesin-mesin, air sadah membentuk endapan berupa kerak yang akan menempel pada mesin- mesin.
Kesadahan yang disebabkan ikatan kapur dan magnesium dengan karbonat terutama dengan bikarbonat, maka air sadah tersebut dikatakan memiliki kesadahan sementara (kesadahan tidak tetap). Untuk itulah ditambah soda kapur (Ca(OH)2) agar membentuk endapan kapur dan magnesium:
Ca(HCO3) 2 + Ca(OH)2 2CaCO3 + 2H2O
Mg(HCO3)2 + Ca(OH)2 MgCO3 + CaCO3 + 2H2 O
Reaksi Ferri Sulfat dengan bikarbonat dalam air atau dengan kapur : Fe(SO4)3 + 3Ca(HCO3)2 2Fe(OH)3 + 3CaSO4 +6CO2
Fe(SO4)3 +3Ca(OH)2 2Fe(OH)3 + 3CaSO4 Reaksi Ferro Sulfat dengan bikarbonat dalam air atau dengan kapur :
FeSO47H2O + Ca(OH)2 Fe(OH)2 + CaSO4 + 7H2O 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
2.4. Mekanisme terjadinya gumpalan
Aluminium atau besi akan bereaksi dengan alkalinitas dalam air.
Alkalinitas adalah kemampuan untuk menetralkan asam. Poly Aluminium Chlorida bekerja pada interval pH 6-9 dengan pH netral adalah 7. Reaksi ini menghasilkan Al(OH)3 yang mengendap. Pada reaksi ini akan membebaskan asam yang menurut pH larutan dan bereaksi dengan alkalinitas. Reaksi tersebut tidak sederhana karena hidroksida-hidroksida Al dan Fe ternyata terbentuk ion-ion yang lain menunjukkan reaksi yang amat kompleks. Pada penambahan garam Aluminium atau besi, akan segera terbentuk ion-ion polimer dan dapat terserap oleh partikel-pertikel. PAC benar-benar menggumpalkan zat-zat tersuspensi dan koloid dalam air untuk menghasilkan flok yang belum sempurna, lalu Ca(OH)2
berperan untuk mengikat flok-flok yang belum sempurna tersebut menjadi flok- flok yang lebih sempurna, dengan perbandingan 0,30 ml PAC dan 0,90 ml Ca(OH)2 dalam 500 ml air baku pada uji jar test di laboratorium.Ca(OH)2 bekerja pada pH basa sebagai flokulan yang menetralisir pH asam yaitu PAC sebagai koagulan, yang kemudian membentuk flok-flok yang lebih sempurna dan mempercepat pengendapan dalam penyaringan partikel koloid, yang akan terselubungi oleh koagulan. Muatan partikel koloid dan hasil hidrolisa akan saling menetralkan sehingga muatan dari partikel ini mengecil, hingga tergantung dari pH serta semacam dosis koagulan, maka besarnya zat potensial yang akan diturunkan atau diubah dari sedikit negatif menjadi netral dan akhirnya posif, dan suspensi ini tidak stabil sehingga terjadi penggumpalan sampai ukuran yang dapat mengendap. Bahkan koagulan dapat terhidrolisa dan dapat terbentuk masa yang
lebih besar, dalam hal ini partikel koloid menarik dan menggabungkan sehingga terbentuk gumpalan dan terjadilah pengendapan yang sempurna dalam tangki flokulator.
2.5. Faktor-faktor yang mempengaruhi proses penggumpalan
Terjadinya proses penggumpalan dalam air dipengaruhi oleh pH, turbiditas penyusun air, jenis koagulan, suhu dan pencampuran untuk memperoleh kondisi optimum.
1. Pengaruh pH
pH merupakan salah satu faktor yang menentukan proses koagulasi, pada koagulan ada daerah optimum, dimana koagulasi akan terjadi dalam waktu yang singkat dengan dosis koagulan tertentu. Luasnya range pH ini tinggi akan koagulasinya dan akan berjalan lambat apabila sempurna. Jadi proses koagulasi akan sempurna pada pH 6-9 sesuai dengan standart. Untuk proses koagulasi pH terbaik berkisar 7,0 (pH netral).
2. Pengaruh temperatur
Pada temperatur yang rendah kecepatan reaksi lebih lambat dan viskositas air lebih besar sehingga flok lebih mengendap.
Air dengan turbiditi tinggi memerlukan dosis koagulan yang lebih banyak. Dosis koagulan persatuan unit turbiditi tinggi, akan lebih kecil dibandingkan dengan dosis persatuan untuk air dengan turbiditi rendah.Hal ini disebabkan karena dalam air yang memiliki turbiditi tinggi, kemungkinan terjadi tumbukan antara partikel akan lebih besar. Dosis koagulan yang kurang akan menyebabkan tumbukan antara partikel akan kurang sempurna.
Netralisasi muatan listrik sempurna, sehingga flok yang terbentuk hanya sedikit, akibatnya turbiditi naik. Dosis koagulan yang berlebihan dan menimbulkan efek samping pada partikel sehingga turbiditi akan naik.
3. pengadukan (Mixing)
Baiknya proses koagulasi juga ditentukan oleh pengadukan. Pengadukan ini diperlukan agar tumbukan antara partikel untuk netralisasi menjadi sempurna, distribusi dalam air cukup baik dan merata, serta masukan energi yang cukup. Untuk tumbukan antara partikel-partikel yang telah netral sehingga terbentuk mikro flok. Dalam proses koagulasi ini pengadukan dilakukan dengan cepat. Air yang memiliki turbiditi rendah memerlukan pengadukan yang lebih banyak dibandingkan dengan air yang memiliki turbiditi tinggi.
4. Pengaruh garam
Garam-garam ini dapat mempengaruhi proses suatu penggumpalan.
Pengaruh yang diberikan akan berbeda-beda tergantung dengan macam garam (ion) dan konsentrasi. Semakin besar valensi ion maka akan semakin besar pengaruh terhadap koagulan atau penggumpalan. Pengaruh ion pada penggumpalannya dapat dinyatakan sebagai penggumpalan dengan garam Fe dan Al akan banyak dipengaruhi anion dibandingkan dengan kation. Jadi Natrium, Calsium, Magnesium relatif tidak mempengaruhi. Aliminium dan besi akan bereaksi dengan alkalinitas dalam air. Pada penambahn garam aluminium atau besi akan segera terbentuk ion-ion polimer dan dapat terserap oleh partikel-partikel.