BAB 2
TINJAUAN PUSTAKA
2.1 Teori Atom Bohr
Pada tahun 1913, Niels Bohr, fisikawan berkebangsaan Swedia, mengikuti jejak
Einstein menerapkan teori kuantum untuk menerangkan hasil studinya mengenai
spektrum atom hidrogen. Bohr mengemukakan teori baru mengenai struktur dan
sifat-sifat atom. Teori atom Bohr ini pada prinsipnya menggabungkan teori
kuantum Planck dan teori atom dari Ernest Rutherford yang dikemukakan pada
tahun 1911. Bohr mengemukakan bahwa apabila elektron dalam orbit atom
menyerap suatu kuantum energi, elektron akan meloncat keluar menuju orbit yang
lebih tinggi. Sebaliknya, jika elektron itu memancarkan suatu kuantum energi,
elektron akan jatuh ke orbit yang lebih dekat dengan inti atom. Meski demikian
Bohr menggunakan fisika klasik Newton. Pada saat perhitungan jumlah tingkat
energi pada atom Hidrogen Bohr mematuhi hukum Newton energi kinetik (Ek)
pada elektron yang mengorbiti proton atom Hidrogen:
Dengan
= Energi Kinetik (J)
= Massa elektron (Kg)
= Kecepatan elektron (m/s)
2.2 Teori Relativits Khusus
Teori relativitas khusus di kemukakan Einstein pada tahun 1905 merupakan salah
satu tulang punggung fisika moderen. Sumbangannya terutama dalam bentuk
penataan dan pelurusan konsep-konsep dasar dalam fisika, khususnya yang
berkaitan dengan ruang-waktu, momentum-energi sebagai aspek kinematika
kinetik benda yang bergerak. Rumusan energi kinetik yang di kembang itu
sebagai berikut:
Pada persamaan (2.2) massa relativitas, adalah massa diam dan c adalah
kecepatan cahaya, juga adalah massa relatif benda yang berpindah akan
bertambah dengan kecepatan v oleh fungsi kecepatan berikut:
Demikian massa ( ) relatif setiap benda akan mendekati takhingga dalam batas
kecepatan v mendekati kecepatan cahaya c. jika massa diam lebih besar dari nol
( ). Jika diterapkan pada ekspansi binomial untuk energi kinetik dalam
persamaan (2.2) dibanding dengan kecepatan jauh lebih kecil dari kecepatan
cahaya . Energi kinetik relativistik dijelaskan oleh persamaan (2.2)
sebanding dengan hukum Newton pada persamaan (2.1) untuk elektron:
Dengan,
= Energi kinetik (j)
= Massa relativitas (kg)
=Massa elektron diam (kg)
=Kecepatan elektron (m/s)
=Kecepatan cahaya (m/s)
2.3 Persamaan Maxwell
Teori relativitas khusus merupakan perkembangan yang dihasilkan empat
persamaan Maxwell elektromagnetik kecepatan cahaya (c), dalam sistem satuan
(MKS) dapat di tentukan fungsi dua konstanta bebas dan untuk interaksi
Adapun keempat (4) persamaan Maxwell tersebut adalah sebagai berikut:
Dimana,
Untuk mendapatkan nilai kecepatan cahaya, perhatikan penjabaran persamaan
berikut:
Dimana,
Dengan,
= Operator Del
= Besar medan listrik (N/C)
=Besar medan magnet (T)
=Intensitas medan magnet
=Kerapatan Fluks listrik
= Permebilitas magnetik ruang hampa ( )
=Kecepatan cahaya ( )
Jika persamaan Maxwell berlaku dalam setiap kerangka acuan baik diam
atau bergerak, maka kecepatan cahaya (c) juga konstanta secara teoritis. Jika
kecepatan cahaya konstan hasil dari persamaan (2.3) untuk massa dari setiap
benda bergerak serta penurnan dilatasi waktu untuk benda bergerak terhadap suatu
benda saat diam
Dalam kasus sederhana dari atom Hidrogen kecepatan rata-rata jauh lebih
kecil dari kecepatan cahaya, sehingga persamaan (2.1) berlaku untuk energi
kinetik, tapi dengan meningkatnya nomor atom Z dalam atom yang lebih besar,
elektron atom memiliki kecepatan rata-rata yang mendekati kecepatan cahaya.
kemudian, persamaan (2.1) tidak berlaku lagi terhadap energi kinetik elektron dari
hasil persamaan (2.2) harus di manfaatkan untuk menentukan tingkat energi dari
relativistik model atom Bohr menyerupai Hidrogen yang mungkin lebih dari satu
proton dalam inti dan hanya satu elektron di sekitar inti, memulai dengan
konservasi energi, dari konservasi energi jumlah energi kinetik dan energi
potensial dalam setiap sistem kedua partikel terikat konstan, yang disebut sebagai
energi mekanik (EM) total dan konstan lebil kecil dari nol
Pada energi potensial elektron berinteraksi dengan inti atom bermuatan positif
fungsi negatif hukum coloumb, interaksi antara dua partikel pada bola.
Dengan
Menggabungkan persamaan (2.2) untuk energi relativitas elektron dengan
persamaan (2.15) untuk energi potensial, menghasilkan jumlah tingkat energi
relativistik model atom Bohr menyerupai Hidrogen
Dalam persamaaan (2.16) adalah jumlah energi total Em pada ikatan dalam
atom hidrogen yang dapat ditentukan dengan prinsip fungsi nomor bilangan
kuantum.
2.4. Model Atom Hidrogen
Atom hidrogen merupakan atom paling sederhana yang terdiri dari satu proton
sebagai nukleus dan satu elektron yang mengitarinya. Jika elektron berpindah dari
kuli terluar ke kulit terdalam maka akan melepas energi, demikiaan sebaliknya
jika elektron berpindah dari kulit terdalam ke kulit terluar maka akan menarik
energi.
Model kuantum atom hidrogen, elektron mengelilingi lintasan disekitar
inti atom dengan jarak r. Demikian keliling dari lintasan elektron disekitar inti dengan jarak r:
Dibalik pemikiran model kuantum Bohr ialah dualisme partikel dan juga bagian
dari gelombang, berasal dari Louis de Broglie, pada awal abad ke 20, Louis de
Broglie membuat fungsi invers panjang gelombang pada partikel yang
Persamaan (2.18) h merupakan konstanta Planck dan m merupakan massa relativistik pada partikel yang berpindah dengan kecepatan v. Setiap jumlah orbit lingkaran, keliling s jumlah bilangan kuantum pada panjang gelombang pada parikel yang bergerak dan n lebih besar dari nol (n>0)
Dengan
= Mmomentum Relativistik (Kg m/s)
= Jumlah keliling orbit lingkaran
= Tetapan Planck ( )
= Bilangan kuantum utama
= Jarak pusat massa elektron dengan pusat massa dari inti atom (m)
= Panjang gelombang (m)
Persamaan (2.19) merupakan prinsip gelombang tetap. Disamping itu untuk setiap
orbit lingkaran, besarnya gaya sentrifugal harus sama dengan gaya tarik
antara partikel orbit lingkaran dan jauh lebih besar partikel di pusat orbit
Pada saat persamaan diterapkan disekitar elektron orbit elektron pada atom
hidrogen,dimana besar jumlah muatan elektron.
Jika persamaan (2.21) dibagi r sehingga menjadi
Dari persamaan (2.19) hubungan antara besar momentum relativistik dengan jarak
r dari orbit lingkaran:
Dari subtitusi persamaan (2.23) ke (2.22) dapat ditentukan nilai kecepatan v yang merupakan kecepatan tangensial dari elektron dalam orbit lingkaran atom
Hidrogen:
Sehingga perbandingan kecepatan elektron v dengan kecepatan cahaya c
Massa elektron relativistik dalam model atom Bohr menjadi
lebih kecil hasil bagi pada persamaan (2.25), dan sama dengan setengah akar
muatan elektron dibagi dengan konstanta Planck, permibilitas elektrostatis pada
ruang dengan kecepatan cahaya
Dengan
=Konstanta atom hidrogen.
dan dalam mekanika kuantum relativistik, digunakan secara konsisten. Oleh
karena itu, dalam teori, jika inti adalah titik massa dengan lebih dari 137 foton,
serendah mungkin n = 1 tingkat kuantum bisa tidak ada karena elektron akan dari pada memiliki kecepatan lebih besar dari cahaya pada bilangan gelombang
kuantum n sama dengan satu (n = 1). Namun, jika ada inti dengan nomor atom lebih besar 137 (Z > 137), jumlah massa atom mungkin akan menjadi sekitar 300
Karena satu sekarang memiliki besarnya elektrik kecepatan v sebagai fungsi dari gelombang bilangan kuantum n, adalah mungkin untuk determinan
besarnya sirkular orbit jari r sebagai fungsi dari juga. Dengan subtitusi persamaan (2.26) dan (2.27) ke persamaan (2.19) untuk elektron dalam orbit lingkaran, dan
pemecahan untuk r.
Dengan
r = Jarak pusat massa elektron dengan pusat massa dari inti atom (m)
n = Bilangan kuantum
= Massa diam (kg)
= Kecepatan elektron (m/s)
Z = Nomor atom
q = Muatan elektron (C)
= Tetapan Planck ( )
= Permitivitas ruang hampa
Kembali ke persamaan (2.16), sekarang mungkin untuk mengevaluasi pertanyaan
jumlah mekanik energi En untuk model Bohr relativistik atom hidrogen seperti dengan substitusi dari persamaan (2.29) ke persamaan (2.16)
Dengan
=Jumlah energi mekanik atom Bohr (J)
Perhatikan selama nomor atom Z kurang dari 138, nilai numerik dari
persamaan (2.34) adalah negatif yang konsisten dengan sistem dua partikel terikat.
Ekspresi dalam persamaan (2.34) akan digunakan dalam menentukan tingkat
energi terkuantisasi di bagian mendatang mengenai persamaan gelombang
Schrodinger relativistik, karena spin-orbit kopling tidak dipertimbangkan. juga,
elektrodinamika kuantum tidak akan termasuk baik.
2.5 Persamaan Gelombang Schr dinger Relativistik
Ketika Niels Bohr bekerja di luar struktur kuantum dari atom hidrogen
menggunakan fisika klasik Newton, dia tidak mempertimbangkan tingkat
kuantum yang memiliki bentuk orbit elips atau gerakan osilasi sederhana tanpa
momentum angular. Dalam orbit elips, ada kecepatan radial serta kecepatan sudut
yang muncul karena momentum sudut kurang dari nilai maksimal yang mungkin,
karena momentum sudut maksimum terjadi untuk sistem dua-tubuh terikat hanya
ketika orbit dalam bentuk melingkar. di samping itu, ia diperlakukan karakteristik
partikel subatomik serta untuk foton ligth tiga-dimensi. Tiga gelombang dimensi
dijelaskan oleh persamaan gelombang berikut fisika newtonian menggunakan
dalam persamaan (2.34), adalah fungsi gelombang dan v adalah besarnya kecepatan gelombang dari gelombang tiga dimensi klasik, yang merupakan
produk dari gelombang frekuensi f dan panjang gelombang :
dan T periode gelombang tiga dimensi klasik menjadi kebalikan dari frekuensi
solusi analitis genaral dengan ekspresi diferensial dalam persamaan (2.34) adalah
fungsi berikut koordinat posisi persegi panjang dan waktu:
untuk menurunkan persamaan gelombang Schr dinger untuk partikel bebas,
pertama subtitusikan rumus umum dari persamaan (2.37) untuk persamaan (2.34)
untuk menghasilkan berikut:
setelah itu, satu kemudian menggunakan ekspresi dalam persamaan (2.19) untuk
menggabungkan dualisme gelombang-partikel menghasilkan:
melihat bahwa dalam persamaan (2.39), hasilnya adalah persamaan gelombang
Schrodinger dari partikel bebas, dan dapat disusun kembali ke dalam ekspresi teks
dalam jangka momentum kuadrat dari partikel bergerak:
dalam notasi vektor, p momentum vektor dari partikel bergerak bebas direpresentasikan sebagai
dan ekspresi diffrensial dalam persamaan (2.42) dalam notasi vektor menjadi
operator momentum-squared untuk partikel bebas yang memiliki sebagai fungsi
gelombang nya.
kembali ke ekspresi yang diberikan dalam persamaan (2.16) :
perlu untuk menurunkan persamaan (2.16) menjadi rumus matematika dalam
volving momentum relativistik kuadrat dari partikel menggunakan persamaan
(2.34) tentang dualitas gelombang-partikel dari elektron dalam atom hidrogen
seperti. Untuk menyelesaikan tugas ini, diperlukan kembali ke persamaan (2.3)
untuk massa relativistik dari objek yang bergerak
Persamaan (2.3) dapat di ubah dengan kedua sisi dan persamaan kuadrat,
dikalikan terus dengan kecepatan cahaya yang ditingkatkan ke tenaga keempat
untuk memperoleh:
Kemudian gunakan sifat distribusi dari matematika dan menyusun yang lainya
menjadi persamaan (2.44):
Dengan
= Massa relativitas (kg)
= Massa diam (kg)
= Kecepatan cahaya ( )
= Kecepatan elektron (m/s)
p = Momentum relativistik (kg m/s)
Penjumlahan dari momentum relativitas kuadrat , waktu dari kecepatan kuadrat
mengambil akar kuadrat kedua sisi dan persamaan (2.45), mengungkapkan bahwa
itu dapat disubtitusi kedalam persamaan gelombang relativitas Schr dinger dari
persamaan (2.16) untuk pergerakan elektron:
Mensubsitusi persamaan (2.37) kedalam persamaan (2.16) diikuti dengan
menambahkan masa energi dan energi potensial pada kedua sisinya dari
persamaan (2.16).
Karena orbit perputaran alat penghubung tidak diambil pertimbangan elektron
akan sama jika nilai putaran intrinsik adalah nol dari satu setengah dan masa
energi dari elektron adalah konstan, nilai energi En dari model atom relativitas Bohr (persamaan 2.33) adalah menambahkan nilai masa elektron ke hasil
persamaan gelombang relativitas Schr dingeruntuk nilai energi En:
Dengan
= Energi mekanika atom Bohr (J)
Tak sama dengan hasil energi dari model atom hidrogen relativitas Bohr
hasil bilangan dari persamaan (2.48) adalah lebih baik dari nol, positif n lebih dari satu ketika ada lebih dari 137 proton didalam atom nukleus (Z>137). Jadi,
persamaan (2.48) sekarang menjadi:
Demikian, setelah mengkuadratkan kedua sisi dari persamaan (2.50) dan
Dengan mensubsitusi persamaan (2.43) dan menyatakan differensial dari
partikel-partikel ke persamaan (2.55), diikuti satu versi dari persamaan gelombang
relativitas Schr dinger:
Langkah selanjutnya adalah membagi persamaan (2.56) dengan hasil
dan diikuti pernyataan dan diperoleh:
Kemudian, setelah beberapa aljabar, persamaan (2.57) menjadi versi yang
sederhana dari hasil persamaan gelombang relativitas Schr dinger ke nol
kemudian massa :
Dan setelah mensubsitusi kedalam persamaan (2.48) untuk perhitungan tingkatan
Setelah ditambahkan, untuk mengikuti hasil bagi dari konstanta Planck h
dan hasil akan di susun :
Bagian yang akan datang memberikan pembicaran bagaiman memecahkan
pernyataan sebagian differential di persamaan (2.59) menggunakan polar
Spherical dari pada koordinat kartesius segi empat., operator momentum kuadrat
dapat dipisahkan kedalam penjumlahan dari momentum jari-jari lingkaran
kuadrat dan operator momentum kuadrat angular jika satu persamaan (2.59) terus
dengan :
Ini tepat karena adalah penjumlahan urut untuk momentum angular.
2.6. Metode Beda Hingga (Finite Difference Method)
Metode beda hingga adalah metode numerik yang umum digunakan untuk
menyelesaikan persoalan teknis dan problem matematis dari suatu gejala fisis.
Secara umum metode beda hingga adalah metode yang mudah digunakan dalam
penyelesaian problem fisis yang mempunyai bentuk geometri yang teratur, seperti
interval dalam 1D (satu dimensi), domain kotak dalam dua dimensi, dan kubik
dalam ruang tiga dimensi.
Berbeda dengan metode elemen hingga (Finite Element Method) yang memiliki banyak variasi bentuk elemennya, yaitu bentuk segi empat, segi tiga dan
segi yang lain. Sedangkan metode beda hingga bentuk diskriisasi elemennya
hanya berbentuk segi empat saja.
Aplikasi penting dari metode beda hingga adalah dalam analisis numerik,
khususnya pada persamaan diferensial biasa dan persamaan diferensial parsial.
Prinsipnya adalah mengganti turunan yang ada pada persamaan diferensial dengan
diskritisasi beda hingga berdasarkan deret Taylor. Secara fisis, deret Taylor dapat
diartikan sebagai besaran tinjauan pada suatu ruang dan waktu (ruang dan waktu
yang mempunyai perbedaan yang kecil dengan ruang dan waktu tinjauan
(Anderson, 1984). Atau secara matematis dapat dituliskan sebagai:
Dengan h adalah Δr, subskrip i merupakan titik grid, superskrip n
menunjukkan time step dan adalah reminder atau biasa disebut truncation
error yang merupakan suku selanjutnya dari deret tersebut yang dapat dinyatakan sebagai berikut,
Metode ini akan membuat pendekatan terhadap harga-harga yang tidak
diketahui pada setiap titik secara diskrit. Dimulai dengan pemodelan dari suatu
benda dengan membagi-bagi dalam grid atau kotak-kotak hitungan kecil yang
secara keseluruhan masih memiliki sifat yang sama dengan benda utuh sebelum
terbagi menjadi bagian-bagian yang kecil. Penerapan metode ini pada persamaan
adveksi adalah memperkirakan persamaan differensial yang bersangkutan beserta
syarat-syarat batasnya dengan seperangkat persamaan aljabar. Dengan mengganti
daerah yang kontinu dengan suatu pola titik-titik tersebut. Sistem dibagi menjadi
sejumlah subluas yang kecil dan memberi nomor acuan kepada setiap subluas.
Metode beda hingga bersifat eksplisit, artinya keadaan suatu sistem atau
solusi variabel pada suatu saat dapat digunakan untuk menentukan keadaan sistem
pada waktu beriukutnya. Berbeda dengan metode implisit, yang mana penentuan
solusi sistem harus dengan memecahkan sistem pada kedua keadaan, sekarang dan
yang akan datang.
Berdasarkan ekspansi Taylor di atas (persamaan 2.62), terdapat tiga skema
beda hingga yang biasa digunakan dalam diskritisasi PDP, yaitu beda maju, maju
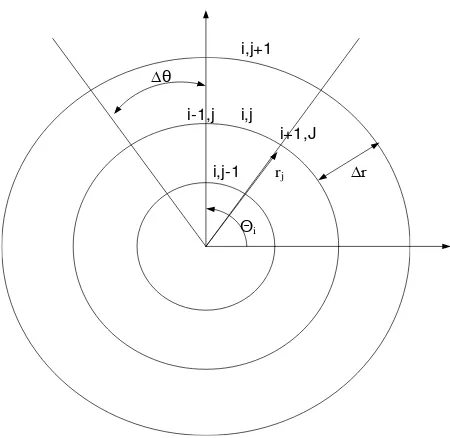
mundur, dan maju tengah. Berikut adalah skema beda hingga untuk koordinat
∆r ∆θ
i,j+1
i,j
i,j-1
Θi
rj i+1,J i-1,j
Gambar 2.2 Skema beda hingga pada arah radial elektron
2.6.1. Beda Maju
Untuk beda maju, mencari nilai suatu fungsi independent variabelnya di geser ke
depan sebesar ∆r. Berikut ekspansi Taylor :
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan
2.6.2. Beda Mundur
Untuk beda mundur, mencari nilai suatu fungsi independent variabelnya di geser
ke belakang sebesar ∆r. Berikut ekspansi Taylor :
Maka,
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan
lengkungan (curvature) dari titik tersebut jika r digeser sebesar ∆r.
2.6.3. Beda Tengah
Jenis beda hingga yang ketiga adalah beda tengah, di mana untuk mencari
kemiringan dari fungsi tersebut dengan menggunakan perbedaan nilai fungsinya
dari beda depan dan beda belakang. Secara matematis, beda tengah adalah
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan