SOLUSI NUMERIK FUNGSI GELOMBANG ARAH RADIAL
ELEKTRON ATOM HIDROGEN DENGAN EFEK
RELATIVISTIK
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ENRA S. TAMBUNAN 090801047
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
SOLUSI NUMERIK FUNGSI GELOMBANG ARAH RADIAL
ELEKTRON ATOM HIDROGEN DENGAN EFEK
RELATIVISTIK
SKRIPSI
ENRA S. TAMBUNAN
090801047
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SOLUSI NUMERIK FUNGSI GELOMBANG
ARAH RADIAL ELEKTRON ATOM HIDROGEN DENGAN EFEK RELATIVISTIK
Kategori : SKRIPSI
Nama : ENRA S. TAMBUNAN
NIM : 090801047
Program Studi : SARJANA (S1) FISIKA
Departemen : FISIKA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, 19 Agustus 2014
Pembimbing I Pembimbing II
Tua Raja Simbolon, S.Si, M.Si
NIP: 197211152000121001 NIP: 195511291987032001 Dra.Manis Sembiring MS
Diketahui/ disetujui oleh
Ketua Departemen Fisika FMIPA USU
PERNYATAAN
SOLUSI NUMERIK FUNGSI GELOMBANG ARAH RADIAL ELEKTRON ATOM HIDROGEN DENGAN EFEK RELATIVISTIK
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, 19 Agustus 2014
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala
anugerah dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul “SOLUSI NUMERIK FUNGSI DISTRIBUSI ARAH RADIAL
ELEKTRON ATOM HYDROGEN DENGAN EFEK RELATIFISTIK”.
Skripsi ini disusun sebagai syarat akademis dalam menyelesaikan studi program
Sarjana (S1) Jurusan Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara Medan:
1. Kepada Ayah dan Ibu
tercinta D.TAMBUNAN dan R. MANIK, kakak ku tercinta Netty Tambunan,
Sri Indah Hastuti Tambunan dan Abang saya Emron Tambunan terimakasih
untuk setiap doa, kasih sayang, dukungan dan nasehat yang senantiasa
diberikan kepada penulis setiap waktu. Semoga Allah BAPA yang maha
pengasih senantisa melimpahkan kasih sayang dan berkah-Nya kepada
keluarga kita dan semoga penulis bisa menjadi “pambangkik batang tarandam” di keluarga kita
2. Kepada Alm Bapak
Drs.Tenang Ginting,M.S selaku dosen pembimbing penulis sebelum Beliau
wafat.Terima kasih Atas ilmu selama diperkuliahan,bimbingan, masukan yang
senantiasa diberikan kepada penulis dan Beliau lah yang mengenalkan fisika
teori kepada penulis.
3. Bapak Tua Raja
Simbolon, S.Si, M.Si dan Dra Manis Sembiring M.S selaku dosen
pembimbing penulis dalam menyelesaikan skripsi ini. Terima kasih untuk
setiap ilmu, bimbingan, masukan dan motivasi yang senantiasa diberikan
kepada penulis.
4. Bapak Drs.
penulis. Terimakasih untuk ilmu yang diberikan, masukan dan motivasi yang
senantiasa diberikan kepada penulis.
5. Kepada Bapak
Dr.Marhaposan Situmorang selaku ketua departemen Fisika USU dan kepada
Bapak Drs. Syahrul Humaidi, M.Sc selaku sekretaris jurusan beserta dosen
dan staff pegawai kantor departemen Fisika USU.
6. Kepada teman-teman
penulis di Fisika Stambuk Breaving ’09: Terkhusus kepada teman
seperjuangan penulis Soni Togatorop, Poltak, Sabam, Kalam siregar, Ade
Irma, Fitri, Villa, Agus, Suhartina, Herdiana, Resdina, Rieni, Valentina, Esra,
Timbul, Wenny, Septi, Jannah, Ferdi, dan teman – teman yang lainnya, terima
kasih untuk setiap kebersamaan dan motivasinya.
7. Kepada Rusel angkatan
2011 Fisika USU, terima kasih atas bantuan, dukungan dan waktu yang
diberikann kepada penulis dalam menyelesaikan penelitian ini.
8. Kepada Bang Mangara,
Bang Rolas, Bangn Indra dan Kak Dewi, dan bang Donal terima kasih untuk
ilmu dan dukungannya.
9. Kepada adik stambuk
angkatan 2010, 2011, 2012 dan 2013 yang tidak bisa penulis sebutkan satu per
satu.
10. Kepada Deby Apriliani
Simanjuntak yang penulis cintai dan sayangi, terimakasih untuk setiap waktu,
kasih sayang, dukungan, masukan, nasehat, doa dan bantuan diberikan kepada
penulis.
11. Kepada teman kost
penulis Frengki, Jhonri, Riama, Livia, Rafles terimakasih telah membantu
penulis menyelesaikan skripsi ini.
Penulis menyadari dalam penulisan skiripsi ini masih jauh dari
kesempurnaan, oleh karena itu kritik dan saran yang sifatnya membangun sangat
Akhir kata semoga skripsi ini dapat bermanfaat terutama bagi penulis dan
pembaca, terutama juga kepada mereka yang ingin melanjutkan penelitian ini.
Medan,
Penulis
SOLUSI NUMERIK ARAH RADIAL ELEKTRON ATOM HIDROGEN DENGAN EFEK RELATIVISTIK
ABSTRAK
Telah dilakukan perhitungan numerik fungsi gelombang arah radial elektron atom hidrogen dengan efek relativistik menggunakan metode beda hingga. Perhitungan ini dimulai dari teori relativistik khusus Einstein pada persamaan gelombang Schrodinger klasik untuk atom hidrogen. Persamaan gelombang Schrodinger ini menyerupai fisika klasik Newton pada benda yang bergerak dan juga menyerupai persamaan gelombang Schrodinger klasik yang melibatkan distribusi diffrensial radial yang sangat sulit untuk mencari solusi analitik, namun dapat diselesaikan dengan solusi Numerik. Dengan menggunakan pemisahan variabel dari persamaan Schrodinger koordinat bola didapat fungsi gelombang arah radial. Fungsi gelombang elektron arah radial yang dipengaruhi efek relativistik terlihat semakin mengecil seiring dengan meningkatnya jejari atom. Nilai energi dari persamaan gelombang Schrodinger relativistik sama dengan model atom Hidrogen Borh. Pada saat spin-orbit berpasangan tidak diperhitungkan seperti yang dilakukan dalam persamaan gelombang Dirac efek relativistik seperti atom Hidrogen. Sebab tidak ada kondisi awal yang digunakan ketika menyelesaikan solusi numerik persamaan gelombang relativistik. Kondisi normalisasi ini digunakan ketika diuji nilai maksimum fungsi radial elektron atom hidrogen, menggunakan perangkat lunak Microsoff Excel untuk mendapatkan solusi Numerik dengan Metode beda Hingga.
NUMERICAL SOLUTION HYDROGEN ATOM ELECTRON RADIAL DIRECTION WITH RELATIVISTIC EFFECTS
ABSTRACT
It has been conducted numerical calculations of electron radial wave function of hydrogen atoms by relativistic effects using the finite difference method. This calculation starts from Einstein's theory of special relativistic Schrödinger wave equation for the classical hydrogen atom. The Schrodinger wave equation resembles the classical physics of Newton on a moving object and also resembles the classic Schrodinger wave equation involving the radial distribution different very difficult to find an analytic solution, but can be solved with numerical solutions. By using the separation of variables of the Schrodinger equation in spherical coordinates obtained radial wave function. Radial electron wave function is influenced relativistic effects look even smaller with the increasing atomic spokes. Energy value of the relativistic Schrödinger wave equation is equal to the atomic model Hydrogen Bohr. At the time of the spin-orbit pairs are not taken into account as is done in the Dirac wave equation of relativistic effects such as atomic hydrogen. Because there are no initial conditions used when solving the numerical solutions of relativistic wave equations. This normalization condition is used when tested maximum value function of radial electron hydrogen atom, using the Microsoft Excel software to obtain numerical solutions with finite different methods.
DAFTAR ISI
Daftar Gambar viii
Bab 1 Pendahuluan
1.6 Sistematika penulisan 3
Bab 2 Tinjauan Pustaka
2.1 Teori Atom Bohr 5
2.2 Teori Relativitas Khusus 5
2.3 Persamaan Maxwell 6
2.4 Model Atom Hidrogen 9
2.5 Persamaan Gelombang Schrodinger Relativistik 13
2.6 Metode Beda Hingga 18
2.6.1 Beda Maju 20
2.6.2 Beda Mundur 21
2.6.3 Beda Tengah 21
Bab 3 Metodologi Penelitian
3.1 Literatur Alir Penelitian 23
Bab 4 Hasil Dan Pembahasan
4.1 Penyelesaian dari Gelombang Relativistik Schrodinger
Dari Atom Hidrogen 24
4.2 Penyelesaian Numerik Dan Fungsi Distribusi Jari-Jari Untuk Persamaan Gelombang Relativistik Schrodinger 30 Bab 5 Kesimpulan Dan Saran
5.1 Kesimpulan 41
5.2 Saran 41
Daftar Pustaka 42
Lampiran
A. Alfabet Yunani 44
DAFTAR GAMBAR
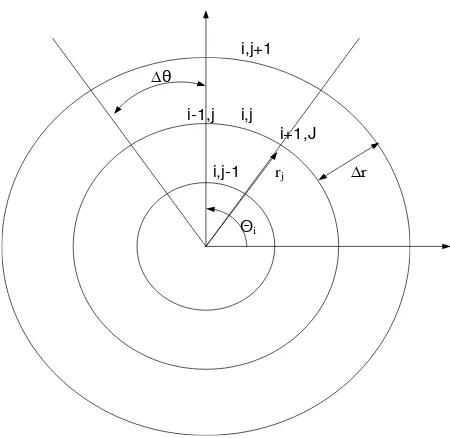
Gambar 2.1 Skema Beda Hingga Pada Arah Radial Elektron 20 Gambar 4.1. Arah Radial Elektron Atom Hidrogen 24 Gambar 4.2 Arah Radial Elektron Atom Hidogen 40 Gambar B.1 Solusi Numerik Arah Radial Atom Hidrogen
BAB 1
PENDAHULUAN
1.1 Latar Belakang Masalah
Pandangan terhadap ilmu fisika mulai berubah sejak peristiwa bencana ultraungu
yang melahirkan hipotesa Planck, kemudian dilanjutkan oleh teori kuantum
cahaya yang dipublikasikan oleh Einstein dan percobaan Efek Compton. Era ini
kemudian ditandai dengan lahirnya fisika kuantum.
Teori kuantum kemudian berkembang seiring dengan formulasi matriks
Heisenberg dan mekanika gelombang yang digagas oleh Schr dinger. Gagasan ini
kemudian dikenal dengan nama Persamaan Schr dinger.
Penerapan persamaan Schrödinger dapat dijumpai pada solusi gerak
partikel dalam sebuah potensial seperti sumur potensial, tanggul potensial, dan
osilator harmonik. Peluruhan alfa, dioda tunel, dan inversi amoniak adalah
beberapa aplikasi persamaan Schrödinger pada tanggul potensial yang dikenal
sebagai efek terobosan.
Dalam perkembangan selanjutnya, persamaan Schr dinger diaplikasikan
pada teori relativitas khusus Einstein untuk atom yang menyerupai Hidrogen.
Selain mirip persamaan persamaan gelombang Schr dinger relativistik klasik
melibatkan distribusi diffrensial radial yang sangat sulit untuk mencari solusi
analitik, tetapi harus diselesaikan dengan solusi numerik.
Metode numerik adalah teknik untuk menyelesaikan
permasalahan-permasalahan yang diformulasikan secara matematis dengan cara hitungan
(Aritmatika). Berbagai permasalahan dalam bidang ilmu pengetahuan khususnya
Fisika dapat digambarkan dalam bentuk persamaan matematik. Apabila
persamaan tersebut mempunyai bentuk yang sederhana maka dapat diselesaikan
secara analitis.
Namun ada beberapa persoalan fisika yang cukup rumit dan menghabiskan
dijumpai bersifat kompleks yang melibatkan banyak variabel dan parameter serta
hubungannya saling ketergantungan antara variabel lain dengan yang lainnya
sehingga metode analitis sulit diterapkan untuk itu perlu disederhanakan
penyelesaiannya dengan menggunakan metode numerik. Karena itu metode
numerik sangat membantu dalam mempelajari gejala fisika
Salah satu gejala fisika yang sangat menarik adalah perilaku gelombang
dari partikel. Analisis persamaan Schrödinger dapat dilakukan dengan
menggunakan model matematika dan menerapkan metode numerik untuk
menyederhanakan penyelesaian matematisnya.
Salah satu metode numerik yang dapat digunakan untuk memecahkan
persamaan differensial seperti pada persamaan Schrödinger adalah metode beda
hingga (Finite Difference Methods). Metode beda hingga lebih mudah dari segi
pemrograman dengan komputer dan konsepnya pun tidak sulit untuk dipahami.
Oleh karena itu pada penelitian ini akan diterapkan metode beda hingga untuk
menyelesaikan persamaan Schrödinger yaitu pada fungsi gelombang arah radial
elektron atom hidrogen dengan efek relativitas.
1.2 Perumusan Masalah
Fokus penelitian ini adalah solusi numerik persamaan gelombang Schr dinger
dengan menggunakan metode beda hingga dan juga evaluasi nilai energi elektron
maksimum dan fungsi gelombang radial pada atom Hidrogen.
1.3 Ruang Lingkup Kajian
Kajian penelitian ini dibatasi hanya pada persamaan gelombang Schr dinger
untuk atom hidrogen sehingga tidak pula mnelibatkan kajian mengenai masalah
1.4 Tujuan Penelitian
Adapun tujuan penetitian ini adalah
1. Menentukan fungsi gelombang arah radial secara relativistik
2. Menentukan fungsi gelombang arah radial elektron yang dipengaruhi
relativistik numerik
1.5Manfaat Penelitian
Adapun manfaat dari penulisan skripsi ini adalah sebagai berikut :
1. Bagi penulis, sebagai tambahan informasi dan wawasan mengenai
bagaimana menentukan solusi numerik fungsi gelombang arah radial
electron atom hydrogen dengan efek relativistik
2. Bagi pembaca, sebagai masukan dan sumbangan pemikiran untuk
memecahkan permasalahan dalam menentukan fungsi gelombang arah
radial electron atom hidrogen dengan menggunakan metode beda hingga.
1.6 Sistematika Penulisan
Tugas akhir ini terdiri dari beberapa bab dan masing-masing bab dipecah beberapa
sub-bab dengan memerinci pokok-pokok permasalahan sehingga penyajian tugas
akhir ini dapat dilakukan secara sistematis:
BAB 1 Pendahuluan
Berisi uraian mengenai hal-hal yang melatarbelakangi penulisan
permasalahan, batasan permasalahan, tujuan penelitian, manfaat
penelitian dan sistematika penulisan.
BAB 2 Tinjauan Pustaka
Berisi tentang teori yang berhubungan dengan teori atom Bohr,
teori relativitas Einstein, persamaan Schr dinger radial dan juga
metode beda hingga.
BAB 3 Metode Penelitian
BAB 4 Hasil dan Pembahasan
Bab ini membahas tentang persamaan gelombang Schr dinger
klasik, evaluasi nilai maksimum fungsi gelombang radial, dan
mendapatkan solusi numerik dengan menggunakan metode beda
hingga
BAB 5 Kesimpulan dan Saran
Berisi hasil-hasil yang didapatkan dari penelitian ini dan
BAB 2
TINJAUAN PUSTAKA
2.1 Teori Atom Bohr
Pada tahun 1913, Niels Bohr, fisikawan berkebangsaan Swedia, mengikuti jejak
Einstein menerapkan teori kuantum untuk menerangkan hasil studinya mengenai
spektrum atom hidrogen. Bohr mengemukakan teori baru mengenai struktur dan
sifat-sifat atom. Teori atom Bohr ini pada prinsipnya menggabungkan teori
kuantum Planck dan teori atom dari Ernest Rutherford yang dikemukakan pada
tahun 1911. Bohr mengemukakan bahwa apabila elektron dalam orbit atom
menyerap suatu kuantum energi, elektron akan meloncat keluar menuju orbit yang
lebih tinggi. Sebaliknya, jika elektron itu memancarkan suatu kuantum energi,
elektron akan jatuh ke orbit yang lebih dekat dengan inti atom. Meski demikian
Bohr menggunakan fisika klasik Newton. Pada saat perhitungan jumlah tingkat
energi pada atom Hidrogen Bohr mematuhi hukum Newton energi kinetik (Ek)
pada elektron yang mengorbiti proton atom Hidrogen:
Dengan
= Energi Kinetik (J)
= Massa elektron (Kg)
= Kecepatan elektron (m/s)
2.2 Teori Relativits Khusus
Teori relativitas khusus di kemukakan Einstein pada tahun 1905 merupakan salah
satu tulang punggung fisika moderen. Sumbangannya terutama dalam bentuk
penataan dan pelurusan konsep-konsep dasar dalam fisika, khususnya yang
berkaitan dengan ruang-waktu, momentum-energi sebagai aspek kinematika
kinetik benda yang bergerak. Rumusan energi kinetik yang di kembang itu
sebagai berikut:
Pada persamaan (2.2) massa relativitas, adalah massa diam dan c adalah
kecepatan cahaya, juga adalah massa relatif benda yang berpindah akan
bertambah dengan kecepatan v oleh fungsi kecepatan berikut:
Demikian massa ( ) relatif setiap benda akan mendekati takhingga dalam batas
kecepatan v mendekati kecepatan cahaya c. jika massa diam lebih besar dari nol
( ). Jika diterapkan pada ekspansi binomial untuk energi kinetik dalam
persamaan (2.2) dibanding dengan kecepatan jauh lebih kecil dari kecepatan
cahaya . Energi kinetik relativistik dijelaskan oleh persamaan (2.2)
sebanding dengan hukum Newton pada persamaan (2.1) untuk elektron:
Dengan,
= Energi kinetik (j)
= Massa relativitas (kg)
=Massa elektron diam (kg)
=Kecepatan elektron (m/s)
=Kecepatan cahaya (m/s)
2.3 Persamaan Maxwell
Teori relativitas khusus merupakan perkembangan yang dihasilkan empat
persamaan Maxwell elektromagnetik kecepatan cahaya (c), dalam sistem satuan
(MKS) dapat di tentukan fungsi dua konstanta bebas dan untuk interaksi
Adapun keempat (4) persamaan Maxwell tersebut adalah sebagai berikut:
Dimana,
Untuk mendapatkan nilai kecepatan cahaya, perhatikan penjabaran persamaan
berikut:
Dimana,
Dengan,
= Operator Del
= Besar medan listrik (N/C)
=Besar medan magnet (T)
=Intensitas medan magnet
=Kerapatan Fluks listrik
= Permebilitas magnetik ruang hampa ( )
=Kecepatan cahaya ( )
Jika persamaan Maxwell berlaku dalam setiap kerangka acuan baik diam
atau bergerak, maka kecepatan cahaya (c) juga konstanta secara teoritis. Jika
kecepatan cahaya konstan hasil dari persamaan (2.3) untuk massa dari setiap
benda bergerak serta penurnan dilatasi waktu untuk benda bergerak terhadap suatu
benda saat diam
Dalam kasus sederhana dari atom Hidrogen kecepatan rata-rata jauh lebih
kecil dari kecepatan cahaya, sehingga persamaan (2.1) berlaku untuk energi
kinetik, tapi dengan meningkatnya nomor atom Z dalam atom yang lebih besar,
elektron atom memiliki kecepatan rata-rata yang mendekati kecepatan cahaya.
kemudian, persamaan (2.1) tidak berlaku lagi terhadap energi kinetik elektron dari
hasil persamaan (2.2) harus di manfaatkan untuk menentukan tingkat energi dari
relativistik model atom Bohr menyerupai Hidrogen yang mungkin lebih dari satu
proton dalam inti dan hanya satu elektron di sekitar inti, memulai dengan
konservasi energi, dari konservasi energi jumlah energi kinetik dan energi
potensial dalam setiap sistem kedua partikel terikat konstan, yang disebut sebagai
energi mekanik (EM) total dan konstan lebil kecil dari nol
Pada energi potensial elektron berinteraksi dengan inti atom bermuatan positif
fungsi negatif hukum coloumb, interaksi antara dua partikel pada bola.
Dengan
Menggabungkan persamaan (2.2) untuk energi relativitas elektron dengan
persamaan (2.15) untuk energi potensial, menghasilkan jumlah tingkat energi
relativistik model atom Bohr menyerupai Hidrogen
Dalam persamaaan (2.16) adalah jumlah energi total Em pada ikatan dalam
atom hidrogen yang dapat ditentukan dengan prinsip fungsi nomor bilangan
kuantum.
2.4. Model Atom Hidrogen
Atom hidrogen merupakan atom paling sederhana yang terdiri dari satu proton
sebagai nukleus dan satu elektron yang mengitarinya. Jika elektron berpindah dari
kuli terluar ke kulit terdalam maka akan melepas energi, demikiaan sebaliknya
jika elektron berpindah dari kulit terdalam ke kulit terluar maka akan menarik
energi.
Model kuantum atom hidrogen, elektron mengelilingi lintasan disekitar
inti atom dengan jarak r. Demikian keliling dari lintasan elektron disekitar inti
dengan jarak r:
Dibalik pemikiran model kuantum Bohr ialah dualisme partikel dan juga bagian
dari gelombang, berasal dari Louis de Broglie, pada awal abad ke 20, Louis de
Broglie membuat fungsi invers panjang gelombang pada partikel yang
Persamaan (2.18) h merupakan konstanta Planck dan m merupakan massa
relativistik pada partikel yang berpindah dengan kecepatan v. Setiap jumlah orbit
lingkaran, keliling s jumlah bilangan kuantum pada panjang gelombang pada
parikel yang bergerak dan n lebih besar dari nol (n>0)
Dengan
= Mmomentum Relativistik (Kg m/s)
= Jumlah keliling orbit lingkaran
= Tetapan Planck ( )
= Bilangan kuantum utama
= Jarak pusat massa elektron dengan pusat massa dari inti atom (m)
= Panjang gelombang (m)
Persamaan (2.19) merupakan prinsip gelombang tetap. Disamping itu untuk setiap
orbit lingkaran, besarnya gaya sentrifugal harus sama dengan gaya tarik
antara partikel orbit lingkaran dan jauh lebih besar partikel di pusat orbit
Pada saat persamaan diterapkan disekitar elektron orbit elektron pada atom
hidrogen,dimana besar jumlah muatan elektron.
Jika persamaan (2.21) dibagi r sehingga menjadi
Dari persamaan (2.19) hubungan antara besar momentum relativistik dengan jarak
r dari orbit lingkaran:
Dari subtitusi persamaan (2.23) ke (2.22) dapat ditentukan nilai kecepatan v yang
merupakan kecepatan tangensial dari elektron dalam orbit lingkaran atom
Hidrogen:
Sehingga perbandingan kecepatan elektron v dengan kecepatan cahaya c
Massa elektron relativistik dalam model atom Bohr menjadi
lebih kecil hasil bagi pada persamaan (2.25), dan sama dengan setengah akar
muatan elektron dibagi dengan konstanta Planck, permibilitas elektrostatis pada
ruang dengan kecepatan cahaya
Dengan
=Konstanta atom hidrogen.
dan dalam mekanika kuantum relativistik, digunakan secara konsisten. Oleh
karena itu, dalam teori, jika inti adalah titik massa dengan lebih dari 137 foton,
serendah mungkin n = 1 tingkat kuantum bisa tidak ada karena elektron akan dari
pada memiliki kecepatan lebih besar dari cahaya pada bilangan gelombang
kuantum n sama dengan satu (n = 1). Namun, jika ada inti dengan nomor atom
lebih besar 137 (Z > 137), jumlah massa atom mungkin akan menjadi sekitar 300
(A 300). Hal ini sangat mungkin, karena itu, bahwa n=1 jari-jari Bohr relativistik
Karena satu sekarang memiliki besarnya elektrik kecepatan v sebagai
fungsi dari gelombang bilangan kuantum n, adalah mungkin untuk determinan
besarnya sirkular orbit jari r sebagai fungsi dari juga. Dengan subtitusi persamaan
(2.26) dan (2.27) ke persamaan (2.19) untuk elektron dalam orbit lingkaran, dan
pemecahan untuk r.
Dengan
r = Jarak pusat massa elektron dengan pusat massa dari inti atom (m)
n = Bilangan kuantum
= Massa diam (kg)
= Kecepatan elektron (m/s)
Z = Nomor atom
q = Muatan elektron (C)
= Tetapan Planck ( )
= Permitivitas ruang hampa
Kembali ke persamaan (2.16), sekarang mungkin untuk mengevaluasi pertanyaan
jumlah mekanik energi En untuk model Bohr relativistik atom hidrogen seperti
dengan substitusi dari persamaan (2.29) ke persamaan (2.16)
Dengan
=Jumlah energi mekanik atom Bohr (J)
Perhatikan selama nomor atom Z kurang dari 138, nilai numerik dari
persamaan (2.34) adalah negatif yang konsisten dengan sistem dua partikel terikat.
Ekspresi dalam persamaan (2.34) akan digunakan dalam menentukan tingkat
energi terkuantisasi di bagian mendatang mengenai persamaan gelombang
Schrodinger relativistik, karena spin-orbit kopling tidak dipertimbangkan. juga,
elektrodinamika kuantum tidak akan termasuk baik.
2.5 Persamaan Gelombang Schr dinger Relativistik
Ketika Niels Bohr bekerja di luar struktur kuantum dari atom hidrogen
menggunakan fisika klasik Newton, dia tidak mempertimbangkan tingkat
kuantum yang memiliki bentuk orbit elips atau gerakan osilasi sederhana tanpa
momentum angular. Dalam orbit elips, ada kecepatan radial serta kecepatan sudut
yang muncul karena momentum sudut kurang dari nilai maksimal yang mungkin,
karena momentum sudut maksimum terjadi untuk sistem dua-tubuh terikat hanya
ketika orbit dalam bentuk melingkar. di samping itu, ia diperlakukan karakteristik
partikel subatomik serta untuk foton ligth tiga-dimensi. Tiga gelombang dimensi
dijelaskan oleh persamaan gelombang berikut fisika newtonian menggunakan
dalam persamaan (2.34), adalah fungsi gelombang dan v adalah besarnya
kecepatan gelombang dari gelombang tiga dimensi klasik, yang merupakan
produk dari gelombang frekuensi f dan panjang gelombang :
dan T periode gelombang tiga dimensi klasik menjadi kebalikan dari frekuensi
solusi analitis genaral dengan ekspresi diferensial dalam persamaan (2.34) adalah
fungsi berikut koordinat posisi persegi panjang dan waktu:
untuk menurunkan persamaan gelombang Schr dinger untuk partikel bebas,
pertama subtitusikan rumus umum dari persamaan (2.37) untuk persamaan (2.34)
untuk menghasilkan berikut:
setelah itu, satu kemudian menggunakan ekspresi dalam persamaan (2.19) untuk
menggabungkan dualisme gelombang-partikel menghasilkan:
melihat bahwa dalam persamaan (2.39), hasilnya adalah persamaan gelombang
Schrodinger dari partikel bebas, dan dapat disusun kembali ke dalam ekspresi teks
dalam jangka momentum kuadrat dari partikel bergerak:
dalam notasi vektor, p momentum vektor dari partikel bergerak bebas
direpresentasikan sebagai
dimana dalam sistem koordinat Cartesian, vektor satuan x, y, dan z sumbu
direpresentasikan sebagai x, y, dan z. notasi vektor menggunakan, persamaan
dan ekspresi diffrensial dalam persamaan (2.42) dalam notasi vektor menjadi
operator momentum-squared untuk partikel bebas yang memiliki sebagai fungsi
gelombang nya.
kembali ke ekspresi yang diberikan dalam persamaan (2.16) :
perlu untuk menurunkan persamaan (2.16) menjadi rumus matematika dalam
volving momentum relativistik kuadrat dari partikel menggunakan persamaan
(2.34) tentang dualitas gelombang-partikel dari elektron dalam atom hidrogen
seperti. Untuk menyelesaikan tugas ini, diperlukan kembali ke persamaan (2.3)
untuk massa relativistik dari objek yang bergerak
Persamaan (2.3) dapat di ubah dengan kedua sisi dan persamaan kuadrat,
dikalikan terus dengan kecepatan cahaya yang ditingkatkan ke tenaga keempat
untuk memperoleh:
Kemudian gunakan sifat distribusi dari matematika dan menyusun yang lainya
menjadi persamaan (2.44):
Dengan
Penjumlahan dari momentum relativitas kuadrat , waktu dari kecepatan kuadrat
cahaya dan masa enegi kuadrat adalah sama dengan masa
mengambil akar kuadrat kedua sisi dan persamaan (2.45), mengungkapkan bahwa
itu dapat disubtitusi kedalam persamaan gelombang relativitas Schr dinger dari
persamaan (2.16) untuk pergerakan elektron:
Mensubsitusi persamaan (2.37) kedalam persamaan (2.16) diikuti dengan
menambahkan masa energi dan energi potensial pada kedua sisinya dari
persamaan (2.16).
Karena orbit perputaran alat penghubung tidak diambil pertimbangan elektron
akan sama jika nilai putaran intrinsik adalah nol dari satu setengah dan masa
energi dari elektron adalah konstan, nilai energi En dari model atom relativitas
Bohr (persamaan 2.33) adalah menambahkan nilai masa elektron ke hasil
persamaan gelombang relativitas Schr dingeruntuk nilai energi En:
Dengan
= Energi mekanika atom Bohr (J)
Tak sama dengan hasil energi dari model atom hidrogen relativitas Bohr
hasil bilangan dari persamaan (2.48) adalah lebih baik dari nol, positif n lebih dari
satu ketika ada lebih dari 137 proton didalam atom nukleus (Z>137). Jadi,
persamaan (2.48) sekarang menjadi:
Demikian, setelah mengkuadratkan kedua sisi dari persamaan (2.50) dan
Dengan mensubsitusi persamaan (2.43) dan menyatakan differensial dari
partikel-partikel ke persamaan (2.55), diikuti satu versi dari persamaan gelombang
relativitas Schr dinger:
Langkah selanjutnya adalah membagi persamaan (2.56) dengan hasil
dan diikuti pernyataan dan diperoleh:
Kemudian, setelah beberapa aljabar, persamaan (2.57) menjadi versi yang
sederhana dari hasil persamaan gelombang relativitas Schr dinger ke nol
kemudian massa :
Dan setelah mensubsitusi kedalam persamaan (2.48) untuk perhitungan tingkatan
Setelah ditambahkan, untuk mengikuti hasil bagi dari konstanta Planck h
dan hasil akan di susun :
Bagian yang akan datang memberikan pembicaran bagaiman memecahkan
pernyataan sebagian differential di persamaan (2.59) menggunakan polar
Spherical dari pada koordinat kartesius segi empat., operator momentum kuadrat
dapat dipisahkan kedalam penjumlahan dari momentum jari-jari lingkaran
kuadrat dan operator momentum kuadrat angular jika satu persamaan (2.59) terus
dengan :
Ini tepat karena adalah penjumlahan urut untuk momentum angular.
2.6. Metode Beda Hingga (Finite Difference Method)
Metode beda hingga adalah metode numerik yang umum digunakan untuk
menyelesaikan persoalan teknis dan problem matematis dari suatu gejala fisis.
Secara umum metode beda hingga adalah metode yang mudah digunakan dalam
penyelesaian problem fisis yang mempunyai bentuk geometri yang teratur, seperti
interval dalam 1D (satu dimensi), domain kotak dalam dua dimensi, dan kubik
dalam ruang tiga dimensi.
Berbeda dengan metode elemen hingga (Finite Element Method) yang
memiliki banyak variasi bentuk elemennya, yaitu bentuk segi empat, segi tiga dan
segi yang lain. Sedangkan metode beda hingga bentuk diskriisasi elemennya
hanya berbentuk segi empat saja.
Aplikasi penting dari metode beda hingga adalah dalam analisis numerik,
khususnya pada persamaan diferensial biasa dan persamaan diferensial parsial.
Prinsipnya adalah mengganti turunan yang ada pada persamaan diferensial dengan
diskritisasi beda hingga berdasarkan deret Taylor. Secara fisis, deret Taylor dapat
diartikan sebagai besaran tinjauan pada suatu ruang dan waktu (ruang dan waktu
yang mempunyai perbedaan yang kecil dengan ruang dan waktu tinjauan
(Anderson, 1984). Atau secara matematis dapat dituliskan sebagai:
Dengan h adalah Δr, subskrip i merupakan titik grid, superskrip n
menunjukkan time step dan adalah reminder atau biasa disebut truncation
error yang merupakan suku selanjutnya dari deret tersebut yang dapat dinyatakan
sebagai berikut,
Metode ini akan membuat pendekatan terhadap harga-harga yang tidak
diketahui pada setiap titik secara diskrit. Dimulai dengan pemodelan dari suatu
benda dengan membagi-bagi dalam grid atau kotak-kotak hitungan kecil yang
secara keseluruhan masih memiliki sifat yang sama dengan benda utuh sebelum
terbagi menjadi bagian-bagian yang kecil. Penerapan metode ini pada persamaan
adveksi adalah memperkirakan persamaan differensial yang bersangkutan beserta
syarat-syarat batasnya dengan seperangkat persamaan aljabar. Dengan mengganti
daerah yang kontinu dengan suatu pola titik-titik tersebut. Sistem dibagi menjadi
sejumlah subluas yang kecil dan memberi nomor acuan kepada setiap subluas.
Metode beda hingga bersifat eksplisit, artinya keadaan suatu sistem atau
solusi variabel pada suatu saat dapat digunakan untuk menentukan keadaan sistem
pada waktu beriukutnya. Berbeda dengan metode implisit, yang mana penentuan
solusi sistem harus dengan memecahkan sistem pada kedua keadaan, sekarang dan
yang akan datang.
Berdasarkan ekspansi Taylor di atas (persamaan 2.62), terdapat tiga skema
beda hingga yang biasa digunakan dalam diskritisasi PDP, yaitu beda maju, maju
mundur, dan maju tengah. Berikut adalah skema beda hingga untuk koordinat
∆r ∆θ
i,j+1
i,j
i,j-1
Θi
rj i+1,J i-1,j
Gambar 2.2 Skema beda hingga pada arah radial elektron
2.6.1. Beda Maju
Untuk beda maju, mencari nilai suatu fungsi independent variabelnya di geser ke
depan sebesar ∆r. Berikut ekspansi Taylor :
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan
2.6.2. Beda Mundur
Untuk beda mundur, mencari nilai suatu fungsi independent variabelnya di geser
ke belakang sebesar ∆r. Berikut ekspansi Taylor :
Maka,
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan
lengkungan (curvature) dari titik tersebut jika r digeser sebesar ∆r.
2.6.3. Beda Tengah
Jenis beda hingga yang ketiga adalah beda tengah, di mana untuk mencari
kemiringan dari fungsi tersebut dengan menggunakan perbedaan nilai fungsinya
dari beda depan dan beda belakang. Secara matematis, beda tengah adalah
Secara umum, symbol ∂R/∂r*∆r menunjukkan kemiringan (gradient) nilai fungsi
R pada jika r digeser sebesar ∆r. Sementara symbol ∂ 2R/∂r2 menunjukkan
BAB 3
METODE PENELITIAN
3.1. Literatur Alir Penelitian
Adapun metode yang digunakan dalam penelitian ini dapat dilihat pada diagram di
bawah ini:
MODEL ATOM BOHR (ATOM HIDROGEN)
KLASIK RELATIVISTIK
PERSAMAAN
SCH DINGERTAK BERGANTUNG WAKTU
NUMERIK (BEDA HINGGA)
BAB 4
HASIL DAN PEMBAHASAN
4.1 Penyelesaian dari Persamaan Gelombang Relativitas Schr dinger Dari Atom Hidrogen
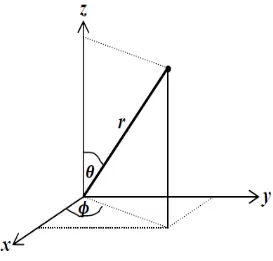
Karena energi potensial diantara elektron dan nukleus positif yang tergantung pada pemisahan jarak r dari tengah lokasi asal nukleus, bagian differential dan persamaan gelombang relativitas Schr dinger harus di transformasikan dengan koordinat kartesius segi empat x,y, dan bahwa dari koordinat polar bola dan
memperoleh penyelesaikan ke persamaan (2.62), jika menentukan satu digunakan sisiten koordinat kartesius segi empat, penyelesaian analitik lainya dengan segitiga yang baik.
Gambar 4.1 koordinat polar bola
Pada persamaan (4.1), dan adalah Dan komponen dari vektor r sepanjang dan akses dan komponennya mengikuti fungsi dan
dan . :
(4.3)
Dengan
= Proyeksi vector r terhadap sumbu x
= Proyeksi vector r terhadap sumbu y =Proyeksi vector r terhadap sumbu z
Pada koordinat polar bola, menetukan sudut di antara poros z dan vektor r tidak ditempatkan. Untuk memperlihatkan vektor dari massa tengah atom nukleus dari elektron dan sepanjang poros x dan poros y pada lokasi asalnya, sudut adalah diantara poros x dan proyeksi dan vector r diatas xy. Karena dan adalah fungsi dari x,y dan z, ketika mengggunakan operator momentum kuadrat diatas fungsi gelombang y, perbedaan kalkulus vektor menggunakan momentum kuadrat dalam kooardinat polar bola :
Setelah menunjukan angka dari perpindahan matematika, persamaan (4.5) diikuti perbedaan pernyataan dalam sistem koordinat polar bola:
Sebuah perbedaan, persamaan (4.6) menjadi:
Subsitusi persamaan (4.7) ke persamaan 2.62) dihasilkan persamaan gelombang relativitas Schr dinger:
Dengan
= Fungsi gelombang Schr dinger = Operator Del
Z = Nomor atom
= Konstanta Atom Hidrogen = Massa Elektron Diam (kg)
= Tetapan Planck ( )
Dengan pernyataan differensial dari persamaan (4.9), solusi matematika
Kembali mengikuti hasil dari dua fungsi gelombang differensial. untuk koordinat polar bola dan
(4.10) Sekarang, memungkinkan untuk memisahkan variable r dari 2 variabel lainnya dan Memasukkan ke penyelesaian, persamaan (4.10) ke dalam persamaan (4.9) sebagian persamaan differensial menjadi:
Untuk persamaan (4.11), diikuti persamaan differensial dihubungkan ke operator momentum angular pengoprasian diatas fungsi gelombang angular y,
dan sudut dan dalam mekanis kuantum:
Dengan,
= Momentum angular = Tetapan Planck (Js)
= Momentum kuantum Orbital L= Momentum Sudut Elektron
adalah bilangan momentum kuantum Orbital dimana selalu bernilai positif atau bernilai nol ,sama dengan gelombang kuantum bilangan n untuk model relativitas Bohr dari atom Hidrogen yang membicarakan sesi sebelumnya dan l dari vektor momentum angular untuk itu :
Hasil ini juga didalam penambahan kuantum magnetik m, dalam atom hidrogen dimana diikuti dengan pemilihan :
setelah terpecahkan untuk , sesuatu akan dapat dibagi pernyataan diffrensial dalam persamaan (4.11) dengan penyelesaain untuk sampai pada persamaan diffrensial untuk fungsi elektron radial R(r) :
Dengan
= Momentum angular = Tetapan Planck (Js)
= Momentum kuantum Orbital
Persamaan (4.16) dibagi dengan dan menambahkan difrensial lengkap dengan r, nilainya diikuti dengan persamaan difrensial dari fungsi distribusi radial untuk elektron dari atom hidrogen dalam persamaan gelombang relativitas Schr dinger:
Berbeda dengan yang diikuti dengan fungsi difrensial radial:
Ini tidak penyelesaian anlitik untuk fungsi distribusi radial R(r) dalam persamaan (4.17) seperti pemakaian pemilihan peraturan diantara bilangan kuantum l dan n:
Oleh karena itu teknik bilangan seperti pembatas difrensial yang dapat diperoleh dalam Microsoft excel yang memecahkan pernyataan difrensial dalam persamaan (4.17) akan di bicarakan dalam sesi selanjutnya.
Erwin Schr dinger dengan persamaan gelombang klasik dari atom hidrogen dengan menggunakan fisika Newton klasik (persamaan 2.1) dalam mengerjakan Energi kinetik dari atom hidrogen seperti:
Pada pencantuman di persamaan (4.21) bahwa Schr dinger memiliki peraturan dalam persamaan (4.20). Jika suatu tampilan persamaan (2.25) dari model atom hidrogen relativitas Bohr, seperti banyaknya jumlah energi dalam persamaan (2.39) untuk awal dari persamaan gelombang relativitas Schr dinger. Pemilihan peraturan untuk momentum angular bilangan kuantum l dalam persamaan (4.20) akan ditampilkan dalam penambahan orbit singular dari jari-jari r untuk model atom hidrogen relativitas Bohr, diikuti pernyataan yang di tampilkan:
Dengan mensubtitusikan persamaan (2.21) untuk orbit sirkuler jari-jari r membagi dan mengalikan sisi sebelah kiri dari persamaan dengan kecepatan cahaya c dan kemudian digunakan pernyataan pada persamaan (2.3) untuk massa relatifitas dari elektron dengan persamaan (4.22) menjadi
Persamaan (4.23) menjadi:
Setelah membagi massa dan tanpa membagi kecepatan elektron dengan kecepatan cahaya adalah sama dengan {persaman (2.17)}. Hasil ini diikuti dengan hubungan diantara nomor kuantum n dan l untuk lingkaran orbit:
Atau sama dengan persamaan kuadrat massa
jari-jari lingkaran sama dengan nol dan momentum angular maksimum memungkinkan untuk mengikari dua bagian dan loncatan pergerakan.
4.2 Penyelesaian Numerik dan Fungsi Distribusi Jari-Jari Untuk Persamaan Gelombang Relativitas Schr dinger
Biasanya untuk mendekati penyelesaian dari bilangan untuk persamaan penting bahwa tidak mengetahui penyelesaian analitik, menggunakan kondisi perputarannya. Bagaimanapun, untuk fungsi pendistribusian jari-jari lingkaran dari elektron dalam persamaan gelombang relativitas Schr dinger, satu yang diketahui bahwa kemungkinan maksimum untuk menentukan bilangan kuantum angular adalah l=0, pada prinsip bilangan kuantum lainnya n, adalah bagian tengah dari inti atom. Jika l>0, momentum angular sekarang ini, kemungkinan dan elektron pada inti atom adalah nol. Bagaimana pun, kondisi yang mengikuti dan keadaaan normal keseluruhan:
Untuk penyelesaian bilangan l=0, kemungkinan maksimum pada pertengahan dan inti atom dapat bervariasi sampai penggabungan bilangan dari persaamaan (4.27) untuk penyelesaian bilangan jari-jari lingkaran ) mendekati persamaan pertama. Untuk jumlah kuantum dari l>0, kemungkinan kecil dari ) menutup inti atom dapat bervariasi sampaikeadaan yang normal yaitu l=0.
Sebelum mambahas teknik bilangan dari perbedaan yang digunakan untuk penyelesaian persamaan (4.17) dengan Mc. Excel, yaitu pentingnya keadaan Unit apa yang akan digunakan. Unit meter—kilogram-sekon (MKS) dari ukuran akan hasil nilai yang sangat kecil yang mana dapat mengakibatkan kesalahan sama seperti kesalahan bilangan ketika melakukan analisis bilangan. Melainkan Angstrom akan digunakan untuk jarak yang cukup dalam meter dimana adalah meter. Massa unit atom akan digunakan dari kilogram (1 unit massa atom adalah kg) dan piko sekon digunakan dari detik pada waktu ketika 1 pikosekon adalah detik.
Itu tidak perlu untuk menunjukan perubahan apa saja untuk permivitas elektrostatik dari ruang hampa dan besar dari listrik dari elektron sejak nilainya adalah masukan unit-less - massa dalam mekanika kuantum relativitas. Dihubungkan kembali dengan persamaan (4.17)
ketika perubahan Angstrom, unit mssa atom, dan piko sekon selesai. Ketiga nilai konstanta diatas menjadi
Pertama dapat dimasukan jumlah bilangan
Dan hasil untuk persamaan (4.17)
Setelah penurunan kedua dari dalam persamaan (4.31) dan turunan pertama dari dibagi dengan r itu sendiri dalam persamaan (4.32), lalu digunakan dalam perhitungan pertama untuk memulai dengan jumlah terkeadaan inisial dari pada dan ) dimana awalnya dapat mendekati solusi analisis yang digunakan dari kegunaan jari-jari lingkaran persamaan gelombang klasik Schr dinger. Melalui Ms. Excel, menjumlahkan bilangan distribusi jari-jari lingkaran untuk persamaan gelombang relativitas Schr dinger sampai kesalahan hasil numerik dalam penyimpangan seperti R (r) mendekati nol dalam batas seperti r kenilai tak terbatas ( ) kemudian periksa normalisasi yang didapat dengan penyambungan bilangan dari persamaan (4.30) dari r=0 pada pertengahan dari inti atom yang langsung ke inti sebelum terjadi penyimpangan bilangan:
Menggunakan Mc.Excel, analisis bilangan adalah batas ke Angstrom ketika terjadi kesalahan menjadi permasalahan yang serius dalam hasil bilangan yang keliru Setelah itu, pengaruh relativitas adalah sejak kemungkinan maksimum neklus terendah dari pada solusi klasik dan solusi bilangan untuk persamaan gelombang relativitas Schr dinger mendekati poros r angka tercepat dengan muda.
Untuk menghasilkan persamaan fungsi gelombang radial elektron yang dipengaruhi relativistik subtitusikan persamaan (4.32), (4.33) dan (4.34) disubtitusikan kedalam persamaan (4.31). adapun persamaannya sebagai berikut:
Langkah selanjutnya mencari solusi numerik arah radial elektron atom hidrogen Dengan,
1. Untuk (lampiran B.1)
2. Untuk (lampiran B.2)
= 1
3. Untuk i=2 ( lampiran B.3)
4. Untuk (lampiran B.4)
5. Untuk (lampiran B.5)
6. Untuk (lampiran B.6)
7. Untuk (lampiran (B.7)
8. Untuk (lampiran B.8)
9. Untuk (lampiran B.9)
Sistem persamaan linear tersebut dapat dinyatakan dalam bentuk matrik
tridiagonal sebagai berikut:
Persamaan diatas dapat dinyatakan sebagai matrik
Penyelesaian dari adalah . Untuk mencari nilai invers matriks A dengan menggunakan Ms. Excel dapat diselesaikan melalui tahapan berikut:
1. Blok sembarang tempat, namun sesuaikan jumlah baris dan kolom pada matriks A.
2. Gunakan rumus {=MINVERSE(formula)} 3. Tekan ENTER
untuk mendapatkan matriks R dicari cari tahapan berikut:
1. Blok sembarang tempat, namun jumlah baris dan kolom harus sesuai dengan jumlah matriks A
2. Gunakan rumus {=MMULT(formula 1, formula 2)}
3. Tekan ENTER
Adapun mariks R (lihat lamp B) yang didapat sebagai berikut:
4.5
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dengan menggunakan pemisahan variabel dari persamaan Schrodinger
koordinat bola didapat persamaan fungsi gelombang arah radial, yaitu:
2. Fungsi gelombang radial elektron yang di pengaruhi efek relativistik dapat
dikomputasiakn menggunakan metode beda hingga seperti persamaan berikut:
3. Fungsi gelombang elektron arah radial yang di pengaruhi efek relativistik
terlihat semakin mengecil seiring dengan meningkatnya jejari atom.
5.2 Saran
Untuk penelitian selanjutnya yaitu menentukan solusi numerik pada tingkat
bilangan kuantum, pertambahan nomor atom maupun untuk atom yang lain
DAFTAR PUSTAKA
Andreas F.Terzis. 2008 A simple Relativistic Bohr Atom, European Journal of physic
Anugraha, R. 2005. Pengantar Teori relativitas dan Kosmologi. Yogyakarta: GajahMada University Press.
Arfken, G.B. dan Weber, H.J. 1995. Mathematical Methods for Phisicists. Fourth Edition. San Diego: academic Press.
Beiser, A.1982. Konsep Fisika modern. Edisi ketiga. Jakarta: Erlangga
Daniel, Keppner and Robert J. Kolenkow.1973, An Introduction to Mechanics, McGraw-Hill Book Comps any
Faires, J. Douglas. 1993. Numerical Method. Boston : PWS-KENT Publishing Company.
Gilbert W. Castellan,1971, physical Chemistry, Edition, Addison-Wesley Publishing Company
Handayanto, Agung. Persamaan Differensial Parsial dalam Koordinat Silindris
pada Masalah Konduksi Panas. Semarang : IKIP PGRI
Hallliday and Resnick.1974. Fundamental of Phisics. John Wiley& Sons, incorporated
Jamhuri,M.2013.Persamaan Difusi,Penurunan,Solusi Analitik,Solusi
Numerik(Beda Hingga).UIN Press. Malang
Kane, G.1987.Modern Elementary Particle Physics. Addison-Wesley Publising Company.Californiane
Kenneth S,1992, Fisika Moderen, Penerjemah Hans J.Wospakrik,Cetakan I,Penerbit Universitas Indonesia
Leveque,Randal J.2005.Finite Difference Methods For Differential Equations. University Of Wasington
Nasution, Amrinsyah & Zakaria Hasballah. 2001. Metode Numerik dan Ilmu
Rekayasa Sipil. Bandung : ITB Press.
Rao, K. Sankara, 2001. Numerical Method for Scientists and Engineering. New
Delhi : Prentice Hall of India
Robert, Eisbert and Resnick.1985. Quantum Phisic of Atom, Molecules,
solids,Nuclei and Particles. Edition. John Wiley & Sons, Incorporate
LAMPIRAN A
Alfabet Yunani
Alpha Nu
Beta Xi
Gamma Omicron
Delta Pi
Epsilon Rho
Zeta Sigma
Eta Tau
Theta Upsilon
Iota phi
Kappa Chi
Lambda Psi
LAMPIRAN B
SOLUSI NUMERIK ARAH RADIAL ELEKTRON ATOM HIDROGEN
Dik
Dit: arah radial..?
4. Untuk
2. Untuk
= 1
4. Untuk
5. Untuk
6. Untuk
7. Untuk
8. Untuk
9. Untuk
Dari persamaan diatas dapat dinyatakan dalam bentuk persamaan linear
Sistem persamaan linear tersebut dapat dinyatakan dalam bentuk matrik
Persamaan diatas dapat dinyatakan sebagai matrik Misal matrik A adalah:
Dan matrik R adalah:
Kemudian matrik B adalah:
Setelah mendapatkan nilai invers matrik A, selanjunya kita akan mencari nilai matrik R, dimana matrik R sebagai berikut:
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5