TINJAUAN PUSTAKA
2.1 SEPSIS 2.1.1 Epidemiologi
Sepsis dalam 20 tahun terakhir meningkat di Amerika Serikat, diperkirakan
jumlah kasus sepsis 400.000 – 500.000 setiap tahunnya. Data di Amerika Serikat
menunjukkan pada tahun 1979 tercatat 164.000 kasus sepsis (87,2/100.000 populasi),
sedangkan pada tahun 2000 tercatat 600.000 kasus (240,4/100.000 populasi) sehingga
terjadi peningkatan insiden pertahun 8,7% (Oncel et.al., 2012). Sepsis merupakan
penyebab terbanyak kematian di ruang rawat intensif pada seluruh dunia dengan
angka mortalitas 28.6% untuk sepsis, 32.2% sepsis berat dan 54% syok sepsis. Di
Amerika Serikat, sepsis merupakan penyebab kematian utama pada pasien jantung
yang dirawat di UPI (Pittet et.al., 1995, Kauss et.al., 2010, Artero et.al., 2012 ).
Dalam penelitian lain, para peneliti menguji hubungan antara umur dan sepsis dan
menunjukkan bahwa pada usia 65, resiko relatif untuk sepsis bagi mereka lebih tua
dari 65 tahun adalah 13,1 kali lebih tinggi dibandingkan mereka yang lebih muda dari
65 tahun. Secara keseluruhan, individu ≥ 65 tahun menyumbang 64,9% dari total
kasus sepsis(Danai et.al., 2006). Menariknya, ada 215.000 kematian selama periode
penelitian, yang sebenarnya mewakili 9,3% dari semua kematian di Amerika Serikat.
Insiden sepsis meningkat karena populasi umur tua, bertambahnya jumlah pasien
immunocompromised, dan meningkatnya tindakan prosedur invasif dan antibiotik
yang resisten terhadap kuman. Di Amerika Serikat, hampir 17 miliar dolar dihabiskan
untuk mengobati pasien sepsis. Meskipun terdapat kemajuan dalam hal perawatan,
lebih dari 210.000 pasien meninggal dengan sepsis berat tiap tahunnya. Dan terdapat
perbandingan insiden dan mortalitas sepsis berat dengan penyakit lain (gambar 2.1)
Gambar 2.1 Perbandingan insiden dan mortalitas sepsis berat dengan penyakit lain
(Angus, 2001).
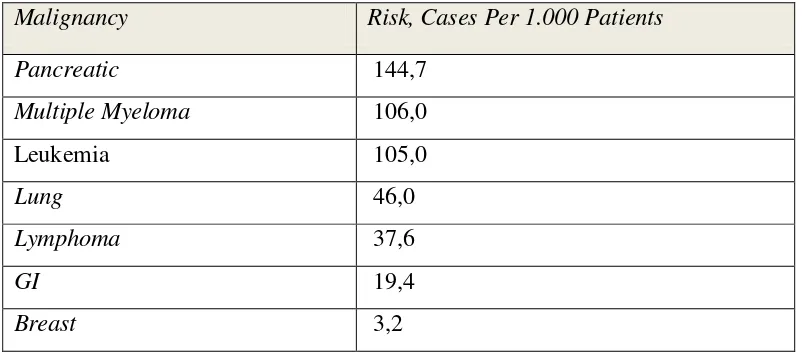
Pasien dengan keganasan yang terdiagnosis dengan sepsis, memiliki resiko
relatif peningkatan sampai 10 kali lipat bila dibandingkan dengan mereka yang
tidak terkena kanker. Kanker pankreas memiliki resiko yang terkait sepsis dengan
angka tertinggi, diikuti oleh multipel myeloma, leukemia, dan kanker paru-paru,
sedangkan kanker saluran cerna dan keganasan payudara berhubungan dengan
kecenderungan yang jauh lebih rendah untuk sepsis (Tabel 2.1) (Danai et.al.,
2006).
Tabel 2.1 Subtipe Kanker dan Kejadian Sepsis(Danai et.al., 2006).
Malignancy Risk, Cases Per 1.000 Patients
Pancreatic 144,7
Multiple Myeloma 106,0
Leukemia 105,0
Lung 46,0
Lymphoma 37,6
GI 19,4
Breast 3,2
Incidence of Severe Sepsis Mortality of Severe Sepsis
AIDS* Colon Breast cancer
CHF Severe sepsis
AIDS* Breast cancer
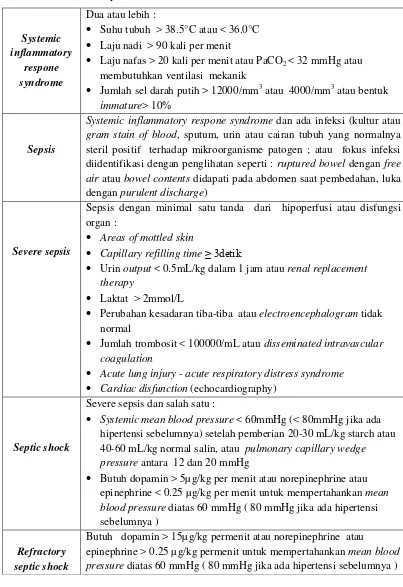
2.1.1 Definisi
Di bawah ini akan dipaparkan definisi penyakit yang berkaitan dengan
sepsis menurut jurnal dari Lancet tahun 2005 (tabel 2.2) (Annane et.al., 2005).
Tabel 2.2 Definisi Penyakit (Annane et.al., 2005).
Systemic
Laju nafas > 20 kali per menit atau PaCO2 < 32 mmHg atau membutuhkan ventilasi mekanik
Jumlah sel darah putih > 12000/mm3 atau 4000/mm3 atau bentuk immature> 10%
Sepsis
Systemic inflammatory respone syndrome dan ada infeksi (kultur atau gram stain of blood, sputum, urin atau cairan tubuh yang normalnya steril positif terhadap mikroorganisme patogen ; atau fokus infeksi diidentifikasi dengan penglihatan seperti : ruptured bowel dengan free air atau bowel contents didapati pada abdomen saat pembedahan, luka dengan purulent discharge)
Severe sepsis
Sepsis dengan minimal satu tanda dari hipoperfusi atau disfungsi organ :
Areas of mottled skin
Capillary refilling time ≥ 3detik
Urin output < 0.5mL/kg dalam 1 jam atau renal replacement therapy
Laktat > 2mmol/L
Perubahan kesadaran tiba-tiba atau electroencephalogram tidak normal
Jumlah trombosit < 100000/mL atau disseminated intravascular coagulation
Acute lung injury - acute respiratory distress syndrome
Cardiac disfunction (echocardiography)
Septic shock
Severe sepsis dan salah satu :
Systemic mean blood pressure < 60mmHg (< 80mmHg jika ada hipertensi sebelumnya) setelah pemberian 20-30 mL/kg starch atau 40-60 mL/kg normal salin, atau pulmonary capillary wedge pressure antara 12 dan 20 mmHg
Butuh dopamin > 5µg/kg per menit atau norepinephrine atau epinephrine < 0.25 µg/kg per menit untuk mempertahankan mean blood pressure diatas 60 mmHg ( 80 mmHg jika ada hipertensi sebelumnya )
Refractory septic shock
Butuh dopamin > 15µg/kg permenit atau norepinephrine atau
2.1.2 Patofisiologi SEPSIS
Sepsis merupakan puncak dari interaksi yang kompleks antara organisme
penyebab infeksi dan host imun. Kedua hal yakni respon host dan karakteristik
dari organisme penyebab infeksi mempengaruhi outcome sepsis. Pada sepsis
diawali dengan aktivasi sistem imun bawaan, sebagai respon terhadap infeksi,
melalui pengenalan terhadap benda asing yakni endotoksin bakteri
(Lipopolisakarida dan Peptidoglikan). Mekanisme ini antara lain pelepasan
sitokin, aktivasi neutrofil, monosit dan makrofag dan sel endotel serta aktivasi
komplemen, koagulasi, fibrinolitik, dan sistem kontak (O’Reilly et.al., 1999,
Balk, 2000).
Toll-like receptors (TLR) mengatur mekanisme pertahanan tubuh dan
berperan penting dalam aktivasi imun bawaaan. TLR adalah reseptor pada
permukaan sel yang mengenali komponen molekuler dari mikroorganisme. Pada
fase awal dari infeksi, TLR mengaktivasi sistem imun bawaan dan
menghancurkan patogen dari makrofag, natural killer cells dan sistem
komplemen. Pada fase kedua, TLR mengaktivasi sistem imun didapat dengan
mengaktivasi limfosit T dan B. Disini produksi sitokin berperan penting.
Makrofag dan monosit yang teraktivasi adalah sel yang utama yang menghasilkan
sitokin, tapi fibroblast, neutrofil dan sel endotel juga dapat menghasilkan sitokin
(O’Reilly et.al., 1999, Balk, 2000). TLR-4 mengenali LPS bakteri gram negatif, TLR-2 mengenali peptidoglikan bakteri gram positif. Ikatan TLR dengan epitop
pada mikroorganisme akan mengaktifkan jalur transduksi sinyal intraseluler yang
mengaktifkan cytosolic nuclear factor kB (NF-kB). NF-kB meningkatkan
transkripsi sitokin. Sitokin akan mengaktifkan sel endotel dengan meningkatkan
ekspresi molekul permukaan dan memperkuat adhesi neutrofil dan endotel di
tempat infeksi. Sitokin juga menyebabkan cedera sel endotel melalui induksi
neutrofil, monosit, makrofag dan trombosit yang melekat pada sel endotel
(O’Reilly et.al., 1999, Balk, 2000, Hotchkiss, 2003).
Sitokin juga melepaskan mediator seperti protease, oksidan, prostaglandin,
dan leukotrien. Protease, oksidan, prostaglandin, dan leukotrien, akan merusak sel
endotel, menimbulkan peningkatan permeabilitas, vasodilatasi dan perubahan
koagulasi. Selain itu endotel yang teraktivasi akan melepaskan nitric oxide (NO),
suatu bahan vasodilator poten yang berperan pada syok sepsis.
Sitokin dibedakan menjadi proinflamasi dan anti inflamasi, tergantung
fungsinya. Tumor Necrosing Factorα (TNF-α), Interleukin 1ß(IL-1ß), IL-6, IL-8,
IL-12 adalah sitokin proinflamasi utama yang berperan dalam aktivasi awal dari
respon inflamasi sistemik pada sepsis. TNF-α terutama diproduksi oleh monosit
dan makrofag, dan bekerja merangsang produksi molekul adhesi pada sel endotel
serta sistem koagulasi dan komplemen. IL-1 terutama dihasilkan oleh monosit dan
makrofag. IL-1ß dan TNF-α mempunyai efek sinergik. IL-1ß merangsang
produksi IL-6, IL-8 dan TNF-α dan dapat menyebabkan perubahan hemodinamik
sama seperti syok sepsis. Pada banyak penelitian didapat bahwa kadar IL-1ß tidak
berhubungan dengan beratnya penyakit, sedangkan TNF-α berhubungan dengan
beratnya penyakit pada beberapa studi (O’Reilly et.al., 1999, Balk, 2000,
Hotchkiss, 2003, Sharma, 2003).
Sepsis juga mengaktifkan produksi dan pelepasan sitokin anti inflamasi.
Antagonis reseptor IL-1 (IL-1ra) menghambat IL-1, yang berikatan secara
kompetitif dengan reseptor IL-1 dan menghambat kerja IL-1. IL-1ra dihasilkan
terutama oleh makrofag. Beberapa studi gagal membuktikan bahwa pemberian IL-
1ra pada sepsis dapat memperbaiki mortalitas pada sepsis.35,36 IL-10 adalah sitokin anti inflamasi utama. Sitokin ini menghambat produksi TNF-α, IL-1ß,
IL-6, IL-8. Sitokin ini juga menekan pelepasan radikal bebas dan aktifitas NO serta
produksi prostaglandin. Beberapa sel yang dapat memproduksi IL-10 adalah
CD-4, CD-8, makrofag, monosit, limfosit B, sel dendrit dan sel epitel. Pada syok
sepsis, monosit merupakan sumber utama dari sitokin ini. IL-10 tidak hanya
membatasi beratnya respon inflamasi, tapi juga mengatur proliferasi sel T, sel B,
natural killer cells, antigen precenting cells, sel mast dan granulosit. Sitokin ini
berperan dalam supresi imun, sebagai stimulator imunitas bawaan. Beberapa studi
mendapatkan bahwa pada keadaan sepsis .kadar sitokin IL-10 meningkat dan
lebih meningkat lagi pada syok sepsis (Jilma et.al., 1999, sharma, 2003,).
IL-6 merupakan sitokin yang paling banyak diteliti pada sepsis dan
palingsering ditemukan meningkat. Kadarnya meningkat lebih lama dibandingkan
dan sel endotel dan berhubungan dengan derajat beratnya sepsis sehingga
peningkatan yang persisten berhubungan dengan perkembangan multiple organ
failure (MOF) dan prognosis buruk. Sitokin ini mengatur diferensiasi dari sel
limfosit B dan T. Sitokin ini adalah pirogen endogen dan demam pada pasien
sepsis disebabkan oleh sitokin ini. Sitokin ini juga bersifat anti inflamasi yang
menghambat produksi sitokin pro-inflamasi lainnya (Cohen, 2002, Nasronudin,
2007).
Gambar 2.2 Respon imun terhadap infeksi organisme (Nasronudin, 2007).
IL-8 berfungsi mengaktivasi dan sebagai kemotaksis neutrofil ke tempat
inflamasi. Konsentrasi tinggi dari sitokin ini dapat merangsang infiltrasi neutrofil,
merusak endotel, kebocoran plasma dan cedera jaringan lokal. Sebaliknya sitokin
ini juga menghambat migrasi neutrofil apabila berada dalam sirkulasi, sehingga
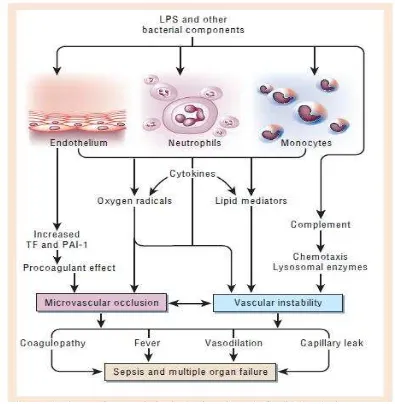
Patogenesis sepsis adalah kompleks, meskipun kemajuan yang bermakna,
masih tetap tidak dimengerti. Utamanya, sepsis adalah hasil dari interaksi antara
mikroorganisme dan/atau produk mereka dan respon tuan rumah akibat
dikeluarkan sitokin dan mediator lainnya.
Gambar 2.3 Patogenesis terjadinya Multiple Organ Failure dan Syok pada Sepsis
(Cohen, 2002).
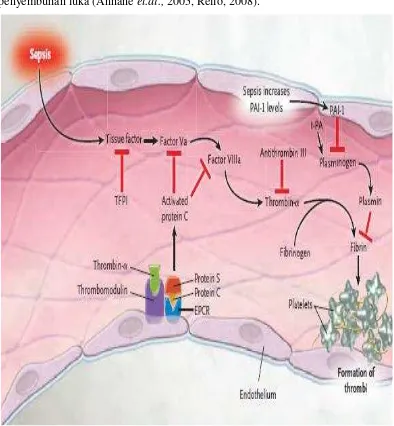
Komponen terpenting dari respon tuan rumah adalah berkembangnya
mekanisme alami awal untuk memproteksi organisme dari kerusakan. Akan tetapi
pada sepsis, respon imun itu sendiri yang menimbulkan respon kaskade sekunder
dimana mencetuskan disfungsi organ bahkan kematian, selain eradikasi dari invasi
terkontrol juga gabungan dari disregulasi dari anti-inflamasi, koagulasi dan jalur
penyembuhan luka (Annane et.al., 2005, Rello, 2008).
Gambar 2.4 Respon prokoagulasi pada sepsis (Annane et.al., 2005).
2.1.4 Disfungsi Mikrosirkulasi Pada Sepsis
Gangguan mikrosirkulasi merupakan petanda terjadinya sepsis. Jejaring
dari pembuluh darah terkecil berdiameter < 100um, tempat terjadinya pelepasan
oksigen ke jaringan dan termasuk arteriol, kapiler serta venula. Jejaring ini
memiliki 10 miliar kapiler dan permukaan endotel lebih dari 0,5 km2. Jenis sel utama dalam mikrosirkulasi diantaranya sel endotel, sel otot polos, sel darah
merah, leukosit dan trombosit.Sel endotel memiliki peran penting dalam
imunologi serta pelepasan NO dalam menanggapi adanya kerusakan-kerusakan
dinding pembuluh darah atau hipoksia. NO mengatur resistensi diameter
pembuluh darah (relaksasi sel-sel otot polos di proksimal arteriol), reologi darah
(mengatur kelenturan sel darah dan leukosit), interaksi antara elemen darah dan
dinding pembuluh darah (mengatur adhesi leukosit-endotel dan adhesi/agregasi
trombosit) serta mengatur volume darah (meningkatkan permeabilitas selama
terjadinya endotosemia).
Sepsis menyebabkan terjadinya inflamasi sistemik dengan mengakitifkan
leukosit yang memproduksi reactive oxygen species (ROS) .ROS dapat membantu
melawan patogen, tetapi juga berdifusi dan mengaktifkan sel-sel endotel,
menyebabkan migrasi P-selectin ke dalam membran endotel. Sitokin
pro-inflamasi dapat langsung mengaktifkan sel-sel endotel dan mencetuskan produksi
ROS oleh mitokondria, xanthine oxidase (XO), dan NADPH oxidase
(NADPH-ox), ROS bisa juga secara langsung merangsang migrasi cadangan P-selectin ke
dalam membran sel atau mengaktifkan nuclear factor- kappa B ( NF-kB). Adhesi
protein expression (P-selectin dan E selectin,intercellular adhesion molecule -1
[ICAM-1], dan vascular adhesion molecule – 1 [VCAM-1] menyebabkan adhesi
leukosit yang memproduksi ROS secara lokal. Produksi ROS intraselular dapat
menetralkan NO dan menurunkan ketersediaannya yang mengaktifkan ganguan
tonus pembuluh darah.Lagi pula ROS dapat mempengaruhi keseimbangan antara
prostanoid vasokonstriktor dan vasodilator dengan memodifikasi aktifitas
cyclooxygenase (COX). Kadar glutathione (GSH) menurun selama sepsis
demikian juga superoxide dismutase (SOD), akibatnya akan terjadi berkurangnya
kemampuan detoksifikasi.
Adhesi leukosit, adhesi/agregasi trombosit, edema endotel semuanya
menyebabkan oklusi kapiler. Sebetulnya oklusi kapiler merupakan mekanisme
adaptasi bahkan mekanisme proteksi untuk membendung penyebaran infeksi
sistemik, namun akibat oklusi ini terjadi gangguan distribusi oksigen dan glukosa
ke dalam sel yang didalamnya terdapat mitokondria yang berfungsi sebagai
pemasok oksigen serta berperan dalam oxygen sensing dan pengaturan jalur
2.1.5 Disfungsi Mitokondria dan Proses Apoptosis Pada Sepsis
Mitokondria ada pada semua sel berinti. Peran utama mitokondria adalah
menghasilkan energi sel dalam bentuk adenosin trifosfat (adenosine triphospate,
ATP) dengan proses yang disebut fosforilasi oksidatif. Fosforilasi oksidatif yang
efisien dalam menghasilkan ATP dikatakan berpasangan ketat. Bila mitokondria
kurang efisien dalam menghasilkan ATP, akan tidak berpasangan sebagian dan
akan menghasilkan panas. Dengan demikian sistem fosforilasi oksidatif
mitokondria harus diatur dengan ketat agar tercapai keseimbangan antara produksi
ATP untuk energi dan produksi panas untuk mempertahankan suhu tubuh.
Beberapa mediator inflamasi yang dilepaskan selama sepsis menghambat proses
fosforilasi oksidatif. Gangguan multi organ yang terjadi pada sepsis belum terlalu
dimengerti, tetap itu ada hubungannya dengan ambilan oksigen di dalam sel
walaupun perfusi jaringan cukup adekuat.
Gambar 2.5 Perbedaan metabolisme aerobik dan anaerobik
Seperti telah disebutkan sebelumnya bahwa mitokondria berfungsi untuk
menjaga homeostasis sel, namun demikian mitokondria juga memegang peranan
penting dalam pengaturan program kematian sel, atau apoptosis. Apoptosis
dicetuskan oleh jalur intrinsik dan ekstrinsik. Stress oksidatif dapat menginduksi
jalur intrinsik dari apoptosis. Zat-zat berbahaya menyebabkan mitokondria
melepaskan sitokrom c dan protein pro-apoptosis lainnya ke dalam sitosol,
akhirnya terjadi pengaktifan kaspase apoptosis semakin diperkuat. Oleh karena
metabolisme sel tergantung pada produksi ATP, kerusakan mitokondria, akan
mempengaruhi fungsi respirasi dan dapat mempengaruhi kemampuan hidup sel
(Sri, 2011).
2.1.6 SURVIVING SEPSIS CAMPAIGN
Pada tahun 2005, Surviving Sepsis Campaign (SSC) bersama dengan
Institute for Health-care Improvement (IHI) menyusun panduan pengelolaan
pasien sepsis berat dan syok sepsis yaitu Severe Sepsis Bundles yang terdiri dari
dua bundle. Pertama, The Sepsis Resusitation Bundle, resusitasi yang harus segera
dimulai dan diselesaikan dalam 6 jam pertama sejak pasien didiagnosis sepsis
berat atau syok sepsis. Kedua, The Sepsis Management Bundle, harus segera
dimulai dan selesai dalam 24 jam pada pasien dengan sepsis berat atau sepsis
berat. Berikut dilampirkan kriteria diagnostik untuk pasien sepsis menurut
Surviving Sepsis Campaign (SSC).
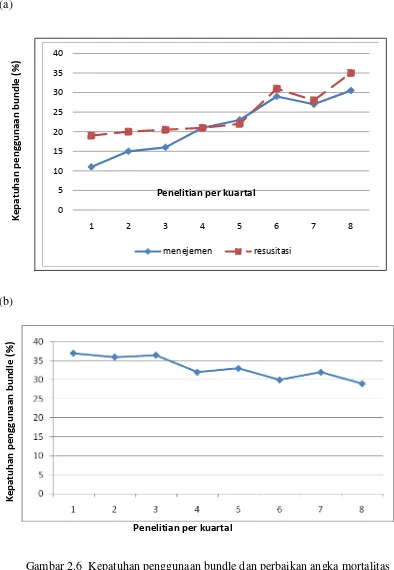
Untuk mengetahui partisipasi pelaksanaan sepsis bundle dan dampaknya
terhadap angka mortalitas rumah sakit, SSC mengumpulkan data kepatuhan
melaksanakan sepsis bundle pada UPI di 165 rumah sakit dengan 15.022 pasien,
pada periode januari 2005 sampai dengan Maret 2008. Kesimpulan dari penelitian
ini adalah bahwa penurunan angka kematian rumah sakit terjadi bila ada
kepatuhan pengguna sepsis bundle pada pengelolaan pasien dengan sepsis berat
dan syok sepsis. Pada tahun 2008 SSC kembali melakukan revisi panduan dengan
menggunakan sistem GRADE (Grade of Recommendation, Assessment,
Development and Evaluation) (Sri, 2011). Pada saat ini SCC 2012 yang
pula Surviving Sepsis Campaign Bundles yang harus diselesaikan dalam waktu 3
jam dan 6 jam (Dellinger et.al., 2012).
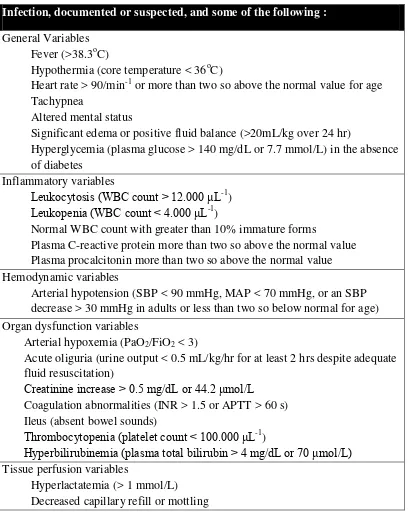
Tabel 2.3 Kriteria Diagnostik (Dellinger et.al, 2008).
Infection, documented or suspected, and some of the following :
General Variables Fever (>38.3oC)
Hypothermia (core temperature < 36oC)
Heart rate > 90/min-1 or more than two so above the normal value for age Tachypnea
Altered mental status
Significant edema or positive fluid balance (>20mL/kg over 24 hr)
Hyperglycemia (plasma glucose > 140 mg/dL or 7.7 mmol/L) in the absence of diabetes
Inflammatory variables
Leukocytosis (WBC count > 12.000 μL-1 )
Leukopenia (WBC count < 4.000 μL-1 )
Normal WBC count with greater than 10% immature forms
Plasma C-reactive protein more than two so above the normal value Plasma procalcitonin more than two so above the normal value Hemodynamic variables
Arterial hypotension (SBP < 90 mmHg, MAP < 70 mmHg, or an SBP decrease > 30 mmHg in adults or less than two so below normal for age) Organ dysfunction variables
Arterial hypoxemia (PaO2/FiO2 < 3)
Acute oliguria (urine output < 0.5 mL/kg/hr for at least 2 hrs despite adequate fluid resuscitation)
Creatinine increase > 0.5 mg/dL or 44.2 μmol/L
Coagulation abnormalities (INR > 1.5 or APTT > 60 s) Ileus (absent bowel sounds)
Thrombocytopenia (platelet count < 100.000 μL-1 )
Hyperbilirubinemia (plasma total bilirubin > 4 mg/dL or 70 μmol/L)
Tissue perfusion variables
Tabel 2.4 Kriteria Sepsis Berat (Dellinger et.al, 2008).
Severe sepsis definition = sepsis-induced tissue hypoperfusion or organ
dysfunction (any of the following thought to be due to the infection)
Sepsis-induced hypotension
Lactate above upper limits laboratory normal
Urine output < 0.5 ml/kg/hr for more than 2 hours despite adequate fluuid
resuscitation
Acute lung injury with PaO2/FiO2 < 250 in the absence of the pneumonia as
infection source
Acute lung injury with PaO2/FiO2 < 200 in the presence of the pneumonia as
infection source
Creatinine > 2.0 mg/dL (176.8 μmol/L)
Bilirubin > 2 mg/dL (34.2 μmol/L)
Platelet count < 100.000 Μl
Coagulopathy (international normalized ratio > 1.5)
(a)
(b)
Gambar 2.6 Kepatuhan penggunaan bundle dan perbaikan angka mortalitas
a. Perubahan persentase kebutuhan pasien dengan resuscitation bundle (garis
putus-putus) dan management bundle (garis tebal) selama 2 tahun
pengumpulan data (*p<0,01 dibandingkan kuartal 1).
b. Perubahan angka kematian rumah sakit selama 2 tahun pengumpulan data
(*p<0,01 dibandingkan kuartal 1) (Sri, 2011).
2.2 TROMBOSIT
2.2.1 Produksi Trombosit
Trombosit, dihasilkan dari megakariosit sumsum tulang, sebuah sel
raksasa (megakariosit) yang memiliki 8-32 inti hasil dari pembelahan inti tanpa
disertai pembelahan sel yang memiliki ukuran 1-2µm (Ferreiro et.al., 2010).
Prekursor megakariosit, megakarioblast, muncul melalui proses
diferensiasi dari sel induk hemopoetik. Megakariosit mengalami pematangan
dengan replikasi inti endomitotik yang sinkron, memperbesar volume sitoplasma
sejalan dengan penambahan lobus inti menjadi kelipatanduanya.Pada berbagai
stadium dalam perkembangannya (paling banyak pada stadium inti delapan),
sitoplasma menjadi granular dan trombosit dilepaskan. Produksi trombosit
mengikuti pembentukan mikrovesikel dalam sitoplasma sel yang menyatu
membentuk membran pembatas trombosit. Tiap sel megakariosit menghasilkan
1000-1500 trombosit. Sehingga diperkirakan akan dihasilkan 35.000/ul trombosit
per hari. Interval waktu semenjak diferensiasi sel induk sampai produksi
trombosit berkisar sekitar 10 hari (Kauhansky, 2004, Italiano, 2008, ADA 2010).
Trombopoetin adalah pengatur utama produksi trombosit, dihasilkan oleh
hati dan ginjal. Trombopoetin meningkatkan jumlah dan kecepatan maturasi
megakariosit (Miller, 2007, Ikeda et.al., 2008, ADA, 2010).
Jumlah trombosit normal adalah sekitar 250 x 109/l (rentang 150-400 x 109/l) dan lama hidup trombosit yang normal adalah 7-10 hari. Hingga sepertiga dari trombosit produksi sumsum tulang dapat terperangkap dalam limpa yang
normal, tetapi jumlah ini meningkat menjadi 90% pada kasus splenomegali berat
2.2.2 Morfologi
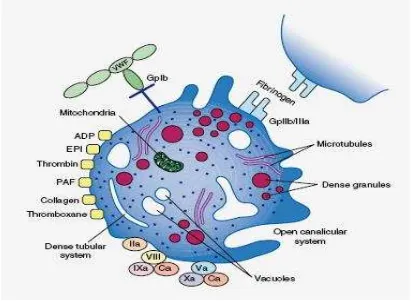
Glikoprotein permukaan sangat penting dalam reaksi adhesi dan agregasi
trombosit. Adhesi pada kolagen difasilitasi oleh glikoprotein Ia (GPIa).
Glikoprotein Ib dan IIb/IIIa penting dalam perlekatan trombosit pada von
Willebrand factor (VWF) dan vaskular subendotel. Reseptor IIb/IIIa juga
merupakan reseptor untuk fibrinogen yang penting dalam agregasi trombosit (Jurk
and Kehrel, 2005, Miller, 2007, Ikeda et.al., 2008).
Gambar 2.7. Gambaran Skematik Morfologi Trombosit
(Ostermann and Van de Loo, 1986).
Membran plasma berinvaginasi ke bagian dalam trombosit untuk
membentuk suatu sistem membrane (kanalikular) terbuka yang menyediakan
permukaan reaktif yang luas tempat protein koagulasi plasma diabsorbsi secara
selektif. Fosfolipid membran (faktor trombosit 3) sangat penting dalam konversi
faktor X menjadi Xa dan protrombin (faktor II) menjadi trombin (faktor Iia) (Jurk
Di bagian dalam trombosit terdapat kalsium, nukleotida (terutama ADP,
ATP dan serotonin) yang terkandung dalam granula padat.Granula alfa
mengandung antagonis heparin, Platelet Derived Growth Factor (PDGF), β
-tromboglobulin, fibrinogen, vWF. Organel spesifik lain meliputi lisosom yang
mengandung enzim hidrolitik, dan peroksisom yang mengandung katalase.
Selama reaksi pelepasan, isi granula dikeluarkan ke dalam sistem kanalikular
(Jurk and Kehrel, 2005, Miller, 2007, Ikeda et.al., 2008).
2.2.3 Fungsi Trombosit
Fungsi utama trombosit adalah pembentukan sumbat mekanik selama
respon hemostasis normal terhadap cedera vaskular (fungsi koagulasi).Tanpa
trombosit, maka dapat terjadi kebocoran darah spontan. Reaksi trombosit dapat
berupa adhesi, sekresi, agregasi dan fusi serta aktivitas prokoagulannya sangat
penting untuk fungsinya (Calverley and Maness, 2004, Jurk and Kehrel, 2005,
Brass and Stalker, 2008).
2.2.4 Pembentukan Sumbat Trombosit
Agar dapat terjadi hemostasis primer yang normal, dan agar trombosit
memenuhi tugasnya membentuk sumbat trombosit inisial, maka harus terdapat
trombosit dalam jumlah memadai di dalam sirkulasi, dan trombosit tersebut harus
berfungsi normal. Fungsi hemostasis normal memerlukan peran serta trombosit
yang berlangsung secara teratur, yang penting dalam pembentukan sumbat
hemostatik primer. Hal ini melibatkan, pada awalnya, adhesi trombosit, agregasi
trombosit dan akhirnya reaksi pembebasan trombosit disertai rekrutmen trombosit
Gambar 2.8. Fungsi normal trombosit (Cox, 2005).
2.2.4.1 Adhesi Trombosit
Setelah cedera pembuluh darah, trombosit melekat pada jaringan ikat
subendotel yang terbuka. Trombosit menjadi aktif apabila terpajan ke kolagen
subendotel dan bagian jaringan yang cedera. Adhesi trombosit melibatkan suatu
interaksi antara glikoprotein membran trombosit dan jaringan yang terpajan atau
cedera. Adhesi trombosit bergantung pada faktor protein plasma yang disebut
faktor von Willebrand, yang memiliki hubungan yang integral dan kompleks
dengan faktor koagulasi antihemofilia VIII plasma dan reseptor trombosit yang
disebut glikoprotein Ib membrane trombosit. Adhesi trombosit berhubungan
dengan peningkatan daya lekat trombosit sehingga trombosit berlekatan satu sama
lain serta dengan endotel atau jaringan yang cedera. Dengan demikian, terbentuk
sumbat hemostatik primer atau inisial. Pengaktifan permukaan trombosit dan
rekrutmen trombosit lain menghasilkan suatu massa trombosit lengket dan
dipermudah oleh proses agregasi trombosit (Calverley and Maness, 2004,
2.2.4.2 Agregasi Trombosit
Agregasi adalah kemampuan trombosit melekat satu sama lain untuk
membentuk suatu sumbat. Agregasi awal terjadi akibat kontak permukaan dan
pembebasan ADP dari trombosit lain yang melekat ke permukaan endotel. Hal ini
disebut gelombang agregasi primer. Kemudian, seiring dengan makin banyaknya
trombosit yang terlibat, maka lebih banyak ADP yang dibebaskan sehingga terjadi
gelombang agregasi sekunder disertai rekrutmen lebih banyak trombosit. Agregasi
berkaitan dengan perubahan bentuk trombosit dari diskoid menjadi bulat.
Gelombang agregasi sekunder merupakan suatu fenomena ireversibel, sedangkan
perubahan bentuk awal dan agregasi primer masih reversibel (Calverley and
Maness, 2004, Michelson and Furman, 2005).
In vitro, agregasi dapat dipicu dengan reagen ADP, trombin, epinephrine,
serotonin, kolagen atau antibiotik ristosetin.
Agregasi in vitro juga terjadi dalam dua fase; agregasi primer atau
reversible dan agregasi sekunder atau ireversibel.
Pengikatan ADP yang dibebaskan dari trombosit aktif ke membran
trombosit akan mengaktifkan enzim fosfolipase, yang menghidrolisis fosfolipid di
membran trombosit untuk menghasilkan asam arakidonat. Asam arakidonat
adalah prekursor mediator kimiawi yang sangat kuat baik pada agregasi maupun
inhibisi agregasi yang terlibat dalam jalur prostaglandin. Melalui proses ini, asam
arakidonat diubah di sitoplasma trombosit oleh enzim siklooksigenase menjadi
endoperoksida siklik. Stimulator kuat untuk agregasi trombosit, senyawa
tromboksan A2, dihasilkan oleh kerja enzim tromboksan sintetase pada berbagai
endoperoksidase siklik ini. Tromboksan A2 adalah senyawa yang sangat aktif,
tetapi tidak stabil yang mengalami penguraian menjadi tromboksan B2 yang stabil
dan inaktif. Tromboksan A2 juga merupakan vasokonstriktor kuat yang akan
mencegah pengeluaran darah lebih lanjut dari pembuluh yang rusak (Calverley
and Maness, 2004, Cox, 2005, Michelson and Furman, 2005, Watson and
2.2.4.3 Reaksi Pembebasan
Pemajanan kolagen atau kerja trombin menyebabkan sekresi isi granul
trombosit yang meliputi ADP, serotonin, fibrinogen, enzim lisosom, β -tromboglobulin dan faktor trombosit. Kolagen dan trombin mengaktifkan sintesis
prostaglandin trombosit. Terjadi pelepasan diasil gliserol (yang mengaktifkan
fosforilasi protein melalui protein kinase C) dan inositol trifosfat (menyebabkan
pelepasan ion kalsium intrasel) menyebabkan terbentuknya tromboksan A2
(Calverley and Maness, 2004, Michelson and Furman, 2005, Brass and Stalker,
2008).
Agregasi primer melibatkan perubahan bentuk trombosit dan disebabkan
oleh kontraksi mikrotubulus. Gelombang agregasi trombosit sekunder melibatkan
terutama pelepasan mediator-mediator kimiawi yang terdapat di dalam granul
padat. Pelepasan ini melengkapi fungsi utama ketiga trombosit, yaitu reaksi
pembebasan.Reaksi pembebasan diperkuat oleh peningkatan kalsium intrasel,
yang semakin mengaktifkan dan meningkatkan pembebasan tromboksan
A2.Tromboksan A2 memperkuat agregasi trombosit serta mempunyai aktivitas
vasokonstriksi yang kuat. Reaksi pelepasan dihambat oleh zat-zat yang
meningkatkan kadar cAMP trombosit, salah satunya adalah prostasiklin (PGI2)
yang disintesis oleh sel endotel vaskular. Prostasiklin merupakan inhibitor
agregasi trombosit yang kuat dan mencegah deposisi trombosit pada endotel
vaskular normal (Calverley and Maness, 2004, Michelson and Furman, 2005,
Brass and Stalker, 2008).
2.2.4.4 Aktivitas Prokoagulan Trombosit
Setelah agregasi trombosit dan reaksi pelepasan, fosfolipid membran yang
terpajan (faktor trombosit 3) tersedia untuk 2 jenis reaksi dalam kaskade
koagulasi. Kedua reaksi yang diperantarai fosfolipid ini bergantung pada ion
kalsium. Reaksi pertama (tenase) melibatkan faktor IXa, VIIIa dan X dalam
pembentukan faktor Xa. Reaksi kedua (protrombinase) menghasilkan
pembentukan trombin dari interaksi faktor Xa, Va dan protrombin. Permukaan
protein-protein tersebut yang penting (Michelson and Furman, 2005, Brass and Stalker,
2008).
2.2.4.5 Agregasi Trombosit Irreversibel
Konsentrasi ADP yang tinggi, enzim yang dilepaskan selama reaksi
pelepasan dan protein kontraktil trombosit menyebabkan fusi yang ireversibel
pada trombosit yang beragregasi pada lokasi cedera vaskular. Trombin juga
mendorong terjadinya fusi trombosit, dan pembentukan fibrin memperkuat
stabilitas sumbat trombosit yang terbentuk (Michelson and Furman, 2005, Brass
and Stalker, 2008).
2.2.5 Fisiologi Koagulasi
Sistem hemostasis dipertahankan oleh interaksi antara sel endotel, protein
koagulasi, dan trombosit sebagai tiga unsur utama untuk menjaga fluiditas darah
pada keadaan normal. Pada keadaan cedera, ketiga unsur utama tersebut
bekerjasama dalam sistem koagulasi. Sel endotel merupakan lapisan dalam
pembuluh darah yang non trombogenik. Fungsi sel endotel dalam sistem
hemostasis (Gambar 2.9) antara lain mensintesis tissue factor (TF), tempat
penyimpanan faktor von Willebrand, berperan pada sistem fibrinolisis dengan
menghasilkan plasminogen activator inhibitor (PAI-I) dan memiliki reseptor
trombomodulin. Apabila PAI-I berikatan dengan trombin dapat mengaktivasi
thrombin activatable fibrinolytic inhibitor (TAFI), dan berperan pada sistim
antikoagulan dengan menghasilkan tissue factor pathway inhibitor (TFPI), tissue
plasminogen activator (tPA), Prostacyclin (PGI), mengaktivasi protein C. Pada
permukaan sel endotel terdapat heparin-like material yang merupakan kofaktor
antitrombin. Trombosit merupakan sel yang sangat berperan pada proses
koagulasi. Trombosit berinteraksi dengan komponen matriks ekstrasel disaat
terjadinya cedera sehingga terbentuk plak trombsit sebagai penutup lesi pembuluh
darah. Trombosit yang teraktivasi juga menghasilkan berbagai agonis trombosit
Gambar 2.9 Fungsi endotel pada prokoagulasi dan antikoagulasi
(Faranita et.al., 2011).
Sejak tahun 1960-an diperkenalkan kaskade koagulasi melalui jalur
intrinsik dan jalur ekstrinsik. Model kaskade koagulasi memberi kesan bahwa
kedua jalur tersebut bekerja terpisah, namun manifestasi klinis menyangkal
konsep tersebut. Sekitar lima belas tahun yang lalu timbul hipotesis baru untuk
memahami proses hemostasis. Model koagulasi berbasis sel (cell-based model of
coagulation) menyatakan bahwa koagulasi muncul pada tahapan yang
Gambar 2.10 Model koagulasi berbasis sel (Faranita et.al., 2011).
Tahap inisiasi dimulai pada sel yang dapat mengekspresikan tissue factor
(TF). membentuk kompleks dengan faktor VIIa dan mengaktivasi faktor IXa dan
Xa. Faktor Xa berikatan dengan faktor Va pada permukaan sel dan menghasilkan
trombin dengan jumlah sedikit. Faktor Xa segera diinhibisi sehingga tidak dapat
bergerak ke sel yang lain. Tahap amplifikasi dimulai setelah munculnya cedera,
trombosit keluar dari pembuluh darah sehingga terjadi perlekatan trombosit
dengan trombin yang dihasilkan pada tahap inisiasi. Trombin mengaktivasi
trombosit sehingga terjadi perubahan permukaan dan pengeluaran faktor V yang
sebagian aktif. Trombin juga mengaktivasi kofaktor V dan VIII, serta
mengaktivasi faktor XI menjadi faktor XIa. Tahap propagasi berlangsung pada
permukaan trombosit yang teraktivasi. Pada tahap ini FIXa berikatan dengan
VIIIa, jumlah FIXa bertambah dari hasil ikatan trombosit dengan FXIa. Kompleks
FIXa/VIIIa mengaktivasi FXa pada trombosit dan segera berikatan dengan FVa
sehingga mengubah protrombin menjadi trombin, selanjutnya pembentukan
trombin mengubah fibrinogen menjadi fibrin. Setelah bekuan fibrin terbentuk,
bekuan saat cedera sembuh. Untuk mengontrol pembentukan bekuan fibrin
terdapat tiga mekanisme yaitu TFPI, mekanisme antitrombin-heparin, dan jalur
antikoagulan protein C. Sedangkan yang bertanggung jawab dalam pelepasan dan
degradasi bekuan fibrin adalah sistem fibrinolisis. Plasmin berperan penting pada
fibrinolisis dan dikatalisasi oleh tPA atau urokinase-type plasminogen activator
(uPA). Inhibitor pada sistem fibrinolisis adalah PAI-1 dan antiplasmin (Faranita
et.al., 2011).
2.2.6 Trombosis
Pembuluh darah yang normal dilapisi oleh sel endotel. Dalam keadaan
yang utuh sel endotel bersifat antikoagulan dengan menghasilkan inhibitor
trombosit (nitrogen oksida, prostasiklin, ADPase), inhibitor bekuan darah/lisis
(heparin, tissue plasminogen activator, urokinase plasminogen aktivator,
trombomodulin, inhibitor jalur faktor jaringan). Sel endotel ini dapat terkelupas
oleh berbagai rangsangan seperti asidosis, hipoksia, endotoksin, oksidan, sitokin
dan stress oksidatif. Endotel pembuluh darah yang tidak utuh akan menyebabkan
vasokonstriksi lokal, menghasilkan faktor koagulasi (tromboplastin, faktor
vonWillebrand, aktivator dan inhibitor protein C, inhibitor aktivator plasminogen
tipe1), terbukanya jaringan ikat subendotel (serat kolagen, serat elastin dan
membran basalis) yang menyebabkan aktivasi dan adhesi trombosit serta
mengaktifkan faktor XI dan XII (Setiabudi, 2009).
Trombosis adalah pembentukan suatu massa abnormal di dalam sistem
peredaran darah yang berasal dari komponen-komponen darah dan salah satu
komponen yang berperan adalah trombosit. Trombosis terjadi karena adanya
ketidakseimbangan antara faktor trombogenik dengan mekanisme proteksi sebagai
akibat dari meningkatnya stimulus trombogenik atau penurunan mekanisme
proteksi, misalnya cedera jaringan pada sepsis yang melepaskan berbagai
mediator inflamasi, sitokin dan terjadinya disfungsi endotel. Pada tahun 1845
Virchow pertama kali mengemukakan adanya 3 faktor utama yang berperan
dalam patofisiologi trombosis (Triad of Virchow’s) yaitu kelainan endotel
pembuluh darah, perubahan aliran darah yang melambat/stasis dan perubahan
2.2.7 Hubungan Trombosis dan Sepsis
Komplikasi perdarahan yang sering terjadi pada sepsis dapat disebabkan
oleh gangguan vaskuler, koagulasi dan gangguan fibrinolitik. Trombosis
intravaskuler merupakan petanda respon inflamasi lokal untuk membatasi ruang
gerak invasi mikroorganisme. Terjadinya deposit fibrin intravaskuler, trombosis
dan koagulasi intravaskuler disseminata (KID) merupakan manifestasi respon
sistemik terhadap infeksi dan sepsis. Pada sepsis berat terjadi berbagai peristiwa
seperti leukosit yang mengalami hiperresponsif persisten, jejas endotel vaskuler
yang luas, KID, disfungsi multi organ dan trombosis yang menunjukkan prognosis
yang jelek. Pada sepsis terjadi gangguan hemostasis, gangguan keseimbangan
faktor prokoagulan dan antikoagulan dan juga terjadi peningkatan aktivitas
hemostatik yang berlebihan untuk mengatasi jejas vaskuler yang luas. Pelepasan
sitokin proinflamasi pada sepsis seperti TNF-α, IL-1, IL-2, IL-6 dan IL-8 akan
menginduksi monosit dan sel endotel vaskuler serta mengaktivasi jalur intrinsik
dan ekstrinsik, gangguan fungsi protein-C, menghambat jalur protein-S dan
menurunkan antitrombin. Fibrinolisis dapat dihambat melalui peningkatan
activator inhibitor-1 plasminogen dalam plasma. Akibatnya terjadi deposisi fibrin
intravaskuler, trombosis, perdarahan dan KID yang menyebabkan disfungsi
multiorgan maupun syok. Hal inilah yang pada akhirnya menimbulkan kondisi
status hiperkoagulasi, hipokoagulasi dan trombositopenia yang pada akhirnya
menyebabkan KID dimana bisa terjadi trombosis dan perdarahan. Jika proses ini
terus berlanjut akan terjadi kegagalan fungsi organ multipel dan menyebabkan
kematian (Yaguchi et.al., 2004, Pohan, 2005, Woth et.al., 2010, Wang et.al.,
Gambar 2.11. Patogenesis Trombosis pada Sepsis (Cohen, 2002).
2.2.8 Kelainan Trombosit Pada Sepsis
Keterlibatan trombosit dalam patofisiologi sepsis sebagai petanda
yang sering dijumpai adalah trombositopenia. Pada sepsis dapat terjadi aktivasi
trombosit, yang dapat secara langsung oleh endotoksin atau sitokin proinflamasi.
Trombosit juga dapat teraktivasi oleh faktor koagulasi seperti trombin, aktivasi ini
terjadi akibat sekresi protein proinflamasi dan growth factors yang berkontribusi
pada proses inflamasi. Komponen permukaan dinding sel dari organisme gram
negatif (endotoksin) dan gram positif (peptidoglycans dari Staphylococcus
aureus) dapat memicu terjadinya Koagulasi Intravaskular Disseminata, kemudian
peningkatan konsumsi trombosit yang mengakibatkan trombositopenia.Trombosit
dapat menjadi sangat aktif pada sepsis. Hal ini ditandai dengan meningkatnya
aktivitas trombosit dalam fungsinya mengalami agregasi dan adhesi yang lebih
reaktif dibandingkan pada keadaan bukan sepsis. Aktivasi ini disebabkan oleh
endotoksin (lipopolisakarida) dan sitokin inflamasi ataupun aktivasi langsung dari
faktor koagulasi. Pada sepsis berat endotel mikrovaskuler dapat mengalami
kerusakan oleh berbagai faktor, termasuk perfusi jaringan yang buruk, hipoksia,
peningkatan aktivasi, agregasi dan konsumsi trombosit. Sehingga pada sepsis
rangkaian interaksi yang kompleks tersebut sering pada akhirnya meningkatkan
terjadinya trombositopenia dan sering dikaitkan juga dengan perubahan ukuran
trombosit atau Mean Platelet Volume. Perubahan ukuran trombosit ini
dihubungkan dengan supresi sumsum tulang dan pengaruh sitokin inflamasi pada
set kromosom trombosit serta terganggunya fungsi trombopoetin dalam maturitas
trombosit itu sendiri. Pada sepsis ini akan disekresikan trombosit dengan ukuran
besar dengan fungsi yang lebih reaktif akibat proses inflamasi yang terus berlanjut
sejalan dengan peningkatan konsumsi dan destruksi dari trombosit, sehingga pada
perjalanannya akan mempengaruhi proses pembentukan trombosit itu sendiri pada
tingkat megakariosit dimana akan menyebabkan terganggunya maturitas inti
trombosit sebagai kompensasi untuk mencapai keseimbangan hemostasis terhadap
reaksi inflamasi yang semakin berat. Selain itu sitokin yang diekspresikan pada
sepsis akan mempengaruhi juga pembentukan set kromosom trombosit pada
tingkat megakariosit, sehingga juga sangat berperan dalam perubahan morfologi
dari trombosit itu sendiri (Faranita et.al., 2011).
2.3 Mean Platelet Volume (MPV)
Begitu eratnya korelasi antara kejadian sepsis dengan aktivasi trombosit
sebagai kompensasi keseimbangan hemostasis menimbulkan banyaknya
penelitian yang mengambil komponen trombosit sebagai marker ataupun
prediktor prognosis pasien sepsis. Ukuran penilaian tidak hanya dilihat dari
jumlah trombosit namun juga dinilai dari variasi volume trombosit yang muncul
sebagai gambaran terhadap fungsi trombosit. Mekanisme kontrol yang utama
yang berhubungan dalam menentukan ukuran trombosit masih belum dapat
dipahami sepenuhnya, namun proses hematopoiesis dalam status tetap, jumlah
dari trombosit ditentukan oleh jumlah megakariosit dan jumlah dari set kromosom
dari megakariosit secara langsung berhubungan dengan MPV. Hubungan ini juga
dibuktikan pada status penyakit yang berbeda, jadi pasien dengan hipoplasia
sumsum ulang atau reaktif trombositosis (MPV rendah) juga mengalami
pengurangan set kromosom dan pasien dengan kerusakan imunitas dari trombosit
perubahan yang cepat dari ukuran trombosit dan ukuran megakariosit, jumlah set
kromosom, yang terjadi secara akut yang diakibatkan oleh trombositopenia telah
didokumentasikan secara jelas. Pemberian anti trombosit antibodi pada tikus,
diikuti oleh peningkatan MPV dalam 8 jam dan kemudian terjadi peningkatan
pada jumlah set kromosom megakariosit pada sumsum tulang. Volume
megakariosit juga meningkat, namun peningkatan volume sitoplasma yang
didokumentasikan tidak terjadi setelah 24 jam setelah induksi akut
trombositopenia. Perubahan ukuran maksimal terjadi setelah 48 jam, juga
peningkatan dari jumlah set kromosom megakariosit. Modal set kromosom
meningkat dari 16n ke 32n dengan produksi trombosit yang lebih besar dan
peningkatan heterogenitas dari trombosit pada darah perifer (Jackson and Carter,
1993).
Mean Platelet Volume (MPV) adalah rerata ukuran trombosit di sirkulasi
darah tepi dan merupakan salah satu variabel biologi yang penting dari trombosit.
MPV merupakan penanda fungsi trombosit dan berhubungan dengan penunjuk
aktivitas trombosit yang meliputi agregasi dan pelepasan tromboksan A2, platelet
factor 4, dan tromboglobulin. Ukuran trombosit ditentukan pada waktu
pembentukan dan perusakan trombosit yang meningkat. Trombosit yang besar
mempunyai butiran padat lebih banyak dan lebih kuat daripada yang kecil dan
lebih bersifat trombogenik. Trombosit memainkan peran utama dalam menjaga
integritas pembuluh darah melalui hemostatik. Efisiensi sel-sel hemostatik yang
beredar secara langsung tergantung pada beberapa faktor vasoaktif dan agen
protrombotik termasuk tromboksan A2, dan serotonin yang dikeluarkan dari
butiran trombosit. Jelas bahwa trombosit yang lebih besar mengandung lebih
banyak butiran dan karena memproduksi dan mengeluarkan jumlah yang lebih
besar dari stimulator ini. Pada kenyataannya, volume trombosit dikaitkan dengan
waktu perdarahan yang lebih pendek, dan volume trombosit rata-rata ( MPV )
telah dianggap sebagai penentu untuk tingkat aktivitas trombosit. Trombosit yang
beredar dalam sirkulasi dalam ukuran heterogen, kepadatan dan aktivitas. MPV,
adalah penilaian dari ukuran trombosit yang tersedia di setiap pemeriksaan sel
darah lengkap. MPV diakui sebagai penanda penting dari aktivitas trombosit.
trombogenik, dan lebih mungkin untuk terjadi agregasi dibandingkan dengan
trombosit yang lebih kecil (Rosmiati et.al., 2012).
Seperti diketahui pada penelitian sebelumnya mengenai Mean Platelet
Volume, ukuran trombosit ditentukan pada tingkat sel progenitor (yaitu
megakariosit) dan sepsis sangat berpengaruh pada tingkat sel ini. Pada sepsis
terjadi konsumsi trombosit yang berlebihan dan gangguan pembentukan trombosit
pada level kromosom sehingga sangat berpengaruh terhadap produksi trombosit
dan kompensasi yang terjadi. Pada suatu penelitian menunjukkan bahwa sitokin
seperti interleukin -3 dan interleukin-6 pada sepsis mempengaruhi ploidi
megakariosit dan menyebabkan produksi trombosit yang belum matur serta
berukuran lebih besar tetapi berfungsi lebih reaktif. Trombosit ini yang secara
langsung akan mengalami proses adhesi, agregasi, dan pembebasan sebagai
respon terhadap inflamasi. (Debili et.al., 1993, Oncel et.al., 2013).
Ada juga penelitian lain yang menjelaskan tentang hubungan MPV dengan
sepsis, antara lain penelitian oleh Becci C dkk melaporkan bahwa MPV lebih
tinggi pada kondisi sepsis berat dari pada sepsis saja. Mereka juga melaporkan
bahwa nilai MPV pada saat diagnosis sepsis >9.7 fL (nilai normal 7.0 – 8,0)
berhubungan dengan tiga kali lipat peningkatan mortalitas (OR=3,04; p<0,05).
Menurut Thompson, perubahan trombosit pada sepsis terjadi karena pelepasan
faktor pertumbuhan pada sumsum tulang yang memacu produksi trombosit dalam
ukuran besar sebagai mekanisme kompensasi (Thompson et.al., 1983). Dastugue
dkk dan Van der Lelie dkk menyatakan bahwa terdapat peningkatan MPV pada
pasien dengan sepsis dan syok septik. Peningkatan MPV menunjukkan terjadinya
infeksi invasif atau infeksi yang tidak responsif dengan pemberian antibiotik,
sehingga menimbulkan mortalitas yang tinggi pada sepsis (Dastugue and
Picheloup, 1982, Van der Leile and Von dem Borne, 1983). Alshorman A dkk
yang melakukan penelitian pada sepsis neonatorum melaporkan terjadinya
peningkatan MPV seiring dengan terjadinya trombositopenia terutama infeksi
yang disebabkan oleh kuman gram negatif (Alshorman et.al., 2008). Studi-studi
sebelumnya juga melaporkan hal yang sama seperti studi yang dilakukan Connor
dkk menemukan bahwa MPV dapat digunakan sebagai pemeriksaan tambahan
negatif (O’Connor et.al., 1993). Bessman dkk menyatakan bahwa MPV dapat
digunakan sebagai prediktor pemulihan trombositopenia yang disebabkan supresi
sumsum tulang pada sepsis, dapat mendeteksi gangguan trombosit lebih awal
walaupun jumlah trombosit masih normal, serta dapat membedakan penyebab
trombositopenia (Bessman et.al., 1985). Cho SY dkk melaporkan bahwa MPV
meningkat seiring dengan peningkatan procalcitonin >1,0 ng/mL walaupun secara
statistik tidak signifikan dan menyimpulkan bahwa peningkatan MPV
menunjukkan adanya pro-inflamasi dan kondisi trombosis yang melibatkan
sejumlah mediator inflamasi, sitokin dan disfungsi endotel (Cho et.al., 2013).
Eberhardt A dkk melaporkan penelitian yang melibatkan 183 pasien sepsis bahwa
MPV mempunyai korelasi positif yang signifikan dengan terjadinya bakteremia
dan kematian sehingga MPV dapat digunakan sebagai biomarker untuk menilai
beratnya derajat sepsis dimana semakin tinggi nilai MPV maka prognosisnya
semakin buruk (9.6 vs 9.19fL ; P=0.031) (Eberhardt et.al., 2013). Kukukardali Y
dkk juga menemukan korelasi positif yang signifikan antara MPV dan skor
APACHE dalam menilai beratnya sepsis (r=0,34), namun tidak didapati korelasi
yang signifikan antara MPV dengan kematian pada pasien sepsis yang dirawat di
ICU (Kukukardali et.al., 2010). Sebaliknya, studi yang dilakukan Sadaka F (2014)
dan Wilar R dkk tidak menemukan hubungan yang signifikan antara MPV dengan
mortalitas (Wilar et.al., 2010, Sadaka et.al.,2014). Guclu E dkk melaporkan
bahwa nilai MPV >8 fL (rujukan normal 7,0-8,0 fL) memiliki sensitifitas 53,47%,
spesifisitas 87,41% dan positive predictive value (PPV) 81,1% dalam menegakkan
diagnosa sepsis sepsis (Guclu et. al., 2013). Beberapa studi juga melaporkan
bahwa peningkatan MPV, trombositopenia dan peningkatan PDW (Platelet Width
Distribution) dapat digunakan sebagai indikator langsung terjadinya disfungsi
organ pada sepsis (Patrick and Lazarchick, 1990, Aydin et.al., 2012). Sementara
Patrick CH dkk yang melakukan studi pada sepsis neonatorum melaporkan
bahwa spesifisitas MPV dan PDW dalam mendeteksi adanya bakterimia
masing-masing adalah 95% dan 79% (Patrick and Lazarchick, 1990, Aydin et.al., 2012).
Menurut beberapa penelitian sepsis menyebabkan peningkatan destruksi
trombosit dan supresi dari sumsum tulang yang akibatnya mempengaruhi
immatur dengan fungsi yang lebih reaktif. Mean Platelet Volume (MPV) adalah
marker dari variasi ukuran dan volume trombosit yang beredar pada sirkulasi, dan
dapat digunakan untuk melihat aktivitas dan fungsi trombosit. Nilai Normal MPV
adalah 7,0-8,0 fL. Pengukuran MPV telah dilakukan sejak tahun 1970 an dan
sekarang telah menjadi pemeriksaan rutin, namun masih jarang dipelajari dalam
hubungannya dengan sepsis (Becchi et.al., 2006, Levi and Lowenberg, 2008,
Oncel et.al., 2013). Pada populasi sehat, MPV mempunyai hubungan terbalik
dengan jumlah trombosit.
MPV dan trombosit dihitung menggunakan automated blood cells counter
yang menggunakan teknologi aperture-impedance untuk mengukur trombosit. Di
samping itu, sel-sel difokuskan melewati celah kecil secara hidrodinamik, dan
gelombang listrik yang sesuai dengan ukuran dan volume sel dihasilkan. Pemisah
“autodiscriminators” yang bergerak memisahkan antara machine noise pada bagian bawah dan sel darah merah pada bagian atas dari setiap distribusi volume
trombosit. MPV dihitung dengan menggunakan rumus: MPV (fL)=Pct
(%)x1000 Plt (x103/µL), dimana Plt adalah jumlah trombosit dan jumlah partikel diantara pemisah atas dan bawah, Pct merupakan trombosit crit dan dihitung
secara elektronik dari data histogram.
2.4 SISTEM SKOR DI UNIT PERAWATAN INTENSIF
Perkembangan teknologi kesehatan yang sangat pesat terutama di bidang
terapi intensif akhir-akhir ini telah membuat pelayanan di UPI membutuhkan
sumber daya dan biaya operasional yang cukup tinggi, sehingga UPI hanya
diperuntukkan bagi pasien-pasien yang akan mendapatkan manfaat dari terapi
intensif dengan resiko kematian yang rendah. Untuk itu diperlukan instrumen
objektif yang dapat menentukan keparahan penyakit dan menilai prediksi
mortalitas pasien yang masuk UPI (Palazzo, 2003).
Selama 3 dekade terakhir ini telah dikembangkan beberapa sistem skor
atau model prognostik UPI. Sebagian besar sistem skor mempunyai fokus
keluaran angka kematian rumah sakit dan sebagian lagi memperkirakan besarnya
disfungsi organ (Palazzo, 2003). Gangguan fisiologis, proses patologis dan
stasistik. Keluaran yang umumnya diukur adalah mortalitas di UPI atau mortalitas
pada 28 hari atau 30 hari (mortalitas rumah sakit). Mortalitas rumah sakit
merupakan keluaran yang paling sering dipakai karena dapat digunakan sebagai
diskriminator dan mudah diamati (Bion, 1996).
Pada awal pengembangan sistem skor, pemilihan variabel klinik dan
fisiologik sebagai variabel-variabel prediksi berdasarkan penilaian subjektif dari
hasil konsensus para klinisi serta tinjauan pustaka. Selanjutnya teknik model
regresi logistik ganda digunakan untuk memilih variabel prediksi dari sistem skor
(Palazzo, 2003).
2.4.1 Definisi
Sistem skor adalah suatu alat atau instrumen untuk menentukan
probabilitas mortalitas pasien.
2.4.2 Tujuan Penggunaan Sistem Skor
Sistem skor dapat digunakan untuk berbagai hal. Pada penelitian uji acak
terkendali (randomized controlled trial) dan penelitian klinik lainnya digunakan
untuk menentukan sampel penelitian. Pada manajemen rumah sakit sistem skor
digunakan sebagai dasar pertimbangan kebijakan administrasi sistem pelayanan
kesehatan dan rumah sakit seperti menentukan alokasi sumber daya. Pada
pengelolaan UPI, sistem skor digunakan untuk menilai tampilan UPI dan
membandingkan kualitas pengelolaan pasien pada beberapa UPI yang berbeda,
atau pada UPI yang sama dengan waktu yang berbeda-beda. Sistem skor dapat
digunakan untuk menilai pengaruh keluaran pasien terhadap perencanaan
pengelolaan UPI, seperti penambahan jumlah tempat tidur, rasio staf dan jasa
medis. Sistem skor digunakan juga untuk menilai prognosis pasien secara individu
sebagai data objektif dalam berkomunikasi dengan keluarga pasien, perusahaaan
asuransi kesehatan atau pengelola kesehatan dalam membuat keputusan tentang
perawatan di UPI. Selain itu sistem skor digunakan untuk mengevaluasi pantas
atau tidaknya pasien mendapatkan novel therapy, seperti menggunakan sistem
protein C (drotrecogin alfa) pada pasien sepsis berat/syok septik (Knaus et.al.,
1985, Bion, 1996, Husain et.al., 2003, Palazzo, 2003).
2.4.3 Klasifikasi Sistem Skor
Secara umum sistem skor yang digunakan di UPI dapat digolongkan
menjadi sistem skor model prognostik dan skor disfungsi organ. Ada 4 generasi
sistem skor prognostik. Generasi pertama adalah Acute Physiologic and Chronic
Health Evaluation I ( APACHE I ). Generasi kedua terdiri dari APACHE II,
Simplified Acute Physiology Score I ( SAPS I) dan Mortality Probability Model I (
MPM I ). Generasi ketiga adalah APACHE III, SAPS II, dan MPM II. Generasi
terakhir adalah APACHE IV, SAPS III, dan MPM III.Sedangkan sistem skor
disfungsi organ adalah Multipel Organ Dysfunctiopn Score (MODS), Logistic
Organ Dysfuction Score (LODS), dan Sequential Organ Failure Assessment
(SOFA) Score (Palazzo, 2003).
2.5 SKOR ACUTE PHYSIOLOGY AND CHRONIC HEALTH
EVALUATION II (APACHE II)
Dasar dari pengembangan APACHE II yang merupakan penyederhanaan
dari APACHE I sebelumnya, adalah hipotesis bahwa derajat keparahan suatu
penyakit akut dapat diukur dengan melakukan kuantifikasi derajat penyimpangan
dari berbagai variabel fisiologi yang dapat diukur secara objektif. Knaus dkk. pada
tahun 1985, menggunakan 12 variabel pengukuran fisiologis (acute physiologic
score, APS) yaitu : suhu tubuh, tekanan darah arteri rata-rata, laju nadi, laju
nafas, oksigenasi, pH arteri, natrium serum, kalium serum, kreatinin serum,
hematokrit, leukosit, skala koma Glasgow, ditambah umur dan penyakit kronik
dengan bobot nilai tertentu yang dinilai dalam 24 jam pertama pada sejumlah
5815 pasien yang masuk UPI dari 13 rumah sakit di Amerika Utara (Bion, 1996,
2.5.1 Definisi
Skor APACHE II adalah hasil penjumlahan dari APS , umur dan riwayat
penyakit kronik . Skor APACHE II bervariasi dari 0 – 71, untuk APS maksimal
60, skor umur maksimal 6, dan untuk skor riwayat penyakit kronik maksimal 5.
Pada kasus paska bedah, nilai variabel pH dan kreatinin serum sering
dianggap normal. Pada kasus pasien dengan sedasi, bantuan ventilasi mekanik,
nilai variabel skor koma Glasgow dianggap 15 , bila masalah neurologi tidak ada .
Pasien yang menjalani bedah jantung atau yang berumur <16 tahun dikeluarkan
dari analisis APACHE II.
2.5.2 Aplikasi Skor APACHE II
Skor APACHE II telah banyak dilaporkan dapat memprediksi mortalitas
pasien kritis, dengan alasan ini maka sistem skor ini paling banyak digunakan.
Penggunaan sistem skor ini terutama pada pasien dengan infeksi, uji klinis,
pemanfaatan sumber daya, peraturan pelayanan kesehatan, dan pada Surviving
Sepsis Campaign (Dellinger et.al., 2008).
Tabel 2.6 Skor APACHE II dan tingkat mortalitas pada 5.185 pasien UPI (Knaus
et.al., 1985).
APACHE II Score and Mortality in 5,185 ICU Patients
APACHE II Score Hospital Mortality (%)
Nonoperative Postoperative
0-4 4 1
5-9 6 3
10-14 12 6
15-19 22 11
20-24 40 29
25-29 51 37
30-34 71 71
2.7 KERANGKA KONSEP
keterangan:
Variabel bebas : Nilai MPV
Variabel tergantung : Skor APACHE