BAB II
TINJAUAN PUSTAKA
2.1 Protein dan Non Protein Nitrogen
Nama protein berasal dari kata yunani proteos, yang berarti yang utama atau yang terdahulukan. Kata ini diperkenalkan oleh seorang ahli kimia Belanda, Gerardus Mulder (1802-1880), karena ia berpendapat bahwa protein adalah zat yang paling penting dalam tiap organisme. Protein adalah biopolimer dari asam-asam amino yang dihubungkan melalui ikatan peptida. Protein terdiri atas rantai-rantai panjang asam amino, yang terikat satu sama lain oleh ikatan peptida. Asam amino terdiri atas unsur-unsur karbon, hidrogen, oksigen, dan nitrogen, beberapa asam amino di samping itu mengandung unsur-unsur fosfor, besi, kalium, dan kobalt. Unsur nitrogen adalah unsur utama protein yang tidak terdapat pada karbohidrat dan lemak (Almatsier, 2004; Irianto, 2004).
Protein merupakan zat yang tersusun dari berbagai asam amino. Protein di dalam tubuh dirubah menjadi asam amino. Dari dua puluh macam asam amino, tubuh orang dewasa membutuhkan delapan jenis asam amino esensial yaitu lisin, leusin, isoleusin, valin, triptofan, fenilalanin, metionin, treonin, sedangkan untuk anak-anak yang sedang tumbuh, ditambahkan dua jenis lagi yaitu histidin dan arginin. Adapun contoh asam amino non esensial yaitu prolin, serin, tirosin, sistein, glisin, asam glutamat, alanin, asam aspartat, aspargin, ornitin (Djaeni, 1976; Irianto, 2004).
NPN merupakan senyawa-senyawa bukan protein yang mengandung nitrogen seperti asam amino bebas, asam nukleat, ammonia, urea, trimetilamina
(TMA), dimetilamina (DMA), nitrat dan lain-lain. Asam amino bebas yang terdapat dalam jaringan hidup merupakan hasil residu dari sintesis protein yang tidak rampung atau kemungkinan dari hasil degradasi dari protein. Sedangkan dari asam amino bebas ini dapat terbentuk senyawa-senyawa NPN lainnya merupakan hasil deaminasi atau dekarboksilasi dari asam amino bebas, yang dikatalis oleh enzim-enzim tertentu (Silalahi, 1994).
2.1.1 Ciri-ciri Molekul Protein
Menurut Ellya (2010), ciri-ciri molekul yaitu:
1. Berat molekulnya besar, ribuan sampai jutaan sehingga merupakan suatu makro molekul.
2. Strukturnya tidak stabil terhadap beberapa faktor seperti pH, radiasi, temperatur, medium pelarut organik dan deterjen.
3. Terdapat ikatan kimia lain yang menyebabkan terbentuknya lengkungan-lengkungan rantai polipeptida menjadi struktur tiga dimensi protein.
4. Umumnya terdiri dari 20 macam asam amino.
5. Umumnya reaktif dan sangat spesifik, disebabkan terdapatnya gugusan samping yang reaktif dan susunan khas struktur makromolekul.
2.1.2 Klasifikasi Protein
Berdasarkan keanekaragaman penyusun struktur protein, maka protein dapat diklasifikasikan sebagai berikut:
A. Menurut Sudarmadji dan Suhardi (1989), berdasarkan morfologinya protein dapat dikelompokkan menjadi 2 bentuk:
2. Protein globuler (steroprotein) yaitu protein yang berbentuk bola. Contohnya: albumin, globulin.
B. Menurut Winarno (1991), berdasarkan kelarutannya protein dapat dibagi menjadi beberapa golongan yaitu:
1. Albumin: larut dalam air dan terkoagulasi oleh panas. Contohnya albumin telur, laktalbumin dalam susu.
2. Globulin: tidak larut dalam air, terkoagulasi oleh panas, larut dalam larutan garam encer, dan mengendap pada larutan salting out. Contohnya: ovoglobulin dalam kuning telur, legumin dalam kacang-kacangan.
3. Glutelin: tidak larut dalam pelarut netral, tetapi larut dalam asam/basa encer. Contohnya glutelin dalam gandum, orizenin dalam beras.
4. Prolamin atau gliadin: larut dalam alkohol 70-80%, dan tidak larut dalam air maupun alkohol absolut. Contohnya gliadin dalam gandum, zein pada jagung. 5. Histon: larut dalam air dan tidak larut dalam amonia encer. Contohnya globin
dalam hemoglobin.
6. Protamin: larut dalam air dan tidak terkoagulasi oleh panas. Contohnya salmin dalam ikan salmon.
C. Menurut Djaeni (1976), berdasarkan hasil hidrolisanya protein dapat dikelompokkan menjadi 2 golongan yaitu:
1. Protein sederhana (simple protein) yaitu hasil hidrolisa total protein yang merupakan campuran yang hanya terdiri atas asam-asam amino. Contohnya: albumin, globulin, kreatin, dan hemoglobin.
2. Protein kompleks (complex protein, conjugated protein) yaitu hasil hidrolisa total protein yang selain terdiri atas berbagai jenis asam amino, juga terdapat
komponen lain, misalnya unsur logam, gugusan phosphat dan sebagainya (contoh: hemoglobin, lipoprotein, glikoprotein, dan sebagainya).
D. Menurut Djaeni (1976), berdasarkan sumbernya protein dikelompokkan menjadi 2 golongan yaitu:
1. Protein hewani
Protein hewani adalah protein dalam bahan makanan yang berasal dari binatang/hewan yang memakan tumbuhan mengubah protein nabati menjadi protein hewani. Contoh protein hewani yaitu:
a. Protein daging
Protein daging terdiri dari: 70% protein struktur/fibril, dan 30% protein yang larut dalam air. Protein fibril terdiri dari: 32-38% miosin, 7% triptomisin, 13-17% aktin, 6% protein stroma. Protein lainnya kurang lebih mempunyai bentuk globular dan terdiri atas partikel yang biasanya tidak terlibat dalam susunan struktur secara ekstensif. Contohnya: protein susu, protein serelia dan biji minyak.
b. Protein ikan
Otot ikan terdiri atas serat pendek, disusun diantara lembaran jaringan ikat. Jumlah jaringan ikat dalam otot ikan lebih kecil daripada jumlah jaringan ikat dalam mamalia dan seratnya lebih pendek. Miofibril otot ikan beralur seperti otot mamalia dan mengandung protein yang sama: miosin, aktin, aktomiosin, dan tropomiosin.
merupakan golongan heterogenfosfoprotein yang diendapkan dari susu skim pada pH 4,6 dan 20ºC, dan juga termasuk protein yang tidak homogen yang dapat dipisahkan dengan cara elektroforesis. Protein yang tetap di dalam larutan disebut serum atau protein dadih. Susu skim merupakan bahan mentah untuk memanufaktur sejumlah produk protein susu. Produk ini digunakan sebagai bahan baku dalam banyak makanan yang dimanufaktur dan mencakup kasein, kaseinat.
d. Protein telur
Protein telur terbagi atas: protein putih telur, dan protein kuning telur. Protein putih telur mengandung sekurang-kurangnya 8 jenis protein yang berbeda.
2. Protein nabati
Protein nabati adalah protein dalam bahan makanan yang berasal dari tumbuhan, seperti protein dari jagung, terigu, kacang-kacangan. Kacang kedelai merupakan sumber protein nabati yang mempunyai mutu tertinggi, sedangkan sumber protein nabati yang bermutu rendah adalah padi-padian dan hasilnya. Contoh protein nabati yaitu:
a. Protein kedelai
Protein kedelai terdapat dalam badan protein atau butir aleuron yang berdiameter 2-20 µm. Protein kedelai merupakan sumber yang baik untuk semua asam amino kecuali metionin dan triptofan. Di dalam kedelai terdapat kandungan lisin yang tinggi yang membuatnya menjadi pelengkap yang baik pada protein serelia (yang rendah kandungan lisinnya). Protein kedelai laur dalam air, atau dalam larutan garam encer
dan di atas atau di bawah pI. Oleh karena itu protein kedelai digolongkan ke dalam protein globulin.
b. Protein gandum
Diantara protein nabati, protein gandum bersifat unik yang berperan dalam pembuatan roti. Ada 4 fraksi dalam protein ini yaitu: albumin(larut dalam air), globulin (larut dalam larutan garam netral), gliadin (prolamin yang larut dalam alkohol 70%), glutenin (larut dalam asam/basa encer). Pembentukan gluten terjadi jika tepung gandum dicampur dengan air. Gluten adalah massa kenyal yang melengket yang menyatukan komponen-komponen roti lain, seperti pati dan gelembung gas, jadi membentuk struktur lunak dari roti. Nilai protein berbagai bahan makanan dapat dilihat pada Tabel 2.1 berikut ini:
Tabel 2.1 Nilai Protein berbagai bahan makanan (gram/100 gram) Sumber Protein
Hewani
Nilai Protein Sumber Protein Nabati
Nilai Protein
Ayam 18,2 Kacang merah 29,1
Kerang 16,4 Kelapa 3,4
Susu sapi 3,2 Kacang kedelai 34,9
Daging 18,8 Kentang 2,0
Daging kelinci 16,6 Babat 17,6
Telur 12,8 Kenari 15,0
Hati 19,7 Beras 7,4
Ikan 17,0 Singkong 1,1
Telur ayam 13,1 Daun singkong 6,6
Jeroan 14,0 Jagung 9,2
Jampang 6,2 Kacang hijau 22,2
Telur bebek 12,0 Tepung terigu 8,9
Udang 21,0 Kacang tanah 25,3
Sumber: Daftar Komposisi Bahan Makanan, Depkes 1979 (Almatsier, 2004).
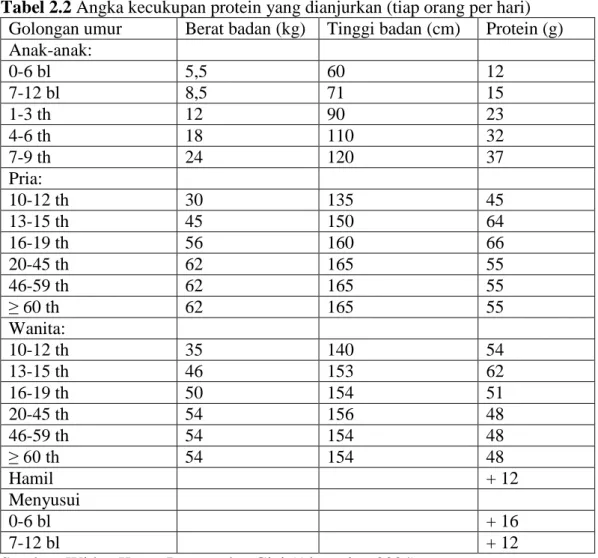
Angka kecukupan protein yang dianjurkan (tiap orang per hari) dapat dilihat pada Tabel 2.2 berikut ini:
Tabel 2.2 Angka kecukupan protein yang dianjurkan (tiap orang per hari) Golongan umur Berat badan (kg) Tinggi badan (cm) Protein (g) Anak-anak: 0-6 bl 5,5 60 12 7-12 bl 8,5 71 15 1-3 th 12 90 23 4-6 th 18 110 32 7-9 th 24 120 37 Pria: 10-12 th 30 135 45 13-15 th 45 150 64 16-19 th 56 160 66 20-45 th 62 165 55 46-59 th 62 165 55 ≥ 60 th 62 165 55 Wanita: 10-12 th 35 140 54 13-15 th 46 153 62 16-19 th 50 154 51 20-45 th 54 156 48 46-59 th 54 154 48 ≥ 60 th 54 154 48 Hamil + 12 Menyusui 0-6 bl + 16 7-12 bl + 12
Sumber: Widya Karya Pangan dan Gizi (Almatsier, 2004).
2.1.3 Struktur Protein
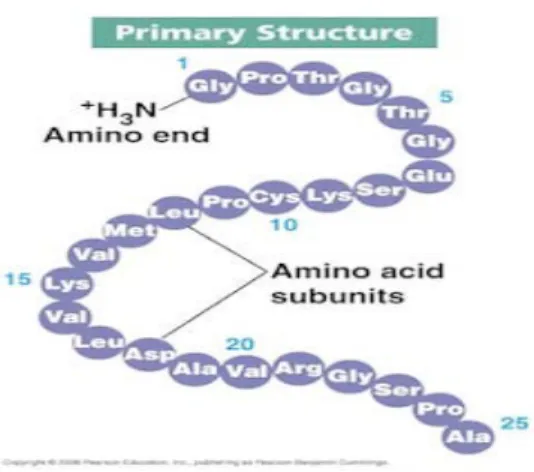
1. Struktur Primer
Strukur primer dari protein mengacu pada susunan/urutan linier dari konstituen asam amino yang secara kovalen dihubungkan melalui ikatan peptida. Susunan tersebut merupakan suatu rangkaian unik dari asam amino yang menentukan sifat dasar dari berbagai protein, dan secara umum menentukan bentuk struktur sekunder dan tersier (Winarno, 1991). Struktur primer protein dapat dilihat pada Gambar 2.1 berikut ini:
Gambar 2.1 Struktur primer protein (Anonim, 2010) 2. Struktur Sekunder
Struktur sekunder adalah struktur tiga dimensi lokal dari berbagai rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen.
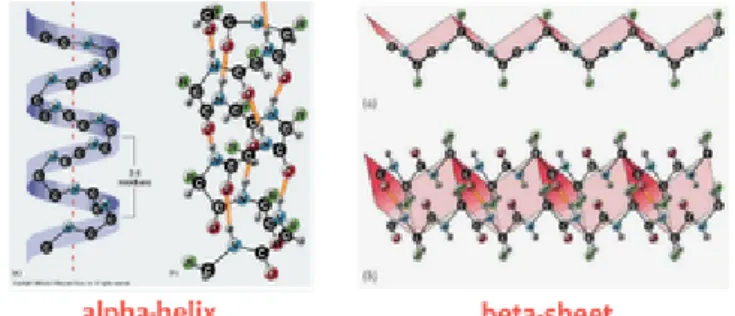
Pada struktur sekunder protein sudah mengalami interaksi intermolekul, melalui rantai samping asam amino. Ikatan yang membentuk struktur ini didominasi oleh ikatan hidrogen antar rantai samping yang membentuk pola tertentu bergantung pada orientasi ikatan hidrogennya. Ada empat macam struktur sekunder (Winarno, 1991), yaitu:
a. α heliks (puntiran alfa), berupa pilinan rantai asam amino yang berbentuk spiral.
b. β sheet (lempeng beta), berupa lembaran-lembaran lebar yang tersusun dari sejumlah rantai asam amino yang saling terikat melalui ikatan hidrogen. c. β turn (lekukan beta).
d. Gamma turn (lekukan gamma)
Gambar 2.2 Struktur sekunder protein (Anonim, 2010)
Pada bagian tertentu dari protein, terdapat susunan asam amino yang membentuk suatu struktur yang reguler dengan sudut-sudut geometri tertentu. Ada dua struktur sekunder utama yaitu alfa-helix dan beta-sheet. Struktur ini terjadi akibat adanya ikatan hidrogen antar asam amino yaitu antara atom O pada gugus CO dengan atom H pada gugus NH (ditandai dengan garis warna orange). Struktur alfa-helix terbentuk oleh backbone ikatan peptida yang membentuk spiral dimana jika dilihat tegak lurus dari atas, arah putarannya adalah searah jarum jam menjauhi pengamat (dinamakan alfa). Seperti halnya alfa-helix, struktur beta-sheet juga terbentuk karena adanya ikatan hidrogen, namun ikatan hidrogen terjadi antara dua bagian rantai yang paralel sehingga membentuk lembaran yang berlipat-lipat. Tidak semua bagian protein membentuk struktur alfa-helix dan beta-sheet, pada bagian tertentu mereka tidak membentuk struktur yang reguler (Winarno, 1991).
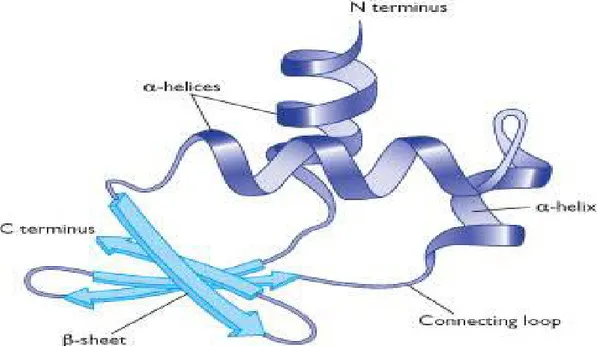
3. Struktur Tersier
Struktur tersier adalah gabungan dari dua atau lebih struktur dua dimensi. Gabungan ini umumnya berupa gumpalan. Beberapa molekul dapat berinteraksi secara fisika tanpa ikatan kovalen (ikatan non kovalen) membentuk oligomer yang stabil (dimer, trimer, atau kuartomer) dan membentuk struktur kuartener (misalnya hemoglobin). Struktur tersier menjelaskan bagaimana seluruh rantai
polipeptida melipat sendiri sehingga membentuk struktur tiga dimensi. Pelipatan ini dipengaruhi oleh interaksi antar gugus samping (R) satu sama lain (Winarno, 1991). Struktur tersier protein dapat dilihat pada Gambar 2.3 berikut ini:
Gambar 2.3 Struktur tersier protein (Anonim, 2010) Ada beberapa interaksi yang terlibat yaitu:
a. Interaksi ionik
Terjadi antara gugus samping yang bermuatan positif (memiliki gugus –NH2 tambahan) dan gugus negatif (–COOH tambahan). Interaksi ionik dapat dilihat pada Gambar 2.4 berikut ini:
Gambar 2.4 Interaksi Ionik (Anonim, 2010).
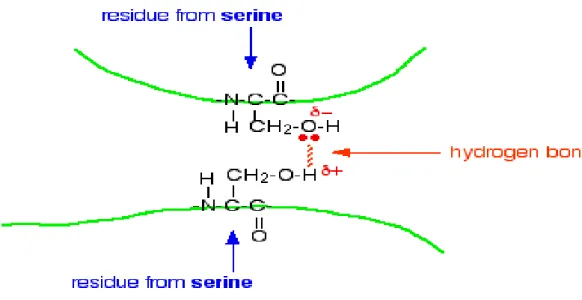
b. Ikatan hidrogen
Jika pada struktur sekunder ikatan hidrogen terjadi pada ‘backbone‘, maka ikatan hidrogen yang terjadi antar gugus samping akan membentuk struktur tersier. Karena pada gugus samping bisa banyak terdapat gugus seperti –OH, – COOH, –CONH2 atau –NH2 yang bisa membentuk ikatan hidrogen. Ikatan hidrogen dapat dilihat pada Gambar 2.5 berikut ini:
c. Gaya dispersi Van Der Waals
Beberapa asam amino memiliki gugus samping (R) dengan rantai karbon yang cukup panjang. Nilai dipol yang berfluktuatif dari satu gugus samping dapat membentuk ikatan dengan dipol berlawanan pada gugus samping lain. Interaksi Gaya dispersi van der waals dapat dilihat pada Gambar 2.6 berikut ini:
Gambar 2.6 Gaya dispersi Van der Waals (Anonim, 2010).
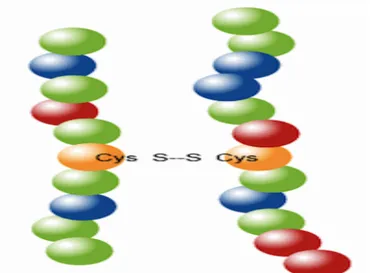
d. Jembatan disulfida
Cysteine memiliki gugus samping –SH dimana dapat membentuk ikatan sulfida dengan –SH pada cystein lainnya, ikatan ini berupa ikatan kovalen sehingga lebih kuat dibanding ikatan-ikatan lain yang sudah disebutkan di atas. Interaksi Jembatan disulfida dapat dilihat pada Gambar 2.7 berikut ini:
Gambar 2.7 Jembatan Disulfida (Anonim, 2010). 4. Struktur Kuartener
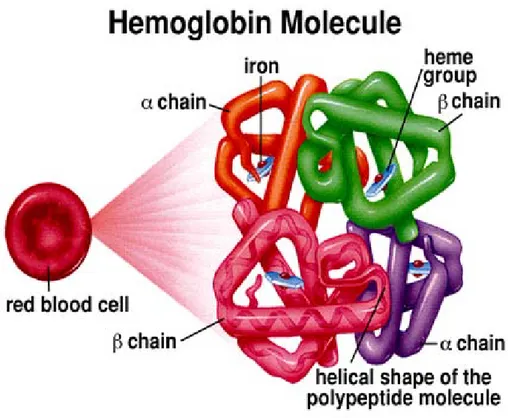
Protein atau polipeptida yang sudah memiliki struktur tersier dapat saling berinteraksi dan bergabung menjadi suatu multimer. Protein pembentuk multimer dinamakan subunit. Jika suatu multimer dinamakan dimer jika terdiri atas 2 subunit, trimer jika 3 subunit dan tetramer untuk 4 subunit. Multimer yang terbentuk dari subunit-subunit identik disebut dengan awalan homo-, sedangkan jika subunitnya berbeda-beda dinamakan hetero-. Misalnya hemoglobin yang terdiri atas 2 subunit alfa dan 2 subunit beta dinamakan heterotetrame (Winarno, 1991). Struktur kuartener protein dapat dilihat pada Gambar 2.8 berikut ini:
Gambar 2.8 Struktur kuartener protein (Anonim, 2010).
2.1.4 Fungsi Protein
Dalam penyuluhan dan pendidikan gizi protein berfungsi sebagai zat pembangun. Selain itu protein berfungsi dalam pertumbuhan dan pemeliharaan jaringan, menggantikan sel-sel yang mati.
Sebagai badan-badan anti, protein juga berfungsi dalam mekanisme pertahanan tubuh melawan berbagai mikroba dan zat toksik lain yang datang dari luar dan masuk ke dalam tubuh.
Sebagai zat-zat pengatur, protein mengatur proses-proses metabolisme dalam bentuk enzim dan hormon. Semua proses metabolik diatur dan dilangsungkan atas pengaturan enzim, sedangkan aktivitas enzim diatur lagi oleh
Protein sebagai salah satu sumber utama energi, bersama-sama dengan karbohidrat dan lemak. Tetapi energi yang berasal dari protein termasuk mahal, sehingga dapat digantikan dengan energi yang berasal dari karbohidrat karena jauh lebih murah dan lebih mudah didapat.
Dalam bentuk kromosom, protein juga berperan dalam menyimpan dan meneruskan sifat-sifat keturunan dalam bentuk gen. Di dalam gen tersimpan kodon untuk sintesa protein enzim tertentu, sehingga proses metabolisme diturunkan dari orangtua kepada anaknya dan terus kepada generasi-generasi selanjutnya secara berkesinambungan (Djaeni, 1976).
2.1.5 Sifat Protein dan Asam Amino
1. Denaturasi
Denaturasi protein melibatkan gangguan dan perusakan yang mungkin dari kedua struktur sekunder, tersier, dan kuartener tanpa diikuti oleh struktur primer. Karena reaksi denaturasi tidak cukup kuat untuk mematahkan ikatan peptida, struktur primer (urutan asam amino) tetap sama setelah proses denaturasi. Denaturasi mengganggu normal alfa-heliks dan lembaran beta pada protein menjadi bentuk acak. Denaturasi terjadi karena interaksi yang bertanggungjawab untuk struktur sekunder, struktur tersier, dan struktur kuartener terganggu. Dalam struktur tersier ada empat jenis interaksi ikatan antara rantai samping termasuk ikatan hidrogen, jembatan garam, ikatan disulfida, dan non-polar interaksi hidrofobik, yang mungkin terganggu. Oleh karena itu, berbagai reagen dan kondisi dapat menyebabkan denaturasi. Denaturasi dapat diartikan suatu perubahan terhadap struktur sekunder, tersier, dan kuartener terhadap molekul protein, tanpa terjadinya pemecahan ikatan-ikatan kovalen. Pengamatan yang
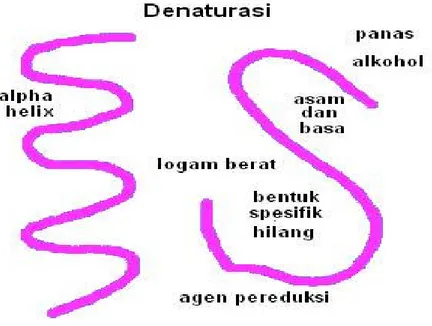
paling umum dalam proses denaturasi adalah pengendapan atau koagulasi protein (Winarno, 1986). Sketsa proses denaturasi protein dapat dilihat pada Gambar 2.9 berikut ini:
Gambar 2.9 Sketsa proses denaturasi (Anonim, 2010).
Menurut Winarno (1991), ada beberapa faktor yang menyebabkan denaturasi yaitu:
a. Fisika 1) Panas
Panas adalah penyebab umum denaturasi molekul serum albumin alamiah berbentuk ellips dengan panjang : lebar (3 : 1) yang akan berubah bentuk menjadi bulat (5 : 5) bila dipanaskan. Denaturasi sering diikuti oleh penurunan kelarutan protein, karena terbukanya gugus hidrofilik disebut agregasi. Protein atau denaturasi cendrung migrasi ke interface
2) Alkohol
Alkohol dapat menyebabkan terjadinya denaturasi protein yaitu dengan mengganggu ikatan rantai sisi hidrogen intramolekuler.
3) Pendinginan
Suhu yang rendah dapat menyebabkan terjadinya denaturasi. Beberapa protein susu dan telur teragregasi dan mengendap apabila didinginkan pada freezer.
4) Rangsangan mekanik
Perlakuan mekanik pada adonan roti (kneading and rolling) dapat menyebabkan terjadinya denaturasi (akibat energi yang diberikan), dan terjadinya regangan yang berulang; rusaknya α-helix.
5) Tekanan hidrostatik
Pada tekanan > 50 kPa dapat menyebabkan terjadinya proses denaturasi. 6) Radiasi
Pengaturan radiasi elektromagnetik terhadap protein tergantung pada panjang gelombang dan energi yang diberikan. Radiasi UV diadsorbsi oleh residu asam amino aromatik yaitu: triptofan, tirosin, dan fenilalanin. b. Bahan kimia
1) Asam dan basa
Protein stabil pada pH tertentu, tetapi bila diberi pH yang jauh lebih besar atau jauh lebih kecil, maka akan terjadi denaturasi.
2) Logam
Ada beberapa jenis logam yang dapat menyebabkan denaturasi yaitu: logam alkali Na, K (sedikit bereaksi); logam alkali tanah Ca, Mg (lebih
reaktif); logam transisi Cu, Fe, Hg, dan Ag (langsung bereaksi dan membentuk komplek yang stabil).
3) Pelarut organik
Hampir seluruh pelarut organik akan menyebabkan denaturasi, dengan cara mengganggu konstanta dielektrika dari media pelarut sehingga stabilitas protein terganggu. Pelarut organik non polar mampu menembus ke dalam daerah hidrofobik, mengganggu interaksi hidrofobik. Denaturasi juga terjadi karena interaksi pelarut organik dengan air (kompetisi, misal alkohol/etanol).
4) Larutan senyawa organik dalam air
Beberapa senyawa organik seperti urea dan garam dalam air akan mengganggu ikatan hidrogen sehingga menyebabkan terjadinya denaturasi. Senyawa ini juga menurunkan interaksi hidrofobik, dengan menaikkan kelarutan residu asam amino hidrofobik dalam fase air.
2. Zwitter ion
Dalam larutan asam (pH rendah), gugus amino bereaksi dengan H+, sehingga protein bermuatan positif. Bila pada kondisi ini dilakukan elektrolisis, molekul protein akan bergerak ke arah katoda. Sebaliknya, dalam larutan basa (pH tinggi), molekul protein akan bereaksi sebagai asam atau bermuatan negatif, sehingga molekul protein akan bergerak menuju anoda. Pada pH tertentu yang disebut titik isoelektrik (pI) (berkisar 4-4,5), muatan gugus amino dan karboksil bebas akan saling menetralkan sehingga molekul bermuatan nol. Tiap jenis protein
pada titik isolistrik ini, dan prinsip ini digunakan dalam proses-proses pemisahan serta pemurnian protein (Winarno, 1991).
3. Ampoter
Adanya gugus amino dan karboksil bebas pada ujung-ujung rantai molekul protein, menyebabkan protein banyak muatan (polielektrolit) dan bersifat amfoter (dapat bereaksi dengan asam dan basa). Daya reaksi berbagai jenis protein terhadap asam dan basa tidak sama, tergantung dari jumlah dan letak asam amino dan karboksil dalam molekul (Winarno, 1991).
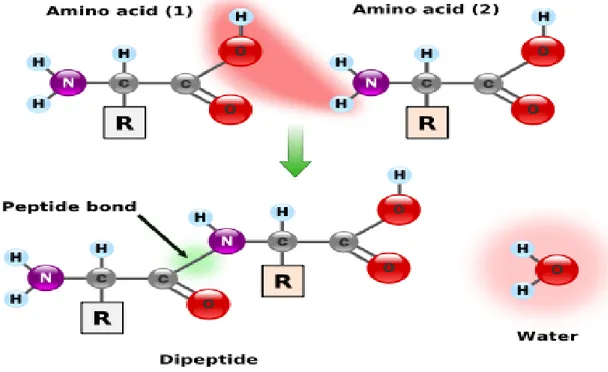
4. Pembentukan ikatan peptida
Dua asam amino berikatan melalui suatu ikatan peptida dengan melepas sebuah molekul air. Reaksi keseimbangan ini untuk berjalan ke arah hidrolisis daripada sintesis. Pembentukan ikatan tersebut memerlukan banyak energi, sedang untuk hidrolisis praktis tidak memerlukan energi (Winarno, 1991). Pembentukan ikatan peptida dapat dilihat pada Gambar 2.10 berikut ini:
2.1.6 Manfaat Protein
Protein adalah salah satu bagian dari makanan sehat. Protein berperan penting dalam struktur dan fungsi semua sel makhluk hidup dan virus. Selain itu protein juga memiliki peran penting dalam pembentukan sistem kekebalan (imunitas) sebagai antibodi, mengatur kerja hormon dan enzim dalam tubuh. Disamping menjadi salah satu sumber gizi, pada prinsipnya protein berperan menunjang keberadaan setiap sel tubuh dan proses kekebalan tubuh. Setiap orang dewasa sedikitnya wajib mengkonsumsi 1 g protein per kg berat tubuhnya. Kebutuhan akan protein bertambah pada perempuan yang mengandung dan atlet. Protein mutlak diperlukan tubuh selama masa pertumbuhan. Protein berperan dalam proses regenerasi sel, penyembuhan luka, produksi antibodi dan haemoglobin untuk menjaga kesehatan tubuh, serta mengatur kerja hormon dan enzim dalam tubuh (Widodo, 2009).
2.1.7 Akibat Kelebihan dan Kekurangan Protein
Mengonsumsi protein dalam jumlah yang berlebihan akan membebani kerja ginjal. Makanan yang tinggi proteinnya, biasanya juga tinggi lemaknya sehingga menyebabkan obesitas. Kelebihan protein pada bayi dapat memberatkan ginjal dan hati harus memetabolisme dan mengeluarkan kelebihan nitrogen dan juga dapat menyebabkan asidosis, dehidrasi, diare, kenaikan amonia darah dan ureum darah, dan demam (Ellya, 2010).
Sebaliknya, jika kita kurang mengonsumsi protein maka dapat menyebabkan penyakit kwashiorkor dan marasmus. Penyakit kwashiorkor lebih
pertumbuhan terhambat, otot-otot berkurang dan melemah, edema (terutama pada perut, kaki, dan tangan), muka bulat seperti bulan (moonface), gangguan psikomotor, apatis, tidak ada nafsu makan, tidak gembira dan suka merengek, kulit mengalami depigmentasi, kering, bersisik, pecah-pecah, dan dermatosisi, luka sukar sembuh, rambut mengalami depigmentasi, menjadi lurus, kusam, halus, dan mudah rontok, hati membesar dan berlemak, sering disertai anemia dan xeroftalmia. Kwashiorkor jarang dijumpai pada orang dewasa. Marasmus berasal dari kata Yunani yang berarti wasting/merusak. Marasmus pada umumnya merupakan penyakit pada bayi (dua belas bulan pertama), karena terlambat diberi makanan tambahan. Marasmus adalah penyakit kelaparan yang banyak terdapat pada kelompok sosial ekonomi rendah dan lebih banyak daripada kwashiorkor. Gejalanya adalah pertumbuhan terhambat, lemak di bawah kulit berkurang serta otot-otot berkurang dan melemah, apatis, muka seperti orangtua (olman's face) (Widodo, 2009; Yuniastuti, 2008).
2.2 Asam Amino
2.2.1 Pengertian Asam Amino
Asam amino adalah suatu erivat dari asam karboksilat yang pada C-α nya berikatan dengan gugus amina, hidrogen, dan rantai samping R (Sudarmadji dan Suhardi, 1989). Struktur asam amino dapat dilihat pada Gambar 2.11 berikut ini:
2.2.2 Sifat Asam Amino
Pada umumnya asam amino larut dalam air dan tidak larut dalam pelarut organik non polar seperti aseton, eter, kloroform. Sifat asam amino berbeda dengan asam karboksilat maupun dengan sifat amina yaitu titik leburnya. Asam amino mempunyai titik lebur yang lebih tinggi apabila dibandingkan dengan asam karboksilat ataupun amina. Apabila asam amino larut dalam air, gugus karboksilat akan melepas ion H+, sedangkan gugus amino akan menerima ion H+. Oleh adanya gugus tersebut maka asam amino dapat membentuk ion yang bermuatan negatif (zwitter ion) atau ion amfoter (Poedjiadi, 1994).
2.2.3 Penggolongan Asam Amino
Tidak semua asam amino yang terdapat dalam molekul protein dapat dibuat oleh tubuh kita. Jadi apabila ditinjau dari segi pembentukannya asam amino dapat dibagi dalam dua golongan (Poedjiadi, 1994), yaitu:
1. Asam amino esensial adalah asam amino yang tidak dapat dibentuk oleh tubuh dan harus disuplai dari makanan sumber protein. Contohnya: lisin, leusin, isoleusin, valin, triptofan, fenilalanin, metionin, treonin, arginin dan histidin ( ditambahkan dua lagi untuk anak-anak yang sedang tumbuh). 2. Asam amino non-esensial adalah asam amino yang dapat dibentuk oleh tubuh
sepanjang bahan dasarnya memenuhi bagi pertumbuhannya. Contohnya: alanin, aspargin, asam aspartat, asam glutamat, sistein, glisin, ornitin, prolin, serin, tirosin.
2.3Metode Analisis Protein 2.3.1 Analisis Kualitatif
1. Reaksi Biuret
Larutan protein dibuat alkalis dengan NaOH kemudian ditambahkan larutan CuSO4 encer. Uji ini untuk menunjukkan senyawa-senyawa yang mengandung gugus amida asam yang berada bersama gugus amida yang lain. Uji ini memberikan reaksi positif yang ditandai dengan timbulnya warna merah violet atau biru violet (Bintang, 2010).
2. Reaksi Xanthoprotein
Larutan HNO3 pekat ditambahkan hati-hati ke dalam larutan protein, setelah dicampur terjadi endapan putih yang berubah menjadi kuning apabila dipanaskan. Reaksi yang terjadi adalah nitrasi pada inti benzena yang terdapat pada molekul protein. Reaksi ini positif untuk protein yang mengandung triptofan, fenilalanin, tirosin (Poedjiadi, 1994).
2.3.2 Analisis Kuantitatif
1. Titrasi Formol
Larutan protein dinetralkan dengan NaOH, kemudian ditambahkan formalin dan akan membentuk dimenthiol. Dengan terbentuknya dimenthiol ini berarti gugus aminonya sudah terikat dan tidak akan mempengaruhi reaksi antara asam (gugus karboksil) dengan basa NaOH sehingga titrasi dapat diakhiri dengan tepat. Indikator yang digunakan adalah fenolftalein, akhir titrasi bila tepat terjadi perubahan warna menjadi merah muda yang tidak hilang dalam 30 menit. Titrasi formol ini hanya tepat untuk penentuan protein (Sudarmadji dan Suhardi, 1989).
2. Metode Kjeldahl
Metode Kjeldahl merupakan metode sederhana untuk penetapan nitrogen total pada asam amino, protein, dan senyawa yang mengandung nitrogen. Metode Kjeldahl cocok untuk menetapkan kadar protein yang tidak larut atau protein yang mengalami koagulasi akibat proses pemanasan maupun proses pengolahan lain yang biasa dilakukan pada makanan. Metode ini digunakan untuk menganalisis kadar protein kasar dalam bahan makanan secara tidak langsung karena senyawa yang dianalisisnya adalah kadar nitrogennya. Dengan mengalikan hasil analisis tersebut dengan faktor konversi 6,25 diperoleh nilai protein dalam bahan makanan tersebut (Sudarmadji dan Suhardi, 1989).
Penetapan kadar protein dengan metode ini memiliki kelemahan karena adanya senyawa lain yang bukan protein yang mengandung N akan tertentukan sehingga kadar protein yang diperoleh langsung dengan metode Kjeldahl ini disebut dengan kadar protein kasar (crude protein) (Sudarmadji dan Suhardi, 1989).
Metode Kjeldahl dilakukan dengan beberapa tahapan kerja yaitu: a. Tahap Destruksi
Pada tahap ini sampel dipanaskan dengan asam sulfat pekat sehingga terjadi destruksi menjadi unsur-unsurnya, dimana seluruh N organik dirubah menjadi N anorganik yaitu elemen karbon (C) teroksidasi menjadi karbondioksida (CO2), elemen hidrogen (H) teroksidasi menjadi air (H2O), dan elemen nitrogen (N) berubah menjadi ammonium sulfat {(NH4)2SO4}. Asam sulfat yang dipergunakan
Untuk mempercepat proses destruksi maka ditambahkan katalisator. Gunning menganjurkan menggunakan kalium sulfat ( K2SO4) dan tembaga (II) sulfat (CuSO4). Dengan penambahan katalisator ini, maka titik didih asam sulfat akan ditinggikan sehingga proses destruksi akan berjalan dengan cepat. Tiap 1 gram kalium sulfat akan mampu meningkatkan titik didih asam sulfat 3ºC. Suhu destruksi berkisar antara 370ºC-410ºC. Proses destruksi diakhiri jika larutan telah berwarna hijau jernih (Bintang, 2010).
Reaksi yang terjadi pada proses destruksi adalah:
Protein + H2S04(p) + katalisator (NH4)2SO4 + CO2 + SO2 + H2O b. Tahap Destilasi
Pada tahap ini ammonium sulfat {(NH4)2SO4} yang terbentuk pada tahap destruksi dipecah menjadi amonia (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Amonia yang dibebaskan selanjutnya akan ditangkap oleh larutan baku asam. Larutan baku asam yang dipakai adalah asam sulfat (H2SO4). Agar kontak antara asam dan amonia berjalan sempurna, maka ujung selang pengalir destilat harus tercelup ke dalam larutan asam. Destilasi diakhiri apabila semua amonia terdestilasi sempurna yang ditandai dengan destilat tidak bereaksi basis (Bintang, 2010).
Reaksi yang terjadi pada tahap destilasi adalah:
(NH4)2SO4 + 2 NaOH NH3 + 2 H2O + Na2SO4 c. Tahap titrasi
Penampung destilat yang digunakan adalah asam sulfat berlebih, maka sisa asam sulfat yang tidak bereaksi dengan amonia dititrasi dengan NaOH 0,02 N
menggunakan indikator mengsel. Titik akhir titrasi dapat ditandai dengan perubahan warna dari warna ungu menjadi hijau (Sudarmadji dan Suhardi, 1989). Reaksi yang terjadi pada tahap titrasi adalah:
2 NH3 + H2SO4 (NH4)2SO4 H2SO4 (sisa) + 2 NaOH Na2SO4 + 2 H2O
Kadar protein (% P) dapat dihitung dengan persamaan sebagai berikut: % P = ml NaOH (blanko−sampel )
berat sampel (g)x 1000 x N NaOH x 14,007 x FK x 100% FK = faktor konversi atau perkalian = 6,25
Besarnya faktor konversi nitrogen tergantung pada persentase nitrogen yang menyusun protein dalam bahan pangan yang dianalisa tersebut (Budianto, 2009). Besarnya faktor konversi dari bermacam-macam bahan makanan dapat dilihat pada Tabel 2.3 berikut ini:
Tabel 2.3 Tabel faktor konversi dari bermacam-macam bahan makanan
No Bahan Makanan Faktor Konversi
1. Beras (semua jenis) 5,95
2. Gandum biji 5,83
3. Kacang kedelai 5,71
4. Kacang tanah 5,46
5. Kelapa 5,30
6. Makanan lain (umum) 6,25
7. Susu (semus jenis)/keju 6,38
8. Tepung 5,70
3. Metode Lowry
Konsentrasi protein diukur berdasarkan optikal density pada panjang gelombang 600 nm. Untuk mengetahui banyaknya protein dalam larutan, lebih
dalam NaOH 0,1 N, CuSO4 dan Na-K-tartrat 2%. Cara penentuannya adalah 1 ml larutan protein ditambah 5 ml Lowry B, dikocok dan dibiarkan selama 10 menit. Kemudian ditambah 0,5 ml Lowry A dikocok dan dibiarkan 20 menit, selanjutnya diamati OD-nya pada panjang gelombang 600 nm (Sudarmadji dan Suhardi, 1989).
4. Metode Pengecatan
Beberapa bahan pewarna misalnya amido black, orange G, orange 12 dapat membentuk senyawaan berwarna dengan protein dan menjadi tidak larut. Dengan mengukur sisa bahan pewarna yang tidak bereaksi dalam larutan (dengan colorimeter), maka jumlah protein dapat ditentukan dengan cepat (Sudarmadji dan Suhardi, 1989).
5. Metode Spektrofotometer UV
Kebanyakan protein mengabsorbsi sinar UV maksimum pada 280 nm. Hal ini terutama oleh adanya asam amino tirosin, triptofan, dan fenilalanin yang ada pada protein tersebut. Pengukuran protein berdasarkan absorbsi sinar UV adalah cepat, mudah, dan tidak merusak bahan (Sudarmadji dan Suhardi, 1989).
6. Metode Turbidimetri atau Kekeruhan
Kekeruhan akan terbentuk dalam larutan yang mengandung protein apabila ditambahkan bahan pengendap protein misalnya Tri Chloro Acid (TCA), Kalium Ferri Cyanida {K4Fe(CN)6} atau asam sulfosalisilat. Tingkat kekeruhan diukur dengan alat turbidimeter. Cara ini hanya dipakai untuk bahan protein yang berupa larutan atau hasilnya, tetapi biasanya hasilnya kurang tepat (Sudarmadji dan Suhardi, 1989).
2.4 Pengaruh Memasak terhadap Protein
Diantara pengaruh memasak secara umum ialah melunaknya jaringan ikat dan hancurnya lemak yang memungkinkan cairan-cairan pencernaan menembus lebih baik ke dalam bahan makanan. Tetapi di luar pengaruh ini, beberapa jenis protein menjadi lebih mudah dicerna karena perubahan penyusunan asam-asam aminonya, sebagai contoh, putih telur mentah lebih sukar dicerna dan diserap, dibandingkan dengan putih telur yang bergumpal karena dimasak. Tetapi sebaliknya suhu tinggi ketika memanggang dapat menurunkan nilai protein, seperti yang terdapat pada bagian kulit yang berwarna coklat sebuah roti, yang mempunyai nilai cerna dan nilai biologik yang lebih rendah bila dibandingkan dengan protein di bagian dalam roti tersebut. Di dalam bagian kulit ini telah terjadi pengrusakan pada sebagian lysine dan mungkin pula pada asam-asam amino lainnya. Nilai-nilai protein mungkin pula menjadi berkurang karena bahan makanan dimasak terlalu lama atau karena diulang pemasakannya; tetapi cara-cara memasak yang baik akan menambah digestibilitas protein bukan menguranginya (Budianto, 2009).
2.5 Analisis Protein dan Non Protein Nitrogen Dalam Belut 2.5.1 Penetapan Kadar Protein
Salah satu cara yang umum dilakukan untuk mengetahui kadar protein dalam bahan makanan adalah berdasarkan kandungan rata-rata unsur N yang terdapat dalam protein tersebut dengan metode Kjeldahl. Penetapan kadar protein
urea, asam nukleat, asam amino bebas, nitrat, nitrit, dan lain-lain, sehingga kadar protein yang diperoleh langsung dengan cara Kjeldahl ini sering disebut dengan kadar protein kasar (crude protein) (Sudarmadji dan Suhardi, 1989).
Dasar perhitungan penentuan protein menurut Kjeldahl adalah berdasarkan hasil penelitian yang menyatakan bahwa umumnya protein mengandung rata-rata 16% N dalam protein murni. Apabila jumlah N dalam bahan telah diketahui, maka jumlah protein dihitung dengan mengalikan jumlah N dengan 100/16 (N x 6,25). Sedangkan untuk protein-protein tertentu yang telah diketahui komposisinya dengan tepat, maka faktor perkalian yang lebih tepat yang dipakai. Pada analisis protein dengan cara Kjeldahl ini dapat dibagi menjadi 3 tahap yaitu:
1. Tahap Destruksi
Pada tahap ini sampel dipanaskan dalam H2SO4 pekat sehingga terjadi destruksi menjadi unsur-unsurnya. Elemen karbon, hidrogen, teroksidasi menjadi CO, CO2, dan H2O. Sedangkan nitrogennya (N) akan berubah menjadi (NH4)2SO4. Untuk mempercepat proses destruksi sering ditambahkan katalisator berupa campuran Na2SO4 dan HgO (20 : 1). Gunning menganjurkan menggunakan K2SO4 atau CuSO4. Dengan penambahan katalisator tersebut titik didih asam sulfat akan dipertinggi sehingga destruksi berjalan dengan cepat. Tiap 1 gram K2SO4 dapat menaikkan titik didih 3ºC. Suhu destruksi berkisar antara 370º - 410ºC. Bila menggunakan HgO, ammnonium sulfat yang terbentuk dapat mengadakan reaksi dengan merkuri oksida membentuk senyawa kompleks. Proses destruksi sudah selesai apabila larutan menjadi jernih atau tidak berwarna. Agar analisa lebih tepat maka pada tahap destruksi ini dilakukan pula perlakuan blanko
yaitu untuk koreksi adanya senyawa N yang berasal dari reagensia yang digunakan.
2. Tahap Destilasi
Pada tahap ini, ammonium sulfat dipecah menjadi ammonia (NH3) dengan penambahan NaOH sampai alkalis dan dipanaskan. Ammonia yang dibebaskan selanjutnya akan ditangkap oleh larutan asam standar. Asam standar yang dipakai adalah asam klorida atau asam borat 4% dalam jumlah yang berlebihan. Agar kontak antara asam dan amoniak lebih baik maka diusahakan ujung tabung destilasi tercelup sedalam mungkin dalam asam. Untuk mengetahui asam dalam keadaan berlebih maka diberikan indikator misalnya BCG MR + PP. Destilasi diakhiri bila sudah semua ammonia terdestilasi sempurna dengan ditandai destilasi tidak bereaksi basis.
3. Tahap Titrasi
Apabila penampung destilasi digunakan asam klorida maka sisa asam klorida yang tidak bereaksi dengan ammonia dititrasi dengan NaOH standar (0,1 N). Akhir titrasi ditandai dengan tepat perubahan warna larutan menjadi merah muda dan tidak hilang selama 30 detik bila menggunakan indikator PP. Selisih jumlah titrasi balnko dan sampel merupakan jumlah ekuivalen nitrogen. % N = ml NaOH (blanko−sampel )
berat sampel (g)x 1000 x N NaOH x 14,007 x 100%
Apabila penampung destilasi digunakan asam borat maka banyaknya asam borat Yang bereaksi dengan ammonia dapat diketahui dengan titrasi menggunakan asam klorida 0,1N dengan indikator (BCG + MR). Akhir titrasi ditandai dengan
% N = ml HCl (blanko−sampel )
berat sampel (g)x 1000 x N HCl x 14,007 x 100%
Setelah diperoleh %N, selanjutnya dihitung kadar proteinnya dengan mengalikan suatu faktor. Besarnya faktor perkalian N menjadi protein ini tergantung pada persentase N yang menyusun protein dalam suatu bahan (Sudarmadji dan Suhardi, 1989).
2.5.2 Penetapan Kadar Non Protein Nitrogen
Ketelitian penentuan kadar NPN tergantung pada kemampuan dari metode yang digunakan untuk memisahkan protein dari NPN. Setelah pemisahan protein dari NPN maka kadar protein dan NPN dapat ditentukan kadarnya dengan metode Kjeldahl. Dari analisis yang telah dilakukan, umumnya larutan ATA 10% dipilih untuk mengendapkan protein dalam bahan makanan. Beberapa keuntungan pemakaian larutan ATA ini yaitu pengerjaannya mudah, endapan protein yang diperoleh mudah dipisahkan dari larutan ATA nya dan tidak mempengaruhi ketelitian metode Kjeldahl. Ada 2 cara yang dapat dilakukan untuk mengetahui kadar NPN ini, yaitu dengan menentukan langsung kadar NPN dengan metode Kjeldahl, atau dengan cara mengurangkan kadar N total yang diperoleh dengan kadar N endapan (N protein) (Silalahi, 1994).
2.6 Penetapan Kadar Non Protein Nitrogen Terhadap Penetapan Kadar Protein
Adanya NPN dalam bahan makanan yang kaya protein perlu diketahui untuk memberi gambaran nilai gizi yang sebenarnya dari bahan makanan tersebut. Pada umumnya NPN yang terdapat dalam bahan mentah hanya sedikit dibandingkan dengan kandungan proteinnya. NPN yang terdapat dalam bahan
mentah tersebut biasanya berasal dari asam-asam amino bebas yang kemungkinan merupakan hasil degradasi proteinnya ataupun residu dari sintesis protein yang tidak jadi. Jadi nilai gizi dari bahan mentah sebenarnya tidak begitu dipengaruhi oleh adanya NPN tersebut. Pada bahan makanan yang telah mengalami perubahan-perubahan baik karena pengaruh kondisi dari luar ataupun karena proses pengolahannya kemungkinan sekali NPN nya semakin bertambah. Misalnya dalam ikan laut, senyawa amina yang dalam ikan segar relatif kecil akan naik dengan cepat bila mengalami pembusukan. Hal ini terjadi karena adanya enzim-enzim yang berasal dari mikroorganisme pembusuk yang terdapat dalam ikan atau yang dihasilkan ikan itu sendiri, yang mengkatalisa perubahan asam amino bebas menjadi senyawa amina (Silalahi, 1994).
Banyak senyawa-senyawa amina yang dapat terbentuk dari asam-asam amino bebas, seperti ammonia sebagai hasil deaminasi asam amino bebas, ataupun His yang berasal dari dekarboksilasi histidin yang aktif secara fisiologis. Jadi penentuan kadar NPN dalam bahan makanan yang telah diproses penting sekali untuk mengetahui nilai gizi yang sebenarnya tersedia dalam bahan makanan tersebut (Silalahi, 1994).
2.7 Belut
Walaupun tidak memiliki kaki, belut merupakan binatang melata yang termasuk bangsa ikan dan bukan sejenis ular. Belut tidak bersirip, bentuk badannya bulat panjang dan berlendir banyak. Belut memiliki mata kecil, dan
Belut mampu hidup di lumpur dan di air keruh. Di Indonesia sekitar 20 jenis belut. Namun, karena tingkat populasi dan kedekatan habitatnya, terdapat tiga jenis belut yang dikenal masyarakat yaitu:
a. Belut sawah (Monopterus albus)
Belut sawah mempunyai panjang badan 20 kali tinggi badan. Letak permulaan sirip punggung sedikit di belakang perut. Sementara alat pernapasan belut dilengkapi dengan tiga lengkung insang. Rata-rata, panjang tubuh maksimal belut mencapai 80 cm dan berat maksimal 400 g.
b. Belut rawa (Synbranchus bengalensis)
Belut rawa mempunyai panjang badan 30 kali tinggi badan. Letak permulaan sirip punggung di depan dubur. Di bagian perut, terdapat lubang insang berukuran kecil yang hanya dilengkapi empat lengkung insang sebagai alat pernapasannya.
c. Belut laut/payau (Macroterma caligans)
Belut payau mempunyai mata yang kecil dan letaknya bertepatan dengan tengah bibir. Adapun permulaan sirip punggung belut ini bertepatan dengan dubur. Sementara alat pernapasannya terdiri dari empat lengkung insang.
Adapun klasifikasi belut (Saparinto, 2009) adalah sebagai berikut: Kingdom : Animalia Subkingdom : Metazoa Phylum : Chordata Kelas : Pisces Subkelas : Teleostei Ordo : Synbranchoidae
Famili : Synbranchidae Genus : Monopterus
Spesies : Monopterus albus (belut sawah)
Belut dianggap sebagai hewan karnivora karena memakan daging sebangsa ikan. Belut tergolong hewan yang bisa mengalami pergantian alat kelamin, dari betina berubah menjadi jantan. Belut betina berwarna lebih cerah atau lebih muda, hijau muda pada punggung dan putih kuning pada perut. Belut jantan berwarna abu-abu gelap, badannya lebih panjang dengan kepala lebih tumpul. Saat terjadinya pergantian kelamin, belut mengalami kosong kelamin dan dapat menjadi kanibal dan ganas (Sundoro, 2003).
Kandungan gizi belut cukup tinggi, dan dapat dikelompokkan dalam empat kelompok yaitu: unsur makro, vitamin, mineral, dan asam amino. Kandungan gizi belut dapat dilihat pada Tabel 2.4.
Tabel 2.4. Kandungan Gizi Belut
Kandungan Gizi Belut
Kelompok Nutrisi Kandungan
Lemak 20%
Asam lemak 27 g/100 g
Omega 3 4,48-11,80%
Unsur Makro Asam aspartat 1.638 g/100 g
Serat 2,3 g/100 g Energi 303 Kkal/100 g Air 78 g/100g Kalsium 2.378 mg/100 g Besi 4,97 mg/100 g Mineral Fosfor 206 mg/100 g Kalium 420 g Seng 6,38 mg/100 g Vitamin Niasin 4.956 mg/100 g Vitamin A 50 µgRE/100 g
Asam glutamat 2.676 mg/100 g
Glisine 1.231 mg/100 g
Histidin 409 mg/100 g
Asam amino Isoleusin 769 mg/100 g
Lisin 1.471 mg/100 g Methionin 476 mg/100 g Fenolalanin 803 mg/100 g Prolin 785 mg/100 g Serin 696 mg/100 g Leusin 1.322 mg/100 g Threonin 771 mg/100 g Triptofan 250 mg/100 g Tirosin 604 mg/100 g Valin 844 mg/100 g
Sumber: Cina Food Composition Database, 2002 (Saparinto, 2009).
Manfaat belut adalah sebagai penyediaan sumber protein hewani yang sangat diperlukan oleh tubuh, juga makanan sehari-hari bagi manusia, serta sebagai obat untuk penambah darah, meningkatkan stamina dan meningkatkan sistem kekebalan tubuh, memelihara tulang, merangsang pertumbuhan balita, mencegah penyakit jantung koroner, menurunkan tekanan darah tinggi (Arief dan Hasanawi, 2009; Saparinto, 2009).