PENGARUH KONSENTRASI NAA TERHADAP PERTUMBUHAN DAN
PERKEMBANGAN PLANLET KINA (Cinchona succirubra Pavon)
PADA SUBKULTUR KE IV
(The Effect of NAA Concentration on Growth and Development of Plantlets of
Quinine in the Fourth Subculture)
Reni Mayerni, Netti Herawati, dan Syazwana
Jurusan Budidaya Pertanian Fakultas Pertanian Universitas AndalasABSTRACT
Experiments on the effect of NAA concentration on growth and development of plantlets of quinine in the fourth subculture were carried out in Plant Tissue Culture Laboratory, Department of Agriculture, Faculty of Agriculture, Andalas University in Padang. The experiment was conducted in July through October 2009. The experiment was arranged in completely randomized design consisting of four levels of treatment and 3 replications. The purpose of experiment was to obtain the concentration of NAA was best for the growth and development of quinine culture plantlets on MS medium with BAP concentration of 3 mg/L. The experimental results have not obtained the concentration of NAA is the best for the growth and development of quinine succi plantlet subculture shot but with the addition of NAA concentration of 0.5 mg/L - 2.0 mg/L will encourage the formation of callus, beginning at week 5 reached 79, 69%.
Kata kunci : NAA, plantlets of quinine, subculture
PENDAHULUAN
anaman kina (Cinchona succirubra Pavon) yang telah dikenal manusia sejak zaman kuno pertama kali ditemukan oleh bangsa Indian Peru sebagai obat demam, karena tanaman ini mengandung alkaloid kuinolin (quinoline) pada kulit batang. Tanaman kina terdiri atas kurang lebih 40 spesies. Spesies yang paling banyak digunakan sebagai sumber obat adalah Cinchona succirubra, C. Ledgeriana, C. Officinalis, dan C. Calisaya (Widayat, 2000).
Tanaman kina secara umum hanya dikenal orang untuk obat Malaria, padahal banyak lagi manfaat dari kina. Garam kina juga digunakan untuk industri kosmetik, industri minuman dan pada tahun terakhir oleh industri Farmasi, garam Kina digunakan dalam pembuatan Tamiflu (Obat Flu Burung). Dari tahun ke tahun permintaan akan kina terus mengalami peningkatan, tapi menurut data tahun 2002-2003 Dinas Perkebunan Jabar, di daerah itu tanaman kina yang masih diusahakan hanya tinggal sekitar 4496,27 ha.
Sedangkan sebelum tahun 1945 total luas lahan tanaman kina 17.000-18.000 ha.
Perbanyakan tanaman kina secara konvensional biasanya dilakukan dengan biji, setek, sambungan dan okulasi. Namun penyediaan bibit melalui biji menghasilkan keragaman tanaman yang tinggi akibat adanya penyerbukan silang sehingga menghasilkan turunan yang umumnya mempunyai kandungan kuinolin yang lebih rendah. Perbanyakan cara setek menghadapi kesulitan dalam menginduksi perakaran, sedangkan teknik sambung dan okulasi memerlukan batang bawah dalam jumlah besar selain perlu adanya kesesuaian antara batang bawah dan batang atas (Arifin et al., 1995). Untuk itu diperlukan suatu metode perbanyakan yang dapat memecahkan permasalahan bibit, salah satunya melalui metode in vitro. Metode ini dapat menghasilkan bibit dalam jumlah yang besar tanpa memerlukan jumlah induk yang banyak, waktu yang relatif singkat dan bibit yang dihasilkan bebas patogen.
Kemampuan eksplan untuk beregenerasi sangat ditentukan oleh media yang digunakan dan komposisi zat pengatur tumbuh dalam
T
media. Pada kultur jaringan dikenal banyak jenis media yang digunakan. Media MS digunakan hampir semua kultur jaringan. Walaupun unsur-unsur makro dalam media MS dibuat untuk kultur kalus tembakau, tetapi komposisi MS pada umumnya juga mendukung kultur tanaman lainnya (Gunawan, 1988). Pemberian zat pengatur tumbuh merupakan faktor yang menentukan arah perkembangan eksplan. Gunawan (1987) menyatakan bahwa penggunaan zat pengatur tumbuh sangat diperlukan sebagai komponen media. Tanpa penambahan zat pengatur tumbuh dalam media maka pertumbuhan akan terhambat. Pembentukan planlet bergantung penggunaan yang tepat dari zat pengatur tumbuh. Dua golongan zat pengatur tumbuh yang sangat penting dalam kultur jaringan tanaman adalah auksin dan sitokinin.
Zat pengatur tumbuh seperti NAA (Napthalene Asetic Acid) merupakan salah satu auksin sintetis yang banyak digunakan untuk meningkatkan ratio pertumbuhan akar baru pada selang waktu tertentu (Suliansyah, 2002). Beberapa zat yang tergolong auksin sintesis untuk merangsang pertumbuhn akar adalah IAA, NAA dan IBA. NAA dan IBA lebih ekektif daripada IAA, kandungan kimia IBA dan NAA dan daya kerjanya lebih stabil serta memberi-kan kemungkinan lebih berhasil dalam pem-bentukan akar (Hartmamn cit Santoso, 2004).
Menurut Marta (2008), dengan kombinasi 0,5 mg/ L NAA dengan 3,0 mg/ L BAP hanya mampu memacu pertumbuhan shootlet tapi belum mampu merangsang keluarnya akar pada eksplant tanaman kina, dan dari semua perlakuan hanya satu perlakuan yang mampu berakar yang membentuk planlet. Selanjutnya Tahardi dan Riyadi (2005) menyatakan bahwa planlet kina berhasil tumbuh dan berkembang pada media Murashige skoog (MS) standar yang mengandung sukrosa 30 g/L dan diberi NAA 0,1 – 2 mg/L (secara tunggal) dan 0,05 – 1 mg/L yang dikombinasikan dengan IBA. Percobaan yang dilakukan Wenas (2003) menunjukkan bahwa penambahan zat pengatur tumbuh 0,1 NAA mampu mendukung pertumbuhan dan perkembangan planlet Gambir.
Prahardini dan Sudaryono cit Wulandari (2004) membuktikan bahwa penambahan 3 mg/L NAA dan 2 mg/L BA efektif untuk induksi kalus pepaya dan jumlah kultur perkalus meningkat dengan peningkatan NAA dari 1 mg/L – 3 mg/L dan Wulandari (2004)
melaporkan 1 ppm NAA mempunyai kemampuan dalam merangsang pembelahan sel terutama dalam pucuk tanaman dan pertumbuhan akar. Roseliza cit Wulandari (2004) mengatakan bahwa pada umumnya perbandingan yang relatif tinggi antara auksin dan sitokinin akan mempengaruhi pembentukan akar.
Dalam penelitian Santoso et al (2004), menyatakan bahwa konsentrasi BAP yang terbaik untuk inisiasi dan penggandaan tunas tanaman kina Ledger dan Succi adalah 3,0 mg/L BAP dengan laju penggandaan 7 tunas/ eksplan per bulan untuk ledger dan 3-4 tunas/ eksplan per bulan untuk kina Succi.
Tujuan dari percobaan ini adalah untuk mendapatkan konsentrasi NAA yang terbaik bagi pertumbuhan dan perkembangan planlet kina yang dikulturkan pada media MS dengan konsentrasi BAP 3 mg/ L.
BAHAN DAN METODE
Percobaan ini telah dilaksanakan di Laboratorium Kultur Jaringan Tumbuhan, Jurusan Budidaya Pertanian, Fakultas Pertanian, Universitas Andalas Padang. Percobaan dilaksanakan dari bulan Juli sampai Oktober 2009. Bahan yang digunakan adalah potongan satu ruas kina succi in vitro hasil sub kultur ke III, zat pengatur tumbuh NAA, BAP, sukrosa 30 g/L, agar-agar powder, alkohol 70 %, Alkohol 96 %, aquadest, bayclin, deterjen, spritus, NaOH 0,1 N dan HCl 0,1 N. Alat-alat yang digunakan adalah Laminar Air Flow Cabinet (LAFC), lemari es, oven, autoklaf, kompor gas, timbangan analitik, botol kultur, pengaduk kaca, pH meter, plastic wrap, gelas piala, gelas ukur, handsprayer, scalpel, gunting, pinset, pipet, plastik kaca, karet gelang, tissue, lampu spritus, kertas label, petridis, rak kultur, kamera dan alat-alat tulis.
Rancangan yang dipakai dalam percobaan ini adalah Rancangan Acak lengkap (RAL) yang terdiri dari 4 perlakuan dan 3 ulangan, sehingga terdapat 12 satuan percobaan. Pada masing-masing satuan percobaan terdapat 7 botol kultur sehingga terdapat 84 botol kultur. Tiap botol masing-masing ditanam 1 eksplan dan semua populasi diamati. Percobaan ini menggunakan media MS dengan konsentrasi BAP 3,0 mg/ L. Data yang diperoleh diuji dengan uji F pada taraf nyata 5 %. Apabila berbeda nyata, maka dilanjutkan dengan uji
lanjutan Duncan’s Multiple Range Test (DNMRT) pada taraf nyata 5 %. Perlakuannya adalah konsentrasi NAA yang terdiri dari 4 taraf: 0,5 mg/ L NAA(A), 1,0 mg/ L NAA(B), 1,5 mg/ L NAA(C), dan 2,0 mg/L NAA(D).
Sterilisasi Alat
Alat-alat seperti petridish, botol, pinset, scalpel dan peralatan lainnya dicuci dengan detergen dan dibilas hingga bersih, selanjutnya botol direndam dalam bayclin selama 24 jam kemudian disterilisasi dalam autoklaf pada tekanan 15 psi dengan suhu 121o C selama 15
menit. Alat-alat selain botol kultur dibungkus dengan kertas sebelum dimasukkan ke dalam autoklaf. Alat-alat yang tidak langsung digunakan setelah sterilisasi di simpan dalam oven. LAFC disemprot dengan alkohol 70% setiap kali akan digunakan, dan kemudian sterilisasi dengan menyalakan lampu UV sehari sebelum penanaman.
Pembuatan Media
Media yang digunakan adalah media MS. Zat kimia penyusun dibagi menjadi beberapa larutan stok (A, B, C, D, E, dan F) berdasarkan jenis garamnya. Total media yang dibuat sebanyak 3,0 L dimana masing-masing perlakuan mempunyai volume 750 ml. Langkah pertama dalam membuat media adalah pipet unsur hara (A sampai F), mio inositol serta vitamin sesuai takaran, tambahkan gula 30 g/L, pipet BAP 9 ml (stok dibuat dalam konsentrasi 1.000 mg/ L), tambahkan aquadest dan cukupkan volume menjadi 2.000 ml. Kemudian media dibagi 4 ke dalam labu ukur 1.000 ml dengan volume masing-masing 500 ml, lalu pipet NAA sesuai perlakuan. Pemipetan untuk stok NAA langsung dilakukan pada saat pembuatan media.
Larutan media dimasak sampai kelihatan agak jernih. Kemudian media tersebut dimasukkan kedalam botol kultur sebanyak 25 ml per botol dan ditutup dengan plastik kaca dan diikat dengan karet gelang. Media disterilkan dalam autoklaf pada tekanan 15 psi dengan suhu 121o selama 15 menit. Kemudian
botol dipindahkan dalam ruang inkubasi selama satu minggu untuk mengetahui apakah media tersebut terkontaminasi atau tidak. Media yang terkontaminasi harus segera dikeluarkan.
Pemberian Perlakuan
Untuk konsentrasi NAA 0,5 mg/ L maka dipipet sebanyak 3,75 ml, konsentrasi NAA 1,0 mg/ L maka dipipet 7,5 ml, konsentrasi NAA 1,5 mg/ L maka dipipet sebanyak 11,25 ml dan NAA 2,0 mg/ L maka dipipet 15 ml, tambahkan aquadest sampai volume menjadi 750 ml.
Penanaman
Sub kultur kina ke III ini ditanamn pada media MS 0 (Tanpa zat pengatur tumbuh). Eksplan yang dipakai untuk sub kultur Kina ke III adalah dari planlet kina hasil sub kultur dari penelitian mahasiswa sebelumnya yang sudah ada di Laboratorium kultur jaringan tanaman, setelah kina hasil sub kultur ke III berpucuk. Pucuk baru dari eksplan inilah yang akan dijadikan sebagai eksplan untuk sub kultur kina ke IV. Pada Sub kultur Kina ke IV ini, bahan tanamnnya berasal dari Kina hasil Sub kultur ke III yang telah dikulturkan terlebih dahulu pada media. Yang akan dijadikan sebagai eksplan untuk Sub kultur kina ke IV adalah satu ruas pucuk kina hasil sub kultur ke III dan jika ada diantara pucuk tersebut berdaun, maka semua daun dipotong supaya semua seragam.
Kegiatan penanaman eksplan dilakukan dalam LAFC yang telah disterilkan. Botol kultur, petridis, lampu spritus dan alat tanam yang telah disterilkan sebelum dimasukkan disemprotkan terlebih dahulu dengan alkohol 70 %. Kegiatan penanaman dilakukan sebagai berikut : semua alat-alat yang digunakan seperti pinset, gunting dan scalpel direndam dalam alkohol 96 % kemudian dibakar dengan lampu spritus. Kina in vitro dikeluarkan dari botol kultur dan diletakkan dalam petridis, lalu potong satu ruasnya menggunakan scalpel. Kemudian eksplan ditanam pada media perlakuan yang telah disiapkan dimana satu eksplan satu botol. Media yang telah ditanami ditutup dengan selotip dan dibalut rapat dengan plastic wrap dan diberi label. Selanjutnya botol dipindahkan ke ruang inkubasi dan disusun berdasarkan denah penempatan perlakuan.
HASIL DAN PEMBAHASAN
Saat Muncul Tunas Eksplan Tanaman Kina (Hari)
Analisis ragam terhadap saat muncul tunas pada beberapa konsentrasi NAA memperlihatkan hasil yang berbeda tidak
nyata. Hasil pengamatan dapat dilihat pada Tabel 1.
Tabel 1. Saat muncul tunas umur 16 minggu setelah tanam pada beberapa konsentrasi NAA
Zat pengatur
tumbuh Saat muncul tunas (hari) 0,5 mg/ l 1,0 mg/ l 1.5 mg/ l 2,0 mg/ l 12,38 14,55 18,92 13,65 KK = 15,04 %
Angka-angka pada kolom saat muncul tunas yang sama berbeda tidak nyata menurut uji F pada taraf nyata 5 % Pada percobaan yang diamati, semua perlakuan bertunas dan berdaun sampai pada minggu ke 5 setelah tanam, tetapi setelah itu warnanya berubah menjadi merah dan pada minggu ke 7 samapai minggu terakhir percobaan terbentuklah kalus seperti terlihat pada gambar dibawah ini:
Umur 4 MST Umur 12 MST
Gambar 1: Pembentukan daun dan kalus tanaman kina. Pemunculan kalus diduga karena
penambahan konsentrasi NAA menyebabkan tingginya kandungan auksin pada eksplan sehingga menghambat untuk terbentuknya tunas, berarti pada kondisi ini konsentrasi BAP dan NAA pada eksplan berada pada kondisi seimbang sehingga terbentuklah kalus
Hal ini sesuai dengan pendapat Widiastoety (1987) menyatakan bahwa pembentukan kalus biasanya terjadi jika perbandingan auksin dan sitokinin seimbang. Menurut Heddy cit Sudarmadji (2003), hormon pertumbuhan BAP, walaupun dengan konsentrasi rendah, dapat mengatur proses fisiologis tumbuhan. Hal ini disebabkan hormon pengatur tumbuh dipengaruhi oleh asam nukleat sehingga langsung mempengaruhi aktivitas enzim. Pietrik cit Sudarmadji (2003) menyatakan bahwa pertumbuhan kalus tidak terlepas dari media tanam yang dilengkapi dengan unsur-unsur hara dan zat pengatur tumbuh.
Persentase Eksplan yang Membentuk Tunas Analisis ragam terhadap saat muncul tunas pada beberapa konsentrasi NAA memperlihatkan hasil yang berbeda tidak nyata. Hasil pengamatan dapat dilihat pada Tabel 2.
Tabel 2. Persentase Eksplan yang membentuk tunas umur 5 MST pada beberapa konsentrasi NAA Zat pengatur tumbuh Persentase eksplan membentuk tunas (%) 0,5 mg/ l 1,0 mg/ l 1.5 mg/ l 2,0 mg/ l 63,86 47,62 33,33 65,00 KK = 37,62 %
Angka-angka pada kolom persentase eksplan yang membentuk tunas adalah berbeda tidak nyata menurut uji F pada taraf nyata 5%.
daun
Pemberian zat pengatur tumbuh belum memberikan pengaruh yang nyata terhadap persentase eksplan membentuk tunas. Hal ini disebabkan karena kandungan auksin pada beberapa konsentrasi yang diberikan belum mampu memacu proses fisiologis dalam sel berupa pembelahan dan pembesaran yang merupakan tahap pertama dari diferensiasi sel, sehingga belum mampu meningkatkan pertumbuhan tunas. Fungsi pemberian zat pengatur tumbuh adalah menambah kegiatan pembelahan sel di jaringan meristem, dimana sel-sel tersebut menjadi panjang dan banyak berisi air (Harjadi, 1984). Perlakuan yang diberikan belum mampu untuk merangsang aktivitas tersebut.
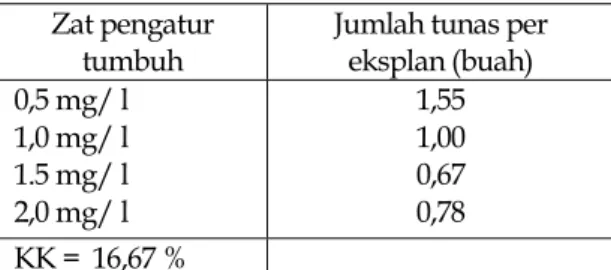
Jumlah Tunas Per Eksplan (Buah)
Analisis ragam terhadap jumlah tunas pada beberapa konsentrasi NAA memperlihatkan hasil yang berbeda tidak nyata. Hasil pengamatan dapat dilihat pada Tabel 3.
Tabel 3. Jumlah tunas per eksplan tanaman kina umur 5 MST pada beberapa konsentrasi NAA
Zat pengatur
tumbuh Jumlah tunas per eksplan (buah) 0,5 mg/ l 1,0 mg/ l 1.5 mg/ l 2,0 mg/ l 1,55 1,00 0,67 0,78 KK = 16,67 %
Angka-angka pada kolom jumlah tunas per eksplan adalah berbeda tidak nyata menurut uji F pada taraf nyata 5%.
Hasil penelitian ini bertentangan dengan hasil penelitian Santosa et al, (2004) yang menyatakan bahwa dengan penambahan 3 mg/L BAP mampu mempercepat pembentukan tunas dengan laju penggandaan 7 tunas/bulan untuk kina Ledger dan 3-4 tunas/bulan untuk kina Succi, hal ini diduga karena berdasarkan sumber eksplan dan jenis zat pengatur tumbuh yang digunakan. Pada penelitian Santosa, eksplan yang dikulturkan berasal dari benih kina yang telah berkecambah dan menggunakan IBA, sedangkan pada percobaan ini, eksplan berasal dari hasil subkultur ke 3 dengan penambahan beberapa konsentrasi NAA. Pada konsentrasi ini diduga bersifat menghambat proses pembentukan tunas, karena sifat dari zat pengatur tumbuh apabila berada pada konsentrasi yang tinggi
akan bersifat sebagai penghambat, karena menurut Wenas (2003) hanya dengan menambahkan 0,1 NAA telah mampu mendukung pertumbuhan dan perkembangan dari planlet gambir.
Jumlah Daun
Analisis ragam terhadap jumlah daun pada beberapa konsentrasi NAA memperli-hatkan hasil yang berbeda tidak nyata. Hasil pengamatan dapat dilihat pada Tabel 4.
Pada Tabel 4 memperlihatkan bahwa pemberian beberapa konsentrasi NAA memperlihatkan respon yang berbeda tidak nyata terhadap jumlah daun. Konsentrasi NAA yang digunakan belum mampu meningkatkan jumlah daun. Hal ini diduga karena konsentrasi auksin yang digunakan berada dalam jumlah yang tinggi sehingga menghambat pertumbuhan dari eksplan.
Tabel 4. Jumlah daun per eksplan tanaman kina umur 5 MST pada beberapa konsentrasi NAA
Zat pengatur
tumbuh Jumlah daun (buah) 0,5 mg/ l 1,0 mg/ l 1.5 mg/ l 2,0 mg/ l 1,89 1,00 0,33 1,33 KK = 29,55 %
Angka-angka pada kolom Jumlah daun per eksplan adalah berbeda tidak nyata menurut uji F pada taraf nyata 5%.
Menurut Wattimena et al (1992), zat pengatur tumbuh umumnya digunakan secara kombinasi dan morfogenesis dari eksplan selalu bergantung dari interaksi antara auksin dan sitokinin. Menurut Gunawan (1987), tingginya respon jaringan untuk tumbuh disebabkan penambahan auksin dan sitokinin yang mampu merubah tingkat zat pengatur tumbuh dalam sel.
Persentase Eksplan yang Membentuk Planlet Dalam percobaan ini belum terdapat eksplan yang membentuk planlet. Penambahan beberapa konsentrasi NAA pada media yang telah dicampur dengan BAP belum mampu mendukung bagi terbentuknya planlet atau merangsang keluarnya akar pada tunas tanaman kina. Karena dari semua eksplan yang bertunas tidak satupun eksplan yang berakar.
Menurut Wetherel cit Marta (2008), peranan auksin disamping merangsang
pembelahan dan pembesaran sel, terutama pada pucuk tanaman juga merangsang pembentukan akar. Demikian pula dengan sitokinin disamping merangsang inisiasi tunas juga merangsang pembelahan sel dalam jaringan dan pada konsentrasi tertentu dapat menghambat pertumbuhan dan perkembangan akar. Sitokinin berinteraksi dengan auksin sehingga pemakaiannya secara bersama-sama harus mempertimbangkan konsentrasinya. Persentase Eksplan yang Membentuk Kalus
Pada percobaan yang diamati, awalnya pertumbuhan eksplan sampai pada minggu ke 4 setelah tanam sudah mulai bertunas dan berdaun, maka dilakukan pemeliharaan sampai daunnya hijau dan membuka, tapi setelah sampai minggu ke 5 setelah tanam pucuk dan daun yang ada menunjukkan gejala bewarna merah. Hal ini diduga telah terjadi pertumbuhan abnormal dari pucuk tersebut. Hasil studi pustaka menunjukkan BAP merupakan sitokinin yang paling efektif untuk membentuk tunas. Penggunaan BAP dengan konsentrasi tinggi dalam waktu yang lama sering menyebebkan regenerasi sulit berakar dan dapat menyebabkan penampakan pucuk abnormal (Gunawan, 1988).
Perbandingan jumlah sitokinin dan auksin dalam media menentukan tipe pertumbuhan dan perkembangan eksplan yang ditanam (Murashige, 1974). Pada kombinasi perlakuan NAA dan BAP, pemberian 0,5 mg/ L – 2,0 mg/ L NAA dengan 3,0 mg/ L BAP yang langsung dicampur dengan media MS pada percobaan ini belum bisa memacu pembentukan planlet, tetapi telah mampu membentuk kalus. Terbentuknya kalus terjadi pada bagian luka bekas irisan, kemudian berlanjut dengan pertumbuhan kalus sebagai akibat dari proliferasi sel-sel penyusun kalus, sehingga menutup sebagian permukaan bekas irisan. Sampai diakhir pengamatan pertumbuhan kalus yang lebih mendominasi pada pertumbuhan eksplan tersebut. setelah diamati, kalus ini mulai terinduksi pada minggu ke 7 setelah tanam. Dimana persentase dari pembentukan kalus ini mencapai 79,69% (perhitungan persentase dapat dilihat pada Lampiran 7) . persentase ini lebih tinggi jika dibandingkan dengan persentase pembentukan tunas pada minggu ke 4 setelah tanam yang hanya mampu bertunas sekitar 65,00%. Ini berarti bahwa interaksi auksin dengan konsentrasi 0,5 mg/L – 2,0 mg/L NAA dengan
sitokinin 3,0 mg/L telah memberikan perbandingan yang seimbang terhadap eksplan yang membentuk kalus. Hal ini sesuai dengan pendapat Dodds dan Robert (1982) cit George dan Sherrington (1984) yang menyatakan bahwa terjadinya kalus di tempat irisan bertujuan untuk menutup luka.
Menurut penelitian Utami et al (2007) tentang embriogenesis somatik Anggrek Bulan perlakuan NAA 2 mg/L merupakan konsentrasi yang paling cocok untuk induksi kalus embriogenik. Induksi kalus embriogenik pada perlakuan ini paling cepat dibanding dengan perlakuan yang lain. Diduga pemberian NAA 2 mg/L menyebabkan perubahan konsentrasi auksin endogen, sehingga tercapai keseimbangan relatif untuk induksi kalus embriogenik
Sumardi (1996) menyatakan bahwa, pertumbuhan kalus dipengaruhi oleh beberapa faktor utama yang berhubungan langsung dengan eksplan seperti tempat eksplan tumbuh dan kehadiran zat pengatur tumbuh terutama auksin dan sitokinin dalam medium kultur dengan keseimbangan tertentu.
KESIMPULAN
Dari hasil percobaan belum didapatkan konsentrasi NAA yang terbaik untuk pertumbuhan dan perkembangan planlet kina hasil subkultur pucuk kina succi tetapi dengan adanya penambahan konsentrasi NAA pada 0,5 mg/ L – 2,0 mg/ L justru mendorong terbentuknya kalus, dimulai pada minggu ke 5 mencapai 79,69%.
DAFTAR PUSTAKA
Arifin, S., Astika, W., Bambang, K., Wibowo, ZR., Sukasmono, Katawijaya, W., Santoso, J., Widayat, W., Sriyadi, B., Rachmiaty, Y., Sabur, A., Suhargyanto, Adimulyo, Topani, Samudi, B. 1995. Petunjuk kultur teknis tanaman kina. BPTK Bandung.
George, E.F. & Sherrington (1984). Plant propagation by tissue culture. England, Exegetics Ltd.
Gunawan. L. W. 1987. Teknik kultur jaringan. Laboratorium kultur jaringan PAU Bioteknologi IPB, Bogor 252 hlm
Gunawan, L. W. 1988. Teknik kultur jaringan tumbuhan. Pusat Antar Universitas. Bioteknologi IPB Bogor.
Harjadi, S. S. 1984. Pengantar agronomi. PT Gramedia. Jakarta. 197 hal
Marta, N. 2008. Pertumbuhan dan perkembangan planlet hasil subkultur pucuk kina Succi (Cinchona succirubra Pavon) pada beberapa konsentrasi NAA dan BAP secara In Vitro. Skripsi Faperta Unand.
Murashige. 1974. Plant Propagation Cells in Paul F. K jt and M. K Patterson. Jr (ed) tissue culture mer hools and Aplication. Academis Press. New York. Santoso, J. Mathius, N. T, Sastraprawira, U, Suryatmana, G dan Saodah, D. 2004. Perbanyakan tanaman kina Cinchona ledgerianan Moens dan C. succirubra melalui penggandaan tunas aksiler. http: www.google.co.id [ 5 januari 2009)
Sudarmadji. 2003. Penggunaan Benzil Amino Purine pada pertumbuhan kalus kapas secara In vitro. Buletin Teknik Pertanian. Vol 8. No 1. Malang.
Sumardi. 1996. Penggunaan arang aktif pada beberapa kombinasi NAA dan BAP dalam kultur durian (Durio zibethinus Muur) secara In vitro. Tesis S2 Program pascasarjana Universitas Andalas. Padang 76 hal
Suliansyah. I. 2002. Kultur jaringan tanaman. Faperta Unand. Padang.
Tahardi, J. S dan I. Riyadi. 2002 Perbanyakan In Vitro tanaman kina melalui penggandaan tunas. Laporan hasil penelitian. Balai Penelitian
Bioteknologi Perkebunan Indonesia. Bogor [20 Februari 2009].
____________. 2005.Pengaruh NAA dan IBA terhadap pertumbuhan dan perkembangan tunas kina (Cinchona succirubra Pavon). www.google.co.id [5 januari 2009].
Utami, E. S. W. I, Sumardi. Taryono. E, Semiarti. 2007. Pengaruh α-Napthaleneacetic Acid (NAA) terhadap embriogenesis somatik angrek Bulan Phalaenopsis Amabilis BI. Biodiversitas. Vol 8, No 4 hal 295-299.
Wattimena, G. A, Gunawan, L. W. Mattjik, Samsudin, Wiendi, N. A dan Ernieati. 1991. Bioteknologi tanaman. Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor. Bogor.
Wenas, M. 2003. Pengaruh beberapa konsentrasi NAA dan BAP terhadap pertumbuhan dan perkembangan tunas pucuk gambir (Uncaria gambir Roab) secara In Vitro. Skripsi Faperta Unand.
Widiastoety, D. 1987. Penggunaan teknik kultur In vitro untuk perbanyakan tanaman. Bahan latihan dan diskusi penelitian buah-buahan Malang. Pusat penelitian dan pengembangan hortikultura balai penelitian hortikultura Lembang. 1-28 hal.
Wulandari, S. 2004. Respon eksplan daun tanaman jeruk manis (Citrus sinensis L). Secara In vitro akibat pemberian NAA dan BAP. Universitas Riau. Pekanbaru [20 Februari 2009].