MUTASI BARU G9053A DNA MITOKONDRIA
PADA PASIEN DIABETES TIPE 2 MATERNAL DAN KATARAK
DAN PENGARUH MUTASI TERHADAP STRUKTUR SUBUNIT ATP6
Iman P. Maksum1*), Merry J. Silaen1), O. Suprijana1), G. Natadisastra2), S. Nuswantara3) 1)Jurusan Kimia FMIPA Universitas Padjadjaran
2)Fakultas Kedokteran Universitas Padjadjaran 3)
Sandia Biotech Diagnostic Centre Rumah Sakit Santosa
*e-mail: ip_maksum@unpad.ac.id
ABSTRAK
Diabetes melitus tipe 2 (DM tipe 2) dan katarak merupakan salah satu gambaran klinis yang dikaitkan dengan penyakit mitokondria atau kegagalan sintesis ATP. Penyakit mitokondria merupakan penyakit multisistem yang salah satu karakteristiknya adalah disebabkan oleh beberapa mutasi DNA mitokondria (mtDNA). Kami telah menemukan mutasi baru G9053A (gen ATP6) pada empat dari 20 pasien DM tipe 2 dan katarak yang membawa mutasi A3243G. Subunit ATP6 yang dikode oleh mtDNA berperan penting pada proses transfer elektron dan translokasi proton dalam sistem respirasi. Oleh karena itu, perlu dipelajari pengaruh mutasi tersebut terhadap struktur subunit ATP6 melalui pendekatan bioinformatika, seperti Accelrys
Discovery Studio. Hasil analisis ini menunjukkan mutasi G9053A dapat meningkatkan energi
potensial (menurunkan stabilitas struktur) subunit ATP6 dan fluktuasi jarak interaksi antara asam amino yang berperan dalam translokasi proton. Hal tersebut diduga dapat menyebabkan terhambatnya translokasi proton yang berkaitan dengan sintesis ATP.
Kata Kunci: Mutasi baru G9053A, subunit ATP6, Accelrys Discovery Studio.
ABSTRACT
Type-2 diabetes mellitus (type-2 DM) and cataract are some of the clinical features associated with mitochondrial diseases. Mitochondrial diseases is multisystemic disorders which one of the characteristic is caused by some mitochondrial DNA (mtDNA) mutations. Here we show that we have found G9053A as a novel mutation (ATP6 gene) in four of 20 patients which carried A3243G mutations. ATP6 subunit that encoded by ATP6 gene in mtDNA which roles important for electron transfer and proton translocation process in respiration system. Therefore, The effect of this mutation to the structure of ATP6 subunit need to be further elaborated using bioinformatics approaches, such as Accelrys Discovery Study. These results showed that G9053A can increase the potential energy with decreasing the structure stability of ATP6 subunit, and also this mutation increased the fluctuation of interaction distance between amino acids that roles in proton translocation. These results have suggested that this mutation can block proton translocation which associated with ATP synthesis.
PENDAHULUAN
Pada penelitian sebelumnya, kami telah menemukan mutasi A3243G pada 20 dari 57 pasien katarak dan DM tipe 2 dengan menggunakan metode PASA. Hasil penelitian tersebut telah mendukung beberapa penelitian sebelumnya, yang melaporkan bahwa DM tipe 2 dan katarak berkaitan dengan mutasi pada DNA mitokondria (mtDNA), yaitu mutasi A3243G dan C12258A masing-masing pada gen tRNALeudan tRNASer (Lynn et al., 1998; Suzuki et al., 2004; Nomiyama et al., 2002; Maksum dkk., 2007)
Penyakit mitokondria merupakan penyakit multisistem, yaitu satu mutasi tertentu dapat menyebabkan beberapa gambaran klinis atau satu gambaran klinis dapat disebabkan oleh beberapa mutasi. Contoh, mutasi A3243G ditemukan pada pasien yang mengalami penyakit mitokondria seperti MIDD (maternally inherited diabetes and deafness), MELAS (mitochondrial
encephalopathy, lactacidosis, and stroke-like episode), MERRF (myoclonic epilepsy and ragged-red fibers), DM tipe 2, katarak, ketulian dan ataksia, serta pada DM tipe 2, katarak, polidipsia
dan parestesia kaki (Finsterer, 2007; Lynn et al.,1998); Suzuki et al., 2004; Nomiyama et al., 2002). Selain disebabkan mutasi A3243G, MIDD dapat disebabkan oleh mutasi lainnya seperti mutasi C12258A (Lynn et al., 1998; Suzuki et al., 2004).
ATP sintase merupakan komponen kunci dalam konversi energi mitokondria pada mamalia yang memproduksi banyak ATP selular dalam sel aerobik. ATP sintase menggunakan gradien proton yang dihasilkan oleh rantai pernapasan sebagai motor penggerak untuk sintesis ATP dari ADP dan fosfat anorganik. Kompleks ATP sintase pada mamalia dibentuk oleh 16 subunit, terdiri atas dua bagian yaitu bagian F1 yang mengandung sisi katalitik untuk sintesis dan hidrolisis ATP dan bagian F0 yang mengandung saluran proton yang mentranslokasikan proton melintasi membran dalam mitokondria ( Houštěk et al., 2004). Dua subunit dari F0, yaitu subunit a (ATP6) dan A6L (ATP8), dikode oleh gen mitokondria sedangkan semua subunit yang lain merupakan bagian yang dikode gen DNA inti ( Houštěk et al., 2006).
Dari latar belakang di atas, maka pada penelitian ini perlu dipelajari varian gen ATP6 dan
ATP8 pada pasien DM tipe 2 dan katarak yang telah membawa mutasi A3243G untuk mencari
mutasi baru yang belum dilaporkan. Pada hasil penelitian ini, kami telah menemukan mutasi baru G9053A pada gen ATP6. Selanjutnya, untuk mempelajari apakah mutasi baru tersebut dapat mempengaruhi perubahan struktur subunit ATP6, maka pada penelitian ini akan digunakan metode bioinformatika seperti Accelrys Discovery Studio. Dalam metode tersebut akan dipelajari dinamika molekul dan analisis trajectory untuk melihat perubahan energi potensial struktur dan fluktuasi jarak interaksi antara asam amino pada jalur proton subunit ATP6.
BAHAN DAN METODE
PCR fragmen yang mengandung gen ATP6 dan ATP8
5 µL templat mtDNA dimasukkan ke dalam tabung 200 µL dan ditambahkan 15 µL air, 29 µL bufer Repli-G, dan 1 µL DNA polimerase. Campuran dihomogenkan dan diinkubasi pada
heating block PCR pada suhu 75oC selama 5 menit dan 25oC, kemudian suhu 33oC selama 9 jam
dan 65oC selama 3 menit, dan biarkan sampai suhu 4oC, selanjutnya dielusi dengan ddH2O atau bufer TE dan disimpan pada suhu -20oC. Hasil PCR Repli-G dijadikan templat DNA untuk mengamplifikasi fragmen mtDNA yang mengandung gen ATP6 dan ATP8 dengan menggunakan sepasang primer Efor: 5ꞌGGC GGA CTA ATC TTC AAC TC3ꞌ (7925-7944) dan Erev: 5ꞌGCT TCG AAG CCA AAG TGA3ꞌ (9916-9899). Setiap 5 µL templat DNA untuk 25 µL reaksi PCR. Fragmen hasil PCR akan menghasilkan ukuran 1992 pb.
Direct sequencing
Penentuan varian gen ATP6 dan ATP8 dilakukan pada tujuh subjek dari 20 pasien DM tipe 2 dan katarak yang telah membawa mutasi A3243G dengan menggunakan metode direct
sequencing. Pemilihan tujuh subjek tersebut berdasarkan data riwayat medis pasien yang
mempunyai karakteristik penyakit mitokondria, yaitu terserang katarak pada usia 20-45 tahun, indeks massa tubuh rata-rata 23,5 Kg/m2, dan pewarisan katarak atau DM atau kedua-duanya secara maternal. Direct sequencing (Macrogene) dilakukan untuk menemukan adanya mutasi atau varian yang belum dilaporkan. Untuk penentuan urutan nukleotida tersebut digunakan primer-primer PCR dan satu primer internal yaitu dmt2L: 5ꞌGCC CGT ATT TAC CCT ATA GC3ꞌ (8251-8270). Desain primer-primer tersebut dilakukan dengan menggunakan software
Perlprimer.
Hasil sequencing dimasukkan sebagai data Editseq dan selanjutnya dilakukan analisis mutasi dengan menggunakan software Megalign dan Seqman DNAstar. Urutan nukleotida pada tujuh subjek dihomologikan dengan urutan nukleotida Cambridge, Mitomap, dan 13 varian normal sehingga diharapkan diperoleh varian yang sudah atau belum dilaporkan. Varian dikatakan berkaitan dengan katarak atau DM tipe 2 maternal atau katarak dan DM tipe 2 apabila varian tersebut tidak ditemukan pada varian normal dan mutasi tersebut menyebabkan perubahan asam amino dengan karakteristik kepolaran, muatan atau ukuran yang berbeda. Selanjutnya, mutasi yang ditemukan tersebut akan dianalisis hubungannya terhadap struktur tersier protein dengan Sequence Alignment menggunakan Accelrys Discovery Studio, sehingga diharapkan dapat menentukan posisi asam amino yang mengalami mutasi dan pengaruhnya terhadap fungsi transfer elektron, translokasi proton, dan sintesis ATP suatu subunit kompleks protein respirasi.
Analisis mutasi dengan Accelrys Discovery Studio
Dalam metode tersebut akan dipelajari dinamika molekul dan analisis trajectory untuk melihat perubahan energi potensial struktur dan fluktuasi jarak interaksi antara asam amino pada jalur proton subunit ATP6. Tahapan-tahapan yang dilakukan adalah: 1) pemodelan struktur ATP6 dengan Server Zhang, 2) prediksi struktur ATP6 dalam membran dengan Add Membrane
& Orient Molecule, 3) prediksi struktur mutan ATP6 dalam membran dengan Build Mutan, 4)
analisis pengaruh mutasi terhadap energy potensial dengan Sandart Dynamics Cascade, Analisis pengaruh mutasi pada jarak interaksi menggunakan Trajectory.
HASIL DAN PEMBAHASAN
Hasil analisis sequencing pada tujuh subjek penderita DM tipe 2 dan katarak yang membawa mutasi A3243G menunjukkan ada enam mutasi baru yang terletak pada gen ATP6 dan
ATP8 (Tabel 1). Tiga di antaranya mengalami perubahan asam amino, yaitu mutasi yang
seluruhnya terletak pada gen ATP6, yaitu mutasi A8701G , A8860G, dan G9053A, sedangkan sisanya tidak menyebabkan perubahan asam amino.
Tabel 1 Klasifikasi mutasi yang ditemukan pada tujuh subjek berdasarkan perubahan asam amino.
Varian
Gambaran Klinis
Gen/Locus Perubahan Asam
Amino
DM tipe 2 Katarak DM+Katarak
Le Sgi Sa Ja Ai EL Ece
A8701G + + ATP6 T-A
A8718G + ATP6 K-K
G8838A + ATP6 M-M
A8860G + + + + + + + ATP6 T-A
G9053A + + + + ATP6 S-N
Untuk menentukan apakah tiga mutasi baru yang menyebabkan perubahan asam amino tersebut berkaitan dengan kelainan mitokondria, maka perlu dihomologikan dengan genom varian normal. Dua belas genom varian normal digunakan, yaitu sebelas genom diperoleh dari
GenBank, yang berasal dari Meksiko, Bolivia (La Paz), Peru (Ancash), Amerika Serikat
(Pennsylvania, Montana, North Dakota, dan Wisconsin), Kanada (Ojibwa), dan Indonesia (Sunda dan Jawa), serta satu genom diperoleh dari hasil sequencing yang dilakukan bersamaan dengan tujuh genom pasien katarak dan DM tipe 2. Hasil homologi terhadap 12 genom varian normal, menunjukkan bahwa hanya satu mutasi, yaitu G9053A yang tidak ditemukan pada varian normal, sehinggga hanya mutasi inilah yang akan dipelajari lebih lanjut.
Mutasi G9053A ditemukan pada empat subjek (Sgi, Ja, Ece, dan El) yang mewakili tiga kelompok pasien, yaitu DM tipe 2, katarak, serta DM tipe 2 dan katarak. Hasil penelitian ini menunjukkan bahwa varian yang ditemukan cenderung mengarah ke karakteristik multisistem seperti pada umumnya karakteristik penyakit mitokondria, yaitu satu mutasi tertentu dapat menyebabkan beberapa gambaran klinis atau satu gambaran klinis dapat disebabkan oleh beberapa mutasi. Fakta ini dapat terlihat dari hasil penemuan mutasi G9053A pada empat subjek dari ketiga kelompok pasien yang membawa mutasi A3243G.
Pengaruh Mutasi G9053A Terhadap Struktur Subunit ATP6
Mutasi G9053A menyebabkan perubahan asam amino serin 176 menjadi asparagin (S176N). Mutasi tersebut terjadi pada gen ATP6 yang mengode ATP6 sebagai salah satu subunit pada unit Fo ATP sintase sedangkan fungsi unit Fo adalah mentranslokasi proton dari intermembran ke matriks mitokondria. Translokasi proton menyebabkan pergerakan rotor dan dapat menggerakan unit F1 untuk menyintesis ATP dari ADP dan fosfat anorganik. Berdasarkan hasil analisis Accelrys Discovery Studio, mutasi S176N mempengaruhi fleksibilitas dan posisi R210 karena terjadi perubahan ukuran (Gambar 2). R210 merupakan residu asam amino penting di dalam transfer proton ke dua residu asam aspartat di rotor. Terganggunya translokasi proton diprediksikan mempengaruhi sintesis ATP di unit F1. Pengaruh mutasi ini dapat dipelajari lebih lanjut menggunakan teknik dinamika molekul dengan membandingkan fleksibilitas model homologi ATP6 normal dan mutan.
S176N
ATP6
S176N
Gambar 2. Analisis struktur ATP6 dengan Accelrys Discovery Studio. (Kiri) Translokasi
proton terjadi dari intermembran ke matriks melalui unit Fo menyebabkan pergerakan rotor dan menggerakan unit F1 menyintesis ATP. (Kanan) Posisi mutasi S176N pada ATP6. Arah panah biru menunjukkan translokasi proton. Pengaruh mutasi tersebut terhadap kestabilan struktur dapat dilihat secara energetikanya melalui metode dinamika molekul. Model struktur ATP6 normal didapat dari hasil pemodelan, kemudian dilihat energinya dengan menggunakan metode dinamika molekul yang terdapat pada program Accelrys D.S. 2.5. Gambar 3 merupakan kurva energi potensial yang diplotkan terhadap waktu dari berbagai konformasi struktur ATP6 normal dan mutan hasil dinamika molekul. Pada gambar tersebut, terlihat bahwa grafik energi potensial dari struktur ATP6 normal memiliki nilai yang paling rendah dibandingkan dengan energi potensial dari struktur ATP6 yang telah mengalami mutasi S116N. Hal tersebut menunjukkan bahwa stuktur ATP6 normal memiliki kestabilan struktur yang lebih baik. Penurunan kestabilan struktur ATP6 ditunjukkan dengan kenaikan energi potensial yang dihasilkan melalui metode dinamika molekul. Hal tersebut mengindikasikan secara energetika adanya pengaruh mutasi pada model struktur ATP6 (Accelrys, 2007).
Gambar 3. Kurva energi potensial terhadap konformasi tiap waktu. Energi potensial
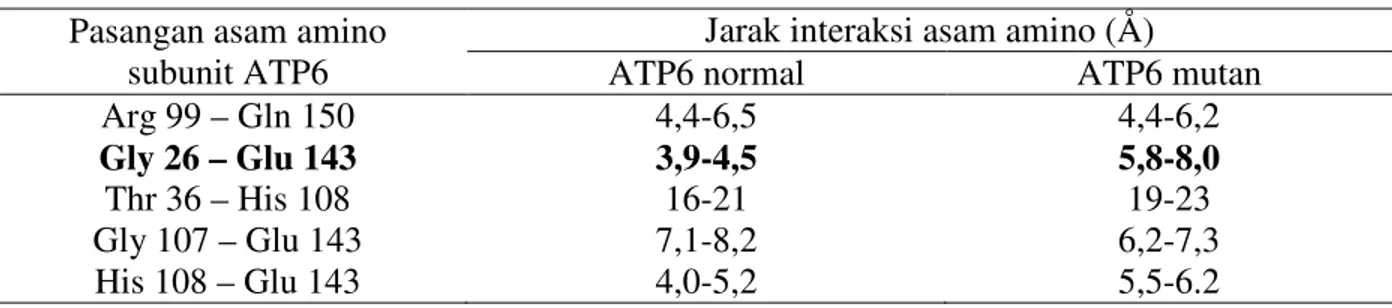
struktur mutan lebih besar dibandingkan dengan energi potensial struktur normal. Selanjutnya dilakukan analisis Trajectory untuk melihat perubahan atau fluktuasi jarak interaksi antara asam amino pada jalur proton subunit ATP6. Pada Tabel 2 dapat ditunjukkan bahwa terjadi fluktuasi jarak interaksi pada beberapa pasangan asam amino, yaitu antara Gly26 dengan Glu143 dan Ser39 dengan Thr36.
Tabel 2. Jarak interaksi antara asam amino pada jalur proton subunit ATP6. Pasangan asam amino
subunit ATP6
Jarak interaksi asam amino (Å)
ATP6 normal ATP6 mutan
Arg 99 – Gln 150 Gly 26 – Glu 143 Thr 36 – His 108 Gly 107 – Glu 143 His 108 – Glu 143 4,4-6,5 3,9-4,5 16-21 7,1-8,2 4,0-5,2 4,4-6,2 5,8-8,0 19-23 6,2-7,3 5,5-6.2
Arg 99 - Asn103 Asn 103 - Gln 150 Gli 107 – Asn 103 Ser 39 – Thr 36 Thr 36 – Thr 35 4,1-5,2 4,4-6,6 2,9-3,5 2,5-4,3 3,0-4,5 4,3-5,9 3,5-5,3 3,0-3,9 2,5-6,1 3,2-4,9
Keterangan: Huruf tebal menunjukkan pasangan asam amino yang mengalami fluktuasi jarak interaksi.
Dari hasil Accelrys Discovery Studio secara keseluruhan menunjukkan mutasi G9053A dapat meningkatkan energi potensial atau menurunkan stabilitas struktur subunit ATP6, dan meningkatkan fluktuasi jarak interaksi antara asam amino yang berperan dalam translokasi proton. Hal tersebut diduga dapat menyebabkan terhambatnya translokasi proton yang berkaitan dengan kegagalan sintesis ATP. Penurunan sintesis ATP tersebut dapat menyebabkan penurunan fungsi sekresi insulin pada sel β pankreas sehingga dijadikan sebagai salah satu penyebab diabetes (Maassen et al., 2004). Sedangkan pada lensa mata, kegagalan sintesis ATP dapat menyebabkan penurunan aktivitas renaturasi protein lensa yang dapat menimbulkan katarak (Vinson, 2006). Hasil penelitian ini dapat dijadikan bahan pertimbangan untuk studi lebih lanjut mengenai prevalensi dan patologi mutasi, serta diharapkan dapat memberikan informasi data varian sehingga dapat diperoleh pemahaman mengenai hubungan antara mutasi pada mtDNA dengan penyakit katarak dan DM tipe 2.
KESIMPULAN
1. DM tipe 2 dan katarak merupakan penyakit mitokondria yang multisistem dengan ditemukannya beberapa mutasi termasuk mutasi baru G9053A di gen ATP6 pada empat subjek (Sgi, Ja, Ece, dan El) dari ketiga kelompok pasien yang membawa mutasi A3243G. 2. Berdasarkan hasil analisis struktur menggunakan accelrys discovery studio, mutasi G9053A
mempengaruhi kestabilan ATP6 dengan meningkatnya energi potensial mutan dan fluktuasi jarak interaksi pada asam amino yang terlibat dalam translokasi proton.
SARAN
Hasil Penelitian ini perlu dikembangkan ke arah studi prevalensi mutasi baru pada pasien katarak dan DM tipe 2 serta perlu dilakukan studi patologi mutasi berkaitan dengan penurunan konsumsi oksigen, ATP dan potensial membran.
UCAPAN TERIMA KASIH
Penelitian ini didanai oleh Direktorat Pembinaan dan Pengabdian pada Masyarakat Departemen Pendidikan Nasional dalam Proyek I-MHERE. Untuk itu penulis mengucapkan terima kasih kepada Dirjen DIKTI, Pimpinan Universitas Padjadjaran, Ketua I-MHERE, Dekan FMIPA Unpad, Ketua Jurusan Kimia serta Kepala Laboratorium dan seluruh staf Laboratorium Kimia Bahan Alam Juruan Kimia FMIPA Unpad yang telah membantu terlaksananya penelitian ini.
DAFTAR PUSTAKA
Alan, T. W., Choo-Kang, Lynn, S., Geoffrey, A.T., Mark, E. D., Sarcpreet, S. S., Teressa, M.W., Patrick, F. C., Douglass, M. T. & Mark, W. 2002. Defining the Importance of Mitochondrial
Gene Defects in Maternally Inherited Diabetes by Sequencing the Entire Mitochondrial Genome. Brief Genetics Report. Diabetes. 51: 2317-2320.
Accelrys. 2007. Accelrys Discovery Studio 2.5. Accelrys Software, Inc.
Finsterer, J. 2007. Genetic, Pathogenetic, and Phenotypic Implication of The Mitochondrial A3243G tRNALeu(UUR) Mutation. Acta Neurol Scand. 116: 1-14.
Houštěk, J. P. K., Hermanska, J. H., Houstkova, C., Bogert, V., & Zeman, J. 2004. altered properties of mitochondrial ATP synthase in patients with a T-G mutation in the ATPase 6 (subunit a) gene at position 8993 of mtDNA. Biochimica et Biophysica Acta. 1658: 115–121. Houštěk, J. P. K., Pícková, A., Vojtíšková, T., Mráček, P. & Pecina, P. J. 2006. mitochondrial
diseases and genetic defects of ATP synthase. Biochimica et Biophysica Acta. 1757: 1400– 1405.
Lynn, S., Wardell, T., Johnson, M. A., Chinnery, P. F., Daly, M. E., Walker, M. & Turnbull, D. M. 1998. Mithochondrial Diabetes: Investigation and Identification of A Novel Mutation.
Brief Genetics Report. Diabetes. 47:1800-1804.
Maassen, J. A., t’Hart, L. M., van, Essen, E., Heine, R. J., Nijpels, G., Roshan, S., Tafrechi, J., Raap, A. K., Janssen, G. M. C. & Lemkes, H. P. J. 2004. Mitochondrial Diabetes: Molecular
Mechanisms and Clinical Presentation, Diabetes. 52: S103-S109.
Maksum, I. P., Oemardi, M., Sriwidodo, Sidik, A., Amalia, R. & Sasongko, H. 2007. Penggunaan Metode PASA Mismatch Tiga Basa Untuk Pencarian Fenotipe MIDD Pada Pasien Diabetes Melitus Tipe 2 di Indonesia. Seminar Nasional Ikatan Ilmu Faal Indonesia. MITOMAP. 2010. Mitochondrial DNA Base Substitution Disease. Melalui
<www.mitomap.org>, [Maret, 2010].
Nomiyama, T., Tanaka, Y., Hattori, N., Nishimaki, K., Nagasaka, K., Kawamori, R. & Ohta, S. 2002. Accumulation of Somatic Mutation in Mitochondrial DNA Extracted from Peripheral Blood Cells in Diabetic Patients. Diabetologia. 45:1577-1583.
PDB. 2009. A Resources for Studying Biological Macromolecules. Melalui <www.pdb.org>, [Oktober, 2009].
Perego, U. A., Achilli, A., Angerhofer, N., Accetturo, M., Pala, M., Olivieri, A., Kashuni, B. H., Ritchie, K. H., Scozzari, R., Kong, Q. P., Myres, N. M., Salas, A., Semino, O., Bandelt, H. J., Woodward, S. R. & Torroni, A. Homo sapiens mitochondrion, complete genome. GenBank,
NCBI, USA, Accession No. FJ168746, FJ168750, FJ16852, FJ168760, FJ168762, FJ168763,
FJ168764, FJ168765, & FJ168766.
Suzuki, Y., Nishimaki, K., Taniyama, M., Muramatsu, T., Atsumi, Y., Matsuoka, K. & Ohta, S. 2004. Acute Metabolic Cataract as A First Manifestation of Diabetes Mellitus in A 12-year-old Girl. Diabetologia. 47: 3.