BAB II
TINJAUAN PUSTAKA
2.1 Gambaran umum hidrogenHidrogen telah digunakan bertahun-tahun sebelum akhirnya dinyatakan sebagai unsur yang unik oleh Cavendish di tahun 1776. Dinamakan hidrogen oleh Lavoisier, hidrogen adalah unsur yang terbanyak dari semua unsur di alam semesta. Elemen-elemen yang berat pada awalnya dibentuk dari atom-atom hidrogen atau dari elemen-elemen yang mulanya terbuat dari atom-atom hidrogen. Hidrogen diperkirakan membentuk komposisi lebih dari 90% atom-atom di alam semesta (sama dengan tiga perempat massa alam semesta). Dalam keadaan yang normal, gas hidrogen merupakan campuran antara dua molekul, yang dinamakan ortho- dan para- hidrogen, yang dibedakan berdasarkan spin elektron-elektron dan nukleus.Hidrogen normal pada suhu ruangan terdiri dari 25% para hidrogen dan 75% ortho-hidrogen. Bentuk ortho tidak dapat dipersiapkan dalam bentuk murni. Karena kedua bentuk tersebut berbeda dalam energi, sifat-sifat kebendaannya pun juga berbeda. Titik-titik lebur dan didih parahidrogen sekitar 0.1 derajat Celcius lebih rendah dari hidrogen normal.
Hidrogen (hidrogenium, simbol H), dalam tabel periodik unsur memiliki Ar =
1,00797, nomor atom 1, konfigurasi elektron 1s1. Biasanya dalam oksidasi dinyatakan +1, tapi dalam garam tipe hidrida -1 adalah juga mungkin. Tiga isotop dengan Ar 1, 2 dan 3 telah diketahui; isotop dengan Ar 3 adalah tidak stabil.
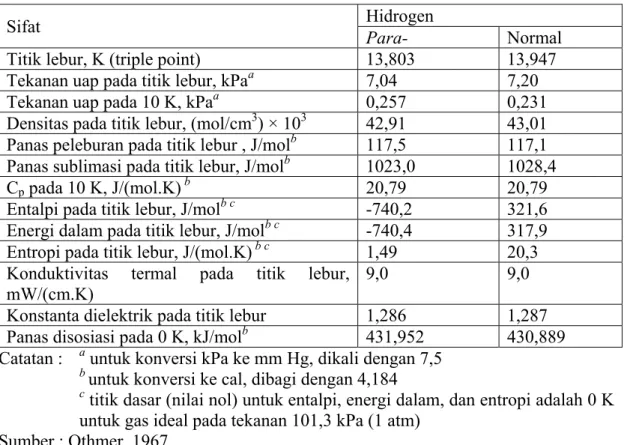
Perbedaan dalam massa isotop relatif adalah sedemikian besar sehingga sifat kinetika dan fisik juga sangat berbeda. Isotop dengan massa relatif 2 dinamakan Deuterium (simbol D), dan pada massa relatif 3 dinamakan Tritium (Simbol T). Pada atom nukleus, semua muatan positif tunggal dinamakan proton, deuteron, dan triton. Sifat termodinamika dan fisik dari hidrogen padatan dapat dilihat pada Tabel 2.1, sifat termodinamika dan fisik dari hidrogen cair dapat dilihat pada Tabel 2.2 serta sifat termodinamika dan fisik dari hidrogen gas dapat dilihat pada Tabel 2.3.
Tabel 2.1 Sifat termodinamika dan fisik dari hidrogen padatan
Sifat Hidrogen
Para- Normal
Titik lebur, K (triple point) 13,803 13,947
Tekanan uap pada titik lebur, kPaa 7,04 7,20
Tekanan uap pada 10 K, kPaa 0,257 0,231
Densitas pada titik lebur, (mol/cm3) × 103 42,91 43,01 Panas peleburan pada titik lebur , J/molb 117,5 117,1
Panas sublimasi pada titik lebur, J/molb 1023,0 1028,4
Cp pada 10 K, J/(mol.K) b 20,79 20,79
Entalpi pada titik lebur, J/molb c -740,2 321,6
Energi dalam pada titik lebur, J/molb c -740,4 317,9
Entropi pada titik lebur, J/(mol.K)b c 1,49 20,3
Konduktivitas termal pada titik lebur, mW/(cm.K)
9,0 9,0 Konstanta dielektrik pada titik lebur 1,286 1,287
Panas disosiasi pada 0 K, kJ/molb 431,952 430,889
Catatan : a untuk konversi kPa ke mm Hg, dikali dengan 7,5
b untuk konversi ke cal, dibagi dengan 4,184
c titik dasar (nilai nol) untuk entalpi, energi dalam, dan entropi adalah 0 K
untuk gas ideal pada tekanan 101,3 kPa (1 atm) Sumber : Othmer, 1967
Tabel 2.2 Sifat termodinamika dan fisik dari hidrogen cair
Sifat Hidrogen
Para- Normal
Titik lebur, K (triple point) 13,803 13,947
Titik didih normal, K 20,268 20,380
Suhu kritis, K 32,976 33,18
Tekanan kritis, kPaa 1298,8 1315
Densitas pada titik didih, mol/cm3 0,03511 0,03520
Densitas pada titik lebur, mol/cm3 0,038207 0,03830 Faktor kompresibilitas, Z = PV/RT
pada titik lebur titik didih 0,001606 0,01712 0,001621 0,01698 Titik kritis 0,3025 0,3191
Kompresibilitas adiabatik, (–∂V/V∂P)s, MPa-1 b
pada triple point titik didih
0,00813 0,0119
0,00813 0,0119 Koefisien ekspansi volume, (–∂V/V∂T)p, K-1
pada triple point titik didih
0,0102 0,0164
0,0102 0,0164 Panas penguapan, J/molc
titik didih 898,3 899,1 Cp, J/(mol.K)c
pada triple point titik didih 13,13 19,53 13,23 19,70 Cv, J/(mol.K)c
pada triple point titik didih 9,50 11,57 9,53 11,60 Entalpi, J/molc d
pada triple point
titik didih -622,7 -516,6 438,7 548,3 Energi dalam, J/mol c d
pada triple point
titik didih -622,9 -519,5 435,0 545,7
Entropi , J/(mol.K) c d pada triple point titik didih 10,0 16,08 28,7 34,92 Kecepatan suara, m/s
pada triple point titik didih 1273 1093 1282 1101 Viskositas, mPas (=cp)
pada triple point titik didih 0,026 0,0133 0,0256 0,0133 Konduktivitas termal, mW/(cm.K)
pada triple point titik didih 0,73 0,99 0,73 0,99 Konstanta dielektrik
pada triple point
titik didih 1,252 1,230 1,253 1,231
Tegangan muka, mN/m(=dyne/cm) pada triple point
titik didih 2,99 1,93 3,00 1,94
Kompresibilitas isotermal, 1/V(∂V/V∂P)T , Mpa
-1 b
pada triple point titik didih
–0,0110 –0,0199
–0,0110 –0,0199 Catatan : a untuk konversi kPa ke mm Hg, dikali dengan 7,5
b untuk konversi Mpa ke atm, dibagi dengan 0,101 c untuk konversi J ke cal, dibagi dengan 4,184
d titik dasar (nilai nol) untuk entalpi, energi dalam, dan entropi adalah 0 K
untuk gas ideal pada tekanan 101,3 kPa (1 atm) Sumber : Othmer, 1967
2.2 Penggunaan Hidrogen Sejumlah besar H2 diperlukan dalam industri petrokimia dan kimia.
Penggunaan terbesar H2 adalah untuk memproses bahan bakar fosil dan dalam
hidrodealkilasi, hidrodesulfurisasi, dan penghidropecahan (hydrocracking). H2
memiliki beberapa kegunaan yang penting. H2 digunakan sebagai bahan hidrogenasi,
terutama dalam peningkatan kejenuhan dalam lemak tak jenuh dan minyak nabati (ditemukan di margarin), dan dalam produksi metanol. Ia juga merupakan sumber hidrogen pada pembuatan asam klorida. H2 juga digunakan sebagai reduktor pada
bijih logam. Selain digunakan sebagai pereaksi, H2 memiliki penerapan yang luas
dalam bidang fisika dan teknik. Ia digunakan sebagai gas penameng di metode pengelasan seperti pengelasan hidrogen atomik. H2 digunakan sebagai pendingin
rotor di generator pembangkit listrik karena ia mempunyai konduktivitas termal yang paling tinggi di antara semua jenis gas. H2 cair digunakan di riset kriogenik yang
meliputi kajian superkonduktivitas. Oleh karena H2 lebih ringan dari udara, hidrogen
pernah digunakan secara luas sebagai gas pengangkat pada kapal udara balon.
Baru-baru ini hidrogen digunakan sebagai bahan campuran dengan nitrogen (kadangkala disebut forming gas) sebagai gas perunut untuk pendeteksian kebocoran gas yang kecil. Aplikasi ini dapat ditemukan di bidang otomotif, kimia, pembangkit listrik, kedirgantaraan, dan industri telekomunikasi. Hidrogen adalah zat aditif yang diperbolehkan penggunaanya dalam ujicoba kebocoran bungkusan makanan dan sebagai antioksidan.
Isotop hidrogen yang lebih langka juga memiliki aplikasi tersendiri. Deuterium (hidrogen-2) digunakan dalam reactor candu sebagai moderator untuk memperlambat neutron. Senyawa deuterium juga memiliki aplikasi dalam bidang kimia dan biologi dalam kajian reaksi efek isotop. Tritium (hidrogen-3) yang diproduksi oleh reaktor nuklir digunakan dalam produksi bom hidrogen, sebagai penanda (www. Wikipedia.com).
2.3 Gas alam (natural gas)
Gas alam sering juga disebut sebagai gas bumi atau gas rawa, adalah bahan bakar fosil berbentuk gas yang terutama terdiri dari metana CH4). Ia dapat ditemukan
di ladang minyak, ladang gas bumi dan juga tambang batu bara. Ketika gas yang kaya dengan metana diproduksi melalui pembusukan oleh bakteri anaerobik dari bahan-bahan organik selain dari fosil, maka ia disebut biogas. Sumber biogas dapat
ditemukan di rawa-rawa, tempat pembuangan akhir sampah, serta penampungan kotoran manusia dan hewan.
Komponen utama dalam gas alam adalah metana (CH4), yang merupakan
molekul hidrokarbon rantai terpendek dan teringan. Gas alam juga mengandung molekul-molekul hidrokarbon yang lebih berat seperti etana (C2H6), propana (C3H8)
dan butana (C4H10), selain juga gas-gas yang mengandung sulfur (belerang). Gas
alam juga merupakan sumber utama untuk sumber gas helium.
Metana adalah gas rumah kaca yang dapat menciptakan pemanasan global ketika terlepas ke atmosfer, dan umumnya dianggap sebagai polutan ketimbang sumber energi yang berguna. Meskipun begitu, metana di atmosfer bereaksi dengan ozon, memproduksi karbon dioksida dan air, sehingga efek rumah kaca dari metana yang terlepas ke udara relatif hanya berlangsung sesaat. Sumber metana yang berasal dari makhluk hidup kebanyakan berasal dari rayap, ternak (mamalia) dan pertanian (diperkirakan kadar emisinya sekitar 15, 75 dan 100 juta ton.
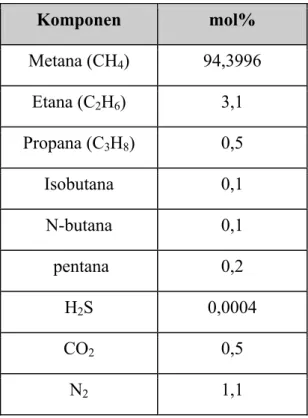
Tabel 2.3 komposisi natural gas
Komponen mol% Metana (CH4) 94,3996 Etana (C2H6) 3,1 Propana (C3H8) 0,5 Isobutana 0,1 N-butana 0,1 pentana 0,2 H2S 0,0004 CO2 0,5 N2 1,1
Sumber : (Spath and Mann,2000)
Nitrogen, helium, karbon dioksida (CO2), hidrogen sulfida (H2S), dan air
dapat juga terkandung di dalam gas alam. Merkuri dapat juga terkandung dalam jumlah kecil. Komposisi gas alam bervariasi sesuai dengan sumber ladang gasnya.
Campuran organosulfur dan hidrogen sulfida adalah kontaminan (pengotor) utama dari gas yang harus dipisahkan . Gas dengan jumlah pengotor sulfur yang signifikan dinamakan sour gas dan sering disebut juga sebagai "acid gas (gas asam)". Gas alam yang telah diproses dan akan dijual bersifat tidak berasa dan tidak berbau. Akan tetapi, sebelum gas tersebut didistribusikan ke pengguna akhir, biasanya gas tersebut diberi bau dengan menambahkan thiol, agar dapat terdeteksi bila terjadi kebocoran gas. Gas alam yang telah diproses itu sendiri sebenarnya tidak berbahaya, akan tetapi gas alam tanpa proses dapat menyebabkan tercekiknya pernafasan karena ia dapat mengurangi kandungan oksigen di udara pada level yang dapat membahayakan.
Gas alam dapat berbahaya karena sifatnya yang sangat mudah terbakar dan menimbulkan ledakan. Gas alam lebih ringan dari udara, sehingga cenderung mudah tersebar di atmosfer. Akan tetapi bila ia berada dalam ruang tertutup, seperti dalam rumah, konsentrasi gas dapat mencapai titik campuran yang mudah meledak, yang jika tersulut api, dapat menyebabkan ledakan yang dapat menghancurkan bangunan. Kandungan metana yang berbahaya di udara adalah antara 5% hingga 15%.
Ledakan untuk gas alam terkompresi di kendaraan, umumnya tidak mengkhawatirkan karena sifatnya yang lebih ringan, dan konsentrasi yang diluar rentang 5 - 15% yang dapat menimbulkan ledakan (http://www. Wikipedia.com).
2.4 Pemanfaantan Gas alam (natural gas)
Secara garis besar pemanfaatan gas alam dibagi atas 3 kelompok yaitu : Gas alam sebagai bahan bakar, antara lain sebagai bahan bakar Pembangkit
Listrik Tenaga Gas/Uap, bahan bakar industri ringan, menengah dan berat, bahan bakar kendaraan bermotor (BBG/NGV), sebagai gas kota untuk kebutuhan rumah tangga hotel, restoran dan sebagainya.
Gas alam sebagai bahan baku, antara lain bahan baku pabrik pupuk, petrokimia, metanol, bahan baku plastik (LDPE = low density polyethylene, LLDPE = linear low density polyethylene, HDPE = high density polyethylen,
PE= poly ethylene, PVC=poly vinyl chloride, C3 dan C4-nya untuk LPG, CO2-nya untuk soft drink, dry ice pengawet makanan, hujan buatan, industri besi tuang, pengelasan dan bahan pemadam api ringan.
Gas alam sebagai komoditas energi untuk ekspor, yakni Liquefied Natural Gas (LNG).
Teknologi mutakhir juga telah dapat memanfaatkan gas alam untuk air conditioner (AC=penyejuk udara), seperti yang digunakan di bandara Bangkok, Thailand dan beberapa bangunan gedung perguruan tinggi di Australia.
Pemanfaatan gas alam di Indonesia dimulai pada tahun 1960-an dimana produksi gas alam dari ladang gas alam PT Stanvac Indonesia di Pendopo, Sumatera Selatan dikirim melalui pipa gas ke pabrik pupuk Pusri IA, PT Pupuk Sriwidjaja di Palembang. Perkembangan pemanfaatan gas alam di Indonesia meningkat pesat sejak tahun 1974, dimana PERTAMINA mulai memasok gas alam melalui pipa gas dari ladang gas alam di Prabumulih, Sumatera Selatan ke pabrik pupuk Pusri II, Pusri III dan Pusri IV di Palembang. Karena sudah terlalu tua dan tidak efisien, pada tahun 1993 Pusri IA ditutup,dan digantikan oleh Pusri IB yang dibangun oleh putera-puteri bangsa Indonesia sendiri. Pada masa itu Pusri IB merupakan pabrik pupuk paling modern di kawasan Asia, karena menggunakan teknologi tinggi. Di Jawa Barat, pada waktu yang bersamaan, 1974, PERTAMINA juga memasok gas alam melalui pipa gas dari ladang gas alam di lepas pantai (off shore) laut Jawa dan kawasan Cirebon untuk pabrik pupuk dan industri menengah dan berat di kawasan Jawa Barat dan Cilegon Banten. Pipa gas alam yang membentang dari kawasan Cirebon menuju Cilegon, Banten memasok gas alam antara lain ke pabrik semen, pabrik pupuk, pabrik keramik, pabrik baja dan pembangkit listrik tenaga gas dan uap.
Selain untuk kebutuhan dalam negeri, gas alam di Indonesia juga di ekspor dalam bentuk LNG (Liquefied Natural Gas)
Salah satu daerah penghasil gas alam terbesar di Indonesia adalah Nanggröe Aceh Darussalam. Sumber gas alam yang terdapat di di daerah Kota Lhokseumawe dikelola oleh PT Arun NGL Company. Gas alam telah diproduksikan sejak tahun 1979 dan diekspor ke Jepang dan Korea Selatan. Selain itu di Krueng Geukuh, Nanggröe Aceh Barôh (kabupaten Aceh Utara) juga terdapat PT Pupuk Iskandar
Muda pabrik pupuk urea, dengan bahan baku dari gas alam (http://www. Wikipedia.com diakses tanggal1 Mei 2009).
2.5 Cadangan gas alam dunia
Berdasarkan data dari Natural Gas Fundamentals, Institut Francais Du Petrole pada tahun 2002, cadangan terbukti (proved reserves) gas alam dunia ada sekitar 157.703 109 m3 atau 142 Gtoe (1000 m3 = 0,9 toe). Jumlah cadangan ini jika dengan tingkat konsumsi sekarang akan dapat bertahan sampai lebih dari 60 tahun. Apabila kita bandingkan dengan cadangan minyak dunia, maka berdasarkan tingkat konsumsi sekarang, minyak bumi hanya akan dapat bertahan sampai 40 tahun ke depan saja. Namun demikian, penemuan baru cadangan gas alam umumnya lebih cepat daripada tingkat konsumsinya. Pada tahun 1970, cadangan terbukti gas alam dunia hanya sekitar 35 Gtoe. Dengan asumsi konsumsi sebesar 47 Gtoe, berarti selama 30 tahun terakhir tambahan cadangan gas alam adalah sebesar 154 Gtoe.
Dengan menggunakan metode estimasi yang konvensional, total sumber gas alam dunia dapat mencapai 450 gtoe, sedangkan apabila estimasi berdasarkan unconventional yang tingkat ketidakpastiannya lebih tinggi maka sumber gas alam dapat mencapai 650 gtoe. Cadangan gas alam tersebar di seluruh benua, dengan cadangan terbukti (proved reserves) terbesar berada pada negara-negara pecahan Uni Soviet dan Timur Tengah (http://www. Wikipedia.com diakses tanggal1 Mei 2009)..
2.7. Proses Pembuatan hidrogen
Kriteria seleksi proses dalam pembuatan gas hidrogen difokuskan dalam beberapa faktor : kandungan hidrogen dalam umpan; hidrogen yang dihasilkan dari proses; yang meliputi biaya dari umpan; biaya modal dan operasi; energi yang dibutuhkan; pertimbangan lingkungan; penggunaan yang diharapkan dari hidrogen.
Secara mendasar, spesifikasi proses komersial untuk pabrik hidrogen diperoleh dari steam reforming, oksidasi parsial, gasifikasi batubara, dan elektrolisa air. Di seluruh dunia, hidrogen sebagai bahan baku untuk industri kimia diperoleh sebagai berikut: 77% dari gas alam/petroleum, 18% dari batubara, 4% dari elektrolisa air, dan 1% dari proses lain.
Semua proses ini menghasilkan hidrogen dari hidrokarbon dan air. Mekanisme reaksinya adalah sebagai berikut :
(Othmer, 1967)
Sekarang ini hidrogen digunakan hampir secara eksklusif sebagai suatu bahan kimia industri, dimana kapasitas itu diterapkan untuk suatu penggunaan yang luas, mencakup produksi amoniak (untuk pabrik fertilizer), refineri yang digunakan untuk proses desulfurisasi dan lain-lain, serta untuk produksi methanol. Produksi tahunan dunia adalah sekitar 500 milyar Nm3. Produsen yang paling besar adalah produk udara, yang beroperasi lebih dari 50 pabrik individu, yang menghasilkan lebih dari 25 juta Nm3 per hari, dan 7 sistem perpipaan secara total lebih dari 340 juta. Produksi curah hidrogen (hampir 50%) dihasilkan oleh proses Steam Methane Reforming, yang mana proses tersebut adalah dalam skala besar merupakan rute ekonomis. (Dutton, G., 2002)
2.7.1 Steam Methane Reforming (SMR) atau cracking
Proses Steam Methane Reforming (SMR) terdiri atas 4 langkah proses:
a. Pemanasan stok umpan dan pemurnian (dibutuhkan karena katalis memiliki sensitivitas yang tinggi oleh ketidakmurnian, contohnya: sulfur, mercury, dan logam lainnya)
b. Steam reformer c. CO shift
d. PSA purification (menyerap campuran lainnya selain dari H2 untuk
menghasilkan H2 mencapai 80 – 90%.
CH4 + 2H2O ↔ CO2 + 4H2 (ΔH0 = +164kJ /mol; secara umum beroperasi pada
suhu 850 oC) CH4 + H2O ↔ CO2 + 3H2 (ΔH0 = +205kJ /mol )
- Beroperasi pada tekanan < 40 bar - Reaksi sangat endotermis
- Konversi penguapan oleh steam dan suhu yang tinggi; konversi akan berkurang dengan tekanan yang tinggi.
- Membutuhkan katalis nikel yang aktif
- Kemungkinan untuk tingkatan reaksi oleh adsorpsi CO2, memungkinkan suhu
reaksi untuk menjadi berkurang sampai 550 oC. Reaksi CO shift :
CO + H2O ↔ CO2 + H2
- Menggunakan katalis CO shift : besi oksida (secara konvensional suhu tinggi 340 – 460 oC), (suhu sedang) besi + tembaga oksida (suhu tinggi dimodifikasi 310 – 370 oC), tembaga, seng, aluminium (suhu rendah 180 – 280 oC)
- Ukuran pabrik kecil dan sedang yang memiliki reactor shift suhu sedang yang tunggal
- Pabrik skala besar memiliki 2 reaktor suhu sedang atau suhu tinggi ditambah reaktor suhu sedang
Ukuran pabrik yang umum :
Kecil 500 - 3000 Nm3/jam Sedang mencapai 25,000 Nm3/jam Besar lebih dari 25,000 Nm3/jam Sangat besar over 150,000 Nm3/jam (Dutton, G., 2002)
2.7.2 Oksidasi parsial
Hidrogen juga dapat dibentuk oleh non-katalisis oksidasi parsial hidrokarbon. Banyak umpan hidrokarbon yang dapat dimampatkan atau dipompa mungkin digunakan. Efisiensi proses secara keseluruhan adalah hanya 50% (dibandingkan SMR pada 65 – 75%). Oksigen murni diperlukan sebagai umpan.
Gas alam : CH4 + ½ O2 → CO + 2H2 (1350 oC)
Batu bara : C + ½ O2 → CO (1350 oC)
- Proses gas sintesis
- Menggunakan banyak bahan bakar fosil dan dapat beroperasi pada tekanan tinggi (>100 bar)
Daftar sumber hidrogen terdiri atas tiga model teknologi :
a. Catalytic Steam Reforming (CSR) melibatkan reaksi bahan bakar hidrokarbon dan steam dalam kehadiran katalis dimana dibutuhkan sumber panas eksternal. Proses ini memiliki efisiensi yang tinggi.
b. Auto Thermal Reforming (ATR) melibatkan reaksi bahan bakar hidrokarbon dan steam dalam kehadiran katalis dan oksigen dimana beberapa bahan bakar yang digunakan untuk menghasilkan hidrogen dibutuhkan panas untuk reaksi. Proses ini dapat digunakan pada banyak perbedaan tipe dari bahan bakar.
c. Catalytic Partial Oxidation Reforming (CPOX) adalah serupa seperti auto thermal reforming (ATR) tetapi menggunakan sistem operasi yang lebih simpel dan sederhana.
(Dutton, G., 2002)
2.7.3 Integrated gasification combined cycle (IGCC)
Dalam sistem IGCC, gasifier batubara konversi batubara di pulverisasi kedalam gas sintesis (campuran H2 dan CO) dengan penambahan steam dan oksigen.
Gas sintesis ini selanjutnya dibersihkan dari kotorannya dan digunakan untuk menghasilkan energi dalam turbin gas. (secara alternatif gas yang diproduksi dapat digunakan untuk menghasilkan hidrogen, bahan kimia, atau bahan bakar lainnya).
Panas yang terbuang dari turbin gas digunakan dalam turbin steam untuk menghasilkan banyak elektrisitas. Telnologi gasifier terintegrasi dengan siklus yang dikombinasikan dalam jalan ini menawarkan efisiensi sistem yang tinggi dan tingkatan polusi yang sangat rendah. Sistem dirancang untuk menangani berbagai umpan, mencakup batubara dengan kandungan sulfur yang tinggi dan rendah, antrasit, dan biomassa. Secara umum sistem memiliki rentang dalam ukuran dari 200
– 800 MWe. Secara umum pabrik menawarkan suatu peningkatan 10% dalam efisiensi suhu melebihi stasiun pembakaran batubara konvensional.
Efisiensi operasi dalah diantara 29 – 41%, tergantung pada karakteristik bahan bakar (yaitu kandungan sulfur, kandungan abu, dan nilai kalori), tipe dari sistem IGCC (yaitu entrained, moving-bed atau fluidized bed) dan puncak suhu turbin gas. Dalam kaitan efisiensi rendah dan biaya, IGCC hanya merupakan teknologi demonstrasi, akan tetapi hal itu diharapkan bahwa teknologi generasi kedua akan merealisasikan efisiensi dari 45 – 50% dan mengurangi biaya.
(Dutton, G., 2002)
2.7.4 Pirolisis
Hidrokarbon dapat dikonversi menjadi hidrogen tanpa menghasilkan CO2,
jika hidrokarbon tersebut didekomposisi pada suhu yang tinggi dalam ketidakhadiran oksigen (pirolisis). Sebagai contoh methana dapat di cracked dalam katalis seperti karbon (golongan karbon, seperti jelaga C60, grafit atau karbon aktif). Dalam
prinsipnya, pirolisis dapat juga diaplikasikan lebih jauh kedalam hidrokarbon kompleks, biomassa, limbah padat kota. (Dutton, G., 2002)
2.7.5 Elektrolisis air
Hidrogen dapat dihasilkan dari air yang dielekrolisis. Jika elektrolitas dihasilkan dari teknologi renewable (seperti solar, hidro, angin, pasang surut), maka proses tersebut disebut bebas karbon. Pemecahan elektrokimia dari air telah diketahui melalui reaksi :
H2O → H2 + ½ O2
Pabrik elektrolisis komersial secara umum mencapai efisiensi 70 – 75%. Ada 2 tipe dasar dari elektrolizer:
a. Alkalin cair
b. Membran pertukaran proton
Secara umum tekanan beroperasi pada 50 bar (750 psig) yang mana tidak cukup pembebanan silinder tekanan tinggi. Konsumsi listrik dari proses elektrolisis dapat direduksi dengan operasi pada suhu tinggi (900 – 1000 oC). Untuk penyimpanan hidrogen, dapat dilakukan menggunakan kompresor atau disebut elektrolizer tekanan tinggi. (Dutton, G., 2002)
2.7.6 Produksi hidrogen secara biologi
Hidrogen dapat dihasilkan secara biologi dalam 2 proses : a. Proses fotosintesis
b. Proses fermentasi
Ganggang hijau dapat menangkap energi dari sinar matahari. Dibawah kondisi anaerobik, ganggang hijau menghasilkan enzim hidrogenase yang mana dapat menghasilkan hidrogen dari air dengan proses yang diketahui sebagai bio-fotolisis. Kondisi ini harus diatur secara hati-hati sewaktu enzim hidrogenase bekerja dalam fase gelap dan sangat sensitif pada kehadiran oksigen yang dihasilkan dari fotosintesis. Ada dua tahapan proses yang digunakan untuk memaksimalkan produk hidrogen. Tantangan riset yang utama adalah:
a. Peningkatan produksi hidrogen oleh suatu faktor 10, atau lebih.
b. Peningkatan efisiensi konversi energi solar dari 5% menjadi 10% atau lebih. c. Memproduksi sel membran tidak hidup oleh oksigen dan hidrogen untuk
menghasilkan enzim
Proses biologi yang kedua untuk menghasilkan hidrogen adalah dengan menggunakan fermentasi tanpa membutuhkan cahaya. Ini dilakukan dalam keadaan gelap, dimana proses anaerobik dilaksanakan oleh banyak spesies bakteri, satu diantaranya adalah Clostridia. Reaksi melibatkan enzim hidrogenase yang bertindak untuk menghasilkan hidrogen (dan karbon dioksida):
C6H12O6 + 2H2O → 2CH3COOH + 2CO2 + 4H2
Secara teoritis, hidrogen yang dihasilkan adalah 0,5 m3 H2/kg karbohidrat.
Bakteri fermentasi dikalikan secara cepat dan dapat menghasilkan kuantitas yang banyak dari hidrogen, tetapi parameter rancangan dan operasional ini adalah belum mapan. (Dutton, G., 2002)
2.7Pemilihan Proses
Dari beberapa jenis proses pembuatan hidrogen yang ada, dapat dipilih proses yang akan dipakai berdasarkan bahan baku, jenis produksi maupun kemurnian produk.
Berdasarkan pertimbangan-pertimbangan di atas dipilihlah proses cracking atau yang biasa di sebut steam reforming.
Alasan dipilihnya proses itu adalah:
a. Merupakan proses yang paling efisien untuk mengubah gas alam menjadi hidrogen sampai saat ini.
b. Panas yang digunakan dapat diperoleh dari panas yang sebelumnya. c. Teknologinya sudah dapat dibuktikan.
d. Biaya Produksi paling murah (www.wikipedia.org.com)
2.8. Deskripsi Proses
2.8.1 Unit untuk menghilangkan kandungan sulfur (desulphurization)
Gas alam (natural gas) dinaikan tekanannya sampai 30,2 bar dengan menggunakan kompresor (G-101) kemudian dilewatkan melalui heater (E-101) dengan memakai gas yang keluar dari high temperatur shift (R- 202) sebagai media pemanas hingga suhu mencapai 3750C. Gas alam yang telah dipanaskan sampai mencapai 3750C ini akan melewati reaktor desulphurization (R-101), reaktor desulphurization (R-101) ini terdiri dari 2 buah vessel yaitu (R-101A) dan (R- 101B) yang terpasang secara pararel. Reaktor desulpurization (R-101) berisi
katais ZnO. Kandungan sulfur yang tertinggal didalam gas alam harus lebih kecil dari 0,5 ppm. Kandungan sulfur harus dihilangkan karena akan menutupi permukaan katalis.
ZnO + H2S ZnS + H2O
Tekanan gas keluar dari reaktor desulfurisasi ( R-101A) dan (R-101B) adalah 30 bar dan temperaturnya 3610C.
2.8.2 Unit Steam Reforming dengan memakai katalis
Gas alam yang telah melewati unit desulpurization (R-101A) dan (R-101B), dicampur dengan sejumlah steam yang tekanannya 30 bar dan suhunya 3880C yang berasal dari boiler, dengan rasio steam/carbon adalah 3 mol H2O/mol C (Leiby,
1994). Setelah steam dan gas dicampur temperaturnya berubah menjadi 3710C.
Sebelum masuk ke unit steam reformer (R-202), campuran gas ini terlebih dahulu dipanaskan melalui feed steam preheater (E-102) sampai suhu 5200C dan tekananya menjadi 29 bar. Setelah melewati feed steam preheater (E-102) gas ini akan
memasuki suatu pipa yang terdapat didalam reformer furnace (R-210) dan di panaskan lewat pembakaran (burner). Didalam pipa tersebut akan terjadi reaksi antara gas alam dan steam dan akan diubah menjadi gas-gas : CO, H2. Sebagai bahan
bakar direformer furnace digunakan PSA offgas yang dicampur dengan sedikit gas alam, PSA offgas yang tekananya 1 bar dan suhunya 420C dan sejumlah kecil gas alam yang tekananya 1 bar dan suhunya 250C, setelah dicampur maka tekanan dan temperaturnya berubah menjadi 1 bar dan 420C yang dialirkan menggunakan blower (G-104). Jumlah gas alam yang ditambahkan adalah 10% dari nilai pemanasan (heating value) PSA offgas .Hasil pembakaran dari PSA off gas dan gas alam akan dihasilkan flue gas yang tekanan dan suhunya sekitar 1 bar dan 9000C akan di buang melalui cerobong . Saat gas keluar dari sistem reformer furnace (R-201) suhunya mencapai 8500C dan tekananya 27,5 bar dan harus didinginkan hingga suhunya mencapai sekitar 3500C dan tekananya 27,2 bar dengan menggunakan waste heat boiler (E-103).
2.8.3 Unit Pengubah CO dengan suhu tinggi (High Temperatur CO Shift Convension)
Gas yang keluar dari (E-103) akan memasuki unit pengubah CO dimana reaksi terjadi dalam dua tahap yaitu high temperatur shift (R-202) yang berisi katalis besi oksida dimana reaksi terjadi reaksi antara CO dan air pada temperatur 3500C dan tekananya 27,2 bar karena reaksi proses adalah eksotermik, temperatur gas yang keluar dari high temperatur shift (R-202) sekitar 4300 C dan tekananya 26, 8 bar, gas ini akan didinginkan dengan cara memanfaatkan panasnya untuk memanaskan gas alam sampai suhunya 2000C dan tekananya 26,5 bar
CO + H2O CO2 + H2
T = 3500C
CO + H2O CO2 + H2
T = 2000C
Tahap kedua adalah low temperatur shift (R-203) yang berisi katalis krom oksida merupakan komponen yang utama dalam katalis low temperatur shift yaitu tembaga oksida, dimana paling sering dicampur dengan zink oksida. (Spath, Dayton, 2003).Disini juga akan terjadi reaksi antara CO dan air dimana temperatur masuk
2000C dan tekananya 26,5 bar. Temperatur gas yang keluar dari low temperatur shift (R-203) sekitar 2330C dan tekananya 26, 1 bar. Setelah gas keluar dari low temperatur shif (R-203), gas akan didinginkan di cooler (E-104) menggunakan air pendingin sampai suhunya 1660C. Dan selanjutkan akan dipisahakan di knot out drum (KOD-301), gas akan keluar dari bagian atas dengan tekanan 26,1 bar dan suhunya 1660C dan kodensat akan keluar dari bagian bawah. Kemudian gas didinginkan lagi menggunakan cooler (E-105) sampai suhunya 430C dipisahkan lagi di knock out drum (KOD-302), gas akan keluar dari bagian atas dan akan masuk ke PSA (Pressure swing adsorpsi) (D-410) dengan tekanan 24,4 bar, kondensat akan keluar dari bagian bawah dimana tekanan dan suhunya 24,4 bar dan 430C.
2.8.4 Unit penyerap kotoran preassure swing adsortion (PSA)
Alat pressure swing adsorpsion (PSA) (D-410) ini berfungsi sebagai alat pemisah gas-gas yang bercampur dengan hidrogen, sehingga kandungan impuritis sangat sedikit terdapat pada gas hidrogen yang dihasilkan.
PSA (Pressure swing adsorpsi) (D-410) akan memisahkan hidrogen dengan PSA off gas, gas akan masuk dari bagian bawah dimana suhunya 430C dan tekananya 24,4 bar, kemudian akan dihasilkan hidrogen yang bertekanan 24,4 bar dan suhunya 42,70C dan akan dinaikan tekanan menjadi 70 bar dengan menggunakan kompresor sehingga hidrogen yang dihasilkan kemurniannya 99,9% dengan tekanan 70 bar dan suhunya 42,70C.
PSA off gas ini akan digunakan untuk bahan bakar reformer tetapi terlebih dahulu ditampung di dalam drum (T-601). Saat berlangsungnya proses diPSA ini, tidak dapat dihindari terjadinya penghilangan atau terikutnya sejumlah kecil H2 dan
gas-gas yang harus dibuang (dipisahkan). Gas yang diinginkan dari unit PSA ini hanya Hidrogen. Alat PSA terdiri dari 4 buah absorben (penyerap) dengan kode nama, yang dilengkapi dengan bahan-bahan penyerap (Adsorben) seperti molekular sieves yang berfungsi untuk menyerap CO2 yang berada dibagian atas, karbon aktif
yang berfungsi menyerap CH4 yang berada dibagian tengah, alumina aktivated yang
2.9. Spesifikasi Bahan Pendukung 2.9.1. Air
− Rumus molekul : H2O
− Berat molekul : 18
− Berat jenis cair : 1 gr/cm3 (pada suhu 25 0C) − Berat jenis gas : 0,804 kg/m3
− Titik lebur : 0 0C − Titk didih : 100 0C (Othmer, 1967)
2.9.2. Katalis Zink Oksida − Rumus kimia : ZnO
− Berat molekul : 81,39 gr/mol − Berat jenis : 5,47 gr/cm3 − Titik lebur : 1800 0C
− Kenampakan : butir–butir dengan diameter rata-rata 366 nm (Othmer, 1967)
2.9.3 Katalis Ni
− Rumus kimia : Ni
− Berat molekul : 58,69 gr/mol
− Berat jenis : 8,90 (20 0C) gr/cm3 − Titik lebur : 1425 0C
− Titik didih : 29000C
2.9.4 Metana (CH
4)
Fungsi : merupakan komponen unsur terbesar (88,85%) di dalam gas alam. − Berat molekul : 16,043 g/mol
− Temperatur kritis : -82,7 0C − Tekanan kritis : 45,96 bar − Fasa padat
− Titik cair : -182,5oC − Panas laten : 58,68 kJ/kg
− Fasa cair
− Densitas cair : 500 kg/m3 − Titik didih : -161,6oC − Panas laten uap : 510 kJ/kg − Fasa gas − Densitas gas : 0,717 kg/m3 − Faktor kompresi : 0,998 − Spesifik graffiti : 0,55 − Cp : 0,035 kJ/mol.K − Cv : 0,027 kJ/mol.K − Kelarutan : 0,054 vol/vol − Viskositas : 0,0001027 poise (Anonim3, 2007) 2.9..5 Ethana (C 2H6)
− Berat molekul : 30,069 g/mol − Temperatur kritis : 32,2 0C − Tekanan kritis : 40,2 bar − Fasa padat
− Titik cair : -183,3oC − Panas laten : 94,977 kJ/kg − Fasa cair