MAKALAH MATA KULIAH
SISTEM PENGHANTARAN OBAT (Kelas A)
“Sisten Penghantaran Obat Tertarget (Targeted Drug Delivery System)”
Kelompok 3
Chairunisa Larasati Yusuf 1006659432 Futty Dewi Nuzulia Famini 1006659470
Sarah Karima 1006659571
Azizah Nurrakhmani 1006775003
Elda Yulia Mamora 1006756572
Aprillia Wulandari 1006683375
FAKULTAS FARMASI UNIVERSITAS INDONESIA
BAB I PENDAHULUAN 1.1 Latar belakang
Dewasa ini, semakin banyak terjadinya resistensi penyakit terhadap suatu obat ataupun terapi. Selain itu juga sering terjadi kasus over dosis sehingga menyebabkan efek samping atau gangguan kesehatan lainnya bagi konsumen atau pasien. Sehi diperlukan suatu metode penghantaran obat yang dapat dengan selektif mengenali lokasi spesifik tertentu sehingga dapat meningkatkan efektivitas dari obat tersebut di lokasi tertentu. Oleh karena itu, saat ini banyak dilakukan penelitian dan perkembangan teknologi dalam bidang sistem penghantaran obat tertarget atau Targeted Drug Delivery System (TDDS). Komponen yang menjadi target suatu sediaan TDDS dapat berupa enzim, reseptor, kanal ion, transporter, dll. Perkembangan teknologi TDDS banyak dikembangkan antaralain dengan tujuan untuk menurunkan dosis yang diperlukan oleh tubuh, meningkatkan efektivitas terapi dan pengobatan, serta meminimalisir efek samping daari suatu sediaan konvensional.
1.2 Perumusan Masalah
1. Apakah yang dimaksud dengan sistem penghantaran obat tertarget?
2. Bagaimana mekanisme penghantaran obat oleh sistem pengahntaran obat tertarget? 3. Apa saja yang menjadi target dalam Sistem Penghantaran Obat tertarget?
4. Apa saja jenis pembawa pada sistem penghantaran obat tertarget?
1.3 Tujuan Penulisan
1. Menjelaskan apa yang dimaksud dengan sistem penghantaran obat tertarget.
2. Menjelaskan apa saja yang dijadikan target dalam sistem penghantaran obat tertarget. 3. Menjelaskan pembawa apa ssaja yang dapat digunakan dalam sistem penghantaran obat
tertarget.
1.4 Metode Penulisan
Dalam penulisan makalah ini, penulis menggunakan metode studi pustaka untuk mencari data dan fakta-fakta dari berbagai sumber. Adapun sumber yang digunakan penulis dalam penulisan makalah ini antara lain buku-buku, jurnal ilmiah, dan berbagai sumber dari internet.
1.5 Sistematika Penulisan
Sistematika penulisan makalah ini dibagi menjadi tiga bab, antara lain :
BAB I. Pendahuluan I.1. Latar Belakang I.2. Perumusan Masalah I.3. Tujuan Penulisan Makalah I.4. Metode Penulisan
I.5. Sistematika Penulisan
BAB II. Isi
II.1. Sistem Penghantaran Obat Tertarget II.2. Mekanisme Penghantaran Obat
II.3. Target pada Sistem Penghantaran Obat Tertarget II.4. Liposom
II.5. Monoklonal Antibody
II.6. Nanopartikel dan Mikropartikel
BAB III. Penutup III.1. Kesimpulan III.2. Saran
BAB II
PENGHANTARAN OBAT TERTARGET
2.1 Sistem Penghantaran Obat Tertarget
Sistem penghantaran obat bertarget digunakan untuk menghantarkan obat ke tempat aksi spesifiknya. Penghantaran ini dapat meningkatkan:
1. Keamanan obat, efek samping toksik karena aksi obat pada tempat non-target diminimalkan.
2. Efikasi obat, obat terkonsentrasi pada tempat aksi daripada yang tersebar di tubuh.
3. Kepatuhan pasien, peningkatan keamanan dan efikasi meningkatkan penerimaan pasien dan kepatuhan.
Dalam bentuk sederhana, obat bertarget dapat dilakukan dengan pemberian senyawa terapetik secara lokal dan bentuk sediaan yang umum. Misalnya, tempat aksi yang diinginkan adalah kulit, pengobatan dapat menggunakan salep, lotion, krim pada tempat aksi secara langsung. Injeksi agen anti inflamasi langsung ke dalam sendi juga salah satu bentuk penghantaran spesifik tanpa menggunakan sistem yang khusus. Teknologi tinggi untuk obat bertarget banyak tersedia terutama untuk penghantaran oral dan parenteral. Namun belum cukup maju untuk mendesain “magic bullet” seperti yang dipaparkan Paul Ehrlich pada akhir abad 20, dimana obat ditargetkan tepat pada tempat aksi.
Teknologi yang paling maju dari sistem penghantaran obat bertarget adalah pemberian parenteral. Teknologi dilakukan dengan menghantarkan obat ke target spesifik dalam tubuh dan melindungi obat dari degradasi dan eliminasi yang terlalu cepat.
Kemajuan bidang biologi dan kimia memberikan peran untuk pengembangan teknologi yang dapat memastikan penghantaran obat bertarget yang lebih efektif. Contohnya adalah Antibody-Directed Enzyme/Prodrug Therapy (ADEPT), Virus-Directed Prodrug/Enzyme Therapy (VDEPT), dan sistem penghantaran obat secara kimia.
Karakteristik Sistem Penghantaran Obat Bertarget yang Ideal adalah: a. Menghantarkan obat ke sel target atau jaringan secara khusus b. Menghindarkan obat dari organ, sel, atau jaringan non-target
e. Melindungi obat dari klirens cepat
f. Mempertahankan obat pada tempat aksi selama waktu yang diinginkan g. Memfasilitasi transport obat ke dalam sel
h. Menghantarkan obat ke dalam target aksi intraseluler yang sesuai i. Biokompatibel, biodegradable, dan non-antigenik
Komponen sistem penghantaran obat bertarget 1. Active moiety. Berguna untuk mendapatkan efek terapi.
2. Sistem pembawa. Untuk mengatur distribusi obat yang diinginkan, melindungi obat dari metabolisme, dan menjaga obat dari klirens cepat.
Sistem pembawa dapat dibagi menjadi dua golongan berdasarkan ukuran:
a. Pembawa makromolekular yang larut, termasuk antibodi dan polimer sintetik yang larut seperti poli(hidroksipropilmetakrilat), poli(lisin), poli(asam aspartat), poli(vinilpirolidon), poli(N-vinil-2-pirolidon-co-vinilamida) dan poli (stiren co-asam maleat/anhidrida). Keuntungan utama adalah kemampuannya yang lebih besar untuk ekstravasasi. Kerugian sistem ini adalah kapasitas muatan dosis yang terbatas, rendahnya stoikiometri sehingga membatasi transpor masa yang dimediasi pembawa obat, terikat secara kovalen dengan obat sehingga menutupi tempat aksi obat, reaksi konjugasi dapat merusak moietas obat yang labil, dan pembawa memberikan perlindungan yang terbatas pada moietas obat.
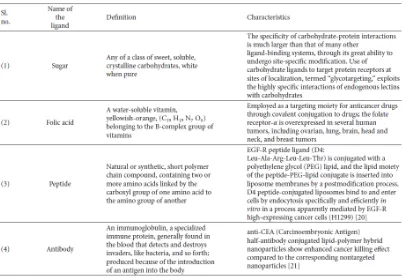
1) Antibodi Monoklonal
Penggunaannya terbatas karena efisiensi muatan yang rendah yaitu hanya beberapa senyawa obat yang dapat berikatan dengan antibodi. Untuk meningkatkan efisiensi penargetan Mab, dapat diikat dengan obat dengan sistem pembawa partikulat.
2) Immunotoxin
b. Sistem pembawa partikulat
Pembawa partikulat biasanya memiliki tiga karakteristik:
Ukuran terkecil 0.02 µm dan ukuran terbesar untuk obat bertarget adalah 10–30 µm.
Biodegradable
Obat terikat secara fisik dengan pembawa dan secara umum kinetika pelepasan obat diatur oleh transpor difusi atau degradasi matriks
Keuntungan dari sistem ini adalah tingginya muatan obat, obat tidak terikat secara kimia dengan pembawa, dan memberi perlindungan obat dengan enkapsulasi. Kekurangannya adalah ketidakmampuan menembus barier endothelial dan meninggalkan sirkulasi umum. 1) Liposom
Struktur vesikuler dengan satu atau lebih lipid bilayer, diameter antara 0.02 and 20 µm. Berdasarkan komposisi dasar dan kegunaan in vivo dibagi menjadi liposom konvensional, sterically stabilized (“stealth”) liposomes, immunoliposom, dan liposom kationik. 2) Misel Polimer
Misel bersifat stabil dalam sirkulasi darah atau memiliki CMC yang sangat rendah. Diameter dipilih dimana efek EPR terlihat (<0.2 µm) sehingga terjadi akumulasi obat. 3) Pembawa Lipoprotein
Perbandingan lemak dan protein menentukan densitas lipoprotein: kilomikron paling rendah densitasnya, sebagian besar lipid ukuran 10–90 nm; VLDL (Very Low Density Lipoproteins) ukuran 30–90 nm; LDL (Low Density Lipoproteins) ukuran 25 nm; dan HDL (High Density Lipoproteins) ukuran 10 nm.
4) Lain-lain: mikrosfer albumin, mikrosfer Poly(lactide-co-glycolide) (PLGA), dan niosom. 3. Homing device. Untuk menarget obat secara khusus ke sel atau jaringan target (tidak
dibutuhkan untuk pasive tarrgetting), misalnya reseptor galaktosa yang ada di sel liver parenkim, sehingga residu galaktosa pada pembawa obat dapat menghantarkan ke sel ini. Homing device bukanlah “magic bullets”, namun dapat meningkatkan spesifisitas obat pada tempat aksinya.
Misal:
a. Formulasi insulin long, medium, dan short acting dengan manipulasi kristal atau pembentukan kompleks fisika
c. Implan polimer, misal Zoladex d. Pompa infusi
2.2 Mekanisme Penghantaran Obat
Terdapat dua mekanisme penghantaran obat pada system penghantaran obat tepat target, yaitu active targeting dan passive targeting.
a. Passive Targeting
Passive Targeting memanfaatkan pola distribusi “alami” (pasif) dari pembawa obat in vivo dan tidak ada perangkat pengenalan target yang dipasangkan di pembawanya. Passive targeting dikenal juga dengan physical targeting. Mekanisme ini bekerja berdasarkan preparasi dari kompleks pembawa obat yang dirancang sedemikian rupa agar terhindar dari metabolism tubuh, eksresi, opsonisasi, dan fagositosis, jadi kompleks pembawa obat ini akan tetap berada di sirkulasi darah sehingga dapat bertransmisi ke target reseptor. Kompleks pembawa obat harus disesuaikan pH, suhu, ukuran atau bentuk molekulnya agar dapat sampai pada target reseptornya.
Jadi pada prinsipnya passive targeting terjadi karena adanya akumulasi atau sistem pembawa obat pada daerah tertentu karena sifat fisikokimia zat tersebut atau faktor farmakologis suatu penyakit.
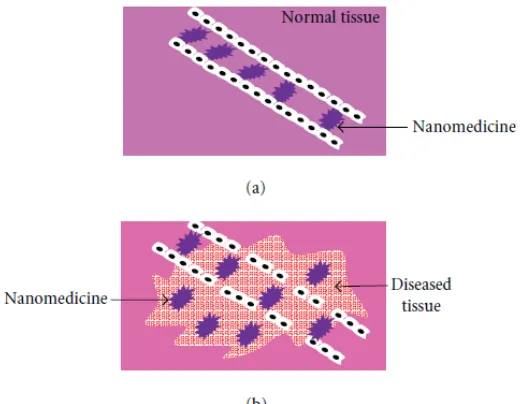
Gambar 1: Akumulasi obat pada system passive targeting pada jaringan normal (a) dan pada jaringan terpatologis (b)
Tabel 1. penyiapan sistem passive targeting
Obat yang digunakan dalam system passive targeting ini merupakan suatu nanopartikel yang cukup besar untuk dapat bertahan akibat adanya aliran darah dalam pembuluh darah, namun harus mempunyai ukuran yang cukup kecil agar dapat terhindar dari makrofag. Ukuran nano partikel yang disarankan 100 nm agar dapat terhindar dari 2 kejadian di atas. Selain ukurannya nano partikel yang digunakan harus mempunyai permukaan yang hidrofilik adar terhindar dari “termakan” oleh makrofag. Hal ini dapat dilakukan dengan melapisi permukaan nano partikel dengan polimer hidrofilik seperti polietilen glikol (PEG) yang dapat melindungi nano partikel dari opsonisasi.
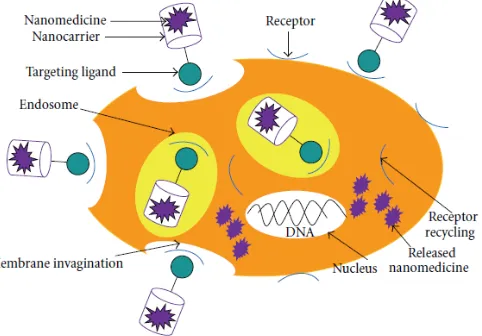
Pada fase awal, zat aktif akan menginvaginasi membran sel untuk masuk kedalam sel. Dalam sel, zat aktif akan terbungkus oleh membrane plasma membentuk endosom. Dari bentuk endosomnya, zat aktif dan target ligan akan dilepaskan dan menyebar didalam sel. Saat zat aktif menyebar dalam sel, ligan akan bermigrasi ke permukaan sel.
b. Active Targeting
Terjadi modifikasi obat atau sistem pembawa dengan komponen aktif yang memiliki afinitas spesifik untuk mengenali dan berinteraksi dengan sel yang dituju Pada system active targeting suatu terdapat homing device (pengenal target) yang terikat pada system pembawa untuk menghantarkan obat ke sel, jaringan atau organ spesifik. Oleh karena itu system pengahntaran active targeting ini terisir dari tiga bagian, yaitu pembawa, homing device, dan obat. Homing device yang biasa digunakan pada active targeting merupakan suatu ligan spesifik seperti antibody, hormone, dan protein yang mempunyai afinitas tinggi terhadap reseptor pada sel target spesifik yang dituju Sebaiknya homing device adalah yang kovalen melekat pada pembawa, meskipun perangkan pelacak yang tidak kovalen melekat pada pembawa juga sukses di targetkan.
Pada aktif targeting, digunkan ligan/anti bodi sebagai target moiet, polimer/lipid sebagai carrier.
Ada tiga orde untuk aktif targeting, yaitu :
Target orde pertama, istilah ini mengacu pada jalur terlarang untuk distribusi sistem obat-carrier, misalnya ke pembuluh-pembuluh kapiler di sekitar situs target, pembuluh limfe, rongga peritoneal, dan barrier otak.
Target orde kedua, Selektivitas penghantaran obat ke sel spesifik, misal sel-sel tumor, tanpa mengenai dan memberi efek ke sel-sel normal disekitarnya. Contoh lain adalah penghantaran selektif untuk sel kupffer pada liver.
Target orde ketiga, Didefinisikan sebagai obat yang sistem penghantarannya dibuat
spesifik untuk situs-situs target intraseluler. Contoh aplikasi pada pelepasan kompleks obat dalam sel melalui endositosis yang dimediasi oleh ligan.
Reseptor dalam membrane sel
Komponen lipid dalam membrane sel
Interaksi antara analog fosfolipidsyntesis dengan membrane sel, akan mengubah komposisi lipid, permeabilitas membrane dan fluiditas.
Antigen atau Protein dalam permukaan sel
Suatu sel yang rusak akan mengeluarkan suatu protein. Protein ini akan dilawan dengan antibody monoclonal.
2.3 Target Obat dalam TDDS
bentuk pembawa nanopartikel, antara lain : Liposome, Micelle, Nanosphere, Polimer, Nanocapsule, dll. Beberapa makromelkul yang dapat digunakan sebagai target suatu obat :
1) Enzim
Enzim adalah senyawa protein yang bertindak sebagai biokatalisator, artinya senyawa tersebut mampu mempercepat reaksi kimia, tetapi zat itu sendiri tidak ikut bereaksi. Enzim digunakan sebagai target obat karena enzim selain berfungsi sebagai biokatalisator di dalam tubuh manusia dan untuk manusia, enzim di dalam tubuh manusia dapat dimanfaatkan oleh penyakit sehingga kondisi patofisiologis tubuh semakin buruk. Intinya, suatu enzim spesifik berperan dalam perkembangan suatu penyakit. Contohnya, struktur tiga dimensi dari enzim protease pada Human Immunodeficiency virus (HIV), yang merupakan enzim penting dalam replikasi virus HIV, memberikan gambaran yang lebih jelas bagi para peneliti untuk mengetahui konfigurasi molekuler dari protein virus HIV. Para peneliti menggunakan hal ini untuk mendesain suatu obat yang dapat menginaktifkan enzim protease tersebut.
Mekanisme obat pada enzim, antara lain :
Inhibitor Enzim
Molekul obat sebagai penghambat enzim-enzim tertentu yang mengganggu kerja sel.
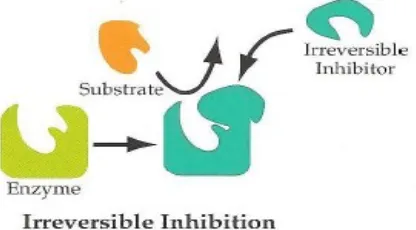
1. Irreversible Inhibitors
Irreversible Inhibitors, yaitu golongan yang bereaksi dengan, atau merusakkan suatu gugus fungsional pada molekul enzim yang penting bagi aktivitas katalitiknya. Inhibitor bereaksi tidak reversibel dengan bagian tertentu pada enzim. Contoh: Diisoprofil fluorofosfat (DFP) yang dapat menghambat enzim asetilkolinesterase (penting dalam transmisi impuls syaraf).
Gambar 3. Inhibisi Ireversible 2. Reversible Inhibitors
Pada inihibitor kompetitif, inhibitor dan substrat berkompetisi untuk berikatan dengan enzim. Seringkali inhibitor kompetitif memiliki struktur yang sangat mirip dengan substrat asli enzim. Sebagai contoh, metotreksat adalah inihibitor kompetitif untuk enzimdihidrofolat reduktase.
Gambar 4. Reversible Inhibitors
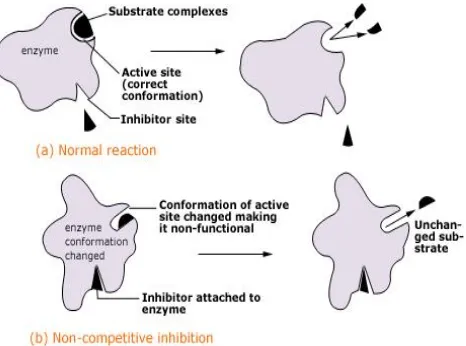
Non-Competitive
Inhibitor nonkompetitif biasanya berupa senyawa kimia yang tidak mirip dengan substrat dan berikatan pada sisi selain sisi aktif enzim. Ikatan ini menyebabkan perubahan bentuk enzim sehingga sisi aktif enzim tidak sesuai lagi dengan substratnya.
Gambar 5. Inhibitor non kompetitif False Substrat
transformasi kimia yang kemudian membentuk produk abnormal sehingga jalur metabolik di dalam tubuh akan berubah. Contoh:
1. 5-Fluorourasil
Obat ini menggantikan urasil dalam biosintesis purin dan akan terbentuk nukleotida palsu “fradulent” Nucleotide Fluoro Deoxyuridine Monophosphat (FDUMP) atau tidak terbentuk 2’-deoxyuridilat monophosphat (DUMP) dan tidak membentuk timidilat (DTMP) sehingga terjadi penghambatan sintesis DNA dan penghambatan pertumbuhan dan pembelahan sel.
2. Metotreksat
Menggantikan folat dalam biosintesis purin sehingga penghambatan sintesis DNA dan penghambatan pertumbuhan dan pembelahan sel.
2) Reseptor
Suatu makromolekul seluler yang secara spesifik dan langsung berikatan dengan agonis/ ligan untuk memicu signaling kimia antara dan dalam sel, sehingga menimbulkan efek. Reseptor digunakan sebagai target obat karena reseptor dapat berfungsi sebagai situs pengenalan dan pengikatan suatu ligan sehingga mempengaruhi aktivitas sel.
Contoh ligan yang dapat berikatan dengan reseptor dan mempengaruhi aktivitas sel: 1. Hormon: insulin, testosteron, dsb.
2. Autocrine/paracrine factors: hormon yang beraksi lokal (contoh: prostaglandin). 3. Neurotransmitters: dilepaskan oleh ujung syaraf sebagai respon dari depolarisasi
(contoh: asetilkolin, norepinefrin, noradrenalin).
4. Cytokines: diproduksi oleh sel-sel pada sistem imunitas. Targetnya bisa jauh atau dekat (cth: interferon, interleukin).
5. Membrane-bound ligands: terdapat pada permukaan sel, mengikat pada reseptor komplementer sel yang lain sehingga menjembatani interaksi antar sel.
6. Drug/chemicals: senyawa yang dipaparkan dari luar. Mekanisme obat pada reseptor :
Agonis
1) Agonisme Langsung
Respon berasal dari interaksi agonis dengan reseptornya, menyebabkan perubahan konformasi reseptor sehingga reseptor aktif dan menginisiasi proses biokimiawi sel (stimulus atau penghambatan respon seluler).
Senyawa obat mempengaruhi senyawa endogen dalam menjalankan fungsinya. (potensiasi atau modulasi). Agonis tidak langsung biasanya merupakan alosterik dimana obat berikatan dengan reseptor pada tempat yang berbeda dari tempat berikatannya endogen sehingga reaksi biokimia yang terjadi lebih efisien. Contoh: Benzodiazepin dan barbiturat pada reseptor GABAA yang dapat memperkuat aksi GABA pada reseptor tersebut.
Antagonis
Antagonis melibatkan suatu senyawa yang akan menurunkan aksi suatu agonis atau ligan dalam memberikan efek.
1. Antagonis kompetitif
Suatu obat yang mengikat reseptor secara reversibel pada daerah yang sama dengan tempat ikatan agonis, tetapi tidak menyebabkan efek. Efek antagonis kompetitif dapat diatasi dengan peningkatan konsentrasi agonis, sehingga meningkatkan proporsi reseptor yang dapat diduduki oleh agonis. 2. Antagonis irreversibel
Antagonis yang dapat mengikat reseptor secara kuat dan bersifat irreversibel, tidak bisa diatasi dengan penambahan agonis.
3. Antagonis non-kompetitif
Suatu antagonis yang dapat mengurangi efektifitas suatu agonis melalui mekanisme selain berikatan dengan tempat ikatan agonis pada reseptor.
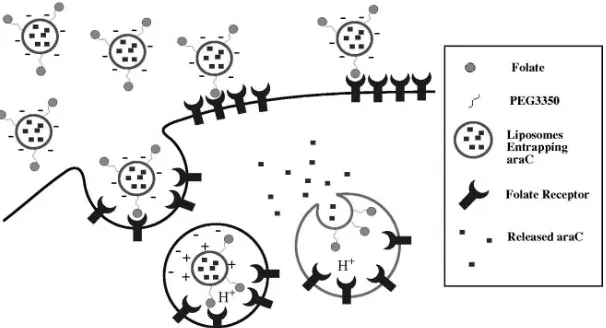
Reseptor folat, yang diekspresikan pada sel kanker, dapat digunakan sebagai target pemberian obat tumor spesifik pada kanker seperti payudara, ovarium, otak, dan paru-paru. Reseptor yang overekspresi tersebut dapat digunakan sebagai target dengan cara obat kanker tersebut ditempelkan dengan suatu ligan berupa asam folat bisa dalam bentuk liposom, asam folat ini sangat dibutuhkan oleh sel-sel kanker untuk pertumbuhannya sehingga ketika obat disuntikan/diberikan asam folat akan dimakan oleh sel kanker, dan disitulah obat kanker akan dilepaskan dan mulai bekerja.
Pada reseptor peptida dalam beberapa sel tumor disajikan dalam jumlah yang banyak, sehingga analog peptida dikonjugasikan ke pembawa obat yang memungkinkan penargetan tumor-spesifik agen sitotoksik, memastikan interaksi dengan reseptor peptida. Sebagai contoh liposom yang dikopling dengan RGD (arginin-Glisin-Aspartat), dengan mekanisme kerja hampir sama seperti reseptor asam folat.
3) Viral Surface Protein
virus/tumor/sel yang terjangkit penyakit, VSP berperan penting dalam interaksi antar sel sehingga bila diketahui suatu protein berperan dalam pertumbuhan dan perkembangan virus/tumor/sel, maka VSP tersebut dapat ditarget agar dapat menghambat perkembangannya.
Contoh :
1. Malaria merozoite surface protein (MSP1). 2. Hepatitis B Virus : P39, GP42.
3. Human Breast Tumor Cells : Ret Kinase (Rearranged during transfection).
4) Kanal Ion
Kanal ion merupakan sebuah protein yang bertindak sebagai pori pada membran sel dan memungkinkan bagian selektif ion (seperti ion kalium, ion natrium, dan ion kalsium), dengan cara yang arus listrik melewati masuk dan keluar dari sel. Saluran ion juga melayani banyak fungsi penting lainnya, termasuk bahan kimia sinyal, transportasi transelular, regulasi pH, dan pengaturan volume sel. Kerusakan saluran ion dapat menyebabkan penyakit pada banyak jaringan. Kanal ion yang meregulasi dan merupakan tranpor ion secara selektif dalam proses fisiologi manusia. Mulai dari pemberi sinyal di jantung dan sistem saraf, sekresi cairan di paru-paru, saluran GI dan ginjal, sistem imun, remodelling tulang dan poliferasi sel tumor. Mekanisme kerja dari kanal ion saluran Voltage-gated diatur oleh perubahan perbedaan potensial listrik melintasi membran (yaitu, potensial membran) sedangkan ligan dan saluran sensory-gated merespon perubahan di berbagai intraseluler atau ekstraseluler dan ligan terhadap rangsangan mekanik atau termal, masing-masing. Masalah yang dihadapi yaitu untuk saluran ion ini bermasalah karena reproduksi otentik sifat fungsional dan farmakologis asli tergantung pada ekspresi yang efisien, lokalisasi, dan orientasi dari suatu kombinasi yang tepat dari subunit, masing-masing yang mungkin memiliki beberapa domain transmembran yang melipat masuk dan keluar dari membran. Akibatnya ada potensi besar untuk kesalahan berikatan dan kesalahan perakitan. Dalam banyak kasus komposisi subunit yang tepat dari saluran target dalam jaringan kurang dikarakterisasi. Demikian pula, kebutuhan untuk faktor selular lain yang mungkin memainkan peran modulasi spesifik jaringan seringkali kurang dipahami.
5) DNA, RNA
DNA merupakan makromolekul polinukleotida yang tersusun atas polimer nukleotida yang berulang-ulang, tersusun rangkap, membentuk DNA heliks ganda dan berpilin ke kanan. Setiap nukleotida terdiri dari 3 gugus molekul, yaitu :
basa nitrogen, yaitu adenin (A) dan guanin (G), sitosin (C) dan timin (T),
gugus fosfat.
DNA digunakan sebagai target karena :
Mengatur regulasi dari replikasi, transkripsi atau translasi,
Membunuh sel, kemungkinan melalui apoptosis (agen anti tumor).
Contoh :
Sitabin dan Gemsitabin yang merupakan obat leukimia anak-anak.
Mekanisme :
1. Terminasi sintesis untai DNA,
2. Penggabungan ke genom (DNA) diikuti dengan perubahan siklus hidup sel termasuk apoptosis (kematian sel terprogram).
RNA merupakan Rantai tunggal polinukleotida, yang setiap ribonukleotida terdiri dari 3 gugus molekul :
5 karbon
basa nitrogen, yaitu adenin (A), guanin (G), sitosin (C) dan Urasil (U)
gugus fosfat
RNA memegang peranan penting dalam proses biologis :
Sintesis protein
Pemotongan mRNA
Regulasi transkripsi
Pengikatan obat ke RNA target spesifik dapat pengaruhi aktivitas biologis dari RNA dengan cara :
1. Mencegah pengikatan makromolekul (protein/RNA) 2. Mengacaukan konformasi aktif RNA
3. Membentuk ikatan kompetitif pada situs pengikatan kofaktor Contoh :
6) Ligan
Ligan (dari bahasa latin ligandum : mengikat) merupakan molekul pemicu sinyal yang terikat ke sebuah daerah ikatan pada protein target. Ikatan ini terjadi oleh gaya antarmolekul, seperti ikatan ion, hidrogen dan gaya van der waals.
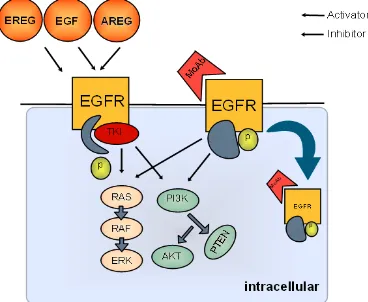
Sebagai contoh pasangan reseptor ligan yaitu EGF dan EGFR. EGFR merupakan reseptor glikoprotein transmembran yang dikode oleh proto onkogen Her 1, yang terdiri dari ekstraseluler dan intraseluler. Ekstraseluler terdiri atas reseptor yang berfungsi sebagai tempat ikatan antara ligan dengan EGFR. Ligan yang dapat berikatan dengan EGFR yaitu EGF (Epidermal Growth Factor), Amphiregulin , Transforming Growth Factor-α (TGF- α), Heparin-binding EGF-like growth factor (HB-EGF), Betacellulin, dan Epiregulin. Pada intraseluler terdapat domain tirosin kinase yang berperan pada proses tranduksi sinyal dalam pertumbuhan kanker. Ikatan antara EGFR dengan ligan dapat mengaktifkan berbagai jalur transduksi sinyal yang berperan dalam regulasi siklus sel sehinga terjadi proses diferensiasi, apoptosis, proliferasi nan angiogenesis. Pada terapi anti kanker untuk menghambat kerja EGFR digunakan EGFR Inhibitor.
Contoh : Antibodi monoklonal anti-EGFR (mAb), yaitu cetuximab, abgenix, medarex. Ketika mAb berikatan dengan reseptor-reseptor EGFR, akibatnya ikatan antara ligan dengan reseptor dapat dicegah sehingga EGFR tidak teraktivasi. mAb ini dapat dibuat dalam bentuk liposom yang sering disebut dengan immunoliposom.
Tabel.4 Target obat Nanopartikel
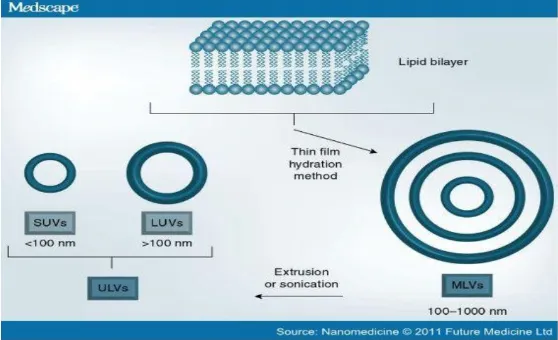
2.4 Liposom dalam Sistem Penghantaran Obat Tertarget
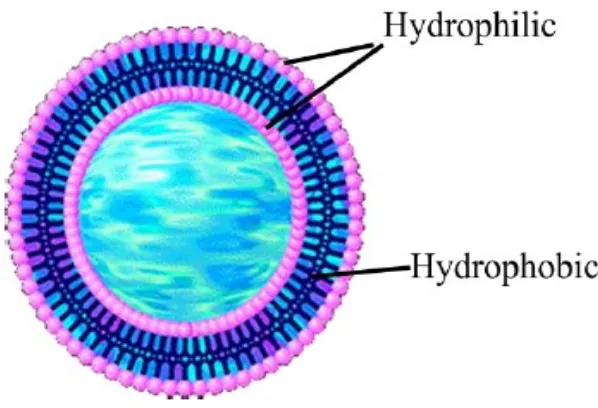
Liposom merupakan suatu sistem penghantaran obat tertarget yang berbentuk sferis dan terdiri atas susuan membran lipid lapis ganda, komponen utama dari liposom yaitu fosfolipid yang memiliki bagian kepala hidrofilik dan bagian ekor hidrofobik. Dengan adanya struktur tersebut, maka bagian hidrofilik akan mengarah ke fase aqueous sedangkan bagian hidrofobik akan mengarah ke fase lipid. Pada umumnya, obat yang dibawa oleh liposom terletak di bagian inti, namun obat juga dapat berada diantara lapisan mebran lipid lapis ganda. Liposom dapat digunakan sebagai karier atau pembawa baik untuk obat-obat yang larut air maupun obat-obat yang larut lemak.
Gambar 7. Struktur Liposom
Bahan yang paling umum digunakan untuk membuat lapisan bilayer pada liposom yaitu Fosfatidilkolin (PC) yang merupakan suatu posfolipid tidak bermuatan. Selain PC, Fosfatidilgliserol dan Fosfatidiletanolamin juga sering digunakan dalam pembuatan liposom.
Rigiditas dan permeabilitas lapisan bilayer dipengaruhi oleh jenis lipid yang digunakan dalam formula. Panjang rantai alkil dan derajat ketidakjenuhan suatu lipid sangat mempengaruhi sifat dari liposom, contohnya yaitu C18. C18 rantai alkil jenuh pada suhu ruang mengahsilkan bilayer yang rigid dengan permeabilitas rendah. Kolesterol juga dapat meningkatkan rigiditas dari bilayer, dengan demikian maka liposom akan lebih stabil sehingga dapat membawa obat dengan durasi yang lebih lama.
2.5.1. Penggolongan liposom
Liposom dapat digolongkan berdasarkan ukuran, dan mekanisme kerjanya secara invivo (aplikasinya).
a) Vesikel Multi Lamelar (MLV)
Liposom MLV dapat dikatakan sebagai bentuk awal liposom. MLV merupakan liposom multikompartemen dengan ukuran vesikel 100 nm sampai dengan 1000 nm dan setiap vesikel biasanya terdiri atas lima atau lebih lamela konsentris. Liposom MLV sangat cocok untuk proses enkapsulasi dari berbagai substansi dan dapat dibuat berbagai macam komposisi lipid.
b) Vesikel Unilamelar kecil (SUV)
SUV memiliki variasi ukuran terkecil. Ukuran SUV didasarkan pada kekuatan ionisasi medium cair dan komposisi lemak pada membran, yaitu ukuran vesikel ± 15 nm untuk liposom yang berasal dari lesitin telur murni pada salin normal dan ± 25 nm untuk liposom DPC.
c) Vesikel Unilamelar besar (LUV)
LUV memiliki ukuran lebih besar dari SUV. Liposom ini memiliki ukuran 500-1000 nm. Vesikel ini dapat dibuat dengan metode injeksi eter dan fusi liposom jenis SUV dengan diinduksi kalsium.
d) Vesikel Unilamelar intermediet (IUV)
Liposom ini berukuran 100-200 nm. IUV dapat bertahan lebih lama dalam sirkulasi dan stabilitasnya baik sehingga sangat bermanfaan dalam penghantaran obat.
Gambar 8. Ukuran liposom
a) Convetional liposomes
Liposome yang terdiri dari bahan yang tidak bermuatan ataupun bahan yang bermuatan negative dan pada umumnya digunakan dalam passive targeting. b) Stericallystabilized liposomes
Liposom yang terbungkus oleh lapis hidrofilik dan digunakan untuk memperlama durasi obat berada dalam sirkulasi darah.
c) Immunoliposomes
Liposom yang dikonugasikan dengan antibody sebagain ligand sehingga cara kerjanya yaitu dengan mekanisme respon imun alami tubuh dimana antibody akan mengenali suatu antigen pada sel tertentu.
d) Cationic liposomes
Liposome yang memiliki muatan positif dan biasanya digunakan untuk penghantaran materi genetik.
2.5.2. Mekanisme Penghantaran Obat a) Passive Targetting
Prinsipnya adalah memeperpanjang durasi liposom dalam aliran darah sehingga dapat memperpanjang durasi kerja obat dalam tubuh sehingga terjadi penurunan interaksi dengan RES (Reticuloendothelial System) dan peningkatan EFR (enhanced permeability and retention) dari liposom
b) Active Targetting
Penggunaan agen aktif (berupa ligan) yang mempunyai afinitas spesifik terhadap sel, jaringan, atau organ. Pemilihan sasaran pada target berdasarkan sifat overekspresi ataupun sifat kespesifikannya dan sasarannya berupa reseptor, komponen lipid pada membran sel, ataupun antigen permukaan pada sel target.
2.5.3. Mekanisme Pelepasan Obat oleh liposom a) Endositosis
Endositosis adalah transpor makromolekul dan materi yang sangat kecil ke dalam sel dengan cara membentuk vesikula baru dari membran plasma. b) Fusi membran liposom-membran sel.
Terjadi fusi atau penggabungan anatara membrane sel dan membrane liposom sehingga zat aktif dikeluarkan langsung ke dalam sitoplasma. c) Makropinositosi
Untuk liposom multilamelar karena ukurannya besar. d) Adsorpsi
Lipososm menempel pada permukaan sel dan melepaskan zat obat secara difusi.
2.5 Antibodi monoklonal dalam targeting drug delivery system
Gambar 9. Struktur molekul antibodi [Sulistyo Emantoko, 2001]
Antibodi monclonal adalah antibodi buatan identik karena diproduksi oleh salah satu jenis sel imun saja. Antibodi monoclonal mempunyai sifat khusus yang unik yaitu dapat mengenali suatu molekul memberikan informasi tentang molekul spesifik dan sebagai terapi target tanpa merusak sel sehat sekitarnya. Antibodi monoclonal digunakan sebagai ligan dalam targeting drug delivery system (Sistem penghantaran obat tertarget). Antibody monoclonal sebagai ligan yaitu merupakan pembawa obat yang dapat mengenali target dalam pengobatan kanker atau penyakit autoimun. Tujuan dari antibodi monoclonal sebagai targeting drug delivery system adalah
• Tepat target
• Memaksimalkan efek terapi
• Meminimalisir efek samping & toksiistas
2.5.4. Penggolongan antibodi monoklonal
Penggunaan antibodi monoklonal untuk terapi obat terutama untuk terapi kanker dibagi dalam 2 tipe, yaitu:
1. Antibodi monoklonal murni
(tempat ikatan molekul pertumbuhan sel kanker) yang akan menghambat pertumbuhan sel kanker.
2. Conjugated monoclonal antibodies (Antibodi monoklonal yang dikombinasikan dengan beberapa senyawa lain)
Merupakan antibodi monoklonal yang dikombinasikan dengan beberapa senyawa lain (conjugated monoclonal antibodies) antara lain kemoterapi, toksin, dan senyawa radioaktif. Obat ini hanya berperan sebagai wahana yang akan mengantarkan substansi-substansi obat, racun, dan materi radioaktif, menuju langsung ke sasaran yakni sel-sel kanker. Antibodi monoklonal jenis ini akan beredar ke seluruh bagian tubuh sampai ia berhasil menemukan sel kanker yang mempunyai antigen spesifik yang dikenali oleh antibodi monoklonal
Gambar 10. Antibodi monoklonal [Teti Indrawati, 2009] Berikut adalah contoh-contoh antibodi monoklonal terkonjugasi :
Radioimuoterapi atau antibodi yang dilabel radioisotop
Radioimunoterapi adalah metode penanganan kanker dengan memanfaatkan reaksi spesifik antigen dan antibodi. Radioisotop dengan jenis radiasi yang mematikan sel ditumpangkan ke antibodi yang bereaksi secara spesifik dengan tumor-associated antigen. Setelah dimasukkan ke dalam tubuh, antibodi akan terikat ke dalam antigen yang ada di sel kanker dan sel tersebut akan dimatikan oleh radiasi yang dipancarkan radioisotop.
Tostizumab merupakan antibodi monoklonal yang akan berikatan dengan antigen CD20 yang ditemukan pada sel mature limfosit B. antibodi berikatan dan menginduksi apoptosis, complement-dependent sitotoksik dan sel mati selama ionisasi radiasi.
Antibodi monoklonal yang dikonjugasi dengan racun yaitu immunotoksin
Suatu protein yang terdiri dari fragmen Fv antibodi monoklonal (mAB) spesifik yang berikatan dengan toksin. Mekanisme aksi imunotoksin adalah
1. Berikatan dengan reseptor (antigen) komplimen dari mAB pembawa toksin pada permukaan tumor
2. Mengalami internalisasi ke dalam endosome 3. Mengalami serangkaian metabolisme di dalam RE.
3. Bertranslokasi ke dalam sitosol, mengalami ribosilasi untuk mengaktifkan toksin. 4. Menginhibisi sintesis protein pada sel tumeor sehinnga menyebabkan kematian sel.
Gambar 12. Mekanisme imunotoksin [Ada Funaro et all. 2000] Contoh :
Mylotarg (Gemtuzumab Ozogamicin) melawan langsung antigen CD33 yang dilekspresikan langsung oleh sel hematopoetik. Ikatan antibodi anti CD33 dalam mylotarg dengan antigen CD33 menghasilkan kompleks mengalami internalisasi. Selanjutnya calicheamicin dilepaskan masuk ke dalam lisosom dalam sel meiloid. Pelepasan calicheamin berikatan dengan DNA sehingga DNA double strand rusak dan sel mati.
Merupakan konjugasi antara antibodi dengan liposom. liposom membawa obat atau nukleotida terapeutik dan kemudian berkonjugasi dengan antibodi monoklonal, obat atau toksin dihantarkan ke sel target.
Gambar 13. Mekanisme liposom Obat-antibodi terkonjugasi
Obat-antibodi terkonjugasi adalah antibodi monoklonal (mAbs) yang terikat pada obat dengan ikatan kimia. Menghasilkan efek terapi yang baik dan mengurangi efek samping. Doxorubicin, duanomicin, klorambucil, dan lainnya dapat dikonjugasi dengan antibodi monoklonal. Mekansime obat-antibodi terkonjugasi adalah
Identifikasi antigen yang dihasilkan oleh sel tumor. Produksi antibodi monoklonal melawan antigen.
Pembentukan kompleks obat pada sel tumor dan pelepasan obat.
2.6 Nanopartikel dan Mikropartikel
Mikropartikel didefinisikan sebagai partikel padat berbentuk sferis dengan ukuran 1-1000 µm. Mikropartikel memiliki inti yang dikelilingi oleh suatu material yang berbeda komposisi dengan intinya. Bagian inti dapat berupa bentuk padat, cairan atau gas. Formula mikropartikel terdiri dari campuran homogen dari polimer dan bahan aktif, sedangkan mikrokapsul setidaknya memiliki satu atau lebih jenis bahan aktif.
mikropartikel antara lain adalah distribusi ukuran partikel, berat molekul dari polimer, perbandingan antara obat dan polimer, dan berat total obat-polimer.
Bahan pembuat mikropartikel dapat bermacam-macam bahan seperti polimer, wax, atau bahan protektif yang lainnya dimana adalah bahan sintesis polimer dan bahan alam yang dimodifikasi sehingga bersifat biodegradable seperti starch, gum, protein, lemak dan wax. Polimer alami terdiri dari albumin dan gelatin sedangkan polimer sintesis terdiri dari asam polilaktat dan asam poliglikolat.
Ukuran mikropartikel sangat kecil dan memiliki lapisan permukaan yang cukup besar. Dengan ukuran terkecil, mikropartikel masih dapat membentuk suatu koloidal. Bagian dari permukaan mikropartikel merupakan bagian terpenting untuk setiap aktivitasnya. Pembuatan mikropartikel dalam industri lebih mengutamakan modifikasi dari permukaan mikropartikel, dengan cara pembentukan bahan materi sebagai permukaan mikropartikel atau penggunaan sambung silang.
Pada industri farmasi potensi yang terdapat pada mikropartikel adalah : 1. Menutupi bau dan rasa tidak enak
2. Meningkatkan sifar alir dari serbuk
3. Melindungi bahan obat dari pengaruh lingkungan yang merugikan seperti kelembaban, oksigen, dan sinar ultraviolet
4. Mencegah penguapan
5. Penanganan yang lebih aman untuk bahan toksik
Mikropartikel dapat dibuat dengan berbagai metode seperti air suspension, coarsevation-phase separation, multiorifice-centrifugal prosess, pan coating, spray drying dan spray congealing, solvent evaporation, polymerization, precipitation, freeze drying, chemical and thermal cross-linking, wax coating and hot melt, spray coating.
a. Air suspension
Beberapa variabel yang mempengaruhi proses ini adalah :
1. Berat jenis, luas area, titik leleh, kelarutan, sifat kristal, sifat alir, kemampuan mengembang dari bahan inti.
2. Konsentrasi bahan penyalut (atau titik lebur jika bukan cairan) 3. Laju pemakaian bahan penyalut
4. Volume untuk menahan dan mencairkan bahan inti 5. Jumlah bahan penyalut
6. Suhu inlet dan outlet saat pembuatan
b. Coacervation (Coacervation-phase separation)
Koarsevasi merupakan proses dimana polimer yang dilarutkan kemudian ditambahkan suatu zat tertentu sehingga menjadi tidak larut dan mengendap. Metode terbagi menjadi dua yaitu koarsevasi sederhana dan koarsevasi kompleks. Pada koarsevasi sederhana proses pembentukan mikropartikel dipengaruhi hanya satu jenis polimer. Sedangkan pada koarsevasi kompleks dibutuhkan dua polimer hidrofilik yang memiliki muatan yang berlawanan, misalnya pembuatan mikropartikel dengan menggunakan sodium alginat, sodium CMC, K-carregeenan, dan asam sodium poliakrilik yang digunakan untuk koarsevasi komplek dengan chitosan. Formula koarsevasi pada chitosan-alginat dan chitosan-k-carrageenan dikeraskan dengan pengeras masing-masing adalah KCl dan CaCl2 sebelum dicuci dan dikeringkan. Untuk obat yang lebih larut air dan dicuci dengan larutan air, kemungkinan konsentrasi obat akan menurun, karena bahan polimer yang hidrofil akan mudah larut dengan pelarut yang hidrofil, sehingga akan mempengaruhi konsistensi kandungan bahan obat didalam polimer, sesuai dengan dengan teori like dissolve like. Metode ini dapat dilakukan pada pH yang spesifik yang dapat distabilisasi dengan penambahan cross linking agent atau panas dan retensi dari enkapsulasi yang bergantung pada lamanya proses crosslinking. Metode coarsevation-phase merupakan metode yang paling sederhana dalam pembuatan mikropartikel. Metode ini dibagi menjadi dua, yaitu :
1. Aqueos Phase Separation Methods
Enkapsulasi terjadi pada saat penjenuhan dan terjadi pengendapan (salted out) dan menyelubungi bagian inti setelah direduksi pada suhu, pH yang berbeda atau penambahan precipitating agent. Metode ini dibagi menjadi koaservasi sederhana dan koaservasi komplek.
1. Koarsevasi Sederhana
Koaservasi sederhana adalah sistem yang mengandung satu colloidal solute(polimer). Dapat dilakukan dengan cara penambahan bahan kimia yang memiliki kelarutan tinggi dalam air seperti garam dan alkohol. Proses koaservasi ini dipengaruhi oleh derajat hidrasi yang dihasilkan. Penambahan bahan akan menyebabkan terbentuknya dua fase. Salah satu fase mengandung banyak droplet sedangkan yang lainnya sedikit mengandung droplet. Proses mikroenkapsulasi dapat dijelaskan dengan tiga tahap dibawah ini :
1) Didispersi material inti ke dalam larutan polimer.
2) Membuat fase hidrofilik kekurangan air dan deposisi lapisan koaservasi disekeliling inti 3) Pengerasan mikrokapsul
2. Koaservasi Komplek
Koarsevasi kompleks melibatkan proses netralisasi muatan dari polimer dan tergantung oleh pH. Metode ini dilakukan dengan mencampurkan dua jenis polimer yang berbeda secara bersamaan.
Proses enkapsulasi ini dapat dijelaskan dengan 4 tahap dibawah ini: 1) Menyiapkan larutan polimer hidrofilik
mengemulsikan campuran polimer dan bahan aktif. Emulsi dimasukkan ke dalam larutan pengeras kemudian diaduk dengan kecepatan tertentu untuk menghasilkan ukuran partikel yang diinginkan. Pembuatan dengan metode ini menghasilkan mikropartikel dengan ukuran yang berbeda (tidak seragam) dan memberikan pelepasan obat yang lebih cepat dibandingkan dengan mikropartikel yang dibuat dengan metode orifice-ionic gelation (Chowdary and Rao, 2003).
Metode orifice-ionic gelation dilakukan dengan cara meneteskan campuran polimer dengan bahan aktif ke dalam larutan pengeras sehingga terbentuk mikropartikel dengan ukuran tertentu. Metode ini menghasilkan mikropartikel dengan ukuran seragam dan pelepasan obat yang lebih lambat sehingga memberikan efek yang lebih baik (Chowdary and Rao, 2003).
Pada pembuatan mikropartikel dengan chitosan dan alginat dengan metodeorifice-ionic gelation dapat digunakan beberapa cara. Larutan Na alginat dicampurkan dengan larutan obat, lalu campuran homogen tersebut diteteskan ke dalam larutan CaCl2 untuk membentuk kompleks, lalu dikeringkan. Mikropartikel yang dihasilkan kemudian didispersikan dalam larutan kitosan yang telah dilarutkan dalam asam asetat sambil diaduk untuk membentuk kompleks alginat-kitosan. Ada juga dengan melarutkan chitosan dalam asam asetat diteteskan dalam larutan tripoliphospate (TPP) kemudian difiltrasi, dicuci, dan dikeringkan.
Metode orifice ionic gelation merupakan metode yang sederhana, sesuai untuk scale up, menggunakan peralatan yang sederhana dan mudah dalam proses pembuatannya sehingga dapat digunakan dalam penelitian di laboratorium.
c. Multiorifice-centrifugal process
Multiorifice-centrifugal process menghasilkan mikropartikel cairan dan padatan (jika padatan didispersikan dalam cairan) dari berbagai kisaran ukuran, dari berbagai polimer. Bahan obat dapat disiapkan sebagai larutan kental dalam media yang mengeras atau sebagai serbuk kering. Variabel proses meliputi kecepatan rotasi dari silinder, laju aliran obat dan polimer, konsentrasi dan viskositas polimer, serta viskositas dan tegangan permukaan dari bahan obat.
d. Pan coating
biasanya air hangat digunakan pada bahan-bahan bersalut saat bersalut ada di dalam pan penyalut. Dalam beberapa hal, penghilangan penyalut terakhir dilakukan dalam oven pengering.
e. Spray drying and spray congealing
Dilakukan dengan mendispersikan bahan obat dalam polimer yang dicairkan, dan menyemprotkan campuran bahan obat-polimer ke dalam suatu kondisi lingkungan pemadat yang relatif cepat. Perbedaan utama antara kedua metode adalah cara dilaksanakannya pemadatan polimer. Pemadat polimer pada metode spray drying dipengaruhi oleh penguapan cepat dari pelarut yang melarutkan polimer. Pemadatan polimer pada metode pembekuan semprot dilakukan membekukan secara thermal suatu polimer yang dilarutkan dengan memasukkan campuran bahan obat-polimer ke dalam suatu bahan bukan pelarut. Penghilangan bahan pelarut atau pelarut dari produk kemudian dilaksanakan dengan teknik peresapan, ekstraksi, atau penguapan.
Kontrol variabel proses meliputi sifat bahan seperti viskositas, homogenitas, dan konsentrasi bahan obat dan polimer, laju pengisian, metode atomisasi, dan laju pengeringan yang dikontrol oleh temperatur pemasukan dan pengeluaran.
f. Solvent evaporation
Pada metode ini, polimer dilarutkan dalam suatu pelarut yang mudah menguap, yang tidak bercampur dengan fase cairan pembawa. Bahan obat dilarutkan dan didispersikan dalam larutan polimer. Dengan pengocokan, campuran ini didispersikan dalam larutan polimer. Dengan pengocokan, campuran ini didispersikan dalam cairan pembawa untuk mendapatkan ukuran mikropartikel yang diinginkan. Campuran ini kemudian dipanaskan jika perlu untuk menguapkan pelarut dari polimer. Bila obat terdispersi dalam larutan polimer, maka polimer akan berkumpul dan mengelilingi bahan obat. Namun bila bahan obat terlarut dalam polimer, akan terbentuk mikropartikel dengan tipe matrik.
g. Polymerization
Polimerasi merupakan reaksi antar unit monomer pada permukaan antara bahan inti dan fase kontinyu pada bahan inti tersebut. Fase kontinyu bahan inti bisa berupa cairan atau gas. Reaksi polimerasi ini dapat terjadi pada permukaan cair-cair,cair-gas, atau padat gas.
h. Precipitation
Merupakan variasi dari solvent evaporation. Pertama dibuat emulsi dengan droplet polar terdispessi pada media non polar. Pelarut dipisahkan dari droplet dengan kosolven, sehingga terbentuk mikropartikel karena adanya endapan terbentuk dari suspensi.
i. Freeze Drying
Metode ini pembekuan emulsi. Pelarut pada fase kontinyu biasanya merupakan pelarut organik dan menghilangkan pelarutnya adalah dengan menyublimasinya pada suhu dan tekanan rendah. Akhirnya, pelarut pada fase dispersi akan berpindah dari sublimasi, meningkatkan partikel obat polimer.
j. Chemical and thermal cross linking
Mikropartikel dibuat dari polimer alam dengan proses cross-linking(sambung silang). Polimernya antara lain gelatin, albumin, amilum (starch) dan dextran. Dibuat emulsi dalam minyak dimana fase air adalah larutan polimer yang mengandung bahan obat untuk diinkorporasi. Fase minyak merupakan campuran pelarut organik-minyak yang berperan juga sebagai emulsifier. Kedua fase dicampur pada suhu tinggi kemudian ditambahkan glutaraldehid untuk membentuk mikropartikel stabil.
Nanopartikel
Manfaat nanoprikel dalam bidang farmasi adalah sebagai berikut:
1. Memungkinkan pengendalian pelepasan obat dan targetting obat.
2. Meningkatkan stabilitas obat.
3. Kemungkinan untuk memasukkan obat lipofilik dan hidrofilik.
4. Pembawa tidak biotoksis.
5. Menghindarkan pelarut organik.
6. Tidak bermasalah mengenai produksi dan sterilisasi skala besar.
Teknik yang digunakan untuk pembuatan nanopartikel pada umumnya diklasifikasikan dalam dua kelompok. Di dalam kelompok pertama, nanopartikel dibentuk dari pembentukan polimer awal. Polimer tersebut melingkupi kedua polimer sintetik tidak larut-air dan larut-air, semisintetik, atau alami. Alternatif lainnya, nanopartikel dibuat melalui bermacam-macam reaksi polimerisasi monomer lipofilik atau hidrofilik.
Terdapat dua metode dasar dalam pembuatan nanopartikel, yaitu metode emulsifikasi dan metode desolvasi. Pada metode emulsifikasi, larutan aqueous dari albumin dibuat menjadi bentuk emulsi dengan minyak nabati (cotton seed oil) pada suhu kamar. Kemudian dengan menggunakan homogenizer pada kecepatan tinggi, akan diperoleh emulsi yang homogen. Emulsi yang diperoleh kemudian ditambahkan ke dalam pre-heated oil (lebih dari 120 oC) setetes demi setetes. Kemudian suspensi yang diperoleh diletakkan dalam penangas es. Pada metode desolvasi, partikel di dalam cairan aqueous akan dibentuk melalui proses koaservasi lalu distabilkan dengan cross linking agent seperti glutaraldehid. Dasar metode ini adalah penggunaan faktor desolvasi seperti garam atau alkohol yang ditambahkan secara perlahan-lahan pada larutan protein. Dengan penambahan faktor tersebut, struktur tersier protein akan berubah. Apabila telah tercapai tingkat desolvasi tertentu, akan terbentuk gumpalan protein. Pada tahap selanjutnya akan terbentuk nanopartikel melalui proses polimerisasi sambung silang (cross lingkage) dengan faktor glutaraldehid.
BAB 2 PENUTUP 3.1 Kesimpulan
a) Sistem penghantaran obat tertarget merupakan suatu upaya untuk meningkatkan efektivitas obat dalam tubuh.
c) Komponen tubuh yang dijadikan sebagai target yatiu: protein, reseptor, kanal, gen, enzim, dan transporter.
DAFTAR PUSTAKA
• Funaro, Ada et al. 2000. Biotechnology Advances : Monoclonal antibodies and therapy of human cancers, 18 (385–401)
• Editor Hillery, Anya, Andrew WL, dan James S, 2005. Drug Delivery and Targeting. London: Taylor & Francis Group
• E. Trachsel, D. Neri. 2006 Advanced Drug Delivery Reviews : Antibodies for angiogenesis inhibition, vascular targeting and endothelial cell transcytosis. 58 (735– 754)
• Emantiko, Sulityo. 2001. Antibodi Rekombinan : Perkembangan Terbaru Dalam TeknologiAntibodi. Vol 9 No. 2 (29-43)
• http://www.drugbank.ca/drugs/DB00081 (diakses pada kamis 14 november 2013, pukul
16.50 WIB)
• Indrawati, Teti. 2009. Sistem Penghantaran Obat Peroral dengan Pelepasan Terkontrol Langsung ke Target. Jakarta.
•
http://www.authorstream.com/Presentation/raj54-1529137-antibodies-drug-delivery-targeted-system (diakses pada Rabu 13 November 2013, pukul 21.20 WIB)
• Mohanraj, VJ. and Y Chen. Tropical Journal of Pharmaceutical Research, Nanoparticles – A Review. June 2006; 5 (1): 561-573
• Hillary, Anya M. et al. 2001. Drug Delivery and Targetting. London: Taylor&Francis Inc