Pembuatan Asam Pikrat
Dian Tri Lestarini, Arya Maulana Ichsan, Mutiara Annisa
Departemen Kimia, Fakultas FMIPA, Univeritas Indonesia Kampus UI Depok, 16424, Depok, Jawa Barat, Indonesia
E-mail: dian.tri41@sci.ui.ac.id
Abstrak
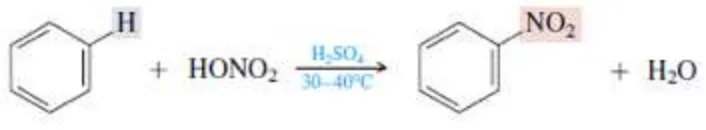
Percobaan ini bertujuan untuk mengetahui pembuatan asam pikrat dari fenol, asam nitrat dan asam sulfat, memahami konsep dasar substitusi elektrofilik aromatik senyawa asam pikrat dan mengetahui mekanisme reaksi sintesis asam pikrat. Asam pikrat diperoleh melalui reaksi nitrasi. Reaksi nitrasi merupakan reaksi yang melibatkan satu atau lebih kelompok nitro (-NO2) yang akan bereaksi membentuk suatu molekul. Dalam pembentukan asam pikrat, fenol direaksikan dengan H2SO4 (reaksi sulfonasi) membentuk asam p-fenolsulfonat (sebagai pelindung fenol). Kemudian direaksikan dengan HNO3 membentuk meta terhadap ion sulfonat dan ion NO2+ akan mensubstitusi ion sulfonat sehingga menghasilkan 2,4,6 -trinitrofenol. Dari hasil percobaan didapatkan % yield dan kesalahan relatif masing-masing sebesar 101,08% dan 1,08%.
Kata kunci : fenol, asam sulfat, sulfonasi, nitrasi, substitusi elektrofilik
Abstract
This experiment aims to determine synthesis of picric acid from phenol, nitric acid and sulphuric acid, knowing the concept of electrophilic substitution aromatic compound of picric acid and knowing mechanism reaction of picric acid. Picric acid is obtained through the nitration reaction. Nitration reaction is a reaction that involves one or more nitro groups (-NO2) which reacts to form a molecule. In the synthesis of picric acid, phenol was treated with H2SO4 (sulfonation reaction) to form p-phenolsulfonat acid (as protector of phenol). Then reacted with HNO3 to form meta side towards sulfonate ion and nitronium ion which will substitute sulfonate ion to produce 2,4,6-trinitrophenol. From the experimental results is obtained %yeild 101,08% and the relative errors 1,08%
Key words : phenol, sulphuric acid, nitric acid, sulfonation, nitration, electrophilic substitution
1. PENDAHULUAN
Asam pikrat adalah senyawa kimia yang bersifat eksplosif (mudah meledak), terbentuk karena reaksi antara fenol dan asam nitrat hingga menghasilkan 2,4,6-trinitrofenol (TNP). Asam pikrat berbentuk kristal berwarna kuning dan memiliki rasa pahit yang bersifat toksik dan larut dalam sebagian besar pelarut organik. Asam pikrat dapat menghasilkan ester, misalnya trinitroanisol dan trinitrofenetol. Asam pikrat juga dapat menghasilkan pikrati (garam dari asam pikrat) bila direaksikan dengan logam. Asam pikrat lebih sensitif dan berbahaya dibandingkan bentuk asamnya. Oleh karena itu, asam pikrat sebaiknya disimpan dalam botol kaca.
Kegunaan utama asam pikrat adalah sebagai bahan peledak dan juga telah digunakan dalam pengobatan (antiseptik, luka bakar), pewarna, dan sebagai bahan kimia. Asam pikrat lebih beracun daripada nitrolatki aromatik. Dosis mematikan tunggal untuk kelinci adalah sekitar 0,5 gram/1 kg berat makhluk hidup. Racun yang dihasilkan menumpuk di dalam tubuh, menembus kulit, rambut, kuku, gigi, dan air liur. Larutan encer asam pikrat (0,05%) dapat digunakan untuk membunuh banyak bakteri.
Gambar 2. Asam Pikrat
Dalam suhu 20oC kelarutan asam pikrat dalam air sedikit larut. Asam pikrat dapat larut baik dalam pelarut
organik terutama aseton (43 gr dalam 100 gr pada 25oC), metanol (21 gr dalam 100 gr pada 25oC). Sedangkan
sedikit larut dalam asam sulfat dan asam nitrat pada suhu kamar, namun kelarutan akan meningkat seiring dengan kenaikan temperatur. Ketika dipanaskan diatas titik leleh (122,5oC) asam pikrat akan menyublim. Asam pikrat
terdapat di alam dan relatif lebih stabil. 2. TINJAUAN PUSTAKA
Asam pikrat (2,4,6-trinitrofenol) adalah suatu turunan dan fenol. Reaksi pembentukan asam pikrat dari fenol tidak dapat diperoleh secara langsung dari asam nitrat dengan fenol, karena fenol terlalu sensitif terhadap reaksi oksidasi. Untuk memperoleh hasil baik, maka dalam prosesnya fenol harus terlebih dahulu dilakukan reaksi sulfonasi (reaksi dimana atom H pada gugus aromatik fenol akan disubstitusi oleh HSO3-)untuk pembentukkan
asam, 2,4-disulfonat dan kemudian ditambahkan asam nitrat untuk reaksi campurannya. Gugus asam sulfonat dapat melindungi fenol dan oksidasi dari asam nitrat. Kemudian gugus asam sulfonat tersebut akan pelan-pelan digantikan oleh gugus nitro (Harizon, 2011).
Prinsip reaksi pada pembuatan asam pikrat yaitu reaksi substitusi elektrofilik. Reaksi substitusi elektrofilik adalah penggantian gugus H+ pada cincin aromatis dengan suatu elektrofil (E+) yang merupakan spesi yang
kekurangan elektron. Pada reaksi ini gugus nitro (NO2+) merupakan elektrofil. Reaksi substitusi gugus H+ pada
benzena oleh gugus nitro disebut reaksi nitrasi.
Nitrasi merupakan salah satu reaksi yang penting disebabkan dua alasan, yang pertama karena proses yang paling utamanya adalah menyiapkan komponen aromatik nitro yang berperan penting dalam pembuatan beberapa pembuatan bahan kimia seperti, pembuatan solven, bahan obat-obatan, farmasi, bahan peledak, dan sebagai bahan intermediet untuk bahan baku pabrik;dan yang kedua karena merupakan salah satu bagian yang mengalami perkembangan sangat pesat dalam teori kimia organik (Hoggett, et al; 1971).
Ion Nitril, NO2+ (ion nitronium) dapat dibentuk melalui pencampuran asam nitrat dengan asam sulfat yang
dikenal sebagai asam campuran. Asam sulfat (H2SO4) disebut sebagai media penitrasi karena berguna sebagai tempat terionisasinya HNO3 menjadi ion nitril (NO2+). Ion NO2+ ini harus dibentuk terlebih dahulu dengan mencampurkan asam nitrat dan asam sulfat sehingga terbentuk ion NO2+ dan ion HSO4-. Ion NO2+yang terbentuk
kemudian menyerang benzena membentuk sigma kompleks, dan kemudian sigma kompleks ini memberikan atom H yang ada pada benzene kepada ion HSO4- yang terbentuk sebelumnya. Sehingga di akhir reaksi akan terbentuk
Gambar 3. Reaksi Nitrasi 3. METODE PERCOBAAN
3.1 Alat dan Bahan
Pada percobaan ini alat yang digunakan adalah labu bulat, kondensor/refluks, pemanas air (waterbath), (ice bath) dan corong Bucher. Sedangkan bahan yang digunakan adalah fenol, asam sulfat pekat, dan asam nitrat pekat.
3.2 Prosedur Pembuatan Asam Pikrat
Dalam pecobaan ini, hal pertama yang dilakukan adalah memasukan fenol 7,5gram ke dalam labu bulat, dan menambahkan asam sulfat pekat 20 ml, memanaskan campuran tersebut dalam pemanas air (waterbath) mendidih selama 0,5-1 jam disertai dengan pengocokan. Selanjutnya mengamati perubahan campuran menjadi semakin jernih, yaitu terbentuknya asam fenolsulfonat. Lalu campuran tersebut didinginkan dengan “ice-bath”, menambahkan dengan hati-hati asam nitrat pekat 22 ml, serta mengamati perubahan cairan menjadi semakin kental, kemudian segera melakukan pengocokan selama 1 – 2 menit yang nantinya akan terbentuk gas kemerahan (NOx) dan cairan akan menjadi merah. Memanaskan kembali campuran dalam pemanas air (waterbath) mendidih selama 2 jam, disertai dengan pengocokan. Selanjutnya menambahkan air sebanyak 50 mL, mendinginkan campuran tersebut dengan ice bath dan menyaring dengan penyaring Buchner. Kemudian memindahkan kristal yang diperoleh ke kaca arloji, me-rekristalisasikan dengan melarutkannya kembali dengan air : etanol (2:1) sampai tepat larut, kemudian mendinginkan kembali larutannya sampai terbentuk kristal kembali. Menentukan berat kristal yang diperoleh (titik leleh asam pikrat 122oC).
3.3 Penentuan Yield Reaksi dan Kesalahan Relatif
Yield ditentukan dengan rumus sesuai yang terdapat dalam buku kimia teknologi semester 6, dengan rumus sebagai berikut:
% ����� = ����� ���������/����� �������� � 100%
Sementara kesalahan relatif pada percobaan ini dapat ditentukan dengan menggunakan rumus berikut:
������h�� ������� = |����� ��������� − ����� ��������|
⁄
����� �������� � 100%
4. HASIL DAN PEMBAHASAN 4.1 Data Pengamatan
Gambar 4. Larutan sampel Gambar 5.Terbentuknya gas NOx Gambar 6. pendinginan dengan icebath
Gambar 7. Pembentukan asam pikrat Gambar 8. Pembentukan kristal Gambar 9. Penyaringan kristal
Gambar 10. Padatan asam pikrat 4.2 Perhitungan Teoritis
Massa fenol = 3,75 gr ρ HNO3 = 1,42 g/ ml V H2SO4 =10ml ρ H2SO4 =1,84g/ml
V HNO3 =11ml
Mr H2SO4 = 98 g/ mol
Mr HNO3 = 63 g/ mol
Mencari molaritas HNO3 (65 %) dan H2SO4 (97 %)
M = % x 10 x ρ / Mr
MH2SO4= (97% x 10 x 1,84 gr/ml) / 98 gr/mol = 18,21 mol/ml
Mencari mol HNO3 dan H2SO4
Mol HNO3 : MHNO3 × VHNO3 = 14,65 mol/ml× 11 ml = 161,16 mol ml
Mol H2SO4 : MH2SO4 × VH2SO4 = 18,21 mol/ml × 10 ml = 182,1 mol
HNO3 + H2SO4 → HSO4- + NO2+ + H2O
m : 161,16 mol 182,1 mol - - -
r : 161,16 mol 161,16 mol 161,16 mol 161,16 mol 161,16 mol
s : - 20,94 mol 161,16 mol 161,16 mol 161,16 mol Mencari Mol Fenol
Mol fenol = massa/Mr = 3,75 gr/ (94 gr/mol) = 0.039 mol
Fenol + 3NO2 → 2,4,6 -trinitrofenol
m : 0,04 mol161,16 mol
-r : 0,0133 mol 0,04 mol 0,0133 mol
s : 0,0266 mol 161,12 mol 0,0133 mol
Massa asam pikrat = mol x Mr = 0,0133 gr/ (229,1 gr/mol) = 3,047 gr 4.3 Perhitungan Secara Percobaan
Massa percobaan didapatkan setelah melakukakan penimbangan sebesar : (Bobot endapan + kertas saring) – bobot kertas saring kosong = 3,56 gr - 0,48 gr = 3,08 gram
4.4 Analisa Percobaan
kembali terbentuk setelah atom hidrogen yang berikatan dengan cincin benzena terlepas Percobaan diawali dengan mereaksikan asam sulfat pekat dengan fenol. Reaksi antara fenol dengan asam sulfat (sulfonasi) menghasilkan asam p-fenolsulfonat. Dalam reaksi tersebut asam sulfat bertindak sebagai pelindung fenol saat terjadi reaksi nitrasi. Dimana dengan penambahan asam sulfat pekat ini menghasilkan reaksi eksoterm. Reaksi eksoterm tersebut dikarenakan sifat dari asam sulfat yang higroskopis sehingga menghasilkan panas. Setelah ditambahkan asam sulfat larutan dipanaskan dalam waterbath selama 30 menit disertai dengan pengocokan. Hal tersebut bertujuan agar reaksi antara asam sulfat dengan fenol berlangsung cepat. Larutan yang terbentuk berwarna coklat muda. Untuk menghindari bumping dan memperoleh reaksi yang sempurna, larutan terebut didinginkan didalam ice bath. Selanjutnya larutan coklat muda tersebut ditambahkan asam nitrat. Pada saat penambahan asam nitrat harus perlahan-lahan agar tidak memercik, penambahan asam nitrat ini dilakukan di lemari asam dan didalam ice bath, hal ini dikarenakan ketika penambahan asam nitrat menghasilkan uap coklat yang terbentuk yaitu gas NOx dari reaksi antara asam p- fenolsulfonat dengan asam nitrat. Setelah itu dilakukan pemanasan di dalam waterbath selama 1 jam, hal ini bertujuan agar reaksi nitrasi antara asam p-fenolsulfonat dengan asam nitrat berlangsung cepat karena umumnya reaksi-reaksi organik berjalan lambat dan juga untuk mengeluarkan gas yang terbentuk dari penambahan HNO3 pekat. Selama proses tersebut didapatkan larutan yang berwarna kuning. Kemudian didinginkan ke dalam ice
bath untuk membentuk kristal. Lalu didapatkan kristal berwarna kuning keputih-putihan dan disaring dengan penyaring Buchner. Setelah tersaring kemudian dipindahkan ke dalam cawan/kaca arloji . Saat pemindahan kristal, ada kuantitas dari kristal yang masih menempel pada kertas saring. Oleh karena itu, digunakan larutan air : etanol (2:1) untuk membilas kristal agar secara kuantitas bersih dari kertas saring dan larutan ini dapat merekristalisasi sehingga terbentuk kristal kembali. Proses rekristalisasi untuk membentuk asam pikrat yang lebih murni. Kemudian kristal dikeringkan dan ditimbang. Diperoleh massa kristal sebesar 3,08 gram dan presentase yield sebesar 101,08%.
Mekanisme reaksi pembentukan asam pikrat sebagai berikut: Langkah 1. Pembentukan p-fenolsulfonat
Langkah 3. Pembentukan Asam Pikrat
4.5 Analisis Hasil
Massa asam pikrat yang diperoleh sebesar 3,08 gr 4.6 Presentase Yield dan Kesalahan Relatif % Yeild = (3,08 gr/ 3,047 gr) x 100% = 101,08%
Kesalahan relatif = | 3,047 gr - 3,08 gr|/ 3,047 gr x 100% = 1,08% 4.7 Analisa Kesalahan
Kesalahan dalam percobaan sehingga bisa menghasilkan 1,08% kesalahan disebabkan karena, praktikan kurang teliti saat melakukan penimbangan, pengukuran volume larutan dan kecerobohan saat memindahan kristal ke cawan setelah penyaringan. Ada kemungkinan kristal belum sepenuhnya masuk ke cawan dan masih tertinggal dalam penyaring.
5. KESIMPULAN
Pembentukan asam pikrat berdasarkan pada reaksi substitusi elektrofilik. Reaksi substitusi elektrofilik adalah penggantian gugus H+ pada cincin aromatis dengan suatu elektrofil (E+) yang merupakan spesi yang
kekurangan elektron. Sintesis asam pikrat dapat dilakukan dengan mereaksikan fenol dengan asam sulfat (sulfonasi) kemudian mereaksikan dengan asam nitrat (nitrasi) dimana H2SO4 bertindak sebagai katalis. Fenol berfungsi sebagai
bahan baku utama pembuatan asam pikrat. HNO3 pekat berperan sebagai pengkontribusi dalam pemberian ion
nitronium. H2SO4 berfungsi sebagai katalis dan pemberi suasana asam. Etanol berperan dalam menghilangkan
pengotor (rekristalisasi). Massa kristal yang diperoleh sebesar 3,08 gram dengan % KR = 1,08% dan % yield = 101,08%.
UCAPAN TERIMA KASIH
rekan kerja penulis, yaitu Arya Maulana Ichsan dan Mutiara Annisa yang sudah bekerja dengan baik. Selain itu, terima kasih pula untuk asisten laboratorium pada percobaan ini yaitu kak Nadia yang sudah membantu dan memberikan pengarahan sehingga praktikum ini dapat selesai dengan baik. Tak lupa, penulis mengucapkan terima kasih kepada orang-orang yang sudah berjasa yang telah membuat referensi di internet maupun di buku hingga laporan ini selesai. Penulis mohon maaf apabila laporan ini masih banyak kesalahan dan jauh dari kesempurnaan. DAFTAR PUSTAKA
Fessenden & Fessenden. 1982. Organic Chemistry 3rd Ed. Jakarta: Erlangga.
Hoggett, J.G; Moodie, R.B; Penton, J.R; and Schofield, K. 1971. Nitration and Aromatic Reactivity. Cambridge: University of Exeter.
Smith, Janice Gorzynski. 2011. Organic Chemistry 3rd ed.. Manoa : University of Hawai’i
Tim KBI Kimia Organik.2011.Penuntun Pratikum Sintesis Organik . Depok : Departemen kimia FMIPA Universitas Indonesia.
LAMPIRAN
MATERIAL SAFETY DATA SHEET (MSDS) 1. FENOL
Nama Lain : Benzenol Hidroksibenzen, fenil alcohol Rumus Molekul : C6H5OH
Toksisitas : Beracun dan sangat berbahaya, korosif
Stabilitas : Stabil, hindari dari oksidator kuat, mudah terbakar
Kelarutan : Larut dalam methanol, dietil eter, air dingin, aseton, benzene, alcohol, kloroform, gliserol, dan lainnya.
2. ASAM PIKRAT
Nama Lain : 2,4,6 -trinitrofenol Rumus Molekul : C6H2(NO3)3OH Data Fisik :
-
Cairan Kuning dan tidak berbau-
Titik Leleh : 122,5oC-
Titik Nyala : 150oC-
Densitas : 1,763 gr/mlToksisitas : Iritasi pada bagian yang menjalin kontak Stabilitas : Stabil dan reaktif terhadap logam 3. ASAM SULFAT
Nama Lain : Minyak vitriol Rumus Molekul : H2SO4
-
Cairan bening, tak berwarna, tak berbau-
Berat Molekul : 98,08 gr/mol-
Titik Leleh : 10oC-
Titik Didih : 290oC-
Berat Jenis : 1,84 gr/mlBahaya : Bila kontak dengan mata/kulit menyebabkan iritasi, rasa terbakar bahkan kebutaan, dan korosif
Stabilitas : Stabil
Kelarutan : Larut dalam air 4. ASAM NITRAT
Nama Lain : Asam Azotat Rumus Molekul : HNO3
Data Fisik :
-
Liquid tidak berwarna-
Berat Molekul : 63,01 gr/mol-
Titik Leleh : 42oC-
Titik Didih : 122oC-
Specific gravity : 1,41Bahaya : Korosif, dapat menyebabkan iritasi dan rasa terbakar pada kulit, mata dan saluran pernapasan
Stabilitas : Stabil