Wikipedia bahasa indonesia
Nitrogen (bahasa Latin: Nitrum, bahasa Yunani: Nitron berarti "soda asli", "gen", "pembentukan") secara resmi ditemukan oleh Daniel Rutherford pada 1772, yang menyebutnya udara beracun atau udara tetap. Pengetahuan bahwa terdapat pecahan udara yang tidak membantu dalam pembakaran telah diketahui oleh ahli kimia sejak akhir abad ke-18 lagi. Nitrogen juga dikaji pada masa yang lebih kurang sama oleh Carl Wilhelm Scheele, Henry Cavendish, dan Joseph Priestley, yang menyebutnya sebagai udara terbakar atau udara telah flogistat. Gas nitrogen adalah cukup lemas sehingga dinamakan oleh Antoine Lavoisier sebagai azote, daripada perkataan Yunani αζωτος yang bermaksud "tak bernyawa". Istilah tersebut telah menjadi nama kepada nitrogen dalam perkataan Perancis dan kemudiannya berkembang ke bahasa-bahasa lain. Senyawa nitrogen diketahui sejak Zaman Pertengahan Eropa. Ahli alkimia mengetahui asam nitrat sebagai aqua fortis. Campuran asam klorida dan asam nitrat dinamakan akua regia, yang diakui karena kemampuannya untuk
melarutkan emas. Kegunaan senyawa nitrogen dalam bidang pertanian, dan perusahaan pada awalnya ialah dalam bentuk kalium nitrat,terutama dalam penghasilan serbuk peledak (garam mesiu), dan kemudiannya, sebagai baja dan juga stok makanan ternak kimia.
Catatan pertama mengenai usaha pembentukan senyawa nitrogen sintetis pertama dilakukan oleh Priestley dan Cavendish yang melewatkan percikan bunga api listrik di dalam bejana berisi udara bebas, dan akhirnya mendapatkan nitrat setelah sebelumnya melarutkan oksida yang terbentuk dalam reaksi dengan alkali. Penemuan ini cukup besar di masanya, mengingat kebutuhan senyawa nitrogen untuk pupuk yang besar namun sayangnya alam tidak cukup untuk memenuhinya. Karena itu, adanya senyawa nitrogen yang dapat dibuat di dalam laboratorium memberikan peluang baru.
Namun usaha komersial dari proses ini tidak berjalan dengan mudah mengingat banyaknya kebutuhan energi yang besar, dan efisiensinya yang terlalu rendah. Setelah ini banyak proses terus dikembangkan untuk perbaikan. Nitrogen pernah juga diikatkan dari udara sebagai kalsium sianida, namun tetap saja proses ini masih terlalu mahal. Proses-proses lain juga tidak terlalu berbeda, seperti
pengolahan termal atas campuran oksida nitrogen (NOX), pembentukan sianida dari berbagai sumber nitrogen, pembentukan aluminium nitrida, dekomposisi amonia, dan sebagainya. Semuanya tidak menunjukkan harapan untuk dapat dikomersialkan walaupun secara teknis semua proses ini terbukti dapat
dilaksanakan.
Bukan peralatan tekanan tinggi saja yang akhirnya tercipta karena dipicu oleh tuntutan industri nitrogen ini. Haber, dan Bosch, ilmuwan lain yang bekerjasama dengan Haber, juga mengembangkan proses yang lebih efisien dalam usahanya menghasilkan hidrogen, dan nitrogen murni. Proses sebelumnya adalah dengan elektrolisis air untuk menghasilkan hidrogen murni, dan distilasi udara cair untuk mendapatkan nitrogen murni yang kedua usaha ini masih terlalu mahal untuk diaplikasikan dalam mengkomersialkan proses baru pembuatan amonia mereka. Maka mereka menciptakan proses lain yang lebih murah.
Usaha bersama mereka mencapai kesuksesan pada tahun 1913 ketika berhasil membentuk amonia pada tekanan tinggi. Proses baru ini masih memerlukan banyak energi namun pengembangan lebih lanjut terus dilakukan. Dengan cepat proses ini berkembang melebihi proses sintetis senyawa nitrogen lainnya, dan menjadi dominan sampai sekarang dengan perbaikan-perbaikan besar masih berlanjut.
http://bkv315a.blogspot.co.id/2012/09/makalah-nitrogen.html
Pada tahun 1772, Hanry Cavendish ( 1731 – 1810 ) mengemukakan bahwa komponen penyusun udara terbanyak adalah mephitic air. Dua tahun kemudian joseph priestley ( 1773 – 1804 ) menemuka komponen udara lain, yaitu apa yang disebutnya vital air.
Penemuan kedua ilmuan inggris di atas mendorong Antoine lourent Lavoisier ( 1743-1794 ) di prancis untuk melakukan eksperimen. Lavoisier memanaskan merkuri (raksa) dalam tabung tertutup . Ternyata merkuri bersenyawadengan seperlima bagian udara, membentuk suatu serbuk merah (yg sekarang di sebut merkuri oksida). Empat perlima bagian sisa udara tetap berupa gas. Lavoisier mengamati bahwa dalam gas sisa itu lilin tak dapat menyala serta tikus tak dapat hidup lama.
Maka, lavoisier menyimpulkan bahwa udara tersusun dari dua jenis gas. Jenis gas yang pertama sangatberguna bagi kehidupan dan pembakaran dan jumlahnya meliputi seperlima bagian udara. Inilah vital air yang di kemukakan oleh
Priestley. Gas Vital air ini oleh Lavoisier diberi namaoksigen.
Adapun jenis gas yang kedua, yang meliputi empat perlima bagian
udara,merupakan gas mephitik air yang ditemukan ole( h cavendish. Lavoisier sendiri memberi nama azote (dalam bahasa yunani) yang berarti” tiada
Simbol: N Nomor atom: 7
Massa atom: 14,0067 u ± 0,0001 u Titik lebur: -210 °C
Titik didih: -195,8 °C
Konfigurasi elektron: 1s22s22p3 Penemu: Daniel Rutherford
Unsur-unsur kimia adalah elemen penyusun segala sesuatu di alam semesta, unsur-unsur tersebut seperti Oksigen (O), Nitrogen (N), besi (Fe), emas (Au) dan lain sebagainya. Terkadang unsur-unsur tersebut ditemukan dalam keadaan murni namun juga terkadang ditemukan dalam bentuk persenyawaan. Dalam pembahasan kali ini akan terfokus pada Nitrogen. Atmosfer tersusun atas berbagai unsur dan 78% adalah nitrogen. nitrogen dianggap sebagai elemen inert karena gas nitrogen biasanya tidak berinteraksi dengan zat lain. Atom nitrogen sangat reaktif, karenanya nitrogen tidak pernah ditemukan sendiri. Dalam keadaan murni, 2 atom Nitrogen berikatan agar mencapai kestabilan. Pasangan atom ini disebut molekul diatomik. Nitrogen ddalam udara tersusun darai molekul-molekul diatomik.
Nitrogen atau zat lemas adalah unsur kimia dalam tabel periodik yang memiliki lambang N dan nomor atom 7. Ini adalah pniktogen paling ringan pada temperatur kamar. Biasanya ditemukan sebagai gas tanpa warna, tanpa bau, tanpa rasa, dan merupakan gas diatomik, sangat sulit bereaksi dengan unsur atau senyawa lainnya. Dinamakan zat lemas karena zat ini bersifat malas, tidak aktif bereaksi dengan unsur lainnya. Nitrogen merupakan unsur umum di alam semesta, diperkirakan merupakan unsur ketujuh dari total kelimpahan di Bima Sakti dan Tata Surya.
Nitrogen sangat penting bagi kehidupan di Bumi. Ini adalah komponen dari semua protein dan dapat ditemukan di semua sistem kehidupan. senyawa nitrogen yang hadir dalam bahan organik, makanan, pupuk, bahan peledak dan racun. Nitrogen sangat penting untuk kehidupan, tetapi lebih juga bisa berbahaya bagi lingkungan.
Dalam bentuk gas, nitrogen adalah tidak berwarna, tidak berbau dan umumnya dianggap sebagai inert. Dalam bentuk cair, nitrogen juga berwarna dan tidak berbau, dan tampak mirip dengan air, menurut Los Alamos.
Nitrogen merupakan unsur alami yang penting bagi pertumbuhan dan reproduksi baik tumbuhan dan hewan. Hal ini ditemukan dalam asam amino yang membentuk protein, asam nukleat, yang terdiri dari materi herediter dan cetak biru hidup untuk semua sel, dan dalam banyak senyawa organik dan anorganik lainnya.
Nitrogen merupakan komponen penyusun asam amino dan urea. Asam amino adalah komponen penting dari semua protein. Protein terdiri tidak hanya komponen struktural seperti otot, jaringan dan organ, tetapi juga enzim dan hormon yang penting untuk semua makhluk hidup. Urea adalah produk sampingan dari pencernaan protein. Nitrogen dalam protein dan urea adalah nitrogen organik. nitrogen organik dapat memasukkan sistem septik sebagai limbah tubuh, bahan makanan dibuang, atau sebagai komponen agen pembersih.
persen amonia yang dihasilkan digunakan sebagai pupuk, dan juga digunakan sebagai gas pendingin; dalam pembuatan plastik, tekstil, pestisida, pewarna; dan dalam membersihkan larutan.
Catatan pertama mengenai usaha pembentukan senyawa nitrogen sintetis pertama dilakukan oleh Priestley dan Cavendishyang melewatkan percikan bunga api listrik di dalam bejana berisi udara bebas, dan akhirnya mendapatkan nitrat setelah sebelumnya melarutkan oksida yang terbentuk dalam reaksi dengan alkali. Penemuan ini cukup besar di masanya, mengingat kebutuhan senyawa nitrogen untuk pupuk yang besar namun sayangnya alam tidak cukup untuk memenuhinya. Karena itu, adanya senyawa nitrogen yang dapat dibuat di dalam laboratorium memberikan peluang baru.
Namun usaha komersial dari proses ini tidak berjalan dengan mudah mengingat banyaknya kebutuhan energi yang besar, dan efisiensinya yang terlalu rendah. Setelah ini banyak proses terus dikembangkan untuk perbaikan. Nitrogen pernah juga diikatkan dari udara sebagai kalsium sianida, namun tetap saja proses ini masih terlalu mahal. Proses-proses lain juga tidak terlalu berbeda, seperti pengolahan termal atas campuran oksida nitrogen (NOX), pembentukan sianida dari berbagai sumber nitrogen, pembentukan aluminium nitrida, dekomposisi amonia, dan sebagainya. Semuanya tidak menunjukkan harapan untuk dapat dikomersialkan walaupun secara teknis semua proses ini terbukti dapat dilaksanakan.
Sampai akhirnya Haber dan Nernst melakukan penelitian yang menyeluruh tentang keseimbangan antara nitogen, danhidrogen di bawah tekanan sehingga membentuk amonia. Dari penelitian ini pula didapatkan beberapa katalis yang sesuai. Reaksi ini sebenarnya membutuhkan tekanan sistem yang tinggi, tetapi pada masa itu peralatan yang memadai belum ada, dan mereka merancang peralatan baru untuk reaksi tekanan tinggi (salah satu sumbangan dari perkembangan industri baru ini).
Bukan peralatan tekanan tinggi saja yang akhirnya tercipta karena dipicu oleh tuntutan industri nitrogen ini. Haber, danBosch, ilmuwan lain yang bekerjasama dengan Haber, juga mengembangkan proses yang lebih efisien dalam usahanya menghasilkan hidrogen, dan nitrogen murni. Proses sebelumnya adalah dengan elektrolisis air untuk menghasilkan hidrogen murni, dan distilasi udara cair untuk mendapatkan nitrogen murni yang kedua usaha ini masih terlalu mahal untuk diaplikasikan dalam mengkomersialkan proses baru pembuatan amonia mereka. Maka mereka menciptakan proses lain yang lebih murah.
Usaha bersama mereka mencapai kesuksesan pada tahun 1913 ketika berhasil membentuk amonia pada tekanan tinggi. Proses baru ini masih memerlukan banyak energi namun pengembangan lebih lanjut terus dilakukan. Dengan cepat proses ini berkembang melebihi proses sintetis senyawa nitrogen lainnya, dan menjadi dominan sampai sekarang dengan perbaikan-perbaikan besar masih berlanjut.
ISOTOP
Isotop menyebabkan elemen memiliki perbedaan sifat nuklir. Namun selama isotopnya stabil, sifat nuklir tidak berpengaruh pada kehidupan.ada perbedaan masa dari isotop-isotop tersebut dan ini akan berdampak pada fraksinasi isotop. Ketika suhu dinaikan, semua isotop rata-rata memiliki energi yang sama dengan elemennya. Sejak E = ½ m v2 , isotop dengan masa yang lebih berat akan mempunyai v lebih kecil, dan akan bergerak lebih lambat dibanding cahaya isotop.
dihasilkan dari nitrogen atmosfer dengan komposisi 0 ± 3 ‰ dan pupuk kandang dengan nilai-nilai nitrat d 15N umumnya di kisaran 10 hingga + 25 ‰; sumber Nitrogen dari bebatuan umumnya dianggap diabaikan. Kedua isotop ini digunakan dalam berbagai aplikasi. N-15 digunakan untuk produksi radioisotop O-15 yang digunakan dalam PET. N-15 juga digunakan untuk mempelajari penyerapan Nitrogen pada tanaman dan metabolisme protein dalam tubuh manusia. N-14 digunakan untuk produksi PET radioisotop C-11. Hal ini juga dapat digunakan untuk produksi PET radioisotop N-13 dan O-15.
Isotop alami
Tabel ini menunjukkan informasi tentang yang terjadi secara alami isotop, massa atom mereka, kelimpahan alami mereka, spin nuklir mereka, dan momen magnetik mereka. Data lebih lanjut untuk radioisotop (isotop radioaktif) nitrogen tercantum (termasuk yang terjadi secara alami) di bawah ini.
Isotope Mass / Da Atom % Spin (l) Momen Magnetik
(μ/μN)
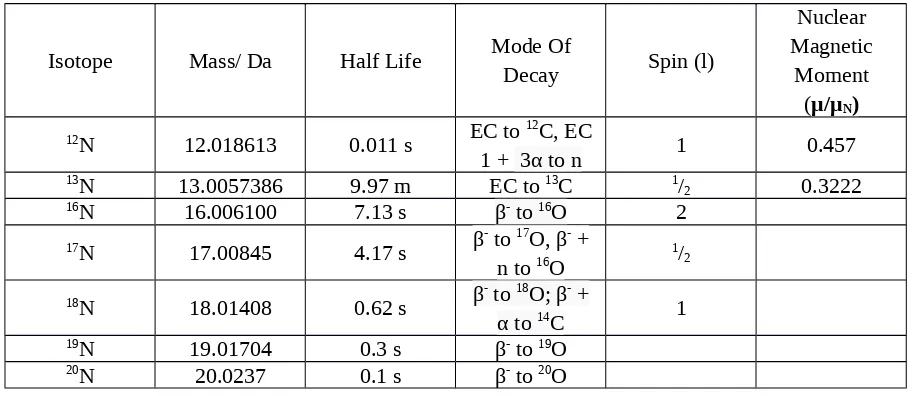
Tabel ini memberikan informasi tentang beberapa radiosotopes nitrogen, massa, waktu paruh, mode pembusukan, spin nuklir, dan momen magnetik nuklir
Isotope Mass/ Da Half Life Mode Of
Spin (l) 1 ½ Frequensi relatif untuk iH =
100 (MHz) 7.226317 10.136767
Reseptivitas,DP, relatif untuk
1H = 1.00 0.00100 0.00000384
Reseptivitas, DC, relatif untuk
13C = 1.00 5.90 0.0225
Rasio Magnetik (γ
(107 rad T-1 s-1)) 1.9337792 -2.71261804
Nitrogen dapat digunakan dalam bentuk unsur maupun senyawanya. Sebagai unsur, nitrogen terdapat dalam bentuk gas nitrogen (N2). Gas nitrogen ini bersifat inert (tidak reaktif) dan dapat digunakan dalam industri farmasi untuk mengusir O2 dalam larutan injeksi. Nitrogen juga digunakan untuk mengusir O2 dalam makanan berlemak atau berminyak agar tidak cepat tengik, ditambahkan dalam roti agar tidak cepat berjamur, serta digunakan untuk mengisi bola lampu.
Nitrogen dalam bentuk senyawa juga sering digunakan dalam kehidupan sehari-hari, senyawa-senyawa tersebut diantaranya amonia, ammonium nitrat, amonium sulfat, amonium fosfat, urea, dan asam nitrat. Amonia sering digunakan sebagai pereaksi dan bahan baku pembuatan pupuk nitrigen, seperti amonium nitrat, amonium sulfat, amonium fosfat, dan pupuk urea.
Peranan nitrogen dalam perindustrian relatif besar, dan industri yang menggunakan unsur dasar nitrogen sebagai bahan baku utamanya disebut pula sebagai industri nitrogen. Nitrogen yang berasal dari udara merupakan komponen utama dalam pembuatan pupuk dan telah banyak membantu intensifikasi produksi bahan makanan di seluruh dunia. Pengembangan proses fiksasi nitrogen telah berhasil memperjelas berbagai asas proses kimia, dan proses tekanan tinggi serta telah menyumbang banyak perkembangan di bidang teknik kimia.
Sebelum adanya proses fiksasi (pengikatan) nitrogen secara sintetik, sumber utama nitogen untuk keperluan pertanian hanyalah bahan limbah, dan kotoran hewan, hasil dekomposisi dari bahan-bahan tersebut serta amonium sulfat yang didapatkan dari hasil sampingan pembuatan kokas dari batubara. Bahan-bahan seperti ini tidak mudah ditangani belum lagi jumlahnya yang tidak mencukupi semua kebutuhan yang diperlukan.
Salpeter Chili, salpeter dari air kencing hewan, dan manusia, dan amonia yang dikumpulkan dari pembuatan kokas menjadi penting belakangan ini tetapi akhirnya disisihkan lagi oleh amonia sintetik, dan nitrat. Amonia merupakan bahan dasar bagi pembuatan hampir semua jenis produk yang memakai nitrogen.
Dari semua macam senyawa nitrogen, amonia adalah senyawa nitogen yang paling penting. Amonia merupakan salah satu senyawa dasar nitogen yang dapat direaksikan dengan berbagai senyawa yang berbeda selain proses pembuatan amonia yang sudah terbukti ekonomis, dan efisiensinya yang sampai sekarang terus ditingkatkan. Sebagian besar amonia diperoleh dengan cara pembuatan sintetis di pabrik, dan sebagian kecilnya diperoleh dari hasil samping suatu reaksi.
Penggunaan gas amonia bermacam-macam ada yang langsung digunakan sebagai pupuk,
pembuatan pulp untuk kertas, pembuatan garam nitrat dan asam nitrat, berbagai jenisbahan peledak, pembuatan senyawa nitro dan berbagai jenis refrigeran. Dari gas ini juga dapat
Gas amonia banyak juga yang langsung digunakan sebagai pupuk, namun jumlahnya masih terlalu kecil untuk menghasilkan jumlah panen yang maksimum. Maka dari itu diciptakan pupuk campuran, yaitu pupuk yang mengandung tiga unsur penting untuk tumbuhan (N + P2O5 + K2O). Pemakaian yang intensif diharapkan akan menguntungkan semua pihak.
Amonium nitrat atau dengan sebutan NH4NO3 (ammonium nitrate) dapat dibuat dengan amonia, dan asam nitrat sebagai bahan bakunya. proses pembuatan amonium nitrat pun ada beberapa macam antara lain : 1. Proses Priling 2. Proses Kristalisasi, dan 3. Proses Stengel atau Granulasi. Dari ke-tiga tahap tersebut, adalah proses kristalisasilah yang paling mudah; prosesnya; bahan baku amonia, dan asam nitrat masuk ke reaktor dengan bentuk fasenya adalah amonia masih berupa gas, dan asam nitrat telah berupa fase liquid. dari reaktor semua bahan baku tersebut di lanjutkan ke evaporator lalu dikristalizer, dan akhirnya di separator, dan jadilah amonium nitrat. Amonium nitrat digunakan sebagai pupuk nitrogen dengan kadar N 33%. Proses pembuatannya cukup murah dan sederhana. Selain sebagai pupuk, amonium nitrat juga digunakan sebagai bahan peledak yang sangat dibutuhkan dalam pertambangan.
Amonium sulfat juga digunakan sebagai pupuk nitrogen. Kelebihans enyawa ini yaitu tidak muah menggumpal,
Amonium fosfat merupakan pupuk sumber nitrogen dengan kadar N yang tinggi sekitar 46%. Urea dapat digunakan sebagai makanan tambahan untuk hewan pemamah iak, bahan tambahan dalam industri plastik melmain, resin, dan sebagai bahan anti kerut pada tekstil.
Asam nitrat digunakan sebagai pelarut dan digunakan dalam proses fotografi.
Sutresna, Nana.2007.Cerdas Belajar Kimia.Bandung: Grafindo Media Pratama
Nitrogen memiliki peranan penting dalam pembentukan sel, jaringan, dan organ tanaman. Nitrigen merupakan bahan baku klorofil, protein, dana sam amino. Karena itu dibutuhkan dalam jumlah besar, terutama saat pertumbuhan vegetatif. Bersama fosfor, nitrogen mengatur pertumbuhan arabicum secara keseluruhan.
Ada dua bentuk nitrogen yakni amonium dan nitrat. Nitrogen dalam bentuk amonium hanya
dibutuhkan dalam jumlah kecil (tidak lebih dari 25% dari total konsentrasi nitrogen) karena sifatnya mengikat zat pati sehingga mengurangi pasokan bagi tanaman. Sementara itu, nitrogen dalam bentuk nitrat sebaiknya tersedia dalam jumlah yang cukup karena nitrat membantu sel-sel tanaman tumbuh kompak dan kuat sehingga lebih tahan penyakit.
Nitrogen cair digunakan sebagai pembeku, seperti makanan, material yang terbuat dari karet, dan bahan-bahan biologi. Gas N2 digunakan sebagai gas pelindung, bertujuan untuk mencegah material kontak dengan oksigen selama pemrosesan atau penyimpanan. Oleh karena itu, komponen elektronik sering diprodukdi dalam komonen bernitrogen.
Amonia, NH3, merupakan senyawa komersial yang snagat pentingdari nitrogen. Amonia adalah gas
tidak berwarna dan berbau menyengat. Amonia dibuat secara komersial melalui proses Haber dari N2
dan H2. Amonia mudah dicairkan dan cairannya digunakan sebagai pupuk nitrogen. Garam amonium,
Asam nitrat, HNO3 adalaha asam yang penting bagi industri dan digunakan untuk bahan peledak,
nilon, dan plastik poliuretan. Asam nitrat dibuat secara komersial melalui proses Ostwald. Dalam proses Ostwald, asam nitrat dibuat dari oksidasi amonia. Proses secara umum, amonia dibakar dengan adanya katalis platina menjadi gas NO dan diubah lebih lanjut menjadi NO2. Kemudian dilarutkan
dalam air menjadi asam nitrat. Gas NO pada tahap akhir dapat digunakan kembali.
Sunarya, Yayan dan Agus Setiabudi.2007.Mudah dan Aktif Belajar Kimia.Bandung : PT. Setia Purna Inves
Nitrogen dalam Sekresi Tubuh
Nitrogen juga digunakan dalam proses sekresi tubuh untuk menjaga keseimbangan dan kestabilan tubuh. Tubulus ginjal dapat mensekresi atau menambah zat-zat ke dalam cairan. Filtrasiselama metabolisme sel-sel membentuk asam dalam jumlah besar. Namun, pH darah dan cairan tubuh dapat dipertahankan sekitar 7,4 (alkalis). Sel tubuh membentuk amonia yang bersenyawa dengan
asam kemudian disekresi sebagai amonium supaya pH darah dan cairan tubuh tetap alkalis, netral, dan seimbang.
Nitrogen bagi Pertumbuhan Tanaman
Nitrogen merupakan elemen hara yang penting bagi pertumbuhan tanaman. Sumber utama Nitrogen di dalam tanah yaitu bahan organik tanah. Selain dari bahan organik tanah Nitrogen juga diperoleh dari gas N2 di atmosfer melalui penambatan atau fiksasi Nitrogen. Penambatan alami disebabkan oleh jasad-jasad renik (terutama bakteri dalam tanah dan alga di air) dan gejala atmosfer tertentu, termasuk kilat.
Bentuk Nitrogen yang dapat digunakan oleh tanaman adalah ion nitrat (NO3-) dan ion amonium (NH4+). Ion-ion ini kemudian membentuk material kompleks seperti asam amino dan asam-asam nukleat yang dapat langsung diserap dan digunakan oleh tanaman tingkat tinggi. Menurut Mengel dan Kirby (1987) dalam Rosmarkam dan Yuwono (2002) pada pH tanah yang rendah ion nitrat lebih cepat diserap oleh tanaman dibandingkan ion amonium, pada pH tanah yang tinggi ion Amonium diserap oleh tanaman lebih cepat dibandingkan ion nitrat dan pada pH netral kemungkinan penyerapan keduanya berlangsung seimbang.
Fungsi Nitrogen bagi pertumbuhan tanaman adalah memperbaiki pertumbuhan vegetatif tanaman. Tanaman yang tumbuh pada tanah yang cukup N, berwarna lebih hijau. Selain itu Nitrogen berfungsi dalam pembentukan protein.
Kekurangan nitrogen dapat menyebabkan daun tanaman berwarna hijau pucat dengan tulang daun berwarna keunguan. Sedangkan kelebihan jitrigen dapat meyebabkan daun tanaman menjadi berwarna hijau tua dan rimbun dengan sosok tanaman bongsor tetapi rentan terserang penyakit.
Arwida, Shintia Dian.2008.Adenium Arabicum.Jakarta: Gramedia Pustaka Utama
Unsur nitrogen sebagai pupuk misalnya pupuk urea, pupuk ZA, pupuk amonia, pupuk amonium nitrat dan pupuk kalium nitrat.
Selain digunakan sebagai pupuk, nitrogen juga digunakan sebagai bahan baku pembuatan amonia pada skala industri. Amonia digunakan sebagai bahan pengawet dalam makanan kemasan untuk memeprpanjang masa penggunaan dan sebagai bahan pendingin.
SIFAT dan SENYAWA NITROGEN
A. SIFAT FISIK DAN KIMIA.
Ditemukkan oleh Daniel Rutherfrrod pada tahun 1772 Mempunyai massa atom 14,0067 sma
Mempunyai nomor atom 7 Titik didih -196 0 C Titik beku -210 0 C
Mempunyai jari-jari atom 0,92 0A
Mempunyai Konfigurasi [He 2] s 2 2 p 3
Dalam senyawa memiliki bilangan oksidasi -3, +5, +4, dan +2. Mempunyai volume atom 17,30 cm3 / mol
Mempunyai struktur heksagonal
Mempunyai massa jenis 1,2151 gram/cm 3 Mempunyai kapasitas panas 1,042 J/gK Mempunyai potensial ionisasi 14,534 Volt
Mempunyai energi ionisasi k-1 = 1402,3 kJ/mol k-2 = 2856 kJ/mol k-3 = 45781 kJ/mol Mempunyai nilai elektronegativitas 3,04
Mempunyai konduktivitas kalor 0,02598 W/mK Mempunyai harga entalpi pembentukan 0,36 kJ/mol Mempunyai harga bentalpi penguapaan 2,7928kJ/mol
Berupa gas tidak berwarna, tidak berasa, tidak berbau, dan tidak beracun. Mudah menguap
Tidak reaktif
Bersifat diamagnetik
Elektronegatifannya paling tinggi dalam satu golongan 3 B. SENYAWAAN NITROGEN
Nitrida ( senyawa metal nitrogen ), Nitrida Hidrida ( NH3, garam amonium, hidrasin N2H4, hidroksilamin NH2OH ), Oksida nitrogen ( N2O, NO, NO2, N2O5 ), Ion nitronium ( NO2+ ), Asam nitrit
Hidrida utama nitrogen ialah amonia (NH3) walaupun hidrazina (N2H4) juga banyak
ditemukan. Amonia bersifat basa dan terlarut sebagian dalam air membentuk ion ammonium (NH4+). Amonia cair sebenarnya sedikit amfiprotik dan membentuk ion ammonium dan amida (NH2-); keduanya dikenal sebagai garam amida dan nitrida (N3-), tetapi terurai dalam air. Gugus bebas amonia dengan atom hidrogen tunggal atau ganda dinamakan amina. Rantai, cincin atau struktur hidrida nitrogen yang lebih besar juga diketahui tetapi tak stabil.
1) Amonia
Amonia umumnya bersifat basa (pKb=4.75), namun dapat juga bertindak sebagai asam yang amat lemah (pKa=9.25). NH3 merupakan molekul polar, berbentuk piramid dengan tiga atom hidrogen menempati dasar piramid dan memiliki sepasang elektron bebas pada puncaknya (atom N), menyebabkan senyawa ini mudah terkondensasi (suhu kondensasi -33oC) menjadi cairan dengan kekuatan besar sebagai pelarut. Dalam banyak hal, ammonia cair merupakan pelarut yang mirip dengan air dan mampu melarutkan berbagai macam garam. Selain itu, ammonia mempunyai sifat yang unik dalam hal melarutkan logam-logam alkali dan alkali tanah, yakni menghasilkan larutan yang mengandung elektron tersolvasi. Gas ammonia sangat larut dalam air, karena baik NH3 maupun H2O adalah molekul-molekul polar. Senyawa nitrogen yang utama adalah ammonia, NH3, yang terdapat di atmosfir dalam jumlah yang sangat sedikit, terutama sebagai produk peruraian bahan yang mengandung nitrogen dari hewan dan tumbuhan. Proses ini merupakan cara yang paling ekonomis untuk fiksasi nitrogen, yakni konversi nitrogen di atmosfir menjadi senyawa yang berguna. Pada proses Haber, ammonia disintesis dengan cara melewatkan campuran nitrogen dan hidrogen di atas permukaan katalisator (umumnya besi oksida) pada suhu 500oC dan tekanan 1000 atm, yang rata-rata dapat mengkonversi 50% N2 menjadi NH3. N2(g) + 3H2(g) => 2NH3(g) + 22 kkal. Kegunaan Amonia yaitu sebagai pupuk (kompos maupun urea), Disinfectan, Bahan bakar, Pelarut senyawa organik, anorganik, dan logam, Bahan pembuatan asam nitrat (www.wikipedia.org)
2) Asam Nitrat
≈ 60% (berat) dan konsentrasi-nya dapat dinaikkan menjadi 68% dengan cara destilasi, proses ini dikenal dengan proses Oswald.
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g)
2 NO(g) + O2(g) → 2 NO2(g)
3 NO2(g) + H2O(l) → 2 H+(aq) + 2 NO3-(aq) + NO(g)
Pada tahap pertama, campuran NH3 dan udara dilewatkan melalui kumparan platina yang dipanaskan pada temperatur 800 °C. Pada pendinginan, produk nitrogen oksida (NO) dioksidasi menjadi nitrogen dioksida (NO2), yang kemudian mengalami disproporsionasi dalam larutan membentuk asam nitrat dan NO. Dengan cara memberikan konsentrasi O2 yang cukup tinggi, NO sisa akan diubah menjadi NO2 dan reaksi terakhir akan bergeser ke arah kanan. Untuk mendapatkan asam 100% dilakukan destilasi HNO3 yang volatil. Asam nitrat murni dapat dibuat di laboratorium dengan cara
menambahkan H2SO4 ke KNO3 dan mendestilasi hasil reaksi in vacuo. Asam nitrat adalah cairan tak berwarna, tetapi harus disimpan dibawah temperatur 273 K untuk mencegah dekomposisi yang menyebabkan asam berwarna kuning
4 HNO3→ 4 NO2 + 2 H2O + O2.
Dalam larutan aqueous, HNO3 bertindak sebagai suatu asam kuat yang menyerang kebanyakan logam-logam (yang sering terjadi lebih cepat jika terdapat HNO2 dalam jumlah trace), kecuali emas (Au) dan logam-logam golongan platinum; dimana 11 besi (Fe) dan krom (Cr) mengalami passivasi
oleh HNO3 (semacam lapisan film tipis sehingga logam-logam ini tidak bisa diserang). Bila timah, arsen dan beberapa logam-logam golongan-d direaksikan dengan HNO3, maka akan dihasilkan oksida-oksida logam-logam tersebut, tetapi jika HNO3 direaksikan dengan logam-logam lain akan dihasilkan nitrat-nitrat. Hanya Mg, Mn, dan Zn yang menghasilkan gas hidrogen jika direaksikan dengan HNO3 dengan konsentrasi sangat encer. Jika logam tersebut merupakan reduktor yang lebih kuat daripada H2, maka reaksi dengan HNO3 akan mereduksi asam menjadi N2, NH3.NH2OH atau N2O, sedangkan logam lain akan menghasilkan NO atau NO2
3 Cu(s) + 8 HNO3(aq, encer) → 3 Cu(NO3)2(aq) + 4 H2O(l) + 2 NO(g)
Cu(s) + 4 HNO3(aq, pekat) → Cu(NO3)2(aq) + 2 H2O(l) + 2 NO2(g)
(www.wikipedia.org) 3) Nitrida
sangat reaktif dan bereaksi dengan air membebaskan ammonia. Tetapi TiN sangat inert dan digunakan sebagai bahan pembuatan wadah reaksi suhu tinggi. Senyawa nitrogen tri-iodida (NI3) dimasukkan kategori senyawa nitrogen dengan bilangan oksidasi -3, karena nitrogen lebih elektronegatif daripada iodium. Pada suhu kamar, NI3 adalah zat padat yang sangat mudah meledak, bahkan seekor lalat yang hinggap di atasnya dapat menyebabkan timbulnya ledakan.
4) Azida
Natrium azida dapat diperoleh dari reaksi :
3 NaNH2 + NaNO3 NaN3 + 3 NaOH + NH3
Azida-azida logam berat mudah meledak, misalnya timbal atau air raksa azida, telah digunakan dalam sumbat bahan peledak. Asam azida murni, HN3, adalah cairan yang mudah meledak dan berbahaya (www.wikipedia.org).
5) Hidrazin
Hidrasin, N2H4, dapat dianggap sebagai turunan dari ammonia dengan penggantian satu atom hidrogen oleh gugus NH2. Hidrasin adalah basa difungsi
N2H4(aq) + H2O = N2H5+ + OH- K25 = 8,5 x 10-7
N2H5+(aq) + H2O = N2H62+ + OH- K25 = 8,9 x 10-15
Dan dua deretan garam hidrasium dapat diperoleh. Garam N2H5+ dapat diperoleh dengan kristalisasi dari larutan aqua yang mengandung banyak kelebihan asam, karena garam ini biasanya kurang larut dibanding garam-garam monoasam. N2H4 anhidrat adalah cairan berasap dan tidak berwarna (titik didih 114oC) dan stabil ditinjau dari sifat endotermisnya (ΔHof = 50 kJ mol-1), dapat terbakar di udara dengan membebaskan panas
N2H4(l) + O2(g) = N2(g) + 2 H2O(l0 ΔHo = -622 kJ mol-1
Hidrasin aqua adalah suatu reduktor kuat dalam larutan basa, dalam keadaan normal dapat teroksidasi menjadi nitrogen. Hidrasin dibuat dengan interaksi larutan ammonia dengan natrium hipoklorit
NH3 + NaOCl → NaOH + NH2Cl (cepat)
NH3 + NH2Cl + NaOH → N2H4 + NaCl + H2O
Tetapi dalam hal ini terjadi persaingan reaksi yang agak cepat segera setelah hidrasin terbentuk
2 NH2Cl + N2H4 → 2 NH4Cl + N2