111.1. Tempat dan Waktu
Penelitian dilakukan di Laboratorium Kimia dan Biokimia Pangan Pusat Antar Universitas (PAU) Pangan dan Gizi - lnstitut Pertanian Bogor (IPB) serta Laboratorium Kimia Pangan Jurusan Teknologi Pangan dan Gizi, Fakultas Tek- nologi Pertanian
-
IPB. Penelitian berlangsung dari bulan April 1995 hingga bulan April 1 997.111.2. Bahan dan Alat
111.2.1. BahanBahan baku yang digunakan dalam penelitian adalah minyak ikan tuna (tuna precook
oil)
dan minyak kelapa sawit kasar (Crude Palm Oil / CPO). Minyak ikan tuna segar diperoleh dari PT Aneka Tuna, Gempol Pasunran-
Jatim, sedangkan CPO diperoleh dari PT Sawit Malinda / PTP I, Lubuk Pakam-
Sumut. Pada minyak ikan tuna ditambahkan formula antioksidan 0.1% a-toko- ferol,0.02%
asam askorbat, 0.02% asam sitrat dan 0.2% lesitin kedelai (bibminyak ikan).
Kedua jenis minyak dikernas dalam wadah tidak tembus cahaya. Setibanya di laboratorium, minyak segera disimpan dalam lemari pembeku
47 adsorber bentonit 40% (bib), yang dipanaskan pada suhu 60-70°C selama 20 menit.
Enzim lipase yang digunakan adalah lipase mikrobial komersial, yakni lipase Rhizomucor miehei imobil (Lipozyme-IM) dan lipase Candida antartica (Novozym-435), keduanya merupakan sumbangan dari Novo Nordisk Bioi n- dustrial Ltd. (Denmark); lipase Chmmobacterium vimsum ban lipase Pseu- domonas sp., keduanya produk dari Sigma Chem. Co. (USA). Berdasarkan keterangan dari Novo Nordisk Bioindustrial, lipase R. mihei memiliki aktifitas sebesar !j-6 BAUN (Batch Acidolysis Units Novo) 1 gram, yakni jumlah asam dekanoat yang terinkorporasi pada posisi snl- dan sn3- dari trigliserida minyak bunga matahari yang kaya akan asam oleat (high oleic sunflower oil) dan diinkubasi pada suhu 70% selama 60 menit. Lipase C. antaffica memiliki aktifitas esteriikasi sebesar k 7000 PLU (Propyl Laurate Units) 1 gram, yakni selisih bilangan asam dari campuran reaksi 1-propanol dan asam laurat sebelum dan sesudah inkubasi pada suhu 60°C selama 15 menit.
Lipase C. vis90sum dan lipase Pseudomonas sp. diperoleh dalam bentuk iyophilized powder, yang kemudian dilatutkan dalam buffer kalium fosfat 0.1 M pH
7.0. Lipase C. viscosum sejumlah 1.7 mg dan lipase Pseudomonas sp. sejumlah 29 mg masing-masing dilarutkan dalam
25
ml dan 10 ml larutan buffer kalium fosfat. Berdasarkan keterangan dari Sigma Chem. Co. (USA), lipase48
mikroekuivalen asam lemak yang terhidrolisis dari minyak zaitun selama 1 jam pada pH 7.7 dan suhu 37OC, sedangkan lipase Pseudomonas sp. memiliki aktifitas hidrolitik sebesar 35 unitlmg, yakni jumlah pmol gliserol yang terbentuk dari trigliserida pennenit pada pH 7.0 dan suhu 37°C.
Bahan dan pelarut yang digunakan adalah bentonit teknis lokal yang diperoleh dari toko bahan kimia di Bogor; molecular sieves 4A (Applied Science Co., USA); urea (BDH, England), Na2EDTA dan Na2S04 anhidrat (Kanto Chem. Industries, Ltd., Japan); NaOH, NaCI, heksana, aseton, kloroforrn, dan indikator fenolftalein (Merck, Darmstadt); metanol, etanol, petroleum eter, dietil eter, HCI dan asam asetat glasial (J.T. Baker, USA); serta a-tokoferol, asam askorbat, asam sitrat dan lesitin kedelai (Sigma Chem. Co., USA).
Bahan kimia lain yang digunakan dalam analisis adalah standar lipida yang terdiri dari mono-, di-, dan tristearin masing-masing dengan konsentrasi 33.3% (blb) (Sigma Chem. Co., USA), n-hepta dekanoat (C17:O) sebagai stan- dar internal (Nacalai Tesque Inc. Kyoto, Japan), standar asam lemak EPA (Sig- ma Chem. Co., USA), standar GLC # 41 1.74X (Nu Check Prep. Inc., USA) yang terdiri dari ester metil asam-asam lemak C8:0, C10:0, C12:0, C13:0, C14:0, C15:0, C16:0, C16:1, C17:0, C18:0, C18:1, C18:2, C18:3, C20:O dan C22:O masing-masing dengan konsentrasi 6.66% (blb) serta standar GLC # 41 1.84X (Nu Check Prep. Inc., USA) yang terdiri dari ester metil asam-asam lemak C16:O
(10.0%), C17:O (5.0%), C18:O (10.0%), C18:l (5.0%), C18:2 (20.0%), C18:3 (5.0%), C20:O (1 0.0%), C20: 1 (1 0.0%), C20:4 (1 5.0%) dan C22:6 (1 0.0%).
Bahan kimia yang lain adalah BFs metanol 14% (blv) (BDH, England), buffer kalium fosfat, asam oksalat, dan 2',7'dichlorofluorescein (Merck, Darrnstadt); albumin dan minyak zaitun (olive oil) (Sigma Chem. Co., USA). Selain itu digunakan juga gas nitrogen untuk menggantikan udara pada bejana reaksi, pada saat analisis dan pada waktu penyimpanan.
111.2.2. Alat
Peralatan yang digunakan dalam penelitian adalah evaporator vakum berputar (rotary vacuum evaporator, Buchi-R1 1 1) dengan penangas air (Buchi
-
461) dan pompa vakum (Aspirator pump model 7049-05), oven model Memmert (854-Scwabah, W-Germany), timbangan analitik (Chyo, JP2-300 dan JP2-160), vorteks, alat pendingin tegak, stimng hot plate (Fisher Scientific, USA), pH meter 3020 (Jenway), lemari pendingin dan pembeku, labu berleher tiga, orbital shaker water bath (Fisher Scientific, USA), aplikator TLC Microdoser-80 dan lampu ultraviolet-visible D6900 denganX
=254 dan 366 nm (Desaga Heidelberg, W. Germany), alat kromatografi gas (Shimadzu GC-9 AM, Jepang) dengan detektor FID (flame ionization detector) dan integrator Chromatopac Shimadzu C-R6A untuk penghitungan data kromatogram, kolom kapiler DB-23 (30m x 0.25 mmPenelitian terdiri dari dua tahap utama, yakni
3.1. Sintesis trigliserida kaya asam lemak n-3 dengan menginkorporasikan asam lemak EPA dan DHA dari konsentrat asam lemak n-3 pada minyak ikan tuna @recook
oil).
Tahap penelitian ini juga mempelajari sifat spe- sifisitas enzim lipase serta faktor-faktor kondisi proses yang mempenga- nrhinya.3.2. Modifikasi CPO dengan menginkorporasikan asam lemak EPA dan DHA dari konsentrat asam lemak n-3, yang dipreparasi dari minyak ikan tuna, dengan teknik asidolisis enzimatik.
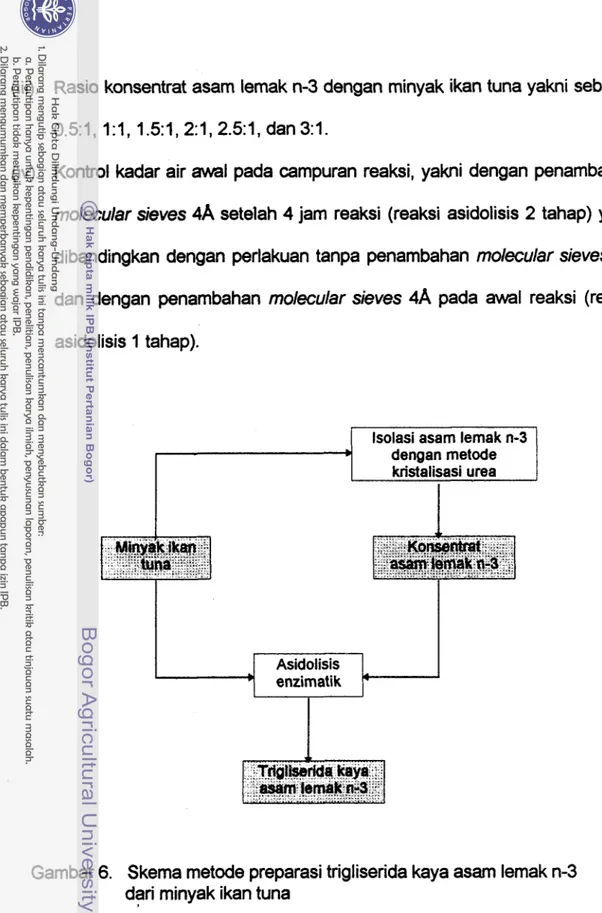
Preparasi trigliserida kaya asam lemak n-3 dari minyak ikan tuna dilakukan dengan metode seperti yang digambarkan pada skema Gambar 6. Pada tahap pertama ini dilakukan 4 set penelitian, dimana faktor perlakuan yang diteliti pada masing-masing set penelitian adalah :
(i). Jenis enzim lipase yakni lipase Rhizomucor miehei imobil (Lipozyme-IM), li pase Candida antartica imobil (Novozy m-435), li pase Chromobacterium viscosum dan lipase Pseudomas sp.
(ii). Jumlah enzim lipase yang dipilih dari hasil penelitian (i), yakni lipase C.antartica yakni sebesar 5%, 7.5%, lo%, 12.5%, dan 15% (blb substrat
5 1
(iii). Rasio konsentrat asam lemak n-3 dengan minyak ikan tuna yakni sebesar 0.5:1, 1:1, 1.5:1, 2:1,2.5:1, dan 3:l.
(iv). Kontrol kadar air awal pada campuran reaksi, yakni dengan penambahan
molecular sieves 4A setelah 4 jam reaksi (reaksi asidolisis 2 tahap) yang dibandingkan dengan perlakuan tanpa penambahan molecular sieves 4A
dan dengan penambahan molecular sieves 4A pada awal reaksi (reaksi asidolisis 1 tahap).
lsolasi asam lemak n-3 dengan metode
Gambar 6. Skema metode preparasi trigliserida kaya asam lemak n-3 dari minyak ikan tuna
>
Asidolisis enzimatik
Adapun parameter performans asidolisis yang diukur adalah tingkat asidolisis; konsentrasi EPA,
D M
dan total asam lemak n-3 dalam produk hasil asidolisis; kandungan monogliserida(MAG),
digliserida (DAG), trigliserida(TAG)
dalam produk; konsentrasi EPA, DHA, dan total asam lemak n-3 dalammasing-masing fraksi gliserida.
Pada tahap kedua dipelajari tentang inkorporasi asam lemak n-3 (EPA dan DHA) ke dalam CPO dengan menggunakan teknik asidolisis enzimatik,
yang preparasinya digambarkan pada skema Gambar 7
di
bawah.I
lsolasi asam lemak n-3I
dengan metodeI
AsidolisisAdapun faktor-faktor proses yang diteliti adalah :
(i). Jenis enzim lipase yakni lipase Rhizomucor miehei imobil (Lipozyme-IM) dan lipase Candida anfarfica imobil (Novozym-435).
(ii). Rasio konsentrat asam lemak n-3 dan CPO yakni rasio 0.5: 1, 1 : 1,
2:
1, dan 3:1.Parameter performans asidolisis yang diukur adalah konsentrasi EPA, DHA dan total asam lemak n-3 dalam produk CPO termodifikasi; kandungan MAG, DAG dan TAG dalam produk; serta konsentrasi EPA, DHA, dan total asam lemak n-3 dalam masing-masing fraksi gliserida.
Setiap perlakuan percobaan dilakukan dengan dua ulangan. Hipotesis diuji dengan sidik ragam (analysis of variance) dan untuk membandingkan nilai rata-rata perlakuan digunakan uji Duncan atau uji t-Student.
111.4.
Prosedur Percobaan
111.4.1. Preparasi konsentrat asam lemak
n-3
(Elisabeth, 1992)Tujuh puluh lima gram minyak ikan tuna dihidrolisis dalam sebuah bejana berleher tiga dengan 150 ml larutan NaOH 6N (36 g NaOH dalam 30 ml air dan 1200 ml etanol). Kedalam campuran ditambahkan 0.4 gram Na2EDTA, dan campuran ini direfluks dengan pemanasan suhu 60°C selama 30 menit, sarribil kedalam bejana dialirkan gas nitrogen.
Hasil hidrolisis ditambahkan dengan 200 ml heksana, dan diaduk selama 1 jam sambil tetap dialirkan gas nitrogen. Setelah didiamkan beberapa saat terbentuk dua lapisan, dimana lapisan bagian atas yang mengandung bahan- bahan yang tidak tersabunkan dipisahkan, sedangkan lapisan bagian bawah ditambahkan dengan HCI pekat sedikit demi sedikit sambil diaduk hingga pH larutan mencapai 4. Setelah itu terbentuk lagi dua lapisan, dimana lapisan bagian bawah dibuang dan lapisan bagian atas dievaporasi dengan evaporator vakum berputar (rotavapor) dengan suhu 30°C dan reduced pressure 6045 crn HQ hingga beratnya konstan.
Hasil yang diperoleh berupa campuran asam lemak yang kemudian ditambahkan dengan larutan jenuh urea dalam metanol dengan suhu 6045°C. Adapun perbandingan jumlah asam lemak dengan urea yang digunakan adalah 1 :3 (bb). Setelah diaduk selama 5 menit, campuran dibiarkan selama semalam pada suhu kamar.
Campuran disaring dengan corong Buchner menggunakan pompa vakum. Filtrat yang diperoleh kemudian disimpan pada lemari pembeku bersuhu 30°C selama 3 jam untuk membuang kelebihan urea. Campuran disaring kem- bali dan pada filtrat ditambahkan 150 ml heksana dan 50 ml HCI pekat. Larutan diaduk selama 1 jam sambil dialirkan gas nitrogen. Lapisan heksana kemudian dipisahkan, dan, lapisan bawah diekstraksi kembali dengan 100 ml heksana.
55
diuapkan dengan rotavapor pada suhu 30°C dan reduced pressure 6045 cm Hg hingga beratnya konstan.
111.4.2. Preparasi trigliserida kaya asam lemak n-3
Reaksi asidolisis enzimatik dilakukan dengan campuran 5 gr minyak ikan tuna atau CPO dan konsentrat asam lemak n-3 (1 : 1
- 1 :3 bib). Pada campuran
minyak ikan tuna atau CPO dan konsentrat asam lemak n-3 ini ditambahkan 50 PI akuades dan didispersikan dalam fase minyak dengan ultrasonikasi, ke- mudian ditambahkan enzim lipase dengan konsentrasi yang sesuai dengan tujuan penelitian. Campuran reaksi ditempatkan dalam erlenmeyer bertutup dengan penggantian atmosfer udara dengan gas nitrogen. Reaksi dilakukan pada suhu 40°C dan kecepatan pengadukan 200 rpm dalam orbital shaker water bath. Reaksi dilakukan dengan beberapa tingkat periode reaksi yakni 0, 3, 6, 9, 12, 15, 24 dan 40 jam. Reaksi asidolisis dihentikan dengan penambahan 10 ml campuran asetonletanol (1 :1 vlv), kemudian disimpan pada suhu 4°C hingga saat analisis dilakukan.Pemisahan enzim imobil dari campuran reaksi dilakukan dengan penyaringan menggunakan kertas saring. Untuk menghilangkan asam lemak bebas dari campuran reaksi, digunakan 0.2 ml larutan contoh dari campuran reaksi yang dilarutkan dalam heksana 10 ml, 10 ml metanol dan 10 ml akuades.
dibutuhkan untuk 0.2 ml larutan contoh tersebut kemudian dikonversi untuk campuran reaksi yang ada.
Setelah disentrifus, kedua fase yang terbentuk dipisahkan. Lapisan atas yang mengandung campuran gliserida diuapkan pelarutnya dengan mengguna- kan
rotavapor
pada suhu 30°C danreduced
pressure
60-65cm
Hg hingga berat- nya konstan. Setelah transmetilasi, komposisi asam lemak dalam produk dianalisis dengan kromatografi gas.111.5.
Metode
Analisis
111.5.1.
Analisis
konsentrasi asam lemak (AOCS M ~ c i a l Method Ce 142, 1990).Sebanyak & 25 mg sampel ditimbang dan kemudian ditambahkan larutan standar internal (C17:O) 1.0 mglml sebanyak 0.5 ml. Kedalam campuran ditam- bahkan 1.5 ml NaQH metanolik 0.5 N kemudian tabung diisi dengan gas NZ, ditutup rapat, dikocok, dan dipanaskan dalam penangas air suhu 100°C selama 5 menit. Setelah tabung didinginkan, kedalam campuran ditambahkan 2 ml BF3- metanol (14% blv), tabung diisi dengan gas N2, ditutup rapat, dan dipanaskan kembali pada suhu 100% selama 30 menit. Kemudian tabung didinginkan hingga suhu 3 0 4 ° C dan ditambahkan dengan 1 ml heksana, diisi dengan gas
vial. Fase metanollair diekstrak kembali dengan 1 ml heksana dan hasil ekstraksi digabung serta dilakukan penyaringan dengan Na2S04 anhidrat. Sampel ester metil asam lemak ini dipekatkan dengan hembusan gas Np hingga volume ~t 1 ml dan sampel siap diinjeksikan ke alat kromatografi gas.
Analisis asam lemak pada sampel menggunakan alat kromatografi gas
GC-SAM (Shimadzu, Jepang) yang dilengkapi dengan detektor FID, integrator Chromatopac C-R 6A dan kolom kapiler DB-23 (30m x 0.25 mm i.d.; J&W Scientific, Folsom, CA). Penyuntikan sarnpel sebanyak 1 p1 menggunakan sistim langsung (splitless
mode)
dengan suhu injektor 250°C, suhu detektor 260°C, suhu kolom awal 140°C yang dipertahankan selama 6 menit, peningkatan suhu kolom kemudian adalah 3OC per menit hingga suhu akhir 230°C dan dipertahankan selama 20 menit. Gas helium digunakan sebagai gas pembawa dengan tekanan 1 kglcm2, sedangkan tekanan gas hidrogen dan udara untuk FID masingmasing adalah 0.5 kg/cm2.. ldentifikasi dilakukan dengan mengunakan standar ester metil asam lemak dan kuantifikasi masing-masing jenis asam lemak dilakukan dengan pembandingan terhadap standar internal C17:O.dimana:
mc17
=
massa standar internal C17:O yang ditambahkan pada sampel K,=
faktor koreksi asam lemak i yang diperoleh dari kromatogramester metil asam lemak standar
dimana Bi
=
berat ester metil asam lemak i dalam campuran ester metil asam lemak standarCBi
=
total berat ester metil asam lemak Ci=
luas area ester metil asam lemak iC
Ci=
total luas area dari ester metil asam lemak standarA,
=
luas area ester metil asam lernak im
=
massa sampel minyak yang ditransmetilasi' KCI7
=
faktor koreksi ester metil asam lemak C17:O yang diperoleh darikromatogram ester metil asam lemak standar (= k l 7 : O 1
=
luas area ester metil asam lemak C17:O111.5.2. Preparasi dan analisis komposisi gliserida
Pemisahan gliserida dilakukan dengan teknik kromatografi lapis tipis (Thin Layer ChmmatographyITLC) menggunakan plate TLC 5721 (Merck, Darm- stadt, Germany). Aktivasi plate dilakukan pada suhu 1 10°C selama 2 jam. Sam- pel minyak yang telah dilarutkan dalam kloroforrn yang mengandung 0.01% antioksidan a-tokoferol, diaplikasi pada plate dengan menggunakan aplikator TLC Microdoser-80. Pengembangan plate menggunakan eluen petroleum eter : dietil eter : asam asetat (90:lO:l vlvlv). Spot dari masing-masing sampel divisualisasi dengan penyemprotan 0.2% (blv) larutan 2:7'dich10mfl~0~~cein dalam etanol. Spot-spot yang terbentuk diidentifikasi di bawah sinar ultraviolet.
dengan campuran heksana
:
dietil eter (1:l vlv), dan fraksi MAG dengan dietil eter. Setelah disaring, pelarut dari masing-masing fraksi diuapkan dengan rotavapor pada suhu 30°C dan reduced pressure 6045cm
Hg hingga beratnya konstan. Setelah transmetilasi, komposisi asam lemak pada masing-masing fraksi gliserida dianalisis dengan kromatografi gas.111.5.3. Pengukuran aktifitas hidrolitik enzim lipase (Metode Lienfield et a/., 1984).
Satu unit aktifitas lipase didefenisikan sebagai kemampuan sejumlah enzim untuk membebaskan 1 pmol asam lemak bebas per menit dari substrat pada pH 6.0 dan suhu 30°C.
Sejumlah 3 gram minyak zaitun (olive oil) ditimbang dalam erlenmeyer 100 ml, kemudian ditambahkan 3.5 ml larutan buffer kalium fosfat 0.1 M dengan pH 7.0, 30 ppm albumin, dan 1 ml larutan enzim untuk enzim cair atau I gr enzim imobil. Ke dalam campuran reaksi ditambahkan akuades hingga volume larutan menjadi 6.5 ml. Campuran ini diinkubasikan dalam orbital shaker water bath dengan suhu 40°C dan kecepatan pengadukan 200 rpm selama 1 jam. Suhu inkubasi senantiasa dikontrol agar tidak berfluktuasi.
Setelah waktu inkubasi tercapai, substrat-enzim segera diinaktifkan de- ngan campuran aseton-etanol(1: 1 vlv) sebanyak 10 ml dan digoyang sempuma. Cam~uran ini kemudian di~indahkan ke dalam erlenmever 250 ml. Erlenmever
Bilasan ini kemudian ditambahkan pada campuran sebelumnya. Selanjutnya pada campuran akhir ini ditambahkan indikator fenolftalein 1% sejumlah 2-3 tetes dan selanjutnya cqmpuran dititrasi dengan larutan NaOH 0.02N. Titrasi dihentikan jika sudah terbentuk wama merah jambu.
Untuk penentuan blanko, prosedur yang sama dilakukan tetapi pada saat larutan enzim dimasukkan, campuran substrat-enzim segera diinaktifkan dengan penambahan campuran aseton-etanol.
Adapun perhitungan aktifitas hidrolitik enzim lipase adalah: Aktifitas lipase
=
(A-B) x N NaOH x 1000 / 60dimana :
A
=
ml NaOH untuk titrasi sampelB
=
ml NaOH untuk titrasi blanko N NaOH=
normalitas NaOH1000