YUYUN YUNITA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
YUYUN YUNITA. Adsorpsi Ion Pb
Menggunakan Campuran Kaolin-Ampas
Saguu dan Bentonit-Ampas Sagu. Dibimbing oleh KOMAR SUTRIAH dan
HENNY PURWANINGSIH.
Berbagai upaya telah dilakukan untuk mengatasi pencemaran logam berat,
di antaranya dengan metode fisikokimia seperti presipitasi kimia dan ultrafiltrasi,
akan tetapi metode-metode tersebut mahal dan tidak efektif. Metode alternatif
yang lebih murah dan efektif
diperlukan
untuk mengatasi pencemaran logam
berat. Pada penelitian ini, adsorpsi ion logam berat Pb
2+dilakukan menggunakan
ampas sagu, campuran ampas sagu dengan kaolin, dan campuran ampas sagu
dengan bentonit. Adsorben yang dibuat terlebih dahulu diaktivasi secara asam dan
basa. Arang aktif komersial digunakan sebagai pembanding. Hasil penelitian
menunjukkan bahwa semua adsorben campuran ampas sagu dengan kaolin dan
bentonit berpotensi untuk mengadsorpsi ion logam berat Pb
2+. Namun adsorben
ampas sagu teraktivasi asam dan campuran ampas sagu teraktivasi asam-kaolin
(75:25) memiliki kapasitas adsorpsi yang paling tinggi. Kapasitas adsorpsi kedua
adsorben ini lebih tinggi daripada arang aktif. Jenis isoterm adsorpsi dari kedua
adsorben ini menunjukkan model isoterm Langmuir, artinya lapisan adsorbat
yang terbentuk pada permukaan adsorben membentuk satu lapisan (monolayer).
ABSTRACT
YUYUN YUNITA. Pb
2+Adsorption Using Mixture of Kaolinite-Sago Waste and
Bentonite-Sago Waste. Supervised by KOMAR SUTRIAH and HENNY
PURWANINGSIH.
Various efforts have been conducted to overcome heavy metal
contamination, among other things with physical and chemical method such as
chemical precipitation and ultra-filtration. However, these methods are costly and
ineffective. Therefore, there is a need to find alternatives to investigate a low cost
and effective method. In this experiment, heavy metal ions Pb
2+were adsorbed on
sago waste, mixture of sago waste with kaolinite, and mixture of sago waste with
bentonite. The adsorbents were activated using acid and base. The activated
charcoal was used as a comparation. The result showed that all adsorbents made
of mixture of sago waste with kaolinite and with bentonite were potential to
adsorb Pb
2+. However, sago waste with acid-activation and the mixture of sago
waste acid-treated as well as the acid-treated kaolinite (75:25) adsorbents gave
adsorption capacity higher than the others. Adsorption capacity of both adsorbents
were higher than the activated charcoal. Adsorption type of the adsorbent can be
evaluated by the determination of Langmuir and Freundlich isotherm test. The
result showed that both adsorbents had Langmuir isotherm type, so it can be
estimated that the adsorbed layers on the adsorbent surface is monolayer.
SAGU
YUYUN YUNITA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Nama
: Yuyun Yunita
NIM :
G44062679
Menyetujui
Pembimbing I,
Drs. Komar Sutriah, M.S.
NIP 19630705 199103 1 004
Pembimbing II,
Henny Purwaningsih, S.Si, M.Si.
NIP 19741201 200501 2 001
Mengetahui
Ketua Departemen Kimia,
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih
dalam penelitian ini ialah Adsorpsi Ion Pb
2+Menggunakan Campuran
Kaolin-Ampas sagu dan Bentonit-Kaolin-Ampas sagu, yang dilaksanakan pada bulan September
2010 sampai dengan Februari 2011 bertempat di Laboratorium Kimia Fisik dan
Lingkungan, IPB.
Penulis mengucapkan terima kasih kepada Bapak Drs. Komar Sutriah,
M.S. selaku pembimbing pertama dan Ibu Henny Purwaningsih, S.Si, M.Si.
selaku pembimbing kedua yang telah memberikan arahan, saran, dan dorongan
selama pelaksanaan penelitian dan penulisan karya ilmiah ini. Ungkapan terima
kasih penulis berikan kepada Mama dan Bapa yang tidak pernah berhenti
memberikan semangat, doa, dan kasih sayangnya kepada penulis. Terima kasih
juga penulis haturkan kepada Bapak Nano, Ibu Ai, dan Bapak Ismail dari
Laboratorium Kimia Fisik serta Bapak Wawan dari laboratorium bersama atas
fasilitas dan bantuan yang diberikan selama penelitian. Ucapan terima kasih juga
disampaikan semua teman-teman KIMIA 43 terutama Ismi, Erika,Susi, Ka Alvin,
Ka Ifan, dan Ka Sidiq yang turut membantu memberikan bantuan, semangat, dan
dukungannya dalam penyusunan karya ilmiah.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
Penulis dilahirkan di Bogor pada tanggal 26 Juni 1986 dari ayah Suhardi
dan ibu Junariah. Penulis merupakan anak kedua dari dua bersaudara.
Tahun 2006 penulis lulus dari Sekolah Menengah Analis Kimia Bogor dan
pada tahun yang sama lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan
Mahasiswa Baru (SPMB). Penulis memilih Program Studi Kimia, Departemen
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Tahun 2009 penulis
melaksanakan praktik lapangan di Laboratorium Instrumen Balai Besar Industri
Agro (BBIA) Bogor dengan judul laporan Validasi Metode Pengujian Kadar
Acesulfam-K dalam Minuman Serbuk Menggunakan HPLC. Tahun 2010/2011
penulis melaksanakan penelitian tugas akhir di Laboratorium Kimia Fisik dan
Lingkungan, Institut Pertanian Bogor. Selama mengikuti perkuliahan, penulis
aktif dalam organisasi dan beberapa kegiatan kepanitiaan antara lain menjadi
pengurus Ikatan Mahasiswa Kimia sebagai staf Pengembangan Sumber Daya
Mahasiswa pada tahun ajaran 2008/2009 serta staf Komunikasi dan Informasi
pada tahun ajaran 2009/2010 dan sebagai bendahara UKM Seroja Putih pada
tahun ajaran 2007/2008. Selain itu, penulis pernah menjadi asisten praktikum
Kimia Dasar Tingkat Persiapan Bersama pada tahun ajaran 2008/2009 sampai
dengan 2010/2011, asisten praktikum Kimia Biologi pada tahun ajaran 2009/2010
dan 2010/2011, asisten praktikum Spektrofotometri mahasiswa kimia IPB
penyelenggaraan khusus pada tahun ajaran 2009/2010 dan 2010/2011, asisten
praktikum Kimia Analitik II pada tahun ajaran 2009/2010, asisten praktikum
Kimia Fisik Layanan ITP dan mahasiswa penyelenggaraan khusus pada tahun
ajaran 2009/2010 dan 2010/2011, serta asisten praktikum Kimia Lingkungan pada
tahun ajaran 2010/2011.
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Ampas Sagu ... 1
Kaolin ...
2
Bentonit ...
2
Timbal ...
3
Adsorpsi ... 3
Isoterm Adsorpsi ... 3
Isoterm Adsorpsi Langmuir ... 3
Isoterm Adsorpsi Freundlich ... 4
BAHAN DAN METODE
Bahan dan Alat ... 4
Metode ... 4
HASIL DAN PEMBAHASAN
Aktivasi ampas sagu, kaolin, dan bentonit ... 5
Seleksi adsorben ... 6
Kondisi optimum ampas sagu teraktivasi asam ... 7
Kondisi optimum ampas sagu teraktivasi asam-bentonit (75:25) ... 8
Kondisi optimum ampas sagu teraktivasi asam-kaolin (75:25) ... 8
Kondisi optimum arang aktif ... 9
Pengaruh waktu adsorpsi dan bobot adsorben ... 9
Perbandingan kinerja adsorben ... 10
Isoterm adsorpsi ... 11
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
Halaman
1 Ampas sagu ...
2
2 Struktur kristal kaolin ... 2
3 Struktur kristal bentonit ... 2
4 Skema interaksi proton pada struktur kaolin ... 6
5 Skema interaksi pada dengan struktur bentonit ... 6
6 Kurva kapasitas dan efisiensi adsorpsi setiap adsorben pada tahap seleksi ... 7
7 Waktu optimum adsorben ampas sagu teraktivasi asam ... 8
8 Bobot optimum adsorben ampas sagu teraktivasi asam ... 8
9 Waktu optimum adsorben ampas sagu teraktivasi asam-bentonit (75:25) ... 8
10 Bobot optimum adsorben ampas sagu teraktivasi asam-bentonit (75:25) ... 8
11 Waktu optimum adsorben ampas sagu teraktivasi asam-kaolin (75:25). ... 9
12 Bobot optimum adsorben ampas sagu teraktivasi asam-kaolin (75:25). ... 9
13 Waktu optimum arang aktif ... 9
14 Bobot optimum arang aktif ... 9
15 Isoterm Langmuir adsorpsi Pb
2+oleh ampas sagu teraktivasi asam ... 11
16 Isoterm Freundlich adsorpsi Pb
2+oleh ampas sagu teraktivasi asam ... 11
17 Isoterm Langmuir oleh ampas sagu teraktivasi asam-kaolin (75:25) ... 11
18 Isoterm Freundlich oleh ampas sagu teraktivasi asam-kaolin (75:25) ... 11
Halaman
1 Diagram alir penelitian ... 16
2 Seleksi adsorben
...
17
3 Penentuan waktu optimum adsorben ampas sagu teraktivasi asam ... 20
4 Penentuan waktu optimum adsorben ampas sagu teraktivasi asam-bentonit 22
5 Penentuan waktu optimum adsorben ampas sagu teraktivasi asam-kaolin .... 24
6 Penentuan waktu optimum adsorben arang aktif ... 26
7 Penentuan bobot optimum adsorben ampas sagu teraktivasi asam ... 28
8 Penentuan bobot optimum adsorben ampas sagu teraktivasi asam-bentonit 30
9 Penentuan bobot optimum adsorben ampas sagu teraktivasi asam-kaolin ... 32
10 Penentuan bobot optimum arang aktif ... 34
11 Penentuan isoterm adsorpsi ... 36
pertambahan jumlah penduduk yang pesat memacu terjadinya pencemaran lingkungan antara lain pencemaran air, tanah, dan udara. Salah satu zat pencemar lingkungan adalah logam berat. Logam berat merupakan polutan yang umumnya bersifat racun bagi makhluk hidup walaupun beberapa diantaranya diperlukan dalam jumlah kecil. Logam berat dapat terdistribusi ke dalam tubuh manusia melalui berbagai perantara, seperti udara, makanan, maupun air yang terkontaminasi (Dewi 2009).
Timbal (Pb) merupakan salah satu logam berat. Limbah yang mengandung Pb dapat berasal dari limbah penggunaan batu bara, minyak, campuran bensin, pembuatan baterai, pewarna, amunisi, tinta koran dan untuk bahan campuran logam lainnya (Dewi 2009). Metode-metode yang biasa digunakan untuk mengatasi pencemaran oleh logam berat antara lain presipitasi, adsorpsi, pertukaran ion, elektrodeposisi, ekstraksi pelarut, pemisahan melalui membran, dan osmosis balik. Pada penelitian ini, metode yang digunakan adalah adsorpsi karena prosesnya mudah dan biaya yang diperlukan lebih ekonomis (Quek et al. 1998).
Adsorben logam berat yang sering digunakan di perusahaan dan pusat pengolahan limbah adalah arang aktif dan zeolit yang mudah didapatkan secara komersil. Adsorben logam berat lain selain arang aktif dan zeolit, yaitu kaolin dan bentonit. Kaolin adalah tanah liat golongan filosilikat dengan tipe 1:1, sedangkan bentonit adalah tanah liat golongan filosilikat dengan tipe 2:1 (Supeno 2007). Penelitian tentang kaolin dan bentonit sebagai adsorben logam berat sudah banyak dilakukan antara lain adsorpsi ion Pb2+ dari larutan dengan
kaolin (Omar & Hossam 2007), adsorpsi logam Pb dan Cu dengan bentonit (Inel et al. 1998), adsorpsi Cu dan Ni dengan Bentonit (Zhi-Rong & Shao-Qi 2010), dan lain-lain.
Adsorben logam berat dari limbah hasil pertanian saat ini banyak dikembangkan. Cara ini diharapkan dapat mengurangi pembuangan limbah yang dapat menyebabkan pencemaran lingkungan serta dapat menambah nilai ekonomis limbah tersebut. Limbah pertanian yang dapat digunakan sebagai adsorben logam berat antara lain ampas sagu, ampas tebu, tongkol
terbesar di dunia hingga 1.2 juta ha atau 51.3% dari 2.2 juta ha areal sagu dunia terutama di Irian Jaya, Maluku, dan Sumatera, namun limbah hasil pengolahan pohon sagu, khususnya ampas sagu sampai saat ini masih sedikit yang dimanfaatkan secara optimal padahal potensinya cukup besar (Tampoebolon 2009). Pada proses pengolahan sagu menjadi tepung sagu, jumlah ampas yang dihasilkan sekitar 75% dari jumlah bahan mentahnya Selama ini, limbah ampas sagu umumnya langsung dibuang ke lingkungan, terutama ke sungai sehingga dapat meningkatkan pencemaran. Sebagian kecil limbah ampas sagu selama ini dimanfaatkan sebagai bahan bakar, campuran pakan ternak, dan media penanaman jamur (Djoefrie1999).
Beberapa penelitian tentang pemanfaatan ampas sagu telah dilakukan, diantaranya asetilasi selulosa ampas sagu dan aplikasinya sebagai fase diam kromatografi kolom (Cahyani 2010), pembuatan arang aktif dari ampas sagu sebagai adsorben logam Cu (Maheswari 2008), dan pemanfaatan ampas sagu sebagai adsorben logam Pb dan Cu (Quek et al. 1998).
Pembuatan adsorben saat ini sedang banyak dikembangkan dengan melakukan modifikasi misalnya dengan mencampur beberapa jenis adsorben tertentu sehingga adsorben yang dihasilkan diharapkan memiliki kapasitas adsorpsi dan efisiensi penjerapan yang tinggi, serta harganya lebih ekonomis (Sembiring et al. 2008).
Penelitian ini mencampurkan ampas sagu dengan kaolin dan ampas sagu dengan bentonit pada perbandingan tertentu yang masing-masing telah diaktivasi secara kimia, kemudian gabungan keduanya digunakan sebagai adsorben ion Pb2+. Penelitian ini
bertujuan untuk memilih adsorben terbaik dari ampas sagu, campuran ampas sagu-bentonit, dan campuran ampas sagu-kaolin dalam mengadsorpsi ion Pb2+.
TINJAUAN PUSTAKA
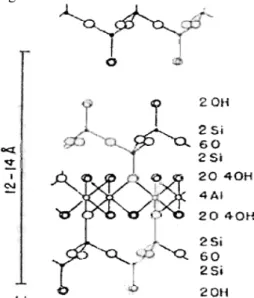
Ampas SaguAmpas sagu (Gambar 1) merupakan limbah berupa serat-serat empulur yang diperoleh dari hasil pemrosesan batang sagu.
Kandungan serat kasarnya sekitar 28.30%, sedangkan kandungan proteinnya sekitar 1.36% (Tampoebolon 2009). Sumber lain menyebutkan bahwa ampas sagu yang berasal dari Malaysia mengandung 66% pati dan 24% serat kasar berupa lignin dan selulosa (Adenil 2010).
.
Gambar 1 Ampas sagu.
Kaolin
Kaolin merupakan salah satu senyawa mineral alumino-silikat. Komposisi kaolin yaitu Al2O3 : SiO2 : H2O (1:1:2) atau
2SiO2.Al2O3.2H2O pada setiap satuan selnya.
Kaolin merupakan golongan filosilikat dengan tipe 1:1 karena struktur satuan sel kristalnya (Gambar 2) terdiri dari satu lembar lapisan aluminium oktahedral pada satu sisi dan satu lembar lapisan silika tetrahedral pada sisi yang lain. Kedua lapisan tersebut dihubungkan oleh atom oksigen melalui ikatan hidrogen antara silika-oksigen dan alumina-oksigen (Supeno 2007).
Gambar 2 Struktur kristal kaolin. Bagian permukaan dari kristal kaolin mempunyai muatan negatif yang tetap. Muatan negatif tersebut disebabkan adanya subtitusi isomorf Si4+ dan Al3+ pada lapisan
silika. Muatan pada permukaan dan tepi-tepi alumina dapat menyebabkan terjadinya protonasi maupun deprotonasi dari gugus
hidroksil bergantung pada pH larutan (Nandi
et al. 2009).
Sifat-sifat fisik kaolin, yaitu berwarna putih, berbentuk butiran rapuh, sulit larut dalam air, memiliki titik lebur 1850°C, serta memiliki daya hantar listrik dan panas yang rendah, Kaolin banyak digunakan di industri keramik sebagai bahan glasir, industri cat sebagai bahan pewarna, industri plastik untuk melicinkan permukaan plastik, dan industri kertas sebagai bahan pengisi (Silitonga 2008).
Bentonit
Bentonit merupakan salah satu jenis batuan dari tanah liat. Nama bentonit digunakan dalam dunia perdagangan untuk tanah lempung yang mengandung montmorillonit lebih dari 85%. Rumus kimia umum bentonit adalah Al2O3.4SiO2.xH2O.
Bentonit merupakan mineral tanah liat tipe 2:1 karena struktur kristalnya (Gambar 3) terdiri dari 2 lembar lapisan silika tetrahedral dan satu lembar lapisan aluminium oktahedral. Setiap satuan selnya terdiri dari 2 lapisan tetrahedral yang disusun oleh unsur utama Si(O,OH) dan mengapit satu lapisan oktahedral yang disusun oleh unsur M(O,OH) dimana M adalah logam Al, Mg, dan Fe, di antara lembaran-lembaran ini, terdapat ruang yang diisi oleh molekul-molekul air dan kation-kation lain (Supeno 2007).
Sifat-sifat fisik bentonit, yaitu memiliki warna yang bervariasi tergantung jenis dan kandungan fragmen mineralnya, pada umumnya, bentonit berwarna kecoklatan. Bentonit bersifat lunak, mudah menyerap air, dan memiliki berat jenis berkisar antara 2,4 -2,8 g/ml.
Bentonit banyak digunakan di industri insektisida dan pestisida sebagai bahan
carrier, industri kertas sebagai bahan pengisi
dan pengental, industri pengeboran minyak, dan lain-lain.
Timbal (Pb)
Pencemaran perairan oleh Pb2+ sangat
berbahaya karena sulit diuraikan atau
nonbiodegradable dan dapat menyebabkan
masalah kesehatan pada manusia dan lingkungan. Pada manusia, akumulasi Pb dalam tubuh dapat menyebabkan anemia, kerusakan ginjal, kerusakan otak, dan paralysis pada urat saraf. World Health Organization (WHO) telah menetapkan batas maksimal kandungan Pb2+ di perairan adalah
0.01 ppm (Omar & Hossam 2007).
Adsorpsi
Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan. Zat yang diadsorpsi disebut fase teradsorpsi (adsorbat) dan zat yang mengadsorpsi disebut adsorben. Adsorben pada umumnya adalah zat padat yang berongga, contohnya zeolit dan arang aktif (Atkins 1999).
Mekanisme adsorpsi dapat dibedakan menjadi dua yaitu, adsorpsi secara fisika (fisisorpsi) dan adsorpsi secara kimia (kimisorpsi). Pada proses fisisorpsi gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya Van der Waals. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah yaitu sekitar 20 kJ/mol. Pada proses kimisorpsi, interaksi adsorbat dengan adsorben melalui pembentukan ikatan kimia. Kimisorpsi terjadi diawali dengan adsorpsi fisik, yaitu partikel-partikel adsorbat mendekat ke permukaan adsorben melalui gaya Van der Waals atau melalui ikatan hidrogen, diikuti oleh adsorpsi kimia yang terjadi setelah adsorpsi fisika. Pada adsorpsi kimia, partikel melekat pada permukaan dengan membentuk ikatan kimia (biasanya ikatan kovalen) dan cenderung mencari tempat yang memaksimumkan bilangan koordinasi dengan substrat (Atkins 1999).
Kemampuan adsorpsi pada adsorben dapat dinyatakan oleh kapasitas adsorpsi. Adsorben yang baik memiliki kapasitas adsorpsi dan persentase efisiensi penjerapan yang tinggi. Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus :
Q = V(Co – C) m
Persentase penjerapan dapat dihitung dengan menggunakan rumus : %E = (C o – C) x 100% Co Keterangan: Q = kapasitas adsorpsi (mg/g) %E = persentase penjerapan V = volume larutan (L) Co = konsentrasi awal (mg/L) C = konsentrasi akhir (mg/L) m = massa adsorben (g) Isoterm Adsorpsi
Isoterm adsorpsi merupakan fungsi konsentrasi zat terlarut yang teradsorpsi pada adsorben terhadap konsentrasi adsorbat dalam larutan. Kesetimbangan terjadi pada saat laju pengikatan adsorben terhadap adsorbat sama dengan laju pelepasannya. Terdapat beberapa tipe isoterm yang digunakan untuk menggambarkan interaksi antara adsorben dan adsorbat. Tipe isoterm adsorpsi yang umum digunakan untuk menggambarkan fenomena adsorpsi padat-cair adalah tipe isoterm Langmuir dan Freundlich (Atkins 1999).
Isoterm Adsorpsi Langmuir
Isoterm adsorpsi Langmuir didasarkan atas beberapa asumsi, yaitu adsorpsi hanya terjadi pada lapisan tunggal, panas adsorpsi tidak tergantung pada penutupan permukaan, semua bagian, permukaannya bersifat homogen, dan terdapat sejumlah tertentu sisi aktif adsorben yang membentuk ikatan kovalen atau ion. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir adalah sebagai berikut,
C α 1 αβ 1 x/m C + =
C merupakan konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi, x/m adalah massa adsorbat yang teradsorpsi per gram adsorben, α dan β adalah konstanta yang berhubungan dengan afinitas adsorpsi (Atkins 1999).
Isoterm Adsorpsi Freundlich
Persamaan isoterm adsorpsi Freundlich didasarkan atas terbentuknya beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada permukaan adsorben, namun pada adsorpsi Freundlich bagian sisi aktif pada permukaan adsorben bersifat heterogen. Isotherm Freundlich hanya melibatkan gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Isoterm Freundlich menganggap bahwa pada semua sisi permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang mampu mencegah adsorpsi pada saat kesetimbangan tercapai, dan hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut,
Log (x/m) = log k + 1/n log C
C merupakan konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi, x/m adalah massa adsorbat yang teradsorpsi per gram adsorben, k dan n adalah konstanta yang berhubungan dengan afinitas adsorpsi (Atkins 1999).
BAHAN DAN METODE
Alat dan BahanAlat-alat yang digunakan adalah alat-alat kaca, pengaduk magnet, pemanas listrik, refluks, oven, alat pengocok, dan Spektrofotometri Serapan Atom (SSA/AAS). Bahan-bahan yang digunakan adalah ampas sagu dari pabrik pengolahan sagu Cimahpar Bogor, bentonit dari PT Sud Chemie, kaolin komersil, arang aktif komersil, H2SO4,
NaOH, H3PO4 (Merck), Pb(NO3)2, dan
akuades.
Metode Penelitian
Penelitian terdiri atas beberapa tahap. Tahap pertama ialah preparasi ampas sagu, kaolin, dan bentonit. Tahap kedua adalah aktivasi. Tahap ketiga adalah pembuatan campuran adsorben kaolin-ampas sagu dan bentonit-ampas sagu. Tahap keempat adalah penentuan waktu dan bobot optimum adsorben pada adsorpsi larutan Pb2+. Tahap
terakhir adalah penentuan jenis isoterm adsorpsi Pb2+.
Preparasi Ampas Sagu, Kaolin, dan Bentonit
Ampas sagu, kaolin, dan bentonit dicuci dengan akuades, kemudian dikeringkan di dalam oven pada suhu 105 °C.
Aktivasi Asam Ampas Sagu
Ampas sagu yang telah dicuci ditimbang sebanyak 10 g ke dalam Erlenmeyer dan ditambahkan 250 mL H3PO4 30%. Campuran
tersebut diaduk dengan pengaduk magnet selama 6 jam, kemudian disaring residu padatnya. Setelah disaring, ampas sagu tersebut dicuci beberapa kali dengan akuades untuk membersihkan sisa asam, lalu dikeringkan pada suhu 105 oC di dalam oven,
kemudian digiling dan diayak.
Aktivasi Basa Ampas Sagu
Ampas sagu yang telah dicuci ditimbang sebanyak 10 g ke dalam Erlenmeyer dan ditambahkan 250 mL NaOH 0.1 N. Campuran tersebut diaduk selama 6 jam, kemudian disaring residu padatnya. Setelah disaring, ampas sagu tersebut dicuci beberapa kali dengan akuades untuk membersihkan sisa basa, lalu dikeringkan pada suhu 105 oC
di dalam oven, kemudian digiling dan diayak.
Aktivasi Asam Kaolin dan Bentonit
Kaolin ditimbang sebanyak 30 g ke dalam labu bulat dan ditambahkan 250 mL H2SO4 30%. Campuran tersebut diaduk
dengan pengaduk magnet sambil dipanaskan pada suhu 90−100 °C selama 6 jam, kemudian didinginkan dan disaring dengan penyaring vakum. Kaolin lalu dicuci beberapa kali dengan akuades untuk membersihkan sisa asam. Keberadaan ion SO42- dideteksi menggunakan larutan BaCl2.
Kaolin yang telah dicuci tersebut dikeringkan pada suhu 105 °C, kemudian diayak. Aktivasi bentonit merujuk pada metode aktivasi kaolin.
Pembuatan Adsorben Kaolin-Ampas sagu dan Bentonit-Ampas sagu
Kaolin dan bentonit yang telah diaktivasi dicampur hingga merata dengan sejumlah ampas sagu yang juga telah diaktivasi. Komposisi campuran ampas sagu dengan kaolin dan bentonit yang dibuat yaitu 100:0 :25:75; 50:50; dan 75:25. Selanjutnya adsorben diberi nama sebagai berikut,
A. ampas sagu teraktivasi basa, B. ampas sagu teraktivasi asam, C. bentonit teraktivasi asam, D. kaolin teraktivasi asam,
E. ampas sagu teraktivasi basa-bentonit teraktivasi asam (25 : 75),
F. ampas sagu teraktivasi basa-bentonit teraktivasi asam (50 : 50),
G. ampas sagu teraktivasi basa-bentonit teraktivasi asam (75 : 25),
H. ampas sagu teraktivasi basa-kaolin teraktivasi asam (25 : 75),
I. ampas sagu teraktivasi-basa-kaolin teraktivasi asam (50 : 50),
J. ampas sagu teraktivasi basa-kaolin teraktivasi asam (75 : 25),
K. ampas sagu teraktivasi asam-bentonit teraktivasi asam (25 : 75),
L. ampas sagu teraktivasi asam-bentonit teraktivasi asam (50 : 50),
M. ampas sagu teraktivasi asam-bentonit teraktivasi asam (75 : 25),
N. ampas sagu teraktivasi asam-kaolin teraktivasi asam (25 : 75),
O. ampas sagu teraktivasi asam-kaolin teraktivasi asam (50 : 50), dan
P. ampas sagu teraktivasi asam-kaolin teraktivasi asam (75 : 25).
Adsorpsi Pb2+ Pembuatan Larutan Pb2+
Larutan stok Pb2+ 1000 mg/L dibuat
sebanyak 1L dari Pb(NO3)2. Larutan Pb2+
1000 ppm kemudian diencerkan menjadi 100 pm dan dibuat kurva standar dari larutan hasil pengenceran larutan stok ini dengan konsentrasi 1, 2, 4, 6, 8, dan 10 mg/L.
Seleksi Adsorben
Masing-masing adsorben dari 16 jenis tersebut ditimbang sebanyak 0.4 g ke dalam Erlenmeyer, kemudian ditambahkan 50 mL larutan Pb2+ 16 mg/L. Larutan berisi adsorben
tersebut lalu dikocok selama 15 menit, setelah itu disaring dan diambil filtratnya, kemudian diukur absorbansnya dengan AAS pada panjang gelombang 217 nm. Setelah itu dihitung masing-masing nilai kapasitas dan efisiensi adsorpsinya. Adsorben yang memiliki nilai kapasitas tertinggi selanjutnya ditentukan waktu dan bobot optimumnya.
Penentuan Waktu Optimum Adsorben
Sebanyak 0.5 g adsorben yang sudah diseleksi dimasukkan ke dalam 50 mL larutan Pb2+ 100 mg/L, kemudian larutan dikocok
selama waktu yang ditentukan. Variasi waktu adsorpsi yang digunakan ialah 15, 30, 45, 60, 90, dan 120 menit. Campuran kemudian disaring filtratnya dan diukur absorbansnya dengan AAS pada panjang gelombang 217
nm. Setelah itu, dihitung nilai efisiensi adsorpsi dan kapasitas adsorpsinya.
Penentuan Bobot Optimum Adsorben
Variasi bobot adsorben yang digunakan adalah 0.25, 0.5, 1.0, dan 2.0 g. Masing-masing ditambahkan 50 mL larutan Pb2+ 60
mg/L, kemudian dikocok selama waktu optimum. Campuran disaring dan absorbans filtrat diukur dengan AAS pada panjang gelombang 217 nm. Setelah itu, dihitung nilai efisiensi adsorpsi dan kapasitas adsorpsinya
Penentuan Isoterm Adsorpsi
Adsorben ditimbang sebanyak bobot optimum kemudian ditambahkan 50 mL larutan Pb2+ pada berbagai konsentrasi, yaitu
50, 75, 100, 125, dan 150 mg/L, kemudian dikocok pada waktu optimum. Setelah itu, disaring dan diambil filtratnya untuk diukur absorbansnya dengan AAS pada panjang gelombang 217 nm.
Persamaan regresi linear menggunakan persamaan Langmuir dan Freundlich dibuat untuk menentukan jenis isoterm yang sesuai.
Penentuan Waktu Optimum dan Pengaruh Bobot Adsorben Arang Aktif
Metode penentuan waktu dan bobot optimum adsorben arang aktif dilakukan dengan merujuk pada metode penentuan waktu optimum dan bobot optimum adsorben diatas.
HASIL DAN PEMBAHASAN
Aktivasi Ampas Sagu, Kaolin, danBentonit
Adsorben yang akan digunakan diaktivasi terlebih dahulu agar jumlah pori-pori yang terbuka lebih banyak sehingga luas permukaannya semakin bertambah. Ampas sagu, kaolin, dan bentonit mula-mula dicuci dengan akuades untuk membersihkan pengotor-pengotor yang larut di dalam air. Ampas sagu kemudian diaktivasi dengan 2 cara, yaitu ada yang menggunakan H3PO4
30% dan ada yang menggunakan NaOH 0.1 N untuk membersihkan senyawa-senyawa selain polisakarida seperti mineral, protein, dan lemak yang larut dalam asam dan basa sehingga diharapkan tidak menutupi pori-pori adsorben yang dapat mengganggu mekanisme adsorpsi ion Pb2+.
Aktivasi kaolin dan bentonit menggunakan asam diharapkan akan
menghasilkan mineral dengan situs aktif dan keasamaan permukaan yang lebih besar, sehingga kemampuan adsorpsi yang dihasilkan akan lebih tinggi dibandingkan sebelum diaktivasi. Asam yang digunakan untuk mengaktivasi kaolin dan bentonit adalah H2SO4 karena H2SO4 memiliki jumlah
ekivalen H+ lebih tinggi dibanding dengan
HCl ataupun HNO3 (Suarya 2008).
Lapisan Silikat Lapisan Kation 7Na+
Pertukaran Kation
Kalsinasi
Proses yang terjadi pada aktivasi kaolin menggunakan H2SO4 30%, yaitu
komponen-komponen seperti Fe2O3, Al2O3, CaO, dan
MgO yang mengisi ruang antarlapisan kaolin menjadi larut serta pengotor-pengotor yang melekat pada permukaan kaolin pun dibersihkan sehingga menambah luas permukaan adsorben. Ion-ion Ca2+ dan Mg2+
yang berada pada permukaan adsorben secara berangsur-angsur juga akan digantikan oleh ion H+ dari H
2SO4 (Gambar 4).
Gambar 5 Skema interaksi proton pada struktur bentonit (Darma 2010).
Seleksi Adsorben
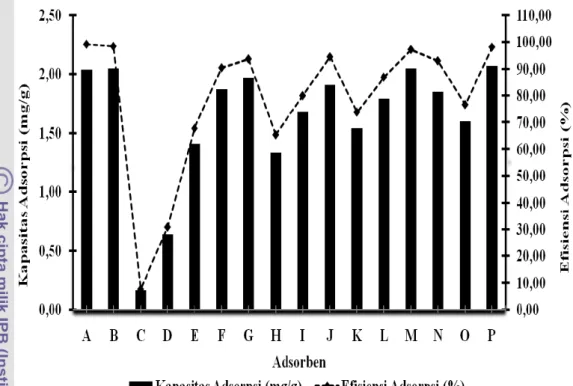
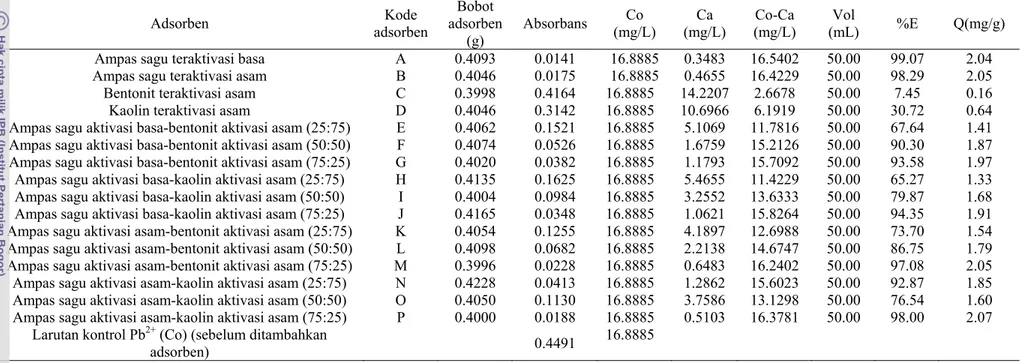
Adsorben yang digunakan pada tahap seleksi adalah ampas sagu teraktivasi asam, ampas sagu teraktivasi basa, bentonit teraktivasi asam, kaolin teraktivasi asam, dan masing-masing campuran antara ampas sagu dengan bentonit dan kaolin yang dibuat dengan perbandingan 100:0 ; 25:75 ; 50:50 ; dan 75:25, sehingga total adsorben yang diseleksi terdapat 16 jenis (Lampiran 2).
Adsorpsi masing-masing adsorben dilakukan pada bobot dan waktu yang sama yaitu selama 15 menit dengan bobot 0.4 g. Larutan yang digunakan adalah larutan tunggal Pb2+ dengan konsentrasi awal 16
mg/L (Lampiran 2). Berdasarkan nilai efisiensi adsorpsinya, adsorben ampas sagu yang teraktivasi asam maupun basa serta campurannya mampu menjerap Pb2+ dengan
kisaran 60–90% dan nilai kapasitas adsorpsinya berkisar antara 1-2 mg/g (Gambar 6). Hal ini membuktikan bahwa ampas sagu dan campurannya dengan bentonit maupun kaolin dapat digunakan sebagai adsorben ion Pb2+. Sebaliknya,
adsorben bentonit teraktivasi asam (C) dan kaolin teraktivasi asam (D) memiliki nilai kapasitas adsorpsi dan efisiensi adsorpsi yang lebih rendah dibandingkan dengan ampas sagu dan campurannya yaitu 0.16 dan 0.64 mg/g serta 7.45% dan 30.72%.
Gambar 4 Skema interaksi proton pada struktur kaolin (Dudkin et al. 2004).
Begitu juga halnya pada aktivasi bentonit. Kation logam seperti Na+, Ca2+, dan Mg2+
dalam struktur bentonit digantikan dengan H+
dari H2SO4 (Gambar 5), aktivasi bentonit
dengan asam mineral juga diharapkan dapat melarutkan sebagian Al2O3 pada daerah antar
ruang dan meningkatkan perbandingan SiO2 :
Al2O3 dari (2 – 3):1 menjadi (5 – 6):1
Gambar 6 Kurva kapasitas dan efisiensi adsorpsi masing-masing adsorben pada tahap seleksi Adsorben yang memiliki nilai efisiensi
adsorpsi yang cukup besar (kisaran 90%) ada 8 jenis yaitu ampas sagu teraktivasi basa (A), ampas sagu teraktivasi asam (B), ampas sagu aktivasi basa-bentonit aktivasi asam (50:50) (F), ampas sagu aktivasi basa-bentonit aktivasi asam (75:25) (G), ampas sagu aktivasi basa-kaolin aktivasi asam (75:25) (J), ampas sagu aktivasi asam-bentonit aktivasi asam (75:25) (M), ampas sagu aktivasi asam-kaolin aktivasi asam (25:75) (N), dan ampas sagu aktivasi asam-kaolin aktivasi asam (75:25) (P). Hal ini menunjukkan bahwa aktivasi ampas sagu dengan asam lemah dan basa encer dapat meningkatkan luas permukaan dan pori-pori adsorben, sehingga dapat meningkatkan efisiensi adsorpsi bentonit dan kaolin yang relatif rendah.
Berdasarkan hasil seleksi, adsorben campuran yang diambil untuk ditentukan kondisi optimumnya adalah campuran ampas sagu aktivasi asam-bentonit aktivasi asam (75:25) (M) dan campuran ampas sagu aktivasi asam-kaolin aktivasi asam (75:25) (P) karena kedua adsorben campuran ini memiliki nilai kapasitas adsorpsi yang lebih tinggi dibandingkan adsorben campuran lainnya (Lampiran 2). Ampas sagu teraktivasi asam (B) yang tanpa dicampur kaolin maupun bentonit dicari kondisi optimumnya sebagai blanko, sedangkan arang aktif komersil yang sering digunakan di perusahaan-perusahaan
dicari pula kondisi optimumnya untuk dibandingkan dengan ketiga adsorben ini, maka jumlah adsorben yang ditentukan kondisi optimumnya ada empat jenis. Kondisi optimum adsorpsinya diukur berdasarkan dua parameter, yaitu waktu adsorpsi dan bobot adsorben. Setelah itu, ditentukan jenis isoterm adsorpsinya.
Waktu optimum atau waktu setimbang adalah waktu dimana adsorben telah jenuh dengan adsorbat. Faktor lain yang mempengaruhi kapasitas dan efisiensi adsorpsi adalah bobot adsorben. Semakin banyak bobot adsorben yang digunakan maka diharapkan luas permukaan akan lebih besar sehingga mampu mengadsorpsi lebih banyak adsorbat. Kisaran bobot yang digunakan adalah 0.25 – 2 g.
Kondisi Optimum Adsorben Ampas Sagu Teraktivasi Asam
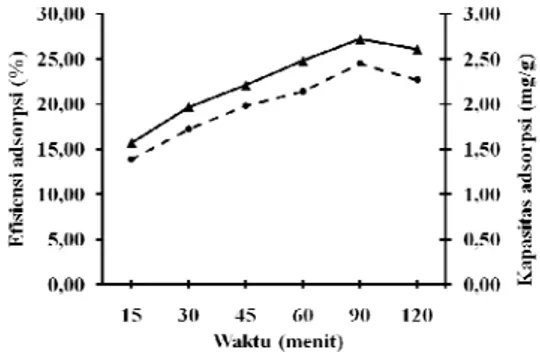
Waktu optimum adsorben ampas sagu teraktivasi asam (adsorben B) adalah 45 menit (Gambar 7) dengan kapasitas adsorpsi rerata maksimum 11.59 mg/g dan efisiensi adsorpsi rerata 98.92% (Lampiran 3), artinya setiap 1 gram adsorben B mampu mengadsorpsi 11.59 mg ion Pb2+ dalam waktu 45 menit. Larutan
Pb2+ yang diadsorpsi berkonsentrasi 118.6000
mg/L, sehingga berdasarkan nilai efisensi adsorpsinya, adsorben ampas sagu teraktivasi
asam dapat menurunkan konsentrasi Pb2+
menjadi 1.2809 mg/L.
Gambar 7 Waktu optimum adsorpsi adsorben ampas sagu teraktivasi asam. Pada penentuan bobot optimum adsorben ampas sagu teraktivasi asam, hasilnya menunjukkan bahwa efisiensi adsorpsi ion Pb2+ meningkat dari 28.75% sampai 95.14%.
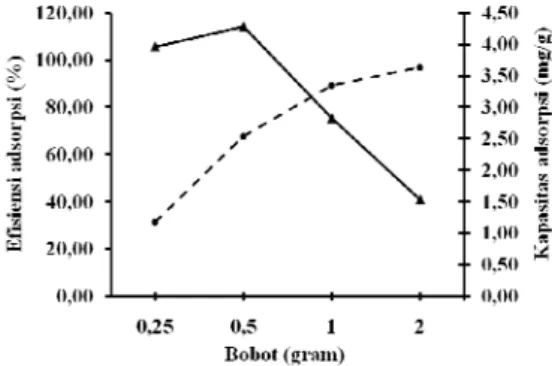
Bobot optimum didapatkan pada 0.5 g (Gambar 8) dengan kapasitas adsorpsi maksimum yaitu 3.00 mg/g. Setelah melewati 0.5 g, kapasitas adsorpsinya menurun (Lampiran 7).
Gambar 8 Bobot optimum adsorben ampas sagu teraktivasi asam.
Kondisi Optimum Adsorben Campuran Ampas Sagu Teraktivasi Asam-Bentonit
(75:25)
Waktu optimum adsorben campuran ampas sagu teraktivasi asam-bentonit teraktivasi asam (75:25) (adsorben M) adalah 90 menit (Gambar 9) dengan kapasitas adsorpsi rerata maksimum 6.52 mg/g dan efisiensi adsorpsi rerata 58.74% (Lampiran 4), artinya setiap 1 g adsorben M mampu
mengadsorpsi 6.52 mg ion Pb2+ dalam waktu
90 menit. Larutan Pb2+ yang diadsorpsi
berkonsentrasi 111.0256 mg/L, sehingga berdasarkan nilai efisiensi adsorpsinya, adsorben campuran ampas sagu teraktivasi asam-bentonit teraktivasi asam (75:25) dapat menurunkan konsentrasi Pb2+ menjadi 45.8092
mg/L.
Gambar 9 Waktu optimum adsorpsi adsorben ampas sagu teraktivasi asam-bentonit aktivasi asam (75:25). Pada penentuan bobot optimum adsorben campuran ampas sagu teraktivasi asam-bentonit teraktivasi asam (75:25) (adsorben M), hasilnya menunjukkan bahwa efisiensi adsorpsi ion Pb2+ meningkat dari 31.32%
sampai 96.81%. Bobot optimum didapatkan pada 0.5 g (Gambar 10) karena kapasitas adsorpsinya maksimum yaitu 4.28 mg/g (Lampiran 8).
Gambar 10 Bobot optimum adsorben ampas sagu teraktivasi asam-bentonit teraktivasi asam (75:25).
Kondisi Optimum Adsorben Campuran Ampas Sagu Teraktivasi Asam-Kaolin
(75:25)
Waktu optimum adsorben campuran ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) (adsorben P) adalah 30 menit
(Gambar 11) dengan kapasitas adsorpsi rerata maksimum 8.22 mg/g dan efisiensi adsorpsi rerata 69.31% (Lampiran 5), artinya setiap 1 g adsorben M mampu mengadsorpsi 8.22 mg ion Pb2+ dalam waktu 30 menit. Larutan Pb2+
yang diadsorpsi berkonsentrasi 118.8800 mg/L, sehingga berdasarkan nilai efisiensi adsorpsinya, adsorben campuran ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) dapat menurunkan konsentrasi Pb2+
menjadi 36.4843 mg/L.
Gambar 11 Waktu optimum adsorpsi adsorben ampas sagu teraktivasi asam-kaolin aktivasi asam (75:25). Pada penentuan bobot optimum adsorben campuran ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) (adsorben P), hasilnya menunjukkan bahwa efisiensi adsorpsi ion Pb2+ meningkat dari 38.31%
sampai 97.25%. Bobot optimum didapatkan pada 0.25 g (gambar 12) karena kapasitas adsorpsinya maksimum yaitu 5.02 mg/g (Lampiran 9).
Gambar 12 Bobot optimum adsorben ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25).
Kondisi Optimum Adsorben Arang Aktif
Waktu optimum adsorben arang aktif adalah 90 menit (Gambar 13) dengan kapasitas adsorpsi rerata maksimum 2.72 mg/g dan efisiensi adsorpsi rerata 24.52% (Lampiran 6), artinya 1 g arang aktif mampu mengadsorpsi 2.72 mg ion Pb2+ dalam waktu
90 menit. Larutan Pb2+ yang diadsorpsi
berkonsentrasi 116.8250 mg/L, sehingga berdasarkan nilai efisensi adsorpsinya, arang aktif dapat menurunkan konsentrasi Pb2+
menjadi 88.1795 mg/L.
Gambar 13 Waktu optimum arang aktif. Pada penentuan bobot optimum adsorben arang aktif, hasilnya menunjukkan bahwa efisiensi adsorpsi ion Pb2+ meningkat dari
2.73% sampai 97.09%. Bobot optimum didapatkan pada 1 g (Gambar 14) karena kapasitas adsorpsinya maksimum yaitu 2.32 mg/g (Lampiran 10).
Gambar 14 Bobot optimum arang aktif.
Pengaruh Waktu Adsorpsi dan Bobot Adsorben
Hasil penelitian menunjukkan bahwa kapasitas dan efisiensi adsorpsi meningkat seiring dengan bertambahnya waktu adsorpsi, selanjutnya setelah melewati waktu optimum, kapasitas adsorpsi cenderung stabil bahkan
menurun. Penurunan kapasitas adsorpsi setelah mencapai nilai optimum dimungkinkan karena terjadi pelepasan kembali ikatan antara sisi aktif pada adsorben dengan ion Pb2+ (desorpsi) akibat semakin
lamanya waktu kontak antara adsorben dan adsorbat karena adsorben telah jenuh oleh ion adsorbat. Pada penelitian ini, bobot optimum diambil hanya berdasarkan nilai kapasitas adsorpsi yang paling tinggi, namun nilai efisiensi adsorpsinya sendiri tidak dalam keadaan optimum. Hal ini karena dari hasil yang didapatkan menunjukkan bahwa nilai kapasitas adsorpsi tidak berbanding lurus dengan efisiensi adsorpsi, kenaikan bobot adsorben meningkatkan efisiensi adsorpsi namun justru menurunkan nilai kapasitas adsorpsi. Hal ini karena kenaikan bobot adsorben pada waktu adsorpsi dan konsentrasi adsorbat yang tetap menyebabkan peningkatan jumlah tapak aktif yang akan meningkatkan penyebaran adsorbat sehingga waktu yang dibutuhkan untuk mencapai kesetimbangan adsorpsi juga lebih lama. Setelah melewati bobot optimum, kapasitas adsorpsi cenderung menurun karena pada bobot optimum, hampir seluruh permukaan adsorben telah terikat dengan adsorbat, sementara pada bobot di atas bobot optimum, masih banyak tapak aktif yang belum berikatan dengan adsorbat.
Perbandingan Kinerja Adsorben
Kinerja dari 3 jenis adsorben yang ditentukan kondisi optimumnya dievaluasi dengan cara membandingkan kemampuan adsorpsinya dengan adsorben komersial, yaitu arang aktif. Hasil penelitian pada Tabel 1 menunjukkan bahwa nilai kapasitas dan efisiensi adsorpsi ion Pb2+ ketiga adsorben ini
lebih besar daripada arang aktif komersial. Tabel 1 Perbandingan kinerja adsorben
Adsorben Waktu optimum (menit) Qmax (mg/g) %E Bobot optimum (gram) B 45 11.59 98.92 0.5 M 90 6.52 58.74 0.5 P 30 8.01 68.77 0.25 AA 90 2.72 24.52 1
B = ampas sagu teraktivasi asam
M =ampas sagu teraktivasi asam-bentonit (75:25) P = ampas sagu teraktivasi asam-kaolin (75:25) AA = arang aktif
Q = kapasitas adsorpsi (mg/g) %E = efisiensi adsorpsi (%)
Adsorben ampas sagu teraktivasi asam (B) memiliki kapasitas dan efisiensi adsorpsi adsorpsi tertinggi. Hal ini kemungkinan
disebabkan proses aktivasi menggunakan H3PO4 yang selain berfungsi membersihkan
pengotor-pengotor dan senyawa-senyawa lain selain polisakarida sehingga dapat meningkatkan porositas granular padatan adsorben. H3PO4 juga dapat mengaktifkan
gugus hidroksi (-OH) polisakarida yang banyak terkandung di dalam ampas sagu. Gugus hidroksi ini bersifat polar (Melisya 2010).
Adsorben campuran ampas sagu teraktivasi asam dengan kaolin dan bentonit memiliki kapasitas adsorpsi lebih kecil daripada ampas sagu yang tidak dicampur. Pada tahap seleksi, bentonit dan kaolin memang memiliki kapasitas adsorpsi yang lebih rendah daripada ampas sagu teraktivasi asam (Lampiran 2).
Karakteristik yang mempengaruhi proses adsorpsi antara lain ukuran adsorbat dan ukuran pori-pori adsorben. Semakin besar ukuran pori-pori adsorben, maka adsorbat akan semakin mudah terjerap (Suzuki 1990). Ukuran jari-jari atom Pb sangat kecil, yaitu 175 pm. Ukuran pori-pori adsorben yang digunakan lebih besar dari Pb.
Ampas sagu memiliki ukuran pori yang sangat kecil atau ultramikropori karena ukuran diameter porinya kurang dari 0,7 nm (Aripin
et al. 2010), namun ampas sagu mengandung
banyak polisakakarida. Salah satunya adalah lignoselulosa. Lignoselulosa memiliki kapasitas penukar ion karena banyak terdapat sisi aktif untuk mengadsorpsi ion Pb2+.
Permukaan lignoselulosa memiliki porositas yang cukup tinggi. Selain itu, adsorpsi ion Pb2+ pada lignoselulosa tidak bergantung pada
ukuran partikelnya (Rowell 2006).
Kaolin memiliki pori-pori dengan diameter berkisar antara 40 - 100 nm (Nandi et al. 2009). Bentonit memiliki 3 jenis ukuran pori-pori berdasarkan diameternya, yaitu mikropori-pori (diameter di bawah 2 nm), mesopori (diameter 2 – 50 nm), dan makropori (diameter di atas 50 nm) (Onal et al. 2002). Dilihat dari nilai kapasitas adsorpsi bentonit yang lebih kecil daripada kaolin, kemungkinan ukuran pori-pori bentonit untuk mengadsorpsi ion Pb2+
lebih kecil daripada kaolin.
Pada adsorpsi ion Pb2+ dengan bentonit,
kemungkinan lain penyebab kecilnya nilai kapasitas dan efisiensi adsorpsinya pada proses aktivasi dengan H2SO4 selama 6 jam
pada suhu 90-100°C tidak cocok untuk struktur bentonit. Kemungkinan ada sebagian ikatan antara alumina dan silika yang putus sehingga sisi aktif untuk mengadsorpsi Pb2+
antar lapisannya yang lemah. Pada kaolin, ikatan strukturnya lebih kuat sehingga tidak mudah putus (Supeno 2007). Maka nilai kapasitas dan efisiensi adsorpsi kaolin pun lebih tinggi daripada bentonit.
Bentonit dan kaolin pada penelitian sebelumnya terbukti dapat mengadsorpsi senyawa-senyawa polutan organik persisten seperti heksakloroetana (Darma 2010) dan pemucat zat warna dengan efisiensi dan kapasitas adsorpsi yang bagus. ion logam berat memiliki sifat yang berbeda dengan senyawa-senyawa tersebut sehinga kemampuan adsorpsinya pada bentonit dan kaolin pun berbeda.
Adsorben arang aktif komersil justru memiliki nilai kapasitas dan efisiensi adsorpsi yang paling kecil dibandingkan ketiga adsorben yang lain. Hal ini kemungkinan diakibatkan arang aktif kurang cocok sebagai adsorben logam berat karena berdasarkan fungsinya, arang aktif terbagi menjadi 2 jenis, yaitu sebagai pemucat warna dan penyerap uap (Sembiring & Sinaga 2003). Selain itu, permukaan arang aktif bersifat nonpolar sehingga kurang efektif untuk mengadsorpsi Pb2+. Berdasarkan bentuknya pula, arang aktif
terbagi menjadi 2 jenis, yaitu serbuk (powder
activated carbon) dan granul (granular activated carbon). Ukuran partikel arang aktif
serbuk berkisar antara 15 – 25 pm (Suzuki 1990), sedangkan arang aktif granul berdiameter antara 10 - 200Ǻ Arang aktif yang digunakan pada penelitian ini kemungkinan adalah jenis powder activated
carbon karena ukuran partikelnya lebih kecil,
maka ukuran pori-porinya pun semakin kecil. Ukuran pori-pori yang kecil menyebabkan proses adsorpsi menjadi tidak optimum sehingga nilai kapasitas dan efisiensi adsorpsinya pun rendah.
Adsorben campuran M dan P memiliki kapasitas adsorpsi yang lebih besar dari arang aktif, namun pada adsorben M, waktu optimumnya sama dengan arang aktif yaitu 90 menit. Berdasarkan data tersebut, kemungkinan besar adsorben yang akan digunakan di industri adalah adsorben B dan P karena waktu dan bobot yang digunakan lebih sedikit namun kapasitas adsorpsinya lebih besar sehingga dapat meningkatkan efisiensi produksi, maka adsorben yang diukur tipe isotermnya hanya 2, yaitu ampas sagu teraktivasi asam (B) dan ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) (P).
Isoterm Adsorpsi
Tipe isoterm adsorpsi dapat digunakan untuk mengetahui proses terbentuknya lapisan adsorbat pada permukaan adsorben apakah
monolayer atau multilayer. Kurva isoterm
adsorpsi Langmuir dibuat dengan cara menghubungkan c/(x/m) terhadap c, sedangkan isoterm adsorpsi Freundlich dibuat dengan menghubungkan log x/m terhadap log c.
Gambar 15 Isoterm Langmuir adsorpsi Pb2+
oleh ampas sagu teraktivasi asam.
Gambar 16 Isoterm Freundlich adsorpsi Pb2+
oleh ampas sagu teraktivasi asam.
Gambar 17 Isoterm Langmuir adsorpsi Pb2+
oleh ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25).
Gambar 18 Isoterm Freundlich adsorpsi Pb2+
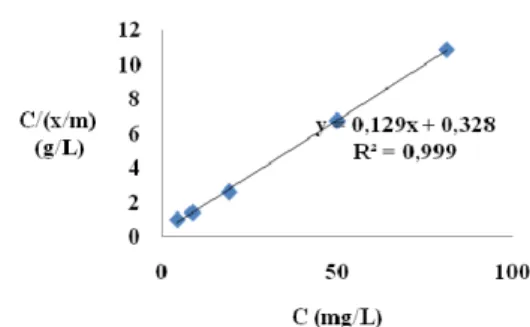
oleh ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25). Berdasarkan kurva diatas, isoterm adsorpsi Pb2+ dengan ampas sagu teraktivasi asam
mengikuti tipe isoterm Langmuir karena memiliki linearitas 99.90% (Gambar 15) dengan nilai α dan β masing-masing adalah 77.5194 dan 0.0393 (Lampiran 11). Adsorpsi ion Pb2+ dengan campuran adsorben ampas
sagu teraktivasi asam-kaolin teraktivasi asam (75:25) juga mengikuti tipe isoterm Langmuir karena memiliki linearitas sebesar 99.5% (Gambar 17) dengan nilai α dan β masing-masing adalah 6.0241 dan -0.2049 (Lampiran 11). Berdasarkan asumsi yang diambil dari tipe isoterm Langmuir, maka situs aktif pada permukaan adsorben ampas sagu teraktivasi asam dan campuran ampas sagu teraktivasi asam-bentonit (75:25) bersifat homogen dan lapisan adsorbat yang terbentuk pada permukaan adsorben adalah monolayer.
Pada tipe isoterm Langmuir, nilai α menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada permukaan adsorben. Nilai β merupakan konstanta yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben.
Gambar 19 Adsorpsi ion positif pada permukaan adsorben (Gunton 2004)
Berdasarkan teori isoterm Langmuir, terdapat sejumlah tertentu sisi aktif adsorben yang membentuk ikatan kovalen atau ion. Pada adsorpsi ion Pb2+ dengan ampas sagu,
kemungkinan terjadi proses pertukaran ion dengan gugus –OH dari polisakarida pada ampas sagu. Mekanisme pertukaran ionnya diperkirakan sebagai berikut,
M2+ adalah ion logam Pb2+, -OH adalah gugus
hidroksil polisakarida dan Y adalah matriks tempat gugus -OH terikat. Interaksi antara gugus -OH dengan ion logam juga memungkinkan melalui mekanisme pembentukan kompleks koordinasi karena atom oksigen (O) pada gugus -OH mempunyai pasangan elektron bebas, sedangkan ion logam mempunyai orbital d kosong. Pasangan elektron bebas tersebut akan menempati orbital kosong yang dimiliki oleh ion logam, sehingga terbentuk suatu senyawa atau ion kompleks. Ikatan kimia yang terjadi antara gugus aktif pada zat organik dengan ion logam berat berdasarkan teori interaksi asam-basa Lewis yang menghasilkan senyawa kompleks pada permukaan padatan. Pada sistem adsorpsi larutan ion logam, kemungkinan interaksi yang terjadi adalah,
[GH] + Mz+→[GM(z-1)]+ + H+
2[GH] + Mz+→[G
2M(z-2)]+ + 2H+
dimana GH adalah gugus fungsional yang terdapat pada zat organik, dan M adalah ion bervalensi z (Amri et al. 2004).
Pada adsorben ampas sagu teraktivasi asam, gugus –OH yang terdapat pada adsorben lebih banyak sehingga lebih banyak mengadsorpsi Pb2+, karena itulah nilai
kapasitas adsorpsinya lebih tinggi daripada saat dicampur dengan kaolin yang diaktivasi asam, namun kaolin tetap dapat mengadsorpsi Pb2+ karena Pb2+ diikat oleh Si pada kaolin,
kemungkinan proses adsorpsinya adalah
Ion Positif Adsorbat Ion Positif 2SiO- + Pb2+→(Si-O) 2 – Pb 2Si-OH + Pb2+→(Si-O) 2 – Pb + 2H+ (Omar 2007).
Mekanisme adsorpsi Pb2+ belum dapat
ditentukan apakah secara fisisorpsi atau kimisorpsi karena harus ada data pendukung yaitu menentukan termodinamika dan kinetika pada proses adsorpsi yang terjadi, sedangkan pada penelitian ini, kedua hal tersebut tidak dilakukan.
SIMPULAN DAN SARAN
SimpulanAdsorben ampas sagu teraktivasi asam dan campuran ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) merupakan adsorben yang memiliki kapasitas adsorpsi tertinggi dalam mengadsorpsi ion Pb2+. Kedua
adsorben ini diperoleh dari 16 variasi adsorben ampas sagu teraktivasi asam, ampas sagu teraktivasi basa, kaolin, bentonit, dan campurannya.
Adsorben ampas sagu teraktivasi asam dan campuran ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) terbukti dapat digunakan sebagai adsorben Pb2+. Kondisi
optimum adsorpsi ion Pb2+ dengan ampas sagu
teraktivasi asam dicapai pada waktu 45 menit dan bobot optimum 0.5 gram. Kondisi optimum adsorpsi ion Pb2+ dengan campuran
ampas sagu teraktivasi asam-kaolin teraktivasi asam (75:25) dicapai pada waktu 30 menit dan bobot optimum 0.25 gram.Tipe isoterm adsorpsi Pb2+ pada kedua adsorben tersebut
adalah tipe isoterm Langmuir.
Saran
Penentuan waktu dan bobot optimum pada penelitian ini hanya diambil berdasarkan nilai kapasitas adsorpsi yang paling tinggi, namun efisiensi adsorpsinya tidak optimum, sehingga bila ingin melihat pengaruh keduanya, disarankan untuk mengambil keadaan optimum pada persilangan kurva antara nilai kapasitas dan efisiensi adsorpsi.
Penelitian ini dilakukan menggunakan larutan tunggal. Penelitian selanjutnya dapat diujicobakan untuk mengadsorpsi Pb2+ pada
limbah campuran. Selain itu, dapat pula dilakukan penelitian lanjutan untuk mencari tipe mekanisme adsorpsi berupa fisisorpsi atau kimisorpsi.
DAFTAR PUSTAKA
Adenil A, Aziz S, Bujang K, M. Hassan A. 2010. Bioconversion of sago residue into value added products. Biotechnology 9 : 2016-2021.
Alemdaroglu T, Akkus G, Onal M, Sarikaya Y. 2003. Investigation of the surface acidity of a bentonite modifed by acid activation and thermal treatment. Turk J
Chem 27:675-681.
Amri A, Supranto, Fahrurozi M. 2004. Kesetimbangan adsorpsi optional campuran biner Cd(II) dan Cr(III) dengan zeolit alam terimpregnasi 2-merkaptobenzotiazol. Natur Indonesia 6: 111-117.
Aripin H, Lestari L, Ismail D, Sabchevski S. 2010. Sago waste based activated carbon film as an electrode material for electric double layer capacitor. Materials Science
Journal 4: 117-124.
Atkins PW. 1999. Kimia Fisik Jilid 1. Irma I Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry. Cahyani RD. 2010. Asetilasi selulosa ampas
sagu dan aplikasinya sebagai fase diam kromatografi kolom. [skripsi]. Bogor: Institut Pertanian Bogor.
Darma MS. 2010. Adsorptivitas kaolin dan bentonit teraktivasi terhadap heksakloroetana. [skripsi]. Bogor: Institut Pertanian Bogor.
Dewi KSP. 2009. Kemampuan adsorpsi batu pasir yang dilapisi besi oksida (Fe2O3)
untuk menurunkan kadar Pb dalam larutan.
Bumi Lestari 9:254-262.
Djoefrie HMHB. 1999. Pemberdayaan Tanaman Sagu sebagai Penghasil Bahan Pangan Alternatif dan Bahan Baku Agroindustri yang Potensial dalam Rangka Ketahanan Pangan Nasional [orasi ilmiah]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Dudkin B, Loukhina IV, Isupov VP, Avvakumov EG. 2005. Mechanical activation of kaolinite in the presence of concentrated sulfuric acid. Russian
Journal of Applied Chemistry 78:33-37.
Gunton C. 2004. Adsorption : Should we care.
Roach IC: 112-116.
Inel O, Albayrak F, Askin A. 1997. Cu and Pb adsorption on some bentonitic clays. Turk
J Chem 22:243–252.
Kadirvelu K, Kavipriya M, Karthika C, Radhika M, Vennilamani N, Pattabhi S. 2003. Utilization of various agricultural wastes for activated carbon preparation
and application for the removal of dyes and metals ions from aqueous solutions.
Biosource Technology 87:129-132.
Maheswari P, Venilamani N, Madhavakrishnan S, Shabudeen S, Venckatesh R, Pattabhi S. 2008. Utilization of sago waste as an adsorbent for the removal of Cu(II) ion from aqueous solution. Chemistry 5:233-242.
Mako E. Senkar Z . Kristof J. Vagvolgyi V. 2006. Surface modification of mechanochemically activated kaolinites by selective leaching. Colloid and Interface
Science 294:326-370.
Melisya N. 2010. Adsorpsi asam lemak bebas minyak goreng bekas menggunakan limbah padat tapioka. [skripsi]. Bogor: Institut Pertanian Bogor.
Nandi BK, Goswami A, Purkait MK. 2009. Adsorption characteristics of brilliant green dye on kaolin. Hazardous Materials 16: 387–395.
Omar W, Hossam A. 2007. Removal of Pb+2
ions from aqueous solutions by adsorption on kaolinite clay. Applied Sciences 4: 502-50.
Onal M, Sarikaya Y Alemdaroglu T. 2002. The Effect of acid activation on some physicochemical properties of a bentonite.
Turk J Chem 26: 409-416.
Quek SY.Wase DAJ. Forster CF. 1998. The use of sago waste for thes of lead and copper. Water SA 24:251-256.
Rowell RM. 2006. Removal of metal ions from contaminated water using agricultural residues. Di Dalam: International Conference on Environmentally-Compatible Forest Products; Fernando Pessoa University Portugal, 20-22 September 2006.
Sembiring MT, Sinaga TS. 2003. Arang aktif (pengenalan dan proses pembuatannya). [makalah]. Medan: Universitas Sumatera Utara.
Sembiring Z, Suharso, Regina, Marta F, Murniyarti 2008. Studi proses adsorpsi-desorpsi ion logam Pb(II), Cu(II), dan Cd(II) terhadap pengaruh waktu dan
konsentrasi pada biomassa nannochloropsis sp. yang terenkapsulasi aqua-gel silika dengan metode kontinyu. Di Dalam: Prosiding Seminar Nasional Sains dan Teknologi; Universitas Lampung, 17-18 November 2008.
Silitonga M. 2008.Pemanfaatan limbah bahan berbahaya dan beracun PT. Pertamina UP IV Cilacap Jawa Tengah sebagai bata tahan api (Teknik Solidifikasi) [skripsi]. Yogyakarta: Universitas Islam Indonesia. Suarya P. 2008. Adsorpsi pengotor minyak
daun cengkeh oleh lempung teraktivasi asam. Jurnal Kimia 2:19-24.
Sulistyawati S. 2008. Modifikasi tongkol jagung sebagai adsorben logam Pb [skripsi]. Bogor: Institut Pertanian Bogor.
Supeno M. 2007. Bentonit alam terpilar sebagai material katalis/Co-katalis pembuatan gas hidrogen dan oksigen dari air [disertasi]. Medan:Program Pascasarjana, Universitas Sumatera Utara. Suzuki M. 1990. Adsorption Engineering.
Tokyo : Kodansha.
Tampoebolon BIM. 2009. Kajian perbedaan aras dan lama pemeraman fermentasi ampas sagu dengan Aspergillus niger terhadap kandungan protein kasar dan serat kasar. Di Dalam: Seminar Nasional Kebangkitan Peternakan; Semarang, 20 Mei 2009.
Zhi-Rong L, Shao-Qi Z. 2010. Adsorption of copper and nickel on Na-bentonite.
Process Safety and Environmental Protection 88:62-66.
Lampiran 1 Diagram alir penelitian
Ampas sagu, kaolin, dan bentonit dicuci dengan
akuades
Ampas sagu, kaolin, dan bentonit dikeringkan
Ampas sagu diaktivasi dengan NaOH 0.1 N selama 6 jam Ampas Sagu aktivasi asam dicampurkan dengan kaolin aktivasi asam dengan nisbah (25:75), (50:50), (75:25), dan (100:0)
Kaolin dan bentonit diaktivasi dengan H2SO4 30 % pada
suhu 90 – 100 °C selama 6 jam
Ampas sagu diaktivasi dengan H3PO4 30 %
selama 6 jam
Penentuan waktu dan bobot optimum
Penentuan isoterm adsorpsi ion Pb2+
Seleksi Adsorben Ampas Sagu aktivasi asam dicampurkan dengan bentonit aktivasi asam dengan nisbah (25:75), (50:50), (75:25), dan (100: 0) Ampas Sagu aktivasi basa dicampurkan dengan kaolin aktivasi asam dengan nisbah (25:75), (50:50), (75:25), dan (100:0) Ampas Sagu aktivasi basa dicampurkan dengan bentonit aktivasi asam dengan nisbah (25:75), (50:50), (75:25), dan (100:0)
Lampiran 2 Seleksi adsorben
Tabel deret standar (λ 217 nm) pada seleksi adsorben
[Pb2+] (mg/L) Absorbans 2 0.0453 4 0.1077 6 0.1792 8 0.2422 10 0.2929 20 0.5567 25 0.6679
Tabel nilai kapasitas dan efisiensi masing-masing adsorben pada seleksi adsorben
Adsorben adsorben Kode
Bobot adsorben
(g) Absorbans
Co
(mg/L) (mg/L) Ca (mg/L) Co-Ca (mL) Vol %E Q(mg/g)
Ampas sagu teraktivasi basa A 0.4093 0.0141 16.8885 0.3483 16.5402 50.00 99.07 2.04
Ampas sagu teraktivasi asam B 0.4046 0.0175 16.8885 0.4655 16.4229 50.00 98.29 2.05
Bentonit teraktivasi asam C 0.3998 0.4164 16.8885 14.2207 2.6678 50.00 7.45 0.16
Kaolin teraktivasi asam D 0.4046 0.3142 16.8885 10.6966 6.1919 50.00 30.72 0.64
Ampas sagu aktivasi basa-bentonit aktivasi asam (25:75) E 0.4062 0.1521 16.8885 5.1069 11.7816 50.00 67.64 1.41
Ampas sagu aktivasi basa-bentonit aktivasi asam (50:50) F 0.4074 0.0526 16.8885 1.6759 15.2126 50.00 90.30 1.87
Ampas sagu aktivasi basa-bentonit aktivasi asam (75:25) G 0.4020 0.0382 16.8885 1.1793 15.7092 50.00 93.58 1.97
Ampas sagu aktivasi basa-kaolin aktivasi asam (25:75) H 0.4135 0.1625 16.8885 5.4655 11.4229 50.00 65.27 1.33
Ampas sagu aktivasi basa-kaolin aktivasi asam (50:50) I 0.4004 0.0984 16.8885 3.2552 13.6333 50.00 79.87 1.68
Ampas sagu aktivasi basa-kaolin aktivasi asam (75:25) J 0.4165 0.0348 16.8885 1.0621 15.8264 50.00 94.35 1.91
Ampas sagu aktivasi asam-bentonit aktivasi asam (25:75) K 0.4054 0.1255 16.8885 4.1897 12.6988 50.00 73.70 1.54
Ampas sagu aktivasi asam-bentonit aktivasi asam (50:50) L 0.4098 0.0682 16.8885 2.2138 14.6747 50.00 86.75 1.79
Ampas sagu aktivasi asam-bentonit aktivasi asam (75:25) M 0.3996 0.0228 16.8885 0.6483 16.2402 50.00 97.08 2.05
Ampas sagu aktivasi asam-kaolin aktivasi asam (25:75) N 0.4228 0.0413 16.8885 1.2862 15.6023 50.00 92.87 1.85
Ampas sagu aktivasi asam-kaolin aktivasi asam (50:50) O 0.4050 0.1130 16.8885 3.7586 13.1298 50.00 76.54 1.60
Ampas sagu aktivasi asam-kaolin aktivasi asam (75:25) P 0.4000 0.0188 16.8885 0.5103 16.3781 50.00 98.00 2.07
Larutan kontrol Pb2+ (Co) (sebelum ditambahkan
Contoh perhitungan (adsorben A) :
Persamaan garis pada kurva : 0.026x + 0.010 dengan R
2= 0.996
Co (mg/L) = absorbans Co – 0.010
0.026
Co (mg/L) = 0.4491 – 0.010 = 16.8885 mg/L
0.026
Ca (mg/L) = (0.0141 – 0.010) = 0.3483 mg/L
0.026
%E = (Co – Ca) x 100%
Co
%E = (16.8885 mg/L – 0.3483 mg/L) x 100% = 97.94%
16.8885 mg/L
Q (mg/g) = (Co – Ca) V
M
Q (mg/g) = (16.8885 mg/L – 0.3483 mg/L) 0.05 L = 2.02 mg/g
0.4093 g
Keterangan :
Co = konsentrasi ion Pb
2+sebelum diadsorpsi
Ca = konsentrasi ion Pb
2+setelah diadsorpsi
V = volume larutan Pb
2+(L)
%E = efisiensi adsorpsi
Q = kapasitas adsorpsi
M = massa adsorben (g)
Lampiran 3 Penentuan waktu optimum adsorben ampas sagu teraktivasi asam
(adsorben B)
Tabel deret standar (λ 217 nm) pada penentuan waktu optimum adsorben ampas
sagu teraktivasi asam
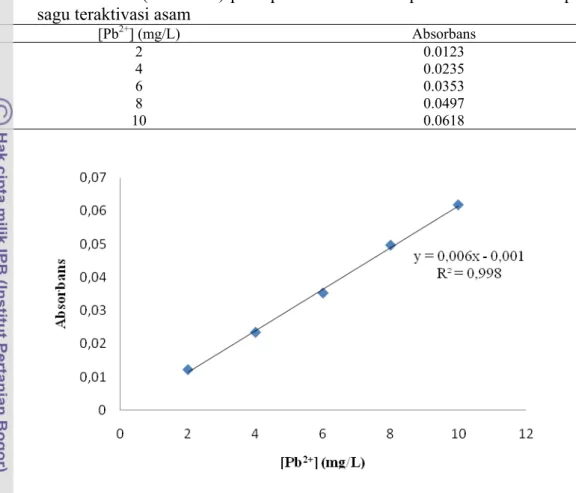
[Pb2+] (mg/L) Absorbans 2 0.0123 4 0.0235 6 0.0353 8 0.0497 10 0.0618
Gambar kurva standar (λ 217 nm) pada penentuan waktu optimum adsorben
ampas sagu teraktivasi asam
Tabel perhitungan efisiensi dan kapasitas adsorpsi pada penentuan waktu optimum ampas sagu teraktivasi asam
Waktu (menit) ulangan Bobot adsorben (gram) Absorbans Co (mg/L) Ca (mg/L) Co-Ca (mg/L) Vol (mL) %E %E rerata Q (mg/g) Q rerata (mg/g) 15 1 0.5002 0.0142 2 0.5021 0.0167 118.6000 118.6000 2.5333 2.9500 115.6500 50.00116.0667 50.00 97.86 97.51 11.52 97.69 11.60 11.56 30 1 0.5057 0.0095 2 0.5016 0.0076 118.6000118.6000 1.7500 116.8500 50.001.4333 117.1667 50.00 98.52 98.79 11.68 98.66 11.55 11.62 45 1 0.5006 0.0068 2 0.5021 0.0064 118.6000118.6000 1.3000 117.3000 50.001.2333 117.3667 50.00 98.90 98.96 11.69 98.93 11.72 11.70 60 1 0.5122 0.0067 2 0.5254 0.0052 118.6000118.6000 1.2833 117.3167 50.001.0333 117.5667 50.00 98.92 99.13 11.19 99.02 11.45 11.32 90 1 0.5205 0.0045 2 0.5029 0.0040 118.6000118.6000 0.9167 117.6833 50.000.8333 117.7667 50.00 99.23 99.30 11.71 99.26 11.30 11.51 120 1 0.5206 0.0035 2 0.5011 0.0044 118.6000118.6000 0.7500 117.8500 50.000.9000 117.7000 50.00 99.37 99.24 11.74 99.30 11.32 11.53 Kontrol Pb2+ 0.7106 118.6000 50.00Lampiran 4 Penentuan waktu optimum adsorben ampas sagu teraktivasi
asam-bentonit teraktivasi asam (75:25) (adsorben M)
Tabel deret standar (λ 217 nm) pada penentuan waktu optimum adsorben ampas
sagu teraktivasi asam – bentonit teraktivasi asam (75:25)
[Pb2+] (mg/L) Absorbans 1 0.0408 2 0.0713 4 0.1393 6 0.2255 8 0.3082 10 0.3922
Gambar kurva standar (λ 217 nm) pada penentuan waktu optimum adsorben
ampas sagu teraktivasi asam – bentonit teraktivasi asam (75:25)
Tabel perhitungan efisiensi dan kapasitas adsorpsi pada penentuan waktu optimum ampas sagu teraktivasi asam – bentonit teraktivasi asam
(75:25) (adsorben M)
Waktu (menit) Ulangan Gram adsorben Absorbans Co° (mg/L) Ca° (mg/L) P Co© (mg/L) Ca© (mg/L) Co©-Ca© (mg/L) Vol (mL) %E %E rerata Q (mg/g) Qrerata (mg/g) 15 1 0.5046 0.1867 5.5513 4.9667 10 111.0256 49.6667 61.3590 50.00 55.27 53.83 6.08 5,92 2 0.5046 0.1991 5.5513 5.2846 10 111.0256 52.8462 58.1795 50.00 52.40 5.76 30 1 0.5235 0.1777 5.5513 4.7359 10 111.0256 47.3590 63.6667 50.00 57.34 58.12 6.08 6,16 2 0.5241 0.1710 5.5513 4.5641 10 111.0256 45.6410 65.3846 50.00 58.89 6.24 45 1 0.5002 0.1829 5.5513 4.8692 10 111.0256 48.6923 62.3333 50.00 56.14 56.96 6.23 6,32 2 0.5002 0.1758 5.5513 4.6872 10 111.0256 46.8718 64.1538 50.00 57.78 6.41 60 1 0.5045 0.1802 5.5513 4.8000 10 111.0256 48.0000 63.0256 50.00 56.77 56.85 6.25 6,26 2 0.5045 0.1795 5.5513 4.7821 10 111.0256 47.8205 63.2051 50.00 56.93 6.26 90 1 0.5000 0.1689 5.5513 4.5103 10 111.0256 45.1026 65.9231 50.00 59.38 58.74 6.59 6,52 2 0.5006 0.1744 5.5513 4.6513 10 111.0256 46.5128 64.5128 50.00 58.11 6.44 120 1 0.5001 0.1746 5.5513 4.6564 10 111.0256 46.5641 64.4615 50.00 58.06 58.27 6.44 6,46 2 0.5006 0.1728 5.5513 4.6103 10 111.0256 46.1026 64.9231 50.00 58.48 6.48 Kontrol Pb2+ 0.2095 5.5513 20 111.0256 50.00Keterangan :
P = pengenceran
Co° = konsentrasi awal Pb
2+sebelum diadsorpsi sebelum dikalikan pengenceran (mg/L)
Ca° = konsentrasi akhir Pb
2+sesudah diadsorpsi sebelum dikalikan pengenceran (mg/L)
Co© = konsentrasi awal Pb
2+sebelum diadsorpsi sesudah dikalikan pengenceran (mg/L)
Ca© = konsentrasi akhir Pb
2+sesudah diadsorpsi sesudah dikalikan pengenceran (mg/L)
Lampiran 5 Penentuan waktu optimum adsorben ampas sagu teraktivasi
asam-kaolin teraktivasi asam (75:25) (adsorben P)
Tabel deret standar (λ 217 nm) pada penentuan waktu optimum adsorben ampas
sagu teraktivasi asam – kaolin teraktivasi asam (75:25)
[Pb2+] (mg/L) Absorbans 1 0.0188 2 0.0438 4 0.0864 6 0.1458 10 0.2432
Gambar kurva standar (λ 217 nm) pada penentuan waktu optimum adsorben
ampas sagu teraktivasi asam – kaolin teraktivasi asam (75:25)
Tabel perhitungan efisiensi dan kapasitas adsorpsi pada penentuan waktu optimum ampas sagu teraktivasi asam – kaolin teraktivasi asam
(75:25) (adsorben P)
Waktu
(menit) Ulangan adsorben Gram Absorbans (mg/L) Co° (mg/L) Ca° P (mg/L) Co© (mg/L) Ca© Co©-Ca© (mg/L) (mL) Vol %E rerata %E (mg/g) Q Qrerata (mg/g) 15 1 2 0.5000 0.5000 0.0990 5.9440 4.2400 10 118.8800 42.4000 76.4800 50.000.0862 5.9440 3.7280 10 118.8800 37.2800 81.6000 50.00 64.33 68.64 8.16 66.49 7.65 7.90 30 1 0.5012 2 0.5014 0.0727 0.0957 5.94405.9440 3.1880 10 118.88004.1080 10 118.8800 31.8800 87.0000 50.0041.0800 77.8000 50.00 73.18 65.44 7.76 69.31 8.68 8.22 45 1 0.5000 2 0.5000 0.1026 0.1060 5.94405.9440 4.3840 10 118.88004.5200 10 118.8800 43.8400 75.0400 50.0045.2000 73.6800 50.00 63.12 61.98 7.37 62.55 7.50 7.44 60 1 0.5019 2 0.5018 0.0898 0.0904 5.94405.9440 3.8720 10 118.88003.8960 10 118.8800 38.7200 80.1600 50.0038.9600 79.9200 50.00 67.43 67.23 7.96 67.33 7.99 7.97 90 1 0.5013 2 0.5014 0.0929 0.0879 5.94405.9440 3.9960 10 118.88003.7960 10 118.8800 39.9600 78.9200 50.0037.9600 80.9200 50.00 66.39 68.07 8.07 67.23 7.87 7.97 120 1 0.5006 2 0.5006 0.0839 0.0892 5.94405.9440 3.6360 10 118.88003.8480 10 118.8800 36.3600 82.5200 50.0038.4800 80.4000 50.00 69.41 67.63 8.03 68.52 8.24 8.14 Kontrol Pb2+ 0.1416 5.9440 20 118.8800 50.00
Keterangan :
P = pengenceran
Co° = konsentrasi awal Pb
2+sebelum diadsorpsi sebelum dikalikan pengenceran (mg/L)
Ca° = konsentrasi akhir Pb
2+sesudah diadsorpsi sebelum dikalikan pengenceran (mg/L)
Co© = konsentrasi awal Pb
2+sebelum diadsorpsi sesudah dikalikan pengenceran (mg/L)
Ca© = konsentrasi akhir Pb
2+sesudah diadsorpsi sesudah dikalikan pengenceran (mg/L)
Lampiran 6 Penentuan waktu optimum adsorben arang aktif
Tabel deret standar (λ 217 nm) pada penentuan waktu optimum adsorben arang aktif
[Pb2+] (mg/L) Absorbans 2 0.0106 4 0.0415 6 0.0768 8 0.1080 10 0.1316 15 0.1930 20 0.2519 25 0.3058 30 0.3627 35 0.4137
Tabel perhitungan efisiensi dan kapasitas adsorpsi pada penentuan waktu optimum adsorben arang aktif
Waktu
(menit) Ulangan adsorben Gram Absorbans (mg/L) Co (mg/L) Ca (mg/L) Co-Ca (mL) Vol %E rerata %E (mg/g) Q Q rerata (mg/g) 15 1 0.5130 2 0.5234 1.2036 1.2150 116.8250 116.8250 100.1333 101.0833 15.7417 50.0016.6917 50.00 14.29 13.47 1.50 13.88 1.63 1.57 30 1 0.5006 2 0.5200 1.1749 1.1496 116.8250116.8250 97.7417 19.0833 50.0095.6333 21.1917 50.00 16.33 18.14 2.04 17.24 1.91 1.97 45 1 0.5442 2 0.5036 1.1102 1.1412 116.8250116.8250 92.3500 24.4750 50.0094.9333 21.8917 50.00 20.95 18.74 2.17 19.84 2.25 2.21 60 1 0.5024 2 0.5053 1.1021 1.1054 116.8250116.8250 91.6750 25.1500 50.0091.9500 24.8750 50.00 21.53 21.29 2.46 21.41 2.50 2.48 90 1 0.5524 2 0.5001 1.0456 1.0748 116.8250116.8250 86.9667 29.8583 50.0089.4000 27.4250 50.00 25.56 23.48 2.74 24.52 2.70 2.72 120 1 0.5056 2 0.5134 1.0850 1.0856 116.8250116.8250 90.2500 26.5750 50.0090.3000 26.5250 50.00 22.75 22.70 2.58 22.73 2.63 2.61 Kontrol Pb2+ 1.4039 116.8250 50.00
Lampiran 7 Penentuan bobot optimum adsorben ampas sagu teraktivasi asam
Tabel deret standar (λ 217 nm) pada penentuan bobot optimum adsorben ampas
sagu teraktivasi asam
[Pb2+] (mg/L) Absorbans 2 0.0530 4 0.1032 6 0.1521 8 0.1979 10 0.2455