PRODUKSI DIMETHYL-ETHER SECARA LANGSUNG DARI GAS SINTESIS MENGGUNAKAN KATALIS Cu-ZnO-Al2O3-ZSM-5
Dijan Supramono 1, Hasbi Priadi 2
1. Teknik Kimia, Fakultas Teknik, Universitas Indonesia,Kampus Baru UI,Depok,16424, Indonesia 2. Rekayasa Produk Kimia dan Alam, Kampus Baru UI,Depok,16424, Indonesia
E-mail : [email protected]
ABSTRAK
Bahan LPG berbasis gas alam masih dominan seagai bahan bakar yang digunakan masyarakat, dimana pada masa yang akan datang kebutuhan masyarakat akan mengalami peningkatan dengan kemajuan industri. Pada penelitian ini telah dimbuat suatu bakar alternatif sebagai substitusi LPG dengan menggunakan dimetil eter (DME). Produksi DME melalui proses langsung dari gasifikasi batubara dan biomassa. Reaksi dilakukan di dalam reaktor unggun diam dengan katalis Cu-ZnO-Al2O3/ZSM-5. Tekanan yang digunakan adalah 20 bar. Variabel bebas yang digunakan yaitu variasi temperatur pada 250˚C, 270˚C, 280˚C dan rasio gas sintesis (H2/CO) untuk biomassa (H2/CO)=0,5 dan batubara (H2/CO)=2. Hasil produk terbesar yang didapatkan pada kondisi temperatur 270˚C dan rasio H2/CO=2 didapatkan yield sebesar 83%, analisa DME yang telah dihasilkan menggunakan gas kromatografi dengan jenis TCD dan FID untuk mengetahui hasil reaksi dari sintesis DME langsung.
ABSTRACT
Materials of natural gas-based LPG is still the dominant fuel used seagai society, where the future needs of the community will increase with the progress of industry. This research will make an alternative fuel as a substitute for LPG by using dimethyl ether (DME). DME production through the direct process of gasification of coal and biomass. The reaction carried out in the fixed bed reactor with catalyst Cu-ZnO-Al2O3/ZSM-5. The pressure used was 20 bar. The independent variables used were variations of temperature at 250 ˚ C, 270˚C, 280˚C and the ratio of synthesis gas (H2/CO) for biomass (H2/CO) = 0.5 and coal (H2/CO) = 2. The results of the largest product obtained under conditions of temperature 270 ˚ C and the ratio H2/CO = 2 obtained a yield of 83%, which has resulted DME analysis using gas chromatography with TCD and FID types to determine the reaction of the direct synthesis of DME.
Key word: Synthesis Gas, Direct DME synthesis, Cu-ZnO-Al2O3/ZSM-5
1. Pendahuluan
Penggunaan LPG meningkatkan efisiensi penggunaan energi karena nilai kalor LPG lebih tinggi dibandingkan minyak. Dengan pemakaian 1 liter minyak tanah akan setara dengan pemakaian 0,57 kg LPG. Besarnya subsidi yang diberikan untuk setiap pemakaian0,57 kg LPG dengan sendirinya akan lebih kecil dibandingkan dengan besaran subsidi untuk 1 liter minyak tanah. Dipastikan pemerintah akan mengalami penghematan
sebesar 20 triliun rupiah pertahun apabila program konversi LPG akan berjalan sesuai dengan rencana. (pertamina,2009)
Adanya program konversi minyak tanah menjadi LPG, maka terdapat peningkatan yang sangat signifikan dalam penggunaan LPG dalam keperluan rumah tangga pada umumnya. Akibatnya terjadi kelangkaan LPG dipasaran, berkaitan dengan kelangkaan LPG pemerintah bermaksud untuk menggunakan DME sebagai alternatif pengganti LPG. DME merupakan gas terbarukan (Renewable source), tidak beracun,ramah lingkungan dan memiliki harga yang ekonomis dibandingkan dengan LPG (Kadarwati,2010).
Kebutuhan LPG diperkirakan akan terus meningkat sejalan dengan program substitusi minyak tanah dengan LPG di sektor rumah tangga dan pertumbuhan jumlah penduduk. Sesuai dengan skenariodasar, kebutuhan LPG di indonesia di perkirakan akan meningkat 11 juta ton pada tahun 2030 dengan didominasi oleh penggunaan rumah tangga (89%). Walaupun produksi LPG dari kilang domestik diperkirakan mencapai 4,2 juta ton pertahun sejalan dengan penambahan kapasitas kilang, sumber LPG impor masih sangat diperlukan mecapai 55% pada tahun 2030. (BPPT - outlook energi indonesia, 2012)
Sebagian besar dari produksi batubara di Indonesia diekspor. Sesuai dengan skenario dasar, produksi batubara Indonesia akan meningkat dengan pertumbuhan rata-rata 5,7% pertahun, sehingga produksi batubara meningkat sekitar tiga kali lipat yaitu dari 270 juta ton pada 2010 menjadi 817 juta ton pada 2030. Sementara itu pertumbuhan kebutuhan batubara domestik akan mencapai 9,8% pertahun dalam periode 2010-2030 mencapai 407 juta ton pada tahun 2030. (BPPT - outlook energi indonesia, 2012)
Pada beberapa tahun terakhir, penelitian tentang DME sebagai pengganti LPG telah dilakukan. DME pada masa ini telah dibuat dengan dua proses yaitu sintesis metanol dan dehidrasi metanol. Untuk menggunakan DME sebagai bahan bakar diperlukan adanya biaya yang murah dalam skala yang besar. Sintesis DME yang berasal dari Syn-gas telah dikembangkan oleh perusahaan JFE dengan menggunakan reaktor yang berisi kolom gelembung semenjak 1989.
Dalam melakukan sintesis DME diperlukan dua tahap proses yaitu sintesis metanol dan dehidrasi metanol. Pada saait ini dikembangkan proses baru dalam melakukan sintesis DME yang dikatakan sebagai direct synthesis yaitu melakukan produksi DME tanpa melalui tahap sintesis metanol. Metode langsung (direct) sangat diminati karena ekonomis dan memiliki termodinamika yang rendah dibandingkan dengan dua tahap proses sintesis DME (Wang D, et al.2009)
2. Tinjauan Teoritis
2.1. Metode Direct Synthesis
Pada dasarnya sintesis DME yang berasal dari syn-gas dapat direpresentasikan dengan beberapa reaksi berikut ini ;
CO + 2H! ↔ CH!OH (1)
CO!+ 3H! ↔ CH!OH + H!O (2)
CO + H!O ↔ CO!+ H! (3)
2CH!OH ↔ CH!OCH!+ H!O (4) CO!+ H! ↔ CH!OCH!+ CO! (5)
Metanol dibentuk dengan hidrogenasi CO dan CO2 (reaksi (1) dan (2)) kemudian melakukan
proses dehidrasi untuk membentuk DME dan H2O (reaksi (4)). Air yang terbentuk bereaksi
dengan CO untuk membentuk CO2 dan H2 (reaksi (3)) yang dikenal dengan reaksi water gas shift (WGS). Dengan adanya katalis komposit, reaksi (1) sampai (3) akan di katalisasi dengan
komponen sintesis metanol yang berupa CuO-ZnO-Al2O3 dan reaksi (4) akan di katalisasi
dengan komponen ZSM-5. Penggunaan katalis komposit menyebabkan 2 tahapan umum sintesis DME berubah menjadi 1 tahap dalam proses sintesis, dimana dengan 1 tahapan akan menghemat biaya produksi DME serta meghemat energi yang dibutuhkan dalam memproduksi DME.
Inti permukaan katalis hybrid yaitu Cu dalam sintesis DME langsung menerapkan reaksi hidrogenasi, dimana dalam sintesis DME langsung ikatan C-O terhidrogenasi oleh Cu sehingga ikatan rangkap akan bereaksi dengan hidrogen (2H). Reaksi water gas shift merupakan salah satu tahapan yang terjadi di dalam inti katalis dimana terdapat dua proses yaitu ; dehidrogenasi H2O untuk O yang teradsorpsi dan CO2 yang terbentuk karena adanya
reaksi yang cepat antara CO dengan O yang teradsorpsi.
Metanol yang terbentuk karena hidrogenasi CO akan beralih pada permukaan asam katalis ZSM-5 dimana dihasilkan proton. Menurut teori kimia organik, terbentuk radikal yang meninggalkan H2O dan membentuk kation karbon. DME kemudian terbentuk dengan reaksi nucleophilic-displacement yang terjadi karena molekul metanol yang teradsorpsi pada kation
2.2. Katalis
Katalis yang digunakan dalam penelitian ini adalah Cu-ZnO-Al2O3-ZSM-5, dimana
katalis ini disebut sebagai katalis bifungsional memiliki fungsi ganda yatiu sintesis metanol dan dehidrasi metanol. Logam yang biasa digunakan dalam katalis bifungsional adalah logam-logam transisi.
Logam-logam transisi mempunyai daya adsorpsi yang kuat karena mempunyai pasangan elektron menyendiri pada orbital d. adanya elektron pada orbital d didukung dengan keadaan elektron orbital s akan menjadi konsentrasi yang lebih besar pada keaktifan yang tinggi dalam pemutusan dan pembentukan ikatan kimia. Hal ini yang menyebabkan logam-logam transisi makin reaktif sebagai katalis (Hegedus, at al, 1999).
Logam transisi Cu-ZnO-Al2O3 dan ZSM-5 memilki prospek untuk digunakan sebagai
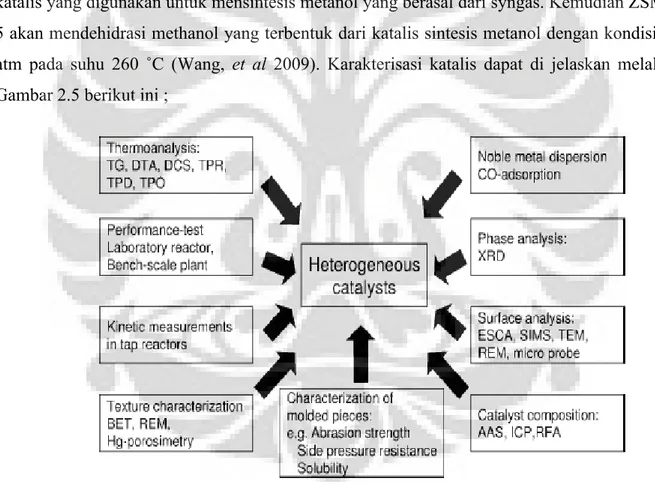
katalis yang digunakan untuk mensintesis metanol yang berasal dari syngas. Kemudian ZSM-5 akan mendehidrasi methanol yang terbentuk dari katalis sintesis metanol dengan kondisi 1 atm pada suhu 260 ˚C (Wang, et al 2009). Karakterisasi katalis dapat di jelaskan melalui Gambar 2.5 berikut ini ;
Gambar 2.1 Penerapan Karakteristik katalis (Sumber: Heri, et al.2005)
CuZnAl merupakan alloy oksida merupakan campuran sempurna Cu/ZnO/Al2O3. Perlu diperhatikan bahwa katalis tersebut harus melalui tahap aktivasi berupa
proses pereduksian agar dapat bekerja. Terlepas dari kedua sistem katalis yang disebutkan di atas, beberapa hasil penelitian mengungkapkan bahwa sintesis metanol (yang berarti juga sintesis DME) memiliki kaitan langsung dengan karakter fisika-kimia dari partikel tembaga
(Cu). Lebih tepatnya, tidak setiap partikel tembaga terlibat dalam proses katalisis dan hanya partikel tembaga berukuran nano yang terdispersi pada permukaan katalis saja yang aktif. Elemen tembaga pada partikel nano tersebut harus memiliki tingkat oksidasi tertentu. Seng (Zn) walaupun banyak disebutkan juga terlibat dalam proses katalis namun katalis ini berperan sebagai pengemban dan juga pendispersi tembaga. Seng memiliki karakter elektronik yang mirip dengan tembaga sehingga mereka bisa membentuk kristal sempurna sebagaimana kristal CuO maupun ZnO murni. Sifat ini memiliki dampak positif yaitu mencegah terbentuknya klaster partikel CuO atau kristal CuO yang besar. Sedangkan aluminium (Al) diyakini tidak terlibat dalam katalisis dan hanya sebagai penguat struktur katalis. Sekumpulan atom pada kondisi tertentu dapat membentuk partikel kristalin atau partikel amorfos yang aktif.
Dari sekian banyak pembahasan tentang gugus aktif sistem katalis CuZnAl, diperlukan dua pendapat yang saling menguatkan hasil-hasil penelitian terkini. Menurut (Nakamura et al. 2005),diperlukan suatu rasio tertentu antara Cu0 dan Cu+ pada sistem katalis berbahan dasar CuZn agar memiliki keaktifan tinggi .Demikian pula disebutkan bahwa gugus aktif katalis untuk sintesis metanol dari CO2dan H2 adalah gugus Cu-Zn, sedangkan untuk
sintesis metanol dari CO dan H2 gugus aktifnya adalah Cu-O-Zn.
2.4.1 Preparasi Katalis
Preparasi katalis sintesis DME dilakukan dengan metode kopresipitasi. Presipitasi merupakan proses reaksi terbentuknya padatan di dalam sebuah larutan sebagau hasil dari reaksi kimia. Presipitasi ini terbentuk ketika konsentrasi ion yang terlah larut mencapai batas kelarutan dah hasilnya adalah membentuk garam. Reaksi ini dapat dipercepat dengan menambahkan agen presipitasi atau mengurangi pelarutmya. Reaksi presipitasi yang cepat akan menghasilkan residu mikrokristalun dan proses yang lambat akan menghasilkan kristal tunggal. Kristal tunggal juga dapat diperoleh dari rekristalisasi dari garam dan mikrokristalin.
2.3. Kopresipitasi
Dalam menghasilkan katalis hybrid dilakukan kopresipitasi dimana proses ini dilakukan dengan menggabungkan dua elemen atau lebih, dimana salah satu dari elemen tersebut mengandung anion dan kation, presipitat akan terbentuk atau dapat terbentuk
komposisi yang tidak seimbang. Apabila kedua elemen mengandung kation atau anion, karakteristik dari reaksi dilakukan dengan larutan anion atau kation yang serupa.
Katalis Cu-ZnO-Al2O3 disiapkan dengan koprecipitasi pada pH konstan dan
temperatur konstan. Larutan yang mengandung metal nitrat ([Cu2+]+[Zn2+]+[Al3+] = 1.0 M) dan larutan sodium karbonat yang di tambahkan pada reaktor dengan sedikit kandungan
deionized water. Larutan akan menghasilkan endapan pada kondisi temperatur tertentu dan
rentang wantu tertentu. Presipitat lalu akan difiltrasi dan dibersihkan dengan deionized water untuk menghilangkan ion sodium yang tersisa pada katalis. Pada saat proses pengendapan katalis, natrium karbonat akan bereaksi dengan logam dan air sehingga membentuk endapan dengan gugus –OH pada setiap unsur logam (CuOH) Setelah proses filtrasi kemudian dilakukan pengeringan pada temperature 110̊C dan melakukan kalsinasi pada suhu 350̊C dengan rentang waktu 6 jam. Kalsinasi dilakukan memberikan ukuran partikel katalis serta pembentukan kristal pada katalis, dengan mengatur laju pemanasan pada oven akan terbentuk partikel katalis yang bervariasi sesuai dengan laju pemanasan. Kalsinasi juga digunakan untuk menguraikan senyawa dalam bentuk garam atau dihidrat menjadi oksida yang membentuk fase kristal.
2.4. Bentuk Katalis
Bentuk umum katalis disajikan dalam Tabel 2.6 berikut ;
Tabel 2.1 Bentuk Umum Partikel (sumber : katalis heterogen)
Jenis Karakteristik
Pelet Bentuk : Silindrik, Uniform, cincin
Ukuran : Diameter 2-10 mm
Penggunaan : Reaktor Unggun, turbular
Ekstruksi Bentuk : Panjang tidak menentu, sirkulat, bintang atau cuping pada bagian melintang
Penggunaan : pada reaktor turbular Bola Ukuran : 1-20 mm
Butir Ukuran : 8-14 hingga 2-4 mesh
Penggunaan : pada reaktor unggun turbular Serpih Bubuk dicampurkan pada wax
Penggunaan : reaktor fasa cair
2.5. Katalis Cu-ZnO-Al2O3
Katalis Cu-ZnO-Al2O3, merupakan jenis katalis hybrid dengan Cu sebagai active site.
ZnO dalam proses sintesis DME langsung berperan sebagai promotor. Adanya ZnO pada katalis sintesis DME satu tahap digunakan sebagai promotor yang berfungsi untuk mengurangi sintering Cu dimana sintering Cu akan menurunkan performa katalis karena luas permukaan aktif yang terdegradasi. dan Al2O3 berperan sebagai support catalyst untuk
memperbesar luas permukaan katalis sehingga reaksi yang berada di dalam katalis terdispersi dengan baik. Pada dasarnya katalis sintesis DME langsung di persiapkan dengan metode kopresipitasi dimana pembentukan terjadi dengan pengendapan pada garam klor/garam nitrat yang kemudian melakukan presipitasi kembali dengan logam Al untuk menambah permukaan katalis sehingga dispersi reaktan pada permukaan aktif terjadi secara merata.
2.6. Katalis ZSM-5
Katalis ZSM-5 pada digunakan sebagai proses dihidrasi dalam sintesis DME yang berasal dari metanol. ZSM-5 memiliki aktifitas katalis yang tinggi pada temperatur reaksi tertentu. Pada proses hidrogenasi CO akan terbentuk air, dan ZSM-5 tidak sensitif terhadap air. Kemudian pada penelitian Yang et al.[1] diketahui bahwa ZSM-5 memiliki aktifitas dan stabilitas yang lebih tinggi dibandingkan dengan katalis komersial untuk dehidrasi seperti γ-Al2O3. Terlebih lagi dengan melihat penelitian Aguayo et al. [2] diketahui bahwa katalis
hybrid Cu-ZnO-Al2O3-ZSM-5 memiliki kemampuan yang sangat baik dalam siklus
regenrasi-reaksi katalis yang terganggu.
2.6.1. Perbandingan katalis ZSM-5 dan !-Al2O3.
Selain ZSM-5,!-Al2O3 merupakan salah satu katalis yang dapat melakukan proses
dehidrasi pada proses sintesis DME langung namun terdapat perbedaan yang signifikan antara katalis ini. !-Al2O3 memiliki keasaman lewis, sedangkan ZSM-5 memiliki asam lewis
karena susunan alumina yang lebih banyak dan asam bronsted, namun jumlah permukaan asam bronsted lebih besar dibandingkan dengan permukaan asam lewis. Melihat penelitian yang dilakukan Mingting Xu et al [3], penambahan air akan memberi efek negatif pada aktifitas keasaman katalis ZSM-5, namun hal ini juga berdampak lebih pada !-Al2O3 , dimana
pada ZSM-5 konversi 13 % akan berkurang menjadi 8,3 % sedangkan pada !-Al2O3 dengan
konversi 17,5 % akan menjadi sebesar 2,7 % sehingga dapat diketahui bahwa penambahan air akan mengurangi jumlah permukaan asam lewis namun untuk permukaan asam bronsted penambahan air tidak akan berpengaruh sebesar permukaan asam lewis.
2.7.Karakterisasi Katalis
Katalis memerlukan pengujian dari struktur katalis tersebut dimana perancangan katalis sudah sesuai dengan struktur yag diinginkan. Struktur katalis secara ilmiah dirancang berdasarkan kinerja yang telah diharapkan pada saat penggunaan katalis untuk proses reaksi tertentu. Apabila telah sesuai dengan proses pembuatan katalis dapar dikatakan berhasil, namum apabila tidak sesuai dengan desain awal katalis maka diperlukan penanganan untuk perbaikan stuktur katalis tersebut.
Pengujian katalis disebut karakterisasi katalis. Dimana bagian terpenting dalam karakterisasi adalah pemilihan metode yang tepat. Oleh karena itu teknik dasar karakterisasi katalis perdu diketahui secara mendasar. Dalam menentukan metode karakterisasi katalis memiliki Pertimbangan sebagai berikut ;
• Sesuai dengan penggunaan katalis untuk proses reaksi yang nyata • Kemudahan akses bahan dan peralatan
• Luas cakupan dan pengaplikasiannya
• Lebih informatif dalam menjelaskan atau menggambarkan aspek-aspek katalis
Secara garis besar, teknik karakterisasi dapat dibagi menjadi beberapa kelompok bahasan, berdasarkan sifat-sifat yang akan diteliti ;
1. Sifat-sifat permukaan katalis,meliputi : struktur dan morfologi (SEM,TEM,XRD,EXAFS,XPS,IR,Raman, UV-Vis), dispersi dan keasaman (TPD).
Pada uji karakterisasi katalis sintesis DME dilakukan beberapa metode yaitu XRD dan XRF. XRD dimaskudkan untuk meng identifikasi fasa bulk suatu katalis dan untuk
menentukan sifat kristal atau kristalinitas dari suatu katalis. Katalis merupakan padatan kirstal seperti oksida logam, zeolit dan logam berpenyangga. XRD menjadi teknik yang cukup handal dan mendasar untuk mengecaluasi sifat-sifat fasa kristal dan ukuran kristal. Metode XRD tidak mampu menampilkan sifat-sifat yang diperlukan untuk katalis-katalis yang bersifat non-kristal. Pada kinerja XRD kristal dari katalis akan memantulkan sinar X yang dikirimkan dari sumber yang akan diterima detektor. Dengan melewatkan sudut kedatangan sinar X maka spektrum pantulan adalah spesifik yang berhubungan langsung dengan lattice spacing dari kristal yang dianalisis.
Kristalinitas dapat ditentuakn dengan XRD melalui perbandingan intensitas atau luasan peak sampel dengan intensitas atau luasan peak standar yang ditunjukan pada persaman sebagai berikut
!"#$%&'#(#%&$ = !"#$"%!#&% !"#$ !"#$%#&%!"#$"%&#'% !"#$ !"#$%& 100% (2.1)
Untuk menentukan ukuran kristal dinyatakan dengan persamaan Scherrer berikut ;
!"!#$% !"#$%&'#(#%&$ =(!!!!!"!)!/! (2.2)
Karakteristik yang dilakukan dengan XRD akan menghasilkan hasil sebagai berikut ;
1. Ukuran dan dispersi kristal, yang merupkan fraksi atau jumlah bagian atom logam yang berhubungan dengan jumlah situs aktif.
2. Distribusi di dalam granul penyangga yang menentukan akses pada situs aktif.
3. Metode Penelitian 3.1.Diagram Alir Penelitian
Penelitian ini memerlukan diagram alir penelitian guna melaksanakan tahapan-tahapan untuk menghasilkan Di-Methyl Ether. Adapun tahapan-tahapan nya yaitu dimulai dari persiapan bahan-bahan sampai pembuatan produk. Detail diagram alir dapat dilihat pada Gambar 2.1 :
Gambar 2. 1 Intrumentasi Penelitian Sintesis DME langsung (sumber : Wei-Hsin Chen.et.al) Variabel penelitian yang dilakukan adalah variasi temperatur dan rasio H2/CO pada
tekanan 20 bar. Instumentasi yang digunakan di dalam penelitian adalah ;
Adapun prosedur penelitian yang dilakukan dari awal sampai akhir dalam penelitian ini antara lain sebagai berikut:
a. Preparasi katalis
• Pada penelitian ini akan digunakan tahap kopresipitasi sedimentasi dimana larutan Cu(NO3). 3H2O dan Zn(NO3).4H2O dengan total konsentrasi 1 M dan Na2CO3 1 M
diteteskan secara simultan ke dalam breaker glass mengandung air demine sealama 30 min pada pH yang teteap dan suhu 50̊C dengan menggunakan magnetik stirrer.
• Setelah campuran kedua larutan telah dititrasi, larutan di diamkan selama 2 jam pada suhu yang sama,sehingga menghasilkan endapan yang kemudian akan disaring dan dicuci dengan air panas. Endapan yang berada di dalam gelas reaksi merupakan hasil reaksi antara larutan logam dengan natrium karbonat dan air sehingga campuran dari ketiga senyawa ini akan membentuk gugus –OH. Campuran kemudian di saring untuk menghilangkan sisa natrium di dalam larutan dan dikeringkan pada suhu 110̊C selama 12 jam.
• Melakukan kalsinasi untuk membentuk luas permukaan katalis dan membentuk kristal katalis, dengan kalsinasi katalis akan berikatan dengan oksigen dimana katalis CuZnAl akan membentuk CuO-ZnO dan Al2O3 yang kemudian akan direduksi dengan katalis
untuk memperoleh logamnya.
• Kemudian menambahkan ZSM-5 sebanyak 0,2 gram sebagai katalis dehidrasi dari sintesis Dimethyl Ether
b. Karakterisasi katalis Cu-ZnO-Al2O3-ZSM-5
• Krakterisasi katalis dilakukan untuk mengetahui kristalinisasi katalis pada sintesis katalis yang telah dilakukan dimana karakterisasi pada katalis dalam penilitan ini adalah banyaknya Cu sebagai inti aktif dan Al2O3 sebagai supporting catalyst kemudian
ZnO sebagai promotor. Dalam karakterisasi katalis menggunakan XRF untuk mengetahui komposisi dari katalis sehingga dapat melakukan perbandingan dengan data literatur.
• Melakukan analisa XRD untuk mengetahui bentuk kristal yang terbentuk pada saat proses pembuatan katalis CuO-ZnO-Al2O3, inti aktif dari katalis harus memiliki jumlah
kristal yang lebih banyak di bandingkan katalis pendukung sehingga diperlukan analisa XRD dalam proses karakterisasi katalis sintesis DME langsung
• Dilakukan dengan menggunakan reaktor bertekanan tinggi. Untuk sintesis dimetil ether, katalis direduksi dengan menggunakan gas hidrogen pada suhu yang telah ditentukan sebagai variabel bebas dari percobaan ini dan tekanan 20 bar. Rasio perbandingan syngas adalah 0,5 sampai 2 dimana 0,5 merupakan simulasi untuk biomassa dan 2 merupakan simulasi/model untuk batubara
• Reaktor yang digunakan adalah reaktor fixed bed dengan kondisi tekanan 20 bar dengan diameter 0,8 cm dan panjang 3,5 cm.
• Melakukan proses reduksi katalis dengan temperatur 320°C dengan perbandingan H2/N2 = 1. Total volume gas campuran dari nitrogen dan Hidrogen diatur menggunakan
flow meter dengan laju alir 150ml/min
• Gas keluaran reaktor akan dianalisa menggunakan Gas cromatograph dengan tipe TCD dengan jenis kolom karbon aktif untuk mengetahui komposisi keluaran dari gas CO,CO2, H2 dan CH4. Kemudian menggunakan GC- FID yang bertujuan untuk
mengetahui berapa jumlah DME, Metanol yang terbentuk dengan menggunakan carrier gas N2 ataupun Ar. Dengan menggunakan RF sebagai acuan untuk mengetahui
komposisi dari produk dan produk samping di dalam sintesis DME langsung 4. Hasil dan Pembahasan
4.1.Karakter Katalis
Karakterisasi katalis digunakan untuk mengidentifikasi unsur yang terdapat di dalam katalis dimana setiap katalis memiliki inti aktif dan juga unsur pendukung untuk memaksimalkan kinerja katalis. Pada umumnya jumlah unsur yang memiliki jumlah lebih banyak dibandingkan dengan unsur lainnya bekerja sebagai inti aktif kemudian selebihnya merupakan katalis pendukung ataupun pengotor. Selain diperlukan unsur yang berada di dalam katalis perlu diketahui jumlah kristal yang terbentuk di dalam katalis, banyaknya kristal yang terbentuk di dalam katalis sangat beragam tergantung pada jenis katalis tersebut.
4.1.1. XRF
Katalis yang digunakan dalam penelitian ini adalah katalis hibrida yang memiliki dua inti aktif yaitu tembaga dan zeolit. Analisa XRF digunakan untuk mengetahui komposisi yang terdapat di dalam katalis. Desain katalis CuO-ZnO-Al2O3 yang terdapat di dalam literatur
Unsur Komposisi Massa (%) CuO 66,25 ZnO 27,16 Al2O3 4,78 K2O 0,38 P2O5 0,36 Cl 0,25 SO3 0,22 CaO 0,16 NiO 0,15 Nd2O3 0,12 Ga2O3 0,06 Cr2O3 0,05 CoO 0,03 SnO2 0,03
sehingga perlu dilakukan normalisasi untuk mengetahui komposisi massa dari tembaga, zinc dan alumina.
Tabel 3. 1 Hasil XRF
Tabel 3.1 menunjukan komposisi dari masing-masing unsur yang berada di dalam katalis CuO-ZnO-Al2O3 , untuk komposisi masing masing Cu-Zn-Al adalah ; 66,25 27,16 dan 4.7
dengan melakukan perbandingan dari katalis desain awal yang berdasarkan literatur diperoleh persen error untuk masing masing komponen utama katalis adalah Cu = 2,7 % Zn = 13% dan Al2O3 = 20% .
4.1.2. XRD
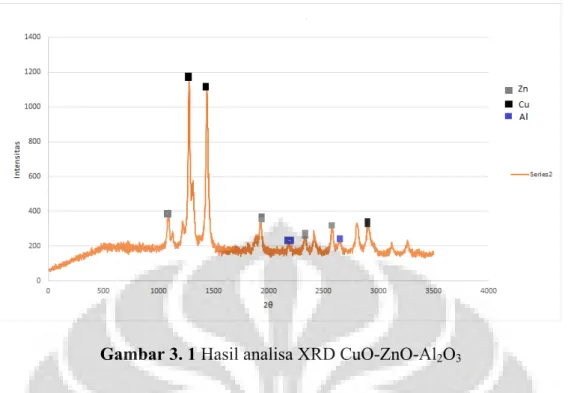
Selain menggunakan analisa XRF perlu dilakukan analisa lain yaitu XRD untuk mengetahui kristal yang terbentuk di dalam katalis CuO-ZnO-Al2O3. Banyaknya kristal yang terbentuk
dapat diketahui dengan melihat nilai peak dalam intensitas serta 2θ. Data XRD yang didapatkan dapat dilihat pada Gambar 3.1
Gambar 3. 1 Hasil analisa XRD CuO-ZnO-Al2O3
Berdasarkan Gambar 4.1 di atas, dapat diketahui bahwa banyaknya kristal yang terbentuk adalah kristal tembaga dimana tembaga merupakan inti aktif dari katalis kemudian dapat diamati dengan grafik 4.1 terdapat kristal zinc oksida yang berfungsi sebagai sebagai katalis pendukung serta Al2O3 yang juga berfungsi sebagai katalis pendukung. Sebagai inti aktif dari
katalis, tembaga harus memiliki jumlah kristal yang besar oleh karena itu hasil XRD untuk katalis CuO-ZnO-Al2O3 individual telah berhasil dibuat berdasarkan jumlah kristal inti aktif
dan terdapat kristal dari katalis pendukung. 4.2.Uji Aktifasi
4.2.1. Pengaruh Rasio H2/CO
Gambar 3. 1 Pengaruh rasio pada Konversi CO dan H2 pada suhu 270°C
0 10 20 30 40 50 60 70 80 0.5 2 Ko nv er si (% ) Rasio H2/CO CO H2
Dapat dilihat pada Gambar 3.2 bahwa konversi CO naik pada sedangkan H2
cenderung menurun pada kedua rasio H2/CO = 0,5 dan H2/CO = 2. Konversi CO cenderung
pada saat kenaikan rasio H2/CO berada pada kondisi 0,5 menuju 2 sedangkan H2 menurun
pada kedua rasio dikarenkan pada saat penambahan H2 menyebabkan penambahan konversi
pada CO karena adanya pengaruh dari reaksi water-gas shift (3) yang berlawanan dengan sintesis metanol, karena sintesis metanol memiliki orde reaksi 2 sedangkan water-gas shift (3) memiliki orde reaksi 1 (Aguayo et.al,2005). Penuruan konversi H2 pada kedua rasio juga
dipengaruhi oleh reaksi water-gas shift karena produk yang dihasilkan dari reaksi ini adalah H2
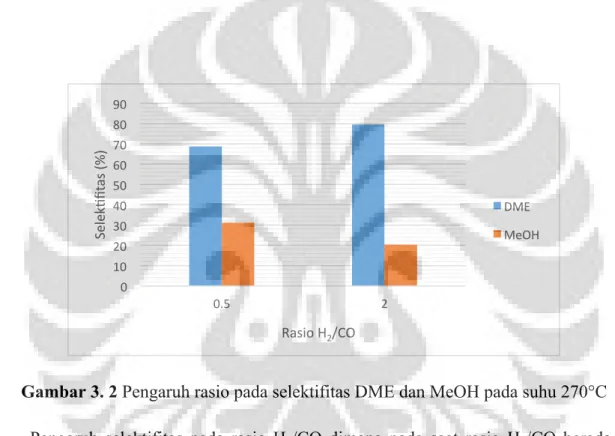
Gambar 3. 2Pengaruh rasio pada selektifitas DME dan MeOH pada suhu 270°C Pengaruh selektifitas pada rasio H2/CO dimana pada saat rasio H2/CO berada pada
kondisi 0,5 dan 2 selektifitas DME naik, berlawanan dengan selektifitas metanol yang menurun pada rasio H2/CO 0,5 dan 2. Pada rasio H2/CO = 0,5 selektifitas metanol lebih
besar dibandingkan dengan rasio H2/CO = 2, hal ini karena pada saat pada saat gas masuk CO
lebih tinggi dibandingkan H2 konversi H2 meningkat, hal ini menyebabkan terbentuknya
metanol karena konversi H2 lebih dominan untuk berubah menjadi metanol (Mohradi et.al,2008). Pada penelitian ini, rasio H2/CO =0,5 tidak memiliki kesetimbangan yang baik
berdasarkan laju alir keluaran. Dengan tidak adanya kesetimbangan yang baik maka akan banyak reaksi yang mungkin terjadi diantaranya reaksi karbonilasi dan reaksi metanasi. Apabila menggunakan teori kesetimbangan untuk rasio H2/CO = 0,5 maka kesetimbangan
dalam reaksi sintesis DME langsung akan bergerak ke arah kiri karena adanya kelebihan CO
0 10 20 30 40 50 60 70 80 90 0.5 2 Selek Afit as (%) Rasio H2/CO DME MeOH
merupakan limiting reactant sehingga produksi dari metanol dan DME rendah berdasarkan reaksi dehidrasi dimana DME juga di produksi dengan banyaknya metanol yang terbentuk. Pada rasio H2/CO = 2 kesetimbangan reaksi memiliki nilai yang cukup baik sehingga dapat
di analisa berdasarkan kesetimbangan reaksi. Dengan melihat analisis reaksi konversi pada kondisi H2 ditambahkan makan konversi CO akan bertambah, konversi CO pada kondisi ini
lebih dominan untuk berubah menjadi DME (Mohradi.et.al, 2008). Banyaknya H2 yang
masuk menyebabkan produk metanol meningkat karena merupakan kesetimbangan dari reaksi sintesis metanol, namun karena konversi CO besar menyebabkan efektifitas dari water-gas shift untuk mengkonsumsi H2O sehingga DME lebih dominan karena efek katalis.
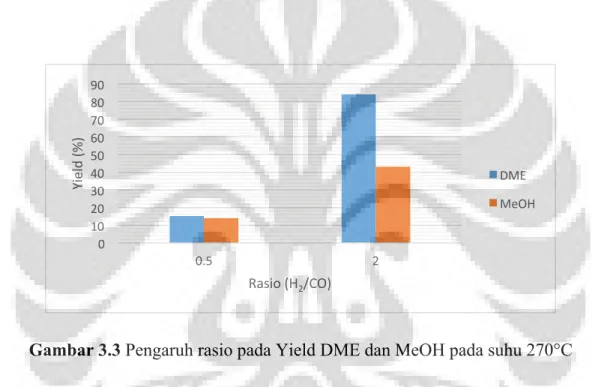
Gambar 3.3 Pengaruh rasio pada Yield DME dan MeOH pada suhu 270°C
Dengan mengetahui selektifitas dan konversi dapat diketahui yield atau banyaknya produk yang dihasilkan pada reaksi sintesis DME. Pada Gambar 3.4 merupakan masing masing yield DME dan MeOH pada rasio H2/CO yang berbeda-beda. Yield DME dan MeOH akan naik
dengan bertambahnya rasio dari 0,5 hingga 2. Dalam rasio H2/CO = 0,5 meskipun konversi
CO dan H2 rendah namun selektifitas MeOH naik sehingga berbanding lurus dengan
selektifitas DME karena pengaruh reaksi dehidrasi metanol untuk menjadi DME sehingga yield metanol dan DME dapat bertambah.
4.2.2. Pengaruh Temperatur
Efek temperatur dan konversi CO pada selektifitas dan yiled DME sangat penting dalam reaksi sintesis DME langsung maupun reaksi sintesis MeOH. Dengan melakukan analisis stokiometri dan temodinamika maka akan di dapatkan temperatur yang optimum untuk reaksi
0 10 20 30 40 50 60 70 80 90 0.5 2 Yi el d (% ) Rasio (H2/CO) DME MeOH
sintesis DME langsung. Pengaruh temperatur disajikan dalam bentuk gambar dengan variasi rasio H2/CO dengan konversi, selektifitas dan yield.
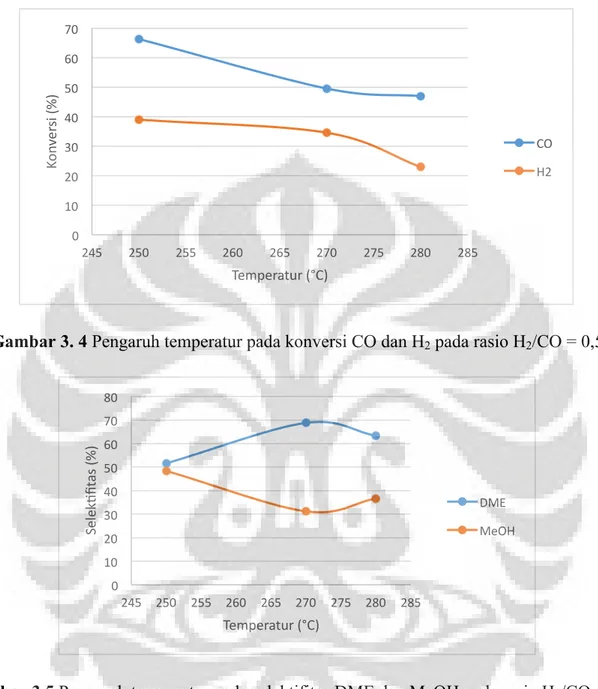
Gambar 3. 4 Pengaruh temperatur pada konversi CO dan H2 pada rasio H2/CO = 0,5
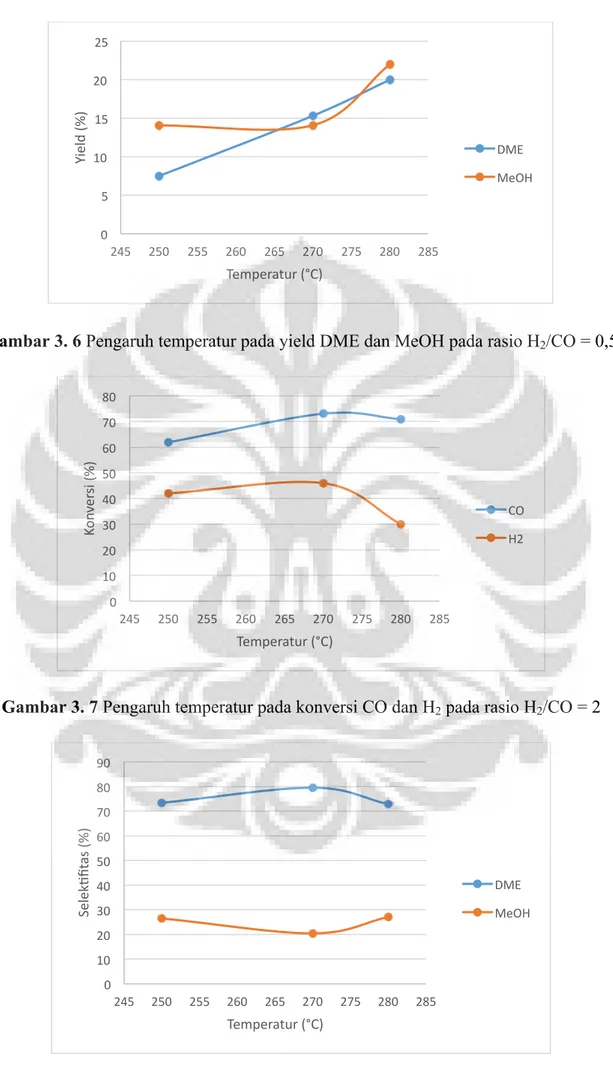
Gambar 3.5 Pengaruh temperatur pada selektifitas DME dan MeOH pada rasio H2/CO = 0,5
0 10 20 30 40 50 60 70 245 250 255 260 265 270 275 280 285 Ko nv er si (% ) Temperatur (°C) CO H2 0 10 20 30 40 50 60 70 80 245 250 255 260 265 270 275 280 285 Selek Afit as (%) Temperatur (°C) DME MeOH
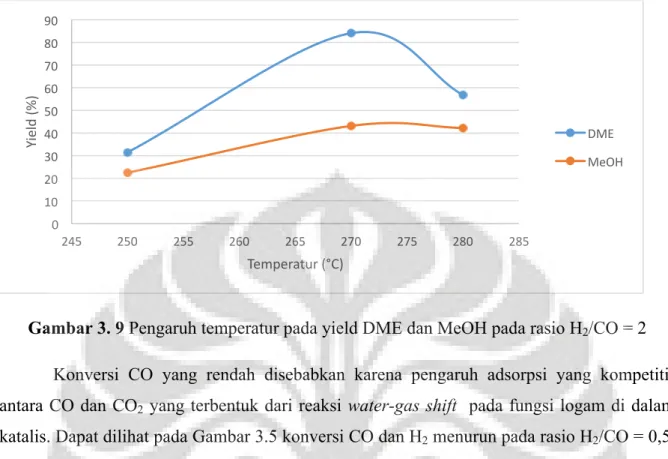
Gambar 3. 6 Pengaruh temperatur pada yield DME dan MeOH pada rasio H2/CO = 0,5
Gambar 3. 7 Pengaruh temperatur pada konversi CO dan H2 pada rasio H2/CO = 2
0 5 10 15 20 25 245 250 255 260 265 270 275 280 285 Yi el d (% ) Temperatur (°C) DME MeOH 0 10 20 30 40 50 60 70 80 245 250 255 260 265 270 275 280 285 Ko nv er si (% ) Temperatur (°C) CO H2 0 10 20 30 40 50 60 70 80 90 245 250 255 260 265 270 275 280 285 Selek Afit as (%) Temperatur (°C) DME MeOH
Gambar 3. 8 Pengaruh temperatur pada selektifitas DME dan MeOH pada rasio H2/CO = 2
Gambar 3. 9 Pengaruh temperatur pada yield DME dan MeOH pada rasio H2/CO = 2
Konversi CO yang rendah disebabkan karena pengaruh adsorpsi yang kompetitif antara CO dan CO2 yang terbentuk dari reaksi water-gas shift pada fungsi logam di dalam
katalis. Dapat dilihat pada Gambar 3.5 konversi CO dan H2 menurun pada rasio H2/CO = 0,5.
Kemudian pada gambar 3. 8 dimana konversi CO dan H2 pada rasio H2/CO = 2. Kedua hal
ini di pengaruhi oleh pengaruh ketetimbangan termodinamika untuk reaksi eksotermis, pada reaksi eksotermis apabila temperatur bertambah maka kesetimbangan akan berubah ke arak reaktan.
Pada Gambar 3.6 dan 3.9 selektifitas DME dan MeOH meningkat pada suhu 270°C kemudian menurun pada suhu 280°C. Dengan menghubungkan perinsip termodinamika dengan pengaruh selektifitas dari sintesis DME dan metanol, pada suhu dibawah 300°C reaksi hydrocracking lebih dominan pada kondisi ini. Pada saat lebih banyak terbentuk hidrokarbon maka, selektifitas DME akan berkurang. Sebagian DME akan bereaksi dan berubah menjadi air, kemudian air akan bereaksi dengan CO dan menghasilkan CO2 yang
akan bereaksi kembali menjadi DME atau menjadi reaksi samping dari sintesis DME langsung. Pada gambar 3.8 dan 3.10 yield dari DME menurun pada variasi suhu yang berbeda karena pengaruh konversi dan selektifitas. Untuk pengaruh MeOH yang bertambah pada rasio H2/CO = 0,5. Hal ini karena pengaruh rasio yang telah dijelaskan pada analisis
rasio dimana CO yang berlebih menyebabkan konversi H2 yang bertambah dan menyebabkan
selektifitas MeOH meningkat.
0 10 20 30 40 50 60 70 80 90 245 250 255 260 265 270 275 280 285 Yi el d (% ) Temperatur (°C) DME MeOH
5. Kesimpulan
Beberapa kesimpulan yang dapat diambil dari penelitian ini adalah
a. Rasio H2/CO yang tinggi dari sintesis DME langsung akan menghasilkan yield DME
sebesar 83%, namun pada rasio H2/CO rendah menghasilkan DME yang lebih rendah
yaitu11%.
b. Kondisi Temperatur optimum reaksi sintesis DME berada pada suhu 270°C karena pada suhu ini yield, konversi CO adalah 75 % dan H2 adalah 45%, selektifitas DME pada suhu
ini adalah 83 % dengan Yield DME sebesar .
c. Adanya karbon monoksida yang tersisa pada reaksi menimbulkan beberapa reaksi samping yang membentuk metanol.
Daftar Pustaka
Aguayo AT,Erena J,Sierra I, Olazar M, Bilbao J. Deactivation and regeneration of hybrid catalyst in the single step synthesis of DME from syngas and CO2. Catalyst today
2005;106:265-70
Andres Aguayo, Javier Erena, Diana Mier. Et al. Kinetic Modeling of Dimethyl Ether Synthesis in a Single Step on a CuO-ZnO-Al2O3/γ-Al2O3 Catalyst. Chemical Resources. 2007; 46; 5522-5530
Andres Garcia, Agustin Martinez. The influence of zeolite surface-aluminium species on the deactivation of CuZnAl/Zeolite hybrid catalyst for the direct DME synthesis. Catalyst
Today. 2013;227;144-153
Chen Wei-Hsin, Lin Bo-Jhih, Huang Men-Han.One step synthesis of dimethyl ether form gas mixture containing CO2 with high velocity. Applied Energy.2012;98;92-101
Gholamremza Moradi, Javad Ahmadpour, Mahdi Nazari. Effects of Feer Composition and Space Velocity on Direct synthesis of Dimethyl Ether from syngas. Chemical
Resources.2008 ;47 ; 7672-7679
Gonzalo Prieto, Krijin P, Petra A. Towards greener catalyst manufacture : Reduction of wastewater from the preparation Cu/ZnO/Al2O3 methanol synthesis catalyst. Catalysis Today. 2012;215;142-151
Hayer Fatemeh, Myrstad Rune.Characteristic of integrated micro packed bed reactor heat-exchanger configurations in the direct synthesis of dimethyl ether. Chemical
Engineering and Processing.2012;70;77-85
Hermansyah Heri, Slamet, Siti Fauziah R, Witta K. Sintesis Dimetil Eter Menggunakan
Katalis Cu-Zn/!-Al2O3 dalam reaktor fixed bed. 2010. Seminar Rekayasa Kimia dan
Proses.
Javier Erena,Raul Garona,Jose M.Aarandes. Effectoperating condition on the synthesis over CuO-ZnO-Al2O3/NaHZSM-5 bifuncional catalyst. Catalyst Today.2005: 107-108
M.Nasikin, Bambang Heru S. Buku Katalis Heterogen. 2010. Departemen Teknik Kimia Universitas Indonesia.
Mao D, Xia J, Zhang B, Lu G. Highly Efficient synthesisof DME from syngas over the admixed catalyst of Cu-ZnO-Al2O3 and antimony oxide modified ZSM-5 zeolite. Energy Covers Management. 2010;51:1134-9.
Mario Marchionnaa,Renata Patrini, Domenico Sanfilippo, Gabriele Migliavacca. Fundamental investigation on DME as LPG substitute or make up for domestic used.
Fuel Processing Technology. 2008;89;1255-1261
Meltem Yildiz, Ayse Nilgun. Deactivation of a co-precipitated Co/Al2O3 catalyst. Catalyst Today. 2007;65;90-100
Mingting Xu, Jack H., D.Wayne. Synthesis of dimethyl ether (DME) from methanol over solid-acid catalyst.Applied Catalyst. 1997;149;289-301
R. Vakili, E. Pourazadi, P. Setoodeh, R. Eslamloueyan, M.R. Rahimpour.).Direct DME synthesis through a thermal reactor coupled heat exchanger reactor. Applied Energy. 2010;88;1211-1223
Sadegh Papari, Mohammad Kazemeini and Moslem Fattahi. Modelling-based optimisation of direct synthesis of DME from syngas in a commercial slurry reactor. Chinese Journal
of Chemical Engineering. 2011;21;611-621
Wei-Hsin Chen, Bo-Jhih Lin, How-Ming Lee, Men-Hang Huan. One step synthesis of dimethyl ether from gas mixture containing CO2 with high space velocity. Applied Energy 2012:92-101.
Wen Zhi Lu, Li-Hua Teng, Wen-De Xiao. Simulation and experiment study of DME synhesis from syngas in a fluidized-bed reactor. Kinetics Reactions 2004;5455-5464
Yang G, Thingkarn M, Vitidsant T, Yoneyama Y, Tan Y, Tsubaku N. A double shell capsule catalyst with core shell like structure for one step exactly controlled synthesis of