FORMULASI SEDIAAN EMULGEL
EKSTRAK ETANOLIK DAUN SALAM (Eugenia polyantha Wight.) DENGANMINYAK PEPPERMINT SEBAGAI PENETRATION ENHANCER DAN AKTIVITASNYA SEBAGAI ANTIINFLAMASI
TOPIKAL PADA TIKUS
SKRIPSI
Disusun Untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh :
Odilia Arum Narwastu
NIM: 108114076
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
FORMULASI SEDIAAN EMULGEL
EKSTRAK ETANOLIK DAUN SALAM (Eugenia polyantha Wight.) DENGANMINYAK PEPPERMINT SEBAGAI PENETRATION ENHANCER DAN AKTIVITASNYA SEBAGAI ANTIINFLAMASI
TOPIKAL PADA TIKUS
SKRIPSI
Disusun Untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Farmasi
Oleh :
Odilia Arum Narwastu
NIM: 108114076
FAKULTAS FARMASI
iii
iv
HALAMAN PERSEMBAHAN
Karya ini aku persembahkan untuk :
Bapak dan Ibu yang selalu setia mendampingi
Mbak Embun, Mas Indra, Didit, Choco, Bosco yang selalu membagi
keceriaan
Anne dan Restu yang ikut menyemangati
Sahabat-sahabat yang selalu memberi penghiburan
dan untuk almamaterku tercinta
Just because I don’t
understand God’s plans,
doesn’t mean that he Is not
vii PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas kasih karunia,
rahmat dan penyertaan-Nya sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Formulasi Sediaan Emulgel Ekstrak Etanolik Daun Salam (Eugenia
polyantha Wight.) denganMinyak Peppermint Sebagai Penetration Enhancer dan
Aktivitasnya Sebagai Antiinflamasi Topikal Pada Tikus” dengan baik. Skripsi ini
disusun untuk memenuhi salah satu syarat memperoleh gelar Sarjana Strata Satu
(S.Farm.) pada program studi Farmasi di Universitas Sanata Dharma Yogyakarta.
Selama proses masa studi S1 sampai penulisan skripsi ini, penulis tidak
terlepas dari bimbingan dan dukungan dari berbagai pihak. Oleh karena itu,
penulis ingin mengucapkan terima kasih kepada :
1. Orangtua penulis, yang selalu mendoakan, memberi semangat, perhatian,
dukungan dan motivasi kepada penulis.
2. Dekan Fakultas Farmasi Universitas Sanata Dharma.
3. Ibu C. M. Ratna Rini Nastiti, M. Pharm, Apt., selaku Kaprodi Fakultas
Farmasi Universitas Sanata Dharma, sekaligus Dosen Pembimbing Skripsi
yang telah memberikan waktu, pengarahan, masukan, kritik, saran dan
semangat selama persiapan, penelitian sampai penyusunan skripsi.
4. Bapak Ipang Djunarko M. Sc., Apt. selaku dosen penguji skripsi yang telah
berkenan memberikan masukan dan pengarahan demi perbaikan skripsi ini.
5. Bapak Yohanes Dwiatmaka, M. Si. selaku dosen penguji skripsi yang telah
viii
6. Seluruh dosen Fakultas Farmasi, Universitas Sanata Dharma, yang telah
mengajar dan membimbing selama penulis menempuh pendidikan di
Fakultas Farmasi.
7. Seluruh staf laboratorium, staf kebersihan, dan staf keamanan Fakultas
Farmasi, Universitas Sanata Dharma, Yogyakarta. Terutama Pak Musrifin,
Pak Heru, Pak Wagiran yang telah banyak membantu kelancaran
penelitian.
8. Tomas, Lulu, Samuel, selaku teman seperjuangan skripsi, atas kerjasama,
dukungan, semangat, dan masukan yang diberikan.
9. Sahabat-sahabatku Didit, Desti, Wulan, Angga, Dian, Anis, yang selalu
memberi keceriaan dan semangat dalam menjalani perkuliahan dan skripsi.
10.Teman – teman angkatan 2010 atas kebersamaan, kerjasama, dan kenangan
selama di Fakultas Farmasi.
11.Semua pihak yang tidak dapat disebutkan satu per satu yang telah
membantu penulis dalam menyelesaikan pendidikan di Perguruan tinggi
ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Penulis
mengharapkan kritik dan saran yang membangun dari semua pihak. Akhir kata,
semoga penilitian ini dapat berguna bagi semua pihak terutama di bidang farmasi.
Yogyakarta, 5 Juni 2014
ix DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI... v
x
BAB III. METODE PENELITIAN... 20
A. Jenis dan Rancangan Penelitian ... 20
B. Variabel dan Definisi Operasional ... 20
1. Variabel Penelitian ... 20
2. Definisi Operasional ... 21
C. Bahan Penelitian ... 22
D. Alat atau Instrumentasi Penelitian ... 22
E. Tata Cara Penelitian ... 22
6. Uji aktivitas antiinflamasi emulgel ... 26
F. Analisis Hasil ... 28
BAB IV. HASIL DAN PEMBAHASAN ... 29
xi
B. Standarisasi Ekstrak Daun Salam ... 29
C. Sifat Fisik dan Stabilitas Emulgel ... 29
1. Uji Organoleptis ... 30
2. Uji Daya Sebar... 31
3. Uji Viskositas ... 31
4. Uji pH ... 32
D. Uji Aktivitas Antiinflamasi Emulgel... 34
E. Hasil Uji Antiinflamasi Emulgel ... 35
BAB V. KESIMPULAN DAN SARAN ... 42
A. Kesimpulan ... 42
B. Saran ... 42
DAFTAR PUSTAKA ... 44
LAMPIRAN ... 48
xii
DAFTAR TABEL
Tabel I. Formula Emulgel Daun Salam (Eugenia polyantha Wight.)... 24
Tabel II. Hasil Uji Organoleptis Emulgel ... 31
Tabel III. Hasil Uji Sifat Fisik Emulgel (Rata-rata ± SD) ... 32
Tabel IV. Hasil Uji pH Emulgel ... 33
Tabel V. Hasil Statistik Uji T-berpasangan Antara Penyimpanan 48 Jam dan 28 Hari ... 33
Tabel VI. Hasil Perhitungan % Reduksi Udema Kaki Tikus ... 36
Tabel VII. Hasil Uji Statistik TukeyHSD % Reduksi Udema Jam Ke-4 ... 37
xiii
DAFTAR GAMBAR
Gambar 1. Voltaren® Emulgel ... 9
xiv
DAFTAR LAMPIRAN
Lampiran 1. Sifat Fisik dan Stabilitas Emulgel ... 49
Lampiran 2. Hasil Analisis Stabilitas Fisik Emulgel Menggunakan Software R.2.14.2 ... 53
Lampiran 3. Hasil Uji Antiinflamasi Emulgel ... 55
Lampiran 4. Hasil Analisis Aktivitas Antiinflamasi Menggunakan Software R.2.14.2 ... 59
Lampiran 5. Dokumentasi Ekstraksi ... 71
Lampiran 6. Dokumentasi Emulgel ... 72
Lampiran 7. Dokumentasi Pengujian Aktivitas Antiinflamasi ... 73
Lampiran 8. Surat Keterangan Pembelian Daun Salam ... 74
Lampiran 9. Hasil Uji Kadar Air dan Quercetin Ekstrak Etanolik Daun Salam (Eugenia polyantha Wight.) ... 75
xv INTISARI
Daun salam (Eugenia polyantha Wight.) memiliki kandungan flavonoid yang telah diketahui memiliki khasiat sebagai antiinflamasi. Penelitian ini bertujuan untuk membuat sediaan emulgel antiinflamasi yang kualitas fisiknya bagus dan untuk mengamati aktivitas antiinflamasi dalam formulasi tersebut pada tikus betina galur Wistar. Selain itu bertujuan juga untuk mengamati pengaruh penambahan konsentrasi minyak peppermint sebagai penetration enhancer.
Penelitian ini termasuk dalam penelitian eksperimental murni dengan rancangan acak pola searah. Konsentrasi minyak peppermint yang digunakan adalah 0%, 1,25%, 2,5%, dan 5%. Hewan uji tikus dibagi menjadi 10 kelompok. Kelompok kontrol negatif diberi karagenan 1% saja, kontrol positif menggunakan Voltaren®, kelompok lainnya diberi basis emulgel dan emulgel daun salam. Tebal edema diukur menggunakan jangka sorong pada jam ke-4 dan ke-24 setelah pemberian emulgel. Data dianalisis menggunakan aplikasi program R versi 2.14.2 dengan taraf kepercayaan 95%.
Hasil penelitian menunjukkan emulgel daun salam memiliki kualitas fisik yang baik. Emulgel daun salam yang diberikan secara topikal mampu mereduksi edema yang terjadi. Minyak peppermint mempengaruhi aktivitas antiinflamasi sediaan, namun peningkatan konsentrasi tidak memberikan pengaruh yang signifikan.
xvi ABSTRACT
Bay leaf (Eugenia polyantha Wight.) contains flavonoid that has anti-inflammatory activity. The research aimed to produce ethanolic extract of bay leaf emulgel with good physical qualities and observed anti-inflammatory activity of bay leaf emulgel. The research also aimed to investigate the addition effect of peppermint oil as penetration enhancer in formulation.
The research was purely experimental research using one-way randomized design. The concentrations of penetration enhancer that used in formulation were 0%, 1,25%, 2,5%, and 5%. The rats were grouped into ten groups. Negative controlled group would receive carragenan 1% only, positive controlled group received Voltaren®, and other groups received emulgel base and bay leaf emulgel. Edema was measured by using digital vernier caliper 4 hours and 24 hours after emulgel application. The data were analyzed by using R-2.14.2 with a level of confidence 95%.
The result showed that bay leaf emulgel had good physical qualities. The bay leaf emulgel which was given by topical route was able to reduce edema. Addition of peppermint oil showed effect on emulgel penetration into the skin, but the increase of the concentration had no significant effect.
1 BAB I
PENGANTAR
A. Latar Belakang
Inflamasi atau radang merupakan respon fisiologi terhadap kerusakan
jaringan. Tanda utama inflamasi adalah kemerahan, panas, nyeri, dan bengkak.
Respon inflamasi berfungsi untuk melindungi, mengisolasi, menon-aktifkan, dan
mengeluarkan agen penyebab serta jaringan yang rusak sehingga dapat terjadi
pemulihan. Inflamasi dapat disebabkan oleh mikroorganisme, agen fisik seperti
suhu yang ekstrem, radiasi ion, agen kimia, maupun antigen yang menstimulasi
respon imunologis (Brooker, 2008).
Pemberian obat antiinflamasi non steroid (AINS) secara peroral dapat
mengiritasi lambung karena ketidakselektifan terhadap enzim siklooksigenase
(COX). Hampir semua obat antiinflamasi non steroid (AINS) bekerja pada semua
isoform dari enzim siklooksigenase sehingga senyawa yang memproteksi
lambung yang dihasilkan oleh enzim COX-1 dihambat pembentukannya (Schror
and Meyer-Kirchrath, 2000).
Kulit merupakan bagian tubuh yang rentan mengalami inflamasi. Oleh
karena itu dibuat rute pemberian obat AINS secara topikal yang efeknya lokal.
Pemberian AINS secara topikal mempunyai efek samping yang lebih ringan
karena kemungkinan masuk ke saluran sistemik sangat kecil. Inflamasi pada kulit
dan IL-6. Pada inflamasi terjadi pelepasan mediator-mediator inflamasi seperti
histamin, bradikinin, serotonin, dan prostaglandin (Necas, 2013).
Obat herbal merupakan salah satu solusi kesehatan yang dipercaya oleh
masyarakat dan mulai dikembangkan dalam industri besar farmasi. Secara empiris
banyak tanaman obat yang berpotensi menyembuhkan berbagai penyakit.
Penggunaan obat herbal ini banyak disukai karena masyarakat mempercayai
bahwa obat herbal akan memiliki efek samping yang lebih ringan.
Daun Salam (Eugenia polyantha) merupakan tanaman asli Indonesia
yang sering digunakan sebagai salah satu bahan masakan, namun juga secara
empiris dipercaya mampu menyembuhkan berbagai penyakit. Daun salam sering
digunakan untuk obat diabetes, diare, radang lambung, kolesterol, maupun
penyakit kulit seperti eksim atau kudis, serta mempunyai potensi anti-inflamatory
(Haryanto, 2006).
Menurut Badan POM (2004), kandungan kimia daun salam adalah
tannin, minyak atsiri (salamol, eugenol), flavonoid (quercetin, quercitrin,
myrcetin, myricitrin), seskuiterpen, triterpenoid, fenol, steroid, sitral, lakton,
saponin dan karbohidrat.
Berdasarkan pernyataan diatas maka daun salam menjadi menarik untuk
dibuktikan secara ilmiah khasiatnya sebagai obat antiinflamasi dengan dibuat
sediaan farmasi topikal. Sediaan topikal digunakan untuk mengatasi radang
terutama pada permukaan kulit, di mana obat akan langsung dilepaskan ditempat
aksinya. Menurut Yuliani (2012), bentuk sediaan antiinflamasi sebaiknya mampu
mempercepat angiogenesis dan meningkatkan pecahnya fibrin dan jaringan mati.
Kandungan kimia seperti tanin, flavonoid, dan triterpenoid diketahui dapat
membantu penyembuhan luka salah satunya dengan cara angiogenesis
(Ferdinandez, Anom, Damriyasa, 2013). Flavonoid pada daun salam akan
menghambat pelepasan TNF-α dan IL-6 yang merupakan mediator inflamasi
sehingga tidak akan terjadi inflamasi (Lafuente, Guillamon, Vilares, 2009).
Emulgel terdiri dari 2 sistem yaitu sistem emulsi dan gel. Gel akan
memberikan rasa dingin dikulit dan mencegah dehidrasi jaringan karena
kandungan airnya cukup tinggi, sedangkan emulsi dalam emulgel akan
memudahkan penetrasi ke kulit. Emulgel tidak lengket dikulit walau mengandung
minyak karena adanya sistem gel dalam sediaan ini, sehingga akan lebih nyaman
digunakan dan mudah dicuci(Haneefa, Easo, dan Mohanta, 2013).
Pada pembuatan emulgel ini ditambahkan penetration enhancer yaitu
minyak peppermint. Struktur kulit terutama startum korneum menjadi barier yang
sulit ditembus oleh sediaan. Penetration enhancer digunakan untuk membantu
sediaan masuk menembus lapisan-lapisan kulit sehingga dapat sampai ke tempat
aksi (Fox, Gerber, dan Plessis, 2011). Lebih lanjut, Fox et al. (2011)
menambahkan bahwa minyak peppermint dapat digunakan sebagai penetration
enhancer pada konsentrasi 0,1%-5%. Minyak peppermint dipilih karena aroma
dari minyak peppermint yang segar akan menyamarkan aroma dari ekstrak daun
1. Permasalahan
Berdasarkan latar belakang yang telah dipaparkan di atas, maka
dimunculkan masalah sebagai berikut :
a. Apakah sediaan emulgel ekstrak etanolik daun salam (Eugenia polyantha
Wight.) memiliki sifat fisik yang memenuhi syarat sediaan yang baik?
b. Bagaimana efektivitas antiinflamasi emulgel ekstrak etanolik daun salam
terhadap tikus?
c. Bagaimana pengaruh penambahan konsentrasi minyak peppermint yang
digunakan sebagai penetration enhancer pada formulasi sediaan emulgel
ekstrak etanolik daun salam?
2. Keaslian penelitian
Sejauh penelusuran penulis, penelitian tentang efek anti inflamasi
ekstrak daun salam dalam sediaan emulgel dengan minyak peppermint sebagai
penetration enhancer belum pernah dilakukan.
Penelitiaan yang pernah dilakukan adalah Daya Antibakteri Minyak
Atsiri Daun Salam (Eugenia polyantha (Wight.)) terhadap bakteri Shigella
dysenteriae (Widyastuti, 2002).
Penelitian lain dilakukan oleh Martina (2008), mengenai Pengaruh
Pemberian Ekstrak Daun Salam (Eugenia polyantha) Terhadap Kadar LDL
Kolesterol Serum Tikus Jantan Galur Wistar Hiperlipidemia.
Adapun penelitian mengenai antiinflamasi dan diuji dengan metode
Bunga Telang (Clitoria ternatea L.) Pada Udema Telapak Kaki Mencit Betina
Terinduksi Karagenin Dengan Pengukuran Jangka Sorong (Manurung, 2013).
3. Manfaat penelitian a. Manfaat teoretis
Penelitiaan ini diharapkan dapat memberikan sumbangan
pengetahuan bagi perkembangan obat alami terutama dari ekstrak etanolik
daun salam sebagai obat anti inflamasi.
b. Manfaat praktis
Penelitiaan ini diharapkan dapat menghasilkan sediaan emulgel
ekstrak etanolik daun salam sebagai obat anti inflamasi.
B. Tujuan Penelitian 1. Tujuan umum
a. Untuk memberikan informasi kepada masyarakat tentang tanaman obat
yang berkhasiat sebagai antiinflamasi.
b. Untuk membuat sediaan emulgel dengan zat aktif berupa ekstrak etanolik
daun salam yang memiliki aktivitas antiinflamasi.
2. Tujuan khusus
a. Untuk menghasilkan sediaan emulgel daun salam yang memiliki kualitas
fisik bagus
b. Untuk mengetahui efektivitas antiinflamasi yang dimiliki oleh ekstrak
c. Untuk mengetahui pengaruh penambahan konsentrasi minyak peppermint
sebagai penetration enhancer pada formulasi sediaan emulgel ekstrak
7 BAB II
PENELAAHAN PUSTAKA A. Inflamasi
Inflamasi atau peradangan merupakan respon yang terjadi pada
jaringan-jaringan hidup di sekitar sel atau jaringan-jaringan tubuh yang cedera atau mati adalah
suatu reaksi vaskular yang hasilnya merupakan pengiriman cairan, zat-zat terlarut,
dan sel-sel dari darah yang bersirkulasi ke dalam jaringan-jaringan interstitial
pada daerah cedera atau nekrosis (Price dan Wilson, 1992).
Inflamasi biasanya dibagi dalam 3 fase : inflamasi akut, respons imun,
dan inflamasi kronis. Inflamasi akut merupakan respon awal dari cedera jaringan.
Inflamasi tersebut terjadi melalui autakoid serta pada umumnya didahului oleh
pembentukan respon imun. Sejumlah autokoid yang terlibat seperti histamin,
serotonin, bradikinin, prostaglandin, dan leukotrien (Katzung, 2001).
Mekanisme inflamasi dipengaruhi oleh senyawa dan mediator yang
dihasilkan oleh asam arakidonat. Saat membran sel mengalami kerusakan oleh
suatu rangsangan kimiawi, fisik, atau mekanis, enzim fosfolipase diaktifkan untuk
mengubah fosfolipid yang terdapat di membran sel tersebut menjadi asam
arakidonat (Tjay dan Rahardja, 2002). Asam arakidonat merupakan komponen
normal yang disimpan pada sel dalam bentuk fosfolipid. Adanya stimulus
menyebabkan asam arakidonat dilepaskan dari sel penyimpanan lipid oleh asil
Gejala inflamasi yang dapat diamati adalah kemerahan (rubor), panas
meningkat (calor), pembengkakan (tumor), nyeri (dolor), dan gangguan fungsi
(fungsio laesa). Gejala-gejala tersebut adalah akibat dari gangguan aliran darah
yang terjadi akibat kerusakan jaringan dalam pembuluh pengalir terminal,
gangguan keluarnya plasma darah (eksudasi) ke ruangan ekstrasel akibat
meningkatnya ketebalan kapiler dan perangsangan reseptor nyeri (Mutschler,
1991).
B. Antiinflamasi
Pengobatan inflamasi meliputi dua sasaran yaitu mengurangi nyeri
sebagai gejala yang paling sering tampak dan menghambat atau mencegah proses
perusakan jaringan. Pengobatan inflamasi dengan obat antiinflamasi akan
mengurangi nyeri selama waktu tertentu (Furst dan Munster, 2002).
Secara umum mekanisme obat antiinflamasi dibagi menjadi 2 golongan,
yaitu golongan kortikosteroid dan nonsteroid. Obat golongan kortikosteroid
memiliki daya antiinflamasi kuat dengan menghambat pelepasan prostaglandin
dari sel-sel sumbernya. Obat antiinflamasi golongan nonsteroid (OAINS) bekerja
melalui mekanisme lain, seperti inhibisi enzim siklooksigenase yang berperan
dalam biosintesis prostaglandin (Yayasan Pengembangan Obat Bahan Alami
Fitomedika, 1991).
Penggunaan OAINS untuk jangka panjang akan berefek pada
gastrointestinal seperti dispepsia serta rasa nyeri pada abdomen, dapat pula terjadi
pendarahan pada lambung atau duodenum (Fitzgerald et al., 2001). Pemberian
lambung, selain itu tujuan dari sistem penghantaran sediaan secara topikal adalah
menghindari berbagai masalah absorpsi pada saluran cerna seperti deaktivasi oleh
enzim pencernaan (Gunani, 2009).
C. Voltaren® (Dietilamin Diklofenak)
Voltaren® merupakan sediaan topikal berupa emulgel yang ditujukan
untuk pereda nyeri yang disebabkan oleh kecelakaan saat olahraga, radang pada
punggung, pundak, atau otot. Voltaren® mengandung bahan aktif dietilamin
diklofenak 11,6mg/g yaitu setara dengan 10 mg natrium diklofenak. Efek setelah
satu kali pemakaian Voltaren® akan terasa paling lama 48 jam setelah pemakaian.
Tidak dianjurkan menggunakan Voltaren® emulgel bersamaan dengan konsumsi
OAINS oral (Novartis, 2008). Sediaan OAINS mampu menghambat sintesis
mediator nyeri prostaglandin melalui menghambat aktivitas enzim
siklooksigenase (Duffy, 2003).
Gambar 1. Voltaren® Emulgel (Novartis, 2008).
Natrium diklofenak merupakan turunan fenilasetat yang terkuat daya
antiradangnya dan efek sampingnya lebih ringan dibandingkan dengan obat
menghambat siklooksigenase yang relatif non selektif dan kuat, juga mengurangi
bioavailabilitas asam arakhidonat (Furst dan Munster, 2002).
D. Tanaman Salam
Gambar 2. Daun salam (Eugenia polyantha) (Haryanto,2006).
1. Sistematika
Sistematika tanaman Eugenia polyantha adalah sebagai berikut:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Subkelas : Dialypetalae
Bangsa : Myrtales
Suku : Myrtaceae
Marga : Eugenia
Jenis : Eugenia polyantha
2. Uraian tanaman
Pohon salam tumbuh di Bima, ke arah selatan sampai Indonesia. Di
Pulau Jawa tumbuh di Jawa Barat sampai Jawa Timur pada ketinggian 5-1.000
m di atas permukaan laut. Pohon salam dapat tumbuh di dataran rendah
sampai pegunungan dengan ketinggian 1.800 m (Dalimarta, 2003). Merupakan
pohon bertajuk rimbun, tinggi sampai 25 m. Daunnya bila diremas berbau
harum, berbentuk lonjong sampai elips, atau bulat telur sungsang, pangkal
lancip sedangkan ujung lancip sampai tumpul, panjang 5-15 cm, lebar 35-36
mm, terdapat 6-10 urat daun lateral, pangkal daun 5-12 mm. Perbungaan
berupa malai, keluar dari ranting, berbau harum. Bila musim berbunga, pohon
akan dipenuhi bunga. Kelopak bunga berbentuk cangkir yang lebar, ukurannya
lebih kurang 1 mm. Mahkota bunga berwarna putih, panjang 2,5-3,5 mm,
benang sari terbagi dalam 4 kelompok, panjang 3 mm, berwarna kuning
lembayung. Buah berwarna merah gelap, berbentuk bulat dengan garis tengah
8-9 mm, pada bagian tepi berakar lembaga yang sangat pendek (Sudarsono et
al., 2002).
3. Kandungan kimia
Menurut badan POM (2004), kandungan kimia daun salam adalah
tannin, minyak atsiri (salamol, eugenol), flavonoid (quercetin, quercitrin,
myrcetin, myricitrin), seskuiterpen, triterpenoid, fenol, steroid, sitral, lakton,
saponin dan karbohidrat.
Flavonoid yang terdapat dalam daun salam berfungsi untuk
penyumbatan pada pembuluh darah, mengandung anti inflamasi (anti radang),
antioksidan, antialergi, hepatoprotektor, dan membantu mengurangi rasa sakit
(analgesik) (Middleton et al, 2000). Flavonoid pada daun salam akan
menghambat pelepasan TNF-α dan IL-6 yang merupakan mediator inflamasi
sehingga tidak akan terjadi inflamasi (Lafuente, Guillamon, Vilares, 2009).
E. Ekstrak dan Maserasi
Ekstrak adalah sediaan kering, kental, atau cair yang dibuat dengan
menyari nabati atau hewani menurut cara yang cocok, diluar pengaruh cahaya
matahari. Umumnya digunakan air, eter, atau campuran etanol-air sebagai
penyari. Kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
ditetapkan (Dirjen POM, 1995).
Maserasi merupakan salah satu metode ekstraksi yang menggunakan
pelarut disertai penggojokan dan pengadukan pada suhu kamar. Prinsip dari
metode maserasi adalah mencapai konsentrasi pada kesetimbangan. Remaserasi
yaitu pengulangan penambahan pelarut setelah penyaringan maserat pertama dan
seterusnya (Dirjen POM, 2000).
F. Metode Uji Daya Antiinflamasi
Secara umum model inflamasi dibedakan menjadi dua sesuai dengan
jenis inflamasi, yaitu model inflamasi akut dan model inflamasi kronik. Inflamasi
akut dapat dibuat dengan berbagai cara, yaitu dengan induksi udema kaki tikus,
sedangkan inflamasi kronis dibuat dengan pembentukan granuloma dan induksi
arthritis (Gryglewski, 1977).
Beberapa metode yang dapat dipakai untuk mengukur daya antiinflamasi
yaitu:
1. Uji eritema
Tanda awal reaksi inflamasi di kulit adalah kemerahan (eritema) yang
berhubungan dengan vasodilatasi, dimana belum disertai eksudasi plasma dan
udema. Uji eritema yang disebabkan UV dapat digunakan untuk mengukur
fase vasodilatasi pada reaksi inflamasi (Gryglewski, 1977). Keuntungan dari
uji eritema adalah cara pengujian sederhana namun perlu latihan khusus
karena menggunakan fotometer refleksi (Vogel, 2002).
2. Radang telapak kaki belakang
Metode induksi udem merupakan metode paling umum digunakan
untuk skrinning obat antiinflamasi. Uji ini didasarkan pada kemampuan
beberapa bahan uji untuk menghambat produksi udema kaki hewan uji setelah
diinjeksi bahan pembuat radang. Banyak zat pembuat radang (iritan) yang
telah digunakan seperti formaldehid, dextran, albumin telur, karagenin, dll
(Vogel, 2002).
Iritan yang paling banyak digunakan adalah karagenin. Karagenin
merupakan fosfolipida tersulfatasi yang diekstrak dari lumut Irlandia
Chondrus cripus. Efeknya dapat diukur dengan memotong kaki belakang pada
3. Tes radang selaput dada
Radang selaput dada dikenal sebagai fenomena inflamasi eksudatif
pada manusia (Vogel, 2002). Radang selaput dada pada tikus dapat
disebabkan injeksi intrapleural dari turpentine, evans blue, gum arab,
glikogen, dextran, atau karagenin (Gryglewski, 1977). Radang selaput dada
yang disebabkan karagenin dipertimbangkan sebagai model inflamasi akut
yang paling sempurna dimana keluarnya cairan, migrasi leukosit, dan
parameter biokimia lain yang ada dalam respon inflamasi dapat diukur
dengan mudah dari eksudat (Vogel, 2002).
4. Tes kantung granuloma
Hewan uji diinjeksi tikus putih betina diinjeksi bagian punggung
secara subkutan dengan 10-25 ml udara, lalu 0,5 ml minyak kapas sebagai
senyawa iritan. Pada hari kedua setelah pembuatan kantung, udara
dihampakan. Pada hari keempat, kantung dibuka dan cairan eksudat disedot,
selanjutnya diukur volume cairannya. Persen inhibisi granuloma dihitung
dengan membandingkan volume cairan eksudat kelompok perlakuan dengan
kelompok kontrol. Model percobaan ini lebih responsif untuk uji obat
antiinflamasi steroid daripada nonsteroid (Turner, 1965).
G. Karagenin
Karagenin merupakan senyawa iritan dari ekstrak Chindrus cripus.
Karagenin banyak digunakan untuk uji inflamasi karena sifatnya yang tidak
terhadap obat antiinflamasi dibanding senyawa iritan lain (Siswanto dan Nurulita,
2005).
Karagenin biasa digunakan sebagai penginduksi inflamasi berupa
karagenin 1% dalam larutan NaCl fisiologis 0,9%(b/v) dengan volume sebesar 0,1
mL untuk tikus dan 0,05 mL untuk mencit (Suleyman, Demircan, Karagoz, dan
Ozta, 2004).
Proses pembentukan edema akibat injeksi karagenin melalui 2 fase. Pada
fase 1 ( 0-2 jam setelah penginjeksian) mediator yang terlibat adalah histamine,
bradikinin, dan serotonin. Pada fase 2 (3-4 jam setelah penginjeksian) mediator
yang terlibat adalah prostaglandin yang meningkatkan permeabilitas vaskuler.
Inflamasi lokal diasosiasikan dengan peningkatan level dari agen pro-inflamasi
yaitu sitokin TNF-α, IL-1, dan IL-6 (Necas, 2013).
H. Emulgel
Emulgel merupakan bentuk sediaan semisolid yang terdiri dari 2 sistem
yaitu sistem emulsi dan gel. Emulgel merupakan sistem penghantaran obat yang
baik untuk zat aktif hidrofobik. Emulgel menjadi bentuk sediaan yang mengatasi
masalah dari sediaan gel. Emulgel memiliki daya penetrasi ke kulit yang baik.
Selain itu kelebihan dari emulgel untuk pemakaian dermatologis adalah
tiksotropik, berlemak, mempunyai daya sebar yang baik, melembutkan, dan
mudah dicuci, dan larut air (Singla, Saini, Joshi, dan Rana, 2012).
Emulgel dibuat dengan mencampurkan emulsi dan gel. Agar sediaan
merupakan surfaktan yang akan menurunkan tegangan antarmuka antara minyak
dan air (Allen,2005). Gelling agent saat didispersikan dalam suatu pelarut yang
sesuai akan membentuk struktur jaring koloid tiga dimensi yang membatasi cairan
dengan menjebak dan menghentikan pergerakan molekul pelarut. Struktur ini juga
menahan deformasi dan bertanggung jawab terhadap viskositas gel (Pena, 1990).
I. Penetration Enhancer
Sediaan rute transdermal memiliki kekurangan yaitu sulitnya sediaan
menembus barier kulit yaitu stratum korneum. Stratum korneum sangat selektif
terhadap molekul yang akan melaluinya. Hal ini membuat sediaan yang masuk ke
tempat aksi di kulit kemungkinan hanya kecil, karenanya dibutuhkan penetration
enhancer. Menurut Fox (2011), mekanisme aksi penetration enhancer adalah
dengan mengubah permeabilitas kulit sehingga mudah ditembus atau
meningkatkan kemampuan sediaan untuk menembus kulit.
Bahan yang digunakan sebagai penetration enhancer idealnya inert,
aksinya spesifik, tidak menyebabkan alergi, iritasi, dan tidak toksik. Penetration
enhancer dapat berupa bahan kimia, minyak esensial, atau terpen hasil isolasi dari
minyak esensial. Contoh dari penetration enhancer kimia adalah sulfoksida
(DMSO), alkohol (etanol), propilen glikol, alkana, asam lemak (asam oleat), ester,
amida dan amina. Minyak esensial yang digunakan untuk penetration enhancer
antara lain Eucalyptus oil, Alpinia oxyphylla oil, cardamom oil, peppermint oil,
J. Minyak Peppermint
Minyak peppermint (peppermint oil) diekstrak dengan destilasi uap dari
batang, daun, dan bunga tanaman Mentha piperita. Kandungan dalam minyak
peppermint adalah menthol (34-44%), menthone (12-20%), menthofuran (4-9%),
1,8-cineol (2-5%), pulegone (2-5%), dan mentil asetat (4-10%). Minyak
peppermint banyak digunakan untuk meredakan nyeri, mengontrol napsu makan,
menstimulasi digesti, anti tumor, anti virus, anti bakteri, dan agen anti parasit (Fox
et al, 2011).
Minyak peppermint termasuk minyak esensial yang dapat digunakan
sebagai penetration enhancer. Kandungan mentol dalam minyak peppermint
memiliki efek membantu penetrasi di kulit dan merupakan senyawa yang
menjanjikan untuk penghantaran obat dengan jalur transdermal.
Dalam sediaan emulgel, komposisi minyak peppermint hingga 5% dapat
digunakan sebagai penetration enhancer (Singla et al, 2012).
K. Landasan Teori
Inflamasi atau peradangan merupakan reaksi vaskular yang hasilnya
merupakan pengiriman cairan, zat-zat terlarut, dan sel-sel dari sirkulasi darah ke
jaringan-jaringan interstitial pada daerah cedera atau nekrosis (Price dan Wilson,
1992). Penyebab inflamasi dapat ditimbulkan oleh rangsangan fisik, kimiawi,
biologis (infeksi akibat mikroorganisme atau parasit), dan kombinasi ketiga agen
Mekanisme inflamasi dipengaruhi oleh senyawa dan mediator yang
dihasilkan oleh asam arakidonat. Saat membran sel mengalami kerusakan oleh
suatu rangsangan kimiawi, fisik, atau mekanis, enzim fosfolipase diaktifkan untuk
mengubah fosfolipid yang terdapat di membran sel tersebut menjadi asam
arakidonat (Tjay dan Rahardja, 2002). Pada inflamasi lokal diasosiasikan dengan
peningkatan level dari mediator inflamasi seperti sitokin TNF-α, IL-1, dan IL-6
(Necas, 2013).
Daun salam mempunyai banyak kandungan kimia salah satunya adalah
flavonoid. Menurut Haryanto (2006), flavonoid yang terdapat dalam daun salam
berfungsi untuk melancarkan peredaran darah seluruh tubuh dan mencegah
terjadinya penyumbatan pada pembuluh darah, mengandung antiinflamasi
(antiradang), berfungsi sebagai antioksidan dan membantu mengurangi rasa sakit
(analgesik). Flavonoid pada daun salam akan menghambat pelepasan TNF-α dan
IL-6 yang merupakan mediator inflamasi sehingga tidak akan terjadi inflamasi
(Lafuente, Guillamon, Vilares, 2009).
Emulgel merupakan sediaan yang terbentuk dari 2 fase yaitu emulsi dan
gel. Emulgel daun salam yang dibuat menggunakan CMC Na sebagai gelling
agent. Sediaan topikal memiliki hambatan yaitu harus menembus barier kulit
seperti stratum korneum maka dilakukan penambahan minyak peppermint dalam
formula sebagai penetration enhancer untuk membantu penetrasi emulgel ke
L. Hipotesis
1. Formulasi emulgel antiinflamasi dengan ekstrak etanolik daun salam
menghasilkan emulgel dengan kualitas fisik yang baik
2. Sediaan emugel dengan ekstrak etanolik daun salam memiliki aktivitas
sebagai antiinflamasi.
3. Penambahan konsentrasi minyak peppermint memiliki pengaruh sebagai
penetration enhancer pada formulasi sediaan emulgel ekstrak etanolik daun
20 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian tentang formulasi emulgel daun salam dan pengujian efek anti
inflamasi ekstrak etanolik daun salam pada tikus merupakan penelitian
eksperimental murni dengan rancangan acak pola searah..
B. Variabel dan Definisi Operasional 1. Variabel penelitian
Variabel penelitian ini meliputi :
a. Variabel utama
1) Variabel bebas
Konsentrasi minyak peppermint dalam formula emulgel daun salam
2) Variabel tergantung
Tebal udema kaki tikus (mm), sifat fisik emulgel meliputi pH,
viskositas, dan daya sebar
b. Variabel pengacau terkendali
Jenis tikus, umur tikus, jenis kelamin tikus, kecepatan dan lama
pengadukan sediaan emulgel daun salam, wadah sediaan, kondisi
penyimpanan
c. Variabel pengacau tak terkendali
2. Definisi operasional
a. Emulgel adalah sediaan semisolid hasil emulsifikasi dan penambahan CMC Na 4% yang mengandung ekstrak etanolik daun salam yang dibuat
sesuai dengan formula yang tercantum dan berfungsi sebagai
antiinflamasi.
b. Inflamasi adalah reaksi tubuh terhadap mikroorganisme dan benda asing yang ditandai oleh panas, bengkak, nyeri, dan gangguan fungsi organ
tubuh. Dalam penelitian ini adalah udema pada kaki belakang tikus.
c. Aktivitas antiinflamasi adalah kemampuan emulgel sebagai agen antiinflamasi pada tikus yang ditunjukkan dengan penurunan edema.
d. Sifat fisik adalah parameter untuk mengetahui kualitas emulgel yang dihasilkan meliputi viskositas, daya sebar, dan organoleptis.
e. Viskositas adalah kemampuan tahanan dari cairan untuk mengalir, semakin tinggi viskositas maka semakin besar pula tahanannya.
f. Daya sebar adalah kemampuan sediaan emulgel untuk menyebar pada alat uji daya sebar yaitu gelas kaca yang digunakan.
g. Persen (%) reduksi udema adalah hasil perhitungan persen penurunan udema yang terjadi pada kaki belakang tikus betina yang diuji pada jam
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah daun salam
(B2P2TOOT), etanol 70% sebagai pelarut, emulgel Voltaren® (Novartis) sebagai
kontrol positif, karagenin 1% sebagai penginduksi inflamasi, CMC Na
(Bratachem), gliserin (Bratachem), tween 80 (Bratachem), span 80, paraffin cair
(Bratachem), metil paraben (Bratachem), propil paraben, minyak peppermint,
aquadest, hewan uji tikus betina galur Wistar (Laboratorium Imono Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta).
D. Alat atau Instrumentasi Penelitian
Peralatan yang digunakan dalam penelitian ini antara lain seperangkat
alat gelas, spuit injeksi 1 mL, mortar, stamper, indikator pH universal, alat uji
daya sebar, viscotester RION seri VT 04, orbital shaker (Optima), rotary
evaporator (Buchi Labortechnik AG CH-9230), jangka sorong Digital Caliper
“Wipro”, mixer, waterbath (Memmert), wadah pot, termometer, indikator pH
universal (MERCK), neraca analitik,
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman dilakukan oleh Balai Besar Penelitian Dan
Pengembangan Tanaman Obat Dan Obat Tradisional Tawangmangu, Jawa
2. Pembuatan ekstrak daun salam
Ditimbang 50 gram serbuk daun salam lalu dimasukkan ke dalam
Erlenmeyer. Sebanyak 250 mL etanol 70% ditambahkan sebagai pelarut.
Maserasi dilakukan menggunakan orbital shaker selama 24 jam. Maserat
disaring menggunakan corong Buchner dan kertas saring. Pelarut dari ekstrak
diuapkan menggunakan rotary evaporator dilanjutkan dengan waterbath 70oC.
Setelah itu ekstrak kental dioven pada suhu 40oC hingga didapat bobot tetap.
3. Formula
Formula dimodifikasi berdasarkan acuan pada formula Emulgel Antiacne
Minyak Cengkeh (Suryarini, 2011) dengan penyusunan formula basis :
R/ Paraffin liquidum 20 g
Span 80 4,4 g
Propil Paraben 0,02 g
Tween 80 15,6 g
Gliserin 2 g
Metil Paraben 0,18 g
Carbopol 940 0,5 g
TEA 0,5 g
Komposisi formula setelah dimodifikasi sebagai berikut:
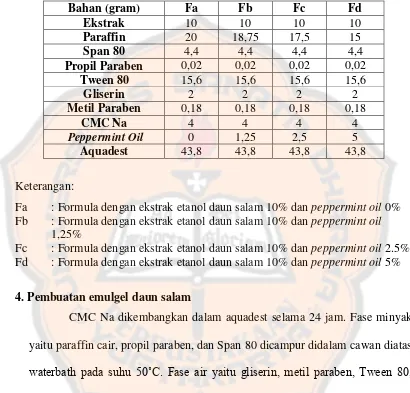
Tabel 1. Formula Emulgel Daun Salam (Eugenia polyantha (Wight.)) dalam 100 gram sediaan
Fa : Formula dengan ekstrak etanol daun salam 10% dan peppermint oil 0% Fb : Formula dengan ekstrak etanol daun salam 10% dan peppermint oil
1,25%
Fc : Formula dengan ekstrak etanol daun salam 10% dan peppermint oil 2.5% Fd : Formula dengan ekstrak etanol daun salam 10% dan peppermint oil 5%
4. Pembuatan emulgel daun salam
CMC Na dikembangkan dalam aquadest selama 24 jam. Fase minyak
yaitu paraffin cair, propil paraben, dan Span 80 dicampur didalam cawan diatas
waterbath pada suhu 50˚C. Fase air yaitu gliserin, metil paraben, Tween 80,
dan aquadest dicampur didalam cawan diatas waterbath pada suhu 50˚C. Fase
air dan fase minyak dicampur dalam wadah dengan mixer. Didiamkan hingga
mencapai suhu ruangan, ditambahkan CMC Na yang telah dikembangkan,
peppermint oil, dan ekstrak daun salam, dimixer hingga tercampur semua.
Setelah itu dilakukan uji pH dengan kertas pH universal, pH sediaan yang
5. Uji sifat fisik dan stabilitas emulgel
Uji sifat fisik emulgel dilakukan dengan menguji organoleptis,
viskositas, dan daya sebar, untuk uji stabilitas dilakukan dengan menguji
viskositas emulgel setelah penyimpanan selama 1 bulan.
a. Uji organoleptis
Pemeriksaan organoleptis meliputi bentuk, warna dan bau yang
diamati secara visual.
b. Uji viskositas
Pengukuran viskositas menggunakan alat viscotester. Emulgel
dimasukkan dalam wadah dan dipasang pada portable viscotester.
Viskositas emulgel diketahui dengan mengamati gerakan jarum penunjuk
viskositas. Uji dilakukan setelah 48 jam dari pembuatan, hingga setelah 1
bulan penyimpanan.
c. Uji daya sebar
Emulgel ditimbang seberat 1,0 gram, diletakkan ditengah kaca
bulat berskala. Diatas emulgel diletakkan kaca bulat lain dan pemberat
dengan berat total 125 gram, didiamkan selama 1 menit, kemudian dicatat
diameter penyebarannya (Grag dkk., 2002). Uji dilakukan setelah 48 jam
dari pembuatan, hingga setelah 1 bulan penyimpanan.
d. Pengukuran pH
Pengukuran pH sediaan gel menggunakan kertas pH universal.
lalu ditentukan pHnya dengan membandingkan warnanya dengan standar
warna yang ada. pH yang diinginkan adalah 5-6.
6. Uji aktivitas antiinflamasi emulgel
Dilakukan uji aktivitas antiinflamasi emulgel daun salam pada
tikus betina galur Wistar dengan tata cara penelitian metode radang
telapak kaki belakang.
a. Penyiapan hewan uji
Hewan uji yang digunakan dalam penelitian ini adalah tikus betina
galur Wistar umur 2-3 bulan dengan berat badan 150-200 gram. Kelompok
perlakuan terdiri dari kontrol negatif karagenin 1%, kontrol positif
Voltaren®, basis emulgel, emulgel peppermint 1,25%, emulgel peppermint
2,5%, emulgel peppermint 5%, emulgel ekstrak daun salam, emulgel
ekstrak daun salam dengan minyak peppermint 1,25%, emulgel ekstrak
daun salam dengan minyak peppermint 2,5%, dan emulgel ekstrak daun
salam dengan minyak peppermint 5%.
b. Pembuatan suspensi karagenin 1%
Karagenan ditimbang sebanyak 0,2 mg, dilarutkan dengan
larutan NaCl fisiologis 0,9% dalam labu takar 20 ml.
c. Perlakuan hewan uji
Hewan uji dibagi menjadi :
1) Kelompok kontrol negatif suspensi karagenin 1%
Kaki kiri dan kanan belakang tikus diukur menggunakan jangka
subplantar. Kemudian diukur udema yang terjadi setelah 2 jam
penyuntikan, 4 jam dan 24 jam.
2) Kelompok kontrol positif Voltaren®
Kaki kiri dan kanan belakang tikus diukur menggunakan jangka
sorong sebelum diinjeksi dengan suspensi karagenin 1% secara
subplantar. Setelah 2 jam, diukur udema yang terjadi lalu dioleskan
Voltaren® dan diukur udema pada 4 jam dan 24 jam setelah
pengolesan.
3) Kelompok perlakuan emulgel daun salam
Kaki kiri dan kanan belakang tikus diukur menggunakan
jangka sorong sebelum diinjeksi dengan suspensi karagenin 1%
secara subplantar. Setelah 2 jam, diukur udema yang terjadi lalu
dioleskan emulgel daun salam, diukur udema pada 4 jam dan 24 jam
setelah pengolesan.
d. Pengukuran penurunan edama
Pengukuran penurunan edema yaitu edema yang terjadi pada
kaki tikus diukur menggunakan vernier caliper (jangka sorong).
Persentase reduksi udema dari tiap sediaan dihitung
menggunakan rumus:
% 𝑟𝑒𝑑𝑢𝑘𝑠𝑖𝑢𝑑𝑒𝑚𝑎= 𝑢𝑑𝑒𝑚𝑎 𝑎𝑤𝑎𝑙 −𝑢𝑑𝑒𝑚𝑎 𝑎𝑘ℎ𝑖𝑟
F. Analisis Hasil
Data organoleptis emulgel dilakukan secara kualitatif dengan kasat mata.
Daya sebar dilihat dari hasil uji daya sebar. Viskositas emulgel secara kuantitatif
dapat dilihat dari nilai yang tertera pada viskotester. Pergeseran viskositas secara
kuantitatif dihitung dari perubahan viskositas selama penyimpanan 1 bulan. Data
aktivitas antiinflamasi didapat dari pengukuran udema yang terjadi pada kaki
belakang tikus yang diinjeksi karagenin setelah pengolesan emulgel pada jam ke-4
dan ke-24.
Data hasil sifat fisik dan aktivitas emulgel pada tikus dianalisis
menggunakan software R versi 2.14.2. Digunakan Shapiro-Wilk untuk melihat
distribusi data. Jika distribusi data normal makan dilanjutkan dengan Levene-test
untuk melihat kesamaan variansi tiap populasi. Jika data memiliki kesamaan
variansi analisis dilanjutkan dengan ANOVA satu arah dengan taraf kepercayaan
95% untuk selanjutnya dianalisis dengan Tukey. Untuk pergeseran viskositas,
29 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Daun salam yang digunakan dalam penelitian ini merupakan daun salam
kering dari Balai Besar Penelitian dan Pengembangan Tanaman Obat dan Obat
Tradisional (B2P2TOOT) Tawangmangu. Daun salam yang digunakan telah
dideterminasi oleh B2P2TOOT untuk memastikan bahwa tanaman tersebut adalah
benar-benar daun salam yang dimaksud oleh peneliti yaitu Eugenia polyantha.
B. Standarisasi Ekstrak Daun Salam
Pada penelitian ini dilakukan standarisasi ekstrak yang meliputi penetapan
kadar quercetin yang merupakan kandungan terbesar dari flavonoid daun salam
dan pengujian kadar air yang terkandung dalam ekstrak etanol daun salam yang
didapat dari hasil maserasi. Standarisasi dilakukan untuk menjamin mutu dari
ekstrak yang akan digunakan sebagai zat aktif dari emulgel. Standarisasi ekstrak
dilakukan oleh Laboratorium Penelitian dan Pengembangan Terpadu (LPPT)
Universitas Gadjah Mada Yogyakarta. Dari hasil standarisasi diketahui bahwa
kandungan quercetin dalam ekstrak etanol daun salam sebesar 0,81% dan kadar
airnya sebesar 14,71%.
C. Sifat Fisik dan Stabilitas Emulgel
Pada penelitian ini dilakukan variasi konsentrasi minyak peppermint
peppermint dengan konsentrasi yang berbeda dapat memberikan perbedaan pula
pada sifat fisik dari emulgel yang dibuat. Emulgel yang dibuat diharapkan
mempunyai sifat fisik yang baik maka dilakukan pengujian terhadap sifat fisik dan
stabilitas dari emulgel. Sifat fisik yang diukur dari sediaan emulgel ini adalah
daya sebar dan viskositas. Daya sebar menjamin pemerataan emulgel saat
diaplikasikan ke kulit. Nilai daya sebar yang direkomendasikan untuk sediaan
semisolid adalah 5 cm. Daya sebar yang diinginkan oleh peneliti adalah 3-5 cm.
Viskositas sediaan akan berpengaruh pada pengaplikasian pada kulit dan
saat dikeluarkan dari kemasan. Viskositas juga berpengaruh terhadap proses
pelepasan zat aktif dari pembawa. Viskositas diukur dengan alat Viscotester seri
VT-04 dan dilakukan pada 48 jam setelah pembuatan agar viskositas tidak
dipengaruhi oleh proses pembuatan emulgel sehinggal sediaan yang terbentuk
sudah stabil. Viskositas yang diinginkan adalah 250-400 d.Pa.s. Rentang
viskositas tersebut dipilih agar emulgel yang dihasilkan tidak terlalu kental
ataupun encer. Dilihat pula pergeseran viskositas yang terjadi setelah disimpan
selama 1 bulan. Hal ini untuk menjamin stabilitas sediaan. Stabilitas dikatakan
baik bila pergeseran viskositasnya kecil. Pegeseran viskositas yang diinginkan
sebesar kurang dari 10%.
1. Uji Organoleptis
Uji organoleptis dilakukan secara kasat mata. Uji yang dilakukan
meliputi bentuk, warna, dan bau. Dari penelitian didapat hasil seperti yang
Tabel II. Hasil Uji Organoleptis Emulgel
Uji daya sebar dilakukan dengan mengukur diameter sebaran 1 gram
emulgel ditengah kaca bulat berskala yang diberi beban total 125 gram dan
telah didiamkan selama 1 menit (Grag dkk., 2002). Daya sebar dipengaruhi
oleh viskositas, jika viskositas rendah maka daya sebarnya semakin tinggi.
Daya sebar penting untuk mengetahui kemudahan saat diaplikasikan ke kulit
dan dikeluarkan dari wadah.
3. Uji Viskositas
Viskositas adalah suatu pernyataan tahanan dari suatu cairan untuk
mengalir, makin tinggi viskositas maka makin besar tahanannya. Pengukuran
viskositas menggunakan alat Viscotester seri VT-04 (RION, Japan). Emulgel
dimasukkan dalam wadah, dipasang pada viscotester, dan diuji menggunakan
putaran nomor 2. Viskositas emulgel diketahui dengan mengamati gerakan
jarum penunjuk viskositas.
Pergeseran viskositas diukur untuk mengetahui stabilitas emulgel.
Besarnya pergeseran viskositas merupakan selisih antara viskositas awal dan
Persen pergeseran viskositas dapat diukur menggunakan rumus :
% 𝑝𝑒𝑟𝑔𝑒𝑠𝑒𝑟𝑎𝑛𝑣𝑖𝑠𝑘𝑜𝑠𝑖𝑡𝑎𝑠= 𝑣𝑖𝑠𝑘𝑜𝑠𝑖𝑡𝑎𝑠 ℎ𝑎𝑟𝑖𝑘𝑒𝑑𝑢𝑎 −𝑣𝑖𝑠𝑘𝑜𝑠𝑖𝑡𝑎𝑠 ℎ𝑎𝑟𝑖𝑘𝑒−28
𝑣𝑖𝑠𝑘𝑜𝑠𝑖𝑡𝑎𝑠 ℎ𝑎𝑟𝑖𝑘𝑒𝑑𝑢𝑎 × 100 %
Data yang didapat selama pengujian lalu diolah dan hasilnya disajikan
pada Tabel III.
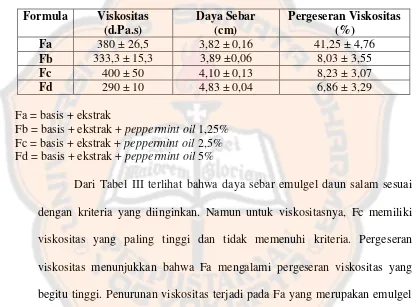
Tabel III. Hasil Uji Sifat Fisik Emulgel (Rata-rata ± SD) Formula Viskositas
dengan kriteria yang diinginkan. Namun untuk viskositasnya, Fc memiliki
viskositas yang paling tinggi dan tidak memenuhi kriteria. Pergeseran
viskositas menunjukkan bahwa Fa mengalami pergeseran viskositas yang
begitu tinggi. Penurunan viskositas terjadi pada Fa yang merupakan emulgel
daun salam tanpa penambahan minyak peppermint. Dapat dikatakan bahwa
Fa tidak stabil dalam penyimpanan.
4. Uji pH
Uji pH dilakukan dengan menggunakan indikator pH universal (pH
Tabel IV. Hasil Uji pH Emulgel
memiliki rentang pH 5-6 sehingga dapat disimpulkan sediaan ini memenuhi
kriteria yang diinginkan.
Dilakukan pula uji statistika stabilitas emulgel. Data pegeseran
viskositas yang didapat diuji dengan menggunakan uji T berpasangan. Uji T
berpasangan biasa dilakukan untuk membandingkan subjek yang berpasangan
atau 2 kelompok data yang diperoleh dari pengukuran dua kali pada objek
pengamatan sama pada jangka waktu berbeda. Emulgel dikatakan stabil bila
p>0,05.
Tabel V. Hasil Statistik Uji T-berpasangan Antara Penyimpanan 48 Jam dan 28 Hari
sehingga sediaan dapat disimpulkan sediaan stabil secara statistik, sedangkan Fa
memiliki p<0,05, artinya sediaan tidak stabil secara statistik. Fa merupakan
emulgel daun salam tanpa penambahan minyak peppermint, maka minyak
dihasilkan. Ketidakstabilan suatu sediaan dapat disebabkan oleh suhu dan kondisi
ruang penyimpanan yang tidak dijaga dengan baik.
D. Uji Aktivitas Antiinflamasi Emulgel
Penelitian aktivitas antiinflamasi emulgel pada tikus putih betina galur
Wistar ini bertujuan untuk mengetahui aktivitas emulgel pada penurunan udema
setelah diinjeksi karagenin 1% secara subplantar dan melihat pengaruh
peningkatan konsentrasi minyak peppermint sebagai penetration enhancer.
Dipilih hewan uji yaitu tikus betina karena ketersediaan hewan uji ini lebih
banyak dan lebih mudah didapat daripada tikus jantan.
Metode yang digunakan adalah pengukuran ketebalan kaki tikus
menggunakan jangka sorong. Metode ini sering digunakan dalam uji antiinflamasi
karena metode ini sederhana, mudah dilakukan, instrumen yang dibutuhkan
sederhana, dan tidak menyakiti hewan uji.
Dalam penelitian ini tikus diinjeksi subplantar karagenin 1%, ditunggu 2
jam lalu diukur ketebalan udemanya. Setelah itu dioleskan emulgel daun salam
yang dibuat sebanyak ± 1 gram. Udema diukur lagi 4 jam dan 24 jam setelah
pengolesan. Untuk menguji aktivitas emulgel digunakan kontrol positif Voltaren®
dan untuk kontrol negatif setelah penyuntikan karagenin tidak dioleskan apapun.
Agar dapat dipastikan bahwa efek antiinflamasi timbul dari ekstrak daun salam
pada sediaan, maka diuji pula daya antiinflamasi dari basis emulgel dan basis
waktu pengolesan yaitu 2 jam setelah disuntik karagenan merupakan hasil dari
orientasi yang menunjukkan waktu pembengkakan optimal. Pada orientasi
dilakukan pengukuran selama 6 jam setiap 30 menit setelah penyuntikan.
Pada penelitian ini dipilih karagenin 1% sebagai penginduksi inflamasi
karena menurut Siswanto dan Nurlita (2005), karagenan tidak menimbulkan
kerusakan jaringan dan memberikan respon yang lebih peka terhadap obat
antiinflamasi dibanding senyawa iritan lain. Sebagai kontrol positif digunakan
Voltaren® emulgel yang mempunyai kandungan aktif dietilamin diklofenak
karena termasuk golongan obat antiinflamasi non steroid yang dapat berikatan
dengan enzim COX untuk menghambat pembentukan prostaglandin. Selain itu
saat ini Voltaren® emulgel menjadi pilihan utama konsumen untuk mengatasi
inflamasi dan nyeri. Persen reduksi udema ditunjukkan oleh penurunan udema
kaki tikus setelah diinjeksi karagenin 1% dan diberi perlakuan pengobatan
inflamasi.
E. Hasil Uji Antiinflamasi Emulgel
Hasil uji antiinflamasi emulgel berupa % reduksi udema kaki tikus. Besar
% reduksi udema kaki tikus ini merupakan selisih antara udema awal dan udema
akhir dibagi udema awal dikalikan 100%.
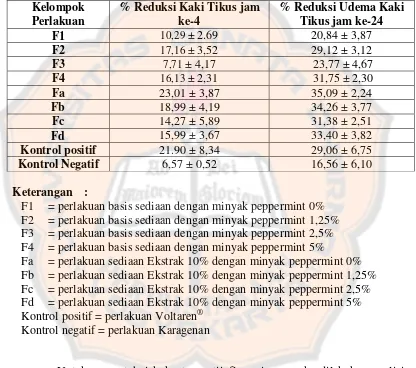
Pada Tabel VI terlihat bahwa kontrol negatif memiliki % reduksi udema
paling kecil dan dapat dilihat bahwa % inhibisi yang paling besar adalah dari
kelompok perlakuan sediaan emulgel dengan ekstrak 10% dan minyak peppermint
0%. Pada kelompok perlakuan sediaan dengan ekstrak, dapat dilihat bahwa
perbedaan reduksi udema yang besar. Dari hal ini dapat dikatakan bahwa
peningkatan konsentrasi minyak peppermint disini tidak memiliki pengaruh yang
signifikan dalam pada reduksi udema.
Tabel VI. Hasil Perhitungan % Reduksi Udema Kaki Tikus Kelompok
Perlakuan
% Reduksi Kaki Tikus jam ke-4
F1 = perlakuan basis sediaan dengan minyak peppermint 0% F2 = perlakuan basis sediaan dengan minyak peppermint 1,25% F3 = perlakuan basis sediaan dengan minyak peppermint 2,5% F4 = perlakuan basis sediaan dengan minyak peppermint 5%
Fa = perlakuan sediaan Ekstrak 10% dengan minyak peppermint 0% Fb = perlakuan sediaan Ekstrak 10% dengan minyak peppermint 1,25% Fc = perlakuan sediaan Ekstrak 10% dengan minyak peppermint 2,5% Fd = perlakuan sediaan Ekstrak 10% dengan minyak peppermint 5% Kontrol positif = perlakuan Voltaren®
Kontrol negatif = perlakuan Karagenan
Untuk mengetahui kekuatan antiinflamasinya, maka dilakukan analisis
statistik terhadap % reduksi udema. Dilakukan uji normalitas dan kesamaan
varians dan didapat hasil menunjukkan p>0,05 sehingga dapat disimpulkan
distribusinya normal dan memiliki kesamaan varians sehingga dapat dilanjutkan
dengan ANOVA. Hasil statistik uji normalitas dan kesamaan varians dapat dilihat
melihat perbedaan respon yang terjadi pada tiap perlakuan. Jika p-values
menunjukkan p>0,05 maka data berbeda tidak bermakna (BTB), sedangkan jika
p<0,05 maka data berbeda bermakna (BB).
Tabel VII. Hasil Uji Statistik TukeyHSD % Reduksi Udema Jam Ke-4
Sediaan p-value Keterangan
Kontrol positif
Kontrol negative 0,000 BB
F1 0,001 BB
F1 = perlakuan basis sediaan dan minyak peppermint 0% F2 = perlakuan basis sediaan dan minyak peppermint 1,25% F3 = perlakuan basis sediaan dan minyak peppermint 2,5% F4 = perlakuan basis sediaan dan minyak peppermint 5%
Fa = perlakuan sediaan Ekstrak 10% dan minyak peppermint 0% Fb = perlakuan sediaan Ekstrak 10% dan minyak peppermint 1,25% Fc = perlakuan sediaan Ekstrak 10% dan minyak peppermint 2,5% Fd = perlakuan sediaan Ekstrak 10% dan minyak peppermint 5% Kontrol negatif = perlakuan Karagenan
Pada Tabel VII dapat dilihat antara kontrol positif dan kontrol negatif
terdapat perbedaan yang signifikan. Ini membuktikan bahwa Voltaren® efektif
menurunkan inflamasi. Emulgel daun salam dengan penambahan minyak
peppermint menunjukkan p>0,05 jika dibandingkan dengan kontrol positif. Hal
ini menunjukkan bahwa tidak ada perbedaan yang signifikan secara statistic antara
emulgel daun salam dan kontrol positif pada penurunan udema 4 jam setelah
induksi agen antiinflamasi yaitu karagenan. Basis dengan penambahan minyak
peppermint 1,25% dan 5% juga menunjukkan hasil berbeda tidak bermakna
dibandingkan kontrol positif. Diduga minyak peppermint sendiri mampu
memberikan daya antiinflamasi sehingga dapat menyamarkan hasil dari emulgel
daun salam yang diuji.
Pada Tabel VII dapat dilihat pula perbandingan antara kontrol negatif
dengan sediaan. Terlihat bahwa Fb, Fd, F1, F2, dan F4 memiliki p< 0,05, ini
menunjukkan bahwa formula-formula tersebut berbeda bermakna dengan kontrol
negatif. Pada Fa, Fc, dan F3 menunjukkan p>0,05 yang berarti formula-formula
tersebut sama dengan kontrol negatif yaitu tidak memiliki kemampuan mereduksi
udema.
Hasil uji statistik perbandingan antara basis dan formula yang hasilnya
berbeda bermakna adalah basis tanpa minyak peppermint dibandingkan emulgel
tanpa minyak peppermint yaitu Fa dibandingkan F1. Perbandingan antarformula
yang lain menunjukkan hasil berbeda tidak bermakna. Hasil berbeda tidak
bermakna ini menunjukkan bahwa basis dengan minyak peppermint memberikan
Emulgel tanpa minyak peppermint juga menunjukkan hasil yang tidak berbeda
dibandingkan formula emulgel lainnya. Sehingga dapat disimpulkan kenaikan
minyak peppermint tidak memberikan pengaruh pada penetrasi emulgel ke dalam
kulit.
Aktivitas antiinflamasi emulgel 24 jam setelah pengolesan juga diuji
dengan uji statistik. Hasil yang tersaji pada Tabel VIII menunjukkan bahwa
setelah 24 jam, kelompok kontrol positif, basis, dan ekstrak memberikan hasil
berbeda tidak bermakna. Hasil tersebut menunjukkan bahwa basis dan emulgel
daun salam dapat dikatakan memiliki aktifitas antiinflamasi yang sama secara
statistik dengan kontrol positif yang digunakan setelah pemakaian 24 jam.
Kelompok kontrol negatif jika dibandingkan dengan kontrol positif menunjukkan
perbedaan yang bermakna. Emulgel daun salam yang dibuat menunjukkan
perbedaan bermakna dengan kontrol negatif sehingga dapat disimpulkan bahwa
emulgel daun salam memiliki kemampuan mereduksi udema yang terjadi.
Perbandingan antarformula emulgel daun salam menunjukkan p> 0,05
yang berarti antarformula tersebut berbeda tidak bermakna. Dapat disimpulkan
bahwa baik emulgel tanpa minyak peppermint atau pun dengan penambahan
minyak peppermint setelah 24 jam memiliki kemampuan yang sama dalam
mereduksi udema. Namun hasil semua formula menunjukkan berbeda tidak
bermakna ini dapat dikarenakan sediaan sudah tereliminasi semua dari tubuh
karena jangka waktu 24 jam setelah pengolesan terlalu lama. Pada pemakaian
sediaan topikal sebaiknya digunakan pengolesan berulang. Sementara pada
Tabel VIII. Hasil Uji Statistik TukeyHSD % Reduksi Udema Jam Ke-24
Sediaan p-value Keterangan
Kontrol positif
Dari penelitian ini menunjukkan hasil yang sedikit bias karena beberapa
formula basis dengan penambahan minyak peppermint juga memiliki kemampuan
untuk mereduksi udema. Dapat dilakukan penelitian lebih lanjut dengan mencoba
penetration enhancer yang berbeda agar didapat hasil yang lebih baik.
Dalam melihat kemampuan emulgel daun salam sebagai antiinflamasi
dapat dilakukan penelitian lebih lanjut dengan metode pengukuran yang berbeda.
selama 4 jam. Pengukuran setiap jam ini dapat memperlihatkan profil penurunan
udema yang terjadi pada setiap jamnya. Profil penurunan ini dapat menunjukkan
42 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian ini maka dapat disimpulkan:
1. Emulgel daun salam formula Fb, Fc, dan Fd mempunyai sifat fisik yang
memenuhi kriteria sediaan yang baik.
2. Emulgel daun salam mempunyai aktivitas antiinflamasi yang berbeda
tidak bermakna dengan Voltaren® yang digunakan sebagai kontrol positif.
3. Penambahan minyak peppermint mempengaruhi penetrasi emulgel ke
dalam kulit, namun kenaikan penambahan konsentrasi tidak berpengaruh.
B. Saran
Berdasarkan penelitian yang dilakukan, perlu dilakukan penelitian tentang:
1. Perlu dilakukan penelitian lebih lanjut untuk mendapatkan penampilan
emulgel yang lebih baik.
2. Perlu dilakukan penelitian lebih lanjut dengan metode pengukuran yang
berbeda untuk melihat profil penurunan udema yang terjadi selama rentang
waktu tertentu.
3. Perlu dilakukan penelitian lebih lanjut menggunakan penetration enhancer
4. Perlu dilakukan penelitian lebih lanjut mengenai absorpsi perkutan
emulgel daun salam secara in vitro untuk melihat kadar senyawa aktif
Daftar Pustaka
Allen Jr., L. V., 2005, The Art, Science, and Technology of Pharmaceutical
Compounding, 2nd ed., American Pharmaceutical Association,
Washington, D.C., pp. 301-324
Badan Pengawasan Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia Vol 1. Jakarta : BPOM.
Becker, J.R., 1997, Crude Oils: Waxes, Emulsions, and Asphaltenes, PenWell Publising Company, Oklahoma, pp. 53-55.
Brooker, C., 2008, Ensiklopedi Keperawatan, Penerbit Buku Kedokteran EGC, Jakarta, pp. 382
Dalimartha, S., 2003, Atlas Tumbuhan Obat Indonesia, Jilid III, Trubus Agriwidya, Jakarta
Direktorat Jendral Pengawasan Obat dan Makanan, 1995, Farmakope Indonesia, Edisi IV, Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan, p. 7.
Direktorat Jendral Pengawasan Obat dan Makanan, 2000, Parameter Standard Umum Ekstrak Tumbuhan Obat, Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan, pp 1-17.
Duffy, T., Belton, O., 2003, Inhibition of PGE2 Production by Inimesulide Ccompared with Diclofenac in the Acutely Inflamed joint of Patients with Arthritis, Drugs 63, pp.2
Ferdinandez, M. K., Anom, I. K., dan Damriyasa, I. M., 2013, Bioaktivitas Ekstrak Daun Tapak Dara (Catharantus roseus) Terhadap Kecepatan Angiogenesis dalam Proses Penyembuhan Luka pada Tikus Wistar, Indonesia Medicus Veterinus, pp. 191-190
Fitzgerald, G. A., and Patrono, C., 2001, The Coxibs, Selective Inhibitors of Cyclooxygenase-2, N Engl. J. Med., Vol.345, pp. 6.
Fox, L.T., Gerber, M., Plessis, J.D., 2011, Transdermal Drug Delivery Enhancement by Compound of Natural Origin, Molecules, pp. 10507-10535
Gunani, S. B., 2009, Uji Daya Antiinflamasi Krim Tipe A/M Ekstrak Etanolik Jahe 10% (Zingiber officinale Roscoe) yang Diberikan Topikal Terhadap Udem Kaki Tikus yang Diinduksi Karagenin, Laporan Penelitian, Surakarta.
Garg, A., Aggrawal, D., Garg, S., dan Singla, A. K,. 2002, Spreading of Semisolid Formulations. Pharmaceutical Technology, pp. 84-105.
Gryglewski, R.J., 1977, Some Experimental Models for the Study of Inflammation and Anti-inflammantory Drugs, in I. L. Bonta, J. Thomson, and K. Brune, Inflammation : Mechanism and Their Impact on Therapy, Birkhaueser Verlag Basel, Rotterdam, pp. 19-21
Haneefa, K.P.M., Easo,S., Mohanta, G.P., 2013, Emulgel : An Advance Review,
Journal of Pharmaceutical Sciences and Research, pp. 254-257
Haryanto, S., 2006, Sehat dan Bugar Secara Alami, Penebar Swadaya, Bogor, p.59
Katzung, Bertram, G., 2001, Farmakologi Dasar dan Klinik, edisi I, Salemba Medika, Jakarta, pp. 677-678
Kharat, N., Shylaja, H., Viswanatha, G. L., Lakshman, K., 2010, Anti-inflammatory and Analgesic Activity of Topical Preparation of Root Extracts of Ichnocarpus frutescens (L.) R. Br, International Journal of Applied Biology and Pharmaceutical Technology, (1), pp 1101.
Lafuente, A. G., Guillamon, E., Villares, A., 2009, Flavonoid as anti-inflammatory agents : implications in cancer and cardiovascular disease,
Inflammation Research, pp. 537-542.
Manurung, D.Y., 2013, Efek Antiinflamasi Infusa Bunga Telang (Clitoria ternatea L.) Pada Udema Telapak Kaki Mencit Betina Terinduksi Karagenin Dengan Pengukuran Jangka Sorong, Skripsi, Universitas Sanata Dharma, Yogyakarta.
Martina, L.T., 2008, Pengaruh Pemberian Ekstrak Daun Salam (Eugenia polyantha) Terhadap Kadar LDL Kolesterol Serum Tikus Jantan Galur Wistar Hiperlipidemia, Artikel Ilmiah, Universitas Diponegoro, Semarang
Middleton E, Kandaswami C, Theoharides TC. 2000. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacological reviews 53, pp. 673-751