3 METODOLOGI 3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April 2011-Juni 2011. Sampel berupa daun tanaman mangrove Api-api (A. marina) diambil dari daerah Belanakan Kabupaten Subang, Jawa Barat. Penelitian bertempat di Laboratorium Karakteristik Bahan Baku, Laboratorium Bioteknologi Hasil Perairan 1, Laboratorium Bioteknologi Hasil Perairan 2, Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan, Laboratorium Proling Departemen Manajemen Sumber Daya Perairan Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Mikroteknik Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Mikrobiologi Terpadu Fakultas Kedokteran Hewan.
3.2 Bahan dan Alat
Bahan utama yang dibutuhkan untuk penelitian ini adalah daun tanaman mangrove Api-api (A. marina). Bahan-bahan yang dibutuhkan untuk analisis proksimat meliputi akuades, kjeltab jenis selenium, larutan H2SO4 p.a. pekat,
asam borat (H3BO3) 4% yang mengandung indikator bromcherosol green-methyl
red (1:2) berwarna merah muda, larutan HCl 0,0947 N, pelarut lemak (n-heksana p.a.), larutan HCl 10% dan larutan AgNO3 0,10 N. Bahan-bahan yang
dibutuhkan untuk analisis histologi daun meliputi daun Api-api, larutan FAA (Formaldehida, Asam asetat glasial dan Alkohol), etanol absolut, TBA (Tertier Butil Alkohol), minyak parafin, parafin, xilol, larutan Gifford, etanol 95%, etanol 70%, etanol 50%, etanol 30%, akuades, safranin 2%, dan fast green 0,5%, aniline blue, entellan. Bahan-bahan yang diperlukan dalam proses ekstraksi dan evaporasi sampel meliputi pelarut methanol (p.a), etil asetat (p.a) dan heksana (p.a). Bahan-bahan yang dibutuhkan untuk uji aktivitas antioksidan, yaitu ekstrak kasar daun Api-api dari 3 jenis pelarut, kristal 1,1-Diphenil-2-picryl hydrazil (DPPH), metanol p.a., BHT (butylated hydroxytoluena) sebagai kontrol positif. Bahan-bahan yang dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner pereaksi Meyer, pereaksi Dragendroff, kloroform, anhidrat asetat, asam sulfat pekat, serbuk magnesium, amil alkohol, air panas, larutan HCl 2 N, etanol 70%,
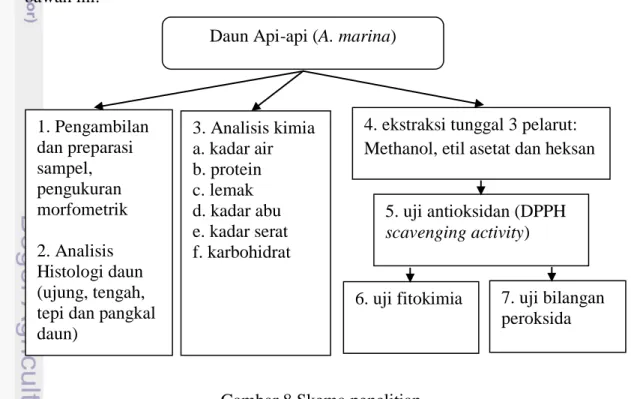
Daun Api-api (A. marina) 1. Pengambilan dan preparasi sampel, pengukuran morfometrik 2. Analisis Histologi daun (ujung, tengah, tepi dan pangkal daun) 3. Analisis kimia a. kadar air b. protein c. lemak d. kadar abu e. kadar serat f. karbohidrat
4. ekstraksi tunggal 3 pelarut: Methanol, etil asetat dan heksan
5. uji antioksidan (DPPH scavenging activity)
6. uji fitokimia 7. uji bilangan peroksida
larutan FeCl3 5%, peraksi Molisch, asam sulfat pekat, pereaksi Benedict, pereaksi
Biuret dan larutan Ninhidrin 0,10%. Bahan-bahan yang dibutuhkan untuk pengujian bilangan peroksida yaitu asam asetat glasial, kloroform, minyak kelapa, kalium iodida, natrium tiosulfat dan indikator pati.
Alat-alat yang diperlukan dalam penelitian ini meliputi jangka sorong, pisau, sudip, cawan porselen, timbangan digital, botol film dan botol kaca kecil, holder, kotak blok, pinset, kuas, oven, mikrotom Yamato RV-240, hot plate, gelas obyek, rak pewarna, mikroskop cahaya Olympus tipe CH20 dan kamera mikroskop Olympus DP12, alumunium foil, gegep, desikator, oven, kompor listrik, tanur pengabuan, kertas saring Whatman 42 bebas abu, kapas bebas lemak, labu lemak, kondensator, tabung Soxhlet, penangas air, labu Kjeldahl, destilator, labu Erlenmeyer, buret, pipet volumetrik, pipet mikro, pipet tetes, gelas ukur, grindmill, orbital shaker, rotary vacuum evaporator, corong kaca, botol gelas, gelas piala, tabung reaksi, spektrofotometer UV-VIS, inkubator dan vortex. 3.3 Metode Penelitian
Rangkaian penelitian ini mengikuti skema yang tertera pada Gambar 8 di bawah ini.
3.3.1 Pengambilan dan preparasi sampel
Sampel daun mangrove api-api diambil di daerah Belanakan, Kabupaten Subang, Jawa Barat. Pengambilan sampel dilakukan dengan mengumpulkan daun mangrove api-api dari beberapa titik pada lokasi tersebut. Daun dimasukkan ke dalam wadah plastik berwarna gelap dan dilakukan identifikasi dan pengukuran morfometrik yang meliputi panjang, lebar dan tebal daun. Sejumlah sampel disimpan dalam wadah tertutup yang berisi larutan etanol 70%, sampel ini akan digunakan untuk analisis histologis.
Daun mangrove api-api kemudian dibagi menjadi dua bagian. Bagian pertama untuk uji kadar air, protein, lemak, abu dan abu tidak larut asam. Bagian kedua dikeringkan dan dipergunakan untuk uji aktivitas antioksidan, bilangan peroksida dan fitokimia.
3.3.2 Analisis proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia yang terkandung dalam suatu bahan, termasuk di dalamnya analisis kadar air, protein, lemak, abu dan abu tidak larut asam.
1) Analisis kadar air (AOAC, 2005)
Prinsip dari analisis kadar air yaitu untuk mengetahui kandungan atau jumlah kadar air yang terdapat dalam suatu bahan. Tahap pertama untuk menganalisis kadar air yaitu mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam. Cawan kemudian diletakkan ke dalam desikator selama kurang lebih 15 menit dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sampel sebanyak 1 gram dimasukkan ke dalam cawan setelah terlebih dahulu dipotong kecil-kecil. Cawan tersebut lalu dimasukkan ke dalam oven dengan suhu 150 oC selama 8 jam atau hingga beratnya konstan. Cawan kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin kemudian ditimbang. Kadar air dihitung dengan menggunakan rumus berikut:
Kehilangan berat (g) = berat sampel awal (g) – berat setelah dikeringkan (g)
% Kadar air (berat basah) =
Kehilangan berat (gram)
X 100 % Berat sampel awal (gram)
2) Analisis kadar lemak (AOAC 2005)
Daun mangrove api-api seberat 2 gram (W1) dimasukkan ke dalam kertas
saring yang telah dibuat menjadi bentuk selongsong (thimble) dan kedua ujungnya ditutup dengan kapas. Sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2). Pelarut lemak
(n-heksan) dituangkan ke dalam labu lemak kemudian labu lemak dihubungkan dengan soxhlet dan direfluks selama 6 jam. Sampel dikeluarkan, labu lemak dan soxhlet dipasang kembali lalu didestilasi hingga pelarut lemak yang ada dalam labu lemak menguap. Setelah itu, labu lemak dan soxhlet diangkat dan pelarut dikeluarkan. Labu lemak dikeringkan dalam oven pada suhu 100 oC selama satu jam. Labu kemudian didinginkan dalam desikator sampai beratnya konstan (W3).
Kadar lemak dapat dihitung dengan rumus berikut: % Kadar lemak =
W3 – W2
X 100 % W1
Keterangan: W1 = Berat sampel (gram)
W2 = Berat labu lemak kosong (gram)
W3 = Berat labu lemak dengan lemak (gram) 3) Analisis kadar protein (AOAC 2005)
Prinsip dari analisis protein yaitu untuk mengetahui kandungan protein kasar (crude protein) pada suatu bahan. Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu dekstruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan dengan metode Kjeldahl.
(a) Tahap destruksi
Daun mangrove api-api ditimbang sebanyak 1 gram kemudian dimasukkan ke dalam labu Kjeldahl. Selenium 0,25 gram dimasukkan ke dalam tabung tersebut dan ditambahkan 3 mL H2SO4 p.a 98%. Tabung yang berisi
larutan tersebut dimasukkan ke dalam alat pemanas dengan suhu 400 oC selama 1 jam. Proses destruksi dilakukan sampai larutan menjadi /jernih/ bening.
(b) Tahap destilasi
Hasil destruksi yang telah dingin selanjutnya diencerkan dengan 50 mL akuades dan 20 mL NaOH 40% lalu didestilasi. Hasil detilasi ditampung dalam labu Erlenmeyer yang berisi campuran 10 mL H3BO3 2% dan 2 tetes indikator
Brom Cresol Green-Methyl Red berwarna merah muda. Setelah volume hasil tampungan (destilat) menjadi 10 mL dan berwarna hijau kebiruan, proses destilasi dihentikan dan selanjutnya destilat ditritasi.
(c) Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0,1 N sampai terjadi perubahan warna menjadi merah (warna asam borat semula). Kadar protein dihitung dengan rumus sebagai berikut:
%N =
(mL HCL A. marina – mL blanko) x N HCl x 14, 007
x 100 % mg contoh x faktor koreksi alat
Keterangan :
% Kadar Protein = %N x faktor konversi (6,25)
4) Analisis kadar abu (AOAC 2005)
Prinsip dari analisis kadar abu yaitu untuk mengetahui jumlah abu yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis. Cawan pengabuan dikeringkan dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel daun sebanyak 1 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api hingga tidak berasap lagi. Cawan tersebut kemudian dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 2 jam. Cawan didinginkan di dalam desikator lalu ditimbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus berikut:
% Kadar abu (berat basah) =
Berat abu (gram)
X 100 % Berat sampel awal (gram)
Keterangan:
Berat abu (g) = berat sampel dan cawan akhir (g) – berat cawan kosong (g)
5) Kadar serat kasar (AOAC 2005)
Serat kasar diukur dengan menguji sebanyak 1 gram sampel dilarutkan dengan 100 H2SO4 1,25%, kemudian dipanaskan hingga mendidih dan
selanjutnya dilanjutkan dengan destruksi selama 30 menit. Hasil destruksi selanjutnya disaring dengan kertas saring dan dengan bantuan corong Buchner.
Residu hasil saringan dibilas dengan 20-30 mL air mendidih dan dengan 24 mL air sebanyak 3 kali.
Residu didestruksi kembali dengan NaOH 1,25 % selama 30 menit, lalu disaring dengan cara yang sama seperti sebelumnya dan dibilas berturut-turut dengan 25 mL H2SO4 1,25% mendidih dan 25 mL air sebanyak tiga kali dan 25
mL alkhohol. Residu dan kertas saring dipindahkan ke cawan porselen dan dikeringkan dalam oven pada suhu 130 oC selama 2 jam. Residu yang sudah dingin bersama cawan porselen ditimbang (A), kemudian dimasukkan ke dalam tanur pada suhu 600 oC selama 30 menit, didinginkan dan ditimbang kembali (B). Bobot serat kasar dihitung dengan persamaan berikut:
% Kadar serat kasar =
Bobot serat kasar (gram)
X 100% Bobot sampel (gram)
Keterangan: Bobot serat kasar = W – Wo
W = bobot residu sebelum dibakar dalam tanur
= A - (bobot kertas saring+cawan) : A : bobot residu + kertas saring + cawan Wo = bobot residu setelah dibakar dalam tanur
= B – (bobot cawan): B : (bobot residu + cawan)
3.3.3 Analisis mikroskopis (Johansen 1940)
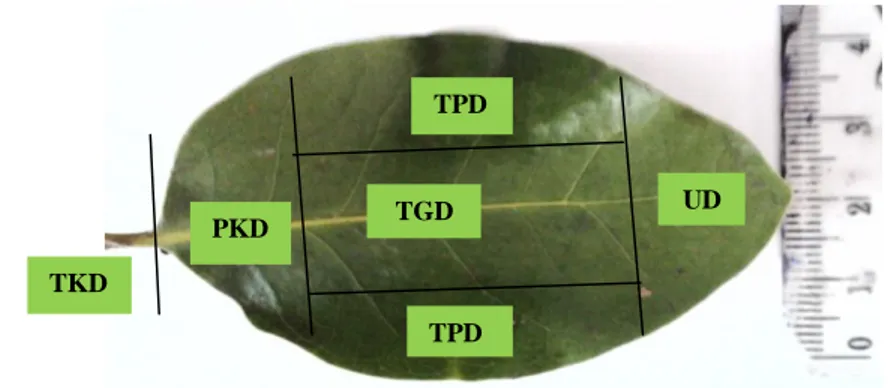
Pengamatan jaringan tanaman diawali dengan pembuatan preparat daun mangrove Api-api (A. marina) kemudian pengambilan gambar objek pada mikroskop. Pembuatan preparat dilakukan dengan metode paraffin. Tahapannya terdiri atas fiksasi, pencucian, dehidrasi dan penjernihan, infiltrasi, penanaman dalam blok, penyayatan, perekatan, dan pewarnaan. Bagian daun mangrove Api-api yang diambil adalah ujung daun, tengah daun, tepi daun, pangkal daun dan tangkai daun (dapat dilihat pada Gambar 9).
Gambar 9 Bagian-bagian daun ( keterangan: TKD = tangkai daun, PKD = pangkal daun, TPD = tepi daun, TGD = tengah daun, UD= ujung daun ) Fiksasi dilakukan selama 5 hari dalam larutan FAA, setelah itu larutan fiksasi dibuang dan sampel dicuci dengan etanol 50% sebanyak 4 kali dengan waktu penggantian masing-masing selama 30 menit. Kemudian dilakukan dehidrasi dan penjernihan secara bertahap melalui perendaman dalam larutan seri Johansen I-VII pada suhu ruang dengan perincian :
1. Johansen I selama 2 jam 2. Johansen II selama 24 jam 3. Johansen III selama 2 jam 4. Johansen IV selama 2 jam 5. Johansen V selama 2 jam
6. Johansen VI (TBA murni) selama 24 jam 7. Johansen VI (TBA murni) selama 2 jam 8. Johansen VI (TBA murni) selama 2 jam 9. Johansen VI (TBA murni) selama 2 jam 10. Johansen VII selama 4 jam
Proses infiltrasi dimulai dari perendaman sampel dalam Johansen VII (TBA : minyak paraffin 1:1) dan 1/3 parafin beku dan disimpan pada suhu kamar selama 4 jam yang dilanjutkan pengovenan pada suhu 58 ˚C selama 18 jam. Kemudian pergantian paraffin dilakukan setiap 5 jam sekali sebanyak 4 kali pergantian. Proses penanaman dilakukan dengan cara sampel dari tahap infilrasi dimasukkan ke dalam blok kotak yang berisi paraffin cair dan disimpan pada suhu ruang hingga benar-benar membeku. Proses penyayatan dilakukan dengan menggunakan mikrotom putar setebal 10 μm. Blok paraffin terlebih dahulu dipotong dan dirapihkan kemudian ditempelkan pada holder lalu disayat. Hasil
TKD PKD D UD TPD TGD TPD
sayatan direkatkan pada gelas obyek yang telah diolesi albumin-gliserin dan ditetesi air. Gelas berisi pita parafin kemudian dipanaskan pada hot plate dengan suhu 45 ºC selama 3-5 jam.
Proses pewarnaan dilakukan dengan safranin 2% dalam air dan fast green 0,5% dalam etanol 95% serta safranin 2% dan aniline blue dalam alkohol 88%. Pewarnaan diawali dengan perendaman gelas obyek ke dalam larutan xilol 1 dan 2 masing-masing selama 15 menit, dilanjutkan perendaman dalam etanol absolut (100%), 95%, 70%, 50%, dan 30% masing-masing selama 3 menit. Setelah itu, obyek dibilas dengan akuades dan dimasukkan ke dalam safranin 2% selama 2 hari. Selanjutnya, gelas obyek dibilas ke dalam akuades dan dimasukkan ke dalam etanol 30%, 50%, 70%, 95%, dan absolut masing-masing selama 3 menit. Kemudian obyek dimasukkan ke dalam pewarna fast green 0,5% selama 10 menit lalu etanol absolut 1 dan 2 selama 3 menit. Gelas obyek kemudian direndam dalam xilol 1 dan xilol 2 selama 10 menit. Pewarnaan dengan aniline blue dilakukan sebagai pengganti fast green. Gelas obyek dimasukkan ke dalam aniline blue + alkohol 88% selama 10 menit, setelah etanol 70%. Kemudian obyek dimasukkan ke dalam etanol 95% + HCl 2 tetes selama beberapa detik dan dilanjutkan ke dalam etanol 95% selama 3 menit, seterusnya.
Proses selanjutnya adalah penutupan dengan pemberian entellan atau Canada balsam pada gelas obyek dan ditutupi dengan gelas penutup. Proses pengambilan gambar dilakukan dengan mikroskop cahaya Olympus CH20 dan kamera digital merek Olympus DP12.
3.3.4 Analisis aktivitas antioksidan
1) Ekstraksi bahan aktif daun mangrove Api-api (Quinn 1988 dalam Darusman et al. 1995, yang telah dimodifikasi)
Tahap ini terdiri dari beberapa langkah, yaitu persiapan sampel dan ekstraksi bahan aktif. Pada tahap persiapan sampel, daun mangrove Api-api yang telah diambil dari daerah Belanakan, Subang segera dikeringkan dengan panas matahari. Daun mangrove api-api yang telah dikeringkan tersebut kemudian dihancurkan dengan Grindmill sehingga didapat serbuk yang halus. Tujuan penghancuran sampel adalah untuk memperluas permukaan sampel yang bersentuhan dengan pelarut, sehingga rendemen ekstrak akan lebih besar.
Tahap selanjutnya adalah ekstraksi. Metode ekstraksi yang digunakan adalah metode ekstraksi tunggal (Quinn 1988 dalam Darusman et al. 1995) yang telah dimodifikasi. Ekstraksi dilakukan dengan 3 jenis pelarut dengan tingkat kepolaran yang berbeda, yaitu methanol p.a (polar), etil asetat p.a (semi polar) dan heksana p.a (non polar).
Sampel daun mangrove Api-api yang telah dihancurkan ditimbang sebanyak 25 gram dan dimaserasi dengan masing-masing pelarut sebanyak 150 mL selama 24 jam. Hasil maserasi yang berupa larutan kemudian disaring dengan kertas saring Whattman 42 sehingga didapat filtrat dan residu. Filtrat yang diperoleh dievaporasi hingga pelarut memisah dengan ekstrak menggunakan rotary vacuum evaporator pada suhu ± 50 oC. Berdasarkan proses ini maka akan diperoleh ekstrak metanol (EM), ekstrak etil asetat (EEA) dan ekstrak heksana (EH).
Ekstrak yang diperoleh selanjutnya dihitung persentase rendemennya dengan rumus:
Rendemen (%) =
Berat ekstrak (g)
X 100% Berat sampel awal (g)
2) Uji aktivitas antioksidan (DPPH) (Blois 1958 dalam Hanani et al. 2005, yang dimodifikasi)
Ekstrak kasar daun mangrove Api-api dari hasil ekstraksi tunggal dengan menggunakan 3 jenis pelarut selanjutnya dilarutkan dalam methanol p.a dengan konsentrasi 50, 100, 150, 200 dan 300 ppm. Larutan DPPH yang akan digunakan dibuat dengan menggunakan kristal DPPH dalam pelarut metanol dengan konsentrasi 1 mM. Hal ini karena metanol dapat melarutkan kristal DPPH (Molyneux 2004) dan lebih bersifat fleksibel, yakni ekstrak yang bersifat semi polar dan non polar pun dapat larut. Menurut Molyneux (2004) mengenai pelarut yang dipakai dalam metode DPPH, uji berkerja dengan baik jika menggunakan metanol atau etanol yang tidak mengganggu jalannya reaksi. Proses pembuatan larutan DPPH 1 mM dilakukan dalam kondisi suhu rendah dan terlindung dari cahaya matahari.
Kontrol positif antioksidan yang digunakan dalam uji ini adalah antioksidan sintetik yaitu Butylated Hydroxy Toluene (BHT). Herawati dan Akhlus (2006) menyatakan bahwa selain memiliki aktifitas yang baik terhadap radikal , BHT juga cukup tahan terhadap proses pemanasan. Konsentrasi BHT yang digunakan dalam uji ini adalah 2 ppm, 4 ppm, 6 ppm dan 8 ppm.
Larutan ekstrak dan larutan antioksidan pembanding BHT yang telah dibuat, masing-masing diambil 4,5 mL dan direaksikan dengan 500 µL larutan DPPH 1 mM dalam tabung reaksi yang berbeda yang telah diberi label. Campuran tersebut kemudian diinkubasi pada suhu 37 oC selama 30 menit dan diukur absorbansinya dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 517 nm. Absorbansi larutan blanko juga diukur untuk menghitung persen inhibisi. Larutan blanko dibuat dengan mereaksikan 4,5 mL pelarut metanol dengan 500 µL larutan DPPH 1 mM dalam tabung reaksi. Larutan blanko dibuat hanya satu kali ulangan saja. Setelah itu, aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding BHT dinyatakan dengan persen inhibisi yang dihitung dengan rumus berikut:
% Inhibisi =
Absorbansi blanko – absorbansi sampel
X 100 % Absorbansi blanko
Nilai konsentrasi sampel (ekstrak maupun antioksidan pembanding BHT) dan persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk persamaan y = a + bx digunakan untuk mencari nilai IC50 (inhibitor concentration 50%) dari
masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan
sampel (ekstrak maupun antioksidan pembanding BHT) yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%.
3.3.5 Uji fitokimia (Harborne 1984)
Pengujian fitokimia dilakukan untuk mengetahui ada tidaknya komponen-komponen bioaktif yang terdapat pada ekstrak kasar daun mangrove Api-api yang memiliki aktivitas antioksidan terbaik. Uji fitokimia meliputi uji alkaloid, uji
steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict, Biuret dan Ninhidrin. Metode uji ini berdasarkan Harborne (1984).
a) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat (H2SO4)
2 N. Pengujian menggunakan tiga pereaksi alkaloid yaitu pereaksi Dragendorff, pereaksi Meyer dan pereaksi Wagner.
Pereaksi Dragendorff dibuat dengan cara 0,8 gram bismutsubnitrat ditambahkan dengan 10 mL asam asetat dan 40 mL air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 mL air. Sebelum dihunakan, 1 volume campuran ini diencerkan dengan 2,3 volume asam asetat glasial dan 100 mL air. Pereaksi ini berwarna jingga.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2
dengan 0,5 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 mL dengan labu takar. Pereaksi ini tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 mL akuades ditambahkan 2,5 gram iodine dan 2 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam labu takar. Pereaksi ini berwarna coklat.
Hasil uji dinyatakan positif bila dengan pereaksi Dragendorff terbentuk endapan merah hingga jingga, endapan putih kekuningan dengan pereaksi Meyer dan endapan coklat dengan pereaksi Wagner.
b) Steroid / triterpenoid
Sejumlah sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Setelah itu ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Reaksi positif ditunjukkan dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c) Flavonoid
Sejumlah sampel ditambahkan 0,1 mg serbuk magnesium dan 0,4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campuran dikocok. Adanya flavonoid ditunjukkan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e) Fenol hidrokuinon (pereaksi FeCl3)
Sampel sebanyak 1 gram diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Adanya senyawa fenol dalam bahan ditunjukkan dengan terbentuknya
warna hijau atau hijau biru. f) Uji Molisch
Larutan sampel sebanyak 1 mL diberi 2 tetes pereaksi Molisch dan 1 mL asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya karbohidrat ditandai dengan terbentuknya kompleks warna ungu diantara 2 lapisan cairan.
g) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 mL pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Adanya gula pereduksi ditunjukkan dengan terbentuknya warna hijau, kuning atau endapan merah bata.
h) Uji Biuret
Sebanyak 1 mL larutan sampel ditambahkan 4 mL pereaksi Biuret. Campuran dikocok dengan seksama. Hasil uji positif adanya peptida ditunjukkan dengan terbentuknya larutan berwarna ungu.
i) Uji Ninhidrin
Larutan sampel sebanyak 2 mL ditambah beberapa tetes larutan ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Reaksi positif terhadap adanya asam amino ditunjukkan dengan larutan berwarna biru.
3.3.6 Evaluasi aktivitas antioksidan (penentuan bilangan peroksida) (Santoso et al. 2004)
Penentuan aktivitas antioksidan dari ekstrak daun mangrove Api-api (ekstrak yang terbaik) diterapkan pada emulsi minyak. Antioksidan berfungsi untuk menghambat pembentukan peroksida pada minyak. Pengujian ini dilakukan
melalui pembuatan minyak kelapa dan sistem emulsinya yang dilanjutkan dengan evaluasi aktivitas antioksidan dengan penentuan bilangan peroksida.
1) Pembuatan minyak kelapa dan sistem emulsinya
Minyak yang digunakan dalam penelitian dibuat dari parutan kelapa yang diperas untuk diambil santan kentalnya. Santan kental tersebut dipanaskan dengan cara direbus untuk memisahkan komponen minyak yang terkandung di dalamnya, kemudian dilakukan penyaringan untuk memisahkan minyak dan ampas parutan kelapa. Filtrat yang dihasilkan kemudian disaring lagi dengan kertas Whatman agar diperoleh minyak kelapa yang bening. Sistem emulsi minyak dibuat dengan mengacu pada metode Santoso et al. (2004) yang dimodifikasi, yaitu dengan menghomogenkan 3% minyak kelapa dan 97% air yang mengandung 0,3% Tween 20.
2) Penentuan bilangan peroksida
Sistem emulsi lemak ditambahkan ekstrak daun mangrove Api-api terbaik dari tahap sebelumnya sebanyak 0 ppm (tanpa penambahan ekstrak), 50 ppm, 100 ppm, 200 ppm dan 300 ppm yang selanjutnya disebut sampel minyak. Sampel minyak selanjutnya disimpan selama tujuh hari dalam inkubator bersuhu 37 oC untuk mempercepat oksidasi. Sampel minyak kemudian ditimbang sebanyak 5 gram di dalam labu erlenmeyer kemudian ditambahkan 30 mL pelarut yang terdiri dari 60% asam asetat glasial dan 40% kloroform. Minyak yang telah larut ditambahkan 0,5 mL larutan KI jenuh dan didiamkan 15 menit dalam ruang gelap sambil dikocok. Iod yang terbentuk dititrasi dengan larutan Na2S2O3 0,01 N
dengan indikator pati 1%. Titrasi dihentikan saat larutan sampel menjadi tidak berwarna. Hasil pengurangan volume akhir terhadap volume awal larutan Na2S2O3 0,01 N yang ditunjukkan oleh skala pada buret merupakan volume total
larutan Na2S2O3 0,01 N yang digunakan untuk titrasi sampel. Cara yang sama
dibuat juga untuk penerapan blanko. Nilai bilangan peroksida dinyatakan dengan miliequivalen per 1 kg minyak atau lemak yaitu dengan rumus:
Miliequivalen/Kg bahan =
(a-b) x N x 1000
x 100% g
Keterangan:
a = jumlah ml larutan Na2S2O3 untuk titrasi sampel
b = jumlah ml larutan Na2S2O3 untuk titrasi blanko
N = normalitas larutan Na2S2O3
g = berat sampel (gram)
3.4 Rancangan Percobaan dan Analisis Data (Steel dan Torrie 1991)
Analisis data dilakukan terhadap hasil pada tahap aplikasi terhadap emulsi minyak. Tahapan aplikasi terhadap emulsi minyak bertujuan untuk menentukan seberapa besar konsentrasi ekstrak terpilih yang mampu menghambat pembentukan peroksida dalam emulsi minyak. Faktor yang digunakan adalah konsentrasi ekstrak dengan lima taraf yaitu 0 ppm, 50 ppm, 100 ppm, 200 ppm dan 300 ppm. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan model:
Yij = µ + αi + Ɛij Keterangan:
Yij = respon pengaruh konsentrasi pada taraf i ulangan ke-j µ = pengaruh rata-rata umum
αi = pengaruh konsentrasi pada taraf i
Ɛij = pengaruh acak (galat percobaan) pada konsentrasi taraf i ulangan ke-j i = 0 ppm, 50 ppm, 100 ppm, 200 ppm dan 300 ppm ( penentuan
konsentrasi ekstrak terpilih )
Hipotesis untuk penentuan konsentrasi ekstrak terpilih:
Ho = Konsentrasi ekstrak tidak mempengaruhi aktivitas antioksidan ekstrak daun mangrove api-api
H1 = Konsentrasi ekstrak mempengaruhi aktivitas antioksidan ekstrak daun
mangrove api-api.
Jika hasil dari pengujian menunjukkan adanya pengaruh yang berbeda nyata pada selang 95% (α=0,05) maka dilakukan uji lanjut Duncan. Rumus uji Duncan adalah:
Keterangan:
Rp = Nilai kritikal untuk perlakuan yang dibandingkan p = Perlakuan
dbs = Derajat bebas
kts = Jumlah kuadrat tengah r = Ulangan