6 BAB II
TINJAUAN PUSTAKA
2.1. Cempaka Kuning (Michelia champaca L.) 2.1.1. Klasifikasi tanaman Kingdom : Plantae Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Magnoliales Famili : Magnoliaceae Genus : Michelia
Spesies : Michelia champaca L.
(Backer and Brink, 1968; Lawrence, 1951).
Nama Daerah
Sumatra: jeumpa (Aceh), jempa (Gayo), Campaga (Minangkabau), cempaka, cempaka kuning (Melayu). Jawa: campaka, campaka koneng (Sunda), kantil, locari, pecari, cempaka, cempaka kuning (Jawa). Nusa Tenggara: campaka, campaka barak, campaka kuning, campaka warangan (Bali), Sawu: hepaka, kepaka (Wijayakusuma, 2000).
2.1.2. Deskripsi tanaman
Cempaka kuning berupa pohon atau tanaman perdu dengan ketinggian 3-6 m. Batang cempaka kuning memiliki bentuk bulat, lurus, kulit batangnya halus berwarna cokelat keabu-abuan, diameter batangnya sampai 180 cm. Daun tersusun spiral, bentuk lanset agak melebar, ukuran sedang dan pada permukaan bawahnya memiliki bulu halus, panjang daun 10-28 cm dan lebarnya 4,5-11 cm. Bunga berbau wangi dan berwarna oranye atau kuning, ukuran agak besar, helaian bunga tersusun dalam untaian yang banyak. Buahnya berwarna cokelat terdiri atas 2-6 biji (Steenis, 1992). Daun, bunga dan kulit batang M. champaca L ditampilkan pada gambar 2.1.
Gambar 2.1 Daun, Bunga dan Kulit Batang M. champaca L (Hutapea, 2001). 2.1.3. Khasiat
Tiap bagian tanaman cempaka kuning mempunyai khasiat berbeda berdasarkan pengobatan empiris. Bunga cempaka kuning digunakan sebagai aroma perawatan rambut. Daunnya memiliki khasiat mengobati perut mulas, batu ginjal dan bau mulut. Kulit kayunya digunakan untuk mengobati demam serta
haid tidak teratur (Widyaningrum, 2011). Kulit batangnya digunakan sebagai obat gastritis, demam, dan batuk (Dwajani and Shanbhag, 2009).
2.1.4. Kandungan kimia dan bioaktivitas M. champaca L.
Bunga M. champaca L. dilaporkan mengandung tanin, flobatanin, saponin, flavonoid, karbohidrat, antrakuinon, polifenol, glikosida. Ekstrak metanol 70% bunga M. champaca L.dilaporkan aktif sebagai antihiperlipid secara
in vivo pada dosis 500 mg/kgBB (Ananthi et al., 2014). Daun M. champaca L. dilaporkan mengandung alkaloid, flavonoid, glikosida, tanin dan sterol (Mullaicharam and Kumar, 2011). Ekstrak etanol daun M. champaca L. dilaporkan aktif sebagai antihiperglikemi secara in vivo pada dosis 200 mg/kgBB (Gupta et al., 2011).
Kulit batang M. champaca L.dilaporkan mengandung senyawa golongan triterpenoid, steroid, dan asam lemak (Chandrashekar et al., 2010). Ekstrak n -heksana, kloroform dan metanol kulit batang M. champaca L. dilaporkan memiliki aktivitas antimalaria yang sangat baik secara in vitro terhadap P. falciparum strain 3D7, dengan IC50 masing-masing sebesar 0,36; 0,24; dan 1,00
µg/mL. Berdasarkan nilai IC50 tersebut, ekstrak kloroform kulit batang M. champaca L. merupakan ekstrak yang paling aktif diantara ketiga ekstrak yang diuji. Hasil skrining kandungan kimia ekstrak kloroform kulit batang M. champaca L. mengindikasikan adanya golongan terpenoid dan flavonoid. Ekstrak metanol kulit batang M. champaca L. mengandung minyak atsiri, flavonoid, triterpenoid dan tanin; ekstrak kloroform mengandung minyak atsiri, flavonoid
dan triterpenoid; ekstrak n-heksana mengandung minyak atsiri dan triterpenoid (Ariantari et al., 2013).
Ekstrak etanol 80% kulit batang M. champaca L. memiliki aktivitas antituberkulosis terhadap M. tuberculosis strain MDR dengan persentase hambatan sebesar 100% pada konsentrasi 100 mg/mL (Astuti, 2012). Fraksi 3 dari hasil fraksinasi ekstrak etanol 80% kulit batang M. champaca L. memiliki aktivitas antituberkulosis terhadap isolat M. tuberculosis strain MDR dengan persentase hambatan sebesar 100% pada konsentrasi 1 mg/mL. Fraksi tersebut mengandung terpenoid dan flavonoid (Dwicandra, 2013). Ekstrak n-heksana, kloroform, metanol kulit batang tanaman ini memiliki aktivitas antituberkulosis, pada konsentrasi 1 mg/mL dengan persentase hambatan masing-masing sebesar 65,41%, 39,85% dan 18,05%, pada konsentrasi konsentrasi 10 mg/mL persentase hambatan masing-masing ekstrak sebesar 100%, 91,73%, 100% dan pada konsentrasi 100 mg/mL ketiga ekstrak tersebut memiliki persentase hambatan sebesar 100%. Rendemen dari ekstrak n-heksana sebesar 0,39%, ekstrak kloroform sebesar 1,33% dan ekstrak metanol sebesar 2,58%. Dari ketiga ekstrak tersebut, ekstrak n-heksana memiliki aktivitas paling besar tetapi rendemen yang dihasilkan paling rendah dan memiliki banyak pengotor. Ekstrak metanol memiliki rendemen paling besar tetapi aktivitas antituberkulosis yang dihasilkan hanya efektif pada konsentrasi tinggi (Yanti, 2014).
2.2. Ekstraksi
Ekstraksi merupakan metode untuk memisahkan senyawa tertentu dari matriks seluler. Prosesnya dimulai sejak pelarut kontak dengan dinding sel tumbuhan. Selama proses ekstraksi, pelarut berdifusi ke bahan tanaman padat dan melarutkan komponen yang memiliki kesamaan polaritas. Setelah itu terjadi proses difusi zat aktif keluar sel dan pengumpulan zat aktif terekstraksi yang disebut sebagai ekstrak (Crowley, 2006; Ncube et al., 2008).
Proses yang terjadi selama ekstraksi dimulai dari kontak pelarut dengan dinding sel tumbuhan, penetrasi pelarut ke dalam sel tumbuhan, pelarutan zat aktif dalam sel, difusi zat aktif ke luar sel, dan pengumpulan zat aktif yang telah terekstraksi (Sticher, 2008). Teknik umum yang digunakan untuk melakukan ekstraksi tanaman obat adalah maserasi, digesti, dan sokletasi (Handa, 2008).
Metode maserasi dilakukan dengan merendam serbuk simplisia dengan pelarut yang sesuai dan ditempatkan dalam wadah tertutup serta dibiarkan pada suhu kamar (Handa, 2008). Proses ekstraksi berhenti ketika terjadi kesetimbangan antara konsentrasi metabolit dalam pelarut dan serbuk simplisia. Keuntungan dari metode ini adalah penggunaan peralatan yang sederhana dan mudah diperoleh serta pengerjaannya yang mudah (Seidel, 2006).
Digesti merupakan bentuk maserasi yang menggunakan pemanasan lemah selama proses ekstraksinya (Bart, 2011). Pemanasan tersebut dapat mengurangi kekentalan pelarut, sehingga lapisan batas pelarut juga akan berkurang, akibatnya kemampuan penyari dalam mengikat senyawa tertentu juga akan meningkat). Efisiensi pelarut dapat meningkat dengan penggunaan metode
ini (Handa, 2008). Metode ini digunakan apabila analit bersifat tahan pada suhu yang cukup tinggi (Crowley, 2006).
Metode sokletasi menggunakan serbuk bahan obat dalam kantong berpori yang terbuat dari kertas filter yang kuat, yang ditempatkan di ruang selongsong dari alat soklet. Ekstraksi berlangsung dalam sistem tertutup dan pelarut terus didaur ulang, sehingga jumlah pelarut yang diperlukan sedikit (Jones and
Kinghorn, 2006).
2.3. Metode Pemisahan Bahan Alam
Produk bahan alam dalam bentuk ekstrak kasar mengandung berbagai kandungan kimia. Sulit untuk menerapkan teknik pemisahan tunggal untuk dapat mengisolasi senyawa tunggal dari campuran kasar tersebut. Hal itu mendasari proses pemisahan produk bahan alam tersebut menjadi beberapa fraksi (Otsuka, 2006). Proses fraksinasi dapat dilakukan melalui metode kromatografi vakum cair dan kromatografi kolom lambat.
2.3.1. Kromatografi vakum cair (KVC)
Pada Kromatografi vakum cair digunakan vakum pada bagian akhir kolom untuk mempercepat laju aliran eluen. Kolom diperbolehkan untuk kering setelah setiap fraksi dikumpulkan (Ried and Sarker, 2006; Sticher, 2007).
Fase diam yang biasanya digunakan dalam metode kromatografi vakum cair antara lain aluminium oksida, silika gel, CN, diol, dan poliamida. Silika gel 60 merupakan fase diam yang umum digunakan. Silika yang digunakan biasanya berukuran 15-40 µm karena silika ini dapat mengalir dengan mudah sehingga
menguntungkan saat pengemasan kolom. Eluen yang populer digunakan dalam KVC adalah heksana dengan peningkatan proporsi etil asetat (Pedersen and
Osenbohm, 2001; Ried and Sarker, 2006; Sticher, 2007; Ghisalberti, 2008). Kolom berdiameter 10-13 cm disiapkan pada corong kaca sinter. Silika gel 60 ditambahkan ke dalam corong dengan ketinggian 6-7 cm sehingga memungkinkan masing-masing pelarut fraksi dapat ditambahkan sekaligus ke permukaan silika dan bukan secara perlahan. Ketukan pada kolom perlu dilakukan agar diperoleh kolom silika yang datar dan padat. Proses pengepakan kolom dilanjutkan dengan penekanan pada permukaan silika dan aplikasi vakum dari bagian bawah corong (Pedersen and Osenbohm, 2001; Ried and Sarker, 2006; Ghisalberti, 2008).
Ukuran sampel dari beberapa milligram hingga 50 g dapat diakomodasi dengan pemilihan ukuran corong yang sesuai. Sampel diaplikasikan dengan seragam pada bagian atas fase diam. Untuk mendapatkan pemisahan yang optimal, sampel diaplikasikan pada kolom dalam lapisan yang setipis mungkin (Pedersen and Osenbohm, 2001; Ghisalberti, 2008).
Pada proses elusi, pelarut untuk fraksi pertama dituangkan pada permukaan kolom yang telah dilapisi kertas saring. Ketika fraksi telah tersedot melalui kolom, kran pada alat diputar dan fraksi pelarut dikumpulkan. Vakum diterapkan kembali dan fraksi pelarut selanjutnya dituangkan ke permukaan kolom. Elusi senyawa dapat dipantau dengan KLT. Rf senyawa yang diinginkan biasanya memiliki nilai 0,5. Pemisahan yang lebih baik dilakukan dengan
penampungan fraksi yang lebih kecil (Pedersen and Osenbohm, 2001; Ghisalberti, 2008).
Keuntungan metode KVC yaitu, teknik ini dapat diterapkan pada pemisahan skala besar (> 10 g campuran senyawa) tanpa kehilangan daya pemisahan. Selain itu, dapat digunakan untuk memisahkan campuran dalam waktu 1-2 jam, tergantung pada jumlah fraksi yang dikumpulkan (Ghisalberti, 2008; Pedersen and Osenbohm, 2001; Ried and Sarker, 2006).
2.3.2. Kromatografi kolom lambat
Kromatografi kolom lambat merupakan metode kolom kromatografi terbuka yang proses pemisahannya berbasis gravitasi (Ghisalberti, 2008). Pada pemisahan dengan metode ini, kolom dikemas dengan fase diam dan sampel diaplikasikan ke bagian atas kolom. Penampungan pelarut terletak di atas fase diam dan pelarut mengalir melalui kolom (Ried and Sarker, 2006). Pemisahan yang berjalan lambat pada metode ini menimbulkan konsekuensi hilangnya analit akibat adsorpsi yang irreversible, terutama dengan silika dan alumina. Fase diam yang banyak digunakan adalah Silika. Akan tetapi terdapat jenis fase diam lainnya yang masih dapat digunakan sesuai dengan senyawa target yang diinginkan. Fase diam tersebut antara lain alumina (Al2O3), fase silika terikat (siano, amino,
hidroksil, nitro), cross-linked dextran (sephadex) dan poliakrilamida.
Proses pemisahan pada metode ini berjalan dengan lambat. Akibatnya terdapat peluang bagi analit untuk teradsorpsi secara irreversibel pada fase tertentu. Sulitnya pengemasan kolom, banyaknya pelarut yang diperlukan, serta sulitnya perolehan kembali pelarut membuat metode ini sering dijadikan sebagai
pilihan nomor kedua (Ried and Sarker, 2006; Ghisalberti, 2008). Metode ini memiliki reproduktivitas rendah akibat sulitnya pengemasan kolom serta membutuhkan pelarut dalam jumlah besar (Ghisalberti, 2008).
2.4. Kromatografi Lapis Tipis (KLT)
KLT merupakan bentuk kromatografi planar. Fase diam pada KLT berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, plat aluminium atau plat plastik. Fase diam yang umum digunakan adalah silika atau serbuk selulosa (Gandjar dan Rohman, 2007). Fase gerak yang digunakan pada KLT memiliki beberapa persyaratan, yaitu tidak mempengaruhi atau tidak melarutkan fase diam serta tidak menimbulkan transformasi pada analit yang ingin dipisahkan.
Pemilihan fase gerak tidak hanya tergantung pada sifat adsorben dan aktivitasnya, tetapi juga pada struktur dan jenis analit yang dipisahkan (Hahn-Deinsotrop, 2007). Pemilihan fase gerak KLT didasarkan pada keterpisahan senyawa-senyawa dalam analit yang didasarkan pada nilai Rf atau hRf (100 Rf).
Nilai Rf diperoleh dari membagi jarak pusat kromatografik dari titik awal dengan
jarak pergerakan pelarut dari titik awal. Pemilihan fase gerak juga dapat dilakukan dengan melihat tingkat keterpisahan 2 senyawa dalam sampel yang dinyatakan dengan nilai resolusi. Nilai resolusi (Rs) diperoleh dari selisih jarak 2 pusat noda
Menurut Reich and Blatter (2003), fase gerak atau sistem pelarut yang umum digunakan penapisan kandungan kimia yang terdapat pada tumbuhan ditampilkan pada Tabel 2.1.
Tabel. 2.1 Sistem Pelarut yang Digunakan dalam Penentuan Profil Kandungan Kimia Tumbuhan (Reich and Blatter, 2003; Hajnos et al., 2008)
Golongan Kandungan
Kimia Tumbuhan Sistem Pelarut atau Fase Gerak
Alkaloid Toluen, etil asetat, dietil amin atau amonia (70:20:10 v/v)
Purin Etil asetat, metanol, air (100:13,5:10 v/v)
Derivat Antrasena Etil asetat, metanol, air (100:13,5:10 v/v) atau n-propanol, etil asetat air, asam asetat (40:40:29:1 v/v)
Minyak atsiri Etil asetat atau metanol dan toluen atau heksan pada berbagai konsentrasi, atau diklorometan
Flavonoid Etil asetat, asam formiat, asam asetat, air (100:11:11:26 v/v)
atau kloroform, metanol (15:1, 3:1 v/v) Arbutin, Derivat
Hidrokuinon
Etil asetat, metanol, air (100:13,5:10 v/v) Asam formiat, air, etil asetat (6:6:88 v/v) Saponin
Kloroform, metanol, air (70:30:4 v/v)
Asam asetat, air, 1-butanol (10:40:50 v/v) atau amonia, air, etanol, etil asetat (1:9:25:65 v/v) atau etil asetat, air, 1-butanol (25:50:100 v/v)
Tanin
Asam formiat, air dan eti asetat pada berbagai konsentrasi, dengan atau tanpa asam asetat, atau etil asetat, toluen (2:98 v/v) atau asam asetat, eter, heksan, etil asetat (20:20:20:40 v/v) Karbohidrat Air, asetonitril (10:85 v/v) atau natrium dihidrogen fosfat
1,6%, 1-butanol, aseton (10:40:50 v/v)
Asam Amino 1-butanol, air, asam asetat, asam formiat (28:8:9:2 v/v)
Umumnya, jika fase diam bersifat polar, fase gerak harus bersifat non polar atau sedikit polar (sistem fase normal). Apabila fase diam bersifat non polar, fase geraknya harus bersifat polar dan sistem kromatografi ini disebut sistem fase balik. Ketebalan fase diam yang digunakan pada KLT biasanya berukuran 0,25 mm untuk tujuan analitik, dan 0,75-2 mm untuk tujuan preparatif. Fase diam yang digunakan dalam penapisan kandungan kimia ditampilkan pada Tabel 2.2.
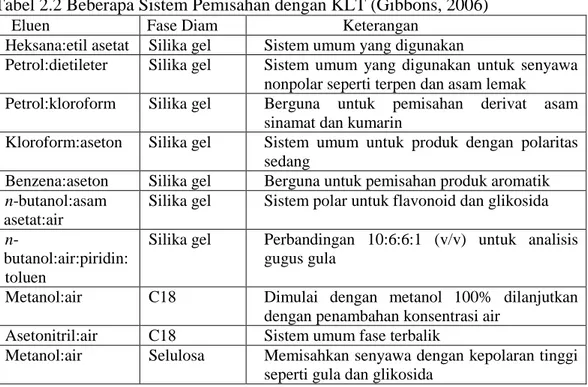
Tabel 2.2 Beberapa Sistem Pemisahan dengan KLT (Gibbons, 2006)
Eluen Fase Diam Keterangan
Heksana:etil asetat Silika gel Sistem umum yang digunakan
Petrol:dietileter Silika gel Sistem umum yang digunakan untuk senyawa nonpolar seperti terpen dan asam lemak
Petrol:kloroform Silika gel Berguna untuk pemisahan derivat asam
sinamat dan kumarin
Kloroform:aseton Silika gel Sistem umum untuk produk dengan polaritas sedang
Benzena:aseton Silika gel Berguna untuk pemisahan produk aromatik
n-butanol:asam asetat:air
Silika gel Sistem polar untuk flavonoid dan glikosida
n
-butanol:air:piridin: toluen
Silika gel Perbandingan 10:6:6:1 (v/v) untuk analisis gugus gula
Metanol:air C18 Dimulai dengan metanol 100% dilanjutkan
dengan penambahan konsentrasi air
Asetonitril:air C18 Sistem umum fase terbalik
Metanol:air Selulosa Memisahkan senyawa dengan kepolaran tinggi
seperti gula dan glikosida
Salah satu poin penting analisis dengan KLT adalah identifikasi golongan-golongan kandungan kimia tumbuhan dengan pemilihan pereaksi warna spesifik atau non-spesifik yang sesuai setelah proses kromatografi (Reich and
Blatter, 2003). Pendeteksi yang digunakan adalah lampu UV254 atau UV366 dan
Tabel. 2.3 Beberapa Jenis Pereaksi Semprot untuk Deteksi Senyawa Bahan Alam pada Plat KLT (Gibbons, 2006; Harborne, 2006; Jones and Kinghorn, 2006).
Golongan
Senyawa Jenis Pereaksi Pendeteksi Hasil Positif Setelah Dideteksi
Terpen
Vanillin asam sulfat Warna merah atau biru
Anisaldehid asam sulfat Warna merah-ungu
Asam fosfomolibdat Warna biru dengan latar belakang
kuning
Diterpen Amonium molibdat (VI) Warna biru
Diterpen dan
triterpen Antimoni (III) klorida Warna merah atau biru
Alkaloid Reagen dragendroff Oranye gelap hingga
Oranye kecoklatan Gugus aldehid
dan keton 2,4 DNP Kuning hingga merah
Gugus
karbonil Uap amonia Fluorosensi terang pada 365 nm
Alkaloid Ninhidrin Merah
Flavonoid
Uap amonia
Fluorosensi kuning, hijau-kuning, hijau-biru, lembayung gelap, biru muda, merah, jingga, biru muda, murup biru muda, kuning, jingga, merah, atau biru pada UV366
Uap amonia
Kuning murup, kuning, hitam redup, hijau-kuning, jerau, jingga, merah, hijau-kuning muda, lembayung lemah, atau kuning lemah
2.5. Metabolit Sekunder Tanaman Sebagai Antituberkulosis
Aktivitas antituberkulosis beberapa senyawa dari bahan alam telah diuji. Sebagian besar senyawa tersebut merupakan metabolit sekunder tanaman diantaranya golongan terpenoid, flavonoid.
2.5.1. Golongan terpenoid
Seskuiterpen longifolene dan diterpen totarol dari Juniperus communis
(Cuppressaceae) dilaporkan memiliki aktivitas antituberkulosis terhadap M. tuberculosis H37Rv dengan MIC berturut-turut sebesar 73,7 dan 38,4 µg/mL (Gordien et al., 2009). Senyawa terpenoid asam bonianat A dan asam bonianat B yang diisolasi dari daun dan ranting Radermachera bonianathe (Bignoniaceae) memiliki aktivitas antituberkulosis terhadap M. tuberculosis H37Rv dengan MIC berturut-turut sebesar 34,8 dan 9,9 μM (Truong et al., 2011).
Seskuiterpen lakton partenolida dan costunolida dari Magnolia grandiflora dan Magnolia virginiana (Magnoliaceae) dilaporkan memiliki aktivitas antituberkulosis terhadap M. tuberculosis H37Rv dengan MIC berturut-turut sebesar 16 dan 32 µg/mL (Fischer et al., 1998). Triterpen asam oleanolat dari tanaman Celaenodendron mexicanum (Euphorbiaceae) memiliki aktivitas hambatan terhadap M. tuberculosis H37Rv dengan MIC sebesar 25 μg/mL (Camacho-Corona et al., 2009). Senyawa triterpenoid yang berasal dari ekstrak metanol kulit batang S. mombin L. dilaporkan memiliki aktivitas sebagai antituberkulosis (Olugbuyiro et al., 2009).
Beberapa pengujian juga menduga golongan triterpenoid bertanggung jawab terhadap aktivitas antituberkulosis, antara lain senyawa golongan triterpenoid dari Spondias mombin L., Lantana hispidia dan Terminalia avicennioides (Jimenez-Arellanes et al., 2007; Olugbuyiro et al. 2009; Mann et al., 2011). Mekanisme kerja golongan triterpenoid terhadap bakteri belum diketahui, tetapi diduga melibatkan perusakan membran sel bakteri oleh
komponen lipofil. Selain itu, juga diduga mekanisme kerja triterpenoid terhadap
M. tuberculosis bergantung pada lipofilitasnya yang akan mempercepat penetrasi di dinding sel M. tuberculosis yang kaya akan lipid (Cowan, 1999; Jimenez-Arellanes et al., 2007).
2.5.2. Golongan flavonoid
Senyawa golongan isoflavon, yaitu isovestinol yang diisolasi dari
Sesbania grandiflora terbukti memiliki aktivitas antituberkulosis terhadap
Mycobacterium tuberculosis H37Rv dengan MIC sebesar 50 μg/mL (Hasan et al.,
2012). Senyawa golongan flavonol, yaitu laburnetin yang diisolasi dari Ficus chlamydocarpa dan Ficus cordata menunjukkan aktivitas antituberkulosis dengan nilai MIC 4,88 μg/mL (Kuete, 2008). Senyawa golongan flavanon yang diisolasi dari tanaman Chromolaena odorata, yaitu 5,7-dihidroksi-4′-metoksiflavanon terbukti memiliki aktivitas antituberkulosis dengan nilai MIC 174,8 µM (Suksamrarn et al., 2004). Brown et al. (2007), melaporkan flavonoid butein, isoliquiritigenin, 2,2’,4’-trihidroksichalkon dan fisetin memiliki aktivitas antituberkulosis dengan mekanisme kerja menghambat biosintesis asam lemak dan asam mikolat bakteri.
Flavonoid dehidrolupinifolinol, flemichin D, eriosemaon A dan lupinifolin merupakan senyawa golongan flavonoid yang berasal dari Eriosema chinense Vogel (Leguminosae-Papilionoideae), memiliki aktivitas sebagai antituberkulosis terhadap M. tuberculosis H37Ra, dengan nilai MIC sebesar 12,5 µg/mL (Sutthivaiyakit et al., 2009). Kombinasi flavonoid 5,7-dihidroksi-6,8-di-C-metilflavanon dan 2’,4’-dihidroksi-3’,5’-dimetil-6’-metoksikalkon dengan
perbandingan 2:8 memiliki aktivitas hambatan terhadap M. tuberculosis H37Rv dengan MIC sebesar 7,8 µg/mL. Kedua flavonoid tersebut diperoleh dari ekstrak etil asetat buah Campomanesia adamantium (Myrtaceae) (Pavan et al., 2009).
2.6. Tuberkulosis
Tuberkulosis adalah penyakit infeksi menular pada sistem pernapasan yang disebabkan oleh M. tuberculosis yang dapat mengenai bagian paru-paru. Proses penularan tuberkulosis dapat melalui udara atau kontak langsung saat batuk (Hidayat, 2008). Gejala tuberkulosis meliputi batuk kronis, demam, berkeringat waktu malam, keluhan pernapasan, hilang nafsu makan, berat badan turun dan rasa nyeri di bagian dada (Tjay dan Rahardja, 2007).
2.6.1. Etiologi
Tuberkulosis disebabkan oleh kompleks M. tuberculosis yang terdiri atas
M. tuberculosis, M. bovis, M. africanum, M. microti, dan M. canettii.
Mycobacterium tuberculosis merupakan agen yang paling penting dan sering menyebabkan penyakit pada manusia. M. tuberculosis adalah bakteri obligat aerob. Mycobacterium tuberculosis umumnya disebarkan dari penderita tuberkulosis positif melalui droplet-droplet yang dikeluarkan ketika batuk, bersin atau bicara. Droplet-droplet ini mengering dengan cepat dan dapat bertahan di udara selama beberapa jam dan dapat terhirup ke dalam saluran pernapasan (Raviglione and O’Brien, 2004).
2.6.2. Epidemiologi
Pada tahun 2012, di dunia terdapat 8,6 juta kasus tuberkulosis dengan angka kematian sebesar 1,3 juta orang. Menurut laporan WHO tahun 2013, Indonesia menempati urutan ke tiga jumlah kasus tuberkulosis setelah India dan Cina dengan jumlah sebesar 700.000 kasus. Angka kematian masih sama dengan tahun 2011 sebesar 27 per 100.000 penduduk, tetapi angka insidennya turun menjadi 185 per 100.000 penduduk di tahun 2012 (WHO, 2013).
2.6.3. Mycobacterium tuberculosis
Mycobacterium tuberculosis merupakan bakteri bentuk basil dengan panjang antara 1-4 mikron dan terlihat lurus atau sedikit melengkung pada pengamatan di bawah mikroskop. Bakteri ini tidak memberikan hasil yang baik pada pewarnaan Gram, sehingga teknik pewarnaan yang biasanya dilakukan adalah dengan teknik pewarnaan Ziehl-Neelsen (ZN) atau dapat juga dengan noda
fluorochrome.
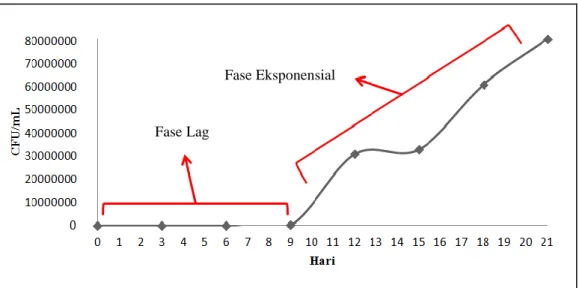
Bakteri ini disebut bakteri tahan asam karena tidak dapat didekolorisasi oleh asam dan alkohol. Mikobakteria cenderung lebih resisten terhadap agen kimia daripada bakteri lain karena bersifat hidrofobik pada permukaan selnya. Mikobakteria kaya akan lipid termasuk asam mikolat (asam lemak rantai panjang C78-C90). Basil tuberkel resisten terhadap kekeringan dan bertahan hidup selama periode waktu yang lama pada sputum kering (Brooks, 2005; Peloquen, 2005). Grafik pertumbuhan M. tuberculosis ditampilkan pada gambar 2.3. Tampak pada gambar 2.3 bakteri ini masih mengalami fase lag hingga hari ke-9. Fase lag merupakan fase dimana bakteri sedang menyesuaikan diri pada lingkungan yang
baru dan mengumpulkan nutrisi untuk tumbuh. Pada fase ini M. tuberculosis
mengalami peningkatan ukuran sel. Lama fase lag M. tuberculosis berbeda-beda sesuai dengan media dan lingkungan tumbuh yang digunakan bakteri tersebut. Lama fase lag yang dialami M. tuberculosis dapat berlangsung selama 2-9 hari (Cardona, 2006; Urquides et al., 2013).
Bakteri ini mampu tumbuh secara in vitro di dalam sistem biakan bebas sel pada suhu 35-37oC. Mycobacerium tuberculosis tidak menghasilkan spora, berbentuk basilus dengan dinding yang banyak mengandung lipid dan tidak bergerak (Smith, 2003).
Gambar 2.2 Grafik pertumbuhan M. tuberculosis selama 21 hari yang terdiri atas fase lag dan fase eksponensial (Urquides et al., 2013).
2.7. Metode Uji Aktivitas Antituberkulosis
Pengujian aktivitas antituberkulosis dapat dilakukan dengan beberapa metode diantaranya: metode BMM, metode MABA dan metode proporsi.
Fase Lag
2.7.1. Metode BMM (Broth Microdilution Method)
Metode ini menggunakan media Middlebrook 7H9/ADC sebagai media pertumbuhan bakteri uji. Inkubasi dilakukan selama 4-6 minggu pada suhu 37°C. Untuk melihat aktivitas penghambatan senyawa yang diuji sebagai antituberkulosis terhadap M. tuberculosis, dilakukan dengan menghitung optical density menggunakan Beckman Coulter (Egharevba et al., 2010).
2.7.2. Metode MABA (Microplate Alamar Blue Assay)
Metode ini menggunakan Alamar Blue sebagai media pertumbuhan mikobakterium. Dibutuhkan waktu 4-6 minggu dan suhu 37°C untuk inkubasi. Aktivitas penghambatan senyawa yang diuji sebagai antituberkulosis terhadap M. tuberculosis, dilakukan dengan metode fluoresensi menggunakan alat Cytoflour II Microplate Flourometer dengan panjang gelombang eksitasi 530 nm dan panjang gelombang emisi 590 nm. Intensitas flouresensi berbanding lurus dengan jumlah koloni bakteri yang hidup (Olugbuyiro et al., 2009).
2.7.3. Metode proporsi
Metode proporsi dapat dilakukan pada media agar Lowenstein-Jensen (L-J) atau media agar Middlebrook (Bwanga, 2010). Media ditempatkan pada botol steril McCartney (Ladda and Magdum, 2012). Inkubasi dilakukan selama 4-6 minggu pada suhu 370C. Untuk melihat aktivitas penghambatan senyawa yang diuji sebagai antituberkulosis, dilakukan dengan menghitung secara manual jumlah Colony Forming Unit (CFU) pada media yang diberi perlakuan dibandingkan terhadap media kontrol (Gupta et al., 2010).