BAB II
TINJAUAN PUSTAKA
2.1 Kontaminasi Logam Kadmium (Cd)
Kadmium dapat ditemukan dalam jumlah yang relatif sedikit. Namun demikian, tingkat toksisitas kadmium sangat tinggi karena termasuk dalam logam berat. Seluruh logam berat muncul secara alami di lingkungan yang dihasilkan dari buangan industri dengan jumlah yang makin hari makin meningkat. Logam yang
mempunyai kontribusi toksisitas di dalam air salah satunya adalah kadmium [3]. Sumber dari logam berat kadmium dalam air, baik yang berupa larutan maupun padatan sering ditemukan di balik batu, ditemukan dalam bentuk sulfida yang berasal dari limbah/buangan industri yang terkontaminasi, kegiatan pertambangan yang buruk, dan kebocoran pada kolam penampungan limbah [10].
2.2 Logam Kadmium (Cd)
Kadmium (Cd) adalah salah satu logam transisi dan terletak di golongan 2B dan periode ke 5 di tabel periodik. Nomor atom Cd adalah 48, berat atom 112,40 dengan densitas 8,65 g.cm-3. Titik cair Cd adalah 320,9oC dan titik didih 765oC. Kadmium (Cd) sangat digunakan di dalam Ni/Cd baterai, sebagai pigmen dan stabilizer plastik, campuran logam dan komponen elektronik [11].
Kadmium (Cd) sukar didegradasi oleh mikroorganisme air sehingga kadmium (Cd) dapat masuk melalui jaringan tanaman. Kadmium akan terlarut dan sebagian lagi akan meresap ke dalam tanah dan ada juga yang masuk ke metabolisme tanaman dan akan terakumulasi pada semua jaringan [12].
Kadmium (Cd) tercemar dilingkungan akibat dari hasil pembangkit listrik, sistem pemanas, industri logam, insinerator limbah, lalu lintas perkotaan, pabrik semen dan pabrik pupuk fosfat [13].
Konsumsi logam kadmium telah meningkat terus-menerus selama abad kedua puluh ini ke seluruh dunia dengan pasokan 22.000 metriks ton [14].
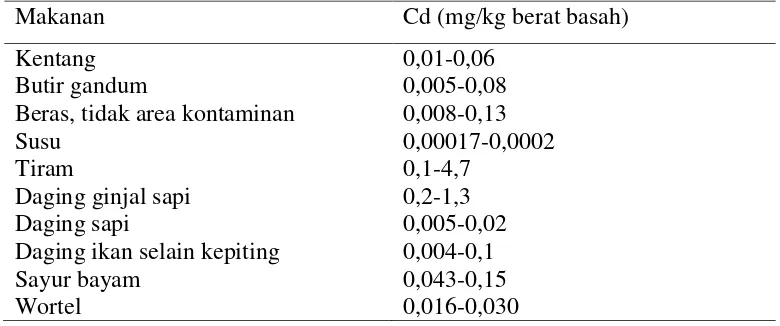
Tabel 2.1 Konsentrasi Kadmium (Nilai Rata-Rata) Dalam Berbagai Jenis Makanan
Makanan Cd (mg/kg berat basah)
Kentang 0,01-0,06
Butir gandum 0,005-0,08
Beras, tidak area kontaminan 0,008-0,13
Susu 0,00017-0,0002
Tiram 0,1-4,7
Daging ginjal sapi 0,2-1,3
Daging sapi 0,005-0,02
Daging ikan selain kepiting 0,004-0,1
Sayur bayam 0,043-0,15
Wortel 0,016-0,030
Sumber: WHO, 2000
Efek dari kontaminasi logam berat di tanah dan di air cukup mengkhawatirkan dan dapat menyebabkan gangguan besar dalam keseimbangan ekologi dan kesehatan makhluk hidup di bumi [15]. Paparan berlebihan terhadap Cd dapat menyebabkan berbagai penyakit pada manusia, termasuk gastroenteritis, disfungsi tubulus ginjal, hipertensi, penyakit jantung, emfisema paru, kanker, dan osteoporosis [16].
Sesuai dengan ketentuan Standar Nasional Indonesia [17], bahwa kandungan logam berat kadmium (Cd) maksimum di dalam produk pangan adalah 0,2 mg/kg, sedangkan menurut Peraturan Menteri Kesehatan [18] Nomor: 492/ Menkes/ Per/ IV/ 2010, menyatakan bahwa persyaratan kualitas air minum yang baik hanya mengizinkan kandungan logam berat kadmium (Cd) maksimum adalah 0,003 mg/l.
2.3 Jagung
Tanaman jagung termasuk dalam keluarga rumput-rumputan. Secara umum, klasifikasi dan sistematika tanaman jagung [19] sebagai berikut:
Jagung merupakan salah satu bahan pangan yang penting di Indonesia karena jagung merupakan sumber karbohidrat kedua setelah beras [20].
Akhir-akhir ini tanaman jagung semakin meningkat penggunaannya. Tanaman jagung banyak sekali gunanya, sebab hampir seluruh bagian tanaman dapat dimanfaatkan untuk berbagai macam keperluan [21], antara lain:
a) Batang dan daun muda: pakan ternak
b) Batang dan daun tua (setelah panen): pupuk hijau atau kompos c) Batang dan daun kering: kayu bakar
d) Batang jagung: pulp (bahan kertas)
e) Buah jagung muda (putren, Jw): sayuran, bergedel, bakwan, sambel goreng f) Biji jagung tua: pengganti nasi, marning, brondong, roti jagung, tepung,
bihun, bahan campuran kopi bubuk, biskuit, kue kering, pakan ternak, bahan baku industri bir, industri farmasi, dextrin, perekat, industri tekstile.
Batang jagung tidak bercabang, berbentuk silinder, dan terdiri dari beberapa ruas dan buku ruas. Pada buku ruas akan muncul tunas yang berkembang menjadi
tongkol. Tinggi batang jagung tergantung varietas dan tempat penanamannya, umumnya berkisar 60-300 cm [22].
Jagung memiliki kadar protein lebih tinggi (9,5%) dibandingkan dengan beras (7,4%). Jagung juga mengandung karoten berkisar antara 6,4-11,3 µg/g, 22% diantaranya beta-karoten dan 51% xantofil. Beta-karoten memiliki aktivitas provitamin A yang dapat memberikan perlindungan terhadap kebutaan khususnya disebabkan oleh katarak dengan menjadi filter terhadap sinar UV. Xanthofil memiliki fungsi meregulasi perkembangan sel dan melindungi sel normal dari sel mutan pemicu penyebab kanker, menangkal radikal bebas yang dapat merusak jaringan tubuh, sistem imunitas tubuh terhadap serangan infeksi dengan meningkatkan komunikasi antar sel, dan mencegah penyakit jantung [23].
2.4 Adsorpsi
Adsorpsi merupakan suatu metode penyerapan fluida. Adsorpsi dapat terjadi karena gaya tarik-menarik secara elektrostatis maupun gaya tarik-menarik yang diperbesar dengan ikatan koordinasi hidrogen atau ikatan Van Der Waals [24].
tipe Van der Waals. Energi yang berasosiasi dengan ikatan tersebut relatif lemah. Sebaliknya dalam adsorpsi kimia ikatan sangat berperan dan merupakan resultan dari suatu transfer atau penempatan elektron dalam reaksi antara adsorbat dan adsorben [25].
Suatu zat dapat digunakan sebagai adsorben untuk tujuan pemisahan apabila mempunyai daya adsorpsi yang selektif, dengan luas permukaan per satuan massa yang besar, serta memiliki daya ikat yang kuat terhadap zat yang hendak dipisahkan secara fisik atau kimia [26].
2.4.1 Faktor-Faktor Yang Mempengaruhi Adsorpsi
Dalam proses adsorpsi, ada beberapa faktor yang mempengaruhi adsorpsi secara umum [27], antara lain adalah:
a) Diameter partikel adsorben
Tiap jenis adsorben mempunyai karakteristik tersendiri. Adsorben yang baik
untuk mengadsorpsi zat yang satu belum tentu baik untuk mengadsorpsi zat yang lain. Semakin kecil diameter partikel adsorben, maka laju adsorpsi akan semakin
meningkat sehingga proses adsorpsi berlangsung lebih efektif. Hal ini disebabkan karena semakin kecil diameter partikel, lintasan yang ditempuh oleh adsorbat dalam berdifusi ke pori-pori adsorben lebih pendek.
b) Adsorbat
Adsorbat dapat berupa zat elektrolit maupun zat non elektrolit. Untuk zat elektrolit adsorpsinya besar, karena mudah mengionisasi sehingga antara molekulnya saling tarik-menarik. Untuk zat non elektrolit adsorpsinya kecil karena tidak mengalami ionisasi.
c) Luas permukaan
Semakin luas permukaan adsorben, maka adsorpsi yang terjadi akan semakin besar sebab kemungkinan adsorbat untuk diadsorpsi juga semakin besar. Jadi semakin halus suatu adsorben maka adsorpsinya akan semakin besar.
d) Konsentrasi
e) Temperatur
Jika temperatur dinaikkan molekul adsorbat akan bergerak lebih cepat sehinnga kemungkinan untuk menangkap atau mengadsorpsi molekul-molekul akan semakin sulit, akibatnya jumlah adsorbat yang teradsorpsi akan sedikit.
f) Kecepatan Pengadukan
Semakin besar kecepatan pengadukan, maka laju adsorpsi akan semakin meningkat. Hal ini disebabkan karena semakin besar kecepatan pengadukan, semakin bertambah kesempatan kontak antara adsorbat dengan adsorben sehingga adsorpsi dapat berlangsung lebih efektif.
g) Kelarutan adsorbat (solubity of adsorbate)
Semakin kecil kelarutan adsorbat, maka laju adsorpsi akan semakin meningkat. Hal ini disebabkan karena semakin kecil kelarutan adsorbat, semakin mudah adsorbat untuk berpindah dari fasa cairan menuju ke fasa padatan
(adsorben).
h) pH
Pengaruh pH terhadap laju adsorpsi dipengaruhi oleh jenis adsorbat. Laju adsorpsi meningkat pada kondisi pH yang menyebabkan penurunan kelarutan adsorbat dalam cairan.
i) Waktu kontak
Untuk mencapai kesetimbangan adsorpsi dan memaksimalkan efisiensi adsorpsi maka diperlukan waktu kontak yang cukup antara adsorbat dengan adsorben.
2.4.2 Pengukuran Adsorpsi
Adsorpsi suatu larutan dapat diukur melalui mekanismenya. Tujuan pengukuran ini adalah untuk mendapatkan data penting yang selanjutnya dapat digunakan untuk mengukur kinetika dan kesetimbangan adsorpsi [28].
Jumlah logam teradsorpsi per satuan massa adsorben pada kesetimbangan , dan persentasi penghapusan pada waktu t, dapat dihitung dengan menggunakan persamaan berikut ini :
(2.1)
(2.2) [29], [30]
Keterangan:
qe = massa logam teradsorpsi pada kesetimbangan (mg/g)
R% = Persentasi penghapusan logam (%)
C0 = konsentrasi logam awal (mg/L)
Ce = konsentrasi kesetimbangan (mg/L)
V= volume larutan (L)
mads= massa adsorben (g)
Persamaan-persamaan ini mengasumsikan bahwa perubahan volume fase cair massa diabaikan karena konsentrasi zat terlarut kecil dan volume yang ditempati oleh adsorben juga kecil [28]. Jumlah logam berat teradsorpsi pada sampel dihitung dengan menggunakan alat AAS (Atomic Absorption Spectrophotometer) untuk mendapatkan data analisis yang akurat dan tepat.
2.4.3 Kinetika Adsorpsi
Kinetika adsorpsi dapat memberikan informasi tambahan mengenai efisiensi adsorpsi dan mekanismenya. Pada tingkat penyerapan zat terlarut dalam adsorben dapat menentukan waktu yang dibutuhkan untuk reaksi adsorpsi dan itu juga dapat diperoleh dari analisis kinetiknya. Kinetika adsorpsi ini diperoleh secara empiris dengan menggunakan model pseudo orde satu, pseudo orde dua dan intra-partikel model difusi [31].
2.4.3.1Model Pseudo Orde Satu
Model pseudo orde satu dijelaskan oleh Lagergen merupakan model yang paling
banyak digunakan untuk mengevaluasi kinetika adsorpsi berdasarkan kapasitas solid (Yang, et al., 2015). Persamaannya dapat dijelaskan sebagai berikut:
ln(qe– qt) = ln qe– k1t (2.3)
[24], [32] Keterangan:
qe = massa logam teradsorpsi pada kesetimbangan (mg/g)
qt = massa logam teradsorpsi pada waktu t (mg/g)
t = waktu adsorpsi (min) 2.4.3.2Model Pseudo Orde Dua
Persamaan pseudo orde kedua adalah model lain dari kinetika adsorpsi yang dikembangkan oleh Ho dan McKay [30]. Persamaannya dinyatakan sebagai berikut:
(2.4)
[24], [32], [33]
Dimana k2 merupakan tetapan laju adsorpsi pseudo orde dua (g/mg.min).
2.4.3.3Intra-Partikel Model Difusi
Intra-partikel model difusi, diusulkan oleh weber dan Morris, yang mengasumsikan bahwa mekanisme adsorpsi terjadi melalui difusi molekul adsorbat ke dalam pori-pori bahan penyerap atau adsorben [32]. Persamaannya dinyatakan sebagai berikut:
qt = Kid.t0,5 + C (2.5)
[33]
Dimana Kid adalah konstanta laju intra-partikel difusi model difusi, nilai C dan
Kid dapat ditentukan dari intersep dan garis kemiringan linear yang diplot dari qt
terhadap t0,5 masing-masing.
2.4.4 Isotermal Adsorpsi
Kesetimbangan isotermal adsorpsi adalah salah satu data penting untuk memahami mekanisme adsorpsi dan menggambarkan bagaimana adsorbat dapat berinteraksi dengan adsorben sehingga sangat penting pengoptimalan penggunaan adsorben [34]. Ada berbagai isotermal adsorpsi yang dapat digunakan, seperti Langmuir dan Freundlich [24], [33].
2.4.4.1Isotermal Langmuir
Metode Langmuir digunakan untuk mengevaluasi kapasitas adsorpsi maksimum yang terjadi pada permukaan homogen adsorben [24]. Model Langmuir dapat dinyatakan sebagai berikut:
(2.6)
[24], [33]
Dimana qe adalah massa logam teradsorpsi pada kesetimbangan (mg/g), Ce =
qmax berkaitan dengan kapasitas adsorpsi maksimum (mg/g). persamaan diatas dapat
dirumuskan dalm bentuk persamaan linier adalah:
(2.7)
[24], [33]
2.4.4.2Isotermal Freundlich
Dibandingkan dengan isotermal Langmuir, isotermal Freudlich lebih universal. Dibandingkan dengan isotermal Langmuir, isotermal Freudlich tidak menganggap bahwa potensi penyerapan konstan [30]. Berikut persamaannya:
log qe = log kf + 1/n log Ce (2.8)
[24], [33]
Dimana kapasitas untuk adsorpsi adalah kf. Intensitas adsorpsi adalah 1/n.
Apabila nilai n>1 , menunjukkan bahwa kondisi untuk adsorpsi sangat bagus. Nilai untuk kf dan n dapat ditemukan dengan memplot log qe vs log Ce dan dari intersep
dan slope [30].
2.4.5 Proses Difusi
Difusi merupakan suatu proses berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian berkonsentrasi rendah. Dalam proses
adsorpsi dapat dipahami sebagai proses berpindahnya suatu substansi dari pelarut menembus permukaan adsorben. Menurut Fonseca dkk., [35] proses
adsorpsi terjadi pada permukaan luar dan permukaan pori-pori bagian dalam adsorben, sehingga untuk dapat teradsorpsi, proses-proses yang terjadi pada padatan dalam larutan umumnya mengalami :
1. Perpindahan massa zat terlarut/padatan dari cairan ke permukaan adsorben. 2. Difusi dari permukaan adsorben ke dalam adsorben melalui pori.
3. Perpindahan massa zat padat dari cairan dalam pori ke dinding pori adsorben.
4. Adsorpsi padatan pada dinding pori adsorben.
(2.9)
[36] Dengan z :
(2.10)
C0, Ct, dan A/V berturut-turut adalah konsentrasi awal larutan, konsentrasi
pada waktu t, dan perbandingan antara total luas permukaan partikel terhadap volume larutan. A/V dapat dihitung dengan :
(2.11)
[36]
Dimana m adalah massa adsorben (g), d adalah diameter partikel (µm), dan
ρ adalah densitas adsorben (g/cm3
). Koefisien difusi eksternal, kf (cm/s), dapat
dideterminasikan dari slop/kemiringan pada garis dari plot antara ln(Ct/Co)
versus t.
Jika difusi ion terjadi pada permukaan dalam dan pori-pori, maka proses ini disebut difusi internal. Difusi internal dapat dideskripsikan menggunakan data
percobaan mengikuti persamaan berikut :
√ (2.12)
[36]
Dimana qt adalah kapasitas adsorpsi pada waktu t (mg/g), kid adalah